第3章 抑うつ的表現型の進化
ポール・W・アンドリュース、ザカリー・デュリスコ
要旨
抑うつ病は、部分的に重複する遺伝子、神経生物学、および症状を共有する、異質な表現型の集まりである。本章では、確実に特定された3つの抑うつ的表現型、すなわち病気行動、飢餓性抑うつ、およびメランコリア(すなわち、メランコリーな特徴を伴う抑うつ)の異なる病因と機能に進化論的視点を適用する。感染症と食糧不足は進化的に古代からの問題であり、したがって病気行動と飢餓性抑うつは恐らく最初に進化した。メランコリアは恐らくより最近進化し、認知的機能のための進化的な設計の兆候を示す。より具体的には、証拠はメランコリアが分析的推論を促進するための適応であり、資源管理または親密な社会的パートナーとの対立を含む複雑な問題に対する適応的反応として恐らく進化したことを示唆している。これらの抑うつ的表現型は、異なるものの、機能的には類似しており、それが重複する遺伝学、神経生物学、および症状を説明する。これら3つすべてにおいて、抑うつ症状は、持続的な脅威に対する限定的なエネルギー資源の再配分を体が調整するのを助ける。
キーワード:適応、分析、抑うつ、エネルギー配分、進化、メランコリア、病気行動、飢餓、自殺、トレードオフ
はじめに
現在診断されている抑うつ障害は、悲しい気分と快感消失によって定義される一連の行動症候群を包含するが、症状と原因においてそれ以外は異質である(Akiskal, 2008)。異なる抑うつ障害は、他の行動症状の有無によって区別される。多くの診断カテゴリーが存在し、それらすべてが信頼できるわけではないため、それらすべてが「自然をその関節で切り分けている」とは明らかではない。さらに、典型的には精神障害として分類されないものを含む(Durisko, Mulsant, & Andrews, 2015)、多くの病因経路が抑うつ症状のクラスターにつながる可能性がある。本章では、重複する症状を持つ、確実に特定された3つの抑うつ的表現型、すなわち病気行動、飢餓性抑うつ、およびメランコリー性抑うつの進化に焦点を当てる。それぞれの症状は表3.1に示されている。
病気行動は、免疫系への挑戦の開始後に誘発され、回復を促進すると考えられている。飢餓性抑うつは、持続的な食糧不足によって引き起こされ、エネルギー不足の期間中の生存を促進すると考えられている。臨床的に診断された大うつ病エピソードのうち、メランコリアは最も確実に診断され、最も一般的なサブタイプであり、地域または患者サンプルにおけるエピソードの50%以上を占めることが多い(Angst, Gamma, Benazzi, Ajdacic, & Rössler 2007; Xiang et al., 2012)。かつて、メランコリー性抑うつ病のいくつかのエピソードは、明らかな環境的トリガーの欠如を指す内因性と呼ばれていた。しかし、これらの原因は、その深刻さ、個人的性質、または恥ずかしい性質のために過少報告されることがある(Leff, Roatch, & Bunney, 1970; Mundt, Reck, Backenstrass, Kronmüller, & Fiedler, 2000)。実際、メランコリアは逆境や生活上のストレス要因と高度に関連している(Taylor & Fink, 2008)。メランコリアは精神障害の診断と統計マニュアル(DSM)の独立した診断カテゴリーではないが、The New Yorkerの最近の投稿は、最新版の作成者が独立したカテゴリーを作成しなかったのは、その信頼性が他のDSMカテゴリーに関連する主観性と不正確さに注意を引くことになっただろうからだと明らかにした(Greenberg, 2013)。
| 症状 | 飢餓性抑うつ | メランコリア | 避けられないショック(ラット) |
| 快感消失 | 1 | 1 | 1 |
| 体重 | 21 | L 21 | 20 |
| 性行動 | L 21 | L 21 | 1 |
| HPA軸活動 | 22 | 22 | 22 |
表3.1 病気行動、飢餓性抑うつ、メランコリア、および避けられないショックの症状類似性
| 症状 | 病気行動 | 飢餓性抑うつ | メランコリア | 避けられないショック |
| 注意の焦点の変化 | + 2,11 | 4 3,11 | Į 2,11 | ? |
| 複雑な情報処理 | Yes 10 | Yes 2 | Yes 1 | Į 2,11 |
| 睡眠時間 | Yes 12,14 | No 3,11 | Yes 1 | 1 3,11 |
| REM睡眠 | 1 Z | 4 11 | 1 11 | – 13 |
| 徐波睡眠 | Yes 2 | Į 2,11 | 1 3,11 | 1 13 |
| 受動的対処 | ? | 1 16 | 1 16 | 1 16 |
| 運動活動 | Yes 22 | 1 6 | 21 | Yes 22 |
| 体温 | 1 6 | 21 | 1 21 | 4 21 |
| タンパク質より炭水化物の好み | Yes 15 | Į 21 | 1 19 | Yes 15 |
1 Andrews and Thomson (2009); 2 Christensen and Brooks (2006); 3 Dantzer (2001); 4 Deak et al. (1997); 5 Dess (1992); 6 Exner et al. (2000); 7 Hart (1988); 8 Jackson et al. (1978); 9 Keys et al. (1950); 10 Kramer et al. (2002); 11 Larson and Dunn (2001); 12 Lee and Maier (1988); 13 MacFadyen et al. (1973); 14 Minor et al. (1984); 15 Neumann et al. (2011); 16 O’Malley et al. (2013); 17 Overmann (1976); 18 Rising et al. (1992); 19 Rausch et al. (2003); 20 Schwartz and Seeley (1997); 21 Taylor and Fink (2008); 22 Vollmayr and Henn (2003).
「?」はデータが入手できないことを示す。「-」は症状に有意な変化がないことを示す。灰色で網掛けされた症状は、表現型間で共有されている。
抑うつ症候群を生み出す複数の経路は、恐らく複数の進化論的説明を必要とする。多くのそのような仮説が存在する(Durisko et al., 2015; Hagen, 2011)が、ほとんどは厳密に検証されておらず、多くは間違いなく誤っている。本章では、病気、飢餓、およびメランコリー性抑うつの症状類似性に洞察を提供する仮説に焦点を当てる。最初に、関連する進化論的概念を定義する。
適応と障害
気分障害に関する重要な進化論的洞察は、一部の気分障害は実際にはまったく「障害」ではない可能性があるということである。現在のDSMは、その診断システムにおいて「正常な症状表現と病的な症状表現を完全に分離する能力」がないことを認めている(APA, 2013, p. 21)。本書において、ジェローム・ウェイクフィールドは、すべての明確な障害のケースは、進化した機能を果たしていない適応を含むと主張しており、本章ではこの定義を採用する。適応とは、独自の遺伝子伝播効果のために、進化の過程で自然選択によって修正された形質である(Andrews, Gangestad, & Matthews, 2002)。その遺伝子伝播効果は、その形質の機能と呼ばれる。手作りの機械と同様に、適応は突然故障したり、徐々に機能が低下したりする可能性があり、これらの事象は機能不全または機能障害と呼ばれる。脊椎動物の目は、進化した適応の古典的な例であるが、多くの既知の機能不全(または障害)の影響を受けやすい。障害のこの進化論的定義の下では、適切に機能している適応は障害を起こすことはできない。本章で示すように、快感消失、性的機能と食欲の低下、認知の変化、自殺行動を含む、抑うつ病のすべてのいわゆる病的な症状は、適切に機能している適応によって生み出すことができる。これにより、そのような基準によって、真の障害の事例とストレス要因への「正常な」反応を区別することが困難になる。重要なことに、多くの深刻な抑うつ病エピソードが適応的である可能性があるという主張は、それらを治療すべきではないという意味ではない。出産もまた、進化的に古代からの歴史を持つ正常な適応であるが、人間においては危険である可能性があるため、しばしば医療介入が必要となる。それにもかかわらず、適切な治療は病因の正確な理解に依存するというのが医学の基本原則である。抑うつ病の適切な治療法を決定するには、それが適切に機能している適応なのか、それとも機能不全の適応なのかを決定する必要がある。
どのようにして適応を認識し、それらが適切に機能しているかどうかを判断するのか?これは、現代の環境における形質に関連する繁殖成功率を測定することによって、信頼性高く行うことはできない(Andrews et al., 2002)。適応に関する主張は歴史的であり、問題の形質を形成した祖先の選択圧を指す。適応に関連する繁殖成功率は、現代と祖先の環境で異なる可能性がある。現代の環境で繁殖成功率が低い適応が存在するのは、それらが祖先の環境で有利であったためである。砂糖に対する私たちの好みは、精製された炭水化物が自由に利用できなかった祖先の環境では間違いなく適応的であった。この好みは現代の環境では障害を引き起こし、繁殖成功率を低下させる可能性がある(糖尿病、心臓病など)が、好み自体は障害ではない。むしろ、それは祖先の環境で形成された適応であり、環境が変化したにもかかわらず、進化したとおりにまだ機能している。
適応を特定する唯一の信頼できる方法は、形質のすべての機能部分を分解し、それらがどのように相互作用するかを理解することである。このプロセスは「リバースエンジニアリング」と呼ばれている(Andrews et al., 2002; Tooby & Cosmides, 2000)。生物は高度に組織化され、うまく協調された物質の集合体であり、自然選択による進化は、非ランダムな生物学的組織化または協調を生み出すことができる唯一の既知の自然プロセスである。形質が特定の効果を促進するために高度に非ランダムな組織化または協調を示し、その効果のために自然選択が形質を形成したとしか考えられない場合、その形質は適応であり、促進された効果はその機能である。たとえば、何千年ものリバースエンジニアリングの研究により、目が複数の高度に組織化された構造(網膜、水晶体、瞳孔、虹彩など)で構成されていることが明らかになった。これらの構成要素は、視力を促進するために高度に非ランダムで協調的な方法で連携して動作する。この設計に対する唯一の妥当な科学的説明は、自然選択が進化の過程で視力を促進するために目を形成したということである。
リバースエンジニアリングの過程で、研究者は適応の構造と操作の概念的な「青写真」を作成する。この青写真はまた、適応がどのように機能不全を起こし、障害を引き起こす可能性があるかについての自然な理解を提供する。たとえば、目の概念的な青写真は、多くの特定の障害(たとえば、水晶体の硬化、脈絡膜からの網膜剥離、線維柱帯の変性による眼内圧の上昇)を理解することを可能にする。
抑うつ的適応
抑うつ症候群は、因果関係の順序のない症状の寄せ集めでは決してない。進化論は、それらが悲しみという感情を中心として有用に組織化できることを示唆している(図3.1)。感情は、環境中の問題に対する適応的な反応を促進するために、身体システムを調整するために進化した古代の適応である(Tooby & Cosmides, 1990)。感情の行動的出力は固定されていないため、感情の進化した機能は、身体が状況を評価し、最善の対応方法について決定を下すことができる、情報処理のレベルの上流に存在しなければならない。したがって、悲しみなどの感情は、身体が環境に対する適応的な反応を生み出す因果経路の不可欠な部分であると考えられている。それらは、環境中の特定の状況によって確実に引き起こされ、情報処理機能を促進するために身体の様々なシステムを調整する。抑うつ的表現型は実際には症状のクラスターであり、悲しみはその1つであるため、一部の症状は引き金となるプロセスの一部である可能性があり、他の症状はそれに続く調整プロセスの一部である可能性がある。この一般的な因果モデルの観点から、病気行動と飢餓性抑うつについて議論する。
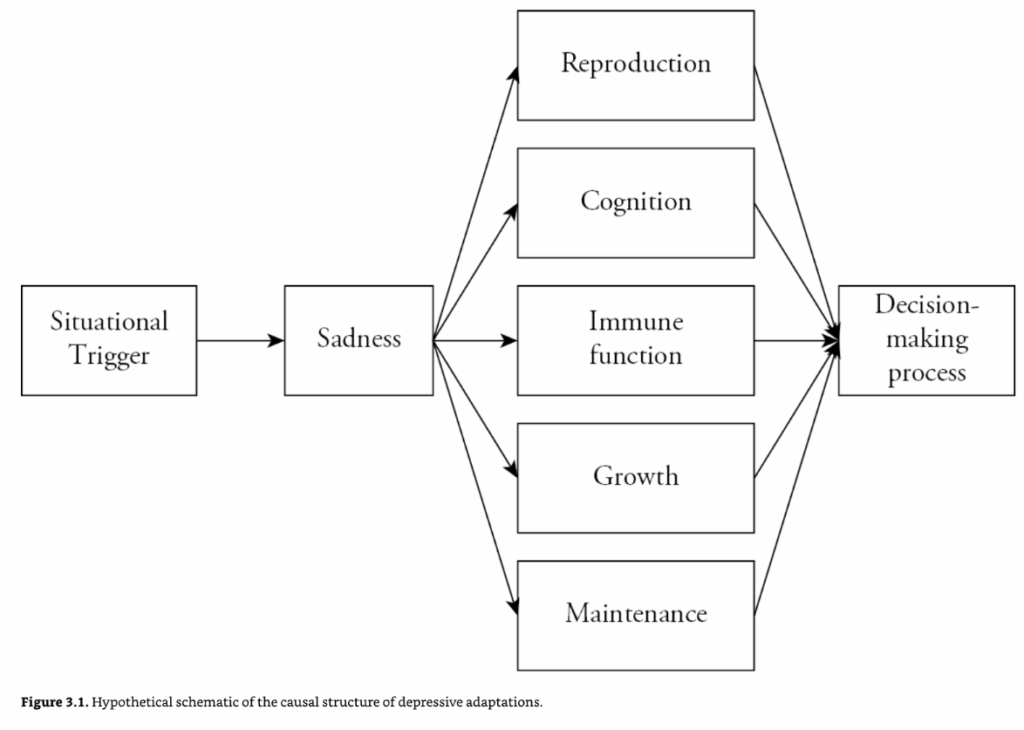
図3.1 抑うつ的適応の因果構造の仮説的な模式図
病気行動
感染症はすべての生物が直面する問題であり(Fuhrman, 1999)、病気の生物は進化的に古代からの適応的な抑うつ的表現型を示す(Dantzer, 2001; Hart, 1988)。病気行動は哺乳類全体に存在し(Hart, 1988)、その側面は昆虫にも見られる(Chambers & Schneider, 2012)。明らかに、体から病原体を除去するには免疫系の反応が必要である。この反応は固定されておらず、病原体に特異的に調整されるため、適切な反応を生み出すためには病原体特異的な情報が処理されなければならない。適切な免疫反応を生み出すには大量のエネルギーが必要であるため、体は免疫機能にエネルギーを再配分し、成長、生殖、身体活動などの他のエネルギーを消費するプロセスをダウンレギュレートする(Lochmiller & Deerenberg, 2000)(図3.2)。注意が痛みを伴う感覚に向けられるため(Kaplan, Trevino, Johnson, & Levy, 2003; Kramer et al., 2002)、感染症の間、一般的な認知機能は低下し、それが倦怠感と休息を促進する。抑うつ症状は、これらのトレードオフを調整する役割を果たす(Dantzer, 2001; Hart, 1988)。倦怠感と快感消失は、通常は報酬となる活動(セックスや遊びなど)に費やされるエネルギーを減らす。食欲も低下するが、免疫系のエネルギー需要を考えると奇妙に思えるかもしれない。しかし、生物はしばしば食物を獲得するためにかなりのエネルギーを費やさなければならず、エネルギーを節約する方が有利な場合がある(Hart, 1988)。さらに、鉄分の多い食物(例えば、動物性タンパク質)の摂取は病原体の複製を促進する可能性がある(Hart, 1988)一方、免疫系は炭水化物を優先的に利用する(Wolowczuk et al., 2008)。したがって、感染症の間、食欲と全体的なカロリー摂取量は減少するが、食事中の炭水化物の割合は増加し、タンパク質の割合は減少する(Dantzer, 2001)。
飢餓性抑うつ
飢餓もまた、すべての生物が直面する問題であり、適応的な抑うつ的表現型を引き起こす可能性がある(Keys, Brozek, & Henschel, 1950)。食糧不足を乗り切るためには、体は維持に不可欠なシステムを監視し、組織(脂肪組織、筋肉)に蓄えられたエネルギーの維持機能への配分を慎重に選別しなければならない(McCue, 2012; Prentice, 2005)(図3.2)。特に脳は維持され、他の組織は犠牲になる(Ruiz-Nunez, Pruimboom, Dijck-Brouwer, & Muskiet, 2013)。成長、生殖、免疫機能は代謝を低下させるためにダウンレギュレートされる(Prentice, 2005; Prentice & Keneba, 2007)。飢餓時に引き起こされる抑うつ病の症状は、これらのトレードオフを調整する(Engel & Schmale, 1972)。たとえば、多くの快楽的な活動(セックス、社会的交流など)はエネルギーを消費するため、そのような活動への関心は低下する。
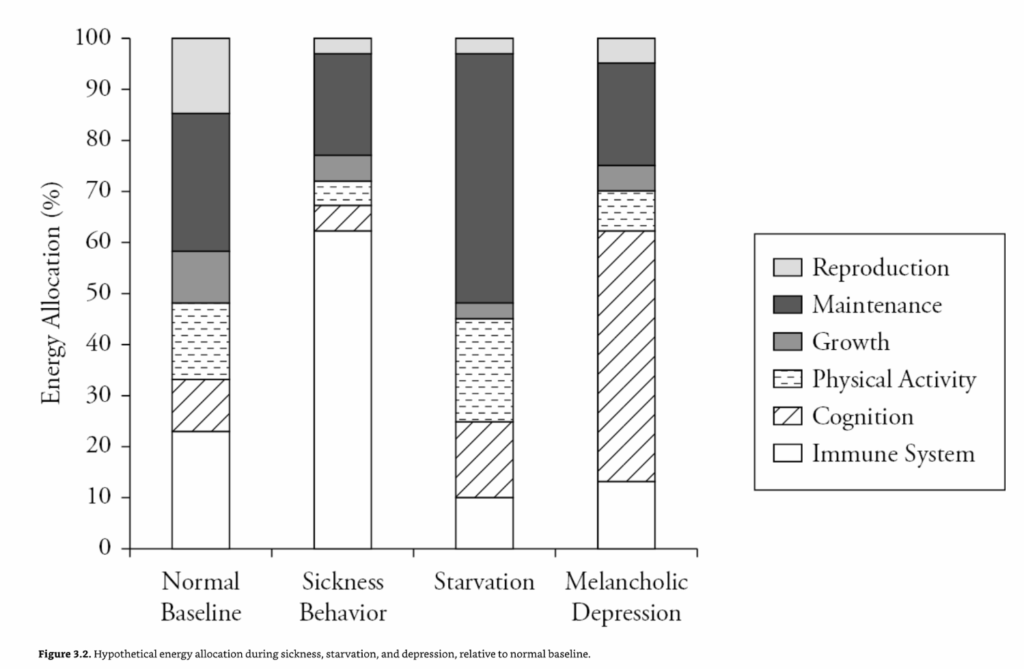
図3.2 正常なベースラインと比較した、病気、飢餓、および抑うつ時の仮説的なエネルギー配分(%)
包括的な仮説
病気行動と飢餓性抑うつは、機能的な類似性を共有している。どちらの場合も、抑うつ症状は、持続的な脅威(感染症と飢餓)に対するエネルギーのトレードオフを調整するのに役立つ。病気行動では、成長と生殖が減少する一方で、免疫機能がリソースへの優先的なアクセスを得る。飢餓では、成長、生殖、免疫機能が減少する一方で、維持機能がリソースへの優先的なアクセスを得る。
これは、自然選択が、体が限られたリソースの配分において持続的なトレードオフを行わなければならないあらゆる持続的な脅威に対する反応として、抑うつ的表現型の進化を有利にする可能性があることを示唆している。この包括的なリソース配分仮説は、リソース配分の論理を中心に構築された抑うつ病のあらゆる特定の仮説が、より大きな注意を払い、厳密に検証されるべきであることを示唆している。次のセクションでは、メランコリー性抑うつ病に関する1つの仮説に詳細に焦点を当てる。
メランコリー性抑うつ病の進化
病気行動とメランコリー性抑うつ病の症状は驚くほど類似しており(表3.1)、共通の遺伝子と神経生物学を共有している(Dantzer, O’Connor, Freund, Johnson, & Kelly, 2008; Raison & Miller, 2013)。この類似性は、抑うつ病を免疫反応の障害(Dantzer et al., 2008)または感染リスクを予測する社会的ストレス要因への適応反応(Raison & Miller, 2013)として特徴づける仮説を促してきた。しかし、これらの仮説は、病気行動とメランコリアが重要な症状の違いを持つという事実と矛盾する。認知は一般的に病気の間は損なわれ、より多くの時間が徐波睡眠に費やされる(Dantzer, 2001; Larson & Dunn, 2001)。対照的に、メランコリー性抑うつ病は、急速眼球運動(REM)睡眠の増加(Taylor & Fink, 2008)と反芻(Nelson & Mazure, 1985)に関連している。1反芻は、エピソードを取り巻く状況に焦点を当てた、侵入的で注意散漫になりにくい思考を指す認知症状である(Andrews & Thomson, 2009)。
これで、メランコリアの起源と機能について強力な推論を引き出すことができる。病気、飢餓、およびメランコリー性抑うつ病はすべてヒトで発現するが、メランコリアの認知的な性質は、それがより最近進化したことを示唆している(図3.3)。それらが共通して共有する神経生物学は、おそらく最初に病気行動または飢餓性抑うつ病を促進するために進化した。その後、それはメランコリアを促進するために共用され、修正された。共用の証拠は、重複する症状、遺伝子、および神経生物学にある。修正の証拠は、異なる神経生物学を伴うに違いない症状の違いから来ている。メランコリアはおそらくより最近進化したとしても、抑うつ病の避けられないショックモデルが症状的に類似しているため(表3.1)、ヒトに特有ではないかもしれない。
メランコリアの独特の症状は、その修正が認知的機能に対する自然選択に起因することを示唆している。つまり、メランコリー症状を引き起こす神経学的メカニズムは、病気行動のエネルギー再配分機構の拡張として進化した、強化された認知のための適応である可能性がある。第一に、反芻思考は、複雑な問題をより小さく、より扱いやすい構成要素に分解し、それらを順次研究する分析的処理スタイルを伴う(Andrews & Thomson, 2009)。分析は、科学、数学、および現代生活の多くの分野における複雑な問題を解決するための非常に有用なアプローチである。第二に、反芻は注意散漫になりにくい(Andrews & Thomson, 2009)。構成要素を追跡するために、分析にはワーキングメモリ(WM)が必要である。ワーキングメモリは、情報が継続的な処理に役立つため、アクティブに保たれる記憶システムである。WM負荷が増加するにつれて、タスクは中断されやすくなる。なぜなら、タスクとは無関係な刺激が関連情報を置き換えるのが容易になるからである(Kane & Engle, 2002)。反芻の注意散漫になりにくい性質は、中断への脆弱性を減らすことによって分析を促進する可能性がある(Andrews & Thomson, 2009)。第三に、REM睡眠の増加も認知機能を示唆している。なぜなら、REM睡眠は複雑な情報をエンコードする海馬の記憶表現の統合を助けるからである(Rasch & Born, 2013)。
動物界
飢餓性抑うつ
病気行動
メランコリア
海綿動物門(カイメン)
刺胞動物門(クラゲ)
線形動物門(C. elegans)
節足動物門(キイロショウジョウバエ)
齧歯類(マウス)
ヒト(ヒト)

図3.3 飢餓性抑うつ、病気行動、およびメランコリアの暫定的な系統樹
各症状は、それ自体でおそらく自明ではない神経学的修飾を反映している。それらが合流することは、メランコリアが複雑な情報の持続的な処理のために高度に非ランダムな生物学的組織を示すことを示唆している。自然選択による進化が高度に非ランダムな生物学的組織の唯一の既知の源であるという事実は、複雑なストレス要因に対する反応としてメランコリー症状を生み出し、それらのストレス要因の処理と解決を支援する適応が存在することを示唆している。明確にするために、主張は、適応はメランコリー症状を生み出す神経学的機構にあり、症状自体にはないということである。なぜなら、症状は、その機構の機能不全によっても生み出される可能性があるからである。
先行研究では、抑うつ病は、症状が中断のない分析を促進するのに役立つ複雑な問題への反応として進化したと提案されている(Andrews & Thomson, 2009)。この分析的熟考仮説(ARH)は、資源配分の論理で明確に組み立てられた。具体的には、ARHは、WMリソースが限られているという事実に基づいている。これにより、分析を含む認知プロセスは、WM負荷が増加するにつれて中断に対してますます脆弱になる。ARHの下では、抑うつエピソードを引き起こした問題は複雑で解決することが重要であるため、WMリソースへの優先的なアクセスを得る必要がある。これを行うために、引き金となった問題からWMリソースを奪う可能性のある他のプロセスを抑制する必要があり、抑うつ症状はこのトレードオフを調整するのに役立つ。たとえば、快感消失は、そうでなければ引き金となった問題から注意をそらす可能性のある、通常は楽しい活動への関心を低下させる。したがって、ARHは、限られたリソースがWMであるという一般化されたリソース配分仮説の観点から組み立てることができる。以下で説明するように、熟考もまたエネルギーを消費する可能性が高い。次に、ARHのいくつかの検証可能な含意に移る。
メランコリー症状の連続体全体で分析的処理が促進される
分析的処理スタイルは、メランコリーの症状の重症度の連続体全体に存在する可能性がある(Andrews & Thomson, 2009)。実際、この予測にはかなりの証拠がある。「反省的熟考」と呼ばれる分析的熟考スタイルは、臨床サンプルと準臨床サンプルの両方で見出されている(Joormann, Dkane, & Gotlib, 2006; Treynor, Gonzalez, & Nolen-Hoeksema, 2003)。私たちの研究では、分析的熟考を評価するために特別に設計された新しい器具を開発しており、臨床サンプルと準臨床サンプルの両方の横断的研究で抑うつ症状との正の相関を示している(Barbic, Durisko, & Andrews, 2014; Durisko et al., 未発表)。
抑うつ病が引き金となった問題の分析に注意を集中させる場合、他のことに利用できる認知リソースは少なくなるはずである。さらに、この効果は抑うつ症状の範囲全体に存在するはずである。これと一致して、抑うつ病患者は、実験室での抽象的な認知課題において、非抑うつ対照群よりも成績が悪いことが多い(Austin, Mitchell, & Goodwin, 2001)。成績の低下が認知障害ではなく、注意の焦点の変化によるものであることは、十分に支持されている。臨床サンプルと準臨床サンプルでは、数分間黒い傘について考えるなどの簡単な注意介入によって成績の低下を解消できる(Andrews & Thomson, 2009でレビュー)。要するに、引き金となった問題の集中的な分析が、抽象的な分析課題における成績の低下を説明するように思われる。
抑うつ病の人は、自分の生活の問題に類似した実験室の課題で、成績の向上を示す可能性が高い(Andrews & Thomson, 2009)。以下で議論するように、抑うつ病の人はしばしば費用便益のトレードオフを伴う問題に直面する。その結果、最適化または費用便益分析に基づいて意思決定を行う実験室の課題において、非抑うつ対照群よりも確実に優れた成績を示すように思われる(表3.2)。この成績の向上は、重度の症状を持つ人々(Keller, Lipkus, & Rimer, 2002; Overall & Hammond, 2013)や抑うつ病で入院した患者(von Helversen, Wilke, Johnson, Schmid, & Klapp, 2011)を含む、抑うつ症状の範囲全体で見出されている。
| 社会的選択肢の費用便益への感受性 | 抑うつレベル | 参照 |
| 実験的に誘発された | Hertel et al. (2000) | |
| 準臨床(BDI > 10) | Hokanson et al. (1980) | |
| 準臨床(BDI-SF > 5) | Pietromonaco and Rook (1987) | |
| 正確なリスク評価 | 大うつ病(CES-D ≥ 16) | Keller et al. (2002) |
| 最適な選択肢 | 大うつ病(HAM-D > 13) | |
| 実験的に誘発された | ||
| 大うつ病(入院) | von Helversen et al. (2011) |
抑うつ病は複雑な問題によって引き起こされる
ARHは、抑うつ病は、持続的で中断のない分析が適応的反応である複雑な問題によって引き起こされると予測する。ここでは、進化的に関連性のある2つの複雑な問題について議論する。第一に、社会的ジレンマは、協力関係を維持することが重要な親しいパートナー(配偶者、家族、友人)との対立である(Andrews & Thomson, 2009)。社会的ジレンマは、協力関係の崩壊を招くリスクなしに自分の有利に解決することが困難であるため、複雑な問題である。社会的ジレンマは、単純な対人関係の葛藤よりも抑うつ症状のより強い予測因子である(Gautam, Saito, Houde, & Kai, 2011; Pagel, Erdly, & Becker, 1987)。第二に、要求を満たすための時間、お金、またはその他の資源が不足している資源管理ジレンマは、希少資源をどのように配分すべきかを決定するために費用便益分析を実行する必要があるため、複雑である。資源管理ジレンマは、抑うつ症状と正の関連がある(Roxburgh, 2004)。1
表3.2 抑うつ気分は費用便益分析を伴う課題の成績を向上させる
| 効果 | 抑うつレベル | 参照 |
| 大学卒業後の給与 | 準臨床(CES-D) | Smoski et al. (2008) |
| 脳損傷と統合失調症における障害の認識 | 準臨床(リッカート尺度) | Au et al. (2003) |
| 恋愛相手のコミットメントの評価 | 準臨床(様々) | von Helversen et al. (2011) |
| Iyengar et al. (2006) | ||
| Fleminger et al. (2003) | ||
| Overall and Hammond (2013) |
BDI:ベック抑うつ尺度;BDI-SF:ベック抑うつ尺度短縮版;CES-D:疫学研究センター抑うつ性尺度;HAM-D:ハミルトン抑うつ評価尺度
死別は、分析によって死者を取り戻すことはできないため、ARHの下では逆説的に思われるかもしれない特定のタイプのストレッサーである。しかし、分析は将来の他の死を防ぐ可能性がある。適応度の結果として、親は、何か他にできたことがあったかどうかを評価するために、子供の死の状況を特に分析する可能性が高い。特に子供の死の直前に子供と否定的なやり取りがあった場合、彼らは何年も失われた子供を悲しむかもしれない(Thieleman & Cacciatore, 2014)。死別は、経済的ストレスや家事管理の困難などの資源管理ジレンマを引き起こす場合にも、抑うつ的になる可能性がある(Liu & Chen, 2006; Umberson, Wortman, & Kessler, 1992)。
分析的熟考は、引き金となった問題を解決、管理、または対処するのを助ける
抑うつ的な認知は不適応であると広く考えられているが、この証拠は強くない(Andrews & Thomson, 2009でレビュー)。抑うつ病は悲観主義の増加と関連しているが、これは、解決困難な複雑な問題に直面しているという正直な評価である可能性がある。さらに、そのような評価は、悲しみと分析的熟考を引き起こす重要な心理状態である可能性がある。抑うつ病の人々はまた、否定的な情報への注意の増加を示すが、そのような情報は、そのような問題を理解し解決しようとする際に役立つ可能性がある。最後に、抑うつ病の人は社会的問題解決スキルが低いと一般的に主張されている。もちろん、これを評価するための最も重要な指標は、抑うつ病の人のエピソードに関連する社会的な目標を達成する能力である。しかし、この分野の研究は、研究者が効果的な社会的問題解決(共感、声のトーン、協調性)に関連すると仮定する代理変数に焦点を当てる傾向がある。
効果的な問題解決に対する証拠と見なされる可能性のある研究の1つの分野は、抑うつ病が脳を変化させ、軽微なストレッサーの抑うつ誘発効果を高め、最終的にエピソードをストレッサーから分離させると提案している。この点火仮説は、かなりの経験的サポートがあると広く考えられており(例:Monroe & Harkness, 2005)、問題が存在しない場合に抑うつ病が問題を解決できないことを示唆している。たとえば、現在抑うつ状態を経験している人々の中で、抑うつ病の既往歴が多い人々は、誘発性ストレッサーが少ないと報告している。点火仮説と一致するが、抑うつ病の既往歴が多い人々は、ストレッサーに対する安定した遺伝的感受性を持っているという代替案とも一致する。1つの研究は、縦断的な個人内デザインを使用してこの代替案を排除しようとした(Kendler, Thornton, & Gardner, 2000)。Cox比例ハザード分析を使用して、著者は、以前の抑うつエピソードの数とストレッサーへの曝露との間に、新しい抑うつエピソードのリスクに関する有意な相互作用を報告した。しかし、その値は1未満であり、脳を過敏にするのではなく、抑うつ病の既往歴が新しい抑うつエピソードから保護することを示唆している可能性がある。最後に、点火研究は、参加者が投薬を受けていないことをめったに保証しない。これは、抗うつ薬(ADM)が点火に類似したパターンを生み出す可能性があるため問題がある(Andrews, Kornstein, Halberstadt, Gardner, & Neale, 2011)。ADMはモノアミン神経伝達物質のレベルを混乱させ、脳のホメオスタシス機構は平衡を回復しようとする。ADMが中止されると、これらのホメオスタシス力は、ストレッサーとは無関係な再発を引き起こす可能性がある。
ARHにとって最も重要な問題は、抑うつ的な熟考が、エピソードを引き起こした問題を解決または対処するのに役立つかどうかである(Andrews & Thomson, 2009)。現在の証拠は、ほとんどの研究が引き金となった問題ではなく、実験室の課題を使用して抑うつ的な認知を評価するため、決定的な判断を許さない。1つの関連する実験では、模擬市場における気分の影響を探求した(Au, Chan, Wang, & Vertinsky, 2003)。参加者は、模擬または実際の金融取引の知識または経験を持つ金融または経済学の学生であった。各ラウンドで、参加者には過去3年間の通貨の日次終値に関する歴史的に正確なグラフと、主要な投資銀行の著名な実務家や経済学者からの影響力のある市場要因、市場の動き、およびコメントを説明するニュース項目が提供された。この情報を注意深く分析することで、参加者はドイツマルクとスイスフランの相対的な動きについて良い予測を立てることができた。成績は、参加者がそのラウンドで正しい通貨を売買することにしたかどうか(正確性)、および参加者が得たまたは失った金額(利益)によって評価され、利益は正確性と投資額に依存した。気分は、最初のラウンドで誤ったフィードバックを提供することによって操作された。肯定的な気分の誘導では、参加者は実際に行ったことに関係なく、決定に対して高い利益を得た。悲しい気分の誘導では、参加者は大幅な損失を被った。中立的な気分の誘導では、参加者は損益分岐点に達した。最初のラウンドで誤った否定的なフィードバックによって悲しい気分に誘導された参加者は、その後のラウンドで、肯定的な条件と中立的な条件の参加者よりも正確な決定を下した。この興味深い研究は、悲しみが引き金となった問題の分析を促進するのに役立つ可能性があることを示唆している。
熟考尺度の因子分析は、2つの異なるサブタイプを示している。1つは過去に焦点を当てたもの(「思い悩み」)、もう1つは分析の増加に関連するもの(「反省的熟考」)である(Joormann et al., 2006; Treynor et al. 2003)。縦断的研究では、思い悩みは時間の経過とともに抑うつ症状の増加と関連しており、一般的に不適応であると考えられている。しかし、反省的熟考は時間の経過とともに症状の低下と関連しており、問題解決における分析の肯定的な効果を反映している可能性がある(Joormann et al., 2006; Treynor et al., 2003)。同様に、自然に熟考を促す介入(例えば、エピソードに関連する最も強い考えや感情について日記を書く)は、臨床エピソードの期間を短縮する傾向がある(Krpan et al., 2013)。問題の分析を促進する治療法も症状を軽減する。熟考焦点認知行動療法は、機能分析技術の使用を通じて熟考の反省的(分析的)スタイルを促進するのに役立つ(Watkins et al., 2007)。同様に、具体性訓練は、抑うつ病の人が個人的に関連する感情的な出来事を想像し、出来事の独特の詳細に焦点を当て、その出来事がなぜ起こったのかを理解しようとすることを伴う(Watkins, Baeyens, & Read, 2009)。
分析的熟考はエネルギーを消費する
避けられないショックにさらされたげっ歯類は、生体プロセスを駆動するために使用される主要な分子であるアデノシン三リン酸(ATP)を生成するために、解糖経路の増加を示す(Mallei et al., 2011; Uehara, Sumiyoshi, Itoh, & Kurachi, 2007)。解糖は酸化的リン酸化よりもグルコース分子あたりのATP生成量が少ないが、より速い速度でATPを生成するため(Pfeiffer, Schuster, & Bonhoeffer, 2001)、解糖は代謝活動の指標となる(Shulman, Hyder, & Rothman, 2001)。さらに、解糖は酸素を使用せず、脳内では血液由来のグルコースではなく貯蔵されたグルコースに依存するアストロサイトで起こる。その結果、前頭前皮質(Vaishnavi et al., 2010)など、解糖に大きく依存する領域では、神経活動と血流が分離する可能性がある(Shulman et al., 2001)。実際、非抑うつ病の人では通常正の相関を示す局所活動と血流の相関は、未治療の抑うつ病患者の多くの脳領域で負になる(Dunn et al., 2005)。この証拠は、抑うつ的な認知が非常にエネルギーを消費するため、解糖によってのみサポートできることを示唆している。
他のエネルギーを消費するプロセスはダウンレギュレートされる
抑うつ病がエネルギーを消費するというさらなる証拠は、成長や生殖など、他のエネルギーを消費する活動がダウンレギュレートされるという事実から得られる。たとえば、海馬の神経新生はダウンレギュレートされ、抑うつ病中の海馬体積の減少に寄与する可能性がある(Arnone et al., 2012)。多くの研究者はこれを病的と見なすが、多くの生物は環境要求に応じて神経新生に可塑性を示す(Gross, 2000)。たとえば、海馬におけるシナプス強度の減衰(長期抑圧と呼ばれる現象)は、ワーキングメモリ(WM)タスクにおいて重要である(Laroche, Davis, & Jay, 2000)。長期抑圧は、海馬ニューロンにおける樹状突起スパインの喪失と関連しており(Zhou, Homma, & Poo, 2004)、この領域の収縮に寄与する可能性がある。さらに、収縮は可逆的であるように見え、薬物療法なしで寛解した抑うつ病患者は正常な海馬体積を示す(Arnone et al., 2012)。したがって、神経新生は、エネルギーを消費し、WMプロセスを妨害するため、一時的にダウンレギュレートされる可能性がある。
他の抑うつ的適応?
繰り返しますが、私たちの分析は、資源配分の論理に基づいた抑うつ病のあらゆる仮説が、より詳細な検討に値することを示唆しています。たとえば、状況が不利であるため無駄になる可能性のある努力を抑制するために、抑うつ病が進化した可能性があります(Nesse, 2000)。
別の仮説は、抑うつ病は、そうでなければ関係から利益を得る親しい社会的パートナー(例えば、配偶者、親族、同盟者)に悪影響を与える可能性があると提案しています。抑うつ病中のこれらの利益の撤回は、社会的パートナーが抑うつ病の個人が問題を解決するのを助ける動機となる可能性があります。したがって、抑うつ病は、エネルギー、時間、労力、またはその他の貴重な資源を親しい社会的パートナーから転用して、彼らに援助を提供する動機を与えるために進化した可能性があります(Hagen, 2003; Watson & Andrews, 2002)。この仮説は、抑うつ病と自殺行動および意図的な自傷行為との関連性の可能性のある説明を提供します。自殺行動は一般的に精神障害の証拠と見なされていますが、自然界には自殺の適応の明確な例があります(Andrews & Thomson, 2010)。ある種の自殺行動は、他人からの援助を求めたり、利用したりするという社会的目標を持っています(Stengel & Cook, 1958)。そのような自殺未遂は、時には「脅し」と考えられますが、社会的パートナーに影響を与えるためには、死亡のリスクは十分に大きくなければなりません(Andrews, 2006)。したがって、一部の自殺未遂は、社会的パートナーからの援助を利用するために、無視できない死亡リスクを伴う必死の賭けである可能性があります。全体として、社会的報酬が十分に大きい場合、自然選択によってその賭けが有利になる可能性がありますが、一部の人々は試みによって死亡する可能性があります。したがって、抑うつ病と自殺行動は、他人からの援助を利用するための同じ戦術的次元の一部である可能性があります。自然選択はまた、試みる人が生き残る可能性がほとんどない、非常に致命的な自殺未遂を有利にする可能性があります。そのような試みの進化を有利にする状況は、個人が将来の生殖の可能性がほとんどなく、親しい遺伝的親族がその個人の世話をすることで適応度が低下する必要がある場合です(例えば、その個人が慢性的な健康問題を抱えている場合)。この近親者への負担仮説に対するいくつかの経験的サポートが人間で見出されています(deCatanzaro, 1995)。両方の種類の自殺行動は、個人の状況の分析(例えば、自殺未遂を行う可能性のあるリスクと利益、およびその試みが親族に与える影響)を必要とする可能性があり、それは抑うつ病との関連性にも寄与する可能性があります(Andrews & Thomson, 2010)。実際、青年は親との対立中に自殺未遂を行う前に費用便益分析を行うようです(Andrews, 2006)。
結論
病気行動、飢餓性抑うつ、およびメランコリアは、部分的に重複する症状、神経生物学、および遺伝子を共有している。共通の神経生物学は、おそらく感染症または飢餓のいずれかに対する反応を調整するために起源したが、メランコリアは、この機構のその後の共用と修正を伴った。これら3つの症候群は、機能的な類似性を共有している。持続的な脅威(飢餓、感染症、社会的または資源管理のジレンマなどの複雑な問題)に対する反応として、限られた資源におけるトレードオフを調整することである。
メランコリアで起こるエネルギー再配分は、多くの場合、適切に機能している適応の出力である可能性がある。第一に、メランコリアはしばしば、(飢餓や感染症と同様に)持続的であるため、エネルギーの持続的な再配分が必要となる可能性が高い複雑な問題によって引き起こされる。第二に、これらの問題の分析を促進するためにエネルギーを向けることによって、メランコリアの認知的影響は、状況的原因との生態学的対応を示す。この対応は、分析的処理スタイルが、抑うつ病の人々がエピソードを引き起こした問題を解決するのを助ける可能性があることを示唆している。いくつかの証拠はこの予測を支持しているが、より詳細な研究が必要である。第三に、認知をアップレギュレートし、成長と生殖をダウンレギュレートすることによって、メランコリアは、中断のない分析を促進するために、身体の様々な生物学的システムを非ランダムな方法で調整するように見える。適応を実証するための証拠要件を考えると、この予測もより厳密にテストする必要がある。反芻の注意散漫になりにくい性質は、非生産的で反復的で循環的な思考を促進すると考えられているため、特にさらなる研究に値する。しかし、注意散漫になりにくい性質は、分析の中断に対する脆弱性を適応的に減らすことによって、問題解決を促進するために進化した可能性がある(Andrews & Thomson, 2009)。ARHは、抑うつ病の多くの行動的および認知的症状(快感消失、社会的引きこもり、倦怠感、睡眠と食事の減少、集中困難)が、注意散漫になりにくくすることによって分析的熟考を促進するために、高度に非ランダムで協調的な方法で作用すると予測している(Andrews & Thomson, 2009)。
進化論は、現在臨床障害として分類されているものを含む、抑うつ的表現型の病因のより良い理解への希望を提供する。これは、より効果的な治療法につながる可能性がある。今後の研究では、この枠組みがメンタルヘルスにおける臨床実践を改善できるかどうかをテストする必要がある。
References
Akiskal, H. S. (2008). Mood disturbances. In S. H. Fatemi & P. J. Clayton (Eds.), The
medical basis of psychiatry (3rd ed., pp. 403-417). Totowa, NJ: Humana Press.
American Psychiatric Association (APA). (2013). (DSM-5) Diagnostic and statistical
manual of mental disorders. Washington, DC: American Psychiatric Press.
Andrews, P. W. (2006). Parent-offspring conflict and cost-benefit analysis in ado-
lescent suicidal behavior-Effects of birth order and dissatisfaction with mother
on attempt incidence and severity. Human Nature-An Interdisciplinary Biosocial
Perspective, 17, 190-211.
Andrews, P. W., Gangestad, S. W., & Matthews, D. (2002). Adaptationism-How to
carry out an exaptationist program. Behavioral and Brain Sciences, 25, 489-504.
Andrews, P. W., Kornstein, S. G., Halberstadt, L. J., Gardner, C. O., & Neale, M.
C. (2011). Blue again: Perturbational effects of antidepressants suggest mon-
oaminergic homeostasis in major depression. Frontiers in Psychology, 2, 159.
Andrews, P. W., & Thomson, J. A., Jr. (2009). The bright side of being blue: Depres-
sion as an adaptation for analyzing complex problems. Psychological Review, 116,
620-654.
Andrews, P. W., & Thomson, J. A., Jr. (2010). Coyne battles Darwin, many other evo-
lutionary biologists-and himself. Psychiatric Times, 27(12), 18.
Angst, J., Gamma, A., Benazzi, F., Ajdacic, V., & Rössler, W. (2007). Melancholia and
atypical depression in the Zurich study: Epidemiology, clinical characteristics,
course, comorbidity and personality. Acta Psychiatrica Scandinavica, 115(s433),
72-84.
Arnone, D., McKie, S., Elliott, R., Juhasz, G., Thomas, E. J., Downey, D., … Anderson,
I. M. (2012). State-dependent changes in hippocampal grey matter in depression.
Molecular Psychiatry, 18, 1265-1272.
Au, K., Chan, F., Wang, D., & Vertinsky, I. (2003). Mood in foreign exchange trading:
Cognitive processes and performance. Organizational Behavior and Human Deci-
sion Processes, 91, 322-338.
Austin, M. P., Mitchell, P., & Goodwin, G. M. (2001). Cognitive deficits in depression:
Possible implications for functional neuropathology. British Journal of Psych-
iatry, 178, 200-206.
Barbic, S. P., Durisko, Z., & Andrews, P. W. (2014). Measuring the bright side of being
blue: A new tool for assessing analytical rumination in depression. PLoS One,
9(11), e112077.
Chambers, M. C., & Schneider, D. S. (2012). Pioneering immunology: Insect style.
Current Opinion in Immunology, 24(1), 10-14.
Christensen, L., & Brooks, A. (2006). Changing food preference as a function of
mood. Journal of Psychology, 140, 293-306.
Dantzer, R. (2001). Cytokine-induced sickness behavior: Where do we stand? Brain,
Behavior, and Immunity, 15, 7-24.
Dantzer, R., O’Connor, J. C., Freund, G. G., Johnson, R. W., & Kelly, K. W. (2008). From
inflammation to sickness and depression: When the immune system subjugates
the brain. Nature Reviews Neuroscience, 9, 46-57.
Deak, T., Meriwether, J. L., Fleshner, M., Spencer, R. L., Abouhamze, A., Moldawer, L.
L., … Maier, S. F. (1997). Evidence that brief stress may induce the acute phase
response in rats. American Journal of Physiology-Regulatory Integrative and Com-
parative Physiology, 273, R1998-R2004.
de Catanzaro, D. (1995). Reproductive status, family interactions, and suicidal
ideation: Surveys of the general public and high-risk groups. Ethology and Socio-
biology, 16, 385-394.
Dess, N. K. (1992). Divergent responses to saccharin vs sucrose availability after
stress in rats. Physiology & Behavior, 52, 115-125.
Dunn, R. T., Willis, M. W., Benson, B. E., Repella, J. D., Kimbrell, T. A., Ketter, T. A., …
Post, R. M. (2005). Preliminary findings of uncoupling of flow and metabolism in
unipolar compared with bipolar affective illness and normal controls. Psychiatry
Research-Neuroimaging, 140, 181-198.
Durisko, Z., Mulsant, B. H., & Andrews, P. W. (2015). An adaptationist perspective on
the etiology of depression. Journal of Affective Disorders, 172, 315-323.
Engel, G. L., & Schmale, A. H. (1972). Conservation-withdrawal: A primary regu-
latory process for organismic homeostasis. In R. Porter & J. Knight (Eds.), Physi-
ology, emotion & psychosomatic illness (pp. 57-85). Amsterdam, Netherlands: As-
sociated Scientific Publishers.
Exner, C., Hebebrand, J., Remschmidt, H., Wewetzer, C., Ziegler, A., Herpertz, S., …
Klingenspor, M. (2000). Leptin suppresses semi-starvation induced hyperactiv-
ity in rats: Implications for anorexia nervosa. Molecular Psychiatry, 5, 476-481.
Fleminger, S., Oliver, D. L., Williams, W. H., & Evans, J. (2003). The neuropsychiatry
of depression after brain injury. Neuropsychological Rehabilitation, 13, 65-87.
Fuhrman, J. A. (1999). Marine viruses and their biogeochemical and ecological
effects. Nature, 399(6736), 541-548.
Gautam, R., Saito, T., Houde, S. C., & Kai, I. (2011). Social interactions and depressive
symptoms among community dwelling older adults in Nepal: A synergic effect
model. Archives of Gerontology and Geriatrics, 53(1), 24-30.
Greenberg, G. (2013). Does psychiatry need science?, Elements. http://
www.newyorker.com/online/blogs/elements/2013/04/psychiatry-dsm-
melancholia-science-controversy.html: The New Yorker.
Gross, C. G. (2000). Neurogenesis in the adult brain: Death of a dogma. Nature Re-
views Neuroscience, 1, 67-73.
Hagen, E. H. (2003). The bargaining model of depression. In P. Hammerstein (Ed.),
Genetic and cultural evolution of cooperation (pp. 95-123). Cambridge, MA: MIT
Press.
Hagen, E. H. (2011). Evolutionary theories of depression: A critical review. Canad-
ian Journal of Psychiatry, 56(12), 716.
Hart, B. L. (1988). Biological basis of the behavior of sick animals. Neuroscience and
Biobehavioral Reviews, 12(2), 123-137.
Hertel, G., Neuhof, J., Theuer, T., & Kerr, N. L. (2000). Mood effects on cooperation in
small groups: Does positive mood simply lead to more cooperation? Cognition &
Emotion, 14, 441-472.
Hokanson, J. E., Sacco, W. P., Blumberg, S. R., & Landrum, G. C. (1980). Interper-
sonal-behavior of depressive individuals in a mixed-motive game. Journal of Ab-
normal Psychology, 89, 320-332.
Iyengar, S. S., Wells, R. E., & Schwartz, B. (2006). Doing better but feeling worse:
Looking for the “best” job undermines satisfaction. Psychological Science, 17(2),
143-150.
Jackson, R. L., Maier, S. F., & Rapaport, P. M. (1978). Exposure to inescapable shock
produces both activity and associative deficits in the rat. Learning and Motiv-
ation, 9, 69-98.
Joormann, J., Dkane, M., & Gotlib, I. H. (2006). Adaptive and maladaptive compo-
nents of rumination? Diagnostic specificity and relation to depressive biases. Be-
havior Therapy, 37, 269-280.
Kane, M. J., & Engle, R. W. (2002). The role of prefrontal cortex in working-memory
capacity, executive attention, and general fluid intelligence: An individual-differ-
ences perspective. Psychonomic Bulletin & Review, 9, 637-671.
Kaplan, R. F., Trevino, R. P., Johnson, G. M., & Levy, L. (2003). Cognitive function in
post-treatment Lyme disease: Do additional antibiotics help? Neurology, 60(12),
1916-1922.
Keller, P. A., Lipkus, I. A., & Rimer, B. K. (2002). Depressive realism and health risk
accuracy: The negative consequences of positive mood. Journal of Consumer Re-
search, 29, 57-69.
Kendler, K. S., Thornton, L. M., & Gardner, C. O. (2000). Stressful life events and
previous episodes in the etiology of major depression in women: An evaluation
of the “kindling” hypothesis. American Journal of Psychiatry, 157, 1243-1251.
Keys, A., Brozek, J., & Henschel, A. (1950). The biology of human starvation. Minne-
apolis, MN: University of Minnesota Press.
Kramer, L., Bauer, E., Funk, G., Hofer, H., Jessner, W., Steindl-Munda, P., … Ferenci,
P. (2002). Subclinical impairment of brain function in chronic hepatitis C infec-
tion. Journal of Hepatology, 37(3), 349-354.
Krpan, K. M., Kross, E., Berman, M. G., Deldin, P.J., Askren, M. K., & Jonides, J. (2013).
An everyday activity as a treatment for depression: The benefits of expressive
writing for people diagnosed with major depressive disorder. Journal of Affective
Disorders, 150(3), 1148-1151.
Laroche, S., Davis, S., & Jay, T. M. (2000). Plasticity at hippocampal to prefrontal
cortex synapses: Dual roles in working memory and consolidation. Hippocam-
pus, 10(4), 438-446.
Larson, S. J., & Dunn, A. J. (2001). Behavioral effects of cytokines. Brain, Behavior,
and Immunity, 15, 371-387.
Lee, R. K. K., & Maier, S. F. (1988). Inescapable shock and attention to internal ver-
sus external cues in a water discrimination escape task. Journal of Experimental
Psychology-Animal Behavior Processes, 14, 302-310.
Leff, M. J., Roatch, J. F., & Bunney, W. E. (1970). Environmental factors preceding
onset of severe depressions. Psychiatry, 33, 293-311.
Liu, R. X., & Chen, Z .- y. (2006). The effects of marital conflict and marital disruption
on depressive affect: A comparison between women in and out of poverty. Social
Science Quarterly, 87(2), 250-271.
Lochmiller, R. L., & Deerenberg, C. (2000). Trade-offs in evolutionary immunology:
Just what is the cost of immunity? Oikos, 88(1), 87-98.
MacFadyen, U., Oswald, I., & Lewis, S. (1973). Starvation and human slow-wave
sleep. Journal of Applied Physiology, 35, 391-394.
Mallei, A., Giambelli, R., Gass, P., Racagni, G., Mathé, A. A., Vollmayr, B., & Popoli, M.
(2011). Synaptoproteomics of learned helpless rats involve energy metabolism
and cellular remodeling pathways in depressive-like behavior and antidepres-
sant response. Neuropharmacology, 60, 1243-1253.
McCue, M. D. (Ed.). (2012). Comparative physiology of fasting, starvation, and food
limitation. Berlin, Germany: Springer-Verlag.
Minor, T. R., Jackson, R. L., & Maier, S. F. (1984). Effects of task-irrelevant cues and
reinforcement delay on choice-escape learning following inescapable shock: Evi-
dence for a deficit in selective attention. Journal of Experimental Psychology-Ani-
mal Behavior Processes, 10, 543-556.
Monroe, S. M., & Harkness, K. L. (2005). Life stress, the “kindling” hypothesis,
and the recurrence of depression: Considerations from a life stress perspective.
Psychological Review, 112, 417-445.
Mundt, C., Reck, C., Backenstrass, M., Kronmüller, K., & Fiedler, P. (2000). Recon-
firming the role of life events for the timing of depressive episodes: A two-year
prospective follow-up study. Journal of Affective Disorders, 59(1), 23-30.
Nelson, J. C., & Mazure, C. (1985). Ruminative thinking: A distinctive sign of melan-
cholia. Journal of Affective Disorders, 9(1), 41-46.
Nesse, R. M. (2000). Is depression an adaptation? Archives of General Psychiatry, 57,
14-20.
Neumann, I. D., Wegener, G., Homberg, J. R., Cohen, H., Slattery, D. A., Zohar, J., …
Mathe, A. A. (2011). Animal models of depression and anxiety: What do they tell
us about human condition? Progress in Neuro-Psychopharmacology & Biological
Psychiatry, 35, 1357-1375.
O’Malley, M. W., Fishman, R. L., Ciraulo, D. A., & Datta, S. (2013). Effect of five-con-
secutive-day exposure to an anxiogenic stressor on sleep-wake activity in rats.
Frontiers in Neurology, 4, 15.
Overall, N. C., & Hammond, M. D. (2013). Biased and accurate: Depressive symp-
toms and daily perceptions within intimate relationships. Personality and Social
Psychology Bulletin, 39(5), 636-650.
Overmann, S. R. (1976). Dietary self-selection by animals. Psychological Bulletin, 83,
218.
Pagel, M. D., Erdly, W. W., & Becker, J. (1987). Social networks: We get by with (and
in spite of) a little help from our friends. Journal of Personality and Social Psych-
ology, 53, 793-804.
Pfeiffer, T., Schuster, S., & Bonhoeffer, S. (2001). Cooperation and competition in the
evolution of ATP-producing pathways. Science, 292, 504-507.
Pietromonaco, P. R., & Rook, K. S. (1987). Decision style in depression: The contri-
bution of perceived risks versus benefits. Journal of Personality and Social Psych-
ology, 52, 399-408.
Prentice, A. M. (2005). Starvation in humans: Evolutionary background and con-
temporary implications. Mechanisms of ageing and development, 126(9), 976-
981.
Prentice, A. M., & Keneba, M. (2007). Surviving famine. In E. Shuckburgh (Ed.), Sur-
vival: Survival of the human race (pp. 146-177). Cambridge, England: Cambridge
University Press.
Raison, C. L., & Miller, A. H. (2013). The evolutionary significance of depression in
Pathogen Host Defense (PATHOS-D). Molecular Psychiatry, 18(1), 15-37.
Rasch, B., & Born, J. (2013). About sleep’s role in memory. Physiological Reviews,
93(2), 681-766.
Rausch, J. L., Johnson, M. E., Corley, K. M., Hobby, H. M., Shendarkar, N., Fei, Y., …
Leibach, F. H. (2003). Depressed patients have higher body temperature: 5-HT
transporter long promoter region effects. Neuropsychobiology, 47, 120-127.
Rising, R., Keys, A., Ravussin, E., & Bogardus, C. (1992). Concomitant interindivid-
ual variation in body temperature and metabolic rate. American Journal of Physi-
ology-Endocrinology and Metabolism, 263, E730-E734.
Roxburgh, S. (2004). “There just aren’t enough hours in the day”: The mental health
consequences of time pressure. Journal of Health and Social Behavior, 45(2), 115-
131.
Ruiz-Núñez, B., Pruimboom, L., Dijck-Brouwer, D. A. J., & Muskiet, F. A. J. (2013).
Lifestyle and nutritional imbalances associated with Western diseases: Causes
and consequences of chronic systemic low-grade inflammation in an evolution-
ary context. The Journal of Nutritional Biochemistry, 24(7), 1183-1201.
Schwartz, M. W., & Seeley, R. J. (1997). Neuroendocrine responses to starvation and
weight loss. New England Journal of Medicine, 336, 1802-1811.
Shulman, R. G., Hyder, F., & Rothman, D. L. (2001). Cerebral energetics and the
glycogen shunt: Neurochemical basis of functional imaging. Proceedings of the
National Academy of Sciences of the United States of America, 98, 6417-6422.
Smoski, M. J., Lynch, T. R., Rosenthal, M. Z., Cheavens, J. S., Chapman, A. L., & Krish-
nan, R. R. (2008). Decision-making and risk aversion among depressive adults.
Journal of Behavior Therapy and Experimental Psychiatry, 39(4), 567-576.
Stengel, E., & Cook, N. G. (1958). Attempted suicide: Its social significance and effects.
London, England: Chapman & Hall.
Taylor, M. A., & Fink, M. (2008). Restoring melancholia in the classification of mood
disorders. Journal of Affective Disorders, 105(1), 1-14.
Thieleman, K., & Cacciatore, J. (2014). When a child dies: A critical analysis of grief-
related controversies in DSM-5. Research on Social Work Practice, 24, 114-122.
Tooby, J., & Cosmides, L. (1990). The past explains the present: Emotional adapta-
tions and the structure of ancestral environments. Ethology and Sociobiology, 11,
375-424.
Tooby, J., & Cosmides, L. (2000). Toward mapping the evolved functional organiza-
tion of mind and brain. In M. Gazzaniga (Ed.), The new cognitive neurosciences (pp.
1167-1178). Cambridge, MA: MIT Press.
Treynor, W., Gonzalez, R., & Nolen-Hoeksema, S. (2003). Rumination reconsidered:
A psychometric analysis. Cognitive Therapy and Research, 27, 247-259.
Uehara, T., Sumiyoshi, T., Itoh, H., & Kurachi, M. (2007). Role of glutamate trans-
porters in the modulation of stress-induced lactate metabolism in the rat brain.
Psychopharmacology, 195, 297-302.
Umberson, D., Wortman, C. B., & Kessler, R. C. (1992). Widowhood and depression:
Explaining long-term gender differences in vulnerability. Journal of Health and
Social Behavior, 33(1), 10-24.
Vaishnavi, S. N., Vlassenko, A. G., Rundle, M. M., Snyder, A. Z., Mintun, M. A., &
Raichle, M. E. (2010). Regional aerobic glycolysis in the human brain. Proceedings
of the National Academy of Sciences, 107, 17757-17762.
Vollmayr, B., & Henn, F. A. (2003). Stress models of depression. Clinical Neuroscience
Research, 3, 245-251.
von Helversen, B., Wilke, A., Johnson, T., Schmid, G., & Klapp, B. (2011). Perform-
ance benefits of depression: Sequential decision making in a healthy sample and
a clinically depressed sample. Journal of Abnormal Psychology, 120(4), 962-968.
Watkins, E., Scott, J., Wingrove, J., Rimes, K., Bathurst, N., Steiner, H., … Malliaris,
Y. (2007). Rumination-focused cognitive behaviour therapy for residual depres-
sion: A case series. Behaviour Research and Therapy, 45, 2144-2154.
Watkins, E. R., Baeyens, C. B., & Read, R. (2009). Concreteness training reduces dys-
phoria: Proof-of-principle for repeated cognitive bias modification in depression.
Journal of Abnormal Psychology, 118, 55-64.
Watson, P. J., & Andrews, P. W. (2002). Toward a revised evolutionary adaptationist
analysis of depression: The social navigation hypothesis. Journal of Affective Dis-
orders, 72, 1-14.
Wolowczuk, I., Verwaerde, C., Viltart, O., Delanoye, A., Delacre, M., Pot, B., &
Grangette, G. (2008). Feeding our immune system: Impact on metabolism. Clin-
ical & Developmental Immunology, 2008, 639803.
Xiang, Y .- T., Wang, G., Hu, C., Guo, T., Ungvari, G. S., Kilbourne, A. M., … Chiu, H. F.
K. (2012). Demographic and clinical features and prescribing patterns of psycho-
tropic medications in patients with the melancholic subtype of major depressive
disorder in China. Plos One, 7(6), e39840.
Zhou, Q., Homma, K. J., & Poo, M .- m. (2004). Shrinkage of dendritic spines asso-
ciated with long-term depression of hippocampal synapses. Neuron, 44(5), 749-
757.

