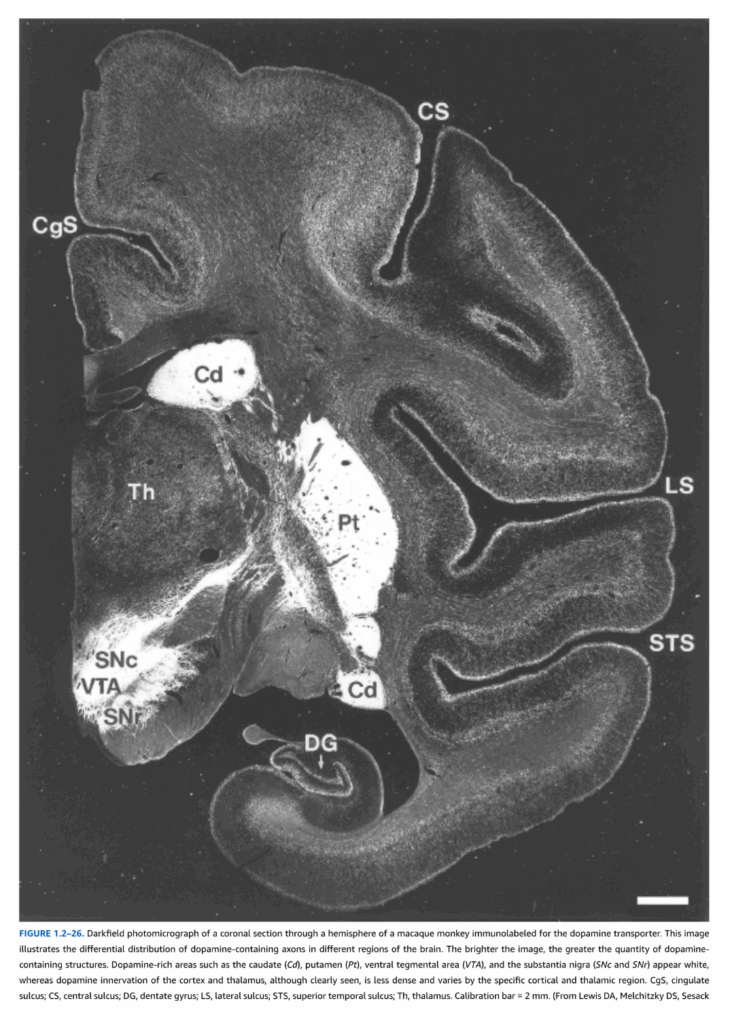
図1.2-26 ドーパミントランスポーター免疫標識による脳内ドーパミン分布
図の概要
マカクザルの大脳半球の冠状断面をドーパミントランスポーターで免疫標識した暗視野顕微鏡写真。この画像は脳の異なる領域におけるドーパミン含有軸索の分布の違いを示している。
画像の読み方
- 明るい部分:ドーパミン含有構造の量が多い
- 暗い部分:ドーパミン含有構造の量が少ない
ドーパミン豊富な領域(白く見える部分)
以下の領域はドーパミンが豊富で白く表示される:
- 尾状核(Cd)
- 被殻(Pt)
- 腹側被蓋野(VTA)
- 黒質(SNc および SNr)
ドーパミン神経支配が比較的少ない領域
皮質と視床への ドーパミン神経支配は:
- 明確に観察できるものの、密度は低い
- 特定の皮質および視床領域によって異なる
解剖学的構造の略語
- CgS:帯状溝
- CS:中心溝
- DG:歯状回
- LS:外側溝
- STS:上側頭溝
- Th:視床
スケール
較正バー = 2 mm
出典
Lewis DA, Melchitzky DS, Sesack [出典が途中で切れています]
臨床的意義
この画像は、前述の文章で言及されたモノアミン系(特にドーパミン系)が大脳皮質に広範囲に投射するが、地域差が存在することを視覚的に示している。ドーパミン系の分布パターンは、統合失調症などの精神疾患における前頭前皮質機能不全の理解において重要である。
基底核系
基底核は、それらの相互結合に基づいて一つにまとめられた核の集合体である。これらの核は運動の調節と、急速な動き(舞踏病)、もがくような動き(アテトーシス)、リズミカルな動き(振戦)を含む特定の運動障害(ジスキネジア)において重要な役割を果たしている。さらに、最近の研究により、基底核の特定の構成要素が多くの認知機能において重要な役割を果たしていることが示されている。
主要構造
基底核は一般的に、尾状核、被殻、淡蒼球(淡蒼球と呼ばれる)、視床下核、黒質を含むとされている(図1.2-27)。線条体という用語は尾状核と被殻を合わせて指し、線条体核という用語は尾状核、被殻、淡蒼球を指し、レンズ核という用語は被殻と淡蒼球を合わせて指している。
これらの核が基底核を構成することは一般的に合意されているが、他の核を基底核の定義に含めるべきかどうかについては議論がある。一部の研究者は、脳の追加領域が基底核の他の構成要素と類似した解剖学的結合を持っており、したがって用語に含まれるべきだと考えている。これらの追加領域は通常、腹側線条体と腹側淡蒼球と呼ばれる。腹側線条体には側坐核(図1.2-28)が含まれ、これは被殻と尾状核頭部が融合する領域であり、嗅結節も含む。腹側淡蒼球は腹側線条体からの求心性線維を受ける領域で、無名質と呼ばれるニューロン群を含むがそれに限定されない(図1.2-8参照)。本節では、基底核に属するとして一般的に受け入れられている構造に焦点を当てるが、システムの機能解剖学に関連する場合には追加構造についても論じる。
尾状核
尾状核はC字型の構造で、3つの一般的な領域に分けられる。構造の前部は頭部と呼ばれ、後部領域は尾部、その間の領域は体部である(図1.2-27参照)。尾状核は側脳室の輪郭に関連している:頭部は側脳室の前角に接し、尾部は側頭角に接している(図1.2-8から1.2-10参照)。尾状核の頭部は被殻と連続しており、尾部は側頭葉の扁桃体で終結する。
被殻
被殻は島皮質の内側の脳内に位置し、外側は外包の線維によって境界づけられ、内側は淡蒼球によって境界づけられている(図1.2-8と1.2-9参照)。前述のように、被殻は尾状核の頭部と連続している(図1.2-27参照)。尾状核と被殻の間のニューロンの橋が核の連続性を示しているが、2つの構造は内包前脚の線維によって分離されている(図1.2-28参照)。
淡蒼球
終脳由来の尾状核と被殻とは対照的に、淡蒼球は間脳から派生している。淡蒼球はレンズ核の内側構成要素を構成し(図1.2-27、下部パネル参照)、被殻とともに円錐様構造を形成し、その先端は内側に向いている(図1.2-8と1.2-9参照)。内包後脚が淡蒼球を内側で境界づけ、視床から分離している;被殻は淡蒼球を外側で境界づけている。ヒトでは、内側髄様板が淡蒼球を外側(外側)と内側(内側)のセグメントに分割している(図1.2-28参照)。
視床下核
視床下核(Luys核)も間脳から派生している。この大細胞核は内包後脚の背内側、黒質の背側に位置している(図1.2-9と1.2-27参照)。ヒトにおける視床下核の限局性病変は、病変と対側に発生する激しく力強い舞踏様運動によって特徴づけられる症候群である偏側バリスムを引き起こす。
黒質
黒質は中脳において被蓋と脚底の間に存在し、中脳由来である(図1.2-9参照)。黒質は2つの構成要素からなる:細胞豊富な背側部分は緻密部と呼ばれ、細胞疎な腹側部分は網様部と示される。ヒトにおける黒質緻密部のニューロンの大部分は、ニューロメラニンの存在により色素沈着している;これらの細胞は神経伝達物質ドーパミンを含有している(図1.2-26参照)。緻密部ニューロンの樹状突起はしばしば網様部に延び、そこで抑制性神経伝達物質GABAを使用する網様部ニューロンからシナプスを受ける。
げっ歯類では、黒質のドーパミン含有ニューロン(A9領域)は腹側被蓋野(A10領域)(図1.2-29)と赤核後野(A8領域)に位置するニューロンから区別されているが、サルとヒトでのより最近の研究では、ドーパミンニューロンは機能レベルで背側層と腹側層により意味深く組織化できることが示唆されている(図1.2-29)。背側層は、(1)内側腹側中脳に位置し、(2)黑質の密な細胞クラスターの背側に散在し、(3)赤核の外側と尾側に分布するドーパミン含有細胞を含む、内側-外側方向のニューロン帯によって形成される。腹側層は、黒質に密に詰まったドーパミンニューロンと黒質網様部に浸透する細胞柱で構成される。背側層ドーパミンニューロンは、ドーパミントランスポーターとドーパミン2型受容体(D2)のmRNAレベルが比較的低く、カルシウム結合タンパク質カルビンディンを含有し、大脳皮質の辺縁系関連構造と連合領域からの入力が優勢な線条体領域に軸索突起を送る。対照的に、腹側層ニューロンはドーパミントランスポーターとD2ドーパミン受容体のmRNAレベルが高く、通常カルビンディンを欠き、線条体の感覚運動領域に軸索突起を送る。これらの特徴のそれぞれが、腹側層ニューロンのパーキンソン病病理に対するより大きな脆弱性に寄与する可能性があり、一方背側層ニューロンは統合失調症の病態生理により関与している可能性がある。
内部組織
尾状核と被殻は、それらの共通特性のために線条体と総称されることが多い。げっ歯類では、これらの核は連続した構造であり、すべての哺乳類において、それらは組織学的に同一の細胞で構成されている。線条体のほとんどのニューロンは、樹状突起に棘を持つ中型細胞(直径10から20μm)である;これらのいわゆる中型有棘ニューロンは、その軸索を線条体外に送ることが知られている。中型有棘ニューロンに加えて、棘のない中型細胞(中型無棘ニューロン)や、棘のある大型細胞と棘のない大型細胞(大型有棘ニューロンと大型無棘ニューロン)も存在する。中型と大型の有棘細胞を除いて、他のほとんどの線条体ニューロンは局所回路ニューロンである。
免疫組織化学的および受容体結合研究により、基底核の機能的回路を形成する特定の神経伝達物質関連物質の分布に不連続性があることが示されている。例えば、線条体では、アセチルコリンエステラーゼ(AChE)酵素活性の低密度を含む領域が、AChE活性に富む領域に囲まれている。AChE豊富領域はマトリックスと呼ばれ、AChE乏しい領域は霊長類ではストリオソーム、げっ歯類ではパッチと呼ばれる。いくつかのニューロペプチドシステムもこの組織化に従っている。例えば、エンケファリン、サブスタンスP、ソマトスタチン免疫反応性の分布は、線条体のAChE豊富領域とAChE乏しい領域と類似した方法で組織化されている。さらに、げっ歯類では、特定のドーパミン受容体サブタイプが主に一つのコンパートメントに存在している。さらに、線条体に終結する一部の求心性システムの分布は、ストリオソーム-マトリックス組織化に従っている。例えば、視床からの求心性線維は、ストリオソームよりもマトリックスに優先的に終結する。
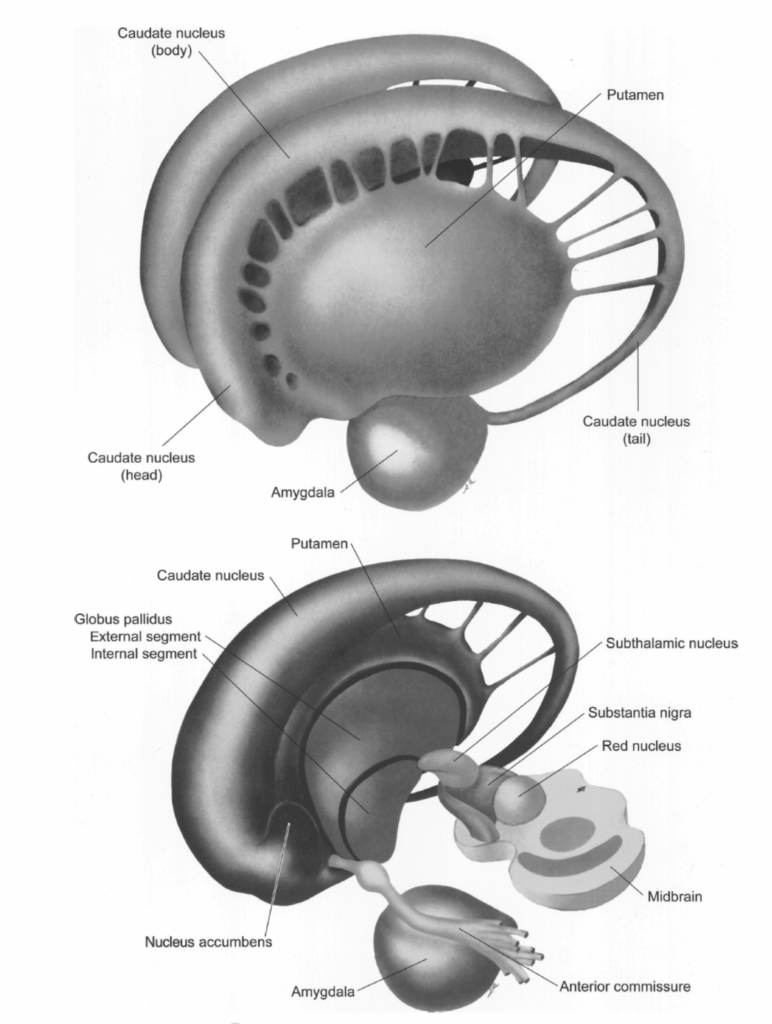
図1.2-27 背外側方向から見た孤立した基底核の模式図で、尾状核が両側に見える。下のパネルでは、左半球の基底核が除去され、右被殻と淡蒼球の内側面、および視床下核と黒質が露出している。(Hendelman WJ. Student’s Atlas of Neuroanatomy. WB Saunders; 1994:37, 41. Copyright @ 1994 Elsevier.より改変)線条体という用語は尾状核と被殻を合わせて指し、線条体核という用語は尾状核、被殻、淡蒼球を指し、レンズ核という用語は被殻と淡蒼球を合わせて指している。
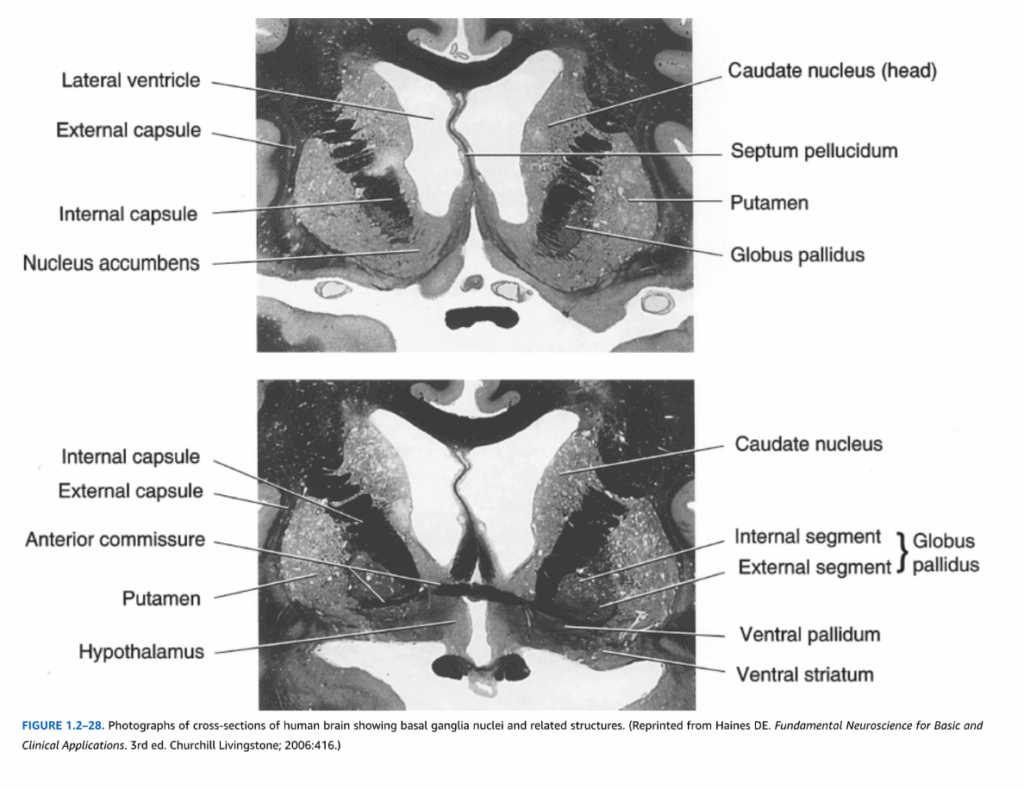
図1.2-28 基底核核および関連構造を示すヒト脳の横断面写真。(Haines DE. Fundamental Neuroscience for Basic and Clinical Applications. 3rd ed. Churchill Livingstone; 2006:416.より転載)
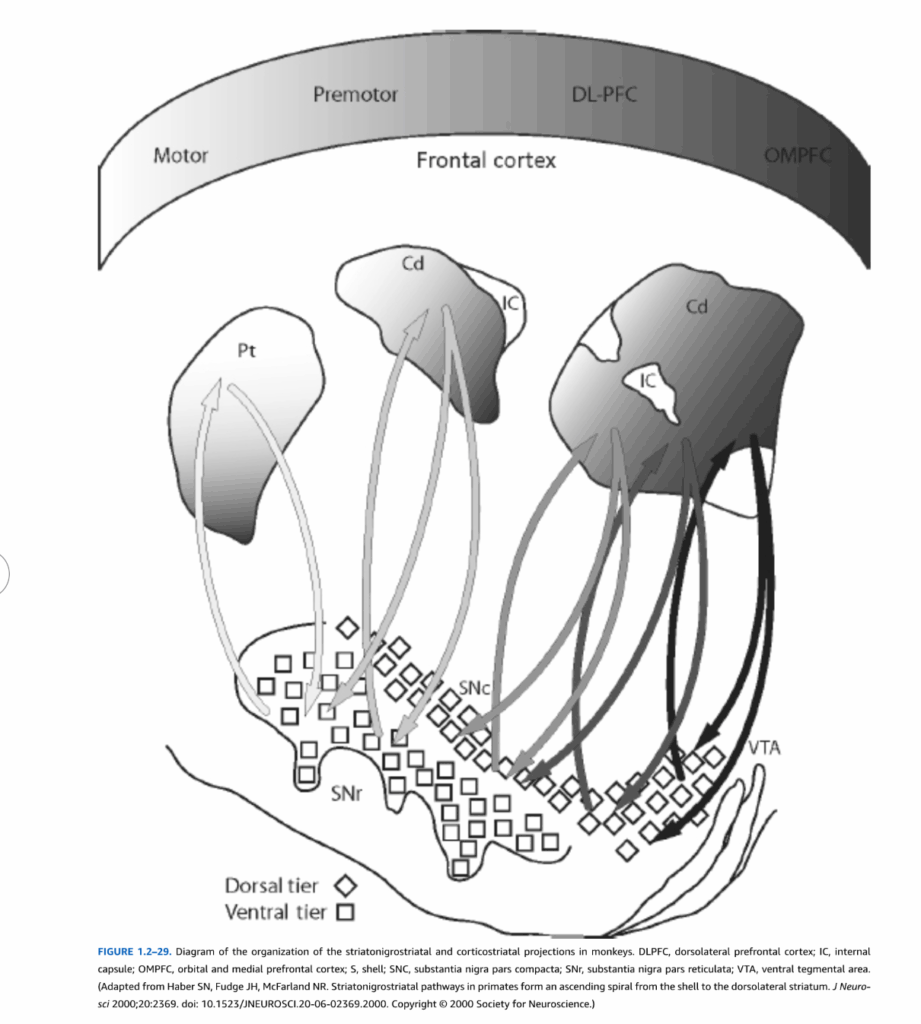
図1.2-29 サルにおける線条体黒質線条体投射と皮質線条体投射の組織化の図。DLPFC、背外側前頭前野;IC、内包;OMPFC、眼窩内側前頭前野;S、シェル;SNC、黒質緻密部;SNr、黒質網様部;VTA、腹側被蓋野。(Haber SN, Fudge JH, McFarland NR. Striatonigrostriatal pathways in primates form an ascending spiral from the shell to the dorsolateral striatum. J Neurosci 2000;20:2369. doi: 10.1523/JNEUROSCI.20-06-02369.2000. Copyright @ 2000 Society for Neuroscience.より改変)
機能的回路
基底核への、基底核内の、および基底核からの投射は局所解剖学的に組織化されており、基底核の処理回路全体を通してこの局所解剖学を維持している。このような結合パターンの存在により、基底核内の並列独立回路が脳の異なる領域からの情報を処理し、別々の複雑な機能を仲介するという仮説が生まれた。例えば、図1.2-29に示されているように、背側と腹側のドーパミンニューロンから線条体への投射には、逆の背側-腹側局所解剖学的組織化がある。背側内側に位置するドーパミンニューロンは線条体の腹側内側部分に投射し、一方腹側外側に位置するドーパミンニューロンは線条体の背側外側部分に投射する。線条体へのもう一つの重要な入力は大脳皮質からのもので、この投射は線条体黒質線条体経路と関連した局所解剖学的組織化を持っている。眼窩内側前頭皮質は腹側線条体に投射し、背外側前頭前野(DLPFC)は中央線条体に投射し、前運動皮質と運動皮質は背外側線条体に投射する。これらの局所解剖学は、皮質線条体投射と線条体黒質線条体投射内に大脳辺縁系、連合、および運動経路を作り出す。
基底核への入力
線条体は基底核への入力の主要な受容体である。線条体に終結することが知られている3つの主要な求心性システムがある:皮質線条体、黒質線条体、および視床線条体求心性線維(図1.2-30)。皮質線条体投射は新皮質のすべての領域から起こり、主に興奮性神経伝達物質グルタミン酸を使用する第5層と第6層の錐体細胞から発生する。皮質線条体投射を支配する局所解剖学がサルで発見されている。感覚運動皮質からの求心性線維は主に被殻に終結し、皮質の連合領域は尾状核に優先的に終結する。特に前頭前野領域は、尾状核頭部への強い入力を提供する。さらに、大脳辺縁皮質領域、海馬、扁桃体からの求心性線維は腹側線条体に終結する。第2の主要な求心性線維群は神経伝達物質ドーパミンを使用する。図1.2-30では、これらの投射は黒質緻密部から発生するように示されているが、前述のように(図1.2-29参照)、線条体の異なる部分は腹側中脳の背側層または腹側層のドーパミン含有ニューロンから入力を受ける。電子顕微鏡研究により、中型有棘ニューロン樹状突起上のドーパミン軸索終末によって形成されるシナプスの多くが、皮質線条体軸索によって提供されるシナプスに直接隣接していることが示されており、ドーパミンが線条体ニューロンに対する皮質投射の興奮性影響を調節する重要な役割を果たしている可能性が示唆される。第3の求心性システムは視床に起源を持つ。投射を提供する視床核は髄板内核、特に中央正中核である。
基底核の入力経路の破綻は、筋強剛、細かい振戦、すり足歩行、動作緩慢によって特徴づけられるパーキンソン病などの一部の運動障害と関連している。パーキンソン病の最も一貫した神経病理学的特徴は、黒質緻密部のドーパミンニューロンの変性で、線条体におけるドーパミン終末の喪失を伴う。ドーパミンの生合成における前駆体である化合物レボドパは、残存する終末からのドーパミン放出を増強する能力のため、パーキンソン病の治療として使用される。逆に、統合失調症の治療における典型的抗精神病薬の投与は、しばしばパーキンソン様特徴とその他の運動系異常と関連している;これらの薬剤がD2ドーパミン受容体拮抗薬であるという事実が、それらの運動関連副作用を説明すると考えられている。
内部処理
基底核内の主要な処理経路は図1.2-31にまとめられている。前述のように、線条体は大脳皮質から主要な投射を受ける。線条体内で、ニューロペプチドのサブスタンスPを含有する中型有棘ニューロンのサブクラスは、直接経路と呼ばれるものにおいて淡蒼球内節への抑制性投射を送る。対照的に、ニューロペプチドのエンケファリンを含有する中型有棘ニューロンのサブ集団は、間接経路と呼ばれるものにおいて淡蒼球内節に抑制性求心性線維を送る淡蒼球外節への抑制性投射を提供する。淡蒼球外節はまた黒質網様部にも投射する。線条体への求心性投射で見られる局所解剖学は、その処理経路において維持されているようである。例えば、線条体の感覚運動領域は淡蒼球の腹側部分に最も強く投射し、一方連合領域は淡蒼球の背側領域に投射する。
淡蒼球外節はまた、視床下核に終結する抑制性投射も生み出す。対照的に、視床下核のニューロンは、淡蒼球の両方の節と網様部に終結する興奮性投射を提供する。基底核内のほとんどの結合は一方向性であるが、淡蒼球外節と視床下核の間には相互投射が見られる。基底核の固有回路は、ハンチントン病における線条体ニューロンの重篤な喪失によって破綻する。この常染色体優性疾患は進行性舞踏病と認知症によって特徴づけられる。原因遺伝子における三塩基リピートの過剰な数は、これらのニューロンの細胞質と核内での変異ハンチンチンタンパク質の蓄積を介して線条体細胞の選択的変性を引き起こす。
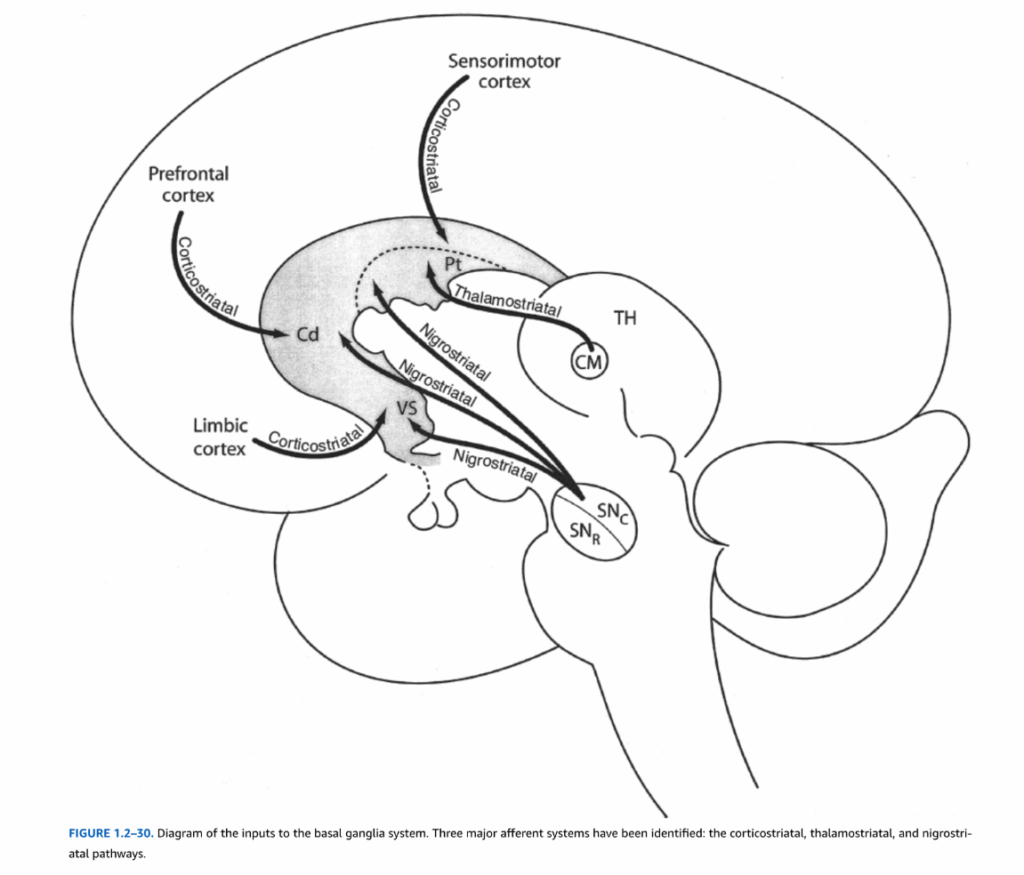
図1.2-30 基底核系への入力の図。3つの主要な求心性システムが同定されている:皮質線条体、視床線条体、および黒質線条体経路。

