1.3 ヒト脳発達の機能ゲノミクス
カルティク・パッタビラマン医学博士・博士、シリーシャ・ポチャレディ博士、ジョン・C・シルベライス博士、ジョン・N・コンスタンチーノ医学博士、ネナド・セスタン医学博士・博士
ヒト中枢神経系(CNS)は、数十万キロメートルの有髄軸索と数百兆から1000兆を大きく超えるシナプスによって結ばれた約860億個のニューロンと、ほぼ同数のグリア細胞から構成されている。この複雑さを反映して、ヒトCNSの構築には分子的・細胞的過程の精密な調節が必要である。この調節を通じて、ヒトゲノムにコードされた内在的過程と環境からの外在的調節因子が発達において収束し、神経機能を実行する回路、解剖学的特徴、シナプス相互作用、細胞過程を形成する。ヒト脳のより大きなサイズと複雑さは、もちろんヒトの拡張された知的、認知的、情動的能力の基盤である。そのサイズと複雑さの結果として、ヒト脳全体、特に大脳新皮質の連合野は、他の哺乳動物の脳よりも発達に相対的により多くの時間を要し、ヒトは特に長い妊娠期間、ならびに幼児期と青年期を持つ(図1.3-1)。この延長された発達経過と依存期間は、他の種よりもさらに、環境因子が認知的、情動的、社会的能力と可能性の発達を形成することを可能にする。長期間にわたって、また無数の細胞型と領域にわたって、多様な分子的・細胞的過程を精密に調節するという生物学的挑戦を示すように、CNSは様々な疾患と侵襲に対して地域的・時間的に異なる脆弱性パターンを示す(図1.3-1参照)。したがって、ヒト脳の複雑さを可能にする多くの神経発達過程は、特定の障害に特に感受性を高める進化的トレードオフを必要としたようである。
最近の技術的進歩とヒト神経発達への注目の増加により、健康と疾患の両方におけるヒトCNSとその発達のより包括的な特徴づけが可能になった。特に、発達期間と脳領域にわたる発達ヒトCNSの転写的(例:遺伝子発現特性)、遺伝子制御、エピジェネティック過程の「-オミクス」レベルの特徴づけと、非ヒト霊長類と齧歯類での比較研究とを組み合わせることで、ヒトCNS発達を定義する分子的ランドスケープとその疾患における機能不全について新たな洞察が生まれた。さらに、ゲノム革命は様々な神経学的・精神医学的障害のリスクを与える遺伝的変異についての知識を大幅に進歩させ、精神疾患が概して遺伝的に複雑で病因学的に多様であることを確認した。
この章では、発達ヒト新皮質とCNSの他の領域の転写的・制御的アーキテクチャの現在の理解を詳述する。さらに、これらの過程の広範囲な機能不全が神経発達障害と精神疾患の基盤にある可能性の例を提供する。高次認知、情動調節、複雑な行動、および多くの神経発達・精神障害の病態生物学における重要性のため、新皮質の研究に重点が置かれる。本書の別の章である「神経発達と神経発生」はCNSの組織化と発達の基本原理を記述しており、併読が推奨される。
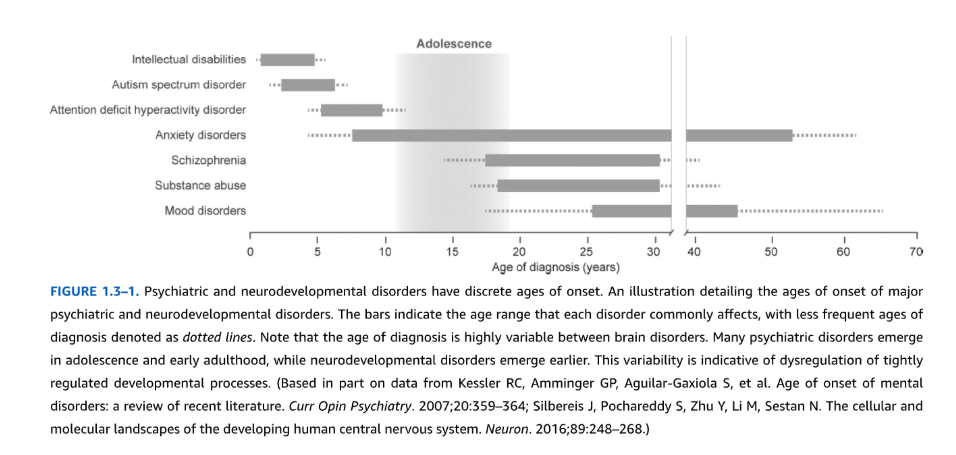
図1.3-1. 精神・神経発達障害は特定の発症年齢を持つ
主要な精神・神経発達障害の発症年齢を詳述した図。棒グラフは各障害が一般的に影響を与える年齢範囲を示し、診断頻度の低い年齢は点線で表示されている。脳障害間で診断年齢が非常に変動することに注目されたい。多くの精神障害は青年期と成人早期に出現する一方、神経発達障害はより早期に出現する。この変動性は、厳密に制御された発達過程の調節異常を示している。
(部分的に以下のデータに基づく:Kessler RC, Amminger GP, Aguilar-Gaxiola S, et al. Age of onset of mental disorders: a review of recent literature. Curr Opin Psychiatry. 2007;20:359-364; Silbereis J, Pochareddy S, Zhu Y, Li M, Sestan N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 2016;89:248-268.)
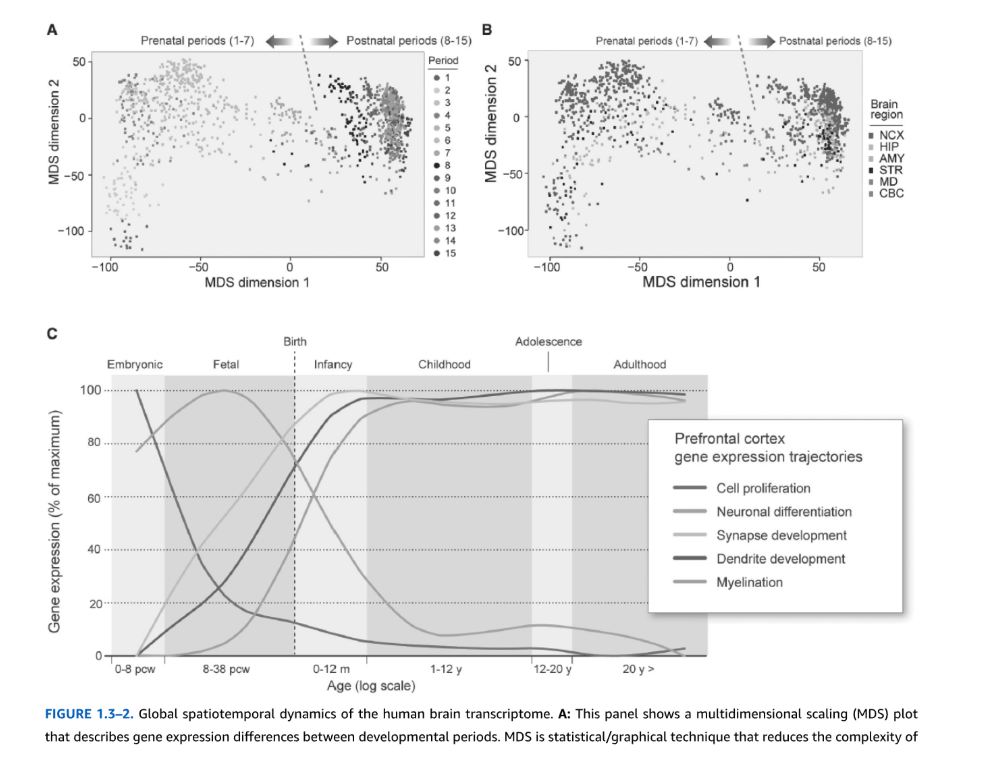
図1.3-2. ヒト脳転写産物の全体的時空間動態
A: このパネルは発達期間間の遺伝子発現差を記述する多次元尺度構成法(MDS)プロットを示している。MDSは、個々のデータポイントを互いの違いの程度に対応する距離で離して配置することによってデータの複雑性を減少させる統計的/図表的技術である。プロットでは、各ドットはサンプルを表し、Kang et al., 2011によって定義された期間に従って色分けされている;点線は出生を示す。最も顕著な差異(約3分の2)が出生前発達(期間1から7)の間に起こることに注目されたい。対照的に、成人期の40年以上(期間13から15)にわたって、1%未満の遺伝子が異なって発現している。
B: ここでは(A)と同じMDSプロットが示されているが、新しいデータポイントは脳領域によって色分けされている。領域間で最も顕著な転写的差異は小脳皮質(CBC)と前脳領域間にあることに注目されたい。NCX、新皮質;HIP、海馬;AMY、扁桃体;STR、線条体;MD、視床の内側背側核。
C: 主要な神経発達過程に重要な遺伝子の発現の発達軌跡を示す線グラフで、遺伝子発現プロファイルが発達の異なる期間に起こる細胞過程とどのように関連しているかを実証している。y軸は最大値に対する遺伝子発現の相対的パーセンテージを表し、x軸は年齢に対応している。(カラー画像についてはeBookを参照。)
脳発達の転写研究
転写研究は、遺伝子発現動態と脳領域の形態学的・機能的発達の相関関係を実証し、その結果、発達過程のタイミングや特定の生物学的機能の開始時期について光を当てている(図1.3-2C)。例えば、遺伝子共発現ネットワーク解析により、発達中の脳の転写産物が、高度に相関した発現を示す遺伝子の明確なモジュールまたはクラスターに分離されることが明らかになった。このようなモジュールの発現軌跡は、発達過程において動的なパターンを示すことが多く、これらが明確で動的な発達過程において役割を果たしていることを示している。例えば、Kangら(2011年)の研究では、最大の2つのモジュールは、脳領域と時間を超えて共調節される遺伝子で構成されており、脳の発達に伴って多くの転写過程が異なる領域間で共有され協調していることを示している。多くのモジュールは機能オントロジーによって定義でき、特定の生物学的過程に重要な遺伝子が高度に濃縮されていた。
機能オントロジー解析により主要な発達過程に関与する遺伝子の発現レベルを広く見ることで、ヒト脳成熟の分子動態と、領域を超えた主要な神経発達事象のタイミングについて洞察が得られる。例えば、前頭前皮質では、細胞増殖を促進する遺伝子は胎生期に最も高く発現し、胎児期に著明に減少する。神経細胞分化に関連する遺伝子は胎児期にピークを迎え、乳児期に下方調節される。髄鞘形成に重要な遺伝子は周産期発達中に著明に上昇し、1歳頃にプラトーに達する(図1.3-2C)。まとめると、空間的、時間的、細胞的次元におけるヒト脳発達の転写産物解析は、正常な神経発達過程と、疾患関連変異および基礎的神経病理学の解釈について新しい洞察を提供している。これについては本章の後半で議論する。
胎児新皮質の転写組織
これらの遺伝子発現の違いは、中枢神経系の複雑な解剖学的、回路的、機能的組織を確立する上で重要な役割を果たしており、これは大脳新皮質の発達において例示することができる。皮質板(CP)の新生投射ニューロンには、少なくとも2種類の空間情報がエンコードされる必要がある。第一に、層状位置に対応する放射方向の位置で、各層内に明確な細胞タイプ、シナプス接続性、機能を持つ。第二に、特定の皮質領域/区域アイデンティティに対応する接線平面での位置である。ヒト大脳新皮質は、すべての哺乳類に共通する基本的組織原理を示すが、認知、感情、行動、疾患症状の違いに主に責任を持つ、ヒトに豊富で定義的な特徴がある。
皮質のほとんどのニューロンは、胚後期から胎児後期にかけて生成される。これは「神経発達と神経新生」の章で詳しく述べられている。この期間中、新皮質壁は層状ゾーンに分離され、各ゾーンは特徴的な細胞組成を持ち、個別の神経発達過程を実行している。これらの層は、その生物学的役割を定義する高度に明確な遺伝子発現パターンを示している。例えば、胎児初期および中期の発達では、増殖と幹細胞アイデンティティに関連する遺伝子が、脳室を覆う生殖層である脳室帯と脳室下帯(VZとSVZ)に濃縮されている。対照的に、大脳皮質の原基であるCPは、神経細胞分化とシナプス形成を促進する遺伝子の高発現によって特徴づけられる。最近の単一細胞レベル研究により、ヒト大脳皮質で大幅に拡張された外側脳室下帯(OSVZ)を含む、VZ、SVZ、CPにおける前駆細胞とニューロンの両方でより大きな不均一性が明らかになり始めている。
CPは最終的に成熟した新皮質を形成し、これは6層構造で、上層(例:2-4層)は脳内投射を送り、下層の5層と6層は大脳下、脳幹、脊髄、他の皮質領域への投射を送る。6層の場合は視床への相互結合も行う。これらの各層も明確な遺伝子発現パターンによって特徴づけられ、これらは独特の投射アイデンティティ、シナプス受容性、機能特性を伝達するために重要である。これらの層を定義するには、転写調節による空間的に制限された遺伝子発現パターンの確立が必要であり、これについては本章の後半で説明する。
発達における新皮質領域と区域を定義する転写パターン
新皮質は高度に特殊化した層状組織を持つ一方で、接線次元に沿った機能的に個別の領域と区域への組織化は、特にヒトにおいて、はるかに複雑である。マウスでの研究は、これが胚初期発達中の転写因子の段階的発現により支配され、その後視床軸索入力からの外因性シグナル伝達が続くことを示している。ヒト転写産物の研究により、発達中のヒト新皮質における実質的な領域/区域遺伝子発現の違いが明らかになった(図1.3-3)。実際、各領域/区域は、特定の領域と区域を包含する神経回路のパターニングと特殊化に関与する基礎的生物学的過程を反映する可能性の高い、明確な時間的に特定された転写特性を示している(図1.3-3A)。
興味深いことに、これらの領域/区域転写プロファイルは、胎児発達から成人期まで、人口レベルで半球間で主に対称的であった。これは、胎児中期後期に生じ、生後初期により顕著になる左右半球の機能的に明確な役割と異なる発達軌跡を考えると驚くべきことである。したがって、これらの知見は、転写新皮質の左右非対称性が組織レベルの転写産物法による検出には微妙すぎるか、神経活動などの非転写メカニズムがより重要な役割を果たしていることを示唆している。
領域間転写の違いは、新皮質神経回路の仕様と初期組立の重要な期間である胎児中期発達(受胎後15-24週)において最も堅牢であることが判明した(図1.3-3B,C)。これらの期間中、認知と行動の最も特徴的にヒト的な側面のいくつかに関与する前頭前野と大脳周囲区域に関連する顕著で特異的な転写シグネチャーがあった。さらに、CPの前後軸に沿った前頭前野/前頭葉濃縮勾配、ならびに側頭、後頭、後頭側頭、大脳周囲、腹内側区域での濃縮を伴う勾配が観察された。ヒト胎児中期皮質の最近の転写産物解析により、前頭前皮質濃縮吻尾勾配によって確立されたレチノイン酸により、前頭葉でレチノイン酸シグナル伝達に関連する遺伝子の新しい濃縮が同定された。発達中のマウス皮質でのレチノイン酸勾配の破綻は、前頭前皮質の仕様と接続性の破綻をもたらした。
強い初期および胎児中期の領域間転写の違いと勾配は周産期に減少し、青年期後に再び増加する(図1.3-3B,C)。対照的に、胎児後期と生後初期発達では、グリア発達、シナプス形成、シナプス可塑性、樹状突起成熟を支配するより一般的な分子プログラムが優勢になりうる。青年期に出現する領域差の進行的増加は、特定の新皮質区域(例:連合野対一次野)間の成熟軌跡の変動を反映し、後期認知、感情、社会行動発達に重要である可能性がある。
まとめると、これらの知見は、他の種と同様に(Brain Initiative Cell Census Network, 2021)、ヒトにおける新皮質細胞タイプの生成と分化、およびそれらの機能的神経回路への組立が、時空間遺伝子発現の精密な調節を通じて達成されることを示している。精神疾患と神経発達障害は、特定の脳領域と新皮質区域の選択的機能不全、およびそれらの間の異常な機能的・解剖学的接続性の両方に関連している。したがって、精神疾患の明確な病因は、発達中の脳の特定の時間と場所での異常な遺伝子発現によって定義される可能性が高い。
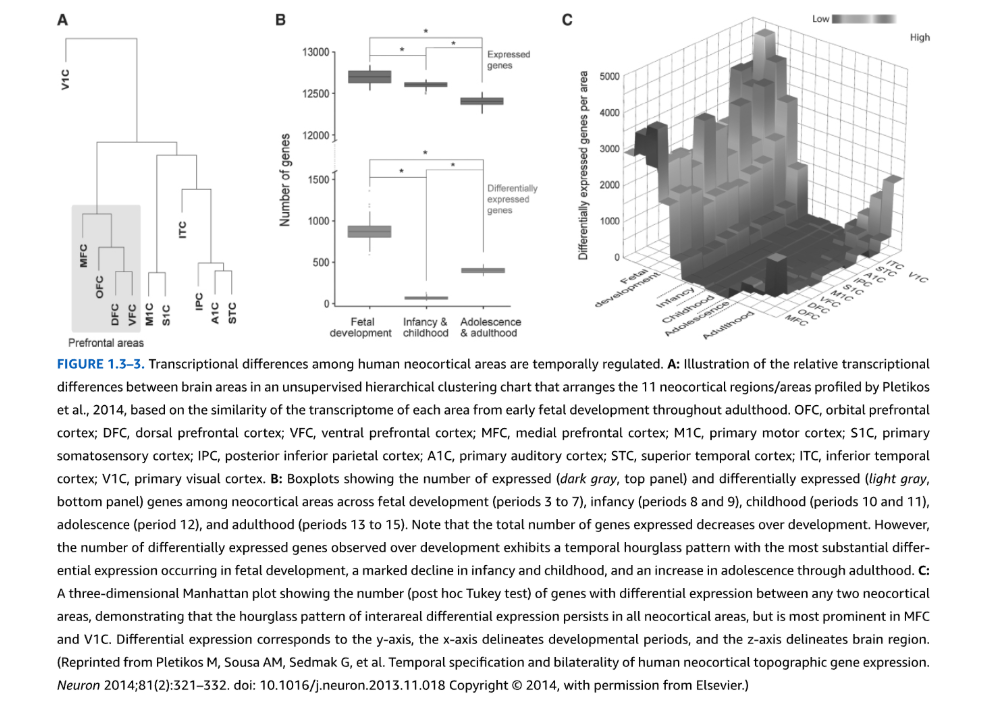
図1.3-3. ヒト新皮質区域間の転写の違いは時間的に調節される
A: Pletikosら(2014年)によってプロファイルされた11の新皮質領域/区域を、胎児初期発達から成人期まで各区域の転写産物の類似性に基づいて配置した、教師なし階層クラスタリング図表における脳区域間の相対的転写の違いの図解。OFC、眼窩前頭前皮質;DFC、背側前頭前皮質;VFC、腹側前頭前皮質;MFC、内側前頭前皮質;M1C、一次運動皮質;S1C、一次体性感覚皮質;IPC、後下頭頂皮質;A1C、一次聴覚皮質;STC、上側頭皮質;ITC、下側頭皮質;V1C、一次視覚皮質。
B: 胎児発達(期間3-7)、乳児期(期間8-9)、小児期(期間10-11)、青年期(期間12)、成人期(期間13-15)を通じた新皮質区域間での発現遺伝子数(濃灰色、上パネル)と差次的発現遺伝子数(薄灰色、下パネル)を示すボックスプロット。発現遺伝子総数は発達とともに減少することに注意。しかし、発達を通じて観察される差次的発現遺伝子数は、胎児発達において最も実質的な差次的発現が起こり、乳児期と小児期に著明な減少、青年期から成人期にかけて増加する時間的砂時計パターンを示している。
C: 任意の2つの新皮質区域間で差次的発現を示す遺伝子数(事後Tukey検定)を示す3次元マンハッタンプロットで、区域間差次的発現の砂時計パターンがすべての新皮質区域で持続するが、MFCとV1Cで最も顕著であることを示している。差次的発現はy軸に対応し、x軸は発達期間を示し、z軸は脳領域を示している。
(Pletikos M, Sousa AM, Sedmak G, et al. Temporal specification and bilaterality of human neocortical topographic gene expression. Neuron 2014;81(2):321-332. doi: 10.1016/j.neuron.2013.11.018 Copyright @ 2014, with permission from Elsevier.より転載)
発達中のヒト中枢神経系の調節環境
上記で議論された遺伝子発現の時空間パターンは、転写の各段階を支配する精巧な調節メカニズムによって確立される。発達中のヒト中枢神経系の転写調節の一般的性質についての現在の理解を以下に議論する。
遺伝子転写の調節
遺伝子は、RNAポリメラーゼおよび他のタンパク質を含むコア転写装置が、遺伝子の近位コアプロモーター(基礎レベルの遺伝子発現を正確に開始するのに十分な連続したDNA配列の最小領域)に動員されるときに転写される。しかし、遺伝子発現の組織特異性、タイミング、レベルは、エンハンサー(発現を増加させる配列)、サイレンサー(発現を抑制する配列)、インスレーター(バリアとして作用する配列)などの遠位DNA配列により大幅に制御される。これらはコアプロモーターとともに、シス(すなわち、ゲノムの近傍領域)での転写活性を媒介する能力について「シス調節エレメント」(CRE)と呼ばれる。エンハンサーは、重要な補助タンパク質をプロモーターに動員することにより転写を活性化すると考えられている。エンハンサーは、主に転写因子である複数のトランス作用調節タンパク質に対する結合部位を持ち、別の染色体のような遠隔位置からその標的プロモーターに対して機能することができる。結合した転写因子は他の転写因子やクロマチン修飾酵素を動員し、メディエーター複合体と相互作用する。活性化の一つのモデルでは、エンハンサー結合転写因子がメディエーター複合体タンパク質とともに、介在するDNAをループさせ、エンハンサーとコアプロモーターを近接させることにより、遺伝子発現の活性化をもたらすと提案されている。エンハンサーと同様に、サイレンサーまたはリプレッサーもタンパク質を動員するが、これらのタンパク質は転写を阻害する。サイレンサータンパク質は、転写開始または伸長を阻害したり、活性化タンパク質を隔離したり、クロマチン状態を変化させることにより作用する。インスレーターもタンパク質を結合し、これらのDNA-タンパク質複合体はゲノム内のバリアとして作用し、エンハンサー/サイレンサーがその非同族プロモーターに作用することを阻止したり、ヘテロクロマチンの拡散を防いだりする。
新皮質発達における転写のシス調節
異なる生物間での配列保存性を評価する比較ゲノム研究により、神経発達に関与する調節ネットワークの多くが哺乳類間で高度に保存されていることが示されている。例えば、皮質脊髄(CS)路発達に必要で、マウスとヒトの間で著しく類似した新皮質発現パターンを持つ遺伝子FEZF2の調節は、これらの種で高度に類似している。マウス新皮質発達におけるFezf2調節の研究は、発達調節ネットワークを記述する重要な概念を例示している。Fezf2転写開始部位の下流に位置する保存されたエンハンサー(E4)が、発達中の新皮質板でのFezf2発現を調節し、CS路の仕様に必須であることが同定された(図1.3-4Aを参照)。Fezf2発現は、CS路を生じさせる大脳皮質の層投射ニューロンに高度に濃縮されている。このパターンは、発現がL5で活性化され、L6および皮質の他の層で阻害される必要があることを示唆している。この選択的発現を達成する遺伝子調節ネットワークが最近定義され(図1.3-4Aを参照)、遺伝子発現の空間制御のモデルを提供している。SOXファミリーの2つの関連転写因子、SOX4とSOX11が、皮質でE4エンハンサーに結合し活性化することによりFEZF2発現に必須であることが示された。SOX転写因子ファミリーの別のメンバーであるSOX5も、E4に結合するがFEZF2発現を抑制する(図1.3-4Aを参照)。SOX4とSOX11がSOX5と機能的に競合して、Fezf2転写が活性化されるか抑制されるかを決定することが観察された。新皮質FEZF2発現の時空間動態は、L6ニューロンで発現される別の転写因子TBR1によってさらに制御される。TBR1は、Fezf2転写開始部位下流の高度に保存された領域の異なるエンハンサーに結合し、L6でのFEZF2発現を抑制する。このプロセスは、重要な調節エレメントにおける転写活性化因子と抑制因子の競合的結合が、遺伝子発現の領域とレベルを決定する勾配を形成するという、遺伝子調節ネットワークの共通原理を示している。
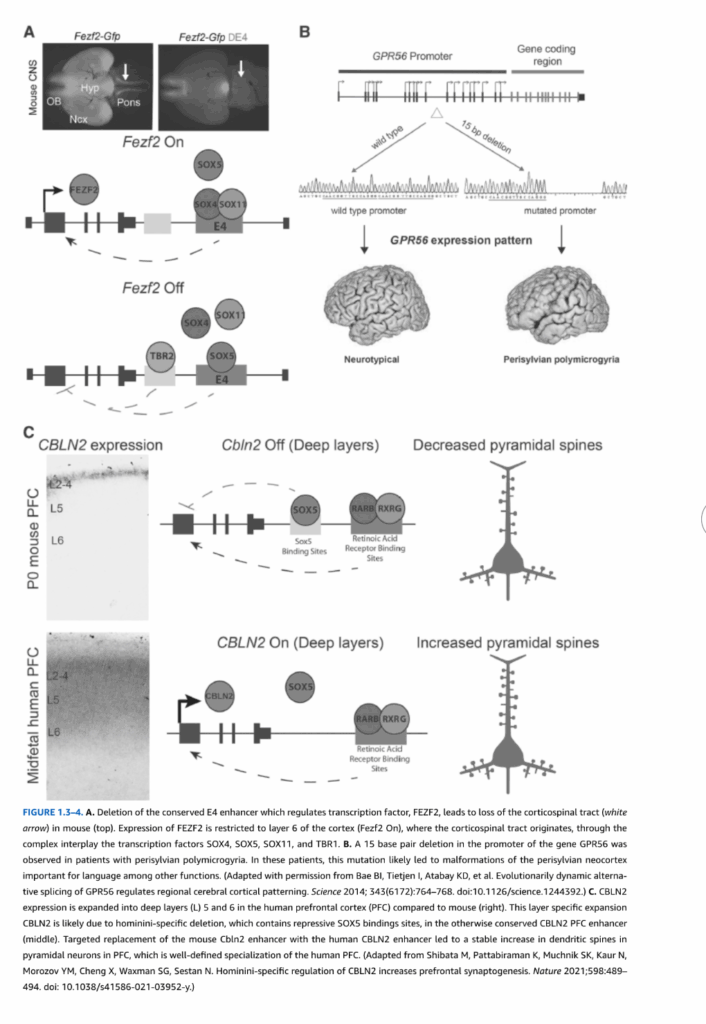
図1.3-4.
A. 転写因子FEZF2を調節する保存されたE4エンハンサーの欠失により、マウスで皮質脊髄路(白矢印)が失われる(上)。FEZF2の発現は、皮質脊髄路が起源となる皮質の第6層に限定され(Fezf2 On)、転写因子SOX4、SOX5、SOX11、TBR1の複雑な相互作用を通じて調節される。
B. 大脳周囲多小脳回症の患者で、遺伝子GPR56のプロモーターに15塩基対の欠失が観察された。これらの患者において、この変異は言語機能などに重要な大脳周囲新皮質の奇形をもたらした可能性が高い。(Bae BI, Tietjen I, Atabay KD, et al. Evolutionarily dynamic alternative splicing of GPR56 regulates regional cerebral cortical patterning. Science 2014; 343(6172):764-768. doi:10.1126/science.1244392.より許可を得て改変)
C. CBLN2発現は、マウスと比較してヒト前頭前皮質(PFC)で深層(L)5および6に拡張している(右)。このCBLN2の層特異的拡張は、他では保存されているCBLN2 PFCエンハンサー内の抑制性SOX5結合部位を含むヒト族特異的欠失によるものと考えられる(中央)。マウスCbln2エンハンサーをヒトCBLN2エンハンサーで標的置換すると、PFCの錐体ニューロンで樹状突起スパインの安定的増加をもたらし、これはヒトPFCの明確に定義された特殊化である。(Shibata M, Pattabiraman K, Muchnik SK, Kaur N, Morozov YM, Cheng X, Waxman SG, Sestan N. Hominini-specific regulation of CBLN2 increases prefrontal synaptogenesis. Nature 2021;598:489-494. doi: 10.1038/s41586-021-03952-y.より改変)

