1.4 神経発達と神経新生
EMANUEL DICICCO-BLOOM, M.D., AND COURTNEY R. MCDERMOTT, B.A.
神経発達と神経新生
神経系発達を仲介する分子・細胞機序の理解は精神医学において重要である。なぜなら、発達過程の異常が多くの脳疾患に寄与することをよく知っているからである。発達的基盤は自閉症、脆弱X精神遅滞、レット症候群などの幼児期疾患では驚くべきことではないかもしれないが、統合失調症やうつ病などの成熟期疾患でさえも個体発生因子を反映している。例えば、診断時に前脳領域の体積、ニューロンおよびグリア細胞数の減少が明らかになる場合があるが、成熟に伴って神経細胞密度、神経線維網、髄鞘化において追加的変化が生じる。同様に、自閉症では初期の脳成長が増加している可能性があり、胎児期の発達的細胞増殖と遊走の障害を反映する細胞組織の異常が観察される。初期脳発達の異常な制御がある場合、細胞型、数、位置が異なる、または異常な結合を形成する可能性のある変化したニューロン集団の基盤を築くことになり、相互作用するグリア集団に対する結果をもたらす。段階的な出生後発達により、成熟する脳システムは構成ニューロンに複雑な情報処理の増加するレベルの達成を求めるが、初期条件が乱れれば欠陥となる可能性がある。成熟中に新しい神経特性が出現するのは、ニューロン集団が進行中の経験に基づき修正された追加的機能ネットワークを形成するためである。脳の動的特性を考慮すると、遺伝的および環境因子によって引き起こされる神経集団とシステムの発達異常は、人の生涯の様々な時期に現れる可能性が高い。
神経系形態学的発達の概観
脳発達を考える際、いくつかの包括的原理が理解の指針となる可能性がある。第一に、異なる脳領域とニューロン集団は発達の異なる時期に生成され、これが遺伝的および環境的侵襲に対する異なる感受性の窓を提供する。第二に、個体発生を構成する細胞プロセスの順序は、初期事象の異常が必然的に後続段階の違いをもたらすことを予測するが、そのような異常は臨床ツールでは検出できない場合がある。例えば、初期生成ニューロンの数の欠陥は、おそらく後に軸索突起と被鞘白質の減少をもたらすが、後者のみが成熟脳のMRIやDTIを用いた脳画像で検出可能かもしれない。第三に、細胞外成長因子と同族受容体や転写因子などの特定の分子シグナルが細胞の複数の発達段階を制御し、細胞増殖、生存促進、ニューロン遊走、突起伸長、学習と記憶の基盤となる瞬間的シナプス修飾(可塑性)に役割を果たすことが明らかである。最後に、高次機能哺乳類は、幹細胞増殖および神経前駆細胞の延長された成熟を含む、継続的成長、学習と記憶、疾患脆弱性に寄与する可能性のある神経新生に対するより高い能力を有している。本章では、これらの原理を考慮しながら発達を制御する細胞・分子システムを検討し、精神疾患への含意を議論する。
神経板と神経管形成
ヒト胚の神経システムは妊娠2週半から4週の間に最初に現れる。発達中、ニューロンを含む新しい細胞型の出現は、隣接する細胞層間の相互作用から生じる。妊娠13日目に、胚は細胞シートから構成される。外胚葉と内胚葉からなる二細胞層胚を形成する原腸形成(14日目と15日目)後、神経板領域は16日目に下層の中胚葉によって画定される。中胚葉は原条と呼ばれる外胚葉の正中線裂隙に入る細胞によって形成され、上層の外胚葉を神経板になるよう誘導する。誘導は一群の細胞からの可溶性成長因子の放出を含み、これが隣接細胞の受容体に結合し、下流遺伝子発現を制御する核転写因子の変化を引き起こす。場合によっては、細胞間接触媒介機序も関与する。以下の遺伝子パターニング節では、可溶性成長因子と転写因子発現の重要な役割について説明する。
18日までに誘導が完成する神経板は円柱上皮のシートであり、外胚葉上皮に囲まれている。形成後、神経板の端が隆起し、神経堤を形成する。その後、細胞内細胞骨格と細胞外基質付着の変化により、堤が正中線で合流し融合する。この神経管形成と呼ばれるプロセスにより、脳室系を予告する中心腔を持つ神経管が形成される(図1.4-1)。融合は後脳レベル(延髄と橋)の頸部領域で始まり、吻側と尾側に続く。神経管形成は妊娠3〜4週に起こり、その失敗は吻側で無脳症、尾側で二分脊椎をもたらす。神経管形成欠陥の発現リスクは、皮膚科製剤のレチノイン酸および抗けいれん薬、特にバルプロ酸(VPA)への曝露、ならびに葉酸欠乏食により増加する。

図1.4-1. 神経管形成の機序。神経管形成は、下層の脊索から放出される可溶性成長因子に反応した神経板の形成から始まる。神経板は、立方上皮細胞が円柱状になることから生じる外胚葉の肥厚として発生する。細胞形状と接着のさらなる変化により、板の端が折れ曲がって立ち上がり、正中線で合流して管を形成する。神経襞の先端の細胞は神経管と上層の表皮の間に位置し、末梢神経系およびその他の構造を生み出す神経堤を形成する。
神経管形成のもう一つの産物は神経堤であり、その細胞は神経板の端縁と背側神経管から由来する。この位置から、神経堤細胞は背外側に遊走して皮膚下でメラノサイトを形成し、腹内側に遊走して末梢神経系の後根感覚神経節と交感神経鎖、および腸管神経系の神経節を形成する。しかし、神経堤は神経内分泌系、心臓系、間葉系、骨格系の細胞を含む多様な組織を生み出し、脳およびその他の臓器に関わる多くの先天症候群の基盤を形成する。神経堤の神経・表皮外胚葉境界での起源とメラノサイトの生成は、結節性硬化症や神経線維腫症を含む神経皮膚疾患の基盤を形成する。最後に、神経管形成中に形成される中胚葉起源のもう一つの非神経構造は、神経管の腹側に見られる脊索である。以下に示すように、脊索は神経管分化中に重要な役割を果たす。なぜなら、遺伝子パターニングと細胞決定に影響を与えるソニックヘッジホッグ(Shh)などの可溶性成長因子のシグナル源だからである。
胚神経系の領域分化
閉鎖後、神経管は差次的に拡張し、脳の主要機能区分に先行する主要細分化を形成する。異なる細分化は、増殖、遊走、分化の特定のスケジュールに従って生成される。神経管は縦方向、周方向、放射方向を含む三次元で記述できる。縦方向の次元は吻尾側(前後)組織を反映し、最も単純には脳と脊髄である。表面に接線方向の周方向組織は二つの軸を表す:背腹軸では、細胞群が上から下まで特異的に位置している。内側から外側への軸では、左右鏡像対称がある。最後に、放射次元は脳室に隣接する最内側細胞層から最外側表面までの組織を表し、領域特異的細胞層化を示す。4週目で、ヒト脳は縦方向に三つの「胞」に分かれる:前脳胞(前脳)、中脳胞(中脳)、菱脳胞(後脳)(図1.4-2)。5週目までに、これら三つの「胞」はさらに五つの区分に分かれ、前脳胞は終脳(皮質、海馬、基底核を含む)と間脳(視床と視床下部)を形成し、中脳胞(中脳)、そして菱脳胞は後脳(橋と小脳)と髄脳(延髄)を生み出す。これらの形態学的変化は、脳室に隣接する前駆細胞の領域特異的増殖、すなわち脳室帯(VZ)に依存する。増殖は増殖細胞自身によって作られる、または領域シグナル中枢から放出される可溶性成長因子に依存する。成長因子産生と同族受容体発現も領域特異的パターニング遺伝子に依存する。形態学的に均質に見えるVZ前駆細胞は、各ドメインで特定タイプのニューロンの生成を制御する分子遺伝学的決定因子のチェッカーボード配列を発現する(図1.4-3)。
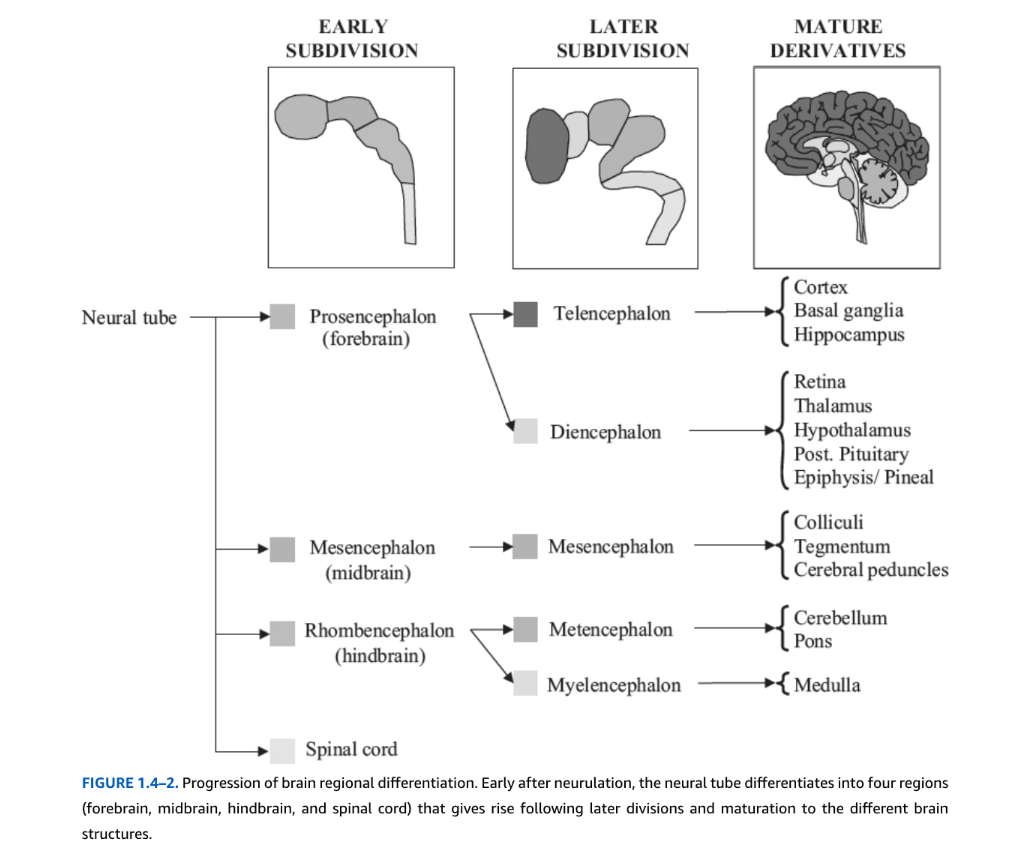
図1.4-2. 脳領域分化の進行。神経管形成の直後、神経管は四つの領域(前脳、中脳、後脳、脊髄)に分化し、その後の分裂と成熟により異なる脳構造を生み出す。
周方向の次元では、組織化は非常に早期に始まり、多くの吻尾側細分化に及ぶ。脊髄では、組織の大部分は側板で構成され、これは後に感覚介在ニューロンからなる背側または翼板と、腹側運動ニューロンからなる運動または基底板に分かれる。天井板と底板と呼ばれる他の二つの小さな板は、胚における成長因子シグナル中枢として重要な制御的役割を果たす。腹側に位置する脊索からのShhに反応して、底板は独自のShhを産生し、これが腹側脊髄と脳幹の隣接細胞に細胞表現型と機能を特定する領域特異的転写因子の発現を誘導する。例えば、底板のShhは中脳前駆細胞を黒質のドパミン分泌ニューロンに分化するよう誘導する。同様に、天井板は骨形成タンパク質(BMP)を分泌し、これは脊髄で背側感覚ニューロンの細胞運命を誘導するが、その欠如では小脳と正中線海馬の両方が欠損する。最後に、放射次元では、層の組織は細分化特異的であり、VZ前駆細胞の差次的増殖と細胞遊走によって産生される。
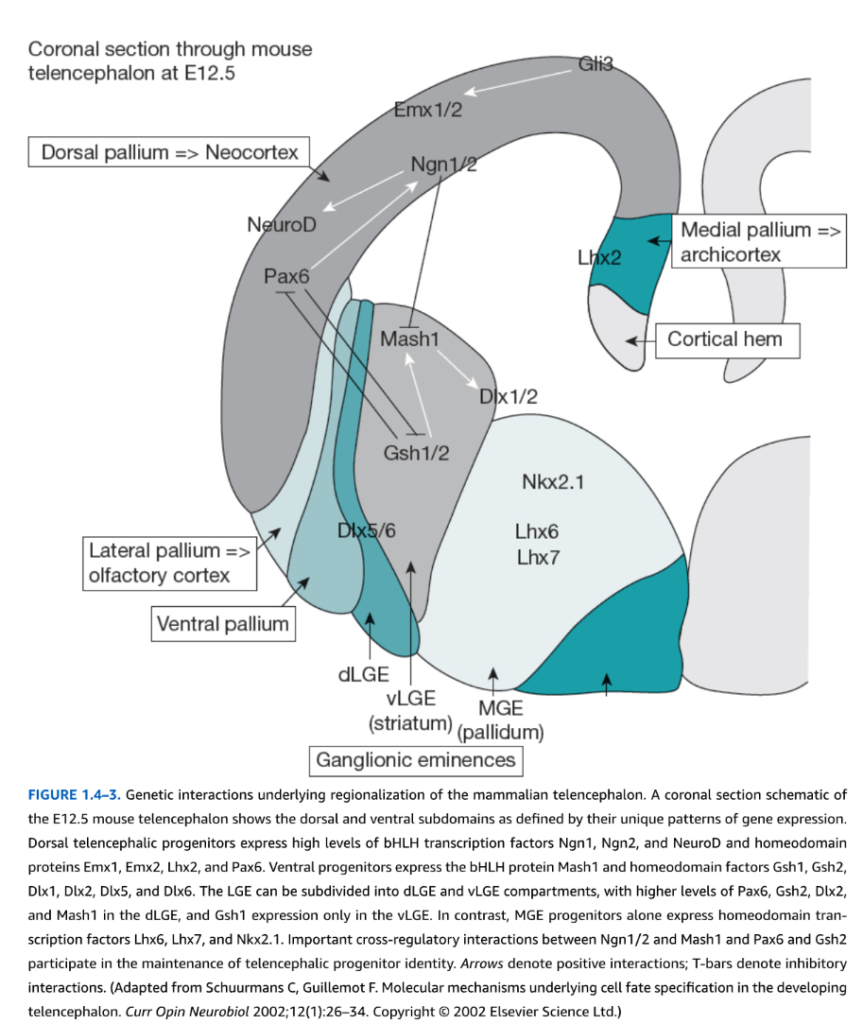
図1.4-3. 哺乳類終脳の領域化の基盤となる遺伝的相互作用。E12.5マウス終脳の冠状断模式図は、独特な遺伝子発現パターンによって定義される背側および腹側サブドメインを示している。背側終脳前駆細胞は、bHLH転写因子Ngn1、Ngn2、NeuroD、およびホメオドメインタンパク質Emx1、Emx2、Lhx2、Pax6の高レベル発現を示す。腹側前駆細胞は、bHLHタンパク質Mash1およびホメオドメイン因子Gsh1、Gsh2、Dlx1、Dlx2、Dlx5、Dlx6を発現する。LGE(外側神経節隆起)はdLGEとvLGEコンパートメントに細分化でき、dLGEではPax6、Gsh2、Dlx2、Mash1のより高いレベルが見られ、Gsh1発現はvLGEのみに見られる。対照的に、MGE(内側神経節隆起)前駆細胞のみがホメオドメイン転写因子Lhx6、Lhx7、Nkx2.1を発現する。Ngn1/2とMash1間、およびPax6とGsh2間の重要な相互制御的相互作用が終脳前駆細胞アイデンティティの維持に関与している。矢印は促進的相互作用を示し、T字バーは抑制的相互作用を示す。(Schuurmans C, Guillemot F. Molecular mechanisms underlying cell fate specification in the developing telencephalon. Curr Opin Neurobiol 2002;12(1):26-34. Copyright @ 2002 Elsevier Science Ltd.より改変)
一次増殖帯
異なる領域における前駆細胞増殖と遊走の独特なパターンが、神経系の放射状組織を生み出す。各縦方向細分化において、脳領域集団の最終サイズは、調節された神経新生とプログラム細胞死の相互作用に依存する。従来の概念では、どこでも過剰な細胞産生が起こり、最終的な細胞数調節は主に標的由来生存(栄養)因子によって媒介される選択的細胞死によって達成されると示唆されていた。実際には、パターニング遺伝子は最終構造的要求と協調された領域前駆細胞増殖の指導において重要な役割を果たし、プログラム細胞死は複数の段階で起こる。したがって、統合失調症のような正常より小さい脳領域を特徴とする疾患では、後続の細胞喪失を伴う正常な生成とは対照的に、初期にニューロンを生成する失敗がある可能性がある。
特定の細胞型の生成、すなわち神経新生のプロセスは、未分化前駆細胞(または前駆体)の増殖、その後の増殖停止(細胞周期からの退出)、細胞の最終目的地への遊走、神経フィラメントや神経伝達物質系などの特定の表現型特徴の発現を含む。前駆細胞増殖は発達中、主に二つの密集した領域で起こる。一次部位は全脳室系の壁を覆うVZであり、吻尾側次元のすべての脳領域に寄与する。しかし、大脳皮質、海馬、小脳皮質を含む特定の領域では、VZからの前駆細胞がより制限された範囲の細胞型を生成する二次帯に遊走する。
初期胚では、神経管VZ前駆体は1細胞層の厚さの偽重層神経上皮として配列している。双極性VZ前駆細胞は脳室から軟膜表面まで広がる細胞質突起を持つ。細胞周期中、細胞核が核間運動と呼ばれる移動を行うため、VZは多層または重層に見える。前駆細胞分裂(M期)は脳室縁で起こり、二つの新しい細胞を産生する(図1.4-4)。次に、子孫細胞は軟膜に向かって外側に移動しながらG1に再入する。細胞外シグナルの影響下で、これらの細胞は別の分裂ラウンドにコミットし、上部VZ縁近くで起こるS期への再入によって標識される。DNA複製後、核はG2中に脳室表面に戻り、そこで有糸分裂して分裂する。
異なる研究分野は核間遊走のいくつかの異なる役割を示唆している:(1)核間核遊走は、後続の増殖と遺伝子発現に影響を与える分裂後細胞によって産生される環境手がかりへの核のアクセスを可能にする可能性がある;(2)VZ縁の分裂細胞は、Shh、Wnt、Notchを含む局所制御シグナルを感知し反応する一次繊毛を持つ;(3)タイムラプス解析は、VZの物理的に制限された領域と有糸分裂を受ける細胞の高密度のため、非分裂細胞の核はこの領域から離れるが、次の分裂時に戻ることを示唆している。核間核移動や有糸分裂紡錘体組織化装置である中心体を妨害するヒト遺伝子変異は、細胞遊走を障害し、異所性ニューロンとてんかん症候群を生み出す。
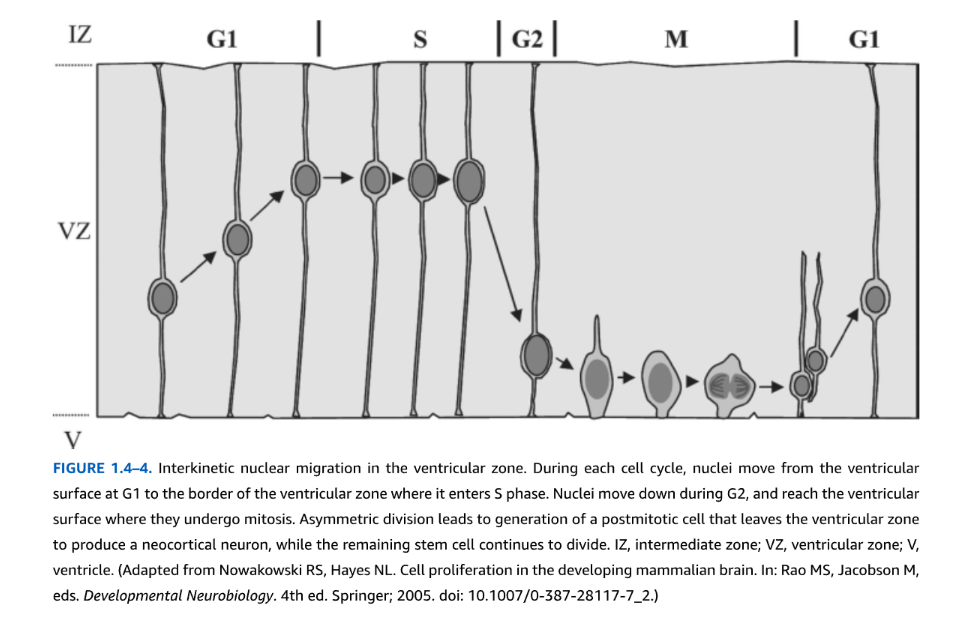
図1.4-4. 脳室帯における核間期核移動。各細胞周期において、核はG1期に脳室表面から脳室帯の境界まで移動し、そこでS期に入る。核はG2期に下方へ移動し、脳室表面に到達して有糸分裂を行う。非対称分裂により、脳室帯を離れて大脳皮質ニューロンを産生する分裂後細胞が生成される一方、残存する幹細胞は分裂を続ける。IZ、中間帯;VZ、脳室帯;V、脳室。(Nowakowski RS, Hayes NL. Cell proliferation in the developing mammalian brain. In: Rao MS, Jacobson M, eds. Developmental Neurobiology. 4th ed. Springer; 2005. doi: 10.1007/0-387-28117-7_2.より改変)
最初期段階では、VZ細胞は前駆細胞プールを増加させるために分裂する。その後、神経形成期において、前駆細胞は分裂して分裂後ニューロンと別の分裂する前駆細胞の両方を生み出す。神経形成が停止すると、前駆細胞の分裂は2つの分裂後ニューロンのみを産生し、これによりニューロン産生が大幅に増加し前駆細胞プールが枯渇する。新生ニューロンは放射状グリア細胞(RGCs)の突起に沿って移動し、大脳皮質板などの最終目的地に到達する(図1.4-5A)。RGCsは双極性のVZ前駆細胞で、一方の突起は脳室表面に接し、もう一方は軟膜表面に接触している。新生ニューロンと放射状グリア突起との結合により、異なるパターニング遺伝子を発現する限局されたVZ領域内で生成された細胞が、特定の皮質機能領域に移動することが可能となる。このモデルは皮質「プロトマップ」と呼ばれ、P. Rakicによって最初に提唱された。前駆細胞の表現型運命は、細胞が分裂を停止し移動を開始する前に、すでに遺伝的に規定されている。ある程度まで、同じVZ領域から生まれた細胞は関連する放射状細胞コラム(クローン集団)を形成し、最初は電気的結合を示し、その後優先的に化学シナプス相互接続を発達させる。この神経解剖学的関係は、げっ歯類およびヒトを含むすべての霊長類の皮質コラムで観察される明確に定義された機能的・神経生理学的活動の基盤の一つである。それにもかかわらず、皮質ニューロンにシナプスを形成する視床からの求心性線維も、それらの最終的なニューロン運命と機能に影響を与える。ヒト脳では、ニューロン産生は一般的に妊娠最初の4か月間に起こり、その後出生まではニューロンの移動が起こる一方で、グリア前駆細胞は増殖・移動し、ミエリン産生を開始する。
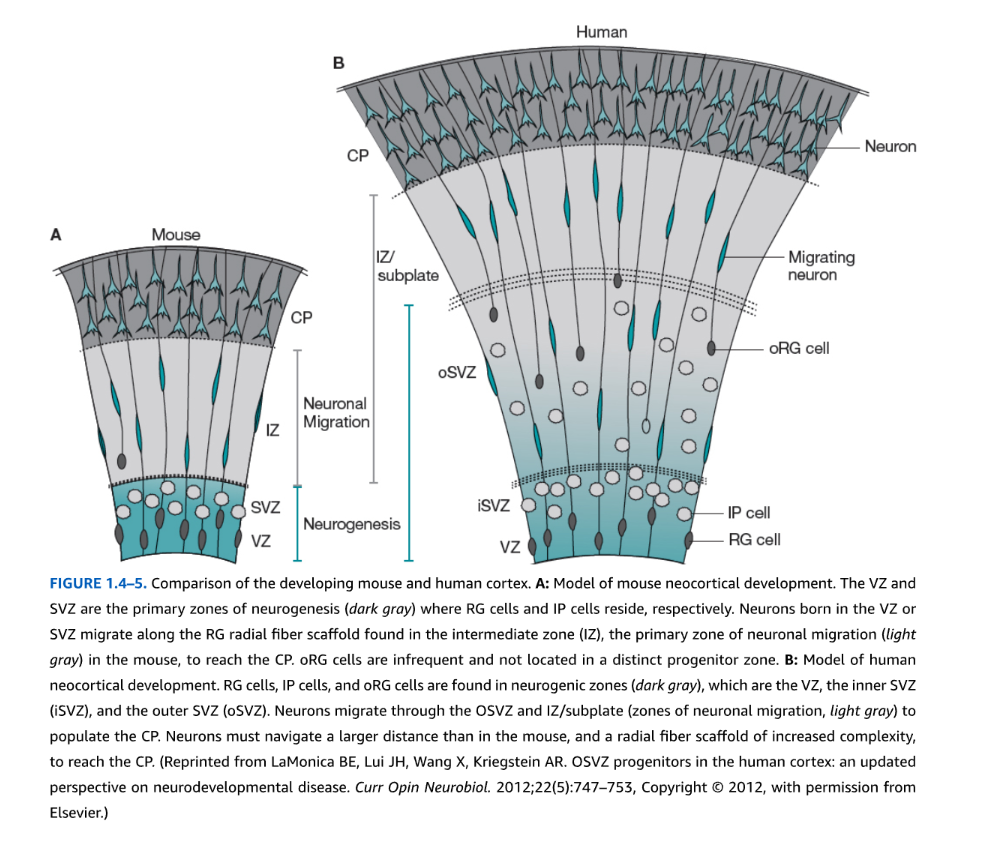
図1.4-5. 発達期マウスとヒト皮質の比較。A:マウス大脳皮質発達のモデル。VZとSVZは神経形成の主要領域(濃灰色)であり、それぞれRG細胞とIP細胞が存在する。VZまたはSVZで生まれたニューロンは、マウスにおける神経移動の主要領域である中間帯(IZ、淡灰色)に存在するRG放射状線維足場に沿って移動し、CPに到達する。oRG細胞は稀であり、明確な前駆細胞領域には局在しない。B:ヒト大脳皮質発達のモデル。RG細胞、IP細胞、およびoRG細胞は神経形成領域(濃灰色)に存在し、これらはVZ、内側SVZ(iSVZ)、および外側SVZ(oSVZ)である。ニューロンはOSVZとIZ/サブプレート(神経移動領域、淡灰色)を通過してCPに集積する。ニューロンはマウスよりも長い距離を移動し、より複雑な放射状線維足場を通ってCPに到達しなければならない。(LaMonica BE, Lui JH, Wang X, Kriegstein AR. OSVZ progenitors in the human cortex: an updated perspective on neurodevelopmental disease. Curr Opin Neurobiol. 2012;22(5):747-753, Copyright @ 2012, with permission from Elsevier.より転載)
VZの神経形成の一般的な計画に加えて、二次増殖帯は特定の領域で特異的なニューロン集団を産生する。例えば、大脳皮質と視床では、脳室下帯(SVZ)が中間前駆細胞を産生し、これらはオリゴデンドロサイト、多様なアストロサイト、およびニューロンを生成できる。海馬では、門部およびその後の顆粒下帯(SGZ)が歯状回(DG)顆粒ニューロンを産生し、これは成体神経形成の生涯にわたるプロセスであるが、ヒト成体神経形成の持続期間は大きな論争の対象である(以下参照)。最後に、新生児小脳では、その上の外顆粒層(EGL)がヒトでは7〜24か月間顆粒ニューロンを生成し、この集団は新生児集中治療室(NICU)で投与される医学的治療の影響を受ける。VZとは対照的に、二次帯細胞は核の移動を示さず、異なる制御機構を示唆している。神経形成が完了すると、VZは上衣内層の線毛上皮細胞に分化する。上衣の下層にあるSVZの未分化細胞は上衣下と呼ばれ、神経幹細胞(NSC)集団として同定されており、生涯にわたって増殖し、ニューロンとグリアを生成する能力がある。ヒトでは、これらの新生ニューロブラストの量と最終目的地は不明であるが、側脳室由来のニューロブラストは成人期に近くの線条体に移動して介在ニューロンに分化する。さらに、ハンチントン病の進行期にはそれらの枯渇が観察される。
SVZと同様に、ヒトおよび他の霊長類は皮質に外側脳室下帯(OSVZ)と呼ばれる追加的な増殖領域を持ち、その広範な増殖が大脳皮質の大規模な進化的増大を説明している。この領域は妊娠第2期の初めに最初に出現し、妊娠中期までに神経形成の主要部位となり、SVZの神経形成能力を約4倍上回る。OSVZは放射状グリア様(oRG)細胞を含み、これらは軟膜に接触する1つの長い基底突起のみを持ち、心室に接触する先端突起と基底突起の両方を持つVZの放射状グリア(RG)とは異なる(図1.4-5B)。oRG細胞は自己再生能力を持ち、OSVZ内での細胞体移動中に有糸分裂を行うが、心室への移動は行わない。これらは増殖能力を持つ中間前駆娘細胞を生み出し、基底突起を上方に移動した後、上位皮質層II-IVの興奮性ニューロンに分化する。OSVZは脳回形成型(高度に折りたたまれた)脳の形成に役割を持ち、皮質の折りたたみにより、より高等な脊椎動物に見られるはるかに大きな皮質表面積が限られた頭蓋内空間に収まることを可能にする。したがって、OSVZはより高機能な生物において皮質の神経形成能力を増加させ、より複雑な機能を可能にするために進化したと思われる。最近の研究では、NOTCH2NLAとその並列遺伝子を含む新たに進化した霊長類遺伝子が、VZとOSVZでの増殖を増強して皮質集団の生成と脳回形成を増加させることにより、ヒトでの拡張的神経形成の基盤となることを示唆している。
神経形成と移動の放射状および接線状パターン
脳の異なる領域は、よく認識された3つの時空間的神経形成パターンを通じて生成される。VZから離れる前駆細胞増殖と細胞移動の放射状パターンが2つあり、これらは内側から外側および外側から内側パターンと呼ばれる。第3のパターンは細胞の非放射状または接線状移動を含む。実験的には、細胞分裂前に合成されるDNAにチミジン類似体を取り込ませることにより、以前にin vivoで標識された細胞の局在を追跡する。これらの類似体には三重水素(3H)チミジンまたはブロモデオキシウリジン(BrdU)が含まれる。発達後期を観察すると、最近有糸分裂を完了した細胞のみが標識を保持する。これは分裂を続ける細胞からは失われるためである。前駆細胞が標識を取り込む最後の日がその誕生日と考えられ、その後細胞周期から離脱し、分化し、最終位置に移動する。
精神医学の焦点として、系統発生学的により最近の大脳皮質は内側から外側神経形成の典型的モデルである。胚性前脳終脳胞から由来し、大脳皮質機能の共通の細胞構築学的および生理学的基盤を表す特徴的な6細胞層構造を示す。各層内で、ニューロンは関連する軸索樹状突起形態を示し、共通の神経伝達物質を使用し、類似の求心性および遠心性接続を確立する。一般的に、III層の錐体ニューロンは皮質半球内および皮質半球間でシナプスを確立するのに対し、より深いV/VI層ニューロンは主に視床、線条体、脳幹、脊髄を含む皮質下核に投射する(第1.2章参照)。皮質ニューロンの大部分、特にグルタミン酸作動性興奮性ニューロンは、前脳VZおよびOSVZに由来する。皮質形成の最初期段階では、最初の分裂後細胞がVZから外向きに移動して前板と呼ばれる表層を確立し、これは最外層Iを形成するカハール・レチウス細胞と、将来のVI層下に位置するサブプレートニューロンから構成される(図1.4-6)。その形成後、前板は成熟皮質板を形成する皮質VZおよびOSVZ前駆細胞の到着によって二分される。これらの皮質前駆細胞は内側から外側の様式で前板に移動する:最初にV/VI層ニューロンが到着し、その後に生成されたニューロンがそれらを通り過ぎてより表層の層を形成する。したがって、前駆細胞が細胞周期から離脱する日が、生成されるニューロンの種類と局在を予測する。
前板カハール・レチウス細胞は細胞外糖タンパク質リーリンを産生し、これはニューロン移動の重要なシグナルである。マウスでリーリンが欠失すると、皮質ニューロン移動が逆転し、ニューロンが逆パターン、すなわち外側から内側の様式で蓄積する。重要なことに、異常なレベルのリーリンタンパク質とmRNAが、大うつ病、双極性障害、統合失調症、自閉症、アルツハイマー病を含む多くの疾患で観察されている。ヒトリーリン変異は滑脳症(平滑脳)、脳回と脳溝の欠如、および小脳の異常と関連している。
もう一つの前板構成要素であるサブプレートニューロンは、異なる出生前および出生後の役割を持つ皮質回路の確立に重要である。サブプレート内の神経回路は最初に自発的神経活動によって確立され、これは部分的にコネキシンタンパク質から構成されるギャップ結合によって媒介される細胞間電気接続に依存する。この活動は自発的であり、外部感覚入力に依存せず、影響も受けない。発達が進むにつれて、後にIV層皮質ニューロンにシナプスを形成する視床からの初期求心性線維は、最初に標的皮質ニューロンの到着を待ちながら前板ニューロンに一時的なシナプスを形成する。視床求心性線維が前板細胞を離れると、多くが細胞死を起こす。臨床的に、サブプレートニューロンは妊娠中およびNICUでの周産期傷害、低酸素虚血、薬物、感染、または炎症に特に脆弱である。
内側から外側神経形成とは対照的に、外側から内側パターンは視床下部、頂蓋、脊髄、海馬DGなどの系統発生学的により古い構造で起こる。最初に形成された分裂後ニューロンは表層に位置し、最後に生成された細胞は中心に向かって局在する。このパターンは単により多くの細胞が生成されるにつれての受動的細胞置換を反映するかもしれないが、放射状グリアと特異的移動シグナル分子が明確に関与している。さらに、細胞は必ずしもVZ生成部位からの直接的延長に位置するわけではない。むしろ、下オリーブ核のニューロンで観察されるように、一部の細胞群は特定の場所に移動する。海馬では錐体細胞層、アンモン角CA1から3のニューロンが、妊娠7〜15週の限定期間に背内側前脳で典型的な外側から内側様式で生成され、複雑な移動パターンを示す。対照的に、DG顆粒ニューロンは18週に出現し始める。前脳VZからの前駆細胞は軟膜下経路に沿ってDG門部に移動し、そこでニューロンとグリアの両方を生成する。時間とともに、顆粒前駆細胞は歯状回顆粒細胞層のすぐ下の層、顆粒下帯(SGZ)と呼ばれる部位に移動し、これは成体ラット、霊長類、ヒトで生涯にわたってニューロンを産生する。げっ歯類では、SGZ前駆細胞は脳虚血、組織損傷、発作、神経精神薬物、食事、運動、および成長因子に応答して増殖する。臨床的に、統合失調症やうつ病で報告されている海馬体積の減少は、機能障害の基盤として、あるいは脳損傷と感染、環境的・経験的ストレッサーの結果として、異常な神経形成が病因に役割を果たしている可能性を提起している。
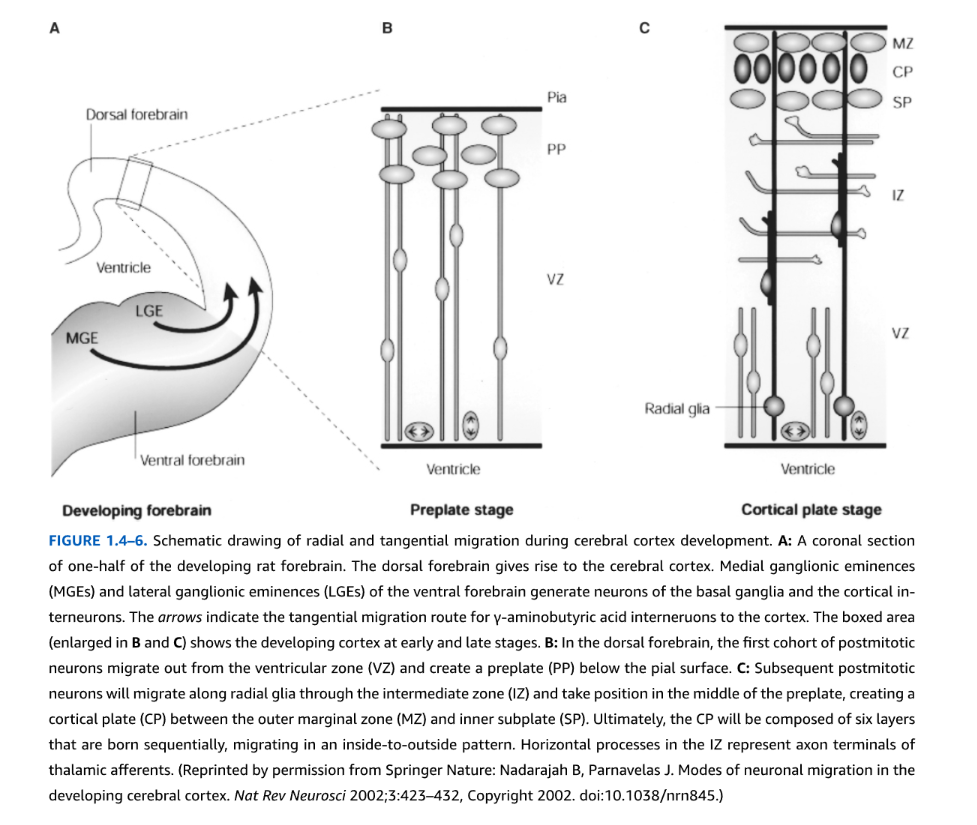
図1.4-6. 大脳皮質発達期における放射状および接線状移動の模式図。A:発達期ラット前脳の半分の冠状断面。背側前脳は大脳皮質を生み出す。腹側前脳の内側隆起(MGE)と外側隆起(LGE)は基底核のニューロンと皮質介在ニューロンを生成する。矢印はγ-アミノ酪酸介在ニューロンの皮質への接線状移動経路を示す。囲まれた領域(BとCで拡大)は発達早期および後期の皮質を示す。B:背側前脳では、分裂後ニューロンの最初のコホートが脳室帯(VZ)から移動し、軟膜表面下に前板(PP)を形成する。C:後続の分裂後ニューロンは中間帯(IZ)を通って放射状グリアに沿って移動し、前板の中央に位置を取り、外側辺縁帯(MZ)と内側サブプレート(SP)の間に皮質板(CP)を形成する。最終的に、CPは順次生まれた6層から構成され、内側から外側のパターンで移動する。IZ内の水平突起は視床求心性線維の軸索終末を表す。(Springer Natureの許可により転載:Nadarajah B, Parnavelas J. Modes of neuronal migration in the developing cerebral cortex. Nat Rev Neurosci 2002;3:423-432, Copyright 2002. doi:10.1038/nrn845.)
放射状および非放射状移動の異なる組み合わせが小脳で観察される。小脳は全脳ニューロンの約75%を含み、運動回路と非運動回路の両方に寄与し、自閉症スペクトラム障害(ASD)との関連で重要である。小脳発達は妊娠4週に始まり、2歳まで続く。プルキンエ細胞と深部核を含む主要なGABA作動性ニューロンは、他の脳幹ニューロンと同時期に、第四脳室を囲む一次VZに由来する。これはヒトでは妊娠5〜15週に起こる。対照的に、顆粒ニューロンと一部の介在ニューロンを含む小脳のグルタミン酸作動性ニューロンは、第四脳室の蓋板を囲むVZとは異なる背側構造である菱脳唇に由来する前駆細胞から生成される。菱脳唇前駆細胞は妊娠8〜9週に背側に移動して小脳表面を覆い、制限された神経運命を持つニューロンを生成し2年まで持続する二次増殖帯、外顆粒層(EGL)を確立する。EGL前駆細胞が増殖を停止すると、細胞体は表面下に沈み、分子層で横方向に伸びる両側突起を成長させ、その後細胞体はさらに下方の内顆粒層(IGL)に移動する。細胞は放射状グリアと類似の誘導機能を果たす特殊化したベルクマングリアに沿ってIGLに到達する。臨床的に、乳児におけるこの出生後集団は、小脳顆粒ニューロン形成を幼児期の感染性傷害に対して脆弱にし、細胞増殖を阻害するステロイドや癌化学療法などの治療薬の望ましくない標的となる。この幹細胞集団の増殖制御は、小児期の一般的な脳腫瘍である髄芽腫で失われる(図1.4-7)。
発達期細胞死
神経系発達期において、細胞死は再現性があり、空間的・時間的に制限された細胞の死であり、その除去は相互作用する神経細胞の比率を調整するために必要である。3つのタイプの細胞死が記述されている:(i)系統発生的細胞死は、尾のように進化的により早期の種で機能していた構造を一つの種から除去する;(ii)形態形成的細胞死は、胚の櫂状肢から指を彫刻し、視胞および尾側神経管の形成に必要である;(iii)組織形成的細胞死は、特定の脳領域の選択された細胞の除去を可能にする広範なプロセスである。組織形成的細胞死は、脳領域によってニューロンの20〜80%に影響を与える可能性がある。発達期細胞死の主要な役割は、神経成長因子(NGF)のパラダイムに基づいて1980年代に提唱された。競争的プロセスが新たなニューロン集団とその最終標的領域のサイズの適切な整合を確保すると考えられていた。神経形成後、分化するニューロンの生存は、軸索が標的に到達してNGF栄養(生存)因子の限定量を獲得することに絶対的に依存すると考えられていた。交感神経および感覚ニューロンなどの末梢集団では明らかに真実であるが、より複雑なプロセスが神経発達中の細胞死を制御し、標的神経支配に先行するすべての段階、すなわち神経前駆細胞の増殖、移動、分化で起こる。プログラム細胞死は神経発達中の必要なプロセスである。胚マウスで媒介酵素であるカスパーゼの遺伝子欠失は、著明な領域特異性を持つ拡大し無秩序な脳を産生するためである。
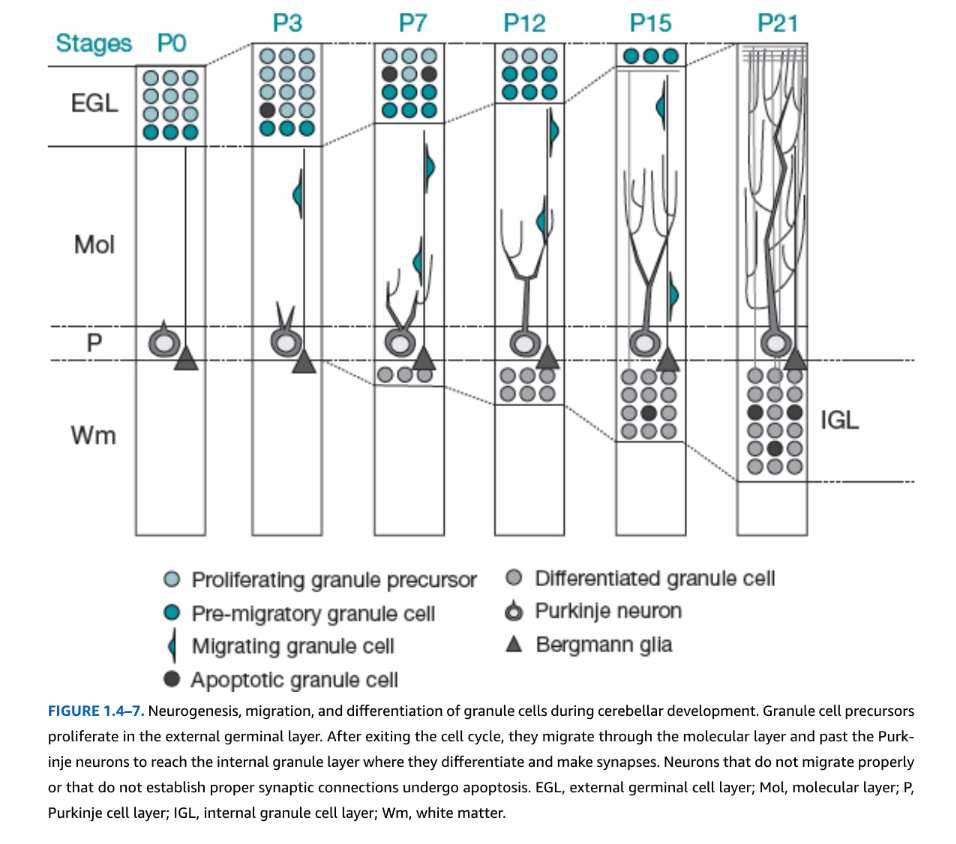
図1.4-7. 小脳発達期における顆粒細胞の神経形成、移動、分化。顆粒細胞前駆細胞は外顆粒層で増殖する。細胞周期から離脱した後、分子層を通ってプルキンエニューロンを通り過ぎ、内顆粒層に到達してそこで分化しシナプスを形成する。適切に移動しないか、適切なシナプス結合を確立しないニューロンはアポトーシスを起こす。EGL、外顆粒細胞層;Mol、分子層;P、プルキンエ細胞層;IGL、内顆粒細胞層;Wm、白質。
プログラム細胞死
形態学的基準に基づいて、3つのタイプのプログラム細胞死が記述されている。「アポトーシス細胞死」は最も一般的であり、クロマチン凝縮と膜ブレッビングを特徴とし、続いて核断片化と細胞収縮が起こる。「オートファジー性変性」では、隣接する変性細胞群が関与し、大きなオートファジー空胞と濃縮核を特徴とする。はるかに稀なのは「細胞質型細胞死」で、これは壊死と類似点を示す。
発生期細胞死の主要なタイプとして、アポトーシス機構は広範囲に検討されている。アポトーシスには、システイン含有アスパラギン酸特異的プロテアーゼの一連の活性化が関与し、これはカスパーゼとも呼ばれ、一連の細胞内イベントを引き起こす。多数のシグナル(アポトーシス促進および抑制の両方)が収束して、3つの段階からなる共通のシグナル伝達経路を制御する。
まず、「開始」と呼ばれる調節段階では、生存または細胞死のいずれかを促進する多数の細胞外および細胞内因子が関与する。次に、細胞死の点火の場合、「実行」と呼ばれる第2段階が始まる。エフェクター酵素であるカスパーゼ3および7が活性化され、特異的基質を切断してアポトーシスの最後かつ不可逆的なステップにつながる。この最終的なプログラム変性の間、カスパーゼ活性化DNAse(CAD)がヌクレオソーム間に位置する露出した染色体DNAを切断し、細胞骨格成分が分解され、細胞膜がアポトーシス小体と呼ばれる小胞に膨張する。その後、細胞は分解され、その内容物を放出することなく貪食される。もし内容物が放出されれば、炎症反応を誘発することになる。
歴史的に、2つの主要な経路が記述されている:(i)腫瘍壊死因子α(TNF-α)やFasリガンドなどの死因子の効果を媒介し、カスパーゼ8を関与させる「外因性経路」、(ii)シトクロムCなどのミトコンドリア因子の放出とカスパーゼ9の活性化を関与させる「内因性経路」。現在では、ほとんどの場合、細胞死は複数の因子間の相互作用から生じ、複数のアポトーシス促進または抑制シグナル分子が関与し、互いに対して正または負の調節を発揮することが明らかになっている。
発生期および病理学的細胞死の両方において、同じシグナル伝達カスケードの多くが関与している。アポトーシスの抑制の失敗は癌や自己免疫疾患(多発性硬化症)に関与し、一方でアポトーシスの過剰刺激は発生期(ハンチントン病、リソソーム病、白質ジストロフィー)および加齢期(アルツハイマー病、パーキンソン病)の神経変性疾患で観察される。アポトーシスは、低酸素虚血、胎児アルコール症候群、電離放射線、吸入麻酔薬、神経毒物質への曝露などの発生期脳損傷でも観察される。したがって、発生期におけるアポトーシス細胞死の調節異常は重篤な脳異常につながり、これは後に成熟した機能障害として現れる場合がある。
神経パターニングの概念
組織における遺伝子発現を明らかにするツールが50年前に開発され、特異的遺伝子ノックアウト法が20年後に完成されて以来、神経生物学者は異なる脳領域と関連機能を決定する責任を持つ遺伝子を探索してきた。以下の章では、主にマウスで行われた分子遺伝学研究の成果を簡潔にレビューし、ヒト神経発生との関連性を述べる。しかし、脳発生に対する単一遺伝子の効果を定義することに焦点を当てるこのアプローチでは、欠失が容易かつ再現性をもって観察される主要な破綻を生じることがほぼ必要となる。これらの研究は、隣接領域で発現する遺伝子の主要な相互作用を明確化し、調節原理の基盤を提供する。一方で、この還元主義的アプローチは、発生期脳で発現するヒトゲノム内のタンパク質コード遺伝子(19,000以上)の85パーセント以上を包含することができない。本書の「ヒト脳発生の機能ゲノミクス」と題された別の章では、ヒト脳の遺伝子転写プロファイルと調節機構について記述しており、併読が推奨される。
機能の原理
神経系発生は、細胞外因子と内在性遺伝的プログラムとの相互作用によって制御される。初期には、細胞外シグナルは主に地域シグナル中心(すなわち、脊索、底板または蓋板、周囲間葉組織)から分泌される可溶性増殖因子である。前駆細胞の応答能力(コンピテンス)は、同族受容体発現に依存し、これはタンパク質が遺伝子転写を調節するパターニング遺伝子によって決定される。
パターニング遺伝子はまた、他の転写因子や細胞プロセス(すなわち、増殖、移動、分化)に関与するタンパク質を含む産物を持つ他の遺伝子の転写も制御する。転写因子タンパク質は主に2つのドメインを含む:遺伝子のプロモーターまたはエンハンサー領域に結合するDNA結合ドメインと、遺伝子転写を活性化または抑制できるタンパク質と相互作用するトランス活性化ドメイン。
転写因子は頻繁に多量体タンパク質複合体を形成し、これにより単一の転写因子が複数の細胞型およびプロセスで、また異なる発生段階で役割を果たすことを可能にする。その結果、単一のパターニング遺伝子の発現を変化させることは、多様な機能的結果につながる。さらに、タンパク質相互作用はタンパク質間親和性に依存する。低濃度では転写因子は主に一つのパートナーと結合するが、より高い濃度では別のパートナーと結合する場合がある。調節複合体の多量体性により、単一の因子が一つのプロセスを刺激しながら同時に別のプロセスを阻害することが可能になる。
例えば、パターニング遺伝子タンパク質は一つの遺伝子プロモーターを刺激することで一つの事象を促進する一方で、同時に代替表現型に必要な活性を持つ異なるプロモーターから別の因子を隔離する場合がある。最後に、これらの因子は頻繁に相互調節活性を示し、一つの因子が別の因子の発現を負に調節する。この活性は組織境界の確立につながり、地域細分化の形成を可能にする。
パターニング遺伝子は、発現と機能の異なる時間的配列を示すことによって階層的に作用する。このような階層を定義するために、研究者は遺伝的操作(遺伝子の欠失[機能喪失]または過剰発現/異所性発現[機能獲得])を使用し、発生的結果を観察する。一般的に、地域限定的パターニング遺伝子は、それらが発現する細胞の同一性、したがって機能を特定することに参加する。
これらの遺伝子は以下を含む複数の発生決定を調節する:(1)外胚葉が(皮膚ではなく)神経系を生じることの決定、(2)背腹軸や前後軸での位置的同一性などの領域の次元的特徴の定義、(3)ニューロンやグリアなどの細胞クラスの特定、(4)増殖が停止し分化が始まる時期の決定、(5)GABA介在ニューロンなどの特異的細胞サブタイプの決定および投射パターン、(6)大脳皮質で観察されるような層位置の定義。
神経系をパターニングする転写因子は、進化を通じて高度に保存されたタンパク質ファミリーに属し、多くはショウジョウバエで発見され、そこで体や器官の分節化と形態形成を媒介し、または神経発生を調節する。哺乳類では、Hoxファミリーが尾部から中脳までの前後軸を区切り、後脳の分節(菱脳節)とその脳神経を定義する。
塩基性ヘリックス-ループ-ヘリックス(bHLH)ファミリーは、それぞれ塩基性およびヘリックス領域を通じてDNAとタンパク質に結合し、神経板から神経形成までの複数段階を調節する。他のファミリーはタンパク質相互作用ドメインを反映した名前を持ち、LIMホメオドメイン(Lhx)、ジンクフィンガー、ペアードドメイン(Pax)、翼状ヘリックス(BF1 = Foxg1、Foxa2 = Hnf3β)、およびPouを含む。
最後に、パターニング遺伝子発現は環境シグナル、特に地域シグナル中心から放出される増殖因子によって調節される。局所的増殖因子放出は、位置情報(背側または腹側)を提供し、細胞特定化を与え、および/または増殖成長を制御するこれらのタンパク質の組織勾配を確立する。例にはBMP、Wingless-intタンパク質(Wnt)、Shh、線維芽細胞増殖因子(FGF)、および上皮増殖因子が含まれる。
胚性前脳のパターニング
この章では、脳領域の同一性を決定する転写因子のいくつかを簡潔にレビューし、シグナル中心増殖因子の役割にも言及する。妊娠第3週、すなわち神経板段階でさえ、下層の脊索と間葉、および周囲の表皮外胚葉が隣接する細胞の同一性に影響を与えるシグナル分子を産生するときに、中枢神経系の誘導が始まる。
おそらく驚くことに、神経分化は阻害されない限り、初期胚組織のデフォルト状態である。自身の神経分化を防ぐため、隣接する外胚葉はBMPを産生し、代わりに表皮分化を促進する。神経分化を誘発するため、原始線条の頭側端にあるシグナル中心であるヘンゼン結節は、BMP媒介性の表皮誘導活性をブロックする阻害タンパク質を分泌する。神経管が閉鎖すると、蓋板と底板が新しいシグナル中心となり、それぞれ背側および腹側神経管を組織化する。
前述したように、同じリガンド/受容体システムが発生期に複数の機能のために順次使用される。BMPがその一例である:神経板段階では神経発生を防ぐが、神経胚形成後は、これらの因子は背側神経管/蓋板自体によって産生され、感覚ニューロンの運命を誘導する。
背側前脳構造には、内側の海馬、背外側の大脳皮質、腹外側の嗅内皮質が含まれ、一方、基底前脳では、淡蒼球が内側に、線条体が外側に位置する。マウス胚では、前脳は縦列と横断分節に配列された転写因子のチェッカーボード様パターンに分割され、各細分化内で独特の組み合わせを産生する(図1.4-3)。
Emx2、Pax6、FoxA2、Dlx2を含む多くの遺伝子は、神経胚形成前の神経板でさえ最初に発現し、その後維持され、脳室帯(VZ)の「プロトマップ」決定因子を構成する。初期前脳遺伝子発現は、以下を含むシグナル中心由来の可溶性因子の配列によって影響を受ける:(1)前神経稜(頭蓋間葉)からのFGF8とShh、(2)皮質縁や交連板を含む正中線構造からのBMPとWnt、(3)背側および腹側大脳皮質の外側接合部である抗縁からのFGF7、Wnt拮抗物質、ニューレグリンおよびレチノイン酸。Shhはまた腹側中脳領域からも由来する(図1.4-8)。これらの局在源の影響は脳サイズが増加するにつれて減少する。
示されたように、bHLHやホメオドメインタンパク質を含む地域パターニング遺伝子は、一つの因子がその隣接因子の発現を負に調節する相互調節活性を頻繁に示す(図1.4-3)。したがって、一つの因子の欠失は他の因子の境界の拡大につながる。例えば、頭側/外側皮質は高レベルのホメオドメイン遺伝子Pax6を発現するが、尾側/内側皮質はEmx2、Lhx2、Lhx5を示す。
予測では、遺伝子発現を変化させることは皮質領域の変化、特に運動皮質と感覚皮質の比率の変化を引き起こすはずである。実際、Pax6変異マウスでは運動皮質マーカーが著しく減少し、下流のbHLH転写因子Ngn2も同様である。逆に、尾側感覚皮質マーカーの比率的増加がある。さらに、背腹次元にも変化がある:腹側線条体と淡蒼球の遺伝子であるGshとDlxが、現在背側領域で異所的に発現している。
他の背側転写因子であるNgn1/2とGli3の欠失でも同様の背側シフトが起こり、大脳皮質の欠失をもたらす。腹側前脳内では、Nkx2.1タンパク質の変異により、推定淡蒼球が線条体様特性を獲得し、Nkx2.1が内側神経節隆起(MGE;淡蒼球)の運命を特定し、外側神経節隆起(LGE)表現型を阻害することを示唆している。これらの観察は、パターニング遺伝子がいくつかの次元において相互阻害機能を発揮することを示している。
予想されるように、パターニング遺伝子とシグナル分子経路の変異は、げっ歯類モデルでも観察されるヒト脳奇形につながる。PAX6欠失は眼の異常(白内障、無虹彩症、無眼球症)と嗅上皮および嗅球の異常をもたらす。さらに、大脳皮質は低形成であり、増殖帯に隣接して分化不良細胞の結節を示す。
蓋板シグナル伝達の破綻は全前脳胞症(HPE)を引き起こし、これは正中線を越えて連続する大脳皮質を持つ単一の前脳脳室によって特徴づけられる。HPEは、SIX3とZIC2を含むShh誘導カスケードのいくつかの成分の変異と関連している。これらの転写因子はどちらもShh遺伝子発現の上流にある。HPEはまた、Shh Patched(PTC)受容体遺伝子とTGF-βファミリーの下流成分であるTGIFの変異の結果でもある。
ShhとSIX3は前神経稜と腹側正中線で共発現するが、Zic2は背側蓋板で発現する。SIX3とSHHは裂脳症の一部の症例でも変異している。最後に、FOXG1(BF1)遺伝子変異は小頭症、脳梁形成不全、髄鞘化遅延を引き起こし、重篤な知的障害、運動遅延、ジスキネジア様運動、てんかんと関連している。
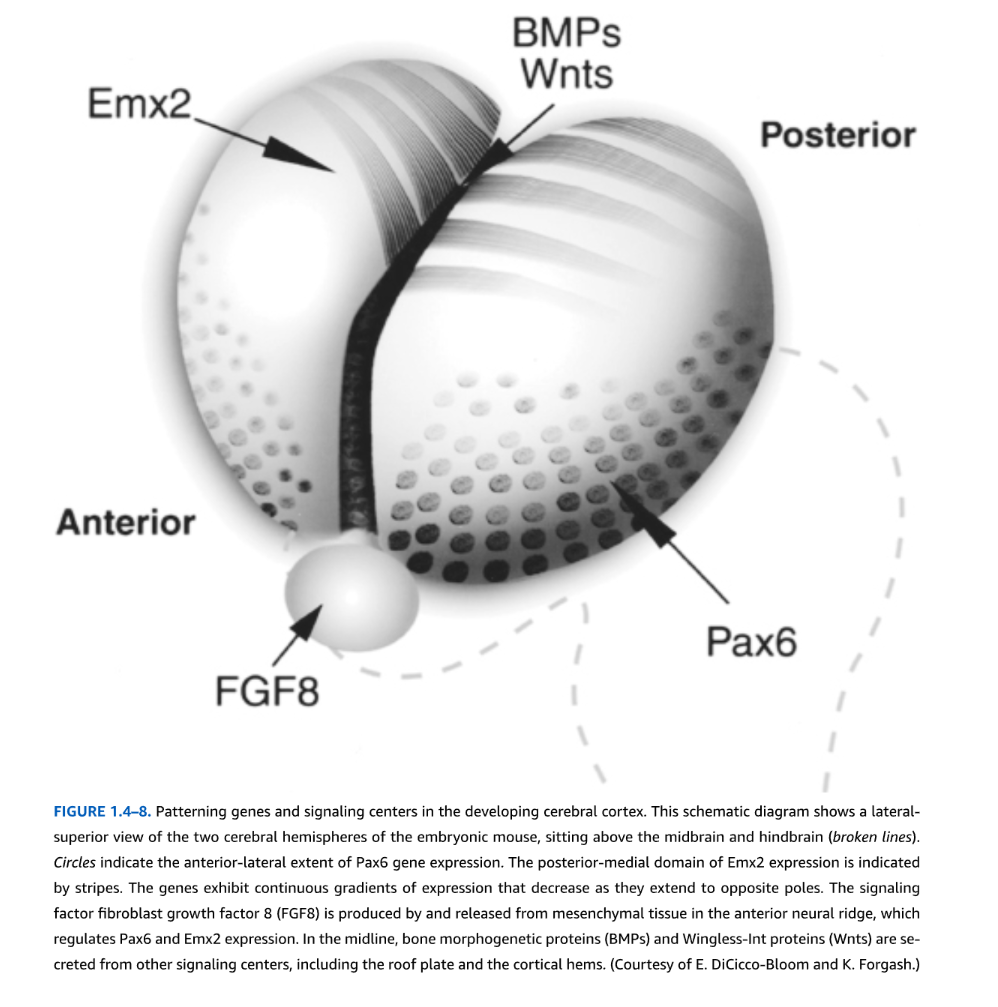
図1.4-8の説明
発生期大脳皮質におけるパターニング遺伝子とシグナル中心
この模式図は、中脳と後脳(破線)の上に位置する胚マウスの2つの大脳半球を外側上方から見た図を示している。円はPax6遺伝子発現の前側-外側範囲を示す。Emx2発現の後側-内側領域は縞模様で示されている。これらの遺伝子は、反対の極に向かって延びるにつれて減少する連続的な発現勾配を示す。シグナル因子である線維芽細胞増殖因子8(FGF8)は、前神経稜の間葉組織によって産生・放出され、Pax6とEmx2の発現を調節する。正中線では、骨形成タンパク質(BMP)とWingless-Intタンパク質(Wnt)が、蓋板や皮質縁を含む他のシグナル中心から分泌される。(E. DiCicco-BloomとK. Forgashの好意による)
領域特定化の調節における分子決定因子(「プロトマップ」)の重要な役割を考慮すると、侵入する視床求心線維は皮質発生に寄与するのだろうか?腹側前脳遺伝子Gbx2とMash1の2つの異なるマウス変異体では、視床皮質神経支配が破綻しているにもかかわらず、皮質パターニング遺伝子の発現は変化せず、これらが限定的な出生前役割を持つことを示唆している。しかし、出生後、視床軸索は局所的な地域的手がかりと相互作用し、皮質分子同一性に適合する適切な結合を確立するために伸長を修正する。さらに、発生期皮質は注目すべき柔軟性レベルを示す:フェレットにおいて、網膜神経節軸索が投射する視床外側膝状体を除去すると、これらの軸索は聴覚皮質に迂回し、その後聴覚皮質が視覚を成功裏に媒介する!
皮質発生期におけるニューロンの層特異的生成。「プロトマップ」パターニング遺伝子による皮質領域同一性の早期決定にもかかわらず、大脳皮質は組織学的解析によって古典的に記述され、現在は「層特異的」分子マーカーによって特徴づけられる共通の6層細胞構築を示す。ヒトを含む哺乳類と霊長類で高度に保存されているマーカーの多くは、神経前駆細胞が細胞周期を脱出する時期や、ニューロン特異的および層特異的細胞分化を開始する時期を決定する転写因子である。神経前駆細胞が分裂後運命にコミットした後、皮質投射ニューロンの多様性は、内在性遺伝的プログラムの活性化の正確なタイミングの重要性を示唆している。皮質層のグルタミン酸作動性投射ニューロンは特定の脳構造を標的とする。下層(V-VI)ニューロンは主に皮質下に投射し、軸索は視床、脳幹、脊髄でシナプスを確立する。上層(II-IV)ニューロンは皮質内に投射し、同側半球内または脳梁を介して対側半球に投射する。この期間中、上層ニューロンはCux1/2、Satb2、Brn1を発現し、一方下層ニューロンはCtip2、Foxp2、Tle4、Fezf2を示す(図1.4-9)。皮質領域決定因子と同様に、機能獲得および機能喪失アプローチを用いた遺伝学的研究は、それらの運命特定役割と相互調節作用を示している。例えば、上層ニューロンにおいて、Satb2が欠失すると、軸索は脳梁を介して対側皮質に伸長せず、代わりに下層ニューロンと同様に皮質下標的に投射する。実際、これらの上層ニューロンは下層因子Ctip2のレベルを上方調節する。逆に、下層ニューロンにおけるCtip2の減少は、それらの脊髄への正常な投射を妨げる。同様に、下層Fezf2転写因子のサイレンシングも皮質脊髄路軸索が標的に到達することを妨げ、一方上層ニューロンにおけるFezf2の異所性過剰発現は軸索を皮質下部位に誤って方向づけた。したがって、大脳皮質は発生期に相互作用および連続的な転写因子配列を示す。
海馬
遺伝学的実験により、皮質縁と海馬原基に局在するパターニング遺伝子が定義され、これらの欠失は様々な形態形成欠陥をもたらす。皮質縁で発現する増殖因子Wnt3aを欠くマウスでは、海馬は完全に欠失するかまたは大幅に縮小するが、隣接する大脳皮質は保持される。Wnt受容体活性化の下流の細胞内因子であるLef1遺伝子を欠失することで同様の表現型が生じ、Wnt3a-Lef1経路が海馬細胞特定化および/または増殖に必要であることを示唆している。別の皮質縁遺伝子であるLhx5(Lhx2も同様)が欠失すると、マウスは縁と隣接する脈絡叢の両方を欠き、両方とも増殖因子の源である。しかし、この場合、皮質縁細胞は過剰に増殖し、海馬は増殖、移動、分化の異常により構造が乱れる。最後に、bHLH転写因子の配列が出生後海馬神経新生で役割を果たす:歯状回分化はNeuroDとMash1変異体で欠陥を示す。重要なことに、すべての海馬パターニング遺伝子はFGF8、Shh、BMP、Wntを含む局所分泌因子によって調節される。
基底核と抑制性介在ニューロンの起源
腹側前脳領域をパターニングする遺伝子は上記で記述され、図1.4-3に示されている。しかし、運動および認知機能に加えて、基底核は接線移動を通じて新皮質に到達するGABA介在ニューロンの胚性起源であるため重要である(図1.4-6)。マウスにおける簡略化モデルとして、MGEは主にNkx2.1を発現し、皮質と海馬のGABA介在ニューロンを生じ、一方LGEはGsh2を発現し、SVZと嗅球のGABA介在ニューロンを生成する。Nkx2.1が欠失すると、LGE転写因子発現がMGEに腹側に拡散し、新皮質と線条体のGABA介在ニューロンが50パーセント減少する。対照的に、Gsh2の欠失は背側皮質分子マーカーの腹側拡大と嗅覚介在ニューロンの付随的減少につながる。最後に、Pax6変異はMGEとLGEの両方を外側および背側皮質領域に拡散させ、介在ニューロン移動の増加をもたらす。
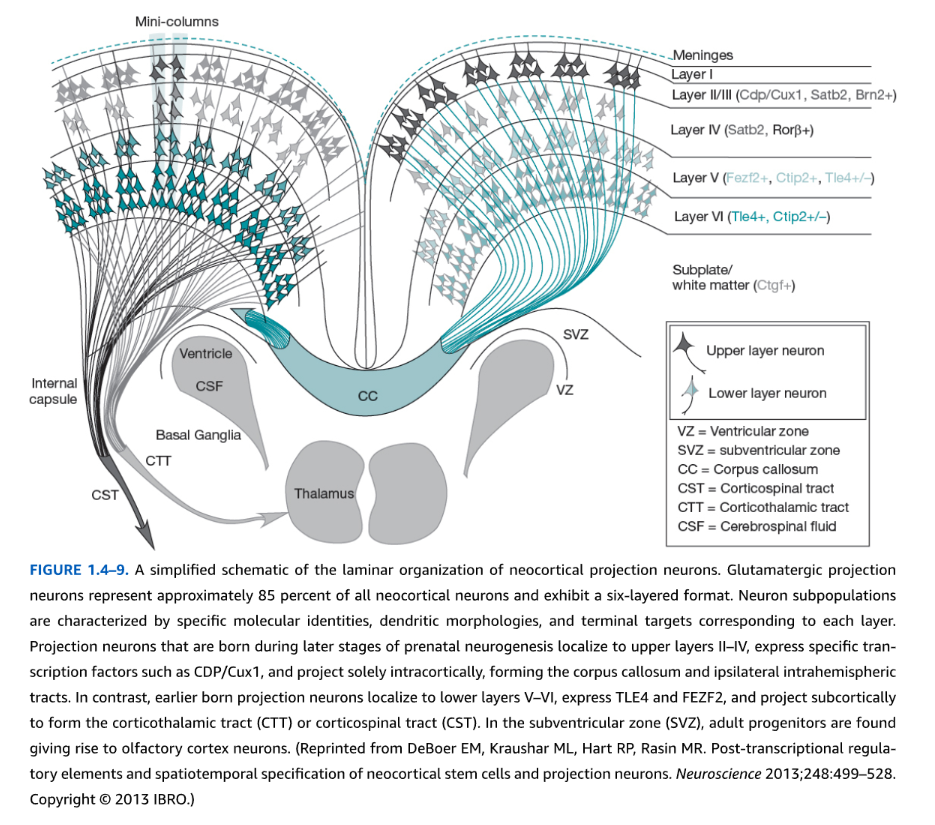
図1.4-9. 大脳新皮質投射ニューロンの層状組織の簡略図
グルタミン酸作動性投射ニューロンは全大脳新皮質ニューロンの約85パーセントを占め、6層構造を示している。ニューロンの亜集団は、各層に対応する特異的な分子同定、樹状突起形態、および終末標的によって特徴づけられる。
出生前神経形成の後期段階で生まれる投射ニューロンは上層(II-IV層)に局在し、CDP/Cux1などの特異的転写因子を発現し、脳梁や同側半球内路を形成して皮質内のみに投射する。対照的に、より早期に生まれる投射ニューロンは下層(V-VI層)に局在し、TLE4およびFEZF2を発現し、皮質視床路(CTT)や皮質脊髄路(CST)を形成して皮質下に投射する。脳室下帯(SVZ)では、成体前駆細胞が嗅覚皮質ニューロンを生み出している。
(DeBoer EM, Kraushar ML, Hart RP, Rasin MR. Post-transcriptional regulatory elements and spatiotemporal specification of neocortical stem cells and projection neurons. Neuroscience 2013;248:499-528. Copyright c 2013 IBRO.より転載)
介在ニューロンの調節
内側神経節隆起(MGE)および外側神経節隆起(LGE)(図1.4-3)の他の転写因子は、生成される介在ニューロンのタイミングと種類の両方を調節する。Mash1は早期に生まれる細胞で発現するが、Dlx1/Dlx2はより後期に成熟するニューロンに現れ、他のファミリーメンバーであるDlx5/Dlx6を標的とする。Dlx1/Dlx2二重ノックアウトでは、大脳新皮質介在ニューロンが75パーセント減少し、海馬では完全に欠如するが、嗅覚ニューロンは保たれる。
Mash1がDlx発現を調節し、Dlx2がGABA合成酵素であるグルタミン酸脱炭酸酵素の発現を誘導できることから、調節カスケードが示唆されている。実際、Mash1欠失変異体は皮質GABA介在ニューロンと線条体コリン作動性介在ニューロンの減少を示す。同様に、Nkx2.1の欠失は、NPY、ソマトスタチン、NOSを発現する全ての皮質介在ニューロンの完全な欠如につながる。これらの研究は、転写因子が一般的な神経運命の特定化および神経サブタイプの決定を含む、神経産生の複数段階で役割を果たすことを示唆している。
神経細胞の特異化
転写因子は神経細胞型(ニューロンまたはグリア細胞)の決定、およびニューロンサブタイプの決定を調節する。例えば、Mash1はグリア運命よりもニューロン運命を促進し、GABA介在ニューロン表現型を誘導することができる。Neurogenin2(Ngn2)はグルタミン酸作動性興奮ニューロン運命を促進できる。しかし、別のbHLH因子であるOlig1/2は、前脳でオリゴデンドロサイト發達を促進する一方で、脊髄では運動ニューロン分化を促進し、特定の細胞で発現する因子の種類が組み合わせ効果と細胞分化の多様な結果をもたらすことを示している。
細胞外因子による神経発達の調節
細胞増殖、遊走、分化、生存を調節する細胞外因子は、内因性遺伝的決定因子と相互作用して領域特異的神経形成を制御する。この節では前駆細胞増殖を一例として焦点を当てる。パターニング遺伝子は成長因子受容体と細胞分裂サイクルの分子機構の発現を制御する。成長因子は脳室帯前駆細胞の増殖を刺激または抑制し、自己分泌、傍分泌、内分泌と呼ばれ、それぞれ細胞自身、近隣細胞/組織、全身循環に由来することを意味する。
当初細胞培養で定義されたが、分裂促進成長因子は現在in vivoでよく特徴づけられている。bFGF、Wnt、IGF-I、Shhなど増殖を刺激するものと、白血球抑制因子(LIF)、下垂体アデニル酸シクラーゼ活性化ポリペプチド(PACAP)、GABA、グルタミン酸、インターフェロンガンマ、グリア由来神経栄養因子など細胞分裂を抑制するシグナルがある。Yuswaら(2016)による胚性皮質前駆細胞とニューロンの統合的トランスクリプトーム・プロテオーム解析では、神経形成分化を促進しながら細胞周期退出を誘発する成長因子が新たに同定された。分裂促進因子として作用することに加えて、細胞外シグナルは栄養因子としても作用し、分裂集団の生存を促進することで増殖を促進する。最大細胞数を産生するには両経路の刺激が必要である。神経栄養因子の数種、特にBDNFと神経栄養因子3(NT3)は、分裂前駆細胞と新たに生成された子孫細胞の生存を促進する。
発達期における分裂促進因子とその受容体の発現と活性の変化は、深刻で永続的な結果を引き起こし得る。例えば、発達中の齧歯類胚や仔への成長因子投与は、出生前皮質脳室帯、出生後小脳外顆粒層、海馬歯状回の増殖変化を誘導し、脳領域サイズ、細胞構成、機能の生涯にわたる変化を産生する。環境因子(低酸素、母体/胎児感染、薬物や毒性物質曝露)も分裂促進経路を調節異常させ、重大な欠陥を産生し得る。ヒトでは、早産での肺成熟促進のための以前のステロイド治療は、小脳顆粒神経形成と認知への負の効果が明らかになったときに中止された。同様に、化学療法と放射線を含む癌治療レジメンは、周産期神経形成を抑制することが長く知られている。
領域神経形成の変化は、神経精神疾患で観察される構造的差異と関連があるかもしれない。FGFリガンドと受容体システム発現の異常は、大うつ病性障害(MDD)患者の脳サンプルとストレスとうつ病行動の多くの動物モデルで一貫して発見されている。最後に、動物における小脳顆粒神経形成を調節する分裂促進因子にはbFGF、Shh、PACAPが含まれ、SHHとWNTの両方の遺伝的変異は小児の髄芽腫の重症度と予後を決定する。
多数の炎症性サイトカインと関連する重篤な全身疾患を経験する小児では神経学的発達が遅延することがよく知られており、これが神経形成と付随するプロセスへの干渉を反映し、認知・運動発達の長期的差異を潜在的に産生するかどうか疑問に思うかもしれない。同様に、妊娠中の母体感染は統合失調症と自閉症の既知の危険因子であり、胎盤関門を通過するサイトカインは、動物モデルで示されるように胎児脳細胞増殖と分化、細胞遊走、軸索標的選択、シナプス成熟に直接影響し、最終的に成体子孫の多発性脳・行動異常につながる可能性がある。
細胞遊走
未成熟ニューロンの増殖領域から脳内の最終位置への移動は、神経発達の必須プロセスである。細胞遊走の方向と指向性は、放射状(皮質)、接線方向(MGE/LGEからの抑制性GABA介在ニューロン)、または遊走流を通じて(嗅球の顆粒介在ニューロン)として記述できる。遊走タイプに関係なく、これらの運動細胞の方向、速度、細胞行動に影響する誘導手がかりがある。これらの手がかりは大まかに、細胞外因子、接着分子、細胞骨格調節分子に分類される。
これらの誘導手がかりに関する知識の多くは動物モデルに由来する。例えば、最もよく特徴づけられた例は、皮質前板の最初期ニューロンであるCajal-Retzius細胞により胚期に産生される大きな分泌糖タンパク質であるリーリンという細胞外因子のレベルが不十分なマウスである。マウス皮質は調節異常のニューロン遊走を示し、外側から内側への様式で生成された逆転皮質層状構造をもたらす。さらに、門と分子層への異常遊走に起因する異所性海馬神経形成がある。リーリンは2つの受容体、超低密度リポタンパク質受容体(VLDLR)とアポタンパク質E受容体2(ApoER2)、および細胞内アダプタータンパク質であるdisabled 1(Dab1)と結合し活性化する。VLDLとApoE2受容体の役割は、アルツハイマー病の遺伝的リスクへのよく知られた寄与を考慮すると興味深い。興味深いことに、死後脳タンパク質レベルは統合失調症と自閉症で異常と報告されているが、最近のゲノム研究では疾患リスクにおけるリーリン遺伝子変異のゲノムワイド有意性は明らかでない。
ニューロン遊走に重要な別の細胞外因子は、ポリペプチドホルモンであるインスリン様成長因子1(IGF-1)である。ノックアウトマウスモデルでは、多極状態での前駆細胞の停止が明らかになり、上位皮質層へのニューロン遊走の失敗をもたらす。
ニューロン遊走に参加する接着分子は、細胞-マトリックスと細胞-細胞相互作用分子に分けることができる。インテグリンなどの細胞-マトリックス接着分子は、細胞表面と細胞外マトリックスの異なるリガンドとの結合を媒介することに参加する。細胞-細胞接着分子については、Ca2+依存性細胞-細胞接着を媒介するカドヘリンがある。特にN-カドヘリンは神経管形成中にオンになり、その欠如は皮質全体で放射グリアと中間前駆細胞の無秩序をもたらす。Ca2+非依存性細胞-細胞接着分子には、免疫グロブリン様細胞接着タンパク質であるネクチンとネクチン様分子が含まれる。これらの分子は海馬、小脳、大脳新皮質で発現し、Cajal-Retzius細胞の放射遊走を指示するリーリンシグナル伝達経路の構成要素として同定されている。
上記の分子の多くは、神経突起伸長と遊走に重要な細胞骨格を調節する。ニューロン細胞骨格はアクチン、中間フィラメント、微小管(MT)で構成される。アクチンフィラメントは細胞遊走で重要な役割を果たし、成長円錐探索に特に重要である(次節で論議)。アクチンフィラメントの動的性質は、Rac1、RhoA、Rnd2、cdc42を含むRho GTPaseにより調節される。Rnd2はRhoAを抑制して放射遊走と神経突起伸長を促進するが、Rac1とcdc42は軸索誘導と極性により多くの役割を果たす。MTは動的で極性を持つ細胞内フィラメントであり、ニューロンで高度に豊富で、遊走を助けるため核を前方に推進するのに必要なエネルギーを生成する。マウスとヒトのMTサブユニットTuba1a/TUBA1Aの両方でのミスセンス変異は、増殖領域でのニューロンの蓄積をもたらし、これらは移出に失敗し、いくつかの神経精神疾患と関連している。
さらに、MTは微小管関連タンパク質(MAP)により調節され、細胞遊走と伸長の正常進行を保証する主要な役割を果たす。細胞外因子、接着分子、細胞骨格調節因子の破綻は皮質発達の奇形につながり得る。例えば、滑脳症患者はしばしば脳溝と脳回を欠く脳を持ち、ニューロン遊走の欠陥に由来する。この疾患は4つの異なる遺伝子(DCX、RELN、LIS1、ARX)の単一変異と部分染色体欠失(Chr 17p-Miller-Dieker症候群)により引き起こされ得る。よく特徴づけられたMAPであるダブルコルチン(DCX)の変異は、男性でX連鎖滑脳症と女性で白質の異所性ニューロンバンドをもたらし、画像研究で「二重皮質」として現れ、重篤な精神遅滞とてんかんを産生する。ヒト誘導多能性幹細胞モデルを利用した研究では、LIS1の喪失はMT安定性とその運動タンパク質であるダイニンを調節異常させることによりニューロン遊走の変化をもたらすことが明らかになった。DCXとLIS1の変異は滑脳症症例の約75パーセントを占めると示唆され、TUBA1Aは症例の約4パーセントを占める。
分化と神経突起伸長
新たに産生されたニューロンとグリア細胞が最終目的地に到達すると、成熟状態への分化が始まり、妊娠5か月頃にピークに達する。ニューロンでは、これは樹状突起の伸長と軸索突起の伸展、シナプスの形成、受容体と選択的神経伝達物質再取り込み部位を含む神経伝達物質システムの産生を含む。この伸長は極性の破綻から始まり、未成熟神経突起の遠位先端が突出し始めて誘導手がかりに応答する。この構造は成長円錐として知られ、Santiago Ramón y Cajalにより発見され命名された。
円錐の構造は2つの領域に細分される:ミトコンドリアとMTを含む中央領域と、ベール様の葉状仮足と棘様の糸状仮足を含み主にアクチンで構成される周辺領域である(図1.4-10)。成長円錐突出と運動性は主にアクチンフィラメントの周期的重合と脱重合により駆動される。より多くの重合またはミオシン活性があるとき、成長円錐は伸展するが、脱重合と逆行運動は成長円錐の退縮をもたらす。急速な成長円錐運動に関与するアクチン調節タンパク質(Arp2/3、プロフィリン、コフィリン)と関連キナーゼ(LIM、SRC)の異常は、変異がWilliams症候群を引き起こすLIMKキナーゼなど、言語と認知障害に寄与する可能性がある。生後最初の数年間、多くのニューロンシステムは過剰な突起成長と分岐を示し、これは後に経験に依存した軸索とシナプスの選択的「剪定」により減少し、髄鞘形成は出生後数年間と成人期まで継続する。
成長円錐運動の多くは、ネトリン、スリット、セマフォリンなどの分泌細胞外マトリックスタンパク質と、エフリン、カドヘリン、ネクチンなどの細胞-細胞接着分子を含む様々な誘引性および反発性細胞外誘導手がかりにより影響される。例えば、カドヘリンなどの誘導分子の領域特異的発現は、パターニング遺伝子Pax6とEmx2により調節される。これらの手がかりは糸状仮足受容体と相互作用して成長円錐を前進、回転、または退縮させる。ネトリンタンパク質は二機能性手がかりとして機能し、受容体に応じて誘引性と反発性シグナルを誘導できる。特にネトリン-1はGABA作動性介在ニューロンの遊走に関与し、ネトリン-4は皮質ニューロンの成熟に影響する。スリット分子はRobo受容体との結合を介して作用し、主に反発性軸索誘導手がかりとして作用し、交連軸索が正中線を一度だけ通過することを可能にし、適切な投射を保証する。スリットと同様に、セマフォリンも発達中の交連軸索の反発性手がかりとして機能する。それらの発現が変化すると、経路探索の失敗から異常軸索投射が起こる。
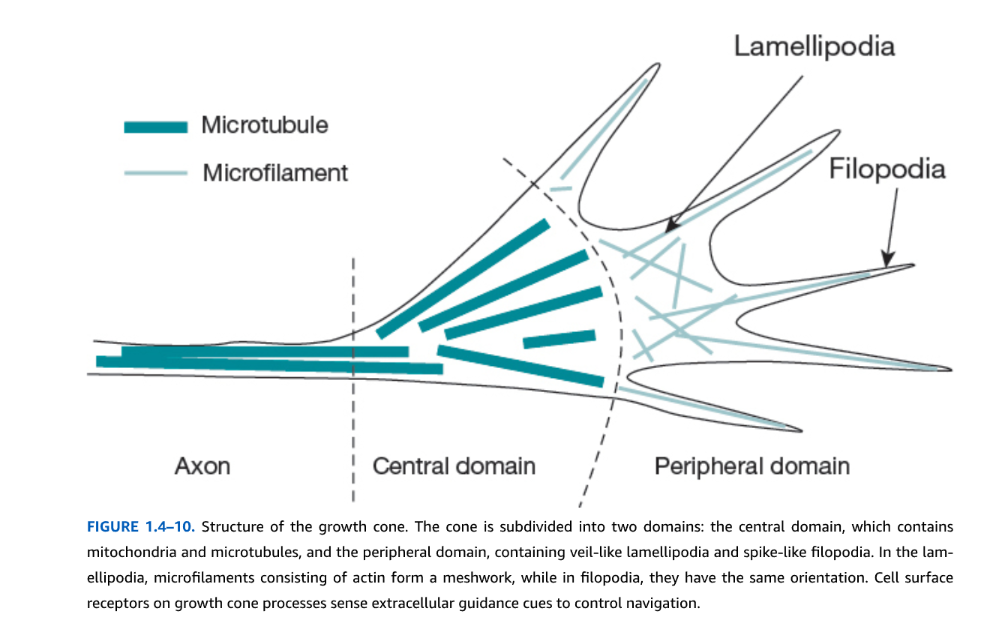
図1.4-10. 成長円錐の構造。円錐は2つの領域に細分される:ミトコンドリアと微小管を含む中央領域と、ベール様の葉状仮足と棘様の糸状仮足を含む周辺領域である。葉状仮足では、アクチンからなる微小フィラメントが網状構造を形成し、糸状仮足では同じ方向性を持つ。成長円錐突起上の細胞表面受容体は細胞外誘導手がかりを感知して誘導を制御する。
エフリンはしばしば化学反発手がかりとして機能し、発達中の軸索が間違った標的領域に進入することを防ぐことにより成長を負に調節する。例えば、視蓋(上丘)は後方から前方への減少勾配でエフリンA2とA5を発現するが、神経支配する網膜神経節細胞はEph受容体の勾配を発現する。高いEph A3受容体レベルを持つ後方網膜からの神経節細胞軸索は、低レベルのエフリン発現が退縮を引き起こすEphキナーゼを活性化しないため、前方視蓋を選択的に神経支配する。軸索誘導と標的認識の調節におけるカドヘリンとネクチンの役割は、脊髄や運動・感覚神経を含む大脳新皮質外の構造でより深く特徴づけられている。しかし、最近の研究では、視床と皮質の共培養でN-カドヘリンの欠如が視床皮質軸索の神経支配パターンの変化をもたらすことが実証され、軸索経路探索の誘導におけるカドヘリンの役割が確認された。
哺乳類における出生後神経形成:脳室下帯と海馬歯状回
成体神経形成は脳内の神経前駆細胞からの新しいニューロンの生成である。このプロセスは2つの領域に限定される:側脳室を覆う脳室下帯(SVZ)と、海馬の歯状回顆粒細胞層下にある顆粒下帯(SGZ)と呼ばれる狭い増殖帯である(図1.4-11)。これは様々な生理学的、病理学的、環境的、薬理学的刺激により変化し得る高度に可塑的なプロセスである。マウス、齧歯類、サルでは、新たに産生されたニューロンはSVZから前方向に嗅球に向かって遊走してGABA(とドパミン)含有介在ニューロンになり、特定の条件下では線条体にも移動する。
齧歯類での研究では、成体神経形成が前駆細胞増殖および/または細胞生存を制御する細胞外シグナル(EGF、bFGF、IGF-I、BDNF、LIF/CNTFなど)により調節されることが実証されている。例えば、bFGFとIGF-Iの両方の末梢投与は神経形成を刺激し、それぞれSVZと海馬SGZで分裂標識を選択的に増加させる。より古典的な研究は脳室内注射による成長因子の適用により行われ、直接的細胞作用を実証した。興味深いことに、妊娠モデルではプロラクチンとオキシトシンホルモンの両方が母体神経形成を促進し、これが子の同定学習に寄与することが示されている。これらの研究は通常、生きた動物に注射後免疫組織化学により検出できるチミジン類似体BrdUとEdUを利用する。増殖細胞を標識するため、Ki-67と増殖細胞核抗原(PCNA)を含む内因性細胞マーカーの使用も可能である。
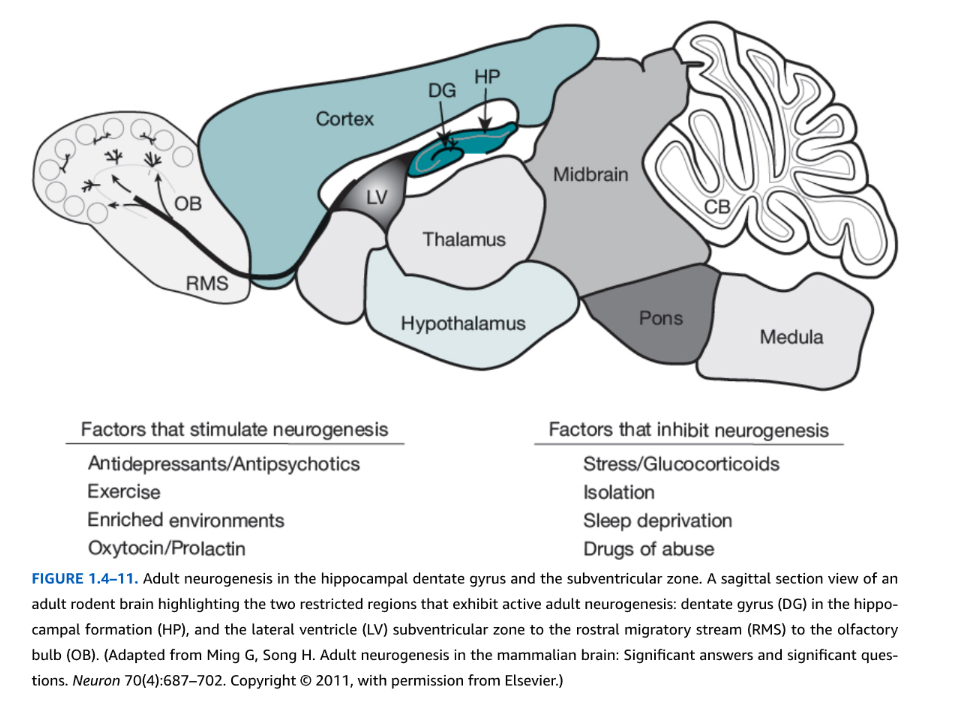
図1.4-11. 海馬歯状回と脳室下帯における成体神経新生
成体ラットの脳の矢状断面図で、活発な成体神経新生が見られる2つの限られた領域を強調しています。それは、海馬(HP)内の**歯状回(DG)**と、**脳室下帯(LV)から吻側移動流(RMS)を経て嗅球(OB)**に至る経路です。
(Ming G, Song H. Adult neurogenesis in the mammalian brain: Significant answers and significant questions. Neuron 70(4):687-702. Copyright @ 2011, Elsevierの許可を得て改変)
これまで述べたように、ダブルコルチン(DCX)は神経前駆細胞や未熟な神経細胞によって発現されるMAPです。このマーカーは特に、死後脳組織におけるヒト成人海馬神経新生(AHN)の可能性を特徴づけるために広く用いられてきました。方法論とリソースの改善により、研究者はこの複雑な問題を解明できるようになり、ここ数年間で議論が続いています。いくつかの研究室は、健康なヒトの海馬の歯状回(DG)において、90歳代に至るまで、様々な成熟段階にある数千の未熟な神経細胞(DCX+細胞)を発見したと結論づけています。これらの研究は最先端の技術と健康なヒトの脳組織を使用していますが、ヒトDGにおけるAHNマーカーの検出は、脳組織が固定液に長時間浸漬されている場合に減少すると報告しており、これは世界中のブレインバンクで通常見られる状況です。
この仮説を否定する研究は、類似の技術を用いており、幼若神経細胞の密度が13歳までに減少し、成人期(18歳以上)には検出できないレベルになると報告しています。しかし、分析された脳組織サンプルにはてんかん患者のものが含まれており、てんかんは神経新生ニッチの破壊をしばしば引き起こすため、報告されたAHNの欠如に寄与している可能性があります。AHNの可能性を適切に支持または反証するためには、サンプルの履歴(神経精神疾患、組織固定液と時間)を考慮し、厳密な方法(偏りのない立体鏡法、バイオインフォマティクス、ヒトにおける非侵襲的生体内研究)を含む追加の研究が必要です。
成人神経新生の発見は、新しい神経細胞が成熟脳の複雑な細胞構築に統合できるのか、またその機能的意義は何かという疑問を自然と生じさせます。広範な分析により、新たに生まれた神経細胞は実際に海馬回路に統合され、典型的なシナプス結合を確立することが示されています。機能的な観点から見ると、新しい神経細胞の生成および/または生存は、行動学習と経験の複数の例と強く相関しています。例えば、新たに生成された神経細胞の生存は、海馬依存的な学習課題や豊かで行動的に複雑な環境によって著しく促進されます。おそらくさらに重要なのは、DG神経新生の減少が痕跡記憶(動物が時間的に離れた刺激を関連付けなければならない、海馬依存的な課題)の形成を損なうことです。
臨床的および治療的な観点から、科学者たちは神経新生の変化が疾患に寄与したり、脳が損傷から回復するのを助けたりすることを観察しています。脳外傷、脳卒中、てんかんを含む成人における複数の病理学的状態に対して、神経新生反応が示されています。例えば、線条体における虚血性脳卒中は、隣接するSVZ神経新生を刺激し(図1.4-11)、神経細胞が損傷部位に移動します。これらの研究は、新しく生成された神経細胞が通常回復に参加し、新しい治療戦略として刺激される可能性があることを示唆しています。しかし、神経新生は病原性においても役割を果たす可能性があります。てんかんのカイリングマウスモデルでは、新しく生成された神経細胞が誤った位置に移動し、異常な神経回路を形成し、てんかんの状態を強化しました。てんかんにおけるDGの外科的切除によるヒトサンプルでも同様の異常が明らかになっています。
逆に、神経新生の減少は、海馬の機能不全または変性を伴ういくつかの状態に寄与する可能性があります。DG神経新生は、高齢ラットで観察されるグルココルチコイドレベルの上昇によって阻害され、ステロイド拮抗薬や副腎摘出術によって逆転します。これらの観察は、ヒトのコルチゾールレベルの上昇と海馬容積の減少、および記憶障害の存在との相関関係に潜在的に関連しています。同様に、ストレス誘発性のヒトグルココルチコイドの増加は、統合失調症、うつ病、および心的外傷後ストレス障害(PTSD)で見られる海馬容積の減少に寄与する可能性があります。いくつかの研究では、抗うつ薬、抗精神病薬、および/または身体運動が神経新生の減少表現型を逆転させることが示されています。例えば、選択的セロトニン再取り込み阻害薬(SSRI)であるフルオキセチンのマウスへの投与は、神経前駆細胞の増加につながり、最終的に海馬に新しい神経細胞となりました。ヒトにおける抗うつ薬治療の成功反応は、構造MRI分析における海馬容積の増加と関連していますが、臨床試験におけるヒトのAHNの因果関係を支持する証拠が必要となるでしょう。
FURTHER READINGS
Alcamo EA, Chirivella L, Dautzenberg M, et al. Satb2 regulates callosal projection neuron identity in the developing cerebral cortex.
Neuron. 2008;57(3):364-377.
Alvarez-Buylla A, Seri B, Doetsch F. Identification of neural stem cells in the adult vertebrate brain. Brain Res Bull. 2002;57:751-758.
Bishop KM, Goudreau G, O’Leary DD. Regulation of area identity in the mammalian neocortex by Emx2 and Pax6. Science. 2000;288:344-349.
Britanova O, de Juan Romero C, Cheung A, et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex.
Neuron. 2008;57(3):378-392.
Cheng Y, Black IB, DiCicco-Bloom E. Hippocampal granule neuron production and population size are regulated by levels of bFGF. Eur J
Neurosci. 2002;15:3-12.
de Agustín-Durán D, Mateos-White I, Fabra-Beser J, Gil-Sanz C. Stick around: cell-cell adhesion molecules during neocortical develop-
ment. Cells. 2021;10(1):118.
DeBoer EM, Kraushar ML, Hart RP, Rasin MR. Post-transcriptional regulatory elements and spatiotemporal specification of neocortical
stem cells and projection neurons. Neuroscience. 2013;248:499-528.
DiCicco-Bloom E, Lord C, Zwaigenbaum L, et al. The developmental neurobiology of autism spectrum disorder. J Neurosci. 2006;26:6897-6906
Falluel-Morel A, Sokolowski K, Sisti HM, et al. Developmental mercury exposure elicits acute hippocampal cell death, reductions in neuro-
genesis, and severe learning deficits during puberty. J Neurochem. 2007;103:1968-1981.
Fiddes IT, Lodewijk GA, Mooring M, et al. Human-specific NOTCH2NL genes affect notch signaling and cortical neurogenesis. Cell.
2018;173(6):1356-1369.e22.
Garcia-Moreno F, Molnar Z. Variations of telencephalic development that paved the way for neocortical evolution. Prog Neurobiol.2020;194:101865.
Guillemot F. Cell fate specification in the mammalian telencephalon. Prog Neurobiol. 2007;83:37-52.
Hansen DV, Lui JH, Parker PR, Kriegstein AR. Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature.2010;464:554-561.
Hevner RF. Layer-specific markers as probes for neuron type identity in human neocortex and malformations of cortical development.J
Neuropathol Exp Neurol. 2007;66:101-109.
Jin SC, Lewis SA, Bakhtiari S, et al. Mutations disrupting neuritogenesis genes confer risk for cerebral palsy. Nat Genet. 2020;52(10):1046-1056.
Kempermann G, Song H, Gage FH. Neurogenesis in the adult hippocampus. Cold Spring Harb Perspect Biol. 2015;7(9):a018812.
Mairet-Coello G, Tury A, DiCicco-Bloom E. Insulin-like growth factor-1 promotes G(1)/S cell cycle progression through bidirectional
regulation of cyclins and cyclin-dependent kinase inhibitors via the phosphatidylinositol 3-kinase/Akt pathway in developing rat
cerebral cortex. J Neurosci. 2009;29(3):775-788.
Molnar Z, Luhmann HJ, Kanold PO. Transient cortical circuits match spontaneous and sensory-driven activity during development. Sci-
ence. 2020;370(6514):eabb2153.
Moreno-Jiménez EP, Terreros-Roncal J, Flor-García M, Rábano A, Llorens-Martín M. Evidences for adult hippocampal neurogenesis in
humans. J Neurosci. 2021;41(12):2541-2553.
Nicot A, Lelièvre V, Tam J, Waschek JA, DiCicco-Bloom E. Pituitary adenylate cyclase-activating polypeptide and sonic hedgehog interact
to control cerebellar granule precursor cell proliferation. J Neurosci. 2002;22:9244-9254.
Noctor SC, Flint AC, Weissman TA, Dammerman RS, Kriegstein AR. Neurons derived from radial glial cells establish radial units in neo-
cortex. Nature. 2001;409:714-720.
O’Leary DDM, Borngasser D. Cortical ventricular zone progenitors and their progeny maintain spatial relationships and radial patterning
during preplate development indicating an early protomap. Cereb Cortex. 2006;16(Suppl 1):i46-i56.
Prem S, Millonig JH, DiCicco-Bloom E. Dysregulation of neurite outgrowth and cell migration in autism and other neurodevelopmental
disorders. Adv Neurobiol. 2020;25:109-153.
Rakic P. Decision by division: making cortical maps. Trends Neurosci. 2009;32(5):291-301.
Rakic P. Evolution of the neocortex: a perspective from developmental biology. Nat Rev Neurosci. 2009;10(10):724-735.
Rossman IT, Lin L, Morgan KM, et al. Engrailed2 modulates cerebellar granule neuron precursor proliferation, differentiation and insulin-
like growth factor 1 signaling during postnatal development. Mol Autism. 2014;5(1):9.
Schuursmans C, Guillemot F. Molecular mechanisms underlying cell fate specification in the developing telencephalon. Curr Opin Neuro-
biol. 2002;12:26-34.
Shors TJ, Miesegaes G, Beylin A, Zhao M, Rydel T, Gould E. Neurogenesis in the adult is involved in the formation of trace memories.
Nature. 2001;410:372-376.
Sorrells SF, Paredes MF, Zhang Z, et al. Positive controls in adults and children support that very few, if any, new neurons are born in the
adult human hippocampus. J Neurosci. 2021;41(12):2554-2565.
Yuzwa SA, Yang G, Borrett MJ, et al. Proneurogenic ligands defined by modeling developing cortex growth factor communication net-
works. Neuron. 2016;91(5):988-1004.

