1.5 神経シグナル伝達の細胞・シナプス基盤
チャールズ・F・ゾラムスキー医師、スティーブン・メンネリック博士
神経精神疾患は、細胞間コミュニケーションや神経回路の機能不全を伴います。これらの欠陥はしばしばニューロン間のシナプス結合の機能不全を反映していますが、ニューロンの固有の興奮性の変化も寄与しています。そのため、ニューロンの興奮性を標的とする薬理学的および神経調節療法が、神経学的および精神疾患の治療において一般的になりつつあります。さらに、精神療法が神経コミュニケーションの特定の側面を変化させて効果をもたらすという認識が高まっています。
ニューロンは電気信号を用いて情報を送受信します。これらの電気信号は脳の局所的およびネットワーク特性を制御し、巨大分子であるイオンチャネルを介した細胞膜を横断するイオンの流れを伴います。ニューロンは、ゲート型と非ゲート型の2つの主要なイオンチャネルを発現します。非ゲート型(または漏れ)チャネルは静止時に開いており、細胞の静止膜電位に寄与します。ほとんどのイオンチャネルの開閉は、膜電位の変化、細胞外化学物質、または細胞内メッセンジャーによって調節(ゲート)されています。電位依存性ナトリウムチャネルは素早く開閉し、ニューロン内およびニューロン間のコミュニケーションの基礎を提供します。ナトリウムチャネルを介した迅速なシグナル伝達は、「全か無か」の活動電位をもたらし、これはニューロンの細胞体近くで生成され、軸索に沿って神経終末まで振幅の減少がほとんどなく伝達されます。この高忠実度な信号伝播は、軸索の長さに沿って電位依存性チャネルによって再生成される活動電位を反映しています。有髄軸索では、活動電位の伝播は跳躍伝導によって促進され、これは電気信号がランヴィエの絞輪間を「跳躍」する能力です。
神経(シナプス)終末では、活動電位を介した脱分極の波が電位依存性カルシウムチャネルを開き、カルシウムの流入が化学神経伝達物質を細胞外空間に放出させ、そこで神経伝達物質は受容細胞に影響を与えます。神経伝達物質は2つの広範な種類の受容体に結合し、イオンチャネルへの作用を介して神経興奮性を変化させます。リガンド依存性イオンチャネルは神経伝達物質結合によって直接開きますが、**Gタンパク質共役受容体(GPCR)**はグアニンヌクレオチド結合タンパク質(Gタンパク質)または細胞内化学メッセンジャーを介してイオンチャネルに間接的に影響を与えます。本章では、細胞電気生理学の基本原理を概説し、脳機能と神経精神疾患における電気信号の重要性について議論します。
細胞電気生理学の原理
静止膜電位
カリウムイオン[K+]の濃度は細胞外よりも細胞内の方がはるかに高く、これは静止時のほとんどの細胞膜がK+に対して選択的な透過性を持っていることを反映しています。細胞膜における非ゲート型(リーク)K+チャネルの発現が、この選択的透過性の基礎となっています。カリウムチャネルは、親水性の孔を持つ膜貫通タンパク質のクラスであり、リークチャネルの開いた孔を介してK+を膜を横切って選択的に伝導します。基礎条件下では、K+イオンは、細胞内に存在する大型の不透過性の細胞内アニオン(酸とタンパク質)によって細胞内に引き寄せられます。細胞内にK+が蓄積すると、細胞の膜電位(電荷分離)は脱分極(負の電位が減少)し、静電的反発(同種電荷は反発する)のためにK+の流入が減少します。細胞内K+濃度は約100mMに達し、細胞外[K+]は2〜6mMの間です。この不均一な分布が化学的勾配を確立し、それ自体が細胞からの正味のK+流出をもたらします。したがって、K+には2つの勾配が作用します:K+流入を促進する細胞内陰性電位と、K+流出を駆動する化学的勾配です。特定の膜電位(約−90 mV)では、K+に対する電気的勾配と化学的勾配は等しく逆方向になります。この膜電位はK+の平衡電位(ネルンスト電位とも呼ばれる)として知られています。イオン種の平衡電位とは、電気的勾配と化学的勾配が平衡しており、イオンの正味の移動がない膜電位のことです。膜が排他的にK+に透過性である細胞では、細胞の静止電位はK+の平衡電位と等しくなります。
ほとんどのニューロンにおける状況はより複雑です。なぜなら、異なる電気化学的勾配を持つ他のイオンが、静止細胞膜で開いているイオンチャネルをわずかに透過するからです。これらの各イオンは、細胞内外のイオン濃度に応じて、独自の特性的な平衡(ネルンスト)電位を持っています。陽イオンNa+とCa2+は、細胞内よりも細胞外で高濃度に存在します。したがって、負の膜電位では、これらの陽イオンに対する電気的勾配と化学的勾配の両方が内向きであり、平衡電位は0 mVよりも正です。塩化物イオン(Cl−)濃度は通常、細胞外の方が高いですが、このイオンの負の電荷のために、塩化物イオンの平衡電位は静止電位に近いです(図1.5-1)。細胞の実際の静止電位は、すべての透過性イオンの平衡電位を、各イオンの相対的な透過性で重み付けした平均によって決定されます。静止時では、K+とCl−は他のイオンよりもはるかに透過性が高いため、静止電位はこれらのイオンの平衡電位に最も近くなります。Na+とCa2+は透過性が低く、静止電位への寄与は少ないですが、これらの陽イオンに対する非ゲート型チャネルのわずかな透過性により、実際の静止電位はK+またはCl−の平衡電位よりも正になります。ニューロンの静止電位の典型的な値は−55 mVから−70 mVの間です。対照的に、アストロサイトはより純粋にK+に透過性の膜を持つため、より深く負の静止膜電位(約−90 mV)を持ち、K+平衡電位に非常に近いです。
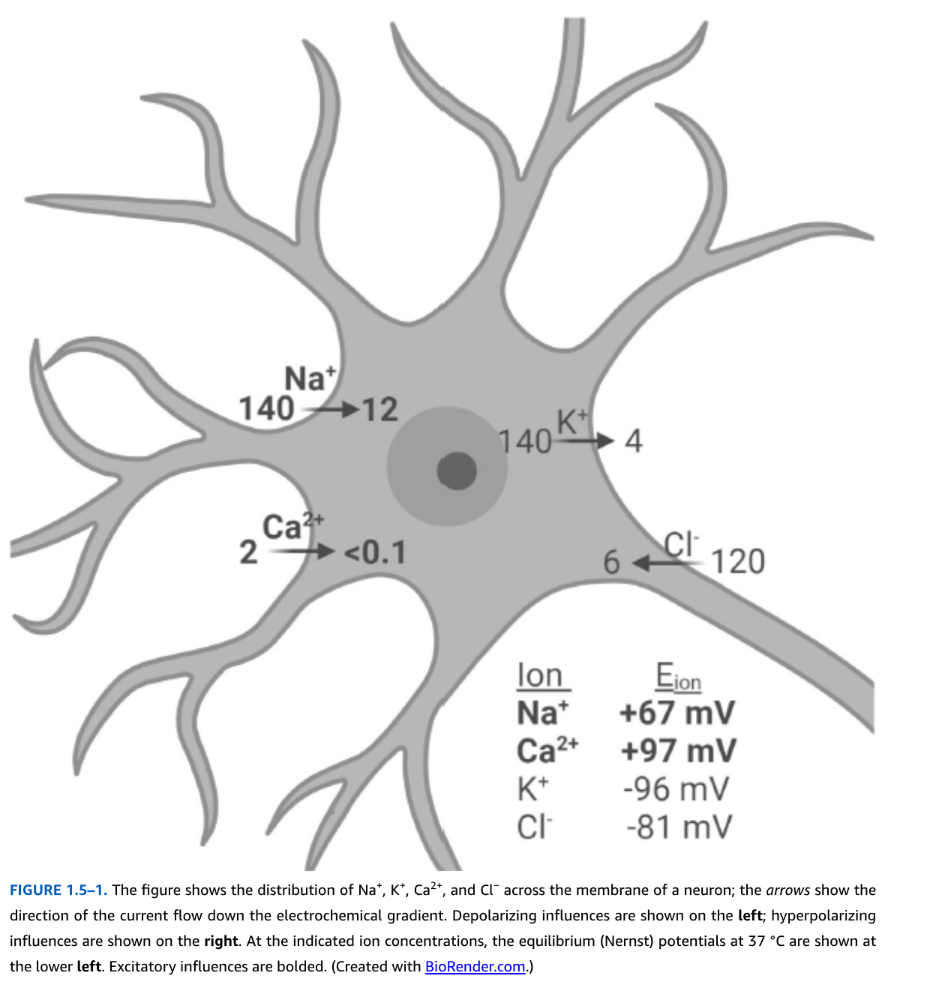
図1.5-1. この図は、ニューロンの膜を介したNa+、K+、Ca2+、およびCl−の分布を示しています。矢印は電気化学的勾配に沿った電流の方向を示しています。脱分極の影響は左に示され、過分極の影響は右に示されています。示されたイオン濃度における37℃での平衡(ネルンスト)電位は、左下に示されています。興奮性影響は太字で示されています。(BioRender.comで作成。)
上記で概説された平衡電位と膜電位の概念は、ネルンスト方程式によって定量的に記述されます。任意のイオン種の平衡電位は、膜の両側のイオン濃度に基づいて計算されます。K+の場合、平衡電位(EKと表記)は次の式で表されます:EK=(RT/zF)×ln([K]o/[K]i)、ここでRは理想気体定数(8.31 joules/degree/mole)、Tはケルビン度の温度、zはイオンの原子価、Fはファラデー定数(96,500 coulombs/mole、1モルの1価イオンの電荷)、そして[K]oと[K]iはそれぞれ細胞外と細胞内のK+濃度です。37℃において、K+の平衡電位は−96 mV、ENaは+67 mV、EClは−81 mV、そしてECaは+97 mVよりも大きいです。これらの平衡電位は、特定のイオン種に透過性のイオンチャネルが開閉する際に膜電位がどのように変化するかを決定する上で重要です。なぜなら、特定のイオンチャネルの開口は、膜電位をそのイオンの平衡電位に向かって駆動するからです。例えば、K+選択的イオンチャネルが開くと、ニューロン膜電位はその平衡電位である−96 mVに向かって移動します。これにより、細胞内部がより負になり、この効果を過分極と呼びます。Na+およびCa2+チャネルの開口は逆の効果を持ち、細胞内部を負の電位が減少させます(脱分極)。
静止細胞膜は複数のイオンに透過性であるため、真の膜電位はいかなる単一イオンの平衡電位とも正確には等しくありません。ゴールドマン・ホジキン・カッツ(GHK)方程式は、実際の静止電位を、各イオンの相対的な透過性によって重み付けされた様々な平衡電位の平均として記述します。方程式は以下の形式です。
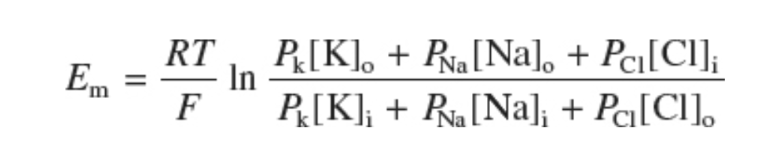
ほとんどの変数は、上記で述べたネルンスト方程式でおなじみのものです。Emは膜電位、Pionは膜のイオンに対する透過性です。したがって、静止膜電位は、静止時に開いている様々なコンダクタンスに対する反転電位(正味の流入電流または流出電流が流れない電位)です。
膜の両側のバルクイオン溶液は電気的に中性であり、ほとんどの細胞内負電荷は大型の細胞内有機アニオン(酸とタンパク質)によって寄与されています。ニューロン膜を横切るイオンの分布の差は、アデノシン三リン酸(ATP)の加水分解からエネルギーを利用して、イオンを濃度勾配に逆らって細胞内または細胞外に移動させる膜ポンプによって維持されています。最もよく特徴づけられているポンプは、各サイクルで3 Na+を細胞外に、2 K+を細胞内に輸送するNa+-K+ ATPase(ナトリウムポンプ)です。各サイクルで不均等な量の電荷が移動するため、このポンプは電気原性であり、膜電位の細胞内陰性に寄与します。Na+-K+ ATPase活性は脳のエネルギー利用の主要な駆動力であり、脳の酸素消費量の最大40%が活動電位の発火とシナプス伝達後にイオン恒常性を再確立するために必要なポンプ活性を反映しています。心臓グリコシドであるジゴキシンとウアバインは、心臓のNa+-K+ ATPaseを阻害し、心筋細胞を脱分極させ、細胞内Ca2+を増加させることで心筋収縮性を改善します。
静止膜電位は比較的静的であり、神経シグナル伝達に利用可能な位置エネルギーを表します。負の静止電位は興奮性細胞に固有のものではありませんが、ニューロンや他の興奮性細胞は、静止電位として蓄えられたエネルギーを独自の形で利用して、一時的な膜電位変化を生成します。これは神経情報交換の真の通貨です。膜電位の変化は通常、膜を横切る電流の流れの変化によって開始され、これは通常、後述する特定のイオンチャネルの開閉によって生じます。膜電位を変化させるために必要なイオンの数は、バルクの細胞内および細胞外溶液中の濃度に比べて非常に少ないです。例えば、1 cm$^2$の膜面積を横切る100 mVの電位変化には、約10−12モルの1価(単一電荷)イオンの移動しか必要ありません。これに対し、Na+とK+は、細胞外液と細胞内液にそれぞれ約$10^{-1}$Mで存在します。
受動膜特性
電気化学的勾配、イオンチャネル、および膜を横切る電荷の不均一な分布がどのように関連しているかを概念化する方法の1つは、細胞膜を抵抗器(導体)、バッテリー、コンデンサの電気回路と見なすことです(図1.5-2)。等価回路の使用により、刺激やチャネル開口に応答して膜電位がどのように変化するかを予測できます。イオンはイオンチャネルを通って流れ、細胞膜に直接浸透しないため、イオンチャネルは可変抵抗器と見なすことができます。これらのイオンチャネルは、その選択性(どのイオンがチャネルを通って流れるか)とコンダクタンス(イオンの通過の相対的な容易さ)によって特徴付けられます。コンダクタンス(g)は、電気回路における抵抗(R)の逆数です(g = 1/R)。異なる種類のイオンチャネルは、互いに並列に、また膜容量と並列に電気回路の一部を構成しています。膜を横切る電圧の存在は、イオンをチャネルを通って駆動する電気力を提供し、膜貫通電流を生じさせます。電圧(V)、イオン電流(I)、および抵抗(コンダクタンス)の関係は、オームの法則のバージョンで与えられます:Iionic=g(Vm−Erev)、ここでVmは膜電位、Erevはチャネルを通って流れるイオンの平衡(ネルンスト)電位であり、(Vm−Erev)はイオンの流れの駆動力です。
容量は、もう1つの重要な受動膜電気特性です。コンデンサは、2つの導体を絶縁材料によって分離した装置で、2つの導体に反対符号の電荷を蓄えることができます。ニューロンでは、導体は細胞外液と細胞内液であり、脂質膜は絶縁体です。電流が膜を流れるたびに、一部の電流は膜容量(Cm)を充電する必要があります。この容量性電流を記述する式は、Icap=Cm(dV/dt)です。容量性電流は、膜電位が変化している場合(つまり、時間tに対する電圧Vに何らかの変化[dV]がある場合)にのみ流れることに注意してください。特定の時間に膜を横切って流れる総電流は、IcapとIionicの合計です。膜容量は、静止時の膜のリークコンダクタンスとともに、ニューロンのローパスフィルタリング特性を定義するのに役立ちます。イオン電流を研究するために使用される主要なツールは、電圧クランプであり、しばしばパッチクランプ法を使用して実装されます。これらの技術は、特殊な増幅器を使用して膜電位を一定に保ち、電圧の変化を防ぐことで容量性電流を排除し、イオンチャネルを介したイオン電流を直接測定することを可能にします。
能動膜特性:活動電位
膜電位の変化は興奮性に重要な影響を与えます。なぜなら、一部のイオンチャネルは電圧変化によって調節(ゲート)されているからです。ニューロンが脱分極すると、特定のNa+チャネルが急速に開き、膜電位をNa+平衡電位(約+66 mV)に駆動します。静止時に開いているリークチャネルがあるため、最初はリーク電流と、脱分極によって開いたNa+チャネルを流れる電流との間に平衡が存在します。特定の脱分極した膜電位において、Na+チャネルを流れる電流がリークチャネルを流れる電流を超えます。Na+電流がリーク電流を超える膜電位は閾値電位と呼ばれ、ニューロンでは通常−45 mVから−30 mVの間です。閾値から脱分極した膜電位では、より多くのNa+の流入がさらなる脱分極を生み出し、正のフィードバックサイクルでより多くのNa+チャネルを開きます。膜電位は0 mVよりも正になりますが、3つの理由でNa+平衡電位には決して達しません。第一に、活動電位中もリークチャネルは膜電位を決定する上で役割を果たし続けます。これらのチャネルの相対的なK+選択性のため、膜電位は決してNa+平衡電位には達しません。第二に、脱分極中、Na+チャネルは活性化するだけでなく、急速に不活性化します。不活性化とは、活性化刺激(この場合、脱分極)が継続しているにもかかわらず、電位依存性チャネルが非導通状態になるプロセスです。第三に、Na+流入によって生成される脱分極は、膜電位をK+平衡電位(約−90 mV)に駆動する電位依存性K+チャネルも開きます。Na+チャネルの活性化と不活性化、および電位依存性K+チャネルの遅延開口の正味の効果は、ニューロン膜電位が急速に0 mVよりも正の値に変化し、その後急速に静止膜電位に戻ることです。この急速な連続は数ミリ秒にわたって発生し、活動電位(またはナトリウムスパイク)と呼ばれます(図1.5-3)。膜電位が一時的に0 mVを超えるという事実はオーバーシュートと呼ばれます。おおよそ、活動電位は電気的興奮性の全か無かの増加を表し、ニューロン内およびニューロン間の情報伝達に重要な貢献をします。活動電位は伝播するため(下記参照)、ニューロンの細胞体が軸索終末と迅速に通信することを可能にします。軸索終末では、スパイクはCa2+チャネルの開口、ひいてはCa2+依存性神経伝達物質の放出を促進する脱分極を提供します。
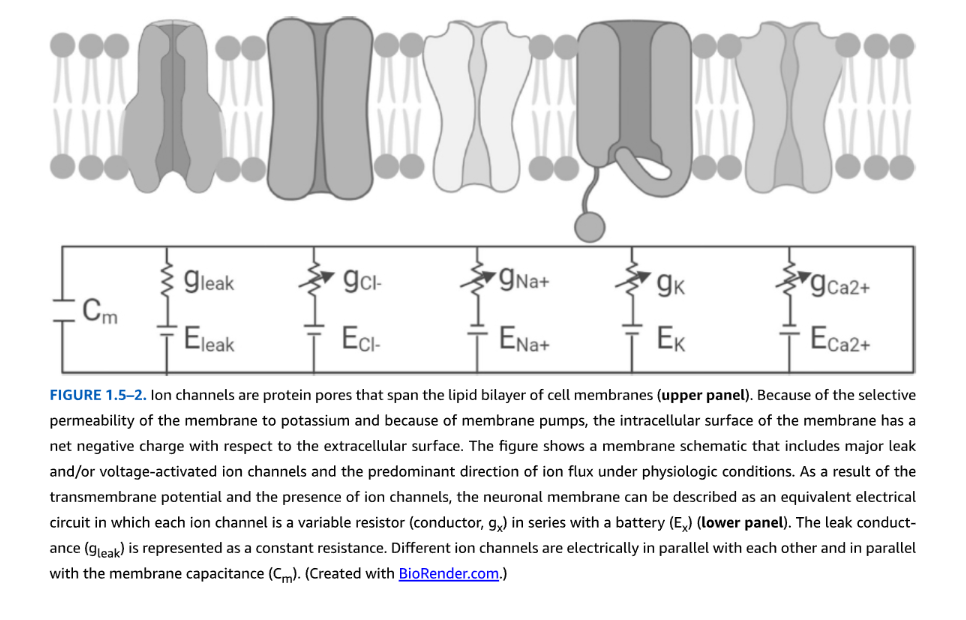
図1.5-2. イオンチャネルは、細胞膜の脂質二重層にまたがるタンパク質孔です(上パネル)。膜のカリウムに対する選択的な透過性、および膜ポンプのために、膜の細胞内表面は細胞外表面に対して正味の負電荷を帯びています。この図は、主要なリークチャネルおよび/または電位依存性イオンチャネルと、生理学的条件下でのイオン流の優勢な方向を含む膜の模式図を示しています。膜電位とイオンチャネルの存在の結果として、ニューロン膜は等価電気回路として記述することができ、各イオンチャネルはバッテリー(Ex)と直列に接続された可変抵抗器(導体、gx)です(下パネル)。リークコンダクタンス(gleak)は一定の抵抗として表されます。異なるイオンチャネルは互いに電気的に並列であり、膜容量(Cm)とも並列です。(BioRender.comで作成。)
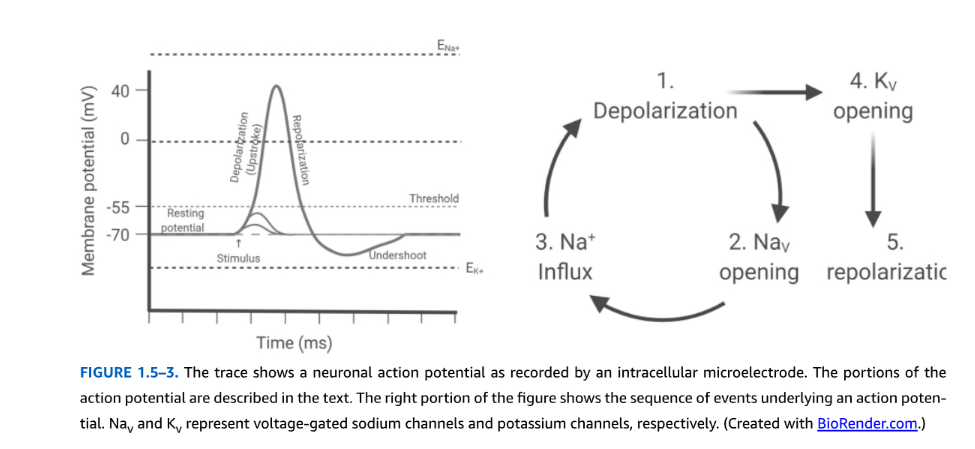
図1.5-3. 活動電位の発生と伝播
図1.5-3. この図は、細胞内微小電極によって記録されたニューロンの活動電位の波形を示しています。活動電位の各部分は本文中で説明されています。図の右側は、活動電位の根底にある一連の出来事を示しています。Na$_V$およびK$_V$は、それぞれ電位依存性ナトリウムチャネルおよびカリウムチャネルを表します。(BioRender.comで作成。)
ほとんどのニューロンでは、K$^+の平衡電位は静止膜電位に対して負です。したがって、活動電位の後に、膜が過分極するにつれて徐々に閉じる開いた電位依存性K^+チャネルに起因する一時的な∗∗アンダーシュート∗∗(または∗∗後過分極∗∗[AHP])が続くことがよくあります(図1.5−3を参照)。活動電位の後には、脱分極が活動電位を誘発できない期間、または非常に強い脱分極でなければ活動電位を誘発できない期間が存在します。これらは∗∗絶対不応期∗∗および∗∗相対不応期∗∗と呼ばれます。絶対不応期は、活動電位直後のNa^+チャネルのほぼ完全な不活性化に起因します。相対不応期は、膜の再分極後に電位依存性K^+$チャネルが閉じるのにかかる時間を反映しています。
### 軸索における活動電位伝導
活動電位は通常、ニューロンの細胞体から約50 µm以内の軸索の起始部(**軸索丘**とも呼ばれる)で発生します。神経伝達物質が放出される神経終末から離れた場所で活動電位が開始されるため、活動電位がシナプス終末にどのように伝播するのかという重要な問題が生じます。
厳密に受動的な神経線維では、膜を横切る電流の漏れが**減衰伝導**を引き起こします。信号(電圧変化)は、線維の縦方向(軸方向)抵抗、膜容量、および膜抵抗によって決定される距離で減衰します。この受動的な減衰伝導は、樹状突起を介した電圧変化がニューロンの細胞体に向かって広がる一般的な様式ですが、樹状突起もまた、逆方向に伝播する活動電位を支持し、樹状突起におけるシナプス生成電圧変化を修飾する上で重要な役割を果たす電位依存性イオンチャネルを発現しています。
多くの軸索(ただしすべてではない)は、有髄鞘に覆われており、これにより無髄軸索よりも効率的に活動電位を伝達できます。ミエリン鞘があるため、軸索は電気的に絶縁されており、**ランヴィエの絞輪**でのみ絶縁が解除されています。ランヴィエの絞輪には、活動電位の生成に関与する電位依存性Na$^+$チャネルが密に集積しています(図1.5-4)。ミエリンは膜抵抗を増加させ、膜容量を減少させます。これにより、軸索からの電流の漏れが減少し、電流が軸索の長さに沿って流れやすくなり、神経伝達物質が貯蔵されている神経(軸索)終末に到達しやすくなります。活動電位は急速に伝播し、脱分極の波は絞輪から絞輪へと跳躍伝導(ラテン語で「跳ぶ」を意味する”saltare”に由来)と呼ばれる形式でジャンプし、信号を神経終末に高い忠実度で伝達します。跳躍伝導は、電気情報がニューロンの細胞体からその終末に伝達される速度と忠実度の点で重要です。電位依存性チャネルの開口がチャネルの立体構造変化を反映して時間依存性である一方、絞輪間の受動的な電流の流れは、忠実度が失われるにもかかわらず、本質的に瞬間的であることに注意してください。したがって、軸索の長手方向への受動的な電流の広がりが伝導速度を決定する上で重要です。大きな有髄軸索における伝導速度の典型的な値は〜100 m/sである一方、小さな無髄線維における伝播はわずか〜0.3 m/sです。多発性硬化症やギラン・バレー症候群を含む特定のヒトの病気では、軸索の脱髄が軸索伝導の変化と特定の神経学的欠陥を引き起こします。
電位依存性イオンチャネルの構造と機能
電位依存性イオンチャネルは、膜電位の変化に応じてイオンの流れを可能にし、神経の興奮性を調節する上で重要な要素です。イオンチャネルは通常、単一のイオン種だけでなく複数のイオン種も通過させることができますが、電位依存性チャネルは、主に透過させるイオンであるNa⁺、K⁺、Ca²⁺、またはCl⁻に基づいて命名されます。グルタミン酸やアセチルコリンなどの神経伝達物質によって開かれる特定のチャネルは、正に荷電したイオン(Na⁺、K⁺、Ca²⁺)を選択的に透過させますが、Cl⁻を排除するため、非選択的陽イオンチャネルです。電位依存性イオンチャネルのファミリーには、ヒトゲノムにコードされた約150のメンバーが存在します。GPCR(Gタンパク質共役受容体)とプロテインキナーゼだけが、これより多くのメンバーを持ちます。国際基礎臨床薬理学連合(IUPHAR)は、イオンチャネルと受容体に関する最新の命名法をウェブサイトで維持しています。

図1.5-4:跳躍伝導
図1.5-4は、有髄軸索を持つニューロンにおける活動電位の跳躍伝導を示しています。活動電位は軸索起始部で生成されます。波形が軸索に沿って移動するにつれて、電流は細胞から漏れ出る傾向があり、振幅を減少させます。しかし、ミエリンは軸索を絶縁し、電流の漏れを著しく減少させるため、最初のランヴィエの絞輪への軸方向電流(破線矢印)の流れを増強します。ランヴィエの絞輪では、脱分極の波に応答してNa⁺チャネルが開き、全か無かの活動電位を複製(再生)します。このシーケンスは、活動電位が軸索終末に到達し、伝達物質の放出を開始するまで、後続のランヴィエの絞輪で繰り返されます。(BioRender.comで作成。)
ナトリウム(Na⁺)チャネル
膜の脱分極に応答したNa⁺チャネルの開口は、神経活動電位の高速な立ち上がりを基礎としており、したがって神経情報処理の重要な決定要因です。一部のニューロンでは、Na⁺チャネルはより小さな脱分極やペースメーカー発火にも寄与します。ペースメーカー活動とは、一部のニューロンが自発的に脱分極し、接続された細胞のネットワークにおける活動を協調させる能力を指します。前述のように、Na⁺チャネルは脱分極に応答して急速に活性化(開口)し、そのほとんどは持続的な脱分極に応答して急速かつほぼ完全に不活性化します。
脳で発現されるNa⁺チャネルは通常、3つのタンパク質サブユニットを持ちます。それは、分子量240から280キロダルトン(kDa)の主要な(α)サブユニット1つと、分子量30から40 kDaの2つの補助的な(β)サブユニットが1:1:1の比率で発現されたものです。α-サブユニットは、構造的に類似した4つのドメインを持ち、それぞれが6つの膜貫通領域(S1からS6)(図1.5-5および1.5-6)を持つ糖タンパク質です。α-サブユニットは、単独で発現された場合でも機能的なチャネルを形成できます。後述する電位依存性K⁺チャネルが、各サブユニットに6つの膜貫通ドメインを含む個別のサブユニットの四量体であるのとは異なり、機能的なナトリウムチャネルは単一のα-サブユニット遺伝子産物から生じます。哺乳類には、ナトリウムチャネルα-サブユニットをコードする遺伝子が少なくとも10種類あり、Nav1.1から1.9、およびNav2があります。Nav1.1から1.3、およびNav1.6から1.9はニューロンチャネルであり、Nav1.4は筋肉で発現され、Nav1.5は心臓で発現されます。一部のニューロンチャネルは主に**中枢神経系(CNS)で発現され、その他は末梢神経系(PNS)**で発現されます。電圧依存性、イオン透過性、薬理学的感受性、活性化、および不活性化の特性は、これらのタンパク質の特定の領域によって付与されます。
Na⁺チャネルにおける一次タンパク質構造とイオンチャネル機能の関係は、特定のアミノ酸残基の部位特異的変異導入によって決定されています。α-サブユニットのアミノ末端とカルボキシ末端は両方とも細胞内に位置しています。4番目の膜貫通領域(S4)には、膜電位の変化を感知し、チャネルの開口を促進する複数の電気的に荷電したアミノ酸残基が含まれています。S5とS6の膜貫通領域の間にある疎水性アミノ酸のセグメントは、膜二重層を完全に横断しません。このアミノ酸群(「Pループ」と呼ばれる)は、イオンチャネルの孔を裏打ちしています(図1.5-5および1.5-6を参照)。Pループは、他の電位依存性イオンチャネルや一部の非選択的陽イオンチャネルに共通する特徴です(図1.5-7および1.5-8)。3番目と4番目の相同ドメインの間にある短い細胞内ループは、チャネルの不活性化に役割を果たし、より長い脱分極期間中にイオン孔を物理的にブロックします。細菌のNa⁺チャネル(NavAb)の高分解能結晶構造は、構造と機能の関係に関する洞察を提供しています。このチャネルは、大きな外部前室、狭いイオン選択性フィルター、およびS6セグメントによって裏打ちされた大きな水で満たされた中央空洞を持っています。イオン選択性フィルターは、グルタミン酸残基の負電荷を帯びた側鎖によって形成されており、Na⁺の水和水の大部分(ただしすべてではない)を除去します。細胞内活性化ゲートは、S6セグメントの一部を横切ることを伴います。
ナトリウムチャネルβサブユニット(β1からβ4と命名)は、大きな細胞外アミノ末端、単一の膜貫通ドメイン、および短い細胞内カルボキシ末端を持つ糖タンパク質です。2つのβサブユニットが単一のαサブユニットと結合し、機能的発現、チャネル動力学、およびゲーティングを調節します。大きな細胞外N末端は、免疫グロブリン様フォールドを介した細胞接着に関与しています。この細胞外フォールドのシステイン残基の変異は、ある種の家族性てんかんにリンクしています。クライオ電子顕微鏡(Cryo-EM)を用いた研究により、βサブユニットと複合体を形成した哺乳類ナトリウムチャネルの構造が解明されています。
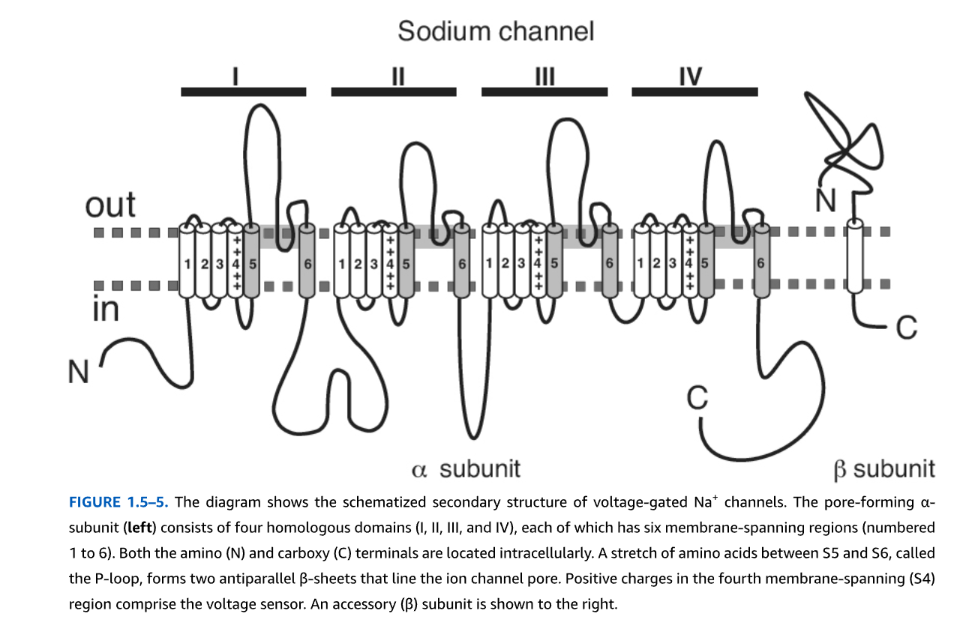
図1.5-5:電位依存性Na⁺チャネルの構造
図1.5-5は、電位依存性Na⁺チャネルの模式的な二次構造を示しています。孔を形成するα-サブユニット(左)は、4つの相同ドメイン(I、II、III、およびIV)から構成され、それぞれが6つの膜貫通領域(1から6まで番号付け)を有しています。アミノ(N)末端とカルボキシ(C)末端は両方とも細胞内に位置しています。S5とS6の間にあるPループと呼ばれるアミノ酸の連なりは、イオンチャネルの孔を裏打ちする2つの逆平行βシートを形成します。4番目の膜貫通(S4)領域にある正電荷が電圧センサーを構成します。補助(B)サブユニットが右側に示されています。
Na⁺チャネルは、神経毒や臨床薬が作用する部位を少なくとも7つ含んでいます。ほとんどすべてのNa⁺チャネルには、テトロドトキシン(TTX)とサキシトキシン(STX)がイオンの流れをブロックする細胞外サイトが存在します。TTXはフグから単離された神経毒で、Na⁺チャネル機能をブロックするために生理学実験で一般的に使用されます。TTXサイトとは異なるNa⁺チャネル上のサイトでは、α-サソリ毒素とイソギンチャク毒素がゲーティングを調節します。α-サソリ毒素はチャネルの不活性化を遅らせる一方、異なるサイトで作用するβ-サソリ毒素は活性化電圧をシフトさせ、チャネルが静止電位に近い電圧で開くことを可能にします。これらのサソリ毒素の正味の効果は興奮性を高めることであり、痛覚線維の発火増加やサソリの刺傷に関連する麻痺に寄与します。骨格筋Na⁺チャネルのα-サブユニットの変異は、ヒトの疾患である高カリウム性周期性麻痺を引き起こします。イソギンチャク毒素やα-サソリ毒素と同様に、これらの変異はチャネルの不活性化を遅らせます。
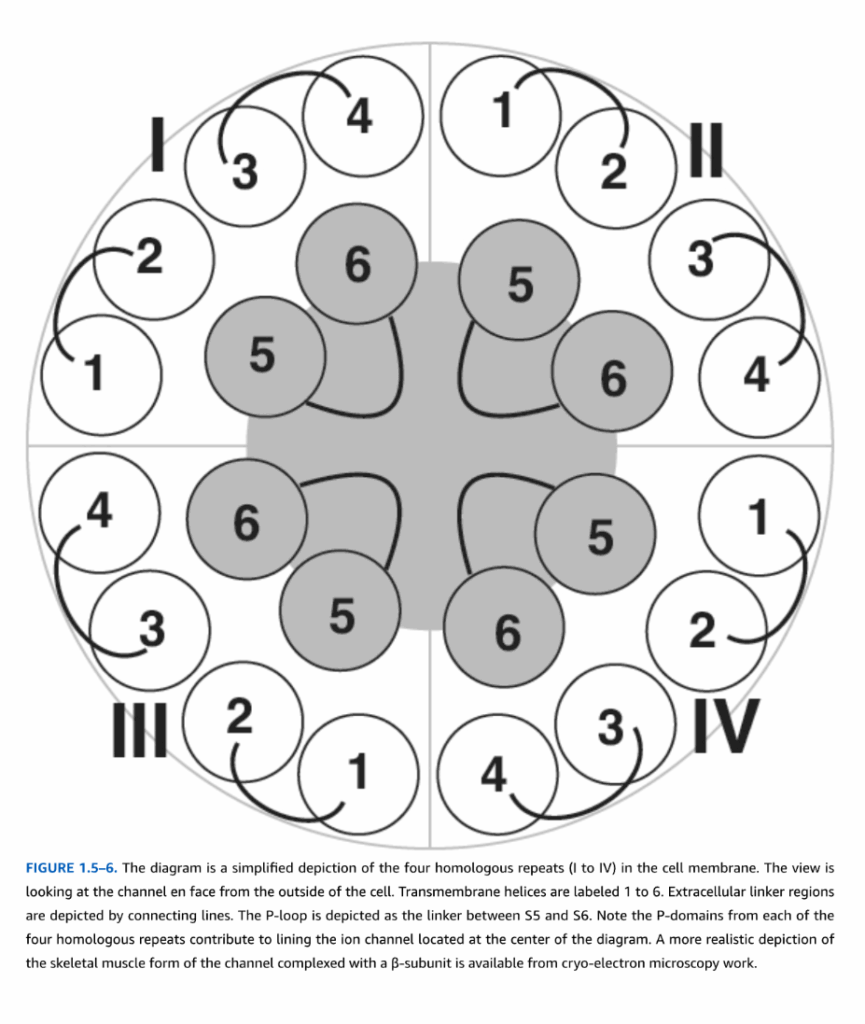
図1.5-6. この図は、細胞膜における4つの相同な繰り返し(IからIV)を簡略化したものです。チャネルを細胞の外側から正面で見た図です。膜貫通ヘリックスは1から6まで番号が振られています。細胞外のリンカー領域は接続線で示されています。PループはS5とS6の間のリンカーとして描かれています。図の中央にあるイオンチャネルの内側を、4つの相同な繰り返しそれぞれからのPドメインが構成していることに注目してください。βサブユニットと複合体を形成した骨格筋型チャネルのより現実的な描写は、クライオ電子顕微鏡の研究から得られます。

