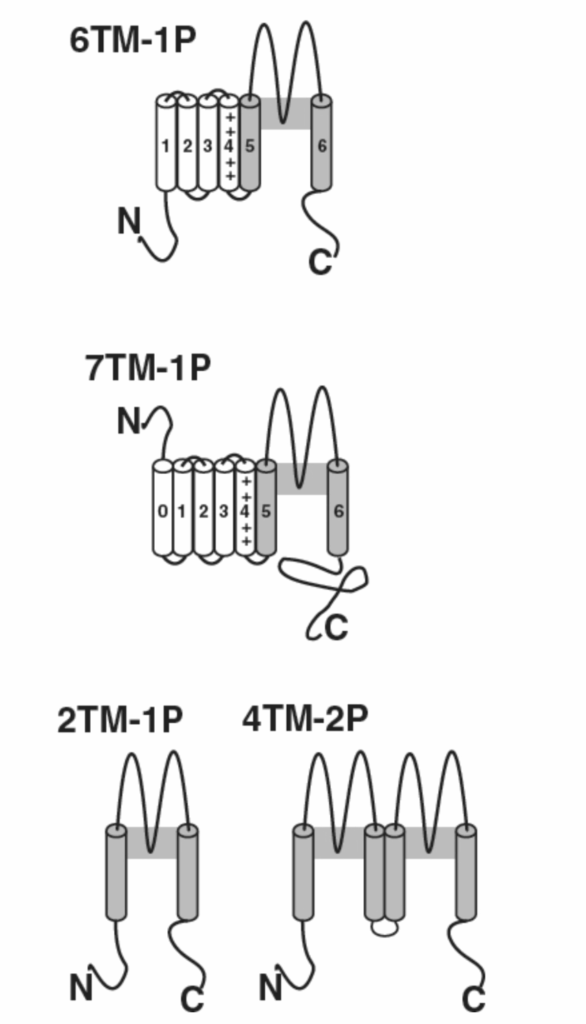
図1.5-7. カリウムチャネルは多様な分子構造を持っています。この図は、膜貫通(TM)ドメインの数とPドメインの数によって定義される4つのK⁺チャネルファミリーを示しています。本文で説明されているチャネルのうち、古典的な脱分極ゲート型K⁺チャネルとKCNQサブユニットは、6つのTMドメインと1つのPドメインを持つファミリーに属します。一部のCa²⁺依存性K⁺チャネルもこのファミリーに属しますが、BK Ca²⁺および電位依存性チャネルは、追加のTMドメインと細胞外N末端を持つため、別のファミリーに属します。KATpやアストロサイトリークチャネルを含む内向き整流チャネルは、2つのTMドメインと1つのPドメインを持つファミリーに属します。タンデムポア(またはTWIK)K⁺チャネルファミリーは、TM領域と2つのPドメインを持っています。
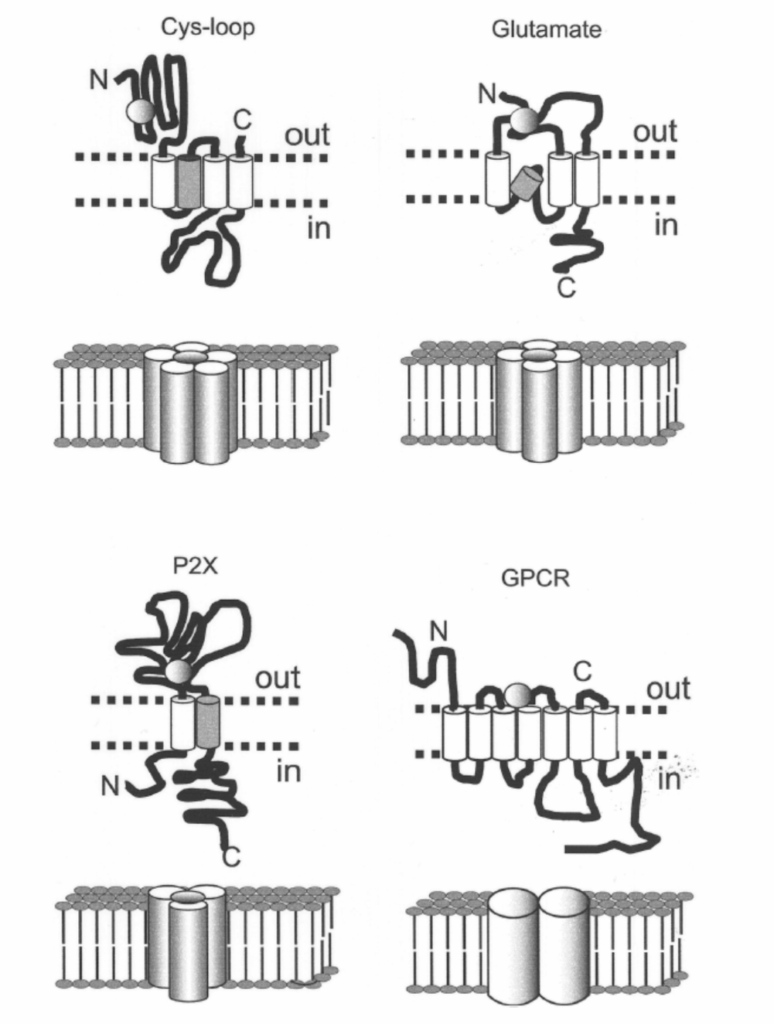
図1.5-8
図1.5-8は、GABAA受容体(システインループファミリーのメンバーで、ヘテロ五量体の機能的受容体構造)、イオンチャネル結合型グルタミン酸受容体(四量体構造)、細胞外ATPによってゲートされるチャネル(P2X; 三量体)、およびGタンパク質共役受容体(GPCR; しばしば二量体)を含む、いくつかの神経伝達物質の受容体サブユニットの模式図を示しています。サブユニットのリガンド結合ドメインは、細胞外領域の円で示されています。
キンポウゲ科(アコニチン)、ユリ科(ベラトリジン)、および南米の矢毒に使用されるカエル(バトラコトキシン)由来の他の毒素は、Na⁺チャネルの直接的な開口を促進し、チャネルが開いた状態を長く保ちます。その正味の効果はサソリ毒素に似ています。リドカインやプロカインを含む特定の局所麻酔薬は、イオンチャネルの疎水性領域内の部位に結合することでNa⁺チャネルをブロックします。Na⁺チャネルの遮断は、局所麻酔効果や心臓における抗不整脈効果に寄与します。特定の臨床的に重要な抗けいれん薬(カルバマゼピン、ラモトリギン、フェニトイン、リルゾール)は、プロカインが結合する部位に類似した部位に結合し、重要な精神療法薬となっています。上記に記載されたすべての遮断薬は、TTXとSTXを除き、使用依存的な様式でNa⁺チャネルをブロックします。つまり、細胞がより脱分極するにつれて、これらの薬物はより効果的になります。メカニズム的には、これは薬物がチャネルの不活性化状態(立体構造)を安定させることによって達成され、その結果、正常な活動は比較的温存されつつ、異常な興奮が遮断されるという臨床的に有益な状況をもたらします。これらの薬物によるさらなる臨床的利益は、完全には理解されていないメカニズムによって、興奮性シナプス伝達を選択的に抑制し、抑制性伝達を温存する能力に起因する可能性があります。ニューロン内のすべてのNa⁺チャネルが上記の薬剤すべてに感受性があるわけではないことを強調することが重要です。例えば、一部の興奮性細胞にはTTX非感受性Na⁺チャネルが存在し、特定の侵害受容ニューロンにおいて顕著な役割を果たしています。
カリウム(K⁺)チャネル
K⁺チャネルはイオンチャネルの中で最も多様なファミリーであり、ニューロンの静止および発火特性を決定します。様々な細胞で少なくとも75種類の異なるK⁺チャネルが発現されています。これらの中には、主要な(α)サブユニット(Kv1からKv12と命名)によって12のファミリーに分類される、電位依存性K⁺チャネルをコードする40種類の哺乳類遺伝子があります。これらの様々なファミリーは、異なる特性と構造モチーフを持っています(図1.5-7を参照)。これらには、6つの膜貫通ドメイン/1つのPドメインを持つチャネル(古典的な脱分極ゲート型チャネル)、2つの膜貫通ドメインを持つ内向き整流チャネル、4つの膜貫通ドメインを持つ二孔チャネル、および8つの膜貫通ドメインを持つ二孔チャネル(無脊椎動物に存在する)が含まれます。第5のクラスのK⁺チャネルは、カルシウムと脱分極によって調節され、BKチャネル(大きな単一チャネルコンダクタンスに由来)として知られています。これらのチャネルは6つの膜貫通ドメインを持つチャネルに似ていますが、7番目の膜貫通ドメイン(S0領域)と細胞外アミノ末端も持っています。さらに多様性を増すものとして、ホモ型およびヘテロ型のK⁺チャネルの両方の証拠があります。また、αサブユニットとα4β4の化学量論で結合するいくつかの補助サブユニット(β1からβ3)も存在します。カリウムチャネルの多様性は圧倒的であり、これらのチャネル間の分子構造の違いは、入力信号に応答した膜電位変化のパターンを含む、広範な機能的意味合いを持っています。
6つの膜貫通ドメインを持つK⁺チャネルはニューロンにおいて特に重要であり、脱分極ゲート型チャネルが主要なサブグループを構成します。電位依存性K⁺チャネルにはいくつかのサブファミリーがあり、Kv1(ショウジョウバエ遺伝子にちなんでShakerとも呼ばれる)、Kv2(Shab)、Kv3(Shal)、およびKv4(Shaw)があり、それぞれが構成サブユニット(例:Kv1.1から1.4)を持ちます。機能的なチャネルは、同じサブファミリーからの4つのサブユニットからなる四量体です。アミノ末端領域の特定のドメインは、四量体の形成を担い、ゲーティング、不活性化、および補助タンパク質との相互作用を調節します。
電位依存性K⁺チャネルに共通する構造モチーフは、S4とS5の間に再進入ループ(Pドメイン)を持つ6つの膜貫通ドメイン(S1からS6)の存在です。4つのサブユニットの再進入ループがイオンチャネルの孔を裏打ちします。Pドメイン内のカルボニル基はK⁺と相互作用し、イオン選択性を決定します。これらの相互作用はK⁺の水和殻を模倣し、K⁺とカルボニル基の間には水分子は介在せず、Na⁺チャネルのイオン選択性とは異なります。チャネル孔内の相互作用の特異性は、他のイオンに対するK⁺の選択性を与え、高効率のチャネル透過は、隣接するK⁺の静電的イオン-イオン反発を伴います。再進入Pループは、K⁺チャネルのすべてのファミリーに共通です。
電位依存性K⁺チャネルは、ニューロンのサブタイプのスパイク形状と発火パターンを定義するのに役立ちます。特定のK⁺チャネルによって媒介される高速な再分極は、活動電位発火率の増加を可能にし、それが周波数依存性の情報コーディングに利用され得ます(図1.5-9)。ほとんどのニューロンは、活性化と不活性化の動態、電圧依存性、および薬理学が異なる複数の種類のK⁺チャネルを発現します。K⁺の平衡電位は約-90mVであるため、K⁺チャネルの開口はK⁺流出、膜過分極、および興奮性の低下をもたらします。

図1.5-9. A:この図は、活動電位の再分極に関わるK⁺チャネルを阻害した際の効果を示しています。波形は、ホジキン・ハクスリーによって記述されたものと同様の、非ゲート型リークチャネルと電位依存性ナトリウムチャネルおよびカリウムチャネルを含むシミュレーションプログラムを用いて作成されました。シミュレーションには、スパイクを誘発するために一定振幅の持続的な脱分極電流注入が含まれています。灰色の波形は、遅延整流カリウムコンダクタンス(gK)を初期のベースラインレベル(黒い波形)の25%に減少させた場合の効果を示しています。電位依存性カリウムチャネルが少ないと、細胞は過興奮性になり、同じ脱分極入力に対してより多くの活動電位を示すことに注目してください。B:下のパネルは、シミュレーションの最初の7ミリ秒を重ね合わせたものです。K⁺チャネルブロック後、個々の活動電位は広がり、アンダーシュートは減少しています。
生理学的に最初に同定されたK⁺チャネルは、遅延整流チャネルと呼ばれました。これらのチャネルは、イカの巨大軸索におけるホジキン・ハクスリーの実験で予測され、活動電位の立ち上がりを生成するNa⁺チャネルよりも電流の活性化が遅いため、そのように名付けられました。つまり、チャネルの開口がNa⁺チャネルの開口に比べて「遅延」しています。「整流器」(ダイオード)とは、特定の電圧で他の電圧よりも電流をよく通す電気デバイスであり、言い換えれば、コンダクタンスが電圧によって変化するものです。K⁺電流が整流器であるのは、チャネルが脱分極によって開くことで、K⁺イオンが細胞に入るよりも外に出ることをより効果的に許容するからです。遅延整流チャネルは、持続的な脱分極の間、ほとんど不活性化を示しません。これらのチャネルは、持続的な脱分極に応答してニューロンが活動電位を発火する頻度を決定するのに役立ちます。例えば、海馬と皮質の「高速発火性」介在ニューロンは、Kv3ファミリーのメンバーによってコードされる、急速に活性化および不活性化する遅延整流チャネルを持っています。これらのチャネルは、この介在ニューロンクラスの狭いスパイクと短い不応期の大部分を担っています。構造的には、遅延整流チャネルは6膜貫通K⁺チャネルサブファミリーのメンバーです。
イカ軸索の実験では、遅延整流チャネルが活動電位の再分極に関与する主要なK⁺チャネルであることが示されました。哺乳類のニューロンでは、状況はより複雑で、追加のK⁺チャネルが大きく寄与しています。これには、細胞内Ca²⁺の増加によって開かれるカルシウム活性化K⁺チャネルの2つのクラス(一部は脱分極によっても開かれる)が含まれます。これらのチャネルは、活動電位の再分極や一部のニューロンに特徴的なAHP(後過分極)の生成において重要です。AHPを持つ細胞では、AHPは持続的な脱分極中の反復的な活動電位発火を減少させる順応(適応)プロセスを担っています(図1.5-9を参照)。AHPには、大きなコンダクタンスを持つBKチャネルと小さなコンダクタンスを持つSKカルシウム活性化K⁺チャネルによって媒介されるいくつかの時間的成分があります。BKチャネルはAHPの速い成分を媒介し、大きな単一チャネルコンダクタンスを持ちます。BKチャネルは、ショウジョウバエのslowpoke遺伝子にちなんで名付けられたSLOチャネルファミリーに属し、Ca²⁺、Na⁺、およびH⁺感受性K⁺チャネルを含みます。これらのチャネルの大きなコンダクタンスは、内側および外側の孔領域における負電荷のリングと大きな内側孔に起因します。いくつかの証拠は、BKチャネルのαサブユニットの欠陥と、知的機能障害を伴う自閉症との関連を示唆しています。SKチャネル(CNSではSK1からSK3)は細胞内Ca²⁺によってゲートされますが、電圧非感受性であり、AHPの中程度および遅い成分に寄与します。いくつかの証拠は、SKチャネルのバリアントを統合失調症や他の精神病性障害と関連付けています。
A型K⁺チャネルは、-60mVより正の電位への脱分極で急速に活性化し、脱分極した電位で急速に不活性化します。A型チャネルは、ニューロンが発火するスパイク間の頻度を調節し、活動電位の再分極に寄与します。これらは周波数符号化、すなわちニューロンの発火頻度における入力強度の符号化に重要です。ショウジョウバエのShaker A型チャネルは、最初にクローン化されたK⁺チャネルでした。
Mチャネルは、時間依存的かつ電圧依存的に活性化され、ムスカリン受容体に作用する神経伝達物質アセチルコリンによって阻害されます。これらのチャネルはゆっくりと活性化し、活動電位の再分極にはほとんど寄与しませんが、負の膜電位での活性化は反復発火を遅らせます。錐体細胞では、Mチャネルは周体領域で発現され、シナプス統合と反復発火への順応を調節します。M電流は、6膜貫通ドメイングループの2つのメンバーであるKCNQ2とKCNQ3(Kv7サブファミリーのメンバー)、およびおそらく他のKCNQファミリーメンバーのヘテロ多量体会合から生じます。KCNQサブユニットの変異は、良性家族性新生児けいれん(BFNC)、難聴、およびある種の心臓性QT延長症候群の原因となります。このクラスのチャネルにおけるサブユニットの名称(KCNQ)は、QT延長症候群におけるそれらの役割に由来します。抗けいれん薬であるレチガビンは、Mチャネルを強力に開口させ、その閉鎖を遅らせます。げっ歯類の研究では、この種の薬剤が抗うつ作用を持つ可能性があることが示唆されています。
アメフラシ(Aplysia californica)では、活動電位の再分極に寄与するK⁺チャネルは、神経伝達物質セロトニンによって阻害され、Sチャネルと呼ばれます。アメフラシのエラ引き込み反射の急性行動感作中にSチャネル活性が減少することが示されており、シナプス機能におけるこれらのチャネルの役割に関する研究は、特定の学習と記憶の細胞基盤に関する重要な洞察を提供しました。
一部のK⁺チャネル(Kirファミリー)は、脱分極ではなく過分極によって開かれ、内向き整流チャネル(異常整流チャネル)と呼ばれます。これは、K⁺が細胞に入るよりも外に出ることをより容易に許容し、K⁺の平衡電位の近くで強く整流するためです。この整流の主要なメカニズムは、正に荷電した細胞内マグネシウムまたはポリアミンによるチャネルブロックです。このチャネルブロックは、チャネルを通るK⁺流入によって解除され、K⁺平衡電位に続く整流を説明します。内向き整流にもかかわらず、ニューロンにおけるこれらのチャネルの生理学的重要性は、ニューロンがK⁺平衡電位を超えて過分極することはめったにないため、小さな外向き(過分極性)電流を通過させることにあると考えられます。内向き整流チャネルは、K⁺チャネルの2膜貫通ドメイングループのメンバーです。このクラスは単一の孔領域を持ち、電圧センサーを欠いています(図1.5-7を参照)。
脳のアストロサイトは、Kir4サブファミリーと、おそらくKir2サブファミリーの内向き整流K⁺チャネルを発現しており、これは神経活動中の細胞外K⁺の増加を緩衝するのに役立ちます。これらの細胞における内向き整流チャネルの発現は、細胞外蓄積が起こり得る軸索および軸索終末からK⁺を吸い出すのに役立ちます。これらのチャネルのユニークな特性は、K⁺の流入を促進します。これらのチャネルを介したK⁺イオンの流入は、チャネルの開口ではなくK⁺の平衡電位の変化によって引き起こされることに注意してください。細胞外K⁺が上昇する一時的な状況は、周囲のアストロサイトの静止電位がK⁺の平衡電位よりも負になるまれな状況を表します。
K⁺チャネルの複雑さに加えて、特定の神経伝達物質がGPCRを介してその機能を変化させるという観察があります。例えば、ムスカリン受容体を介して作用するアセチルコリンは、いくつかのK⁺電流を阻害し、結果として神経の興奮性を増強します。異なるムスカリン受容体では、アセチルコリンは心臓や脳を含む複数の組織で内向き整流K⁺チャネルを活性化します。海馬や他の脳領域では、神経伝達物質であるγ-アミノ酪酸(GABA)、セロトニン、およびアデノシンが間接的に内向き整流K⁺チャネルを開口させます。これらのGタンパク質によって調節される内向き整流チャネル(GIRKチャネル)は、異なるシナプス入力が単一のイオンチャネルクラスを通じてニューロンの発火に調節的な影響を及ぼすことを可能にします。
末梢組織および一部のニューロンでは、2膜貫通内向き整流チャネルのKir6サブファミリーが細胞内ATPによって調節されます(図1.5-7を参照)。膵臓では、KATPチャネルは、これらのチャネルを阻害し、膜脱分極とカルシウム流入を介してインスリン放出を促進する血糖降下スルホニル尿素薬(トルブタミドとグリベンクラミド)の作用部位です。血糖値を上昇させる降圧薬であるジアゾキシドは、膵臓のATP感受性K⁺チャネルに対して逆の効果を持ち、チャネルを開口させてインスリン放出を減少させます。スルホニル尿素薬は、KATPチャネルのKirサブユニットと直接相互作用するのではなく、4つのKirサブユニットと4つのSUR(スルホニル尿素受容体)からなるヘテロ多量体複合体において、高親和性スルホニル尿素受容体(SUR)と結合します。KATPチャネルはCNSでも発現され、特定の神経伝達物質の放出を調節し、おそらく細胞内エネルギーレベルの変化に対するニューロン応答を決定します。これらのチャネルはミトコンドリア膜にも発現され、アポトーシス性細胞死の調節に役割を果たす可能性があります。
HCNチャネル(過分極および環状ヌクレオチドゲート型)またはHチャネルは、K⁺チャネルと構造的に関連する非選択的陽イオンチャネルです。これらのチャネルは、黒質や腹側被蓋野のドーパミン作動性ニューロンを含む特定のニューロンで高い発現を示し、これらの細胞は運動行動、覚醒、注意、報酬、動機付け、および嗜癖に関与しています。H電流は静止膜電位とペースメーカー発火に寄与し、一部の錐体細胞の樹状突起で発現され、そこでシナプス入力の調節に役立ちます。HCNチャネルは、過分極した電圧で活性化し、脱分極で閉じるという点でKirチャネルに似ています。HCNチャネルはK⁺とNa⁺の両方に透過性である点で異なり、静止電位に近い膜電位で脱分極電流を提供します。Hチャネルはニューロンの膜電位を安定させ、細胞を脱分極または過分極させる変化に抵抗するのに役立ちます。抗けいれん薬および気分安定薬であるラモトリギンは、その作用メカニズムの1つとして錐体細胞の樹状突起Hチャネルを活性化し、解離性麻酔薬および抗うつ薬であるケタミンは、その臨床効果の一部に関連する濃度でこれらのチャネルをブロックします。HCNチャネルはKirチャネルとは構造的に異なりますが、6つの膜貫通領域、S4電圧センサー、および再進入Pループを持つ他の電位活性化チャネルに似ています。Hチャネルはカルボキシ末端の近くに細胞内環状ヌクレオチド結合ドメインを持ち、環状AMPの結合がチャネルゲーティングの電圧範囲をシフトさせます。
上記に記述されたK⁺チャネルは、2つまたは6つの膜貫通領域と単一のPループを持っています。もう1つのクラスは、4つの膜貫通領域と2つのPドメインを持っています(図1.5-7を参照)。これらのタンデムポア(K2p)チャネルは、脳と末梢に広く発現されており、少なくとも部分的には、静止膜電位の確立に役立つリークコンダクタンスとして機能します。これらのサブユニットは機能的な二量体を形成し、このファミリーの18のメンバーが同定されています。K2pチャネルは、電気的特性や活性化刺激(例:神経伝達物質、セカンドメッセンジャー、アラキドン酸、酸、熱、伸展)に対する感受性において多様です。機能的なチャネルは、最初にクローン化されたTWIK(タンデムポア弱内向き整流K⁺)チャネルに基づいて様々な名称が付けられています。例えば、TWIK関連アラキドン酸感受性K⁺チャネルはTRAAKと呼ばれ、酸感受性チャネルはTASKと呼ばれます。このクラスのチャネルは、特定の揮発性麻酔薬や抗けいれん薬(リルゾール)によって活性化されます。
前述のように、TWIKファミリーのメンバーは、酸性pH、熱、機械的活動を含む多数の新規な刺激によって活性化されます。ASIC(酸感受性イオンチャネル)と呼ばれる別のクラスのチャネルも、これらの刺激に応答します。ASICは、2つの膜貫通ドメインを持ち、ドメイン間に明らかな再進入ループがあります。少なくとも9つの哺乳類ファミリーメンバーが5つのサブファミリーに分類され、同定されています。TWIKとは異なり、ASICは電圧非感受性の非選択的陽イオンチャネルであり、K⁺よりもNa⁺に透過性が高く、Ca²⁺には最も透過性が低いです。ASICは機能的な三量体を形成すると考えられており、触覚、熱覚、味覚、痛覚を含む末梢感覚処理に関与し、また、海馬と扁桃体における特定の長期シナプス可塑性にも寄与し、そこでは恐怖関連学習に関与しています。

