1.7 生体アミン神経伝達物質
ジョン・D・エルスワース、Ph.D.
生体アミン神経伝達物質は、カテコールアミン(ドーパミン、ノルエピネフリン、エピネフリン)とセロトニン(5-ヒドロキシトリプタミン、5HT)、ヒスタミン、アセチルコリンから構成されます。これらのメッセンジャーが中枢神経系(CNS)機能にとって重要であることは、認知、記憶、動機付け、運動機能、覚醒においてこれらのシステムが果たす重要な役割に反映されており、精神医学との関連性は、複数の疾患の病態生理学および薬理学的治療への関与によって実証されています。
これらの神経伝達物質は、CNSにおいて非典型的かつ機能的に重要な組織を持っています。その細胞体は中脳、脳幹、前脳基底、視床下部の比較的少数の核に限定されていますが、その軸索は広範囲に投射しており、一部の生体アミン伝達システムは他のものよりも複雑な地形的配置を示しています。この広範な影響は、これらの神経伝達物質のそれぞれが、CNS全体の多様な回路における活動を、時には協調的な方法で変調することを可能にします。この解剖学的組織は、これらの神経伝達物質が神経精神疾患において発揮する正確な分子、細胞、およびシステムレベルの貢献を解読する上で大きな課題を提起します。ゲノミクスにおける進歩は、モノアミン作動性神経伝達を調節する多数の遺伝子(例えば、これらの神経伝達物質の合成、細胞作用、および細胞再取り込みをそれぞれ媒介する酵素、受容体、トランスポーターなど)の同定によって例示されるように、これらの神経伝達物質システムの複雑さに対する洞察を明らかにしました。ヒト遺伝学研究は、特定のモノアミン関連遺伝子における対立遺伝子バリアントと精神疾患およびパーソナリティ特性との間に興味深い関連性があるという証拠を提供してきました。一方、実験動物における遺伝子機能および細胞活動を改変する能力は、行動プロセスの媒介における特定の遺伝子および神経経路の役割を明確にしました。
本章では、各生体アミン伝達物質を「ライフサイクル」の詳細、具体的には伝達物質の合成、分解、およびトランスポーターに特化した酵素とトランスポーターの詳細とともに個別に考察します。これらの記述には、伝達物質特異的受容体も含まれています。なぜなら、最終的に生体アミン伝達物質がCNS機能と行動に与える影響は、受容体分子との相互作用に依存するからです。生体アミンがこれらの形質膜タンパク質に結合すると、神経細胞の興奮性を調節する一連の細胞内イベントが開始されます。トランスポーターとは異なり、各生体アミン伝達物質には複数の受容体サブタイプが存在します。神経伝達物質受容体は、以下の2つの基本的なメカニズムのいずれかによって細胞内効果を生み出します。(1) 受容体(GPCR)を細胞内エフェクターシステムに結合させるGタンパク質との相互作用、および (2) 伝達物質が結合したときにイオンが流れるチャネル(リガンド依存性イオンチャネル)の提供。本章で取り上げる神経伝達物質受容体は、セロトニン5-HT3受容体サブタイプとコリン作動性ニコチン受容体を除いて、すべてGPCRのスーパーファミリーに属しています。しかし、各神経伝達物質受容体グループ内では、サブタイプは相互作用するGタンパク質や誘発するセカンドメッセンジャー効果に関して不均一です。受容体はまた、脳内での発現の領域パターン、神経伝達物質結合親和性、およびシナプス局在においても多様です。多くの受容体サブタイプはシナプス後膜にのみ存在しますが、他の受容体はシナプス前にも存在し、一部はシナプス前とシナプス後の両方に存在します。そのニューロンによって放出された伝達物質に応答するシナプス前終末の受容体集団は「自己受容体」として知られており、シナプス内の伝達物質濃度を調節するために(「局所フィードバック抑制」)、神経伝達物質の放出を阻害する作用を持つことがよくあります。特定の伝達物質の受容体が、異なる伝達物質を発現するニューロンの終末に位置する場合、それは「ヘテロ受容体」と呼ばれ、その活性化は伝達物質の放出を増加または減少させる可能性があります。
個々の神経伝達物質受容体サブタイプの位置と機能を決定するために多くの努力が払われてきました。選択的なアゴニストおよび拮抗薬の入手可能性が限られていることがこの努力を妨げていますが、遺伝子操作と標的遺伝子編集における最近の進歩は、神経科学と薬理学の分野を大幅に進歩させています。動物におけるそのような研究は、受容体機能と、非特異的薬物の作用に対する各受容体の寄与に関する手がかりを提供します。近い将来、生体アミン伝達をより洗練された方法で変化させることによって治療効果を達成する受容体サブタイプ選択的化合物の開発が期待されています。
ドーパミンとノルエピネフリン
ドーパミンの解剖学と機能
脳内にはいくつかの異なるドーパミン作動性ニューロン集団が同定されており、A8-A16群に分類されています。脳内のドーパミン作動性神経支配の大部分は、中脳(中脳)の2つの細胞体クラスター、**黒質(A9)と腹側被蓋野(VTA、A10)**から発生する長い投射ニューロンによって提供されます。黒質からのニューロンは、**背側線条体(尾状核と被殻)に高密度の入力を提供する一方、VTAからの投射は、皮質領域(例:前頭前野と帯状皮質)に加えて、主に辺縁系領域(例:側坐核と中隔)**を標的とします。ただし、線条体、辺縁系、皮質のドーパミンシステムにそれぞれ起因するとされる運動、動機付け、認知行動を完全に分離することは不可能であることも留意すべきです。
背側線条体ドーパミン伝達の機能不全は、パーキンソン病や遅発性ジスキネジアなどの運動障害と強く関連しています。パーキンソン病の主要な兆候(運動低下、硬直、振戦)は、線条体のドーパミン作動性神経支配の喪失に起因します。遅発性ジスキネジア(反復性の不随意運動)は、ドーパミン受容体をブロックする特定の抗精神病薬の高用量または長期曝露後に発生する可能性があります。黒質線条体ドーパミンニューロンは、単に運動行動を可能にするだけでなく、行動の選択と開始、および運動技能と習慣の確立においても重要な役割を果たします。
黒質線条体ドーパミンニューロンの独特な特徴は、その終末の複雑な樹状突起形成です。これは、各ヒト黒質線条体ドーパミンニューロンに100万を超える線条体シナプスが関連しているという推定によって示されており、これは他のタイプのニューロンの少なくとも2桁大きいものです。この大規模な構造は、その軸索の非ミエリン化された性質と相まって、黒質線条体ドーパミンニューロンに驚異的なエネルギー需要を課し、おそらくさまざまな生化学的、環境的、および薬理学的攻撃に対するそれらの特定の感受性の重要な要因となっています。
VTAから発生し、前頭前野に終末を持つドーパミンニューロンは、実行機能において重要な役割を果たします。実行機能とは、注意の指示、作業記憶、課題目標の維持、意思決定、柔軟な思考、自制心などの一連の精神機能です。側坐核などの辺縁系領域に神経支配を持つドーパミンニューロンは、報酬、注意、薬物誘発性運動に加えて、目標指向的(動機付けされた)行動に強く関与しています。中脳辺縁系システムにおけるドーパミン伝達の増強は、乱用される精神刺激薬への反復曝露の強化効果および感作効果、ならびにストレスと関連付けられています。しかし、腹側線条体ドーパミン放出の鈍化は、確立された依存症と関連しており、禁断期間中の渇望を引き起こす神経適応的変化に寄与する可能性があります。トゥレット症候群および注意欠陥多動性障害(ADHD)は、主にドーパミン作動性薬物の症状治療における成功に基づいて、辺縁系および皮質領域におけるドーパミン作動性神経伝達の機能不全と関連付けられています。
統合失調症の最も古い信頼できる神経化学的仮説は、この疾患が線条体および辺縁系領域における過剰なドーパミン活性に関連していると提唱しました。その後、統合失調症の精神病症状は背側/連合線条体ドーパミン放出の増加と関連している一方、陰性症状および認知機能障害は皮質および腹側/辺縁系線条体ドーパミン放出の減少と関連していることが示されました。ドーパミンが統合失調症の病態生理に関与しているという確固たる証拠がありますが、必ずしもその根本原因ではありません。むしろ、ドーパミンシステムは、環境的、遺伝的、またはその両方である、疾患の症状につながる多種多様な素因の共通の最終経路として機能していると考えられます。
中脳の黒質およびVTAより前方には、ドーパミン作動性細胞体のいくつかの比較的小さなグループがあります。これらのうち最も顕著なものは、視床下部の弓状核に位置し、正中隆起に投射する漏斗下垂体ドーパミンニューロンです。これらのニューロンから放出されるドーパミンは循環に入り、前下垂体に輸送され、そこで前下垂体からのプロラクチン放出を抑制します。下垂体のドーパミン受容体をブロックする抗精神病薬は、血中プロラクチンレベルの増加を誘発します。
電気生理学的研究は、ドーパミン細胞が、おそらく興奮性入力と抑制性入力のバランスの変化の結果として、単一スパイク発火またはバースト発火の2つの異なるモードで発火することを示しています。細胞がこれらのレベル間を切り替えることができるため、活動の移行は、受容細胞に対するドーパミン神経伝達の影響を変化させるメカニズムである可能性があります。バースト活動はペースメーカー活動よりも活動電位あたりの終末ドーパミン放出が多く、興味深いことに、バーストパターンでの中脳皮質ニューロンの刺激は、ドーパミンと共局在するペプチドであるニューロテンシンの両方のトーニックな刺激よりも大きな放出をもたらします。ドーパミンニューロンの異なる発火速度は、脳内の異なる応答をコードしている可能性があります。最速のスケールでは、バースト発火により、ドーパミンニューロンは報酬を信号したり、報酬が予測とどの程度異なるかを指示したりすることができます。最も遅い時間スケールでは、ドーパミンニューロンのペースメーカー活動は、パーキンソン病で欠損しており、ドーパミン補充療法によって回復できる、さまざまな運動、認知、および動機付けプロセスに対するトーニックな有効化機能と関連付けられています。最近のデータは、ドーパミン神経伝達の相性モードとトーニックモードが連続体として機能し、ポストバーストの細胞外ドーパミンの上昇が持続してドーパミンのトーニック機能を働かせることができることを示しています。このような説明は、動機付けおよび認知機能における両方のタイプのドーパミンシグナル伝達の必要性と一致しています。
脳および下垂体におけるドーパミンシステムに加えて、ドーパミンは末梢において限定的ではあるが重要な役割を果たしています。末梢ドーパミンニューロンの最も明確に定義された作用は、ナトリウム恒常性の腎臓制御にあり、この制御の障害が一部の症例における高血圧の発症の根底にある可能性があります。脳外におけるドーパミンのもう一つの重要な機能は網膜にあり、ドーパミン含有アマクリン細胞が高視力、明順応視覚、および光受容体結合を調節しています。
ノルエピネフリンの解剖学と機能
脳内のノルアドレナリン作動性ニューロンの異なる集団は、A1-A7と指定されています。脳内の広範なノルアドレナリン作動性神経支配は、主に橋の一部である青斑核(LC、A6)に位置する小さなニューロンクラスターと、中脳の一部である外側被蓋野におけるより拡散したグループから派生しています。これらの2つの集団は、事実上すべての脳領域に入力を行い、LCニューロンは主に前脳、視床、小脳、脊髄を標的とし、外側被蓋ニューロンは主に視床下部と前脳基底部に線維を送ります。ノルアドレナリン作動性神経支配の珍しい特徴は、単一のニューロンが通常、いくつかの脳領域を神経支配することです。LCノルアドレナリン作動性ニューロンは、短期間のバースト発火と交互に発生するトーニック発火という異なる活動モードを示します。トーニック活動の増加は行動の柔軟性と関連しており、一方、相性モードは覚醒刺激と関連しています。LCノルアドレナリン作動性ニューロンが、覚醒、警戒、注意、作業記憶、および交感神経系の調節において重要な役割を果たすという十分な証拠があります。
エピネフリンの解剖学と機能
交感神経系および副腎髄質において、エピネフリンはノルエピネフリンと最終神経伝達物質の役割を共有しており、この重複の割合は種に依存し、ホルモンによって修飾されます。脳内の比較的少数のエピネフリン含有細胞は、ほとんどが延髄に存在します。これらのニューロンは、延髄のC1、C2、C3領域に優勢であり、LC、背側縫線核、側坐核を含む様々な脳幹および前脳構造に軸索を送り、視床下部のサブ領域に神経支配を提供します。
ドーパミン、ノルエピネフリン、エピネフリンのライフサイクル
合成
これらの3つのカテコールアミン神経伝達物質は、共通の合成経路を共有しています(図1.7-1)。食事性タンパク質およびフェニルアラニン代謝由来の血中チロシンは、大型中性アミノ酸(LNAA)輸送システムによって脳に入ります。脳細胞外液中のチロシンは、高親和性アミノ酸トランスポーターによってカテコールアミンニューロンに取り込まれます。細胞質における最初の反応では、チロシンは酵素チロシンヒドロキシラーゼによってL-ドーパに変換されます。このステップは律速段階であるため、チロシンからドーパミンへの変換速度を決定し、この反応を生理学的調節および薬理学的操作に対して最も感受性の高いものにします。チロシンヒドロキシラーゼは補因子としてテトラヒドロビオプテリンを必要とし、テトラヒドロビオプテリンの合成自体は別の酵素GTPシクロヒドロラーゼ-1の活性に依存しています。カテコールアミン合成における次の反応は、細胞質における芳香族アミノ酸脱炭酸酵素(AADC)によるL-ドーパの脱炭酸であり、ドーパミンを形成します。AADCはL-ドーパを非常に熱心に脱炭酸するため、正常条件下では脳内のこのアミノ酸のレベルは非常に低いです。L-ドーパは、疾患を特徴付ける欠乏した線条体ドーパミンレベルを回復させるため、パーキンソン病の治療に用いられる主要な薬剤です。外因性L-ドーパをニューロンに供給することで、AADCにのみ依存し、ドーパミン生合成の律速段階であるチロシンヒドロキシラーゼを迂回するため、ドーパミンへの効率的な変換が保証されます。血液脳関門(BBB)を通過しないAADC阻害薬(例:カルビドーパまたはベンセラジド)は、L-ドーパの末梢脱炭酸を阻害してドーパミンにするために、パーキンソン病患者にレボドーパとともに日常的に投与されます。これにより、異常に高い循環ドーパミンレベルに起因する末梢性副作用が軽減されます。過剰な循環ドーパミンの顕著な副作用の1つは、BBB外の領域である最後野におけるドーパミン受容体の活性化に起因する嘔吐です。実際、D2拮抗薬(例:プロメタジン[フェネルガン])は、広く使用されている制吐剤のクラスです。しかし、ドーパミン拮抗薬はパーキンソン病様の副作用を誘発する傾向があるため、**5HT3拮抗薬(例:オンダンセトロン[ゾフラン])やニューロキニン-1受容体拮抗薬(例:アプレピタント[イメンド])**などの代替薬が、化学療法や手術後に発生する悪心や嘔吐の制御のためにますます使用されています。
ノルエピネフリンニューロン、および副腎髄質のクロム親和細胞では、ドーパミンをノルエピネフリンに変換できる追加の酵素、ドーパミン-β-ヒドロキシラーゼ(DBH)が存在します。この酵素は貯蔵小胞内に濃縮されているため、他の反応とは異なり、ノルエピネフリン合成のこのステップは細胞質では起こりません。アルコール依存症の治療に使用される薬剤であるジスルフィラム(アンタビュース)はDBHの阻害剤です。しかし、アルコール依存症の治療におけるジスルフィラムの主要な関連特性は、エタノールから生成されるアセトアルデヒドを代謝する酵素であるアセトアルデヒド脱水素酵素をブロックすることであり、これによりエタノール摂取後に中等度から重度の有害作用を誘発する高レベルのアセトアルデヒドがもたらされます。
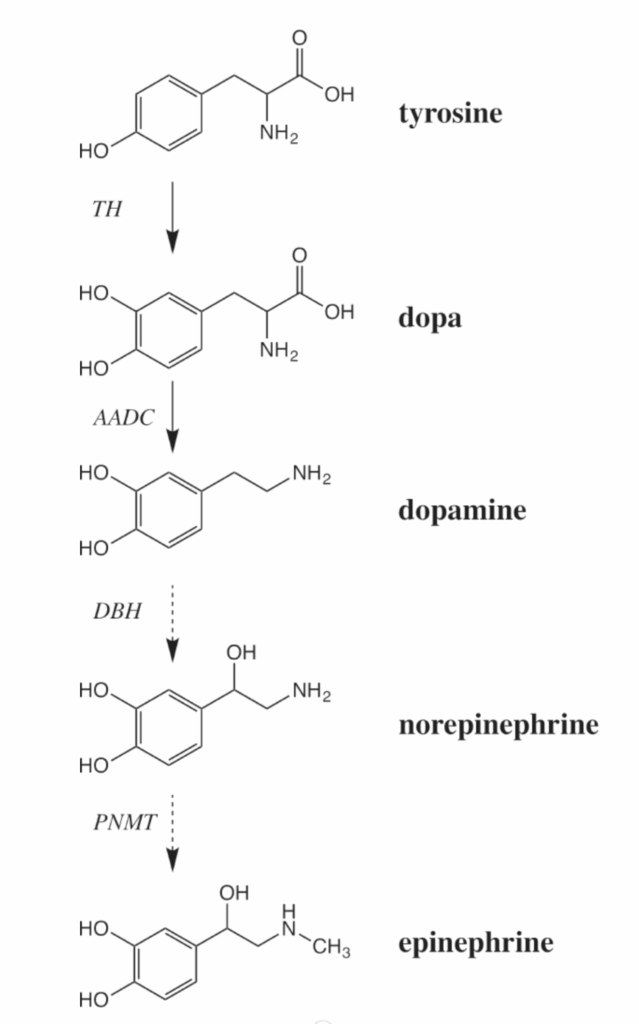
図1.7-1. ドーパミン、ノルエピネフリン、エピネフリンの生合成
カテコールアミン神経伝達物質は、食事性アミノ酸であるチロシンから始まる多段階合成によって産生されます。ドーパミンニューロンには、酵素THとAADCが含まれていますが、ノルエピネフリンニューロンはさらにDBHを発現しています。PNMTは、エピネフリンニューロンにのみ存在する追加の酵素です。AADC:芳香族アミノ酸脱炭酸酵素、DBH:ドーパミン-β-ヒドロキシラーゼ、PNMT:フェノール-N-メチルトランスフェラーゼ。
中心のエピネフリンニューロン、および副腎髄質と心臓のエピネフリンニューロンでは、ノルエピネフリンは酵素**フェニルエタノールアミン-N-メチルトランスフェラーゼ(PNMT)**によってN-メチル化され、エピネフリンを形成します。PNMTは細胞質に位置するため、ノルエピネフリンは貯蔵小胞から出てエピネフリンに変換されてから、小胞に輸送し戻される必要があります。PNMTとのこの反応は、おそらくノルエピネフリンが小胞から細胞質に自然に漏出するとき、またはノルエピネフリンがシナプスに放出され、細胞質に再取り込みされた後に起こると考えられます。
**フェニルケトン尿症(PKU)**は、フェニルアラニン水酸化酵素遺伝子の変異によって引き起こされる稀な遺伝性疾患で、機能不全の酵素が産生され、循環するフェニルアラニンの代謝が妨げられます。これは、フェニルアラニンの食事摂取を制限する措置が講じられない限り、重度の精神遅滞につながる可能性があります。
小胞性トランスポーター
シナプス前終末に存在する小胞は、カテコールアミンの取り込みと貯蔵に特化しており、ミトコンドリアに存在する酵素**モノアミンオキシダーゼ(MAO)**による伝達物質の分解から保護します。小胞内へのカテコールアミン伝達物質の蓄積と濃縮は、**小胞モノアミントランスポーター(VMAT)**によって行われます。この隔離はアンフェタミン様薬物によって妨げられ、小胞貯蔵から細胞質への伝達物質の動員につながり、細胞外コンパートメントへの放出に利用可能な濃度が増加します。VMATには2つの形態があり、VMAT-2は主に中枢神経系、末梢神経系、腸管神経系の神経細胞に局在し、VMAT-1は副腎髄質のクロム親和細胞などの神経外組織で発現しています。
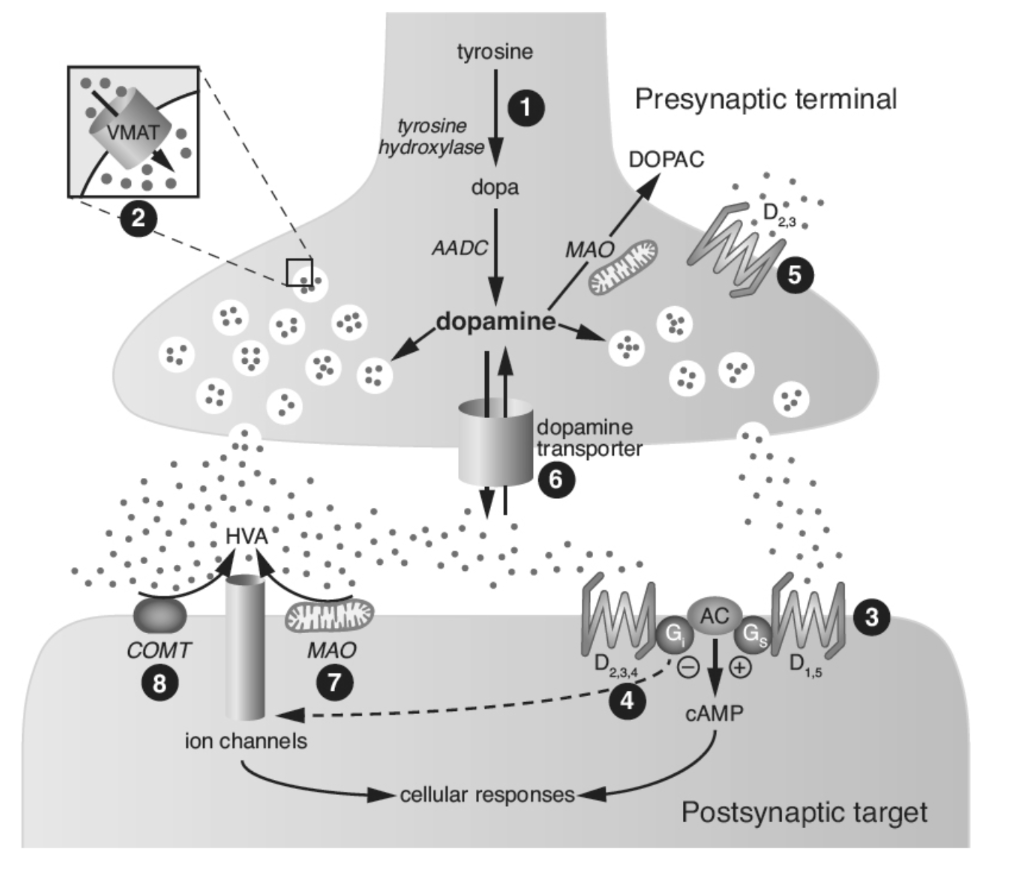
図1.7-2. ドーパミン作動性シナプスの模式図と薬物作用部位
部位1:競争的阻害剤であるα-メチルチロシンによってブロックされるチロシンヒドロキシラーゼ反応。L-ドーパの投与はドーパミンレベルを増強し、パーキンソン病の主要な治療法です。カルビドーパは血液脳関門を通過しないAADCの阻害剤であり、L-ドーパの末梢性副作用を軽減するためにパーキンソン病の治療においてL-ドーパと併用されます。部位2:VMATは細胞質ドーパミンを貯蔵小胞に輸送し、その細胞質濃度を低下させ、ミトコンドリアモノアミンオキシダーゼによる代謝を妨げます。レセルピンはVMATを阻害し、ドーパミン貯蔵を枯渇させます。テトラベナジンも取り込み貯蔵メカニズムを妨げ、多動性運動障害の治療に用いられています。部位3および4:放出されたドーパミンは、シナプス後D1様受容体(部位3)およびD2様受容体(部位4)と相互作用することができます。ブロモクリプチン(パーロデル)およびアポモルヒネ(アポキン)はパーキンソン病の治療に用いられるD2アゴニストです。プラミペキソール(ミラペックス)はパーキンソン病およびむずむず脚症候群の治療に用いられるD3アゴニストです。アリピプラゾール(エビリファイ)は抗うつ薬として用いられる部分D2アゴニストです。すべての抗精神病薬はある程度D2受容体をブロックします。部位5:ドーパミンと自己受容体との相互作用はドーパミンの合成と放出を調節します。低用量のアポモルヒネは実験的に自己受容体アゴニストとして用いられています。部位6:形質膜トランスポーターはシナプスドーパミンを再取り込みします。乱用薬物であるコカインはドーパミントランスポーターを阻害し、アンフェタミンはトランスポーターを介してドーパミン放出を増加させます。部位7:シナプス前終末外に存在するMAOは放出されたドーパミンを代謝することができます。セレギリン(エルデプリル)はパーキンソン病の治療に用いられるMAO-B阻害剤です。部位8:ドーパミンはCOMTの基質であり、COMTはトルカポンとエンタカポンによって阻害される酵素であり、これらはパーキンソン病の治療に用いられます。AADC:芳香族アミノ酸脱炭酸酵素、AC:アデニル酸シクラーゼ、cAMP:サイクリックAMP、COMT:カテコール-O-メチルトランスフェラーゼ、D1-5:ドーパミン受容体サブタイプ、DOPAC:ジヒドロキシフェニル酢酸、G:Gタンパク質、HVA:ホモバニリン酸、MAO:モノアミンオキシダーゼ、VMAT:小胞モノアミントランスポーター。(Nestler E, Hyman S, Holtzman D, Malenka R. Molecular Neuropharmacology. McGraw-Hill Companies, Inc; 2015より改変。)
ドーパミン形質膜トランスポーター
高親和性ドーパミントランスポーター(DAT)は、放出されたドーパミンを再取り込みし、シナプスにおけるドーパミンの濃度と作用を制限する役割を果たします(図1.7-2)。重要なことに、線条体と側坐核のドーパミンニューロンは高密度のDATを備えているため、この部位を標的とし、その作用を阻害する薬物に特に感受性が高いです。例えば、コカインによる側坐核におけるドーパミン再取り込みのブロックは、この領域におけるドーパミンの作用を延長・強化し、その薬物の陶酔効果の鍵となります。同様に、アンフェタミンとメタンフェタミンは、ドーパミン再取り込みをブロックし、ドーパミン放出を増加させることによって、側坐核におけるドーパミンシグナル伝達を増幅させます。VTA-側坐核経路は、食物、性、および多くの乱用薬物など、あらゆる種類の強化刺激によって活性化される脳の報酬経路の一部です。シナプスドーパミン濃度を急速に増加させる薬物は中毒性がある可能性がありますが、これらの薬剤の一部(例:メチルフェニデート、アンフェタミン)はADHDの治療に低用量で使用されており、ドーパミンおよびノルエピネフリントランスポーター(NET)への作用、およびそれに続く伝達物質と自己受容体との相互作用によって有益な効果を達成している可能性があります。自己受容体は通常、シナプス後受容体を活性化するために必要な濃度よりも低い濃度のアゴニストに敏感です。**リスデキサンフェタミン(バイバンセ)**は、血液中で活性D-アンフェタミンに加水分解される長時間作用型経口プロドラッグであり、ADHDの治療に承認されています。DATはまた、パーキンソン病の神経毒である6-ヒドロキシドーパミンおよび1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)がトランスポーターの基質であるため、ドーパミンニューロンへのアクセスも提供します。
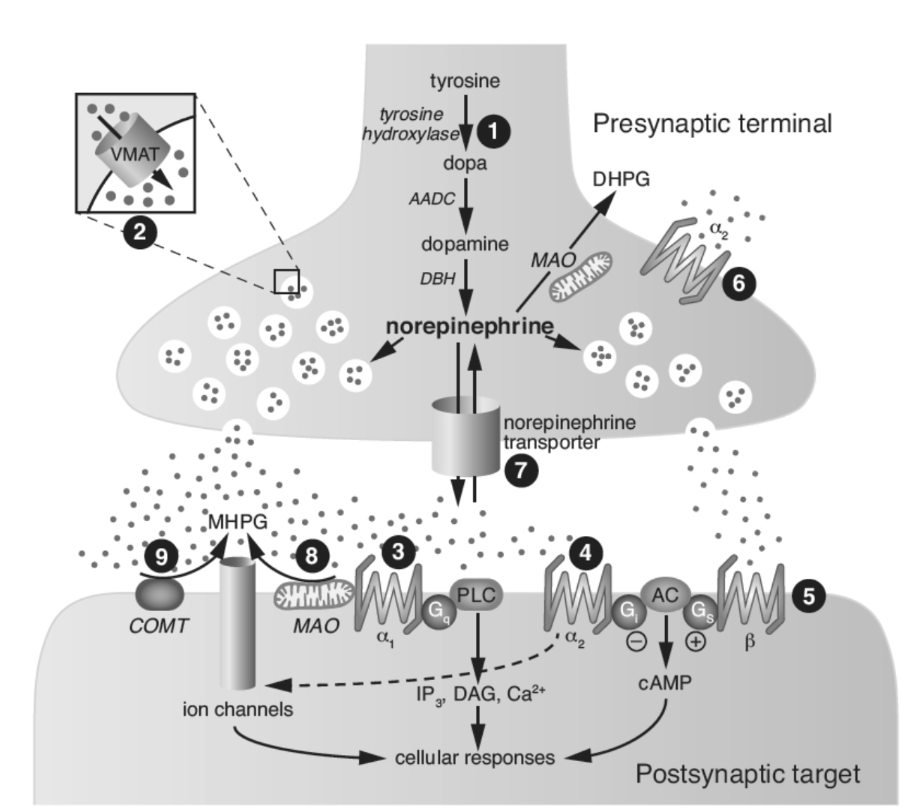
図1.7-3. 中枢ノルエピネフリンシナプスの模式図と薬物作用部位
部位1:チロシンは能動輸送機構によってシナプス前終末に取り込まれ、一連の酵素反応によってNEに変換されます。競合阻害剤であるα-メチルチロシンはチロシンヒドロキシラーゼ反応をブロックします。DBH反応はジスルフィラムによって阻止されます。部位2:ノルエピネフリンは細胞質から取り込まれ、VMAT-2によって貯蔵小胞に輸送されます。レセルピンはVMATを阻害し、ノルエピネフリン貯蔵を枯渇させます。この薬はかつて降圧作用のために広く処方されていました。テトラベナジンも取り込み・貯蔵機構を妨害し、過運動性運動障害の治療に用いられてきました。部位3、4、5:放出後、ノルエピネフリンは2つのカテゴリーのGタンパク質共役型アドレナリン受容体、α1およびα2(部位3および4)、ならびにβ(部位5)と相互作用することができます。アドレナリン受容体の大部分はシナプス後に局在し、シナプス後ニューロンの細胞応答を媒介します。プロプラノロール(インデラル)はβ-アドレナリン受容体の拮抗薬であり、舞台恐怖症や高血圧の治療に用いられます。α1-受容体(部位3)はプラゾシン(ミニプレス)によって阻害されます。プラゾシンは降圧薬として用いられますが、PTSDの治療に用いられる抗不安作用も持ちます。部位6:神経終末に局在するα2-自己受容体はノルエピネフリンの合成と放出を調節し、一方、細胞体および樹状突起のα2-自己受容体はインパルスフローを調節します。クロニジン(カタプレス)およびグアンファシン(イントゥニブ)の低用量はこれらの部位のアゴニストです。α2-アゴニストはオピオイド離脱症状、トゥレット症候群、および高血圧の治療に用いられます。ヨヒンビンはこの受容体部位の拮抗薬です。部位7:ノルエピネフリンのシナプス作用は、ノルエピネフリン形質膜トランスポーターによるシナプス前終末への再取り込みによって終結します。デシプラミン(ノルプラミン)などの三環系抗うつ薬は、この取り込み機構の阻害剤です。アトモキセチン(ストラテラ)などのNETに選択的な新しい抗うつ薬や、デュロキセチン(サインバルタ)などのSNRIも使用されています。部位8:ノルエピネフリンはMAOによって代謝され、MAO-Aの優先的な基質です。MAO-A阻害薬はノルエピネフリンの代謝をブロックし、この作用がその抗うつ特性に寄与している可能性があります。非可逆的非選択的阻害薬の例としては、イソカルボキサジド、フェネルジン、トランシルシプロミンが挙げられます。モクロベミドはMAO-Aを可逆的に阻害します。部位9:ノルエピネフリンはCOMTによっても代謝され、COMTはトルカポン(タスマー)およびエンタカポン(コムタン)によって阻害される酵素であり、これらはパーキンソン病の治療に用いられます。MAOとCOMTの複合作用により、主要な脳ノルエピネフリン代謝物であるMHPGが産生されます。αおよびβ:ノルエピネフリン受容体サブタイプ、AADC:芳香族アミノ酸脱炭酸酵素、AC:アデニル酸シクラーゼ、cAMP:サイクリックAMP、COMT:カテコール-O-メチルトランスフェラーゼ、DAG:ジアシルグリセロール、DBH:ドーパミン-β-ヒドロキシラーゼ、DHPG:3,4-ジヒドロキシフェニルグリコール、G:Gタンパク質、IP3:イノシトールトリホスファート、MAO:モノアミンオキシダーゼ、MHPG:3-メトキシ-4-ヒドロキシフェニルグリコール、SNRI:セロトニン・ノルエピネフリン再取り込み阻害薬、VMAT:小胞モノアミントランスポーター。(Nestler E, Hyman S, Holtzman D, Malenka R. Molecular Neuropharmacology. McGraw-Hill Companies, Inc; 2015より改変。)
ノルエピネフリン形質膜トランスポーター
NETはすべてのノルアドレナリン作動性ニューロンに存在し、シナプスに放出された神経伝達物質のほとんどを効率的に再取り込みします(図1.7-3)。精神刺激薬(例:コカインやアンフェタミン)がDATに与える影響に加えて、これらの薬物はNETとも相互作用し、NEのシナプス作用を強めます。特定の抗うつ薬のメカニズムにはNETのブロックが含まれ、これには三環系抗うつ薬(TCA)や、デュロキセチン(サインバルタ)やベンラファキシン(エフェクサー)などのより特異的なセロトニン・ノルエピネフリン再取り込み阻害薬(SNRI)、ブプロピオン(ウェルブトリン)などのノルエピネフリン・ドーパミン再取り込み阻害薬(NDRI)、そしてマプロチリンやアトモキセチン(ストラテラ)などの**選択的ノルエピネフリン再取り込み阻害薬(NRI)**が含まれます。アトモキセチンはADHDの治療にも用いられます。
ドーパミン取り込みに関する初期の研究のいくつかでは、ドーパミンがNETの良好な基質であることが明らかになりました。しかし、その重要性が認識されたのは比較的最近になってからです。線条体や側坐核のようなドーパミンニューロンが高密度のDATを発現する領域では、ノルエピネフリン神経支配が比較的まばらであり、ドーパミン取り込みは主にDATに依存します。対照的に、前頭前野のようなドーパミンニューロンが低レベルのDATを発現し、ノルエピネフリン神経支配が豊富な領域では、ドーパミン取り込みはNETに強く依存します。実際、NETによるドーパミンの非特異的取り込み、および/またはドーパミンがノルエピネフリン生合成の前駆体であるため、ノルアドレナリン作動性ニューロンによってドーパミンがノルエピネフリンと共放出される可能性があると示唆されています。
エピネフリン形質膜トランスポーター
エピネフリンに特異的なトランスポーターの証拠はなく、エピネフリン再取り込みを選択的にブロックする薬物も報告されていません。NETを選択的にブロックするすべての薬理学的薬剤は、エピネフリン取り込みも効果的に阻害します。したがって、エピネフリンに選択的なトランスポーターが存在する可能性は低いと考えられます。
代謝
カテコールアミンの代謝分解において重要な哺乳類の主要な酵素はMAOと**カテコールO-メチルトランスフェラーゼ(COMT)であり、これらの酵素のいずれもカテコールアミン代謝の最初のステップを触媒することができます。MAOはその基質を対応するアルデヒドに変換し、これらのアルデヒド中間体はアルデヒド脱水素酵素またはアルデヒド還元酵素によって急速に代謝されます。したがって、カテコールアミンは複数の代謝物を形成します。霊長類脳におけるドーパミンの主要な最終代謝物はホモバニリン酸(HVA)ですが、げっ歯類脳では3,4-ジヒドロキシフェニル酢酸(DOPAC)とDOPAC硫酸塩が優勢です。ノルエピネフリンの場合、霊長類脳では3-メトキシ-4-ヒドロキシフェニルグリコール(MHPG)が主要な最終代謝物ですが、げっ歯類脳では3,4-ジヒドロキシフェニルグリコール(DHPG)**とMHPGの両方が高濃度で存在し、両方の代謝物は主に硫酸抱合体です。末梢では、ドーパミンの主要な代謝物はHVAであり、ノルエピネフリンの場合、**バニルマンデル酸(VMA)**であり、両化合物のかなりの割合が硫酸またはグルクロン酸と抱合されます。
動物において、線条体、側坐核、前頭前野におけるドーパミン代謝物、DOPAC、HVAのレベルの短期的な変動が、それぞれ黒質線条体、中脳辺縁系、中脳皮質ドーパミン経路におけるインパルスフローの変化の有用な指標となることが十分に文書化されています。CSF中のドーパミン代謝物濃度の変化も、中枢ドーパミン作動性活動または中枢ドーパミンシステムの統合性の変化と関連付けられています。同様に、MPHGまたはDHPGの濃度の変化は、ノルエピネフリン機能の変化と相関しています。
MAO
この酵素はミトコンドリアの外膜に位置しています。2つのMAOアイソフォーム(A型とB型)は別々の遺伝子によってコードされており、基質特異性と選択的阻害剤に対する感受性によって区別されます。脳内では、MAO-Aはドーパミン作動性およびノルアドレナリン作動性ニューロンに優先的に局在し、MAO-Bはセロトニン作動性ニューロンおよびグリア細胞に存在する主要な形態です。ドーパミンとノルエピネフリンは両方の形態の有効な基質ですが、セロトニンはMAO-Aの優先的な基質です。セロトニン作動性ニューロンにおけるMAO-Bの優位性は、この伝達物質がMAO-Aのより良い基質であることを考えると、直感に反するように見えます。これは、セロトニン作動性ニューロンにおけるMAO-Bが、選択的なMAO-B基質であり、セロトニン取り込みと排出に影響を与える可能性のある「微量アミン」であるフェニルエチルアミンレベルを調節するのに役立つ可能性があるためです。2つの形態の代表的な阻害剤は、MAO-Aにはクロルギリン、MAO-Bにはセレギリン(旧称デプレニル)です。**セレギリン(エルデプリル)またはラサギリン(アジレクト)**は不可逆的MAO-B阻害剤であり、**サフィナミド(ザダゴ)**は可逆的MAO-B阻害剤であり、パーキンソン病の治療に、通常L-ドーパと組み合わせて、L-ドーパから生成されるドーパミンの効果を延長または増強するために使用されます。
COMT
COMTには、膜結合型と可溶型の2つのアイソフォームがあります。膜結合型COMTはCNSで発見される主要な形態であり、カテコールアミンに対する親和性が高く、主にニューロンに局在しています。可溶型はカテコールアミンに対する親和性が低く、末梢で発現する主要な形態ですが、CNSグリア細胞にも存在します。2つのCOMT阻害剤、トルカポンとエンタカポンは、L-ドーパの代謝を遅らせ、その効果を延長し、L-ドーパの必要量を減らすために、パーキンソン病の治療においてL-ドーパの補助薬として使用されます。
臨床および前臨床研究から蓄積された証拠は、DATの不足のためか、前頭前野におけるドーパミン代謝において、COMTが線条体などの他の領域よりもより重要な役割を果たしていることを示しています。前頭皮質におけるCOMTの役割のもう一つの興味深い側面は、COMT遺伝子に酵素のin vivo活性に影響を与える多型(Val158Met)が含まれているという発見です。Met158ホモ接合体はVal158ホモ接合体と比較して前頭前野のCOMT酵素活性が約3分の1低く、これは対立遺伝子によるドーパミン代謝速度の変化と一致します。COMT Val158Met多型は、報酬応答性、報酬探索、認知能力、ストレス処理など、さまざまな表現型と関連付けられています。ただし、前頭前野におけるドーパミン作動性伝達と認知のような行動との関係は逆U字型曲線で表され、最適以下のドーパミン活性も最適以上のドーパミン活性もパフォーマンスを損なうことに留意すべきです。
ドーパミン受容体
ドーパミンの生理学的作用は、5つの異なるが密接に関連するGPCRによって媒介されます。それらの構造、薬理学、および主要なエフェクターメカニズムに基づいて、それらは**D1様(D1およびD5)とD2様(D2、D3、D4)**ドーパミン受容体としてグループ化されます(図1.7-2)。D1様ドーパミン受容体はGsファミリーのGタンパク質を活性化し、アデニル酸シクラーゼ活性を増加させ、ドーパミン受容性細胞のシナプス後に見られます。D2様ドーパミン受容体(D2、D3、D4)はGiファミリーに結合し、アデニル酸シクラーゼ活性を阻害し、ドーパミン受容性細胞のシナプス後とドーパミン作動性ニューロンのシナプス前の両方で発現します。
脳内では、D1ドーパミン受容体は、線条体、側坐核、前頭前野などの黒質線条体、中脳辺縁系、中脳皮質ドーパミンシステムに特に高密度で発現しています。対照的に、D2受容体は脳全体に比較的均等に分布しており、線条体と側坐核で最も高いレベルを示します。線条体と前頭前野におけるD1およびD2受容体を介したドーパミン伝達は、運動制御、報酬システム、および認知の多くの側面において不可欠な役割を果たします。D2遺伝子の選択的スプライシングにより、D2s(D2-short)とD2L(D2-long)と呼ばれる2つの主要なバリアントが生成されます。D2sは主にシナプス前で発現し、自己受容体機能に関与しているという証拠があり、D2Lは主にシナプス後アイソフォームです。D3ドーパミン受容体は分布パターンがより限定されており、側坐核の殻下位区分など、辺縁系領域で最も高い発現レベルが観察されます。一部のデータは、D3受容体がニューロンの発火速度、ドーパミンの合成と放出を調節するD2自己受容体の役割を補完するために自己受容体として機能できることを示唆しています。ドーパミン受容体の中で、D4サブタイプは脳内で最も低い発現レベルを示し、前頭前野、扁桃体、海馬、視床下部に分布しています。D5ドーパミン受容体は、前頭前野、視床下部、海馬を含む複数の脳領域で低レベルで発現しています。D1、D2、D4ドーパミン受容体は網膜にも存在します。視床下部-下垂体軸の調節におけるドーパミンの重要な役割は、下垂体におけるD2ドーパミン受容体の高い発現を説明します。末梢では、ドーパミン受容体のすべてのサブタイプが、腎臓、副腎、交感神経節、消化管(GI)管、血管、心臓において様々な割合で観察されています。
クロルプロマジンなどの一部の古い、いわゆる「定型」抗精神病薬はD1受容体とD2受容体の両方をブロックしますが、ハロペリドールのような他の薬物はD2受容体に選択的です。定型抗精神病薬は、パーキンソニズム、ジストニア、舞踏病様運動(遅発性ジスキネジア)を含む錐体外路系副作用を誘発しやすいです。「非定型」抗精神病薬は、当初、定型薬と比較して錐体外路系副作用のリスクが低いことによって定義され、機械論的には、これは伝統的にD2ドーパミン受容体と5HT2Aセロトニン受容体のブロックに関連付けられており、D1受容体にはほとんどまたは全く影響を与えません。非定型抗精神病薬は、定型抗精神病薬よりも統合失調症の認知症状と陰性症状を軽減するのに効果的であると考えられていますが、セロトニン受容体との相互作用が抗精神病効果を改善するのか、ドーパミン受容体遮断の望ましくない作用の一部を軽減するのかは明らかではありません。抗精神病薬の完全な有益な効果が現れるまでに数週間かかる場合があるため、治療メカニズムは単なるD2受容体部位の遮断以上のものを含んでいることが明らかです。抗精神病薬の追加の副作用は、ドーパミンを介したプロラクチン分泌調節の障害に起因する血清プロラクチン値の上昇です。高プロラクチン血症の結果には、月経不順、乳漏症、性機能不全、女性化乳房、不妊症、骨密度低下、そしておそらく乳がんが含まれます。リスペリドン(リスパダール)などD2受容体に対する親和性が特に高い非定型抗精神病薬は、高プロラクチン血症を誘発しやすいですが、アリピプラゾール(エビリファイ)、クロザピン(クロザリル)、オランザピン(ジプレキサ)、クエチアピン(セロクエル)、ジプラシドン(ジオドン)などD2への結合が少ない薬剤ではこの副作用は稀です。クロザピンは1959年に発見され、1970年代に初めて抗精神病薬として使用されましたが、錐体外路系副作用の可能性が低い治療抵抗性統合失調症と闘う上で依然として重要な役割を果たしています。現在の考えでは、クロザピンの複数の受容体での複合作用がその治療特性に関与している可能性があります。しかし、綿密なモニタリングを行っても、クロザピンで治療された患者の約0.4%が重篤な無顆粒球症を発症します。新しい抗精神病薬の中で、オランザピンはクロザピンに最も近い受容体プロファイルを持っています。体重増加と代謝症候群の誘発は、特にオランザピンを使用するいくつかの非定型薬の使用における中心的な課題であり、これらの副作用に対処するためにメトホルミンやサミドルファンなどの薬剤の併用が利用されています。
D2様アゴニストは、パーキンソン病の対症療法において重要な役割を果たします。このような薬物には、D2アゴニストであるアポモルヒネ、およびD3受容体に対して最高の親和性を持つD2様アゴニストであるプラミペキソール(ミラペックス)とロピニロール(レキップ)が含まれます。非選択的ドーパミンアゴニスト(例:ロチゴチン)も、むずむず脚症候群に加えて、パーキンソン病の症状の治療に用いられています。
歴史的に、GPCRは単量体として機能すると信じられていましたが、現在では、特定の生体アミン受容体が、同じ受容体ファミリーの他のメンバー、または構造的に異なる受容体ファミリーと直接相互作用してヘテロマー(例:D1-D2、D2-5HT2、D2-カンナビノイド受容体-1)を形成し、ユニークな機能特性を持つことが明らかになっています。ヘテロマーの薬理学的標的化は、細胞シグナル伝達の治療的操作のための新しい戦略を提供します。
ノルエピネフリン形質膜トランスポーター
NETはすべてのノルアドレナリン作動性ニューロンに存在し、シナプスに放出された神経伝達物質のほとんどを効率的に再取り込みします(図1.7-3)。精神刺激薬(例:コカインやアンフェタミン)がDATに与える影響に加えて、これらの薬物はNETとも相互作用し、NEのシナプス作用を強めます。特定の抗うつ薬のメカニズムにはNETのブロックが含まれ、これには三環系抗うつ薬(TCA)や、デュロキセチン(サインバルタ)やベンラファキシン(エフェクサー)などのより特異的なセロトニン・ノルエピネフリン再取り込み阻害薬(SNRI)、ブプロピオン(ウェルブトリン)などのノルエピネフリン・ドーパミン再取り込み阻害薬(NDRI)、そしてマプロチリンやアトモキセチン(ストラテラ)などの**選択的ノルエピネフリン再取り込み阻害薬(NRI)**が含まれます。アトモキセチンはADHDの治療にも用いられます。
ドーパミン取り込みに関する初期の研究のいくつかでは、ドーパミンがNETの良好な基質であることが明らかになりました。しかし、その重要性が認識されたのは比較的最近になってからです。線条体や側坐核のようなドーパミンニューロンが高密度のDATを発現する領域では、ノルエピネフリン神経支配が比較的まばらであり、ドーパミン取り込みは主にDATに依存します。対照的に、前頭前野のようなドーパミンニューロンが低レベルのDATを発現し、ノルエピネフリン神経支配が豊富な領域では、ドーパミン取り込みはNETに強く依存します。実際、NETによるドーパミンの非特異的取り込み、および/またはドーパミンがノルエピネフリン生合成の前駆体であるため、ノルアドレナリン作動性ニューロンによってドーパミンがノルエピネフリンと共放出される可能性があると示唆されています。
エピネフリン形質膜トランスポーター
エピネフリンに特異的なトランスポーターの証拠はなく、エピネフリン再取り込みを選択的にブロックする薬物も報告されていません。NETを選択的にブロックするすべての薬理学的薬剤は、エピネフリン取り込みも効果的に阻害します。したがって、エピネフリンに選択的なトランスポーターが存在する可能性は低いと考えられます。
代謝
カテコールアミンの代謝分解において重要な哺乳類の主要な酵素はMAOと**カテコールO-メチルトランスフェラーゼ(COMT)であり、これらの酵素のいずれもカテコールアミン代謝の最初のステップを触媒することができます。MAOはその基質を対応するアルデヒドに変換し、これらのアルデヒド中間体はアルデヒド脱水素酵素またはアルデヒド還元酵素によって急速に代謝されます。したがって、カテコールアミンは複数の代謝物を形成します。霊長類脳におけるドーパミンの主要な最終代謝物はホモバニリン酸(HVA)ですが、げっ歯類脳では3,4-ジヒドロキシフェニル酢酸(DOPAC)とDOPAC硫酸塩が優勢です。ノルエピネフリンの場合、霊長類脳では3-メトキシ-4-ヒドロキシフェニルグリコール(MHPG)が主要な最終代謝物ですが、げっ歯類脳では3,4-ジヒドロキシフェニルグリコール(DHPG)**とMHPGの両方が高濃度で存在し、両方の代謝物は主に硫酸抱合体です。末梢では、ドーパミンの主要な代謝物はHVAであり、ノルエピネフリンの場合、**バニルマンデル酸(VMA)**であり、両化合物のかなりの割合が硫酸またはグルクロン酸と抱合されます。
動物において、線条体、側坐核、前頭前野におけるドーパミン代謝物、DOPAC、HVAのレベルの短期的な変動が、それぞれ黒質線条体、中脳辺縁系、中脳皮質ドーパミン経路におけるインパルスフローの変化の有用な指標となることが十分に文書化されています。CSF中のドーパミン代謝物濃度の変化も、中枢ドーパミン作動性活動または中枢ドーパミンシステムの統合性の変化と関連付けられています。同様に、MPHGまたはDHPGの濃度の変化は、ノルエピネフリン機能の変化と相関しています。
MAO
この酵素はミトコンドリアの外膜に位置しています。2つのMAOアイソフォーム(A型とB型)は別々の遺伝子によってコードされており、基質特異性と選択的阻害剤に対する感受性によって区別されます。脳内では、MAO-Aはドーパミン作動性およびノルアドレナリン作動性ニューロンに優先的に局在し、MAO-Bはセロトニン作動性ニューロンおよびグリア細胞に存在する主要な形態です。ドーパミンとノルエピネフリンは両方の形態の有効な基質ですが、セロトニンはMAO-Aの優先的な基質です。セロトニン作動性ニューロンにおけるMAO-Bの優位性は、この伝達物質がMAO-Aのより良い基質であることを考えると、直感に反するように見えます。これは、セロトニン作動性ニューロンにおけるMAO-Bが、選択的なMAO-B基質であり、セロトニン取り込みと排出に影響を与える可能性のある「微量アミン」であるフェニルエチルアミンレベルを調節するのに役立つ可能性があるためです。2つの形態の代表的な阻害剤は、MAO-Aにはクロルギリン、MAO-Bにはセレギリン(旧称デプレニル)です。**セレギリン(エルデプリル)またはラサギリン(アジレクト)**は不可逆的MAO-B阻害剤であり、**サフィナミド(ザダゴ)**は可逆的MAO-B阻害剤であり、パーキンソン病の治療に、通常L-ドーパと組み合わせて、L-ドーパから生成されるドーパミンの効果を延長または増強するために使用されます。
COMT
COMTには、膜結合型と可溶型の2つのアイソフォームがあります。膜結合型COMTはCNSで発見される主要な形態であり、カテコールアミンに対する親和性が高く、主にニューロンに局在しています。可溶型はカテコールアミンに対する親和性が低く、末梢で発現する主要な形態ですが、CNSグリア細胞にも存在します。2つのCOMT阻害剤、トルカポンとエンタカポンは、L-ドーパの代謝を遅らせ、その効果を延長し、L-ドーパの必要量を減らすために、パーキンソン病の治療においてL-ドーパの補助薬として使用されます。
臨床および前臨床研究から蓄積された証拠は、DATの不足のためか、前頭前野におけるドーパミン代謝において、COMTが線条体などの他の領域よりもより重要な役割を果たしていることを示しています。前頭皮質におけるCOMTの役割のもう一つの興味深い側面は、COMT遺伝子に酵素のin vivo活性に影響を与える多型(Val158Met)が含まれているという発見です。Met158ホモ接合体はVal158ホモ接合体と比較して前頭前野のCOMT酵素活性が約3分の1低く、これは対立遺伝子によるドーパミン代謝速度の変化と一致します。COMT Val158Met多型は、報酬応答性、報酬探索、認知能力、ストレス処理など、さまざまな表現型と関連付けられています。ただし、前頭前野におけるドーパミン作動性伝達と認知のような行動との関係は逆U字型曲線で表され、最適以下のドーパミン活性も最適以上のドーパミン活性もパフォーマンスを損なうことに留意すべきです。
ドーパミン受容体
ドーパミンの生理学的作用は、5つの異なるが密接に関連するGPCRによって媒介されます。それらの構造、薬理学、および主要なエフェクターメカニズムに基づいて、それらは**D1様(D1およびD5)とD2様(D2、D3、D4)**ドーパミン受容体としてグループ化されます(図1.7-2)。D1様ドーパミン受容体はGsファミリーのGタンパク質を活性化し、アデニル酸シクラーゼ活性を増加させ、ドーパミン受容性細胞のシナプス後に見られます。D2様ドーパミン受容体(D2、D3、D4)はGiファミリーに結合し、アデニル酸シクラーゼ活性を阻害し、ドーパミン受容性細胞のシナプス後とドーパミン作動性ニューロンのシナプス前の両方で発現します。
脳内では、D1ドーパミン受容体は、線条体、側坐核、前頭前野などの黒質線条体、中脳辺縁系、中脳皮質ドーパミンシステムに特に高密度で発現しています。対照的に、D2受容体は脳全体に比較的均等に分布しており、線条体と側坐核で最も高いレベルを示します。線条体と前頭前野におけるD1およびD2受容体を介したドーパミン伝達は、運動制御、報酬システム、および認知の多くの側面において不可欠な役割を果たします。D2遺伝子の選択的スプライシングにより、D2s(D2-short)とD2L(D2-long)と呼ばれる2つの主要なバリアントが生成されます。D2sは主にシナプス前で発現し、自己受容体機能に関与しているという証拠があり、D2Lは主にシナプス後アイソフォームです。D3ドーパミン受容体は分布パターンがより限定されており、側坐核の殻下位区分など、辺縁系領域で最も高い発現レベルが観察されます。一部のデータは、D3受容体がニューロンの発火速度、ドーパミンの合成と放出を調節するD2自己受容体の役割を補完するために自己受容体として機能できることを示唆しています。ドーパミン受容体の中で、D4サブタイプは脳内で最も低い発現レベルを示し、前頭前野、扁桃体、海馬、視床下部に分布しています。D5ドーパミン受容体は、前頭前野、視床下部、海馬を含む複数の脳領域で低レベルで発現しています。D1、D2、D4ドーパミン受容体は網膜にも存在します。視床下部-下垂体軸の調節におけるドーパミンの重要な役割は、下垂体におけるD2ドーパミン受容体の高い発現を説明します。末梢では、ドーパミン受容体のすべてのサブタイプが、腎臓、副腎、交感神経節、消化管(GI)管、血管、心臓において様々な割合で観察されます。
クロルプロマジンなどの一部の古い、いわゆる「定型」抗精神病薬はD1受容体とD2受容体の両方をブロックしますが、ハロペリドールのような他の薬物はD2受容体に選択的です。定型抗精神病薬は、パーキンソニズム、ジストニア、舞踏病様運動(遅発性ジスキネジア)を含む錐体外路系副作用を誘発しやすいです。「非定型」抗精神病薬は、当初、定型薬と比較して錐体外路系副作用のリスクが低いことによって定義され、機械論的には、これは伝統的にD2ドーパミン受容体と5HT2Aセロトニン受容体のブロックに関連付けられており、D1受容体にはほとんどまたは全く影響を与えません。非定型抗精神病薬は、定型抗精神病薬よりも統合失調症の認知症状と陰性症状を軽減するのに効果的であると考えられていますが、セロトニン受容体との相互作用が抗精神病効果を改善するのか、ドーパミン受容体遮断の望ましくない作用の一部を軽減するのかは明らかではありません。抗精神病薬の完全な有益な効果が現れるまでに数週間かかる場合があるため、治療メカニズムは単なるD2受容体部位の遮断以上のものを含んでいることが明らかです。抗精神病薬の追加の副作用は、ドーパミンを介したプロラクチン分泌調節の障害に起因する血清プロラクチン値の上昇です。高プロラクチン血症の結果には、月経不順、乳漏症、性機能不全、女性化乳房、不妊症、骨密度低下、そしておそらく乳がんが含まれます。リスペリドン(リスパダール)などD2受容体に対する親和性が特に高い非定型抗精神病薬は、高プロラクチン血症を誘発しやすいですが、アリピプラゾール(エビリファイ)、クロザピン(クロザリル)、オランザピン(ジプレキサ)、クエチアピン(セロクエル)、ジプラシドン(ジオドン)などD2への結合が少ない薬剤ではこの副作用は稀です。クロザピンは1959年に発見され、1970年代に初めて抗精神病薬として使用されましたが、錐体外路系副作用の可能性が低い治療抵抗性統合失調症と闘う上で依然として重要な役割を果たしています。現在の考えでは、クロザピンの複数の受容体での複合作用がその治療特性に関与している可能性があります。しかし、綿密なモニタリングを行っても、クロザピンで治療された患者の約0.4%が重篤な無顆粒球症を発症します。新しい抗精神病薬の中で、オランザピンはクロザピンに最も近い受容体プロファイルを持っています。体重増加と代謝症候群の誘発は、特にオランザピンを使用するいくつかの非定型薬の使用における中心的な課題であり、これらの副作用に対処するためにメトホルミンやサミドルファンなどの薬剤の併用が利用されています。
D2様アゴニストは、パーキンソン病の対症療法において重要な役割を果たします。このような薬物には、D2アゴニストであるアポモルヒネ、およびD3受容体に対して最高の親和性を持つD2様アゴニストであるプラミペキソール(ミラペックス)とロピニロール(レキップ)が含まれます。非選択的ドーパミンアゴニスト(例:ロチゴチン)も、むずむず脚症候群に加えて、パーキンソン病の症状の治療に用いられています。
歴史的に、GPCRは単量体として機能すると信じられていましたが、現在では、特定の生体アミン受容体が、同じ受容体ファミリーの他のメンバー、または構造的に異なる受容体ファミリーと直接相互作用してヘテロマー(例:D1-D2、D2-5HT2、D2-カンナビノイド受容体-1)を形成し、ユニークな機能特性を持つことが明らかになっています。ヘテロマーの薬理学的標的化は、細胞シグナル伝達の治療的操作のための新しい戦略を提供します。
アドレナリン受容体
長年にわたり、ノルエピネフリンとエピネフリンの受容体(アドレナリン受容体)は、α1、α2、およびβの3つの明確なクラスにのみ分けられていました。α1-およびβ-受容体ではシナプス後局在が典型的ですが、α2-受容体はシナプス前とシナプス後の両方に存在します。現在、3つのα1サブタイプ(α1A、α1B、α1D)、4つのα2-受容体サブタイプ(α2A-D)、および3つのβ-受容体サブタイプ(β1-3)が認識されています(図1.7-3)。すべてのβ-受容体はGs共役型であるのに対し、ほとんどのα1-受容体はGq共役型であり、α2-受容体は典型的にGi共役型です。ノルエピネフリンは自律神経系(ANS)のほとんどの節後ニューロンによって使用される神経伝達物質であるため、様々なアドレナリン受容体のアゴニストおよびアンタゴニストは、それぞれ交感神経支配を模倣またはブロックすることによって、多くの末梢器官の機能に大きな影響を及ぼします。アゴニストは「交感神経刺激薬」と呼ばれ、アンタゴニストは「交感神経遮断薬」と呼ばれます。脳内では、LCノルアドレナリン作動性システムは、覚醒と認知の必須基質である神経回路に広範な影響を及ぼし、いくつかの気分障害がノルアドレナリン作動性神経伝達の調節不全に関与すると提唱されています。さらに、脊髄の交感神経節前ニューロンおよび脳幹と脊髄の副交感神経節前ニューロンへの直接投射を送ることにより、ノルアドレナリン作動性LCは自律神経活動の調節において中心的な役割を果たしています。
α1-アドレナリン作動性アゴニストの主な末梢効果は、動脈平滑筋の収縮であり、これにより血圧が上昇します。フェニレフリンやメトキサミンなどの薬物は、低血圧危機の際に血圧を上昇させるために臨床で時折使用されます。α1-アドレナリン作動性アゴニストは、鼻うっ血除去薬としても広く使用されており、そのうっ血除去作用は、鼻粘膜への血流の収縮と気道分泌の減少によって媒介されます。α1-アドレナリン受容体のアンタゴニストは、平滑筋の収縮を抑制し、動脈を拡張させることによって細動脈抵抗を減少させます。それらの主な用途は、高血圧の補助治療と症候性良性前立腺肥大症の治療です。プラゾシン(ミニプレス)などのα1-アンタゴニストは、心的外傷後ストレス障害(PTSD)の症状の一部を治療するのにも有用であることが示されています。
クロニジン(カタプレス)やグアンファシン(イントゥニブ)などのα2-アドレナリン作動性アゴニストは、高血圧を抑制するために使用されており、そのメカニズムは、前視床下部のα2-受容体の活性化によって引き起こされる交感神経緊張の減少であると考えられます。α2-アドレナリン作動性アゴニストは、特定のCNS疾患、特に前頭前野機能不全を伴う疾患の治療にも役割を果たしています。前頭前野のカテコールアミン作動性神経支配の損傷は、実行機能のテストでのパフォーマンスを損ないます。ドーパミンはこれらの病変の効果を媒介する上で重要な役割を果たしますが、ノルエピネフリンも前頭前野機能に強力な調節的影響を及ぼすというかなりの証拠があります。前頭前野機能におけるα2-受容体の役割に関する初期の薬理学的研究はクロニジンに焦点を当てていましたが、この薬物は、おそらく競合するシナプス前とシナプス後の効果、および鎮静作用と降圧作用の副作用からの制限により、混合効果を生み出します。より選択的なα2A-アゴニストであるグアンファシンでは、優れたプロファイルが観察されており、これは動物および一部のヒト集団においてワーキングメモリを改善する可能性があり、おそらくシナプス後α2A-受容体に結合し、ノルアドレナリン作動性緊張を増加させることによります。グアンファシンは現在、トゥレット症候群やADHDを含む、顕著な前頭前野機能不全を伴う様々な疾患の治療に用いられています。クロニジンは、オピオイド離脱の急性期を管理するためにも使用されており、この効果はノルアドレナリン作動性LCニューロンの過活動を正常化することによって達成されます。
β-アドレナリン作動性アゴニストは、心臓および肺システムに大きな影響を及ぼし、喘息およびその他の慢性閉塞性肺疾患の治療に用いられる主要な薬剤の1つです。β-アドレナリン受容体のアンタゴニストは、虚血性心疾患および高血圧の治療における主要な薬剤です。プロプラノロールなどのβ-アドレナリン拮抗薬は、手の震え、発汗、心拍数の増加など、社交不安(舞台恐怖症)のある個人の交感神経活動の増加の兆候を軽減するのにも効果的です。前臨床研究では、プロプラノロールが恐怖記憶の再固定化を減少させることが示されていますが、PTSDの治療におけるその有効性はまだ解決されていません。
セロトニン
解剖学と機能
哺乳類は、中枢神経系と末梢神経系の両方で**セロトニン(5HT)**を神経伝達物質として利用しています。セロトニンは、肥満細胞や腸クロム親和性細胞など、ニューロンではない多くの細胞でも産生され、血中のセロトニンは血小板に取り込まれて濃縮されます。体内のセロトニンの80%以上は消化管系に存在し、そこで運動性や消化機能を調節しています。脳内では、100万個のニューロンのうちわずか1個がセロトニンを産生しますが、この進化的に古いシグナル伝達分子は、ニューロンの広範な神経支配パターンにより、CNS機能のほぼすべての側面に影響を及ぼします。脳内におけるこの広範な分布のため、セロトニンは非常に多くの生理学的および病理学的プロセスに関与していると考えられています。
B1-B9群に分類されるセロトニン作動性細胞体の集団は、脳幹の複数の正中縫線核にクラスター化しています。尾側縫線核は延髄、小脳、脊髄に下行性の投射を送り、これらは運動活動、疼痛制御、および自律神経プロセスの調節に関与しています。より吻側に位置する背側および正中縫線核は、脳の残りの部分に上行性の軸索投射を送ります。正中縫線核は辺縁系に神経支配を行うセロトニン作動性線維のほとんどを提供し、一方、背側縫線核は、黒質およびVTAに存在するドーパミン作動性ニューロンに加えて、大脳皮質、視床、線条体に神経支配を行うセロトニン作動性線維のほとんどを提供します。これらの吻側のセロトニン作動性システムは、気分、不安、攻撃性、認知、摂食、睡眠-覚醒サイクル、性行動など、多くの機能において調節的役割を果たしています。セロトニンとうつ病との関連性は特に説得力があり、抗うつ薬の臨床的有効性はセロトニン作動性機能の増強と強く関連しています。
興味深いことに、背側および正中縫線からの投射は形態学的に区別することができます。背側縫線セロトニン作動性線維は非常に細く、紡錘形または顆粒状の外観を持つバリコシティと呼ばれる小さな小胞で覆われた膨らみを持っていますが、正中縫線線維はより太く、大きな球状またはビーズ状のバリコシティを持っています。2つのシステムは脳のほとんどの領域で共存していますが、その比率はかなり異なります。線条体、視床、中脳のドーパミン作動性細胞体は主に背側縫線から発生するニューロンによって神経支配を受けますが、海馬、中隔、視床下部は正中縫線から発生する線維の特に高い割合を受け取ります。大脳皮質では、背側縫線と正中縫線の投射は広範に重複しています。2種類の線維は、アンフェタミン類似体である3,4-メチレンジオキシメタンフェタミン(MDMA、「エクスタシー」)の神経毒性効果に対して異なる感受性を示します。MDMAは背側縫線の細い軸索に長期的な、または永続的な損傷を与えますが、正中縫線の太いビーズ状の軸索は影響を受けません。
ライフサイクル
合成
脳内では、セロニン合成の最初のステップは、食事性アミノ酸であるトリプトファンがBBBを横断してニューロンに取り込まれることです(図1.7-4)。脳内のトリプトファンは、セロトニンニューロンにおける神経伝達物質合成の基質として機能するだけでなく、すべての脳細胞でタンパク質合成に利用されます。血漿から脳へ、そして細胞外液からニューロンへトリプトファンを輸送するキャリアプロセスは、他の芳香族アミノ酸(例:チロシンやフェニルアラニン)、分岐鎖アミノ酸(例:ロイシン、イソロイシン、バリン)、その他のアミノ酸(例:メチオニンやヒスチジン)を含むLNAAとの競争に開かれています。LNAAキャリアの競争的性質は、脳内のトリプトファンレベルが血漿中のトリプトファン濃度だけでなく、競合する中性アミノ酸の血漿濃度によっても決定されることを意味します。脳内のセロトニン合成の律速酵素であるトリプトファンヒドロキシラーゼは、正常な生理学的条件下では飽和していません。したがって、脳内のトリプトファンレベルの減少または増加は、それぞれセロトニン合成の減少または刺激をもたらします。このように、食事中のタンパク質と炭水化物の含有量は、血漿アミノ酸パターンへの影響により、脳内のトリプトファンとセロトニンレベルに具体的に影響を与えることができます。血漿トリプトファンはその濃度に日内変動があるため、この濃度変動も脳内のセロトニン合成速度に影響を与える可能性があります。しかし、シナプス前およびシナプス後の恒常性メカニズムが、トリプトファン誘発性のセロトニン合成の変化が神経伝達の変化に変換されるのをどの程度防ぐかは不明です。
図1.7-4. セロトニンとメラトニンの生合成
セロトニン(5-ヒドロキシトリプタミン、5HT)とメラトニンは、食事性アミノ酸であるトリプトファンから始まる多段階合成によって産生されます。松果体細胞はメラトニン合成の主要な部位であり、セロトニンをメラトニンに変換するために必要な酵素AANATとASMTを含んでいます。AADC:芳香族アミノ酸脱炭酸酵素、AANAT:アラルキルアミンN-アセチルトランスフェラーゼ(セロトニンアセチラーゼとしても知られる)、ASMT:アセチルセロトニンO-メチルトランスフェラーゼ(ヒドロキシインドールO-メチルトランスフェラーゼとしても知られる)、TPH:トリプトファンヒドロキシラーゼ。
トリプトファンヒドロキシラーゼはトリプトファンから5-ヒドロキシトリプトファンの形成を触媒し、セロトニン合成のこのステップは、トリプトファンと直接競合し、酵素に不可逆的に結合するp-クロロフェニルアラニンによって特異的にブロックすることができます。トリプトファンから合成された5-ヒドロキシトリプトファンは、ほぼ直ちに脱炭酸されてセロトニンを生成します。この変換に関与する酵素はAADCであり、ドーパミンおよびノルエピネフリンニューロンにおいてL-ドーパを脱炭酸する酵素と同一です。AADCは広範に分布しており、カテコールアミンおよびセロトニン含有ニューロンに関連する末梢神経系および中枢神経系、ならびに副腎および松果体で発見されています。また、腎臓、肝臓、および他の様々な組織(通常、モノアミン伝達物質がほとんどまたは全く産生されない場所)でも発見されています。5-ヒドロキシトリプトファンを投与し、律速段階であるトリプトファンヒドロキシラーゼのステップをバイパスすることにより、実験的にセロトニン生成を増加させることが可能です。したがって、セロトニン含有ニューロンのセロトニンを選択的に増加させる可能性のあるトリプトファン投与とは異なり、5-ヒドロキシトリプトファン投与は、カテコールアミン含有ニューロンを含む、AADCを含有するすべての部位での非特異的なセロトニン形成をもたらします。
松果体では、セロトニンはアセチル化とO-メチル化によってさらに代謝され、メラトニンを形成することができます。トリプトファンはセロトニンとメラトニンの前駆体ですが、大量のトリプトファンを摂取しても、この変換を完了するために必要な酵素の利用可能性と活性が制限されているため、松果体でのメラトニン産生は増幅されません。メラトニンは周期的な身体活動の調節において重要な役割を果たしています。前視床下部の視交叉上核は、哺乳類の概日リズムを制御するマスタークロックであり、環境の明暗サイクルに応答して間接的な経路を介して松果体からのメラトニン分泌を制御します。メラトニン分泌のピークは暗闇時に発生します。メラトニンは、体の多くの組織に、1日の時間(「時計」機能)と季節(「カレンダー」機能)の両方を信号します。メラトニンは、睡眠誘発薬として市販されており、睡眠を誘発しますが、内因性メラトニン産生が高い夜間の健康な被験者には効果が限定的です。メラトニン投与は、時差ぼけの治療や、シフト勤務者が新しい勤務時間に順応するのを助けるのに役立つかもしれません。ラメルテオン(ロゼレム)などのメラトニンアゴニストが開発され、最近上市されています。
トランスポーター
細胞質におけるセロトニンの合成後、それは積極的に隔離され、シナプス小胞に濃縮されて放出を待ちます(図1.7-5)。小胞へのセロトニンの取り込みは脳内のVMAT-2によって達成され、レセルピンやテトラベナジンなどの薬物によって阻害されます。シナプスに放出されると、セロトニンはシナプス前およびシナプス後セロトニン受容体と相互作用することができます。セロトニンのシナプス効果は、シナプス前終末への再取り込みと、セロトニンの不活性代謝物への酵素的変換によって制限されます。再取り込みは、シナプスセロトニンの作用終結の主要なメカニズムとして機能します。アミトリプチリン(エラビル)、クロミプラミン(アナフラニール)、デシプラミン(ノルプラミン)、イミプラミン(トフラニール)、およびノルトリプチリン(パメロール)などの三環系抗うつ薬(TCA)の主な標的は、セロトニンとNETのブロックであり、これによりシナプスにおける神経伝達物質の作用が延長されますが、このクラスの薬物は他のいくつかの薬理作用も持ちます。より新しい選択的セロトニン再取り込み阻害薬(SSRI)は現在、最も広く処方されている抗うつ薬および抗不安薬であり、シタロプラム(セルトラ))、エスシタロプラム(レクサプロ)、フルオキセチン(プロザック)、フルボキサミン(ルボックス)、セルトラリン(ゾロフト)、およびパロキセチン(パキシル)などがあります。さらに最近では、デュロキセチン(サインバルタ)、ベンラファキシン(エフェクサー)、およびデスベンラファキシン(プリスティック)などのSNRIがうつ病性障害の治療に導入されています。SSRIは、強迫性障害(OCD)の第一選択薬理学的治療としても認識されています。
セロトニントランスポーター遺伝子のプロモーター領域には、タンパク質の機能に影響を与える多型が存在し、この発見は特定のバリアント(5-HTTLPRの短い対立遺伝子)の可能な結果についてかなりの議論を巻き起こしました。現在、この多型が双極性うつ病(BPD)の感受性に小さなが有意な影響を与え、抗うつ薬治療後の寛解率を低下させることが明らかになっています。
アンフェタミンなどの精神運動刺激薬は、DAT、NET、および**セロトニントランスポーター(SERT)**を介してモノアミン神経終末に入り、迅速な逆輸送によって3つのモノアミンすべてをシナプスに放出するのを刺激します。ハロゲン化アンフェタミン誘導体(例:フェンフルラミン)は、DATやNETと比較してSERTに選択的です。フェンフルラミンの食欲抑制作用は、セロトニン放出と内側視床下部における5HT2c受容体の活性化によって媒介されるという証拠があります。フェンフルラミン単独、またはフェンテルミンとの併用(「フェンフェン」と呼ばれる)は、以前は食欲抑制薬として処方されていました。しかし、フェンフルラミンは肺高血圧症および弁膜症の高い発生率と関連していることが判明し、市場から撤退しました。この毒性効果は、血小板からのセロトニンの末梢放出、またはより可能性が高いのは、フェンフルラミンの主要な代謝物であるノルフェンフルラミンによる心臓5HT2B受容体の活性化に関連していると考えられています。
代謝
セロトニンはMAOによって酵素的に分解され、この反応の生成物である5-ヒドロキシインドールアセトアルデヒドは5-ヒドロキシインドール酢酸(5-HIAA)に酸化されます。一部の研究では、MAO-A遺伝子の特定の機能喪失変異体を持つ人々が暴力やその他の反社会的行動になりやすいことが示されていますが、この研究は非常に議論の余地があります。MAOの阻害薬は、抗うつ薬として初めて市販された薬剤であり、これらの**モノアミンオキシダーゼ阻害薬(MAOI)**はAまたはBアイソフォームに選択的ではなく、トランシルシプロミン(パーネート)やフェネルジン(ナーディル)のように酵素を不可逆的に阻害しました。しかし、これらのMAOIを服用している患者がチラミン豊富な食品(チーズなど)を摂取すると、危険な高血圧反応を引き起こす傾向があることがすぐに認識され、その使用は厳しく制限されました。
腸粘膜は主にMAO-Aを含有するため、チラミンなどの摂取されたMAO基質を代謝する重要な部位です。腸内のMAO-Aが阻害されると、危険な量のチラミンが循環に入り、交感神経ニューロンからノルエピネフリン、副腎髄質からエピネフリンを放出します。これらの神経伝達物質の代謝はMAO-A阻害により鈍化しているため、昇圧反応を引き起こします。選択的MAO-B阻害薬は、この「チーズ反応」に関してより安全であることが示されましたが、残念ながら抗うつ効果が欠けていました。それにもかかわらず、選択的MAO-B阻害薬であるセレギリンは抗うつ薬として市販されていますが、MAO-Aを阻害するのに十分な高用量で使用する必要があります。セレギリンの経皮送達(エムサム)は、消化管および肝臓のMAO-A活性の阻害を最小限に抑えながら、中枢MAO-AおよびMAO-Bの阻害を可能にすることで、チラミン誘発性反応のリスクを低減するように設計されています。可逆的MAO-A阻害薬(RIMA)(例:モクロベミド)はうつ病性障害に有効であり、チラミン感受性に関して比較的安全であると思われます。
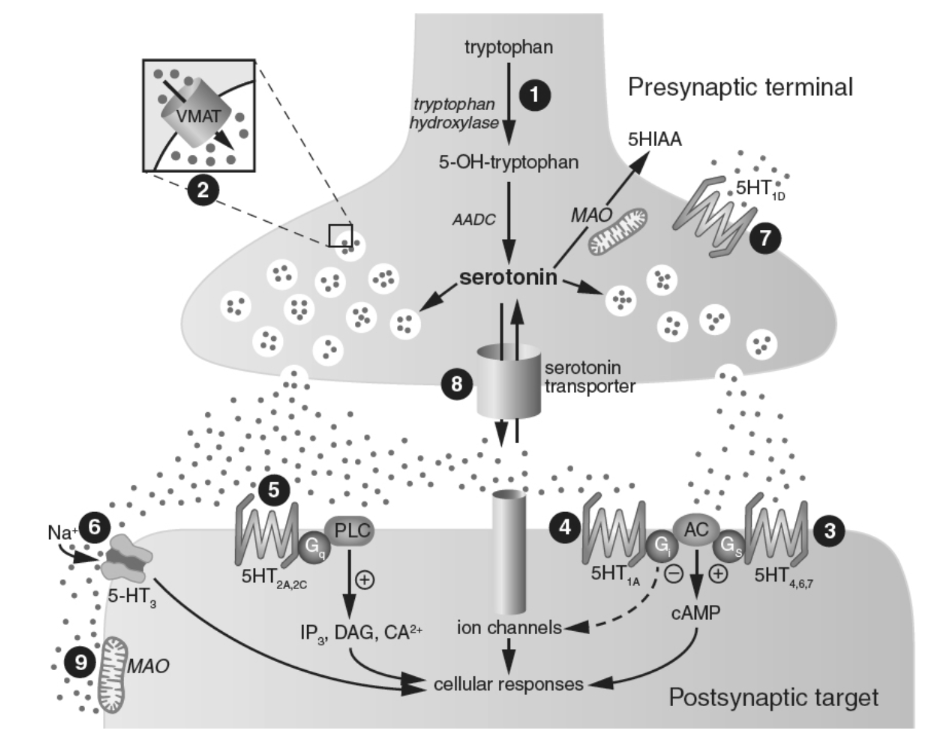
図1.7-5. セロトニンシナプスの模式図と薬物作用部位
部位1:トリプトファンは能動輸送機構によってニューロンに取り込まれ、律速酵素であるトリプトファンヒドロキシラーゼによって5-OH-トリプトファンに変換されます。この酵素はp-クロロフェニルアラニンによって効果的に阻害されます。AADCは5-OH-トリプトファンをセロトニンに変換します。部位2:セロトニンはVMAT-2によって小胞に取り込まれ貯蔵されます。レセルピンとテトラベナジンはアミン顆粒の取り込み貯蔵機構を妨害し、セロトニンを著しく枯渇させます。部位3、4、5:放出されたセロトニンは、最大14種類の異なる受容体と相互作用することができます。多くのGタンパク質共役型セロトニン受容体はシナプス後に位置しています。認知促進作用を持つ可能性のある新規抗精神病薬ルラシドン(ラツーダ)は、5HT7受容体(部位3)に対して高い親和性を持っています。抗不安薬のブスピロン(バスパー)とゲピロン(アリザ)は5HT1A受容体(部位4)です。多くの抗精神病薬は5HT2A受容体(部位5)を阻害します。LSD、メスカリン、シロシビンなどの幻覚作用は、5HT2A受容体におけるアゴニスト相互作用によって媒介されます。部位6:他のセロトニン受容体とは対照的に、5HT3受容体はリガンド依存性イオンチャネルです。オンダンセトロンは5HT3拮抗薬であり、効果的な制吐薬であり、メトクロプラミド(レグラン)やプロクロルペラジン(コンパジン)のようなD2拮抗薬に固有のパーキンソン病様副作用がありません。部位7:セロトニン自己受容体(5-HT1Bげっ歯類および5-HT1Dヒト)は刺激誘発性セロトニン放出を調節し、シナプス前終末に位置しています。5HT1A自己受容体はセロトニン細胞体と樹状突起に位置し、そこでインパルスフローを調節します。スマトリプタン(イミグラン)などの片頭痛治療薬トリプタン類は5HT1D/1Bアゴニストです。部位8:セロトニンのシナプス作用の終結は、セロトニントランスポーターによるニューロンへの再取り込みによって達成されます。SSRIとSNRIは、セロトニントランスポーターを阻害し、セロトニンのシナプス作用を増強する抗うつ薬のクラスです。ハロゲン化アンフェタミンであるフェンフルラミンは、迅速な逆輸送によってセロトニン放出を引き起こします。部位9:セロトニンのシナプス作用は代謝によっても減弱されます。MAO-Aの阻害薬はセロトニンの代謝をブロックし、抗うつ薬として使用されます。不可逆的阻害薬の例としては、イソカルボキサジド(マープラン)、フェネルジン(ナーディル)、トランシルシプロミン(パーネート)が挙げられますが、モクロベミドはMAO-Aを可逆的に阻害します。5HIAA:5-ヒドロキシインドール酢酸、5HT1-7:セロトニン受容体サブタイプ、5-OH-トリプトファン:5-ヒドロキシトリプトファン、AADC:芳香族アミノ酸脱炭酸酵素、AC:アデニル酸シクラーゼ、cAMP:サイクリックAMP、DAG:ジアシルグリセロール、G:Gタンパク質、IP3:イノシトールトリホスファート、MAO:モノアミンオキシダーゼ、SSRI:選択的セロトニン再取り込み阻害薬、VMAT:小胞モノアミントランスポーター。(Nestler E, Hyman S, Holtzman D, Malenka R. Molecular Neuropharmacology. McGraw-Hill Companies, Inc; 2015より改変。)
受容体
5HT受容体は7つの異なるファミリー(5HT1から5HT7)が同定されており、そのうちのいくつかではサブポピュレーションが記述されています(図1.7-5)。イオンチャネル型5HT3受容体を除き、すべてがGタンパク質共役型です。セロトニンGPCRでは、Gタンパク質への主要な結合様式が3つの主要なタイプで記述されています。5HT1および5HT5受容体はGi/Goタンパク質を活性化し、5HT2受容体はGq/11を活性化し、5HT4、5HT6、および5HT7はGs受容体を活性化します。
5HT1受容体
5HT1ファミリーは、5つの異なる遺伝子産物、すなわち5HT1A、5HT1B、5HT1D、5HT1E、および5HT1F受容体で構成されます。5HT1A受容体は最も広範に分布しており、すべてのセロトニンニューロンの細胞体と樹状突起に発現し、そこで細胞の興奮性および5HTの合成と放出を調節する自己受容体として機能します。5HT1A受容体はシナプス後およびアストロサイトや他のグリア細胞にも位置しています。ブスピロン(バスパー)などの部分5HT1Aアゴニストは、臨床的に有用な抗不安薬であり、うつ病の治療における抗うつ薬の有効性を増強します。
5HT1Bおよび5HT1D受容体は、構造と分布において互いに類似しています。それらは主にセロトニンニューロンのシナプス前終末に位置し、そこで5HTの局所合成と放出を制御する自己受容体として機能します。5HT1B受容体は、非セロトニン作動性ニューロンの軸索終末にも存在し、そこで他の神経伝達物質のシナプス前機能を制御するヘテロ受容体として機能します。セロトニン作動性システムは長らく片頭痛と関連付けられており、スマトリプタン(イミグラン)や他のトリプタン類などの5HT1B/Dアゴニストは、これらのタイプの頭痛の効果的な治療法です。しかし、そのメカニズムは明らかではなく、頭蓋血管の5HT1Bおよび5HT1D受容体の活性化によって誘発される血管収縮によるものか、または髄膜から痛み情報を伝達する三叉神経求心性神経の活動の調節によるものである可能性があります。5HT1BのPETリガンドの開発により、これらの受容体はPTSDや大うつ病などの精神疾患の生物学に関与していることが示唆されています。5HT1Bおよびβ-アドレナリン受容体の拮抗薬であるピンジロールは、5HT放出を促進することによって抗うつ薬の有効性を増強すると報告されていますが、これはまだ確固たるものではありません。
5HT1Fはヒト脳で高発現する受容体であり、特に海馬と前頭前野に豊富に存在するため、アルツハイマー病や側頭葉てんかんなどの記憶障害の薬物標的となる可能性があります。興味深いことに、この受容体サブタイプはラットやマウスには存在しません。5HT1F受容体の機能に関する研究は、選択的な薬理学的ツールと特異的抗体の不足によって妨げられてきました。
5HT1Fの発現は、三叉神経節および脳血管に加えて、様々な脳領域で報告されています。片頭痛の治療に用いられるトリプタン類は5HT1F受容体に対して顕著な親和性を持っており、5HT1Fアゴニストの開発は片頭痛の有望な新しい治療法を提供する可能性があります。
5HT2受容体
5HT2ファミリーには、5HT2A、5HT2B、および5HT2cの3つのメンバーがあり、アミノ酸配列とシグナル伝達特性に類似性があります。それらはすべてGq/11によってホスホリパーゼC(PLC)に結合しています。
5HT2Aは脳全体に広く発現しており、特に皮質に豊富に存在し、介在ニューロンと錐体ニューロンの両方に存在します。幻覚性(サイケデリック)薬物(例:D-リゼルグ酸ジエチルアミド[LSD]、メスカリン、シロシビン、2,5-ジメトキシ-4-メチルアンフェタミン)によって誘発される感覚知覚の障害は、5HT2A受容体における完全または部分アゴニズムによって媒介されます。第二世代抗精神病薬は、D2受容体と比較して5HT2A部位での拮抗作用の相対的に高い効力によって特徴付けられます。5HT2A受容体および/または5HT2c受容体のダウンレギュレーションがSSRIの抗うつ効果に寄与する適応メカニズムであるという証拠があり、実際、5HT2Aまたは5HT2c受容体のブロックは動物モデルにおけるSSRIの抗うつ作用を増強します。この仮説と一致するのは、SSRIと併用して投与された非定型抗精神病薬が治療抵抗性うつ病に有効であるという証拠です。ピマバンセリン(ヌプラジド)は5HT2A受容体において逆アゴニストおよび拮抗作用を示し、パーキンソン病患者の精神病に関連する幻覚および妄想の治療に承認されています。予備的な臨床データは、ピマバンセリンが認知症関連精神病の短期治療にも有益である可能性があることを示唆しています。5HT2A受容体活性化の有用な効果の1つは眼内圧の低下であり、これによりBBBを通過せず、幻覚性の副作用を生じさせずに眼内圧を低下させる化合物の開発につながっています。
5HT2B受容体は中枢神経系では発現が限られており、末梢での相対的な豊富さとは対照的です。5HT2Bに関する研究は5HT2Bアゴニストの心毒性のため制限されてきましたが、5HT2B受容体に対して高い親和性を持つ非定型抗精神病薬であるアリピプラゾール(エビリファイ)をSSRIなどの抗うつ薬に追加すると、治療抵抗性うつ病患者に有益な効果をもたらすことが報告されています。
5HT2c受容体は脳内に広範かつ不均一に分布しています。5HT2c受容体は、クロザピン(クロザリル)やオランザピン(ジプレキサ)など体重増加を引き起こす可能性のある抗精神病薬が5HT2A受容体と比較して5HT2cに対してより高い親和性を持つことから、抗精神病薬の慢性投与に起因する体重増加の根底にあるメカニズムに関与していると考えられています。5HT2Aサブタイプにより選択的な拮抗薬である抗精神病薬は、体重増加の責任が少ないです。5HT2c受容体のアゴニストは抗肥満薬として研究されています。興味深いことに、ヒトの5HT2cはX染色体上に位置していますが、他のすべての5HT受容体は常染色体です。したがって、この受容体の多型は、男女で異なる影響を与える可能性があります。5HT2c多型は、循環レプチンレベルに影響を与えるようで、5HT2c受容体と体重増加の遺伝的関連性の根底にある潜在的なメカニズムを提供します。5HT2c受容体は中脳のドーパミンニューロンと密接に関連しており、その終末領域におけるドーパミン放出を調節することができます。例えば、VTAドーパミンニューロンの発火速度は、5HT2cアゴニストまたはアンタゴニストによってそれぞれ阻害または増加され、5HT2c受容体が側坐核におけるドーパミン放出を調節します。この相互作用の根拠は、側坐核に神経支配するドーパミンニューロンとGABAニューロンの両方のVTAにおける5HT2c受容体の位置にあります。5HT2c受容体がVTA-側坐核経路に関与しているため、この受容体サブタイプに対する特異的リガンドは統合失調症および物質乱用障害の治療のために開発中です。
5HT3受容体
上述の通り、5HT3受容体はリガンド依存性イオンチャネルであり、他の5HT受容体サブタイプとは構造とメカニズムが著しく異なります。5HT3受容体は、脳の多くの領域に位置しており、延髄と脊髄で最も高い密度を示します。一部の5HT3受容体はシナプス後に位置することができますが、多くの領域ではシナプス前にも頻繁に発現しており、その活性化は様々な神経伝達物質の放出を調節します。オンダンセトロン(ゾフラン)、グラニセトロン(キトリル)、ドラセトロン(アンゼメット)、パロノセトロン(アロキシ)などの5HT3拮抗薬は、癌化学療法および放射線療法に伴う嘔吐の治療や、過敏性腸症候群の症状に対処するために臨床的に使用されています。5HT3アゴニストの好ましくない効果(例:悪心と不安)のため、これらの臨床的使用は近い将来に起こる可能性は低いでしょう。末梢では、5HT3受容体は様々な末梢神経節に顕著に発現しており、侵害受容と疼痛応答、ならびに腸管および心血管反射を調節すると提唱されています。
5HT4受容体
これらの受容体は脳および末梢に存在します。5HT4アゴニストであるシサプリド(プロプルシッド)は、上部消化管の運動性を高めるための消化管運動促進薬として臨床で使用されています。
5HT5および5HT6受容体
5HT5受容体は脳内で検出されていますが、これまでのところ、このサブタイプに選択性を持つ薬物は臨床で使用されていません。しかし、動物研究は、5HT5A受容体拮抗薬が統合失調症に関連する認知機能障害を治療する可能性があることを示唆しています。5HT6受容体は脳にほぼ排他的に発現しており、辺縁系および皮質領域におけるその豊富さは、いくつかの抗精神病薬によってブロックされるため、かなりの研究関心を刺激しています。いくつかの選択的5HT6リガンドはアルツハイマー病の認知機能障害を治療するための臨床試験に達しましたが、選択された集団で有意な有効性を達成したものはありません。
5HT7受容体
5HT7受容体は、末梢に加えて、脳の多くの領域で同定されています。シナプス前およびシナプス後の両方の5HT7受容体の存在の証拠があります。この受容体の機能は、概日リズムと体温調節の制御に最も強く関連付けられています。しかし、5HT7受容体に対する最近の主な関心は、認知プロセスにおけるその関連する役割の可能性に由来しており、海馬と前頭前野における5HT7受容体の存在がこれを裏付けています。さらに、いくつかの抗精神病薬と抗うつ薬が5HT7受容体に対して高い親和性を持っていることは重要であり、これはそれらの有益な効果に寄与している可能性があります。5HT7は、思春期および成熟脳回路における構造的可塑性の調節にも関与していると考えられています。ルラシドン(ラツーダ)は、特に強力な5HT7拮抗薬である非定型抗精神病薬であり、統合失調症および双極I型障害に伴ううつ病エピソードの治療に用いられます。研究では、ルラシドンが正常なサルにおいて認知促進特性を持つことさえ示されています。
アセチルコリン
解剖学と機能
脳内では、コリン作動性ニューロンの軸索突起は、遠隔の標的に投射するか、または同じ領域内の細胞に局所的に接触します(介在ニューロン)。広範に投射するコリン作動性ニューロンは、上部脳幹の前脳基底複合体および中脳橋複合体内のいくつかの細胞群から発生します。前脳基底複合体のコリン作動性ニューロン集団は、内側中隔核、対角帯、マイネルト基底核に位置し、これらのニューロンは終脳へのコリン作動性神経支配の大部分を提供します。中脳橋複合体内では、コリン作動性ニューロンは橋脚蓋核および外側背側被蓋核に位置し、視床、中脳領域(黒質およびVTAを含む)に神経支配を行うほか、LCや背側縫線などの領域に下行性の神経支配を行います。広範に投射するコリン作動性ニューロンは線条体に神経支配を行いますが、線条体のアセチルコリンの主要な供給源はコリン作動性介在ニューロンであり、これは線条体細胞全体の約1%から2%に過ぎませんが、線条体全体に密な投射のアーバーを送ります。脳内での広範な分布から予測されるように、中枢コリン作動性ニューロンは、認知、学習と記憶、覚醒、運動制御、CBFなど、様々なプロセスに関与しています。アルツハイマー病では、マイネルト基底核のニューロンに有意な変性が見られ、皮質コリン作動性神経支配の著しい減少につながります。ニューロンの喪失の程度は認知症の程度と相関しており、コリン作動性欠損はこの障害における認知機能低下に寄与している可能性があり、これはアセチルコリンシグナル伝達を促進する薬物の有益な効果と一致します。
ANSでは、アセチルコリンは副交感神経と交感神経の両方の節前伝達、および副交感神経系の節後シナプスで責任を負います。しかし、この組織には例外があり、例えば副腎および汗腺の交感神経支配はアセチルコリンによって提供されます。
ライフサイクル
アセチルコリンの神経内合成は、単一のステップ反応のみを伴います(図1.7-6)。基質であるコリンは、高親和性および低親和性の両方のメカニズムによってコリン作動性ニューロンに輸送され、コリンアセチルトランスフェラーゼ酵素が細胞質アセチルコエンザイムAからコリンにアセチル基を転移させることによってアセチルコリンが形成されます。アセチルコリン合成の律速段階は、高親和性コリン取り込みであり、これがどのように調節されているかは不明ですが、ニューロン活動の増加がコリンのニューロンへの侵入を促進し、高親和性取り込みがヘミコリニウムによってブロックされることが知られています。合成されたアセチルコリンは、小胞性コリン作動性トランスポーターによって小胞に取り込まれ、このプロセスはベサミコールによって阻害される可能性があります。
いくつかの強力な毒素が、小胞からシナプスへのアセチルコリンの放出に影響を与えます。A型ボツリヌス毒素と破傷風毒素は細菌由来であり、アセチルコリンの放出を妨げ、麻痺を引き起こします。しかし、少量注入すれば、ボツリヌス毒素は筋肉を局所的に弱めることができ、この効果は痙攣やジストニアの治療、および顔のしわを滑らかにする美容用途(ボトックス)に利用されています。シナプス前ニューロンからシナプスに放出されたアセチルコリンは、他の生体アミンのように取り込みメカニズムによって再取り込みされることはありません。代わりに、コリン作動性伝達の終結は、主にアセチルコリンがコリンと酢酸に分解されることに依存しており、この反応は可溶性および膜結合型の両方で存在する酵素であるAChEによって触媒されます。アセチルコリンの代謝によって放出されたコリンのほぼ半分は、再利用のためにニューロンに再取り込みされます。薬物によるAChE活性の阻害は、アセチルコリンによるコリン作動性受容体の刺激を増強します。**ネオスチグミン(プロスチグミン)はBBBを通過しない可逆的阻害剤であり、重症筋無力症の場合の筋緊張の改善に用いられます。AChE阻害薬は眼圧を低下させるため、特定の種類の緑内障の治療に用いられます。経口投与後脳によく浸透する中枢作用性の可逆的AChE阻害薬、例えばドネペジル(アリセプト)やリバスチグミン(エクセロン)**は、アルツハイマー病およびパーキンソン病関連認知症の症状を改善するために使用されます。不可逆的AChE阻害薬は酵素を永続的に不活性化するため、活性の回復には新しいタンパク質の合成が必要であり、このような化合物は殺虫剤として用いられ、化学兵器(例:サリン、ソマン)として使用されてきました。
受容体
アセチルコリン受容体は、それぞれ自然発生するアゴニストであるムスカリンとニコチンにちなんで名付けられたムスカリン受容体とニコチン受容体の2つの主要なクラスに分類されます(図1.7-6)。
ムスカリン受容体
ムスカリン受容体には5つのサブタイプ(M1からM5)がクローン化されており、すべて脳内に存在します。これらはGタンパク質と結合し、イオンチャネルに直接作用するか、様々なセカンドメッセンジャーシステムに連結しています。M1、M3、M5はGq/11結合型であり、M2とM4はGi/o結合型です。サブタイプに特異的な活性化剤または阻害剤が不足しているため、脳内における各サブタイプの役割は十分に解明されていません。M1とM3は主に大脳皮質と海馬に位置し、学習と記憶に対するアセチルコリンの一部の効果を媒介します。M1とM4は線条体に高密度で位置し、おそらく錐体外路系運動回路におけるコリン作動性シグナル伝達と報酬への応答を媒介します。M2受容体は前脳基底核に集中しており、そこでアセチルコリンの合成と放出を制御する自己受容体として機能します。M5受容体は脳内で低レベルで発現しており、黒質とVTAに存在します。M1-およびM4-選択的ムスカリン受容体アゴニストであるキサノメリンと、副作用を制限するための末梢作用性コリン作動性拮抗薬の組み合わせによる最近の短期試験では、統合失調症の陽性および陰性症状が著しく改善されたことが明らかになりました。これはキサノメリンがドーパミン受容体に対して実質的な親和性を持たないため、興味深い進展です。非特異的ムスカリンアゴニストには、ピロカルピンやアレコリンなどのいくつかの天然アルカロイド、およびカルバコール、オキソトレモリン、ベタネコールなどの合成化合物が含まれます。これらの薬物は中枢神経系疾患の治療には使用されませんが、緑内障および非閉塞性尿閉の症状を軽減し、シェーグレン症候群で発生する口腔乾燥症を治療するために用いられます。アレコリンはビンロウの実とキンマの葉の有効成分であり、多くのアジア文化圏で刺激効果のために噛まれています。ムスカリン作動性コリン作動薬の最も顕著な副作用(徐脈、消化管障害、流涎、発汗)は、末梢M1、M2、およびM3受容体の活性化によって媒介されます。
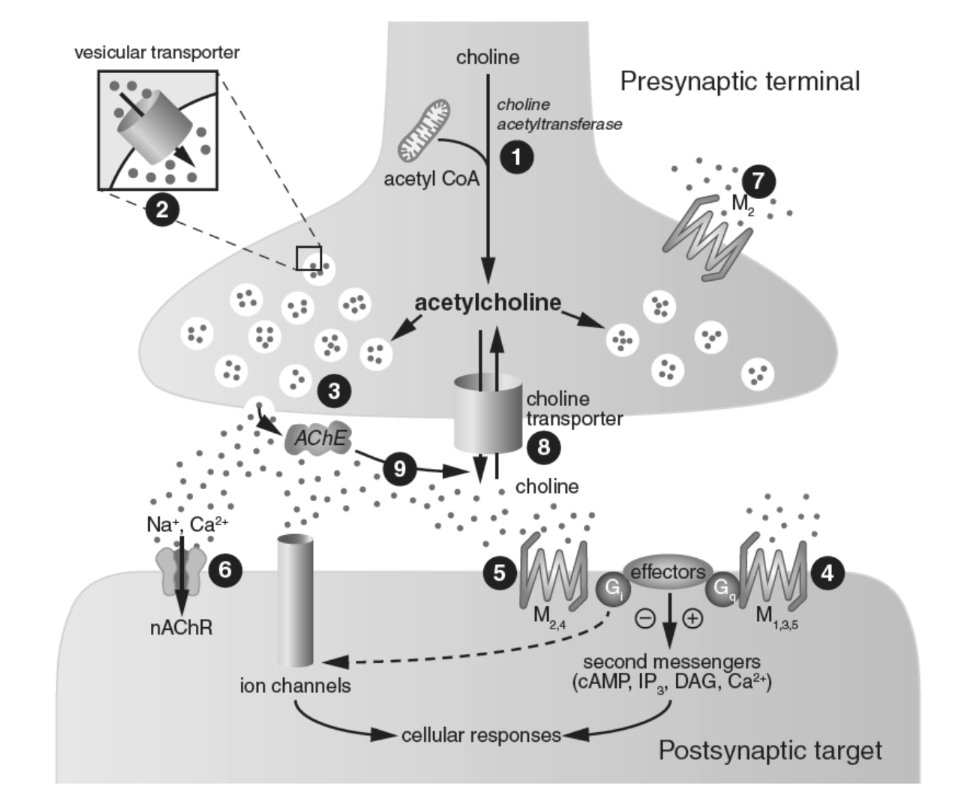
図1.7-6. アセチルコリンシナプスの模式図と薬物作用部位
部位1:コリンは能動的取り込み機構によってシナプス前終末に取り込まれ、単一の酵素ステップによってアセチルコリンに変換されます。アセチルコリン合成に必要なアセチルコエンザイムAはシナプス前ミトコンドリアによって供給されます。部位2:アセチルコリンは小胞に取り込まれ貯蔵されます。コリン作動性ニューロンの小胞性トランスポーターは、他の生体アミンニューロンに存在するVMAT-2とは異なり、ベサミコールによってブロックされます。部位3:放出はクロゴケグモの毒によって促進され、ボツリヌス毒素(末梢シナプス)と破傷風毒素(中枢シナプス)によってブロックされます。部位4および5:放出後、アセチルコリンはシナプス後細胞上のGタンパク質共役型ムスカリン受容体(部位4および5)の両方と相互作用する可能性があります。ムスカリン受容体サブタイプ選択的薬物はありませんが、部分的に選択性を持つ一部の薬剤は実験的に使用されています。臨床的に関連性の高い非選択的ムスカリンアゴニストは、眼科手術に用いられるカルバコール(ミオスタット)です。典型的な拮抗薬はアトロピンであり、これも眼科や手術中の唾液分泌抑制に用いられます。ニコチン依存症の治療に用いられるバレニクリンによって、ニコチン受容体の一部のサブタイプが活性化されます。ニコチン受容体は、薬理学的ツールであるα-ブンガロトキシンとヘキサメトニウムによってブロックされます。部位6:シナプス前終末から放出されたアセチルコリンは、ニコチン性リガンド依存性イオンチャネルにも結合する可能性があります。ニコチン依存症の治療に用いられるバレニクリン(チャンティックス)によって、ニコチン受容体の一部のサブタイプが活性化されます。ニコチン受容体は、薬理学的ツールであるα-ブンガロトキシンとヘキサメトニウムによってブロックされます。部位7:アセチルコリンはシナプス前ムスカリン受容体と相互作用し、その後の神経伝達物質の放出を調節します。部位8:モノアミンシナプスとは対照的に、コリン作動性シナプスにおける形質膜トランスポーターは神経伝達物質をシナプス前終末に戻すのではなく、アセチルコリンの代謝後に放出される前駆体コリンをリサイクルします。ヘミコリニウム-3は、コリン輸送を実験的にブロックするために使用される薬物です。部位9:アセチルコリンはAChEによって代謝され、これはシナプス前膜とシナプス後膜の両方に存在し、その作用を終結させます。AChE阻害薬の例としては、緑内障の治療に点眼薬として使用されるフィゾスティグミンと、アルツハイマー病の症状を改善する**ドネペジル(アリセプト)**が挙げられます。AChE:アセチルコリンエステラーゼ、cAMP:サイクリックAMP、DAG:ジアシルグリセロール、G:Gタンパク質、IP3:イノシトール三リン酸、M1-5:ムスカリン受容体サブタイプ、MAO:モノアミンオキシダーゼ、nAChR:ニコチン性アセチルコリン受容体、VMAT:小胞モノアミントランスポーター。(Nestler E, Hyman S, Holtzman D, Malenka R. Molecular Neuropharmacology. McGraw-Hill Companies, Inc; 2015より改変。)
原型的なムスカリン性拮抗薬は、有毒な植物であるベラドンナ(Atropa belladonna)に自然に存在するアトロピンとスコポラミンです。「belladonna」はイタリア語で「美しい女性」と翻訳され、これはルネッサンス期のイタリアの女性が瞳孔を拡大させるためにベラドンナのベリージュースを眼に塗布し、視力は損なわれるものの、魅力的な外見を得ていたことに由来しています。ムスカリン性拮抗薬を摂取すると、副交感神経系の抑制に起因する他の影響、例えば口渇、便秘、尿閉のほか、認知機能障害や、極端な場合にはせん妄といった中枢作用も引き起こされます。しかし、ムスカリン性拮抗薬にはいくつかの治療用途があります。例えば、スコポラミンは制吐作用があり、乗り物酔いによる吐き気や嘔吐の治療に用いられます。さらに、ベンズトロピン(コジェンチン)やトリヘキシフェニジル(アーテン)などのムスカリン性拮抗薬は、パーキンソン病の運動症状の治療に用いられ、また「定型」抗精神病薬の長期使用によって誘発される可能性のある副作用である遅発性ジストニアの緩和にも役立つことがあります。多くの向精神薬は、一部のTCAや抗精神病薬を含め、望ましくないムスカリン性拮抗作用を持っています。一部の第一世代H1拮抗薬の抗ヒスタミン薬は、市販の催眠薬や抗アレルギー薬として販売されており、これらの薬物も口渇、便秘、尿閉、さらには高齢患者がより感受性の高いせん妄などの副作用の原因となる顕著なムスカリン性拮抗作用を持っています。
ニコチン受容体
これらは神経筋接合部、自律神経節、副腎髄質、脳、脊髄に位置するリガンド依存性イオンチャネルです。ニューロンと筋肉の両方で発現するニコチン受容体は、迅速な興奮性シグナル伝達を媒介しますが、そのサブユニット組成は異なります。すべてのニコチン受容体は、受容体が活性化されたときにイオンを取り込むために開く中央のチャネルの周りに配置された5つのサブユニット分子で構成されており、様々なホモマー(すべて同じ種類のサブユニット)またはヘテロマー(少なくとも1つのαと1つのβ)のグループ化で配置されています。脳内で最も一般的なサブタイプは、ヘテロマーα4β2サブタイプとホモマーα7受容体です。サブユニットの組み合わせは、陽イオン透過性や脱感作速度など、個々の複合体の薬理学的および機能的特性に影響を与えます。これらの様々なニコチン性アセチルコリン受容体サブユニットは、機能クラスに分類されます:(1)神経性(α2-α6およびβ2-β4)、(2)骨格筋(α1、β1、δ、γ、およびε)。神経性ニコチン性アセチルコリン受容体は脳全体に広く分布していますが、筋肉の対応物のように古典的なシナプス後の直接的な興奮性様式で機能するだけではありません。実際、ニコチン結合部位の大部分は、古典的なシナプス後の位置に加えて、シナプス前、シナプス周、およびシナプス外の部位で発見されています。ニコチン受容体は、いくつかの障害や病理学的状態に関与していると考えられています。神経性ニコチン性アセチルコリン受容体の最も明らかな役割は、慢性的なタバコおよび電子タバコの使用者におけるニコチンの強化作用および依存性作用の媒介であり、使用中止時に経験される離脱症状に加えてです。ニコチンの強化作用は、脳の報酬系におけるニコチン受容体との相互作用に依存し、特にVTAから発生し側坐核に神経支配するニューロンからのドーパミン放出に依存します。ニコチン受容体サブユニット遺伝子の1つにおける変異は、特定の種類のてんかんである常染色体優性前頭葉てんかん(ADNFLE)に寄与しています。さらに、α4β2nAChRの異常な発現は、自閉症スペクトラム障害、ニコチン依存症、パーキンソン病を含むいくつかの障害に関与していると考えられています。α7nAChR発現の変化は、認知症や統合失調症スペクトラム障害など、様々な脳障害と関連付けられています。イオンチャネル型α7受容体の興味深く特徴的な特性は、メタボトロピックGタンパク質共役受容体のように、下流の代謝カスケードを活性化する能力です。α7-ニコチン受容体は、統合失調症、アルツハイマー病、パーキンソン病における神経認知機能不全の治療のための潜在的な治療標的として浮上しています。多くのCNS疾患への関与の証拠があるため、将来の選択的ニコチン受容体アゴニストの治療薬としての開発には大きな関心があります。ヘキサメトニウムやメカミラミンなどの薬物は、ニコチン受容体をブロックするのに有用な薬理学的ツールですが、現在治療に使用されているニコチンアゴニストまたは拮抗薬は比較的少ないです。一例として、ニコチン受容体における弱い部分アゴニストであるサクシニルコリンは、麻酔中に麻痺薬として臨床で使用されます。**バレニクリン(チャンティックス)**は、α4/β2ニコチン受容体に選択性を持つ部分アゴニストであり、現在、ニコチン依存症の治療薬として、また禁煙補助薬として広く市販されています。**ガランタミン(ラザダイン)**は、いくつかのサブタイプの神経性ニコチン受容体のアロステリック増強剤であり、AChEの弱い競合的かつ可逆的阻害剤であり、アルツハイマー病の治療にも用いられます。
ヒスタミン
解剖学と機能
体全体に非常に幅広い機能を果たしているにもかかわらず、脳内でのヒスタミンの役割は、他の生体アミンほど注目されていません。ヒスタミン含有神経細胞体は、後部視床下部の結節乳頭体複合体に限定されています。他の生体アミンニューロンと同様に、ヒスタミン作動性システムは、多くの終脳、中脳、小脳構造に拡散性投射を提供する、長く、高度に分岐した、ほとんど髄鞘化されていない、静脈瘤性の線維で構成されています。個々のニューロンは広範に異なる領域に神経支配することができますが、典型的なシナプス接触はほとんどありません。ヒスタミン作動性投射と密接に関連する機能は、睡眠と覚醒の調節、および摂食と食欲の制御です。末梢では、肥満細胞から放出されるヒスタミンがアレルギー反応において重要な役割を果たし、腸クロム親和性細胞と肥満細胞から放出されるヒスタミンは胃の酸分泌を刺激します。
ライフサイクル
ヒスタミンは脳内で主にヒスチジン脱炭酸酵素(図1.7-7)によってヒスチジンの脱炭酸によって形成されますが、ヒスチジンはカテコールアミンとセロトニンの合成にも関与するAADCの基質でもあります。ヒスチジン脱炭酸酵素遺伝子の変異は、トゥレット症候群のまれな遺伝的原因として関与しており、この遺伝子のノックアウトマウスモデルを用いた研究では、この障害の核心的な現象を再現することが示され、基底核におけるヒスタミンとドーパミンの相互作用が病理の原因であるという証拠を強化しました。シナプス小胞にヒスタミンを濃縮する責任を負うトランスポータータンパク質はまだ明確に確立されていませんが、VMAT-2機能に干渉するレセルピンとテトラベナジンは両方とも脳ヒスタミンの放出を誘発します。脳内では、ヒスタミンは主にヒスタミンメチルトランスフェラーゼによってn-メチルヒスタミン(テレ-メチルヒスタミン)に代謝されます。末梢では、ヒスタミンはジアミンオキシダーゼによってイミダゾールアセトアルデヒドに代謝され、これは急速にイミダゾール酢酸に酸化される中間体です。他の生体アミンとは異なり、放出された脳内ヒスタミンの効果を再取り込みして終結させるための特異的な高親和性形質膜トランスポーターの証拠はありません。しかし、ヒスタミンは有機カチオントランスポーター(OCT)ファミリーおよび低親和性形質膜トランスポーターのいくつかの低親和性トランスポーターの基質です。
受容体
ヒスタミン受容体には4つのサブタイプ(H1からH4)が同定されており、すべてGタンパク質共役型受容体のスーパーファミリーに属しています(図1.7-7)。脳内では、H1およびH2受容体の両方がヒスタミン終末のシナプス後ニューロンとグリア細胞の両方に発現しています。H1受容体のブロックは鎮静作用を引き起こします。これは、クロザピン(クロザリル)などの一部の抗精神病薬、ドキセピン(デプトラン)などの抗うつ薬、H1受容体を阻害するジフェンヒドラミン(ベナドリル)などのアレルギー薬に固有の副作用です。実際、ドキセピンの鎮静作用は、原発性不眠症の症状を緩和するために治療的に使用されています。アレルギー反応の治療におけるH1拮抗薬の鎮静効果を克服するために、ロラタジン(クラリチン)などの新しい非鎮静性抗ヒスタミン薬は、BBBを通過しないように設計されています。メクリジン(アンチバート)やジメンヒドリナート(ドラマミン)などのH1拮抗薬は、乗り物酔いやメニエール病などの前庭障害の治療にも用いられています。
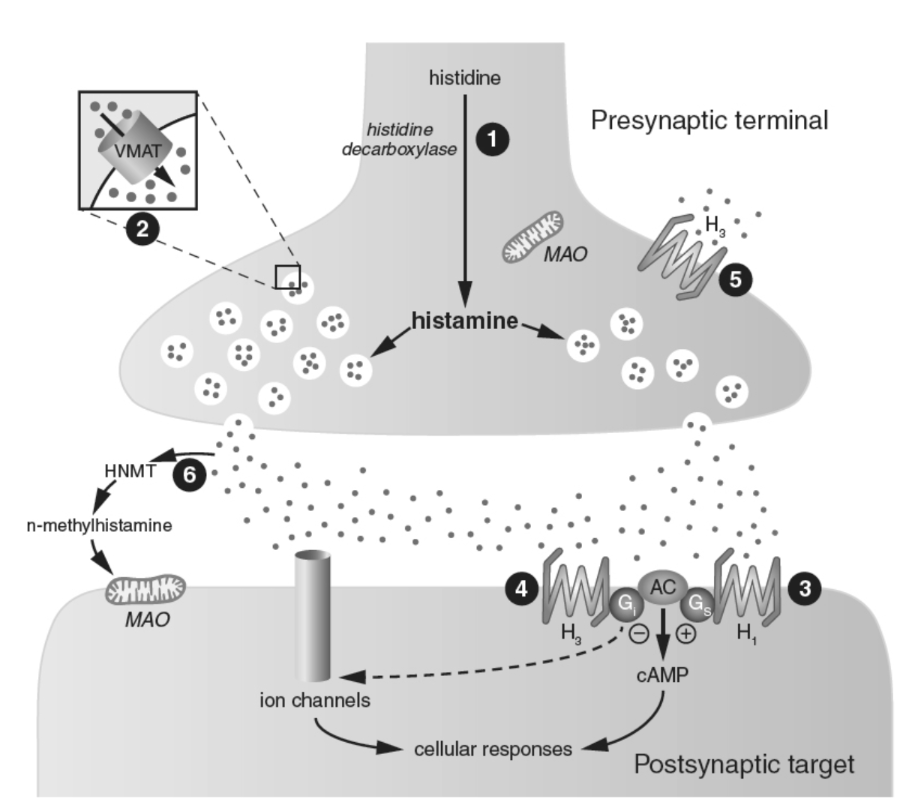
図1.7-7. 中枢ヒスタミン作動性シナプスの模式図と薬物作用部位
部位1:ヒスチジンはヒスタミン含有ニューロンに取り込まれ、ヒスチジン脱炭酸酵素によってヒスタミンに変換されます。この酵素は、他の生体アミンの合成に使用されるAADCとは異なります。ヒスチジン脱炭酸酵素の阻害剤は臨床では使用されていません。部位2:ヒスタミンはVMATの作用により貯蔵小胞に蓄積されます。レセルピンはヒスタミンの小胞貯蔵を妨害します。部位3および4:放出後、ヒスタミンはシナプス後受容体と相互作用します。クロルフェニラミンとジフェンヒドラミンはH1拮抗作用を持ち、抗アレルギー薬として使用されます。メクリジン(ボニン)やジメンヒドリナート(ドラマミン)などのH1拮抗薬は、乗り物酔いや前庭障害の治療に有用であることが証明されています。部位5:自己受容体の活性化は、その後のヒスタミン放出を調節する役割を果たします。ピトリサントはH3受容体における選択的逆アゴニストであり、ヒスタミン放出を増加させ、過剰な日中の眠気の治療に用いられます。H3受容体の選択的拮抗薬として作用する治療薬は現在ありません。部位6:シナプスヒスタミンの再取り込みはなく、その作用はヒスタミンn-メチルトランスフェラーゼによる代謝によって終結します。この酵素を阻害するために選択的に使用される治療薬はありません。代謝物であるn-メチルヒスタミンはMAOの基質です。AADC:芳香族アミノ酸脱炭酸酵素、AC:アデニル酸シクラーゼ、cAMP:サイクリックAMP、H1-3:ヒスタミン受容体サブタイプ、HNMT:ヒスタミンN-メチルトランスフェラーゼ、G:Gタンパク質、MAO:モノアミンオキシダーゼ、VMAT:小胞モノアミン輸送体。(Nestler E, Hyman S, Holtzman D, Malenka R. Molecular Neuropharmacology. McGraw-Hill Companies, Inc; 2015より改変。)
H2受容体は、ヒスタミン終末のシナプス後ニューロンで発現しています。H1受容体と比較して、H2受容体の機能についてははるかに知られていませんが、これはBBBを通過する特異的なアゴニストや拮抗薬が不足しているためでもあります。しかし、H2受容体は記憶保持と侵害受容に関与していると考えられています。シメチジン(タガメット)やファモチジン(ザンタック360、ペプシド)など、BBBを通過しないH2拮抗薬は、胃酸分泌を低下させ、胃潰瘍の痛みを軽減し治癒を早めるために使用されます。
H3受容体はヒスタミンニューロンのシナプス前に位置し、そこでヒスタミン放出を抑制する自己受容体として機能します。さらに、H3受容体は他の神経伝達物質の終末にヘテロ受容体として存在し、それらの機能を調節します。最近、H3受容体における選択的逆アゴニストである**ピトリサント(ワキックス)**が、ナルコレプシー、パーキンソン病、閉塞性睡眠時無呼吸症候群における過剰な日中の眠気に対抗するのに有効であることが示されています。H3受容体の拮抗薬および逆アゴニストは、認知障害の治療薬として潜在的な可能性があります。
H4受容体が脳内に存在するかどうかはまだ十分に確立されていませんが、脾臓、骨髄、白血球など、いくつかの末梢部位で発現しており、免疫系の調節と関連付けられています。アレルギー、喘息、慢性掻痒、自己免疫疾患などの疾患におけるH4受容体シグナル伝達の治療的変更にますます注目が集まっています。
微量アミン
古典的な生体アミンと構造的に類似するいくつかの生物学的に活性な化合物は、脊椎動物の脳や他の組織における濃度が低いため、微量アミンと呼ばれています。これらには、フェニルエチルアミン、チラミン、トリプタミンが含まれ、それぞれカテコールアミンおよびセロトニンのアミノ酸前駆体であるフェニルアラニン/チロシン、およびトリプトファンの脱炭酸によって形成されます。しかし、微量アミンは多くの一般的な食品にも豊富に含まれており、微生物叢によっても産生されます。これらは膜を容易に拡散し、特定の輸送タンパク質や貯蔵区画は特定されていません。これらはMAOを含むいくつかの酸化酵素の基質です。初期の研究では、フェニルエチルアミンに間接的な交感神経刺激作用、アンフェタミン様作用があることが特定されましたが、内因的に発生する濃度よりも高い濃度でした。微量アミン受容体の特定の受容体の特定は、微量アミンの機能と、精神状態の病因と治療におけるそれらの可能な役割に対する関心を喚起しました。特に、アンフェタミンやMDMAなどの一部の精神作用薬がこれらの受容体に対して高い親和性を示すためです。ヒトは6つの機能的アイソフォーム(TAAR1、TAAR2、TAAR5、TAAR6、TAAR8、TAAR9)を持っています。TAAR1を除き、すべて嗅覚上皮ニューロンで発現しています。しかし、TAAR1が最も徹底的に研究されており、中枢および末梢の両方の役割がそれと関連付けられています。脳内では、TAAR1はVTAと背側縫線核に比較的高い発現を示し、それぞれドーパミンとセロトニンの細胞体が集積している領域です。TAAR1を過剰発現するマウスまたは受容体をノックアウトしたマウスの作成は、微量アミンがニューロンの恒常性に寄与する可能性を解明するのに役立ちました。このような研究は、TAAR1受容体の活性化がドーパミン作動性ニューロンとセロトニンニューロンを抑制することを示しており、TAAR1ノックアウトマウスではそれらの発火率が増加することによって例示されます。TAAR1の調節メカニズムが、TAAR1とシナプス前ドーパミンまたはセロトニン自己受容体との間のヘテロダイマー形成を伴う可能性があり、これが伝達を負に調節するという示唆があります。脳における微量アミンの役割を明確にするにはさらなる研究が必要ですが、TAAR1は統合失調症や精神刺激薬依存症の再発防止などの疾患に対する新しい治療標的として特定されています。実際、TAAR1アゴニストは現在、統合失調症の治療のための臨床試験が行われており、利用可能な証拠はTAAR1指向性薬剤の乱用可能性がないことを示しています。
参考文献
- Azizi SA. Monoamines: dopamine, norepinephrine, and serotonin, beyond modulation, “switches” that alter the state of target networks. Neuroscientist. 2022;28(2):121-143.
- Baldan LC, Williams KA, Gallezot JD, et al. Histidine decarboxylase deficiency causes Tourette syndrome: parallel findings in humans and mice. Neuron. 2014;81:77-90.
- Bernstein AI, Stout KA, Miller GW. The vesicular monoamine transporter 2: an underexplored pharmacological target. Neurochem Int. 2014;73:89-97.
- Borroto-Escuela DO, Ambrogini P, Chruscicka B, et al. The role of central serotonin neurons and 5-HT heteroreceptor complexes in the pathophysiology of depression: a historical perspective and future prospects. Int J Mol Sci. 2021;22(4):1927.
- Chestnykh DA, Amato D, Kornhuber J, Müller CP. Pharmacotherapy of schizophrenia: mechanisms of antipsychotic accumulation, therapeutic action and failure. Behav Brain Res. 2021;403:113144.
- Cools R, Arnsten AFT. Neuromodulation of prefrontal cortex cognitive function in primates: the powerful roles of monoamines and acetylcholine. Neuropsychopharmacology. 2022;47(1):309-328.
- Delcourte S, Etievant A, Haddjeri N. Role of central serotonin and noradrenaline interactions in the antidepressants’ action: electrophysiological and neurochemical evidence. Prog Brain Res. 2021;259:7-81.
- Fernstrom JD. Large neutral amino acids: dietary effects on brain neurochemistry and function. Amino Acids. 2013;45(3):419-430.
- Gainetdinov RR, Hoener MC, Berry MD. Trace amines and their receptors. Pharmacol Rev. 2018;70:549-620.
- Gershman SJ, Uchida N. Believing in dopamine. Nat Rev Neurosci. 2019;20(11):703-714.
- Gomes I, Ayoub MA Fujita W, Jaeger WC, Pfleger KDG, Devi LA. G protein-coupled receptor heteromers. Annu Rev Pharmacol Toxicol. 2016;56:403-425
- Grace AA, Gomes FV. The circuitry of dopamine system regulation and its disruption in schizophrenia: insights into treatment and prevention. Schizophr Bull. 2019;45(1):148-157.
- Liu C, Kaeser PS. Mechanisms and regulation of dopamine release. Curr Opin Neurobiol. 2019;57:46-53.
- Liu Y, McNally GP. Dopamine and relapse to drug seeking. J Neurochem. 2021;157(5):1572-1584.
- Lohani S, Martig AK, Underhill SM, et al. Burst activation of dopamine neurons produces prolonged post-burst availability of actively released dopamine. Neuropsychopharmacology. 2018;43(10):2083-2092.
- Martinez D, Gil R, Slifstein M, et al. Alcohol dependence is associated with blunted dopamine transmission in the ventral striatum. Biol Psychiatry. 2005;58:779-786.
- McCutcheon RA, Abi-Dargham A, Howes OD. Schizophrenia, dopamine and the striatum: from biology to symptoms. Trends Neurosci. 2019;42(3):205-220.
- Meltzer HY. New trends in the treatment of schizophrenia. CNS Neurol Disord Drug Targets. 2017;16(8):900-906.
- Moran SP, Maksymetz J, Conn PJ. Targeting muscarinic acetylcholine receptors for the treatment of psychiatric and neurological disorders. Trends Pharmacol Sci. 2019;40(12):1006-1020.
- Nolan SO, Zachry JE, Johnson AR, Brady LJ, Siciliano CA, Calipari ES. Direct dopamine terminal regulation by local striatal microcircuitry. J Neurochem. 2020;155(5):475-493.
- Ott T, Nieder A. Dopamine and cognitive control in prefrontal cortex. Trends Cogn Sci. 2019;23(3):213-234.
- Pani L, Porcella A, Gessa GL. The role of stress in the pathophysiology of the dopaminergic system. Mol Psychiatry. 2000;5(1):14-21.
- Panula P. Histamine receptors, agonists, and antagonists in health and disease. Handb Clin Neurol. 2021;180:377-387.
- Papke RL, Horenstein NA. Therapeutic targeting of a 7 nicotinic acetylcholine receptors. Pharmacol Rev. 2021;73(3):1118-1149.
- Peters KZ, Cheer JF, Tonini R. Modulating the neuromodulators: dopamine, serotonin, and the endocannabinoid system. Trends Neurosci. 2021;44(6):464-477.
- Picciotto MR, Higley MJ, Mineur YS. Acetylcholine as a neuromodulator: cholinergic signaling shapes nervous system function and behavior. Neuron. 2012;76(1):116-129.
- Scammell TE, Jackson AC, Franks NP, Wisden W, Dauvilliers Y. Histamine: neural circuits and new medications. Sleep. 2019;42(1):zsy183.
- Stone EA, Lin Y, Sarfraz Y, Quartermain D. The role of the central noradrenergic system in behavioral inhibition. Brain Res Rev. 2011;67(1-2):193-208.
- Suchting R, Tirumalajaru V, Gareeb R, et al. Revisiting monoamine oxidase inhibitors for the treatment of depressive disorders: a systematic review and network meta-analysis. J Affect Disord. 2021;282:1153-1160.
- Tunbridge EM, Narajos M, Harrison CH, Beresford C, Cipriani A, Harrison PJ. Which dopamine polymorphisms are functional? Systematic review and meta-analysis of COMT, DAT, DBH, DDC, DRD1-5, MAOA, MAOB, TH, VMAT1, and VMAT2. Biol Psychiatry. 2019;86(8):608-620
- Waterhouse BD, Navarra RL. The locus coeruleus-norepinephrine system and sensory signal processing: a historical review and current perspectives. Brain Res. 2019;1709:1-15.
- Wise RA, Robble MA. Dopamine and addiction. Annu Rev Psychol. 2020;71:79-106.
- Wong DL, Tai TC, Wong-Faull DC, et al. Epinephrine: a short- and long-term regulator of stress and development of illness: a potential new role for epinephrine in stress. Cell Mol Neurobiol. 2012;32(5):737-748.
- Xing B, Li YC, Gao WJ. Norepinephrine versus dopamine and their interaction in modulating synaptic function in the prefrontal cortex. Brain Res. 2016;1641(Pt B):217-233.
- Zoli M, Pucci S, Vilella A, Gotti C. Neuronal and extraneuronal nicotinic acetylcholine receptors. Curr Neuropharmacol. 2018;16(4):338-349

