1.8 神経ペプチド:生物学、調節、および神経精神疾患における役割
マイケル・J・オーウェン, 理学士(優等)、医学士、博士、王立内科医会フェロー、SHAUN P. ブラザーズ, 博士、経営学修士、ラリー・J・ヤング, 博士、チャールズ・B・ネメロフ, 医学博士、博士
神経ペプチドは、中枢神経系(CNS)におけるシグナル伝達分子の中で最も多様なクラスを構成します。当初は下垂体ホルモン分泌の視床下部調節における役割で発見されましたが、過去40年間にわたって脳機能におけるペプチドの複雑な役割が明らかになってきました。神経ペプチドとその受容体はCNS全体に広く分布しており、神経伝達物質放出とニューロン発火パターンの調節から情動と複雑な行動の調節に至るまで、驚くほど多様な直接的または神経調節的効果を発揮します。脳内では100を超える独自の生物活性を持つ神経ペプチドが同定されており、その一部は表1.8-1に示されています。CNSにおける神経ペプチドシステムの複雑さに加えて、多くのペプチドの作用は、異なる脳領域に局在する複数の受容体サブタイプを介して媒介されます。実際、新しいペプチドと受容体サブタイプの発見は、正常または異常なCNS機能におけるこれらのペプチドの役割の理解を上回っています。薬理学的、分子学的、遺伝学的なアプローチは現在、精神疾患における神経ペプチドシステムの貢献を理解する上で主導的な役割を果たしています。本章の前半では、生合成、分布、シグナル伝達を含む神経ペプチドの生物学の概要を説明します。本章の後半では、行動および精神疾患に特に関連する神経ペプチドの厳選されたグループについて、具体的かつ詳細な情報を提供します。
表1.8-1. 選択された神経ペプチド神経伝達物質
| 名称 |
| 副腎皮質刺激ホルモン(ACTH) |
| アンジオテンシン |
| アペリン |
| 心房性ナトリウム利尿ペプチド |
| ボンベシン |
| カルシトニン |
| カルシトニン遺伝子関連ペプチド(CGRP) |
| コカインおよびアンフェタミン調節転写物(CART) |
| コレシストキニン(CCK) |
| 副腎皮質刺激ホルモン放出因子(CRF;副腎皮質刺激ホルモン放出ホルモン;CRH) |
| ダイノルフィン |
| β-エンドルフィン |
| ロイ-エンケファリン |
| メト-エンケファリン |
| ガラニン |
| ガストリン |
| グレリン |
| ゴナドトロピン放出ホルモン(GnRH) |
| 成長ホルモン |
| 成長ホルモン放出ホルモン(GHRH;GRF) |
| インスリン |
| キスペプチン |
| モチリン |
| ニューロキニンA(旧サブスタンスK) |
| 神経ペプチドS |
| 神経ペプチドY(NPY) |
| ニューロテンシン |
| ニューロメディン-N |
| ノシセプチン |
| オレキシン(ヒポクレチンとしても知られる) |
| オキシトシン |
| 膵ポリペプチド |
| プロラクチン |
| セクレチン |
| ソマトスタチン(SS;SRIF) |
| サブスタンスP |
| 甲状腺刺激ホルモン放出ホルモン(TRH) |
| ウロコルチン(1、2、および3) |
| 血管作動性腸管ペプチド(VIP) |
| バソプレシン(AVP;ADH) |
定義上、神経ペプチドとは、ペプチド結合によって結合された2つ以上のアミノ酸の鎖であり、アミノ酸鎖の長さのみが他のタンパク質と異なります。神経ペプチドの長さは、2アミノ酸(例:カルノシンとアンセリン)から40アミノ酸以上(例:副腎皮質刺激ホルモン放出因子[CRF]とウロコルチン)まで様々です。慣例として、長さが90アミノ酸(分子量約10,000)を超えるペプチドはタンパク質と見なされます。本章で詳細に強調されている神経ペプチドには、甲状腺刺激ホルモン放出ホルモン(TRH)、CRF、オキシトシン(OT)、アルギニンバソプレシン(AVP)、ニューロテンシン(NT)、および**神経ペプチドY(NPY)**が含まれ、コレシストキニン(CCK)、サブスタンスP(SP)、ガラニン、およびオレキシンに関する関連データの簡単な要約も含まれます。これらの強調された神経ペプチドの構造は表1.8-2に示されており、慣例に従い、左側のアミノ末端(NH2″)から右側のカルボキシル末端(-COOH)まで、一文字アミノ酸コードで書かれています。精神医学に関連する可能性のあるすべての神経ペプチドシステムに関する詳細な議論は本章の範囲外であり、オピオイドペプチド、成長因子、サイトカインを含む他のシグナル伝達ペプチドについては本書の別の箇所で考察されています。TRHとCRFは視床下部下垂体刺激ホルモンであり、それぞれ甲状腺刺激ホルモン(TSH)と副腎皮質刺激ホルモン(ACTH)を前葉下垂体(腺下垂体)から血流中に放出します。OTとAVPは神経下垂体ペプチドであり、特定の生理学的条件下で後葉下垂体(神経下垂体)から血流中に直接放出されます。しかし、これらの上記のペプチドはすべて、NTを含め、しばしば末梢内分泌系への効果とは全く異なり独立した形で、CNSにおいて神経伝達物質、神経調節物質、または神経ホルモンとして機能します。実際、多くの神経ペプチドは2つの異なる活動、すなわちCNSにおける活動と、時には末梢において大きく異なる活動を進化させてきたようです。例えば、OTとAVPはCNSにおける情動に寄与すると考えられており、妊娠中に末梢で子宮収縮を刺激します。おそらく、明確な研究成果を達成することをさらに混乱させるのは、これらの明らかに異なるシステムが、例えば母親の出産後の養育行動に寄与するなど、ある程度の重複さえ持つ可能性があるということです。もう1つの例は、CNSにおけるμ-オピオイド受容体であり、これは侵害受容と報酬を調節し、末梢では呼吸と腸の運動性を調節します。このため、アヘン剤には呼吸抑制と便秘の副作用があります。
表1.8-2. 選択された神経ペプチド構造
| 名称 | アミノ酸配列 |
| 甲状腺刺激ホルモン放出ホルモン(TRH) | pE-H-P-NH2 |
| 副腎皮質刺激ホルモン放出因子(CRF) | S-E-E-P-P-I-S-L-D-L-T-F-H-L-L-R-E-V-L-E-M-A-R-A-E-Q-L-A-Q-Q-A-H-S-N-R-K-L-M-E-I-I-NH2 |
| アルギニンバソプレシン(AVP) | C-Y-I-Q-N-C-P-L-G-NH2 |
| オキシトシン(OT) | C-Y-F-Q-N-C-P-R-G-NH2 |
| ニューロテンシン(NT) | pE-L-Y-E-N-K-P-R-R-P-Y-I-L-OH |
| 神経ペプチドY | Y-P-S-K-P-D-N-P-G-E-D-A-P-A-E-D-M-A-R-Y-Y-S-A-L-R-H-Y-I-N-L-I-T-R-Q-R-Y-NH2 |
| サブスタンスP | R-P-K-P-Q-Q-F-F-G-L-M-NH2 |
| ガラニン | G-W-T-LN-S-A-G-Y-L-L-G-P-H-A-V-G-N-H-R-S-F-S-D-K-N-G-L-T-S |
| オレキシンB | M-T-L-I-G-A-A-H-N-G-S-A-Q-L-L-R-Q-L-R-G-Q-L-G-P-P-G-S-R-NH2 |
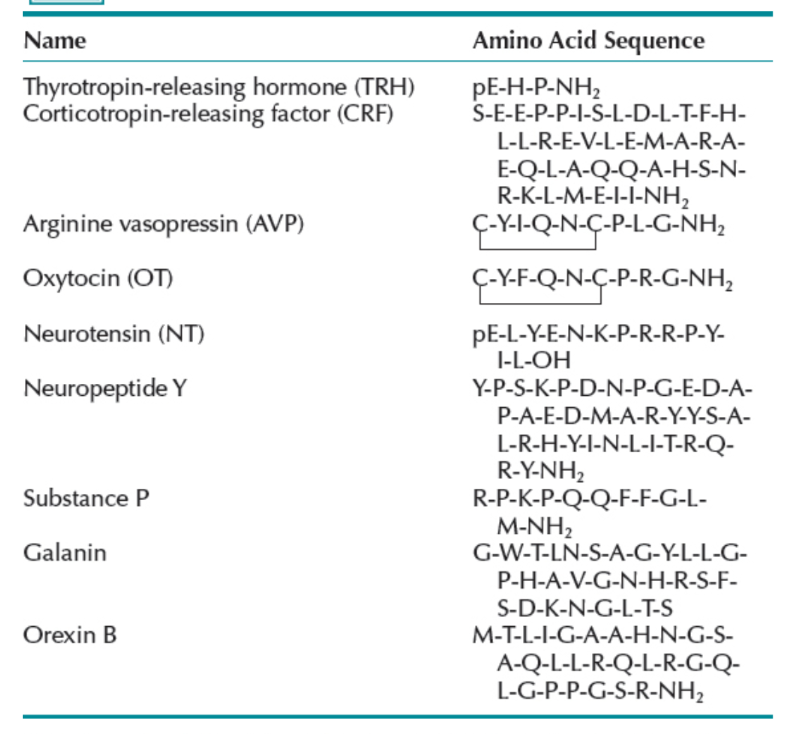
注:TRHおよびNTのN末端にある環化グルタミンはpE-で示され、AVPおよびOTのシステイン-システインジスルフィド結合、TRH、CRF、AVP、OT、NPY、サブスタンスPおよびオレキシンBのアミド化されたカルボキシ末端に注意してください。ヒトガラニンは遊離アミノ末端を持っています。
神経ペプチドは、体温調節、食物と水の摂取、性行動、睡眠、運動、学習と記憶、ストレスと痛みへの反応、感情、社会的認知など、様々な行動および生理学的プロセスの調節に関与していることが示唆されています。このような行動プロセスへの関与は、神経ペプチド系が、自閉症、統合失調症、気分障害、不安症を含む主要な精神疾患に現れる症状や行動に寄与している可能性を示唆しています。
神経ペプチド機能の調査
神経ペプチドのCNS機能と行動における役割は、多様な実験技術を用いて検討されてきました。分析のレベルには、ペプチドとその受容体の分子構造と生合成、ペプチドとその受容体の神経解剖学的局在、ペプチドの発現と放出の調節、そして最終的にはペプチドの行動効果が含まれます。神経ペプチド生物学に関する情報の多くは、実験動物の研究から得られていますが、ヒトにおけるいくつかの神経ペプチドシステムの局在、活性、および潜在的な精神医学的関連性に関するデータベースは絶えず増加しています。
ほとんどの神経ペプチド構造は、精製された生物活性ペプチドの化学分析に基づいて特定され、最終的にそれらをコードする遺伝子のクローニングと特性評価につながりました。ペプチドとその受容体の遺伝子構造の特性評価により、これらのシステムの分子調節を理解することが可能になり、それらの染色体局在は、精神疾患の病因におけるこれらの遺伝子の潜在的役割を調べる遺伝子研究に有用です。構造特性評価により、脳内のペプチド分布と調節を決定するのに有用な免疫学的および分子プローブの生産が可能になります。微細解剖された脳領域における定量的酵素免疫測定法(ELISA)または脳切片における免疫細胞化学は、脳全体におけるペプチドの領域分布を特性評価するために一般的に使用されます。両方の技術は、その存在を検出するために神経ペプチドに対して生成された特異的抗体を使用します。免疫細胞化学は、研究者がペプチド合成細胞の正確な細胞内局在と、脳全体にわたるそれらの投射を視覚化することを可能にしますが、この技術は一般的に定量的ではありません。ペプチドまたは受容体をコードするmRNAに相同な分子プローブを使用して、in situハイブリダイゼーションは、脳切片における遺伝子発現を局在化および定量化するために使用できます。これは、ドーパミン、セロトニン、ノルエピネフリンなど、メッセンジャーRNAの翻訳から直接派生しない他のクラスの非ペプチド神経伝達物質では不可能である、正確な神経解剖学的解像度で神経ペプチド合成の分子調節を調べるための強力な技術です。免疫細胞化学およびin situハイブリダイゼーションに加えて、脳切片における受容体オートラジオグラフィー(図1.8-1)または微細解剖された脳組織における「粉砕結合」受容体結合アッセイは、脳の特定の領域における神経ペプチド受容体を局在化および定量化するために頻繁に使用されます。受容体オートラジオグラフィーは、放射性標識リガンドを薄い組織切片上の受容体に結合させ、X線フィルムまたは他の手段で視覚化することにより結合を検出することを含みます。定量的リアルタイムポリメラーゼ連鎖反応(RT-PCR)やRNAシーケンシング(トランスクリプトミクス)などの他の分子技術も、ペプチドまたは受容体をコードするmRNAを定量化することにより、神経ペプチドおよび受容体の発現と調節を測定するために一般的に使用されます。しかし、細胞または組織ホモジネート内の神経ペプチド遺伝子発現または免疫反応性の定量化は、神経ペプチド放出に関する情報を提供しません。生体内マイクロダイアリシスは、特定の脳領域に埋め込まれた透析プローブを使用して、細胞外液に濃縮され、おそらくニューロン放出に由来するペプチドを連続的な時間間隔で収集するものであり、定義された生理学的または行動的条件下での神経ペプチド放出を定量化するために使用できます。
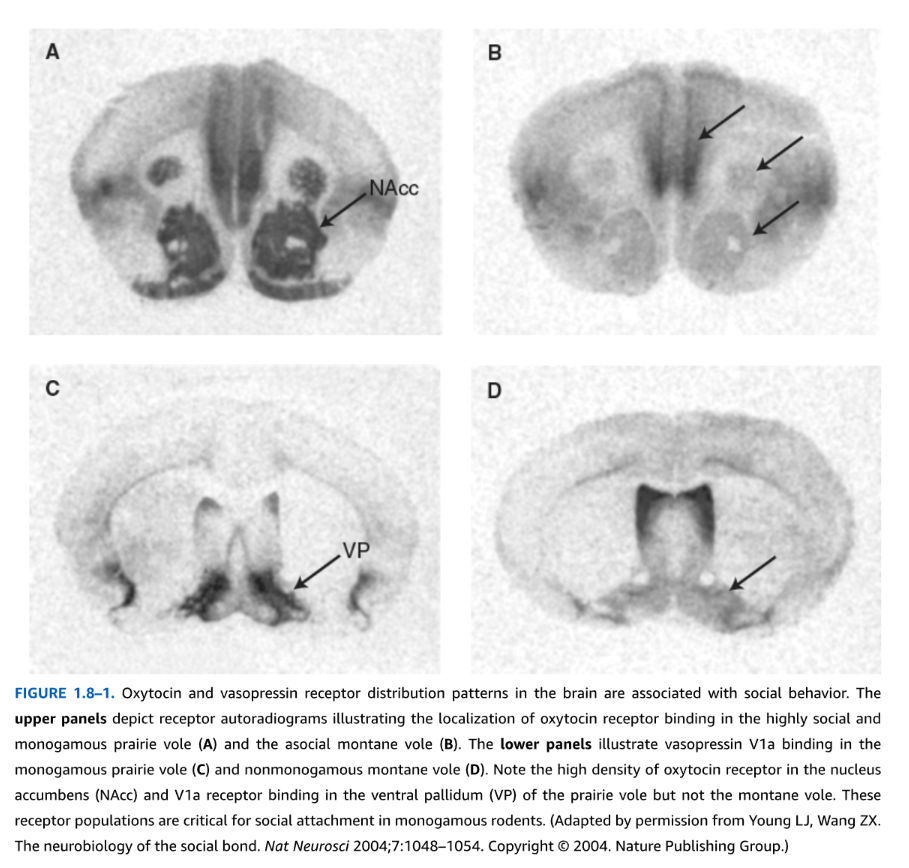
図1.8-1。オキシトシンとバソプレシンの脳内受容体分布パターンは社会行動と関連している。上段のパネルは、非常に社交的で一夫一婦制のプレーリーハタネズミ(A)と非社交的なヤマハタネズミ(B)におけるオキシトシン受容体結合の局在を示す受容体オートラジオグラムである。下段のパネルは、一夫一婦制のプレーリーハタネズミ(C)と非一夫一婦制のヤマハタネズミ(D)におけるバソプレシンV1a結合を示している。プレーリーハタネズミの側坐核(NAcc)におけるオキシトシン受容体結合の密度と腹側淡蒼球(VP)におけるV1a受容体結合の密度の高さは、ヤマハタネズミには見られない。これらの受容体集団は、一夫一婦制のげっ歯類における社会的愛着に不可欠である。(Young LJ, Wang ZX. The neurobiology of the social bond. Nat Neurosci 2004;7:1048-1054より許可を得て改変。Copyright 2004. Nature Publishing Group.)
一般に、神経ペプチドの行動効果は、最初にペプチドを脳内に直接注入することによって調査されます。多くの非ペプチド神経伝達物質とは異なり、ほとんどの神経ペプチドは、中枢神経系(CNS)に影響を与えるのに十分な量で血液脳関門を通過しません。さらに、血清および組織酵素は、標的部位に到達する前にペプチドを分解する傾向があります。この分解は通常、その目的のために設計された特定のペプチダーゼによって標的とされる特定のNアミノ酸配列の切断の結果です。したがって、動物モデルにおけるペプチドの行動効果を調査するためには、通常、脳室内(ICV)または部位特異的注入が必要です。ただし、ヒト被験者における経鼻投与による神経ペプチドの送達の例もいくつかあり、場合によってはペプチドが脳にアクセスできるようになるようです(例:オキシトシン)。ただし、これには依然として議論の余地があります。
多くの場合、特定の神経ペプチドといくつかの異種受容体との間のかなりのクロストークがあるため、神経ペプチド注入研究の解釈は複雑です。例えば、オキシトシンとバソプレシンは9個のアミノ酸のうち2個しか異ならず、両方のペプチドは両方の受容体タイプとある程度交差反応します。場合によっては、研究者が行動または生理学的プロセスの調節における特定の神経ペプチド受容体の役割を検討できるように、非常に選択的なペプチド受容体合成アゴニストまたはアンタゴニストが開発されています。さらに、神経ペプチド機能を調査するために、トランスジェニックマウスおよびノックアウトマウスのアプローチが一般的に使用されます。例えば、ペプチド遺伝子または対応する受容体のいずれかにヌル変異(ノックアウト)を有する変異マウス株が開発されており、行動プロセスにおける神経ペプチドの役割を探るのに非常に有用であることが証明されています。特定の脳領域における標的mRNAの選択的分解につながる低分子干渉RNA(siRNA)またはショートヘアピンRNA(shRNA)技術は、特定の神経ペプチド産生ニューロン集団の機能を検討するために使用されています。遺伝子編集に用いられてきたCRISPR/Casシステムは、神経ペプチドや遺伝子の上方制御/下方制御の時空間的効果を分離し始める可能性を秘めています。ウイルスを用いて特定の微量注入脳領域で神経ペプチドまたは受容体RNAを選択的に過剰発現またはノックダウンする同様の取り組みも追求されています。トランスジェニックおよびウイルスベクターアプローチは、オプトジェネティクス、ケモジェネティクス、およびファイバーフォトメトリーを使用して、神経ペプチドまたは受容体発現ニューロンの活動と機能を調査するためにますます使用されています。これらのアプローチは、通常マウスである、ペプチドまたはペプチド受容体転写産物とタンデムでCreリコンビナーゼを発現する遺伝子操作されたげっ歯類によって可能になります。光感受性オプシン、新規な「デザイナー」受容体、または細胞内カルシウムインジケーター(例:GCaMP)を発現するCre依存性ウイルスベクターと組み合わせることで、研究者は特定のペプチドまたは受容体ニューロン集団の活動を精巧に制御または監視することができます。このアプローチは、ニューロンの機能を神経ペプチドシグナル伝達から分離するために薬理学的操作と組み合わせる必要があります。
上記のように、神経ペプチドの役割と潜在的な治療的価値を探る上での最大の障害の1つは、ペプチドまたはそのペプチド性アゴニスト/拮抗薬が血液脳関門を透過できないことです。したがって、ヒトにおけるほとんどのペプチドの行動効果は、経鼻投与を利用したいくつかの研究を除いて、ほとんど未調査です。しかし、場合によっては、末梢投与可能で、受容体活性化に影響を与えるのに十分な量で血液脳関門を透過する低分子非ペプチド性アゴニスト/拮抗薬が開発されています。他のアプローチとしては、脳透過性薬物を用いて内因性神経ペプチド放出を薬理学的に誘発する方法があります。
ヒトはいくつかの理由から、神経ペプチド研究にとって理想的な被験者ではありません。第一に、血漿ホルモン濃度を決定するための血液サンプルは比較的容易に得られますが、末梢とCNSのペプチド放出の独立した調節、血漿ペプチダーゼの高濃度、および血液脳関門は、血漿ホルモン濃度からCNSペプチド生理学を推論することを事実上不可能にします。また、組織ペプチド濃度を直接評価するための生検の使用は、ルーチンで反復可能ではなく、表層構造に限定され、潜在的な罹患率に苦しむため、理想的ではありません。しかし、対照的に、脳脊髄液(CSF)は、いくつかの神経伝達物質の細胞外液濃度を反映することが示されており、CNSと直接接触しており、血液脳関門によって末梢血清源から遮断されており、時間をかけて採取することができます。ヒトCSF研究の限界には、検出されたペプチド濃度の変化のCNS起源に関する情報不足、高位前脳CNSのペプチド源からやや離れており、脊髄ペプチドの寄与を受ける腰椎CSFの使用、以前の薬物治療または疾患エピソードの潜在的に混乱させる影響、およびこの手順に同意する研究被験者の躊躇が含まれます。精神疾患における神経ペプチド濃度変化の死後組織研究は多くの場合で情報を提供してきましたが、解釈には死後遅延、以前の薬物治療、および併存疾患の考慮を含める必要があります。CSFまたは組織中の神経伝達物質濃度変化に関するデータのほとんどは、診断的に定義された精神医学的グループと対照グループとの比較から得られています。しかし、対照は、健康なボランティアではなく、いわゆる「神経学的または精神医学的対照」である可能性があり、診断の正確性と一貫性は最適ではないかもしれません。さらに、症候性診断の病因は、同じ診断グループ内の被験者間で異なる場合があります。年齢、性別、その他の人口統計学的変数と一致させた後でも、ヒトの研究集団間の異質性は、絶対的なペプチド値の個々の変動につながり、それはしばしば非常に広範です。このような分散は、ペプチド濃度変化を検出するためのグループ比較の検出力を著しく低下させます。治療前後のCSFサンプル、または活動的な疾患状態と患者が寛解期にあるときのサンプルを使用することは、研究デザインにおける深刻な制限の一部に対処します。統合失調症やアルツハイマー病(AD)のような進行性疾患の場合、連続的なCSFサンプルは疾患の進行または治療への反応の貴重な指標となる可能性があります。これらの制約があるにもかかわらず、様々な精神疾患状態がCNSの神経ペプチドシステムに与える影響を記述する上で、大きな進歩が遂げられています。
生合成
他の神経伝達物質とは異なり、神経ペプチドの生合成には、特定の遺伝子からのmRNAの転写、そのmRNAによってコードされるポリペプチドプレプロホルモンの翻訳、そして活性な神経ペプチドを生成するためのプレプロホルモンのタンパク質分解的切断を含む翻訳後修飾が関与します。過去40年間で、ほとんどの神経ペプチドの遺伝子構造と生合成経路が解明されてきました。選択された神経ペプチドの遺伝子構造を図1.8-2に示します。神経ペプチド遺伝子は通常、タンパク質プレプロホルモンをコードする複数のエキソンで構成されています。プレプロホルモンのN末端には**シグナルペプチド(SP)**配列が含まれており、これが成長中のポリペプチドを粗面小胞体(RER)膜に導きます。単一のプレプロホルモン分子は、しばしば複数のペプチドの配列を含んでおり、これらはその後、特定の酵素によるタンパク質分解的切断によって分離されます。例えば、NTをコードする遺伝子の翻訳はプレプロホルモンを生成し、これは酵素的切断によってNTとニューロメディン-Nの両方を産生します。TRH遺伝子などの他の神経ペプチド遺伝子は、ペプチド配列の複数のコピーをコードするか、OTやバソプレシンの場合のように、神経ペプチドの翻訳後修飾と輸送に不可欠な他のタンパク質もコードします。神経ペプチドの神経解剖学的局在と存在量は、主にそれらの遺伝子の領域特異的な発現と調節によって決定されます。各神経ペプチド遺伝子は、脳内の明確に定義されたニューロン集団で発現しています。ペプチドホルモン遺伝子発現の正確な神経解剖学的パターンは、遺伝子を囲む調節DNA配列によって決定されます。これはOT遺伝子についてエレガントに実証されています。OT遺伝子の5’調節領域を含むウイルスベクター構築物は、OTニューロンにおけるトランスジーン発現を確実に誘導し、行動状況におけるこれらのニューロンの活動とOT放出の光遺伝学的または化学遺伝学的操作を可能にします。遺伝子のプロモーターに位置する転写因子結合部位も、ペプチド遺伝子発現の生理学的調節に関与しています。ペプチド遺伝子のプロモーター配列の分析は、ペプチド生合成の分子調節に関する洞察を提供しました。
プレプロホルモンをコードするmRNAは、RERに関連するリボソームによって翻訳され、成長中のポリペプチドは、SPが槽内のRER膜に固定された状態で翻訳されます。翻訳されると、プレプロホルモンのSPはシグナルエンドペプチダーゼによって切断され、プロホルモンポリペプチドが解放されます。プロホルモンはその後、ゴルジ装置に輸送され、そこで顆粒または小胞へのパッケージングが行われます。プロホルモンから生物活性神経ペプチドへのタンパク質分解的切断はゴルジで始まり、顆粒内で続きます。プロホルモンからの生物活性神経ペプチドの産生は、プロホルモンコンベルターゼとして知られる特定のエンドペプチダーゼによって、神経ペプチド配列に隣接する特定の部位での切断から始まります。プロホルモンコンベルターゼは、一般的に神経ペプチド配列を挟む塩基性アミノ酸のペア(例:Lys-Arg、Lys-Lys、Arg-Arg)で切断します。少なくとも7種類のプロホルモンコンベルターゼがあり、それぞれに基質特異性や神経内分泌分布など、独自の特性があります。プロホルモンコンベルターゼは、ゴルジ装置の顆粒内でプロホルモンと一緒にパッケージングされます。プロホルモンコンベルターゼの基質特異性と異なる分布は、単一のプロホルモンによってコードされる異なる神経ペプチドが活性な形で異なって産生されるメカニズムを提供します。エンドペプチダーゼ切断の後、ペプチド断片は、ペプチド断片のカルボキシ末端またはアミノ末端の残りの塩基性残基を除去するために、カルボキシペプチダーゼおよび/またはアミノペプチダーゼによるエキソプロテオリシスを受けます。神経ペプチドの合成と処理を図1.8-3に示します。

