エイコサノイド
概要
オメガ-3脂肪酸(エイコサペンタエン酸(EPA)、そのエステルであるエチル-エイコサペンタエン酸(E-EPA)、ドコサヘキサエン酸(DHA))といった栄養補助食品が、うつ病、双極性障害、統合失調症、認知機能障害の症状緩和に役立つことが臨床所見で示唆されています。DHAとEPAは、子供の行動上の激しい発作を軽減し、注意力を改善するのに役立つ可能性があります。
化学
必須脂肪酸は、脂肪酸鎖のメチル末端基から3番目の位置に炭素-炭素二重結合を持つ多価不飽和脂肪のグループです。これらは、一価不飽和脂肪酸や飽和脂肪酸とは異なり、体内で合成できないため、天然の脂肪や油から食事を通じてのみ摂取できるため、「必須」とされます。**リノール酸(LA)**はオメガ-6脂肪酸の親化合物であり、**α-リノレン酸(ALA)**はオメガ-3脂肪酸の親化合物です。オメガ-3とオメガ-6の両グループは、不飽和化と鎖伸長に同じ酵素を使用します。オメガ-3脂肪酸は藻類とプランクトンによって合成されます。ニシン、サケ、サバ、カタクチイワシなどの魚はこれらの水生種を捕食し、豊富なオメガ-3の食事源となります。EPAとDHAは高度に不飽和なオメガ-3脂肪酸であり、それぞれ長い構造鎖に6つと5つの二重結合を含んでいます。これらは細胞膜にリン脂質によって配置され、細胞膜シグナル伝達において重要な役割を果たします。
特定の臓器およびシステムへの影響
脂肪酸サプリメントによる治療の最も強力な科学的証拠は、心血管系の文献から得られています。いくつかのヒト試験で、オメガ-3脂肪酸が血圧を下げ、再発性心筋梗塞の発生率を減らし、トリグリセリドレベルを低下させることが示されています。神経系では、脂肪酸はニューロン、免疫細胞、グリアのリン脂質膜構造の必須成分です。これらは脳血流を増加させ、血小板凝集を減少させ、心血管系におけるアテローム性動脈硬化の進行を遅らせます。オメガ-6脂肪酸は炎症と神経細胞のアポトーシスを減少させ、ホスファチジルイノシトールセカンドメッセンジャー活性を低下させるようです。オメガ-3脂肪酸は遺伝子発現を変化させることが示唆されています。
中枢神経系では、脂肪酸は神経細胞膜に選択的に濃縮され、細胞膜構造に関与しています。オメガ-6アラキドン酸は、酸化毒性および神経変性において、グルタミン酸神経伝達を増強し、ストレスホルモン分泌を刺激し、グリア細胞活性化を誘発することが示されています。オメガ-3脂肪酸のDHAとEPAは、炎症性および酸化性毒性からニューロンを保護するようです。細胞培養モデルでは、セロトニンの増加、ドーパミンの増強、副腎皮質刺激ホルモン放出因子の調節が実証されています。
うつ病のげっ歯類モデルでは、慢性的なEPA治療がオープンフィールドテストにおける行動を正常化しました。辺縁系領域のセロトニンとノルエピネフリンも増加しました。オメガ-3が不足した食事を与えられたマウスは、記憶力が低下し、学習パターンが変化し、より多くの行動上の問題を示しました。
治療適応
気分障害に対する魚油の使用に関する臨床研究は、魚の摂取量とうつ病症状の間に負の相関関係がある疫学研究から始まりました。一人当たりの魚の摂取量が少ない国では、大うつ病、双極性障害、産後うつ病の発生率が最大60倍増加しました。観察研究では、アイスランドと日本における季節性情動障害の発生率が緯度から予測されるよりも低いのは、これらの集団が食事で摂取する脂肪酸の量に関連していると結論付けられました。ノルウェーの研究では、タラ肝油の使用がうつ病症状を減少させることが示されました。心筋梗塞後のうつ病では、アラキドン酸とEPAの比率が高くなります。大うつ病性障害と診断された患者の脳の死後研究では、眼窩前頭皮質におけるDHAの減少が示されています。
オメガ-3脂肪酸の最初の無作為化対照パイロット研究は、標準的なリチウムまたはバルプロ酸治療に加えて、双極性および単極性うつ病患者の両方に対する補助治療に焦点を当てました。オメガ-3脂肪酸群はハミルトンうつ病評価尺度で有意な改善を示し、プラセボ群よりも長い寛解期間を示しました。その後の大規模な研究は、双極性障害に対するE-EPAによる治療の利点を裏付けました。しかし、双極性障害または急速交代型をE-EPAで治療した患者群の研究では、EPA群とプラセボ群の間でいかなる結果測定値にも有意な差は示されませんでした。治療群では出血時間も増加しました。
2002年、2つの画期的な二重盲検プラセボ対照研究は、単極性うつ病の標準治療に加えてE-EPAまたはDHAを補給すると、ハミルトンうつ病評価尺度で有意な減少につながることを示しました。その後のより長期間でより多くの被験者による研究では、EPAとDHAの補給がうつ気分や認知機能に効果をもたらすことはありませんでしたが、サプリメントによる有害作用も認められませんでした。メタアナリシスはオメガ-3脂肪酸の抗うつ効果を示していますが、より大規模な試験では、うつ病治療における好ましい対象被験者、最適な投与量、およびオメガ-3の組成が特定される可能性があります。
アメリカのガイドラインでは妊娠中のシーフードの摂取制限が推奨されていますが、日本の研究では、EPAではなくDHAの低摂取が産後うつ病のリスクを増加させることが示唆されています。妊娠中の大うつ病性障害に対する単剤療法としてのオメガ-3脂肪酸の無作為化試験では、対照群と比較してハミルトンうつ病評価スコアの低下と治療遵守が示されました。
最も説得力のある証拠は、初期の脳の発達と学習研究から得られています。DHAが豊富な食品を摂取した妊婦は、問題解決能力が向上した乳児を出産しましたが、必ずしも記憶力が向上したわけではありませんでした。視力と眼の発達も、妊娠中のDHA補給と関連しています。
発達性協調運動障害の子供に対するオメガ-3脂肪酸の食事補給に関するオックスフォード・ダーラム研究は、学習障害、注意欠陥多動性障害、自閉症における潜在的に論争のある役割を示唆しています。著者らは、不注意、多動性、衝動性の有意な減少を認めました。クロスオーバープラセボ群は魚油サプリメントに切り替えた後改善し、マルチビタミンはADHD症状に追加の利益を示しませんでした。これにより、イングランドのダーラム郡議会の教育関係者は、5,000人の子供たちが学校の配置試験に臨む際、彼らの成績向上を助けるためにオメガ-3魚油に100万ポンドを費やす計画を立てました。
行動研究では、メガ-3脂肪酸を含むシーフードを多く摂取したイングランドの囚人は、暴行率の低下が見られました。フィンランドの暴力犯罪者の研究では、非暴力犯罪者と比較して、体内のオメガ-3脂肪酸レベルが低いことが特定されました。
統合失調症の陰性症状と精神病性症状は、オメガ-3脂肪酸の補給によって改善される可能性があります。ハロペリドールなどの抗精神病薬は、抗酸化剤とオメガ-3脂肪酸を組み合わせると、錐体外路系副作用が少なくなるようです。
EPAとDHAは認知症の発生率の低下と関連しています。5,300人以上の患者の縦断コホートであるロッテルダム研究を検討した結果、魚の摂取は新規認知症の発症と逆相関しているように見えました。6年後の研究のさらなる分析では、オメガ-3脂肪酸の低摂取が認知症のリスク増加とは関連しないことが示されました。対照的に、同じくオランダの Zutphen 研究では、魚の大量摂取が3年後と5年後の両方で認知機能低下と逆相関していると結論付けられました。オメガ-3脂肪酸が認知機能障害の予防に推奨される前に、十分に設計された臨床試験が必要です。
注意事項と有害反応
最も重篤な合併症は、出血リスクの増加です。食事源には重金属が含まれる可能性があり、カプセル製剤の標準的な調製法は確立されていません。治療研究では、様々な異なる用量が示されています。
ニューロステロイド
背景
ステロイドが身体のホメオスタシスの維持に不可欠である一方で、ニューロステロイドは脳内でコレステロールから合成され、副腎や性腺における末梢での形成とは独立しています。ニューロステロイドは、数種類の中枢神経系(CNS)および末梢神経系(PNS)細胞のミトコンドリア内またはミトコンドリア外で、P450酵素および非P450酵素によって支配される一連の酵素プロセスによって産生されます(図1.9-10)。
ニューロステロイドは、非ゲノム経路を介して、神経伝達物質作動性イオンチャネルへの影響を介して神経興奮性を調節することができます。受容体は一般に、CNSおよびPNSの核、膜、または微小管に位置しています。ステロイドとニューロステロイドは同じ核受容体に作用する可能性がありますが、ニューロステロイドはトポロジー的分布と局所的な合成においてステロイドとは異なります。ニューロステロイドの最もよく知られた効果は、GABA受容体、特にGABA$_A$受容体αサブユニットに対するものです。これらの作用物質は受容体を直接活性化するのではなく、GABAがGABA$_A$受容体チャネルを開く能力を高めるポジティブアロステリックモジュレーターです。主にこの部位に作用するニューロステロイドには、アロプレグナノロン(3α5αテトラヒドロプロゲステロン)、プレグネノロン(PREG)、およびテトラヒドロデオキシコルチコステロン(THDOC)が含まれます。最も一般的なニューロステロイドであるDHEA-S(デヒドロエピアンドロステロン硫酸塩)は、GABAの非競合的モジュレーターとして作用し、その前駆体であるDHEA(デヒドロエピアンドロステロン)もGABA受容体で抑制効果を示すことが示されています。一部のニューロステロイドは、N-メチル-D-アスパラギン酸受容体(NMDA-R)、α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾール-プロパン酸受容体(AMPA-R)、カイニン酸受容体、グリシン受容体、セロトニン受容体、シグマタイプ-1受容体、およびニコチン性アセチルコリン受容体にも作用する可能性があります。プロゲステロンもニューロステロイドと見なされており、プロゲステロン受容体で遺伝子発現を調節することができます。ニューロステロイドが、GABA$_A$受容体αサブユニットのポジティブアロステリックモジュレーターでもあるベンゾジアゼピンと、そのスペクトルにおいてどのように異なるのかという疑問が残っています。手がかりの1つは、GABA$_A$の6つの異なるタイプのαサブユニットのうち、ベンゾジアゼピンがα-4またはα-6に結合しないのに対し、ニューロステロイドは他のサブユニットの中でもこれらに結合するということです。
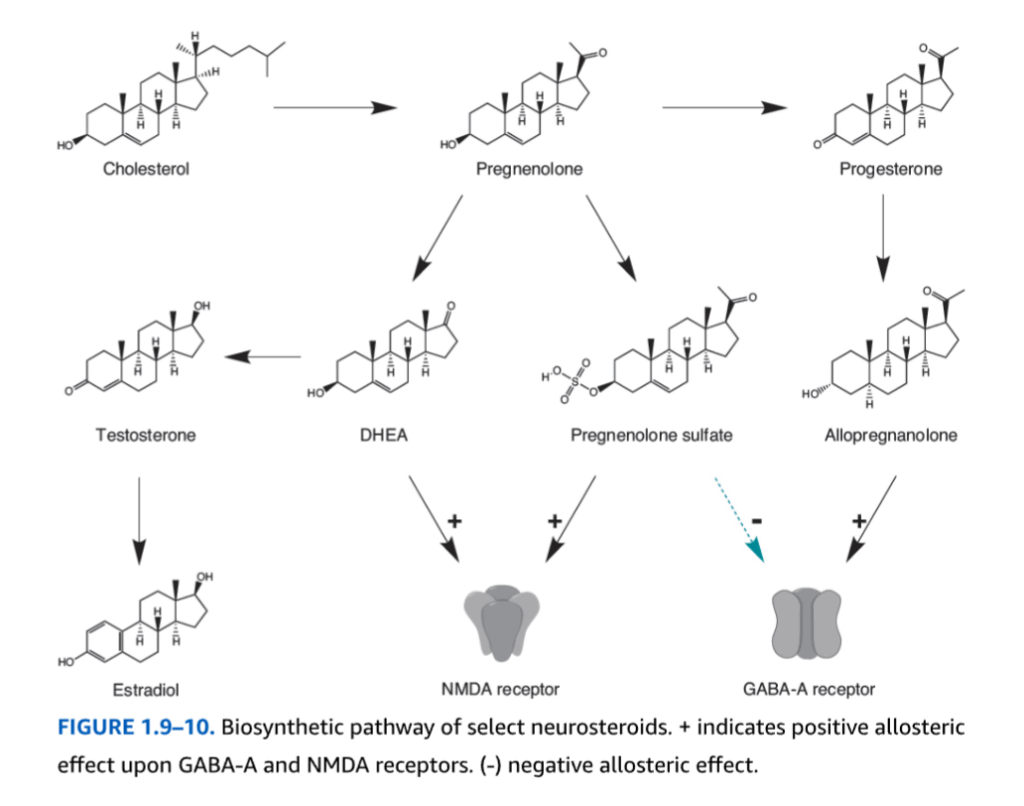
図1.9-10:選択されたニューロステロイドの生合成経路
(+)はGABA-A受容体およびNMDA受容体に対する正のアロステリック効果を示し、(-)は負のアロステリック効果を示します。
神経発達と神経保護におけるニューロステロイド
ニューロステロイドは、軸索の成長を刺激し、シナプス伝達を促進することが示されています。特定の神経保護効果は、各ニューロステロイドに固有のものです。DHEAは、脳のセロトニンとドーパミンのレベルを調節し、コルチゾールを抑制し、海馬のプライムバースト増強とコリン作動性機能を増加させ、アミロイドβタンパク質を減少させ、炎症性サイトカインの産生を阻害し、フリーラジカルのスカベンジングを防ぐ作用があります。DHEAとDHEA-Sの両方は、グリアの発達と神経成長に役割を持ち、動物の生存を促進することが示されています。マウスの脳へのDHEAの注射は、健忘症を改善し、長期記憶を促進しました。プロゲステロンは、損傷した神経ミエリン修復の補助など、ミエリン形成プロセスに関連しています。アロプレグナノロンは、軸索退縮中の接触の減少に寄与します。
精神疾患におけるニューロステロイドの役割
ニューロステロイドは、正常な神経機能の維持に明確な影響を与え、神経精神疾患に寄与します。ニューロステロイドは男女で異なって調節され、これら2つの集団における心理的障害の発現に影響を与える可能性があります。特に、気分障害と不安障害において明確な役割を果たします。**アロプレグナノロン(ブレキサノロン、Zulresso)**は産後うつ病に有益な効果をもたらし、FDA承認の静脈内治療薬です。**ズラノロン(SAGE-217)**は経口投与可能なGABA$_A$ポジティブモジュレーターであり、大うつ病性障害の第2相試験で効果が示されています。
うつ病
うつ病患者は、非うつ病対照群と比較して、血漿およびCSF中のアロプレグナノロン濃度が低いことが研究で示されています。さらに、この研究は、アロプレグナノロン濃度とうつ病の重症度との間に逆相関関係があることを明らかにしました。抗うつ薬、特にフルオキセチンは、複数の研究で特定のニューロステロイドのレベルを増加させることが示されています。それにもかかわらず、ニューロステロイドの治療特性については議論があり、非薬理学的治療を受けている患者におけるニューロステロイド濃度の調査が促されています。予備的な結果は、非薬理学的治療中にニューロステロイドレベルの修飾がないことが、投薬を受けた集団におけるニューロステロイドレベルの上昇における抗うつ薬の薬理学的特性の妥当性を支持し、その治療作用ではないことを示しています。2006年のミルタザピンを用いた臨床研究では、治療効果の有無にかかわらず、大うつ病性障害患者のアロプレグナノロン濃度が増加しました。
不安障害
不安障害の患者において、主要な作用機序はGABA受容体にあります。正常なGABA作動性活性を特徴とするホメオスタシスは、ストレスに応じてニューロステロイドが放出されることでパニック発作後に回復します。アロプレグナノロンは、ベンゾジアゼピンの20倍、バルビツール酸塩の200倍の強度でGABA作動性活性を刺激します。GABA$_A$受容体の正および負の調節は、それぞれ抗不安作用および不安誘発作用と相関しています。
精神病性障害
気分障害および不安障害の薬理学的治療における主な関連性に加えて、ニューロステロイドは精神病性障害、小児期の障害、物質乱用、摂食障害、産後障害に寄与します。統合失調症などの精神病性障害に対するニューロステロイドの影響は、DHEAとDHEA-Sによって媒介されます。DHEAは統合失調症患者の不安を軽減するために投与されており、DHEAとDHEA-SがGABA抑制を抑制し、NMDA-R受容体とシグマ受容体における神経応答を高めるためです。DHEAとDHEA-Sのレベルは、初回精神病エピソードで通常上昇しています。
注意欠陥障害
子供において、ADHDの臨床症状はDHEAとプレグネノロンのレベルと逆相関しています。
物質乱用
アルコールはGABA受容体を調節し、脳内でデノボステロイド合成を誘導すると理論化されています。特に、末梢アルコールレベルの増加に応答して、プレグネノロン、アロプレグナノロン、およびアロテトラヒドロデオキシコルチコステロンのレベルが脳および末梢で増加します。エタノール濃度の急激な増加が急性ストレス応答を模倣し、視床下部-下垂体-副腎軸によってニューロステロイド濃度を上昇させる可能性があると仮説が立てられています。エタノール依存症を防ぐため、研究者たちはニューロステロイドレベルの変動とin vivoでのニューロステロイド応答性を調査しています。ニューロステロイド(特にアロプレグナノロンレベルの増加)は薬物乱用と関連しています。しかし、DHEA-Sはモルヒネ耐性の獲得を抑制する可能性があります。過去の研究では、DHEA-Sレベルは、治療プログラムに従ってコカイン使用を控えた患者でも増加しており、患者が再発すると、DHEA-S濃度はそれに応じて減少することが示されています。
摂食障害
DHEAは、若年発症の過食性遺伝性肥満のげっ歯類モデルにおいて、食物摂取量を減少させ、肥満を抑制し、インスリン抵抗性を緩和し、脂質を低下させることが示されています。セロトニン作動性システムを調節することで、DHEAはカロリー摂取量の減少を促進すると仮説が立てられています。仮説的ですが、神経性食欲不振症の若い女性ではDHEAとDHEA-Sのレベルが低いことが記録されており、3ヶ月間の経口DHEA補給は骨密度を増加させ、この障害に関連する感情的な問題を緩和しました。
産後および婦人科疾患
妊娠中にエストロゲンとプロゲステロンのレベルが変動し、出産後に著しく低下するため、ニューロステロイドは産後障害に寄与すると考えられています。出産後のDHEA濃度が低いことは、気分の不安定さに関連付けられています。加えて、アロプレグナノロンのレベルは、妊娠中の気分障害や月経前症候群(PMS)と相関していました。月経前不快気分障害の女性は、正常な対照群よりも高いアロプレグナノロン/プロゲステロン比を持つことが指摘されており、この疾患で治療された女性は、アロプレグナノロンレベルが減少するにつれて改善を報告しました。
ニューロステロイド、記憶障害、および老化
ニューロステロイドのレベルは、アルツハイマー病やパーキンソン病などの神経変性疾患や老化状態で不規則になる可能性があります。70歳でのDHEAレベルは、20代後半に記録された最大値のわずか約20%に過ぎず、一部の研究者はDHEA補給が老化プロセスに関連する認知機能の低下を防ぐか遅らせることができると信じています。しかし、相反する研究では、DHEA投与が患者の認知機能測定値を改善しないことが示されています。さらに、アルツハイマー病患者では、DHEA濃度が著しく減少していることが判明しています。
結論
ニューロステロイドは、様々な精神病理において役割を果たす可能性があります。動物モデルでの画期的な発見は、ヒトにおけるニューロステロイドの役割の理解における進歩と常に相関するわけではなく、研究を複雑にしています。さらに、様々な精神疾患の治療経過におけるニューロステロイドレベルをさらに調査し、疾患管理のより完全な全体像を把握するための研究が進められています。ヒトでの使用が承認された新しい医薬品は、治療のレパートリーを拡大しています。
新規神経伝達物質:神経伝達物質の古典的定義を超えて
化学物質が神経伝達物質と見なされる古典的な基準は、(a) シナプス前ニューロンでの合成、(b) シナプス前ニューロンからの貯蔵と放出、(c) シナプス後膜の受容体への結合、および (d) 再取り込みまたは分解によるシナプス間隙からの除去でした。過去数十年のうちに、新規神経伝達物質の発見により、これらの厳格な基準の再構築が促されました。ガス、カンナビノイド、エイコサノイドなどのメッセンジャーは、シナプス前ニューロンの小胞に貯蔵されるのではなく、「必要に応じて」生成および放出されるようです。エンドカンナビノイドは、従来のシナプス後ニューロンから放出され、シナプス前ニューロンに作用する逆行性メッセンジャーとして重要な役割を果たすようです(図1.9-9参照)。最後に、ガス状神経伝達物質は、シナプス後ニューロンの細胞外膜上の受容体に作用するのではなく、細胞内に拡散して複数の細胞タンパク質に直接作用し、膜受容体を完全にバイパスします。一部の科学者は、神経伝達物質の古典的定義は変更すべきではないと感じており、前述の物質は一般的に非定型神経伝達物質または新規神経メッセンジャーと称されるべきだと考えています。さらに、まだ発見されていない化学メッセンジャーは、神経伝達物質とは何かという概念をさらに洗練させる可能性があります。
参考文献
- Appleton KM, Voyias PD, Sallis HM, et al. Omega-3 fatty acids for depression in adults. Cochrane Database Syst Rev. 2015;11(11):CD004692.
- Cutajar MC, Edwards TM. Evidence for the role of endogenous carbon monoxide in memory processing. J Cogn Neurosci. 2007;19:557-562.
- Deng J, Lei C, Chen Y, et al. Neuroprotective gases-fantasy or reality for clinical use? Prog Neurobiol. 2014;115:210-245.
- Di Marzo V, Stella N, Zimmer A. Endocannabinoid signalling and the deteriorating brain. Nat Rev Neurosci. 2015;16:30-42.
- Grosso G, Galvano F, Marventano S, et al. Omega-3 fatty acids and depression: Scientific evidence and biological mechanisms. Oxid Med Cell Longev. 2014;2014:313570.
- Gunduz-Bruce H, Silber C, Kaul I, et al. Trial of SAGE-217 in patients with major depressive disorder. N Engl J Med. 2019;381:903-911.
- *Iversen LL. The Science of Marijuana. Oxford University Press; 2008.
- Joy CB, Mumby-Croft R, Joy LA. Polyunsaturated fatty acid supplementation for schizophrenia. Cochrane Database Syst Rev. 2006;2006(3):CD001257.
- Keck PE Jr, Mintz J, McElroy S L, et al. Double-blind, randomized, placebo-controlled trials of ethyl-eicosapentanoate in the treatment of bipolar depression and rapid cycling bipolar disorder. Biol Psychiatry. 2006;60:1020-1022.
- Kidd PM. Omega-3 DHA and EPA for cognition, behavior, and mood: clinical findings and structural-functional synergies with cell membrane phospholipids. Altern Med Rev. 2007;12:207-227.
- Kreitzer AC, Malenka RC. Endocannabinoid-mediated rescue of striatal LTD and motor deficits in Parkinson’s disease models. Nature. 2007;445:643-647.
- *Legare CA, Raup-Konsavage WM, Vrana KE. Therapeutic potential of cannabis, cannabidiol, and cannabinoid-based pharmaceuticals. Pharmacology. 2022;107:131-149.
- Lim E, Mbowe O, Lee AS, Davis J. Effect of environmental exposure to hydrogen sulfide on central nervous system and respiratory function: A systematic review of human studies. Int J Occup Environ Health. 2016;22:80-90.
- Lynch AM, Loane DJ, Minogue AM, et al. Eicosapentaenoic acid confers neuroprotection in the amyloid-beta challenged aged hippocampus. Neurobiol Aging. 2007;28:845-855.
- *Maccarrone M, Guzman M, Mackie K, Doherty P, Harkany T. Programming of neural cells by (endo)cannabinoids: From physiological rules to emerging therapies. Nat Rev Neurosci. 2014;15:786-801.
- Mazier W, Saucisse N, Gatta-Cherifi B, Cota D. The endocannabinoid system: Pivotal orchestrator of obesity and metabolic disease. Trends Endocrinol Metab. 2015;26:524-537.
- *McEwen BS, Bowles NP, Gray JD, et al. Mechanisms of stress in the brain. Nat Neurosci. 2015;18:1353-1363.
- Mifflin K, Benson C, Kerr B, et al. Involvement of neuroactive steroids in pain. Mod Trends Pharmacopsychiatry. 2015;30:94-102.
- *Mischoulon D, Freeman MP. Omega-3 fatty acids in psychiatry. Psychiatr Clin North Am. 2013;36:15-23.
- Moncada S, Bolanos JP. Nitric oxide, cell bioenergetics and neurodegeneration. J Neurochem. 2006;97:1676-1689.
- Nemets H, Nemets B, Apter A, Bracha Z, Belmaker RH. Omega-3 treatment of childhood depression: A controlled, double-blind pilot study. Am J Psychiatry. 2006;163:1098-1100.
- *Paul BD, Snyder SH. Gasotransmitter hydrogen sulfide signaling in neuronal health and disease. Biochem Pharmacol. 2018;149:101-109.
- Pi-Sunyer FX, Aronne LJ, Heshmati HM, Devin J, Rosenstock J; RIO-North America Study Group. Effect of rimonabant, a cannabinoid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients: RIO-North America: A randomized controlled trial. JAMA. 2006;295:761-775.
- Porter J, Van Vrancken M, Corll C, Thompson H, Svec F. The influence of dehydroepiandrosterone and 8-OH-DPAT on the caloric intake and hypothalamic neurotransmitters of lean and obese Zucker rats. Am J Physiol Regul Integr Comp Physiol. 2005;288:R928-R935.
- Ratner MH, Kumaresan V, Farb DH. Neurosteroid actions in memory and neurologic/neuropsychiatric disorders. Front Endocrinol. 2019;10:169.
- Renard J, Krebs M-O, Le-Pen G, Jay TM. Long-term consequences of adolescent cannabinoid exposure in adult psychopathology. Front Neurosci. 2014;8:361.
- Richardson AJ, Montgomery P. The Oxford-Durham study: A randomized, controlled trial of dietary supplementation with fatty acids in children with developmental coordination disorder. Pediatrics. 2005;115:1360-1366.
- Rogers PJ, Appleton KM, Kessler D, et al. No effect of n-3 long-chain polyunsaturated fatty acid (EPA and DHA) supplementation on depressed mood and cognitive function: A randomised controlled trial. Br J Nutr. 2008;99:421-431.
- Rubino T, Parolaro D. The impact of exposure to cannabinoids in adolescence: Insights from animal models. Biol Psychiatry. 2016;79:578-585.
- Rudolph U, Crestani F, Benke D, et al. Benzodiazepine actions mediated by specific y-aminobutyric acid A receptor subtypes. Nature. 1999;401:796-800.
- Schule C, Romeo E, Uzunov DP, et al. Influence of mirtazapine on plasma concentrations of neuroactive steroids in major depression and on 3alpha-hydroxysteroid dehydrogenase activity. Mol Psychiatry. 2006;11:261-272.
- Sedlak TW, Snyder SH. Messenger molecules and cell death: Therapeutic implications. JAMA. 2006;295:81-89.
- Song C, Shieh CH, Wu YS, Kalueff A, Gaikwad S, Su KP. The role of omega-3 polyunsaturated fatty acids eicosapentaenoic and docosahexaenoic acids in the treatment of major depression and Alzheimer’s disease: Acting separately or synergistically? Prog Lipid Res. 2016;62:41-54.
- Su KP, Huang SY, Chiu TH, et al. Omega-3 fatty acids for major depressive disorder during pregnancy: Results from a randomized, double-blind, placebo-controlled trial. J Clin Psychiatry. 2008;69:644-651.
- Sulaieva O, Wallace JL. Gaseous mediator-based anti-inflammatory drugs. Curr Opinion Pharmacol. 2015;25:1-6.
- Tagen M, Klumpers LE. Review of delta-8-tetrahydrocannabinol (48-THC): comparative pharmacology with 49-THC. Br J Pharmacol. 2022;179:3915-3933.
- Vincent SR. Nitric oxide neurons and neurotransmission. Prog Neurobiol. 2010;90:246-255.
- Volk DW, Lewis DA. Insights into the pathophysiology of endocannabinoid signaling in schizophrenia. JAMA Psychiatry. 2019;76:887-888.
- Zorumski CF, Paul SM, Covey DF, Mennerick S. Neurosteroids as novel antidepressants and anxiolytics: GABA-A receptors and beyond. Neurobiol Stress. 2019;11:100196.

