図 1.13-4.
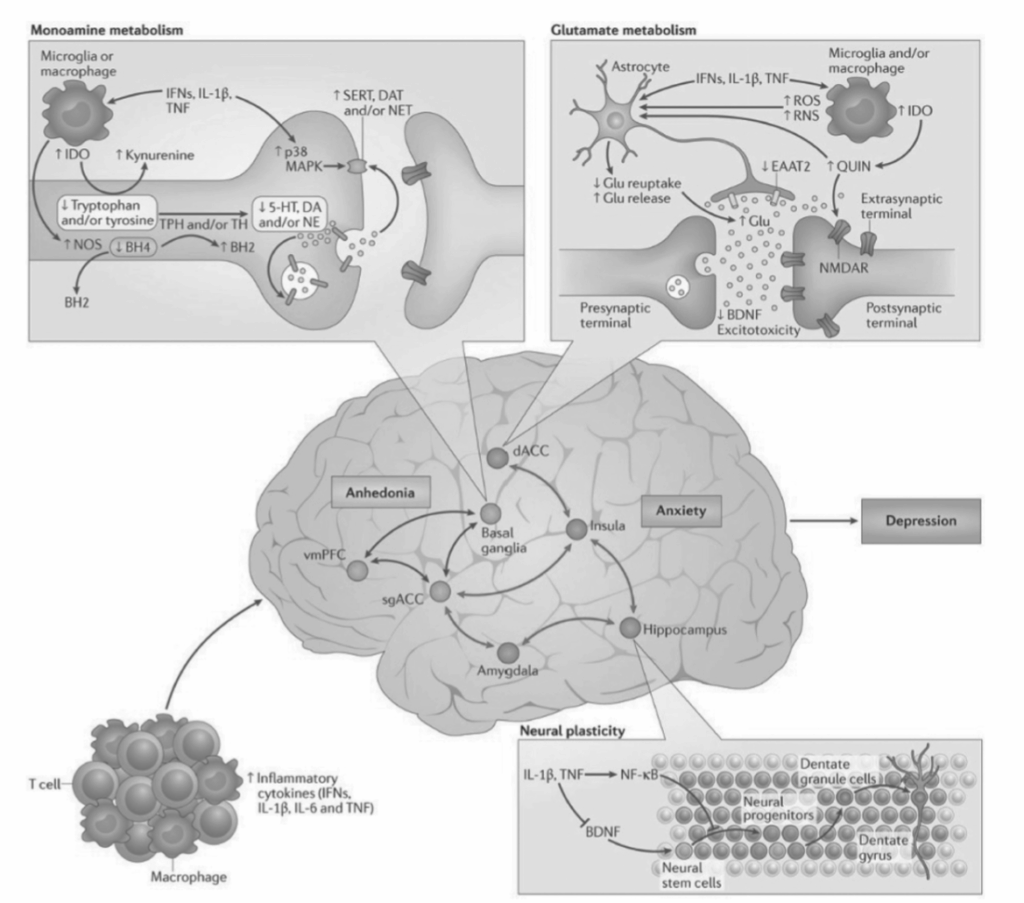
心因性ストレスの状況下では、活性化された交感神経系線維によって放出されるカテコールアミン(ノルアドレナリンなど)が、骨髄での骨髄系細胞(例えば単球)の産生と放出を刺激します。これらの細胞は末梢に入り、そこでストレス誘発性の損傷関連分子パターン(DAMPs)、細菌、そして腸から漏出した微生物関連分子パターン(MAMPs)などの細菌産物と遭遇します。これらのDAMPsとMAMPsは、その後、核因子カッパB(NF-κB)やNOD、LRR、ピリン領域含有タンパク質3(NLRP3)インフラマソームなどの炎症性シグナル伝達経路を活性化します。NLRP3の刺激は、さらにカスパーゼ1を活性化させ、それが成熟インターロイキン-1ベータ(IL-1β)とIL-18の産生につながるとともに、グルココルチコイド受容体を切断してグルココルチコイド抵抗性の一因となります。NF-κBの活性化は、腫瘍壊死因子(TNF)やIL-6を含む他の炎症誘発性サイトカインの放出を刺激し、これらはIL-1βやIL-18とともに液性経路および神経経路を介して脳にアクセスすることができます。心因性ストレスはまた、ミクログリアをM1炎症誘発性表現型に活性化させることがあり、これによりCCケモカインリガンド2(CCL2)が放出され、それが細胞経路を介して活性化された骨髄系細胞を脳に引き寄せます。脳に入ると、活性化されたマクロファージは中枢の炎症反応を永続させることがあります。
- ASC: アポトーシス関連スペック様タンパク質(CARD含有)
- HMGB1: 高移動度群ボックス1
- HSP: 熱ショックタンパク質
- LPS: リポ多糖
- TLR: Toll様受容体
(Miller A, Raison C. The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nat Rev Immunol 2016;16:22-34. doi: 10.1038/nri.2015.5 より転載)
表 1.13-3.
神経伝達物質、ホルモン、およびペプチド – 免疫細胞を標的とするもの
神経伝達物質
- ドーパミン (Dopamine)
- グルタミン酸、受容体、および輸送体 (Glutamate, receptors, and transporters)
- ノルエピネフリン (Norepinephrine)
- セロトニン (Serotonin)
- ヒスタミン (Histamine)
- アセチルコリン (Acetylcholine)
- GABA (GABA)
ホルモン
- コルチコステロイド-グルココルチコイド (Corticosteroids-glucocorticoids)
- ミネラルコルチコイド (Mineralocorticoids)
- エストロゲン (Estrogen)
- プロゲステロン (Progesterone)
- テストステロン (Testosterone)
- GHRH (GHRH)
- GnRH (GnRH)
- 成長ホルモン (Growth hormone)
- オピオイド(エンドルフィン、エンケファリン) (Opioids (endorphins, enkephalins))
- 甲状腺ホルモン (Thyroid hormone)
- プロラクチン (Prolactin)
ペプチド
- ACTH (ACTH)
- アルファ-MSH (Alpha-MSH)
- AVP (AVP)
- カルシトニン (Calcitonin)
- CRH (CRH)
- IGF-1 (IGF-1)
- メラトニン (Melatonin)
- NPY (NPY)
- PTH (PTH)
- ソマトスタチン (Somatostatin)
- サブスタンスP (Substance P)
- TRH (TRH)
- TSH (TSH)
- VIP (VIP)
- CGRP (CGRP)
上記の分子に対する受容体が免疫細胞上で同定されており、それらが免疫系に影響を与えることが示唆されています。
- ACTH: 副腎皮質刺激ホルモン (adrenocorticotropin)
- アルファ-MSH: アルファ-メラノサイト刺激ホルモン (alpha-melanocyte-stimulating hormone)
- AVP: アルギニンバソプレシン (arginine vasopressin)
- CGRP: カルシトニン遺伝子関連ペプチド (calcitonin gene-related peptide)
- CRH: コルチコトロピン放出ホルモン (corticotrophin-releasing hormone)
- GABA: ガンマアミノ酪酸 (gamma amino butyrate)
- GHRH: 成長ホルモン放出ホルモン (growth hormone-releasing hormone)
- GnRH: ゴナドトロピン放出ホルモン (gonadotropin-releasing hormone)
- IGF-1: インスリン様成長因子-1 (insulin-like growth factor-1)
- NPY: 神経ペプチドY (neuropeptide Y)
- PTH: 副甲状腺ホルモン (parathyroid hormone)
- TRH: 甲状腺刺激ホルモン放出ホルモン (thyrotropin-releasing hormone)
- TSH: 甲状腺刺激ホルモン (thyroid-stimulating hormone)
- VIP: 血管作動性腸管ペプチド (vasoactive intestinal peptide)
脳における炎症性活性化のミクロスケール相関
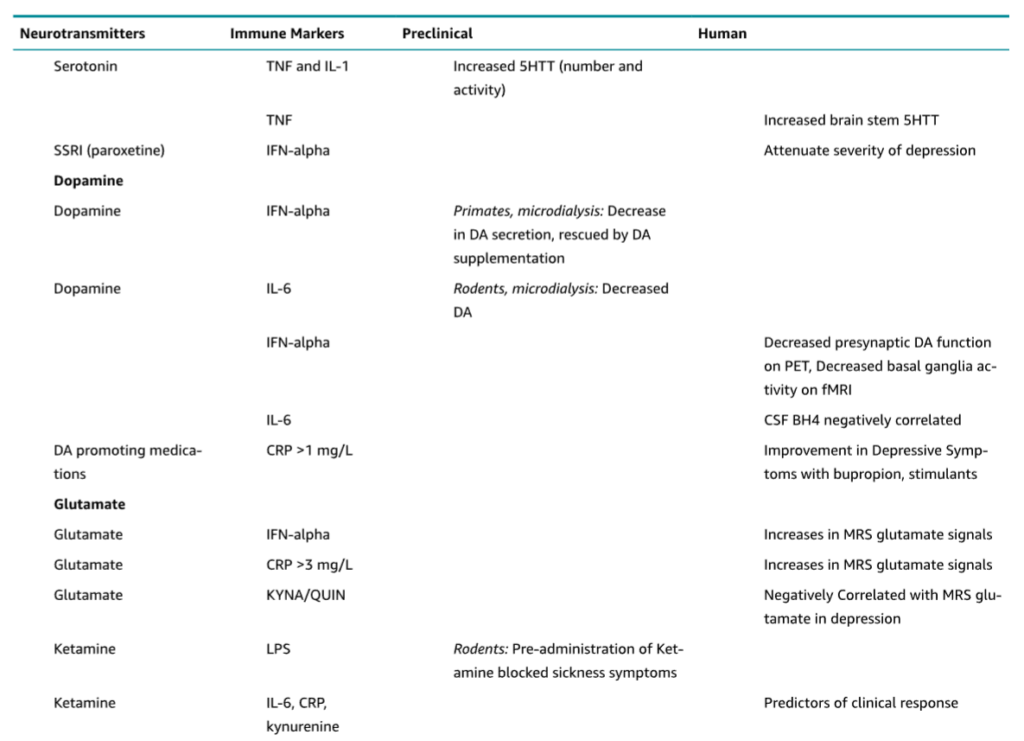
表1.13-4は、精神医学に関連する主要な神経伝達物質の抜粋リストを示しています。以下では、この表の選定された内容について簡潔に説明します。
はい、ご提示いただいた内容を日本語に翻訳します。
表 1.13-4.
代表的な神経伝達物質の免疫学的効果

表の説明
- 神経伝達物質: 脳内で情報伝達を行う化学物質。
- 免疫マーカー: 免疫系が活性化していることを示す生体内の指標。
- 前臨床: ヒト以外の動物(主にげっ歯類や霊長類)を用いた研究での発見。
- ヒト: ヒトを対象とした研究での発見。
注釈
- a7nAChR: アルファ-7-ニコチン性アセチルコリン受容体
- DA: ドーパミン
- HTT: セロトニン再取り込みトランスポーター
- KYNA: キヌレン酸
- LPS: リポ多糖細菌内毒素
- MRS: 磁気共鳴分光法
- QUIN: キノリン酸
ノルエピネフリン
免疫分子がノルエピネフリン(NE)に与える影響は、これまで広範に研究されてきました。NEがベータアドレナリン受容体に結合することは、ストレスが免疫細胞を活性化させる主要なメカニズムです。ベータアドレナリン受容体遮断療法は、医学的疾患における免疫細胞の異常な挙動を制御するのに役立つ可能性があります。例えば、がん治療前にベータブロッカーを投与することは、転移のリスクを軽減するのに有用かもしれません。
セロトニン
TNFやIL-1を含む自然免疫サイトカインも、p38 MAPK関連経路の刺激を介してセロトニン(およびNE)のシナプス再取り込みポンプの発現と機能を増加させることが示されています。このメカニズムがうつ病と関連することは、TNFの血中濃度上昇が脳幹セロトニン再取り込み能の増加と関連していることを示す最近のヒト研究によって強調されています。逆に、TNFの拮抗薬であるエタネルセプトは、脳幹セロトニントランスポーター能を低下させ、うつ病の症状を改善しました。最後に、セロトニン再取り込み阻害薬であるパロキセチンによる治療は、IFN-アルファ投与による行動上の影響を軽減することが示されており、サイトカイン誘発性気分障害におけるセロトニン代謝への影響の重要性をさらに強調しています。
ドーパミン
慢性的なサイトカイン曝露がノルアドレナリン作動性およびセロトニン作動性伝達に与える影響に加えて、IL-2またはIFN-アルファの慢性投与がドーパミン(DA)代謝を著しく変化させ、うつ病を引き起こすことも報告されています。例えば、非ヒト霊長類における炎症誘発(IFN-アルファを使用)は、大脳基底核におけるDA代謝の減少をもたらし、これはうつ病様行動と関連し、逆マイクロダイアリシスによるL-ドーパ局所投与に反応しました。これらのデータは、IL-6の腹腔内注射後に側坐核でDAの減少を示したげっ歯類の研究からのデータと並行しています。さらに、慢性的な(すなわち4〜6週間)IFN-アルファ治療は、動機付け信号に対する機能的磁気共鳴画像法(MRI)における大脳基底核活性化の低下および前シナプス線条体DA機能の低下と相関するアヘドニア、うつ病、疲労を引き起こしました。
最近のいくつかの研究では、DA欠損の根底にあるメカニズムが調査されています。プテリジン誘導体であるテトラヒドロビオプテリン(BH4)は、DA、NE、セロトニンなど、精神薬理学に関連する主要なモノアミンの合成における必須の補因子です。炎症性サイトカイン(IFN-ガンマ、TNF、IL-6など)は、希少なBH4を反応性酸素種および窒素種の生成を触媒するために転用することにより、DAなどの主要なモノアミンの産生を減少させます。例えば、IFN-アルファ治療を受けた患者では、BH4の脳脊髄液(CSF)濃度はCSFのIL-6レベルと負の相関を示します。特に、血漿フェニルアラニン対チロシン比(BH4活性の間接的な測定値)は、IFN-アルファ治療後のDAのCSF濃度およびうつ病症状の重症度と相関します。ブプロピオンまたは刺激剤を用いて炎症におけるDA系を標的とすることにより、ヒトおよび前臨床モデルにおける炎症誘発性のアヘドニア症状が軽減されます。
グルタミン酸
炎症がモノアミン(すなわち、セロトニン、NE、DA)に与える影響に対する当初の関心は、グルタミン酸伝達の変化もサイトカインの行動効果と関連していることを示唆する研究がなされるようになりました。例えば、IFN-アルファ投与を受けている患者では、大脳基底核および背側前帯状皮質(dACC)におけるグルタミン酸レベルの増加が観察されており、これらの脳領域におけるグルタミン酸レベルが高いほどうつ病症状の増加と相関していました。グルタミン酸は、ニューロンの健康と毒性の両方を促進することにより、神経可塑性と生存に逆説的な効果を発揮します。これは、グルタミン酸受容体に対する位置特異的な効果を介して行われる可能性があります。シナプス**N-メチル-D-アスパラギン酸(NMDA)**受容体の刺激はシナプス成長と生存を促進する一方、シナプス外NMDA受容体の刺激は細胞死を促進する可能性があります。毒性の根底にあるメカニズムには、受容体の過剰刺激と脳由来神経栄養因子(BDNF)の合成低下の両方が含まれます。最後に、シナプス外グルタミン酸の増加は、シナプスにおけるグルタミン酸の放出を阻害する前シナプス性代謝型グルタミン酸受容体(mGluR)を刺激し、さらにシナプス機能不全に影響を与える可能性があります。
この文脈において、ミクログリアや遊走性マクロファージを含む活性化された免疫細胞は、脳内の細胞外/シナプス外グルタミン酸の豊富な供給源です。活性化された免疫細胞は、ミトコンドリア代謝の加速と反応性酸素種の合成増加により、高い抗酸化要件を持っています。免疫細胞によるグルタミン酸の放出は、システインと交換してグルタミン酸分子を排出することで抗酸化物質グルタチオンを合成するシステムxCTを介して増加する可能性があります。さらに、上記の細胞は、炎症およびキノリン酸(QA)誘発性のグリア細胞毒性(次のセクションで議論)により、グルタミン酸をシナプス外空間に放出します。さらに、アストロサイトのグルタミン酸再取り込みポンプの免疫関連機能不全は、グルタミン酸のクリアランスの低下と非効率的な封じ込めにつながり、細胞外空間への「溢出」を引き起こします。脳内グルタミン酸測定値の増加は、多発性硬化症やHIVなどの神経免疫疾患における神経病理の増加、IFN-アルファ後のうつ病様行動変化、および高炎症のあるうつ病患者の間で関連付けられています。したがって、うつ病および他の神経精神疾患における免疫関連のグルタミン酸の調節不全を支持する重要な証拠があります。さらに、グルタミン酸の調節不全は、キヌレニン(KYN)経路の活性化にも関連している可能性があります。
グルタミン酸様作用を持つキヌレニン経路分子
キヌレニン類(KYNs)は、末梢の炎症と神経行動学的結果を橋渡しする炎症性分子です。IFN-ガンマやTNFのようなサイトカインによって誘導されると、酵素インドールアミン2,3-ジオキシゲナーゼ(IDO)が免疫細胞内でトリプトファンからKYNを産生します。KYNはその後、一連の生体変換を受けて、QAやキヌレン酸(KYNA)のようなグルタミン酸修飾代謝産物になります。QAは、アストロサイトのグルタミン酸再取り込みポンプの発現を減少させたり、アストロサイトからのグルタミン酸放出を刺激したり、シナプス外NMDA受容体を活性化させたりすることで、グルタミン酸毒性に影響を与えます。一方、KYNAは、NMDA受容体のグリシン結合部位をアロステリックに調節することで、その活性化を減少させます。統合失調症の認知機能障害に関連するニコチン性アセチルコリン受容体タイプ-7(nAChR7)に対するKYNAの拮抗作用も、前シナプスからのグルタミン酸放出を減少させます。炎症性分子がQA経路を選択的に活性化するため、炎症性活性化中にQAレベルは上昇します。前臨床モデルにおけるNMDA活性の過剰な亢進と、うつ病患者における抑うつ症状および自殺行動の重症度の増加は、QAの同時増加とKYNAの減少に関連付けられています。脳内では、QAはミクログリアによって産生され、アストロサイトとオリゴデンドロサイトはKYNAを産生します。この合成の区画化は、QA/KYNAの不均衡において役割を果たす可能性があります。
炎症時には、遊離トリプトファンの95%以上がKYN経路を介して代謝され、残りはセロトニンとメラトニンを産生するために利用されます。この発見に基づいて、一部の研究者は、トリプトファンがKYN経路に転用されることで、トリプトファン欠乏が生じ、うつ病につながる可能性があると提案しました。しかし、細胞が著しいトリプトファン欠乏の状況下でもトリプトファン利用能を維持できることや、IDOの継続的な活性化後も血漿トリプトファンレベルが高く保たれることから、この考えには反論が唱えられています。IFN-アルファ、ガンマ、およびTNFはIDOを刺激し、その結果、血漿トリプトファンレベルが大幅に減少し、血中のKYN代謝産物が増加します。IFN-アルファ誘発性のCSF代謝産物の変化とうつ病の発症との関連を調べた唯一の研究では、サイトカインが中枢トリプトファンレベルに影響を与えない一方で、CSFのKYNとQAレベルを劇的に増加させることが明らかになりました。KYN類が特定のアミノ酸トランスポーターを介して血液脳関門(BBB)を容易に通過できる能力は、その最も顕著な特性です。その結果、KYN分子は炎症と興奮性神経伝達および神経精神症状を引き起こす可能性のある脳の変化とを直接結びつけます。
特筆すべきは、KYN経路の変化が神経精神疾患治療の標的とされてきたことです。KYN経路阻害薬は、がんを含む病態の治療のために開発されており、精神疾患の治療に転用できる可能性があります。興味深いことに、ケタミンでグルタミン酸受容体を遮断したり、IDO活性を阻害したりすると、マウスはリポ多糖(LPS)またはストレス誘発性のうつ病様行動から保護されますが、炎症反応は無傷のままです。これらの結果は、グルタミン酸および/またはQAによるグルタミン酸受容体の活性化の増加が、炎症がうつ病様行動を引き起こす共通経路である可能性を示唆しています。
脳における炎症性活性化のマクロスケール神経相関
ポジトロン放出断層撮影(PET)やMRIを用いた研究は、末梢サイトカイン活性が中枢を介した行動変化を誘発しうることを証明しています。これらの画像診断法やその他のモダリティは、様々な行動変化を特定の脳領域の機能変化と関連付ける手段を提供します。感染症やがんの治療に用いられる自然免疫サイトカインであるIFN-アルファに関する研究は、末梢免疫刺激に対する脳の応答に関する私たちの理解に大きく貢献してきました。IFN-アルファは、治療の量と期間にもよりますが、患者の最大50%に大うつ病を含む実質的な行動異常を誘発します。したがって、IFN-アルファは末梢炎症とその行動相関(うつ病、アヘドニア、疲労、認知障害)の強力かつ信頼できる誘発物質です。
視空間性注意の機能的MRIタスクにおいて、対照群と比較して、IFN-アルファを投与された患者は、dACC(背側前帯状皮質)の有意に大きな活性化を示し、これはタスク遂行中のエラー数と相関していました。興味深いことに、認知課題中のdACC活動の増加は、高い特性不安、神経症傾向、またはOCD(強迫性障害)を持つ患者など、気分障害に脆弱な患者でも示されています。さらに、IFN-アルファはPETを用いた$^{18}$F-FDG(フルオロデオキシグルコース)の取り込みで測定される大脳基底核の代謝亢進を引き起こし、これは疲労の重症度と正の相関がありました。加えて、DA(ドーパミン)代謝の障害は、IFN-アルファ投与後の疲労の発症を媒介しました。注目すべきは、最近の研究が、うつ病患者における炎症の増加による報酬回路の選択的標的化をさらに裏付けていることです。
磁気共鳴分光法(MRS)を用いると、末梢の炎症の増加は、2つの独立したコホート(うつ病患者とIFN-アルファ治療を受けた被験者)において、dACCと大脳基底核領域におけるグルタミン酸シグナルの増加と関連しており、これはうつ病、アヘドニア、精神運動緩慢の重症度と関連していました。その後、我々は、MRSグルタミン酸シグナルのこれらの増加が、安静時機能的MRIにおける自発的な脳酸素レベル依存性変動の不整合の増大と、大脳基底核と内側前頭前野間の機能的結合の障害と関連していることを示しました。同様に、他のグループからの研究も、炎症の同様の脳および行動標的を実証しています。

