1.14 時間生物学、概日リズム、精神医学
チェスター・ウー医学博士、ジョシュア・J・ロジャース医学博士
時間生物学は、生物学的リズムの研究です。時間生物学の領域に属する様々な周期性の中で、概日(ラテン語:circa、約;dies、日)リズムは、約1日の周期を持ち、細胞プロセスと行動を環境の昼夜サイクルに同期させる役割を果たしており、最も広範囲に研究され、最もよく理解されている生物学的リズムの一つです。概日リズムは、既知のほぼすべての生物で進化的に保存されており、この事実がこれらのリズムがこの地球上での適応機能にとって基本的であることを示唆しています。
ヒトを含む哺乳類における主要な概日振動子の部位は、視交叉のすぐ背側にある前視床下部に位置する視交叉上核(SCN)です。視交叉からは求心性網膜視床下部路(RHT)が分かれています(図1.14-1)。比較的固定されたタイミングの局所的な遺伝子フィードバックループを介して、SCNは約24.18時間の概日周期を生成します。したがって、マスター概日時計は、24時間の日の中で行動的および生理学的プロセスの適切な位相関係を維持するために、絶えず調整する必要があります。人がフクロウ(「夜型人間」)やヒバリ(「朝型人間」)として特徴づけられるのは、遺伝的に決定された概日周期の長さがそれぞれ長いか短いかという変動に大きく由来します。
生物は、内因性の概日時計を調整または再同期させるために、時間手掛かりまたはツァイトゲーバー(ドイツ語:zeit、時間;geber、与えるもの)を利用するように進化してきました。最も重要なツァイトゲーバーの一つは、光レベルの日周変動です。照度の変化は、ヒトの網膜に存在する光受容装置によって感知され、RHTを介してSCNに伝達されます。その他の非光ツァイトゲーバーには、食物/摂食、社会的相互作用、温度、物質(アンフェタミンなど)、運動が含まれます。これらの刺激からの信号は、視床および中脳縫線核からSCNに中継されます。
概日時計は、転写や翻訳といった分子レベルから、より高次の代謝機能や認知機能に至るまで、ほとんどすべてのヒトの生理機能を調節しています。これは、行動、深部体温、睡眠、摂食、飲水、ホルモンレベルを含むリズムを駆動することによって行われます。
まとめると、哺乳類の概日軸は、3つの明確な機能的コンポーネントに分けることができます。(1) SCNに位置するマスターペースメーカー、(2) 眼に由来しSCNへの光受容入力、そして (3) 概日ペースメーカーの時計機構への洞察を提供する無数の周期的出力です。
概日ペースメーカー
解剖学
哺乳類の概日システムは、ペースメーカーの階層として組織されています。SCNは、SCN外の多数の振動子を統制するマスター振動子です。これらの振動子は、腎臓、肝臓、肺、および脳内の他の部位を含む広範囲の末梢組織で見られます。SCNは、視交叉のすぐ背側に位置する視床下部の2つの対になった核で構成されています(図1.14-1参照)。
SCNのニューロンは、脳全体の中で最も小さいニューロンの一部です。それらは密に詰まっており、広範囲に分岐していない短い樹状突起を持っています。SCNの細分化は、免疫組織化学的および神経路追跡基準に従って定義されています。これらの細分化には、カルビンジン陽性ニューロンの存在によって定義されるSCNのコアが含まれます。コアを取り囲むSCNの残りの部分はシェルです。これらの細分化への求心性および遠心性投射は、それらの推定される機能への洞察を提供し始めています。
1.14 時間生物学、概日リズム、精神医学:視交叉上核 (SCN) の詳細
このセクションでは、ヒトの**視交叉上核(SCN)**の解剖学的構造と、その求心性・遠心性投射について詳しく見ていきます。SCNは、哺乳類における主要な概日振動子であり、私たちの生物学的リズムを司る「マスタークロック」としての役割を担っています。
図1.14-1:ヒトの視交叉上核
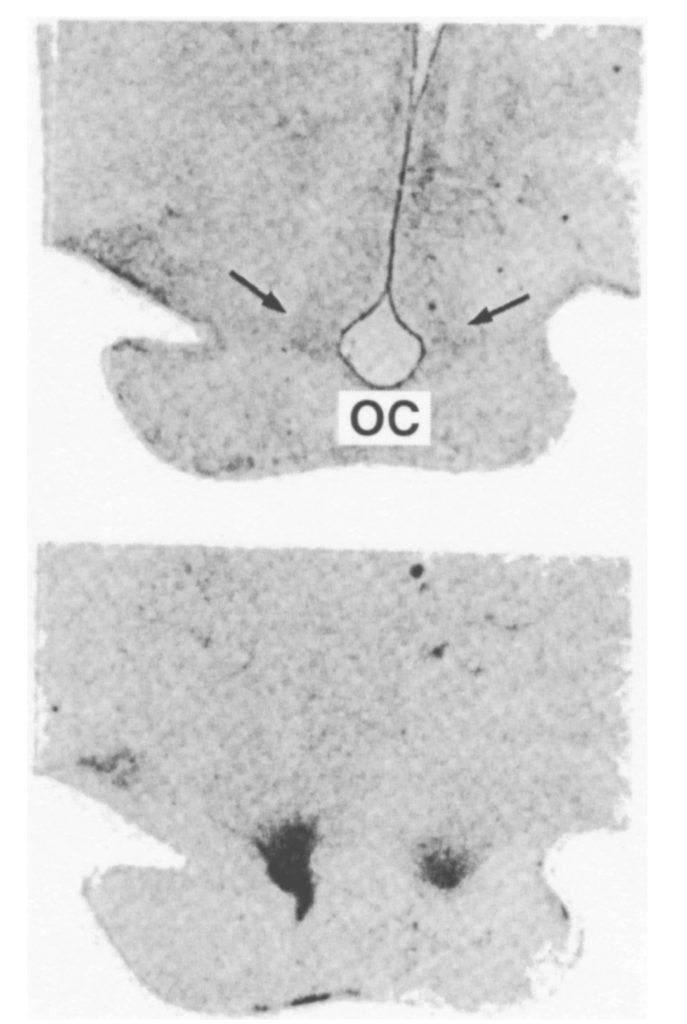
この図は、ヒトの視床下部の断面を示しています。
- 上段: Nissl染色されたヒトの視床下部の断面図です。矢印で示されているのが視交叉上核で、視交叉 (OC) の背側に位置しています。
- 下段: 同じ断面のオートラジオグラフです。放射性ヨウ素で標識されたメラトニン類似体の特異的な結合が、視交叉上核の濃い染まりとして示されています。これは、SCNにメラトニン受容体が存在することを示唆しています。(Reppert SM, Weaver DR, Rivkees SA, Stopa EG. Putative melatonin receptors in a human biological clock. Science 1988;242(4875):78. より、AAASの許可を得て転載。doi: 0.1126/science.2845576.)
求心性投射(入力)
SCNへの主な求心性入力は、**網膜視床下部路(RHT)**です。
- RHTの起源: RHTは網膜の特定の網膜神経節細胞の小集団から発生します。これらの細胞は青色光波長に特に敏感で、SCN全体に神経支配しています。
- 神経伝達物質: RHTの主要な興奮性神経伝達物質はグルタミン酸です。そのため、グルタミン酸受容体拮抗薬は、概日軸に対する光の効果を遮断することができます。同様に、コンピューター画面の出力用の青色光フィルターや、青色光遮断メガネレンズもこれらの信号を抑制することができます。
- 二次経路: 光刺激は、同側の膝状体間葉(IGL)からの膝状体視床下部路からも受け取られ、網膜からSCNへの二次的な経路を提供します。神経ペプチドY (NPY) は、IGLからSCNへの投射における主要な神経伝達物質です。
- その他の入力: その他の求心性入力には、正中縫線核、脚橋被蓋核、傍腕結合核、および外側背側被蓋核からのものがあります。これらのうち最も顕著なのは、中脳縫線核からの明確なセロトニン作動性投射です。セロトニンはSCN機能に対する光の効果を調節し、日中にはグルタミン酸入力を増強し、夜間には抑制すると仮説されています。
遠心性投射(出力)
SCNからのほとんどの遠心性投射は、視床下部の範囲内に留まります。
- 松果体への投射: SCNに由来する最もよく研究されている投射は、松果体への多シナプス性投射であり、これはメラトニン放出の調節に関与しています。抑制性GABA作動性SCNニューロンの軸索は、視床下部を背側に横断して**室傍核(PVN)**へ向かいます。これらの信号は上頸神経節に伝播され、そこから松果体に投射します。松果体とのシナプスにおいて、ノルエピネフリンの放出が松果体細胞のベータ-1およびアルファ-1アドレナリン受容体を刺激し、メラトニン産生を誘発します。
- メラトニンの役割: この負のフィードバック遠心性経路の最終的な結果として、SCN活動が減少するとメラトニン合成が増加します。したがって、メラトニンは脳と身体にとって「生物学的夜」(単なる睡眠だけでなく)のホルモン信号となります。通常、自然な血漿メラトニン濃度は、睡眠開始の2〜4時間前(いわゆるDLMO:薄明り下メラトニン出現)に上昇し始めます。
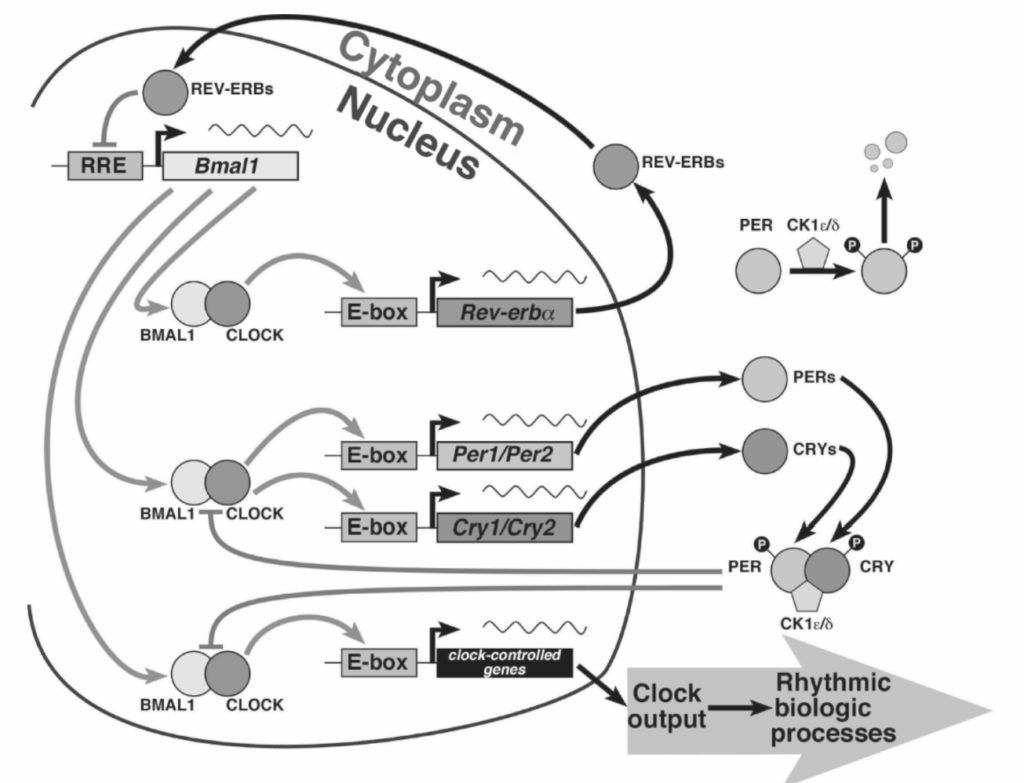
図1.14-2. 哺乳類の概日時計の分子時計機構を構成する転写・翻訳フィードバックループ。(Ko CH, Takahashi JS. Molecular components of the mammalian circadian clock. Human Mol Genet 2006;15(Rev 2):R271 より、Oxford University Pressの許可を得て改変。doi:10.1093/hmg/ddl207.)
SCNはまた、肺、肝臓、腎臓、心臓などの臓器に含まれる末梢概日時計も協調させています。SCNからの第二の、あまり理解されていない遠心性経路は、強い概日成分を持つコルチゾールの制御において重要な役割を果たしており、コルチゾールはヒトでは早朝に最も高くなります。コルチゾールのピークレベルは、メラトニンレベルがベースラインに近づくのとほぼ同時に、午前6時から午前8時頃に発生します。SCNから視床下部のPVNへの投射は、副腎皮質刺激ホルモン放出ホルモン(CRH)を含むニューロンにシナプスを形成し、最終的に副腎皮質刺激ホルモン(ACTH)の放出を刺激し、これが次に副腎に作用してコルチゾールを放出させます。
分子制御
単離されたSCNニューロンは概日リズムを生成できます。哺乳類の概日時計機構は、相互作用する正および負の転写・翻訳フィードバックループで構成されています(図1.14-2)。ピリオド遺伝子(PER)とクリプトクローム遺伝子(CRY)の発現は、Clock-Bmal1(Bmal1)ヘテロ二量体がこれらの遺伝子のプロモーターにあるエンハンサーに結合することによって正に調節されます。Per遺伝子とCry遺伝子の産物は、核内に戻り、自身の転写を抑制します。この一連の出来事が、コア振動の負のフィードバック要素を構成します。
PER遺伝子とCRY遺伝子の転写を活性化することに加えて、Clock-Bmal1複合体はオーファン核内受容体遺伝子Rev-Erbaの発現も活性化します。Rev-Erbaの遺伝子産物は、次に核内に移行し、Bmal1遺伝子のプロモーターにあるRev-Erb/Ror応答要素を介してBmal1遺伝子の転写を抑制します。Bmal1はその後、Clockとヘテロ二量体を形成し、再びPER、CRY、およびRev-Erba遺伝子の発現を活性化します。このBmal1遺伝子の脱抑制(または活性化)、それに続くClockとのヘテロ二量体形成、およびPer、Cry、Rev-Erba遺伝子の活性化が、コア振動の正のフィードバック要素を構成します。
時計タンパク質の相互作用と、これらのタンパク質の細胞内コンパートメント間の移行は、翻訳後修飾によって厳密に制御されています。例えば、カゼインキナーゼIεまたはδによる一部のPerタンパク質のリン酸化は、それらが核内に移行するため、または細胞質内で分解されるために重要です。
睡眠と概日リズム
睡眠-覚醒制御
安らかな統合された睡眠は、睡眠障害を経験したときに最もよく理解されます。睡眠は、2つの動的なプロセスの統合された産物です。最初のプロセスは、しばしば睡眠ホメオスタット、またはプロセスSと呼ばれ、睡眠負債の蓄積と解消から生じます。睡眠負債を符号化する生物学的基質は完全には知られていませんが、覚醒中のVLPOおよびその他の領域におけるアデノシンの蓄積と、睡眠中のそのリサイクルが、睡眠ホメオスタットの主要な候補神経調節物質として浮上しています。アデノシン受容体拮抗薬であるカフェインは、睡眠への恒常性駆動を妨げることによって覚醒を促進すると考えられています。第二の振動プロセスであるプロセスCは、概日時計によって制御され、睡眠傾向、または逆に覚醒の日周リズムを制御します。
覚醒(目覚め)の概日促進は、日中を通して着実に増加し、睡眠への恒常性駆動に対抗し、夕方には最大に達し、その後衰え始め、血漿メラトニンの増加を引き起こします(図1.14-3)。覚醒促進はその後、深部体温の概日最低点と一致するように減少します。概日日を通して強制的な睡眠スケジュールを課す実験では、通常午前5時から午前6時頃に発生する体温の最低点より約6時間前に睡眠を開始した場合に、中断のない8時間の睡眠が最もよく得られることが示されています。健康な個人では、午後11時から午前0時の間に睡眠を開始すると、8時間のぐっすりとした睡眠を得られる可能性が最も高くなります。
日周性嗜好は、年齢、内因性概日周期、およびその他の要因の関数として個人間で異なります。朝型、または「朝型人間」と分類される個人は、夕方型、または「夜型人間」と分類される個人と比較して、早めに覚醒し、より早い時刻に深部体温の最低点を経験する傾向があります。睡眠剥奪研究では、睡眠の恒常性成分は同年齢の個人間で著しく類似していることが示されています。したがって、クロノタイプは、睡眠制御の概日プロセスによってほぼ独占的に決定されます。乳児期から成人期にかけて、睡眠必要量が年齢依存的に減少するという十分に確立された事実があることに注意すべきです。しかし、多くの高齢者が経験する総睡眠時間のより顕著な減少と睡眠の断片化は、医学的および心理社会的併存疾患、ならびに一部のVLPOニューロンの変性によるものであり、結果として睡眠不足につながる可能性があります。
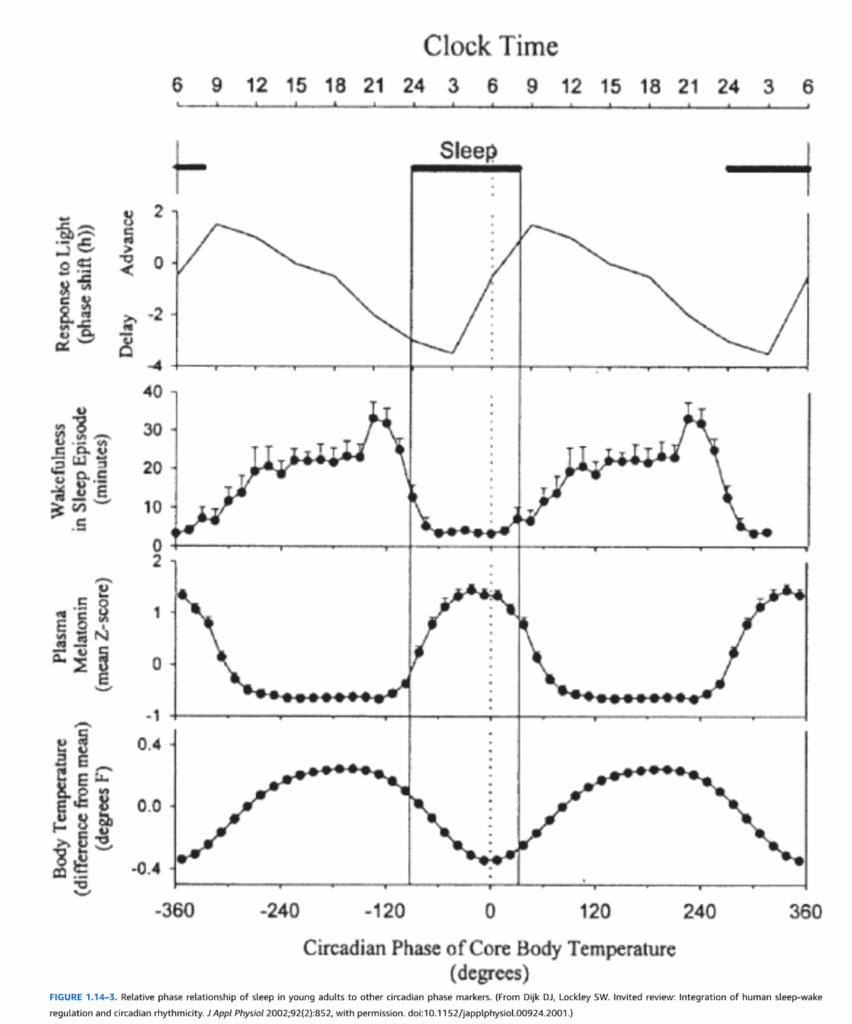
図1.14-3. 若年成人における睡眠と他の概日位相マーカーの相対的位相関係。(Dijk DJ, Lockley SW. Invited review: Integration of human sleep-wake regulation and circadian rhythmicity. J Appl Physiol 2002;92(2):852 より、許可を得て転載。doi:10.1152/japplphysiol.00924.2001.)
季節性
前述の通り、メラトニンレベルは単に睡眠中だけでなく、夜間に上昇します。冬に経験するような長い夜は、比較的長い持続時間でメラトニンプロファイルが上昇した状態をもたらします。対照的に、短い夏の夜は、メラトニンの上昇持続時間が短くなります。 ヒトの行動における季節的変動には、出生率、性的活動、受胎、痛みの閾値、自殺、さらには犯罪行動における季節的ピークが含まれます。成長率、コルチゾール、テストステロンレベルなどの生物学的プロセスにも季節的変動が見られます。一般人口は、冬期の気分の悪化、食欲の増進、睡眠時間の延長、エネルギーの低下、社会的行動の減少を経験します。これらの気分と行動の季節的変動は、潜在的に適応不良である可能性があります。
精神疾患における概日リズム
季節性感情障害
**季節性感情障害(SAD)**は、季節性の最も明白な症状です。これは、季節的に再発する反復性の大うつ病エピソードと、寛解期間または躁病または軽躁病への変化によって特徴づけられます。SADは、精神疾患の診断・統計マニュアル第5版(DSM-5)において、「季節性パターンを伴う」という特定因子を付加された大うつ病性障害(MDD)、双極I型障害、または双極II型障害として診断されます。季節性パターンの特定因子基準には以下が含まれます。
A. 大うつ病エピソードの発症と特定の時期との間に規則的な時間的関係がある(明らかな季節に関連する心理社会的ストレス要因とは無関係)。 B. 完全な寛解(または躁病または軽躁病への変化)もまた、一年のある特徴的な時期に発生する。 C. 過去2年間に基準AおよびBを満たす2つの大うつ病エピソードが発生し、同じ期間に非季節性のエピソードは発生していない。 D. 個人の生涯において、季節性の大うつ病エピソードが非季節性のエピソードを大幅に上回っている。 (アメリカ精神医学会より許可を得て転載。Diagnostic and Statistical Manual of Mental Disorders, 5th ed. text rev. American Psychiatric Association; 2022:214.)
SADの最も一般的な形態は、晩秋から初冬にかけて発症し、晩春から初夏にかけて寛解します。この状態はしばしば冬季SAD、または冬季うつ病と呼ばれますが、「冬の憂鬱」とは異なり、臨床的に有意なレベルのうつ病です。調査によると、一般人口における冬季SADの有病率は4%から9%の間です。女性は男性の最大4倍影響を受けやすく、人口の最大20%が準症候性の症状を抱えている可能性があります。SADの確定診断を受けた患者の親族ではSADの罹患率が高く、双生児研究では季節性および/またはSADの遺伝率が29%から43%であることが特定されています。 冬季SADのゴールドスタンダード治療は光療法です。SAD患者の約半数は光療法に反応して寛解を経験し、これはこの分野で最高の治療反応率の一つです。しかし、光療法のメカニズムはまだ明らかではありません。典型的な光療法の処方には、比較的高い照度(5,000〜10,000ルクス)の広スペクトル、紫外線フィルター付き白色光源に毎日45〜90分間曝露することが含まれます。研究では、睡眠衛生に関する教育を含む**認知行動療法(CBT)**が、急性期治療において光療法と同等の効果があり、その後の再発に対して予防的な効果をもたらす可能性があることが示唆されています。複数の抗うつ薬も冬季SADの治療に成功裏に使用されています。 冬季SAD患者における光療法の抗うつ効果は、この疾患の病因に関するいくつかの仮説を生み出してきました。ある仮説は、SAD患者が慢性的に位相遅延した概日時計の結果を経験していると提案しており、時計と環境との間の異常な位相角が冬季SADの原因であると示唆しています。ほとんどのSAD患者は夜型であると報告していますが、半数近くは有意に遅延したリズムを持っていません。いくつかの研究では、SAD患者は対照群と同じ時刻にメラトニンレベルが上昇するものの、その持続時間が長く、朝の時間帯にまで影響を与えていることが示されています。これらのデータは位相遅延仮説とは一致しませんが、冬季SAD患者の延長されたメラトニンプロファイルを急激に抑制するであろう朝のブライトライト療法の有効性を説明できるかもしれません。朝の光曝露によるメラトニンプロファイルの整形が、光療法の証明された成功を完全に説明できるわけではないことに注意すべきです。一部の冬季SAD患者では、夕方に投与されたブライトライトも抗うつ作用を示します。実際、一部の光療法治療パラダイムでは朝と夕方の光曝露を処方しますが、データは朝の光療法が平均的な患者にとって最も効果的であることを示唆しています。 様々な時刻に投与された光療法の成功は、冬季SADが概日ベースの病因ではない可能性を示唆しています。別の仮説は、冬季SADを経験している患者は、健康な対照者と比較して、一般的に光に対する感受性が低いと提案しています。このような光感受性の低さは、晩秋から初冬にかけての光レベルの低下時に明らかになり、これらの個人をうつ病を回避するために必要な光の閾値から遠ざけることになります。したがって、ブライト光療法による光の毎日の補充は、この理論的な閾値を超えることが期待されます。 一般的に、光療法が冬季SADの効果的な治療法であることが証明されていることは否定できません。しかし、ブライトライトがこの疾患の症状を改善するメカニズムは不明のままです。
非季節性単極性うつ病と概日リズム
単極性の非季節性うつ病患者において、異常な概日リズムが記録されています。例えば、うつ病患者は夜型である可能性が高く、健康な対照群と比較して、メラトニンと深部体温のピーク振幅の遅延と減少を示すことがよくあります。非季節性うつ病では、朝または午後に気分症状が悪化する日中のパターンが明らかであり、これは脳の感情調節領域における脳ブドウ糖代謝と一致しています。報告は一貫していませんが、Clock遺伝子やCry遺伝子を含むいくつかの時計遺伝子の変異が、うつ病の診断と関連していることが見出されています。 睡眠障害は非季節性うつ病の特徴であり、特に不眠症が挙げられます。さらに、うつ病ではREM潜時、すなわち入眠から最初のREMエピソードまでの時間が短縮され、REM密度が増加します。睡眠の改善は再発率の低下の重要な指標であるため、睡眠の概日制御はうつ病の長期転帰を改善する潜在的な手段となります。うつ病と睡眠に関連する興味深い現象は、全睡眠剥奪がうつ病患者の大多数(約60%)において一時的な抗うつ効果を提供できることです。この「覚醒療法」は、一晩または一晩の後半の睡眠制限を伴いますが、完全な一晩の睡眠後にうつ病症状が戻るため、単独療法として使用することはできず、治療効果は別の種類の治療で維持されなければなりません。 この種の睡眠剥奪以外の他の時間療法には、睡眠相前進療法、ブライトライト療法、およびメラトニン投与が含まれます。いくつかの研究では、ブライトライト療法が非季節性うつ病の改善につながる可能性が示されており、光療法が抗うつ薬治療に加えて補助的な治療の選択肢となり得ることが示唆されています。 覚醒療法が迅速な抗うつ効果をもたらす可能性があることを考えると、覚醒療法を抗うつ薬および/または光療法と組み合わせる方法は、迅速な反応を達成し、その後の抗うつ反応の十分な維持に有望性を示しています。さらに、ほぼすべての効果的な抗うつ薬は、過剰なREM睡眠の抑制やREM潜時の延長など、睡眠プロセスに治療効果を持つようで、これは根底にある概日再同期を反映している可能性があります。 うつ病においてネガティブなライフイベントが発生した場合、これは社会的リズムの崩壊(例:配偶者の死後の最初の毎日の社会的接触のタイミング)につながる可能性があります。限られた証拠ですが、このような社会的リズムの崩壊または不規則性が生物学的リズムの同様の崩壊につながり、社会的リズムの規則性を回復させる治療が効果的である可能性があることを示唆しています(対人関係および社会的リズム療法の議論については次のセクションを参照)。ホルモン、体温、および気分の概日調節は異なり、社会的ツァイトゲーバーや遺伝的要因によって異なる影響を受ける可能性があり、相互作用する可能性が高く、気分障害に対する概日影響の複雑さを強調しています。
現在の時刻は2025年5月29日木曜日午後2時07分38秒(日本標準時)です。
現在の場所は日本の東京都品川区です。
双極性障害
非季節性うつ病と同様に、概日異常は双極性障害の発症における潜在的に重要な病因メカニズムとして示唆されています。双極性障害は、ヒトおよび動物モデルにおけるコア時計遺伝子の変異と関連付けられています。例えば、Clock遺伝子に変異を持つマウス(ClockΔ19)は、活動亢進や睡眠時間の減少など、躁病様行動を示します。これらのClockΔ19マウスは、双極性障害における概日リズムの障害の寄与をよりよく理解するための有用なモデルを提供してきました。ClockΔ19マウスは、VTAにおけるドーパミン合成の増加を示しており、腹側被蓋野(VTA)におけるドーパミン作動性活動におけるClock遺伝子の重要性を示唆しています。さらに、VTAにおけるCLOCKタンパク質の発現は、活動亢進や不安を含むClock変異マウスの躁病様行動のほとんどを救済します。総合すると、ClockΔ19マウスモデルは、双極性障害におけるVTA内のドーパミン作動性活動の概日調節の重要性を示唆しています。
双極性障害におけるヒトの研究もまた、異常な概日調節が潜在的な病因メカニズムであることを示唆しています。概日異常は、個人が経験している状態によって異なるようです。例えば、うつ病は位相遅延と関連付けられるのに対し、躁病は位相前進と関連付けられます。したがって、これらのリズムを安定化させることは、双極性障害の個人における躁病またはうつ病エピソードの発生を予防または軽減するのに役立つかもしれません。実際、ツァイトゲーバーをルーチン化して概日力を効果的に利用する**対人社会リズム療法(IPSRT)**は、不規則な日常生活が概日調節不全を引き起こし、気分エピソードを誘発するという観察に応じて開発されました。IPSRTは、双極II型障害に対して気分安定薬と同等の効果があることが示されています。重要なことに、光療法は、双極性障害を発症する素因を持つ人々において躁病的傾向を顕在化させることが示されており、これはおそらく比較的急激な概日変化によるものです。
概日睡眠障害
DSM-5では、概日リズム睡眠-覚醒障害には、概日症状と推定される概日病因を伴う複数の障害が含まれます。これらの中で、**前進睡眠相症候群(ASPS)**は、朝型クロノタイプにおける病理学的な極端な現れです。家族性前進睡眠相症候群(FASPS)の常染色体優性遺伝形式は、遺伝的に特徴づけられています。罹患した家族は、日中の睡眠-覚醒リズムが著しく4時間前進します。彼らは通常、午後7時半頃に就寝し、午前4時半頃に自然に目覚めます。罹患者は、PER2遺伝子に一塩基多型(SNP)を持っており、概日分子時計機構の不可欠な構成要素である変異タンパク質をもたらします。同様に、遅延睡眠相症候群(DSPS)も遺伝的に影響を受けている可能性が高いです。PER3遺伝子の反復領域における長さ多型が、DSPS患者の朝型クロノタイプと関連しているように見え、短いアレルは夜型クロノタイプと関連しています。
次の章では、DSPS、ASPS、過眠症、高齢者の睡眠維持不眠症、時差ぼけや交代勤務障害、非24時間型および不規則睡眠-覚醒型概日リズム障害といった睡眠障害について議論されますが、これらはすべてブライトライト療法によって改善を示します。光療法はアルコールからの離脱中の睡眠正常化にも役立ち、したがって睡眠と気分が障害されている多くの障害において補助的な選択肢として考慮される可能性があります。
生物学的リズムに従って、または生物学的リズムを正常化するために投与される治療法である時間治療には、ブライトライト療法、メラトニンとそのアゴニスト、および覚醒療法と暗闇療法が含まれます。このような治療法は、概日リズム睡眠-覚醒障害の第一選択治療となることが多いです。時間治療では、環境または望ましいスケジュール(例:交代勤務への適応のための使用)との関連におけるこれらの介入の適切なタイミングが重要です。例えば、前述の通り、薄明かり下メラトニン出現は入眠の2〜4時間前に上昇し始めます。就寝時に高用量(5mg以上)の外因性メラトニンを服用すると、眠気を誘う可能性がありますが(睡眠を誘発するのに役立つ)、環境に対する概日リズムの位相遅延も誘発する可能性があり、これはタイムゾーンを飛行機で急速に変更したときに最も経験しやすいことから、一般的に「時差ぼけ」と呼ばれる効果です。
記憶、加齢、および神経認知障害
一般的に、ヒトが加齢し、年齢関連の規範的な記憶問題が始まると、個人は概日周期の短縮、ほとんどの概日リズムの振幅の減少、および位相前進を経験し、その結果、覚醒時間と就寝時間が早まります。前述の通り、VLPOニューロンの変性やその他の医学的および心理社会的併存疾患がこれらの変化を悪化させる可能性があります。さらに、高齢者は時差ぼけによって引き起こされるような劇的な位相シフトに対する耐性が低い可能性があります。
振幅の減少やミスアライメントなど、加齢に伴う概日変化は、神経変性疾患(例:アルツハイマー病[AD]における位相遅延、前頭側頭型認知症[FTD]における位相前進、パーキンソン病[PD]および進行性核上性麻痺[PSP]における睡眠-覚醒逆転)を含む神経認知障害で悪化します。例えば、中等度の認知症の患者は、軽度の認知症や健康な対照と比較して、活動リズムが断片化され、振幅が減少しています。活動リズムの障害の程度は、死後脳で見られる神経病理の重症度とも関連しており、死亡時に最も異常な活動リズムを示した患者は、最も神経病理を示し、しばしばコリン作動性機能の障害を伴っていました。調節不全の概日リズムは、神経認知障害(認知症)の発生やADの臨床診断に先行して見られることが判明しており、ADまたは軽度神経認知障害の発生を有意に予測します。これらの証拠を総合すると、概日リズムの障害がADに関連する神経病理および神経認知障害の発症に中心的な役割を果たす可能性が示唆されます。個人の概日リズムを正常化することを目的とした光療法は、AD患者の睡眠および認知スコアを改善することが示されています。同様に、これらの障害における概日ミスアライメントに関連するコリン作動性緊張の障害は、「夕暮れ症候群」の現象と関連しています。これらの障害は他の症状を悪化させ、落胆の主要な原因となり、介護者の負担を増やし、より早い介護施設入居につながる可能性があります。
概日リズムと薬物療法
概日リズムは薬物の影響を受ける可能性があり、逆に、概日時計は一日を通して薬物の有効性を調節することができます。これらの相互作用をよりよく理解することは、より効果的な薬物療法につながるでしょう。薬物と概日時計の間の最もよく研究されている相互作用のいくつかには、抗うつ薬の概日効果が含まれています。夜間体温の上昇は、うつ病患者に共通する特徴です。この効果は、体温を駆動する視床下部のマスター概日振動子の振幅が減少していることによる可能性があります。TCAs(三環系抗うつ薬)およびSSRIs(選択的セロトニン再取り込み阻害薬)は、夜間体温の上昇を減少させると同時に概日振幅を増強し、その抗うつ効果の一部は、うつ病患者が示す日常活動リズムの減衰した振幅に対抗することにあると考えられています。
短時間作用型ベンゾジアゼピン(例:トリアゾラム[ハルシオン]およびブロチゾラム[レンドルミン])もまた、時間生物学的効果を発揮します。ハムスターにおいて、主観的日中の真ん中に投与されたトリアゾラムまたはブロチゾラムは、概日位相前進を誘発します。ブロチゾラムは、SCNにおける時計遺伝子Per1およびPer2の光誘発性発現を減少させることが示されています。
乱用薬物も概日システムに影響を与えます。3,4-メチレンジオキシメタンフェタミン(MDMA)または「エクスタシー」は、セロトニン神経毒として作用する可能性があります。動物モデルでは、MDMAが薬剤誘発性の位相シフトを減少させ、リズムを再同調させる能力を低下させ、SCNにおけるセロトニン作動性軸索終末を減少させることが示されています。メタンフェタミンの慢性投与は齧歯類の活動リズムを disorganized させますが、一部の研究では、SCNの切除によって不規則になった齧歯類のリズムを再確立するのに役立つ可能性があることが示されています。
多くの薬物療法の有効性と毒性は、概日相の関数として変化します。固定用量の致死毒性の毎日の変動は、長年にわたって齧歯類で認識されてきました。抗代謝薬からDNAインターカレーター、有糸分裂阻害薬まで、様々なメカニズムの多くのがん治療薬は、日中の時間経過とともに齧歯類において耐性が2〜10倍変化することが示されています。この差の多くは、身体の毒性化合物の吸収、分布、代謝、および排泄能力における概日変動に起因しています。これら4つのプロセスは、胃のpH、胃腸の運動性、糸球体濾過率、および膜粘度の毎日の変動などの生理学的プロセスにおける根底にある概日リズムによって影響を受けます。伝統的な時間に摂取される食物の規則的な摂取も、治療薬が体によってどのように処理されるかに影響を与えます。薬物の有効性を最大化し、毒性を最小限に抑えるためには、投与の概日相を考慮する必要があることが明らかになっています。時間治療の分野の出現は、薬理学的治療の有効性に対する概日システムの影響の理解が深まっていることの反映です。
将来の考察
増え続ける研究の蓄積は、概日システムの影響が広範であり、正常な機能にとって基本的であることを示しています。SCNと末梢振動子間の脱同期は、精神疾患を含む複数の疾患の病態形成に関与している可能性が高いです。概日障害と精神疾患の病態生理学との関係の理解が深まるにつれて、光入力、中枢時計、または時計出力メカニズムを操作するように設計された治療法が、精神疾患の治療においてますます有望性を示すことを期待します。
さらに読む
Arendt J, Skene DJ. Melatonin as a chronobiotic. Sleep Med Rev. 2005;9(1):25-39.
Berger M, Vollmann J, Hohagen F, et al. Sleep deprivation combined with consecutive sleep phase advance as a fast-acting therapy in depression: an open pilot trial in medicated and unmedicated patients. Am J Psychiatry. 1997;154:870-872.
Bloom HG, Ahmed I, Alessi CA, et al. Evidence-based recommendations for the assessment and management of sleep disorders in older persons. J Am Geriatr Soc. 2009;57(5):761-789.
Bohle P, Di Milla L, Fletcher A, Rajaratnam S. Introduction: aging and the multifaceted influence on adaptation to working time. Chronobiol Int. 2008;25:155-164.
Carter DS, Goldman BD. Antigonadal effects of timed melatonin infusion in pinealectomized male Djungarian hamsters (Phodopus sungorus sungorus): duration is the critical parameter. Endocrinology. 1983;113:1261-1267.
Chen-Goodspeed M, Lee CC. Tumor suppression and circadian function. J Biol Rhythms. 2007;22:291-298.
Czeisler CA, Duffy JF, Shanahan TL, et al. Stability, precision, and near-24-hour period of the human circadian pacemaker. Science. 1999;284:2177-2181.
Davidson AJ, Sellix MT, Daniel J, Yamazaki S, Menaker M, Block GD. Chronic jet-lag increases mortality in aged mice. Curr Biol. 2006;16:R914-R916.
Dijk D-J, Lockley SW. Integration of human sleep-wake regulation and circadian rhythmicity. J Appl Physiol. 2002;92:852-862.
Germain A, Kupfer DJ. Circadian rhythm disturbances in depression. Hum Psychopharmacol. 2008;23:571-585.
Harvey AG. Sleep and circadian rhythms in bipolar disorder: seeking synchrony, harmony, and regulation. Am J Psychiatry. 2008;165:820-829.
Herzog ED, Schwartz WJ. A neural clockwork for encoding circadian time. J Appl Physiol. 2002;92:401-408.
Klein DC, Moore RY, Reppert SM, eds. Suprachiasmatic Nucleus: The Mind’s Clock. Oxford University Press; 1991.
Klerman EB, Shanahan TL, Brotman DJ, et al. Photic resetting of the human circadian pacemaker in the absence of conscious vision. J Biol Rhythms. 2002;17:548-555.
Ko CH, Takahashi JS. Molecular components of the mammalian circadian clock. Hum Mol Genet. 2006;15:R271-R277.
Kondratova AA, Kondratov RV. The circadian clock and pathology of the ageing brain. Nat Rev Neurosci. 2012;13(5):325-335.
Levi F, Schibler U. Circadian rhythms: mechanisms and therapeutic implications. Annu Rev Pharmacol Toxicol. 2007;47:593-628.
McClung CA. How might circadian rhythms control mood? Let me count the ways. Biol Psychiatry. 2013;74(4):242-249.
Miller JD, Morin LP, Schwartz WJ, Moore RY. New insights into the mammalian circadian clock. Sleep. 1996;19:641-667.
Moore RY. Circadian rhythms: basic neurobiology and clinical applications. Annu Rev Med. 1997;48:253-266.
Morin LP. The circadian visual system. Brain Res Brain Res Rev. 1994;19:102-127.
Nelson DE, Takahashi JS. Sensitivity and integration in a visual pathway for circadian entrainment in the hamster (Mesocricetus auratus). J Physiol. 1991;439:115-145.
Quintero JE, Kuhlman SJ, McMahon DG. The biological clock nucleus: a multiphasic oscillator network regulated by light. J Neurosci. 2003;23:8070-8076.
Ralph MR, Foster RG, Davis FC, Menaker M. Transplanted suprachiasmatic nucleus determines circadian period. Science. 1990;247:975-978.
Roecklein KA, Wong PM, Miller MA, Donofry SD, Kamarck ML, Brainard GC. Melanopsin, photosensitive ganglion cells, and seasonal affective disorder. Neurosci Biobehav Rev. 2013;37:229-239.
Roybal K, Theobold D, Graham A, et al. Mania-like behavior induced by disruption of CLOCK. P Natl Acad Sci USA. 2007;104(15):6406-6411.
Ruby NF, Brennan TJ, Xie X, et al. Role of melanopsin in circadian responses to light. Science. 2002;298:2211-2213.
Smith BN, Sollars PJ, Dudek FE, Pickard GE. Serotonergic modulation of retinal input to the mouse suprachiasmatic nucleus mediated by 5-HT1B and 5-HT7 receptors. J Biol Rhythms. 2001;16:25-38.
Takahashi JS, Turek FW, Moore RY, Takahashi JS, Turek FW, eds. Handbook of Behavioral Neurobiology: Circadian Clocks. Vol. 12. Kluwer Academic Publishers; 2001.
Toh KL. Basic science review on circadian rhythm biology and circadian sleep disorders. Ann Acad Med Singap. 2008;37(8):662-668.
Toh KL, Jones CR, He Y, et al. An hPer2 phosphorylation site mutation in familial advanced sleep phase syndrome. Science. 2001;291:1040-1043.
Weekes NY, Lewis RS, Goto G, Garrison-Jakel J, Patel F, Lupien S. The effect of an environmental stressor on gender differences on the awakening cortisol response. Psychoneuroendocrinology. 2008;33:766-772.
Yamazaki S, Goto M, Menaker M. No evidence for extraocular photoreceptors in the circadian system of the Syrian hamster. J Biol Rhythms. 1999;14:197-201.

