1.15 睡眠の基礎科学
ルース・M・ベンカ医学博士、キアラ・チレッリ医学博士、ジュリオ・トノーニ医学博士
睡眠はすべての動物種にとって基本的な行動ですが、その具体的な機能はまだ完全には解明されていません。睡眠は人間の寿命の約3分の1を占め、睡眠不足は認知、感情、身体の障害につながる可能性があります。睡眠と覚醒の調節に関与するシステムは、感情や他の行動の調節に関与するシステムと重複または相互作用するように見えます。したがって、精神疾患患者において睡眠異常が一般的に見られること、いくつかの疾患の診断基準の一部であること、および将来の精神疾患の発症を予測する価値があることは驚くべきことではありません。さらに、一般的に使用される精神科薬の大部分は睡眠に影響を与えます。
正常な人間の睡眠
睡眠の定義
行動の観点から見ると、睡眠は環境刺激に対する意識が低下した状態であり、昏睡や冬眠のような状態とは、その比較的速い可逆性によって区別されます。眠っている個人はほとんど動かず、定型的な姿勢をとる傾向があります。睡眠は外部世界からの部分的な切断と、その状態の記憶の一般的な欠如によって特徴づけられますが、昏睡状態とは異なり、人々は通常、眠気を感じているとき、およびエピソードの終了時に眠っていたことを認識します。 臨床および研究目的のために、睡眠は通常、行動観察と電気生理学的記録を組み合わせることによって特徴づけられます。他のほとんどの哺乳類と同様に、人間は2種類の睡眠を発現します。急速眼球運動(REM)睡眠と非急速眼球運動(NREM)睡眠です。これらの状態は、独特の神経生理学的および精神生理学的特徴を持っています。REM睡眠は、頻繁に発生する眼球運動活動のバーストにその名を由来します。また、REM睡眠中の脳波(EEG)が覚醒時のそれに似ているため、逆説睡眠とも呼ばれます。乳児では、REM睡眠に相当するものは、顕著な相性筋肉のけいれんがあるため、活動睡眠と呼ばれます。NREM睡眠、または正統睡眠は、脳波の活性化の低下によって特徴づけられます。乳児では、運動活動の相対的な欠如のため、静的睡眠と呼ばれます。
睡眠段階
REM睡眠とNREM睡眠の中には、さらに段階と呼ばれる分類があります(表1.15-1および図1.15-1)。臨床および研究用途では、睡眠は通常30秒のエポックでスコア化され、睡眠段階は顎下に記録された3つのパラメーター(EEG、眼球運動図[EOG]、筋電図[EMG])の視覚的なスコア付けによって定義されます。1968年にRechtschaffenとKalesによって定義された基準のほとんどは、現在でも臨床診療および世界中の研究で受け入れられていますが、2007年にアメリカ睡眠医学会(AASM)によって「The AASM Manual for the Scoring of Sleep and Associated Events」という新しいルールが採用され、これは2020年に最新版が更新されました。覚醒時、EEGは低電圧の速い活動または活性化パターンを示します。EMGは、自発運動に関連する追加の一過性筋活動を伴う高い緊張性活動を示します。自発的な眼球運動とまばたきも覚醒中に観察できます。睡眠の準備のために目を閉じると、特に後頭部でアルファ活動(8〜13 Hz)が顕著になります。
表1.15-1. 睡眠段階—電気生理学的基準
| 睡眠段階 | EEG (脳波) | EOG (眼球運動図) | EMG (筋電図) |
|---|---|---|---|
| 覚醒 | |||
| ステージ W | 低電圧、混合周波数。閉眼時にはアルファ波 (8-13 Hz)、頂点鋭波 | 眼球運動とまばたき | 高い緊張性活動と自発運動 |
| 非急速眼球運動 | |||
| ステージ N1 | 低電圧、混合周波数。シータ波 (4-7 Hz) と頂点鋭波が存在する場合あり | 遅い眼球運動 | 覚醒時よりわずかに緊張性活動が低下 |
| ステージ N2 | 睡眠紡錘波 (12-14 Hzのバースト) とK複合波 (陰性鋭波に陽性徐波が続く) を伴う低電圧、混合周波数背景 | なし | 低い緊張性活動 |
| ステージ N3 | 高振幅 (≥75 uV) の徐波 (≤2 Hz) がエポックの20%以上を占める | なし | 低い緊張性活動 |
| 急速眼球運動 | |||
| ステージ R | 低電圧、混合周波数。のこぎり波、シータ活動、遅いアルファ活動が存在する場合あり | 急速眼球運動 | 相性けいれんを伴う緊張性アトニー |
Google スプレッドシートにエクスポート
基準はIber C, Ancoli-Israel S, Chesson AL, Quan SF. The AASM Scoring Manual for the Scoring of Sleep and Associated Events. American Academy of Sleep; 2007. より。
通常REM睡眠に先行するNREM睡眠は、3つの(N1からN3)段階に細分されます(表1.15-1および図1.15-1)。睡眠は通常、移行状態であるステージN1(以前はステージ1睡眠)から始まります。これは、アルファ活動の消失と、顕著なシータ活動(4〜7 Hz)と時折の中央領域に現れる頂点鋭波(V波)を伴う低電圧の混合周波数EEGパターンの出現によって特徴づけられます。眼球運動は遅くなり、転がるようになり、骨格筋の緊張が弛緩します。主観的には、ステージN1は睡眠として認識されないかもしれませんが、感覚刺激、特に視覚に対する意識は低下し、精神活動はより夢のようになります。運動活動はステージN1中に数秒間持続することがあります。時折、個人は突然の筋肉収縮を経験し、時には転倒感や夢のようなイメージを伴うことがあります。これらの入眠時けいれん(またはスリープスタート)は一般的に良性であり、睡眠不足によって悪化することがあります。通常、睡眠不足の個人は、短い(5〜10秒)ステージN1睡眠の発作からなる「マイクロスリープ」の期間に入ります。これらのエピソードは眠い個人には避けられず、自動車の運転など、絶え間ない注意を要する状況では重大な結果を招く可能性があります。 ステージN1の数分後、睡眠は通常ステージN2(以前はステージ2)に進みます。これは、EEGにおける睡眠紡錘波(11〜16 Hz、0.5秒以上持続)とK複合波(高振幅、陰性鋭波に陽性徐波が続く、0.5秒以上持続)の出現によって告げられます。ステージN2およびその後のNREM睡眠とREM睡眠の段階はすべて、主観的に睡眠として認識されます。特に夜の初めには、ステージN2に続いてN3(以前はステージ3および4)が一般的に続きます。これは、各睡眠エポックの20%以上が徐波、すなわち、前頭領域でピーク間振幅が75uVを超える0.5〜2Hzの周波数の波からなる期間です。N3は徐波睡眠(SWS)、デルタ睡眠、または深睡眠とも定義されます。これは、覚醒閾値がステージN1からN3にかけて段階的に増加するためです。以前は、SWSはエポック内の徐波の割合(ステージ3、20%〜50%;ステージ4、50%超)に応じて細分されていましたが、古い研究ではこの命名法が使用されていました。しかし、この細分化の妥当性と生物学的重要性は疑問視されました。眼球運動は通常、ステージN2およびN3中に停止し、EMG活動はさらに減少します。 REM睡眠、またはステージRは段階に細分されず、むしろ**緊張性(持続的)および相性(エピソード的)**成分で記述されます。REM睡眠の緊張性側面には、ステージN1に似た活性化されたEEGが含まれます。これは、シータ帯域での活動の増加、および外眼筋と横隔膜を除く骨格筋の緊張の全体的な低下を示すことがあります。のこぎり波、すなわち三角形で鋸歯状の2〜6Hzの波の連なりも存在することがあります。REMの相性特徴には、不規則なREMのバーストと筋肉のけいれんが含まれます。緊張性および相性成分を示すステージRの例が図1.15-2に示されています。

図1.15-1. 睡眠段階と覚醒時の脳波パターン。REM:急速眼球運動。(Butkov N. Atlas of Clinical Polysomnography. Synapse Media; 2010, with permission. より。)
睡眠の組織
夜間に得られる睡眠量は個人差があり、年齢によっても異なります。National Sleep Foundation(全米睡眠財団)は、科学文献をレビューし、生涯にわたる睡眠時間の推奨をまとめるための専門家パネルを招集しました。彼らは、ほとんどの成人が最適な機能を果たすために一晩に約7〜9時間の睡眠が必要であると結論付けましたが、65歳以上の場合は7〜8時間で十分かもしれません。これらは人口ベースの推奨ですが、一晩に6時間未満の睡眠で十分に機能する短時間睡眠者や、一晩に12時間以上の睡眠を必要とする長時間睡眠者も存在します。毎日の睡眠必要量に影響を与える年齢や遺伝的要因に加えて、医学的または精神的な障害も睡眠パターンに強く影響します。必要な時間数にかかわらず、各段階に費やされる時間の割合と夜間の段階のパターンは、健常な成人ではかなり一貫しています(図1.15-3)。健康な若年成人は、通常、睡眠期間の約5%をステージN1睡眠に、約50%をステージN2に、そしてそれぞれ20%〜25%をステージN3とRに費やします。睡眠はNREM-REM睡眠のサイクルで発生し、それぞれのサイクルは約90〜110分持続します。SWS(ステージN3)は夜の早い時間帯、特に最初のNREM期間に最も顕著であり、夜が進むにつれて減少します。SWSが衰えるにつれて、REM睡眠期間は長くなり、夜の後半にはより大きな相性活動と一般により激しい夢を見せるようになります。高齢者ではSWSの量が減少します。 上行性覚醒系は、脳幹と後部視床下部から前脳全体に投射を送ります。外側背側被蓋(LDT)核と脚橋被蓋(PPT)核のニューロンは、視床を含む多くの前脳標的にコリン作動性線維(Ach)を送り、それが皮質活動を調節します。アミン作動性核は、前脳の大部分に拡散的に投射し、皮質および視床下部の標的の活動を直接調節します。乳頭体核(TMN)のニューロンは**ヒスタミン(HIST)を含み、縫線核のニューロンはセロトニン(5-HT)を含み、青斑核(LC)のニューロンはノルアドレナリン(NA)を含みます。腹側外側視前野(VLPO)核および前部視床下部と前脳基底部の他の領域の睡眠促進ニューロンは、GABAとガラニン(Gal)**を含みます。

図1.15-2. ヒトの急速眼球運動(REM)睡眠の例。EEG:脳波、EMG:筋電図。(Butkov N. Atlas of Clinical Polysomnography. Synapse Media; 2010, with permission. より。)
睡眠に対する加齢の影響
睡眠パターンは生涯を通じて著しく変化し、最も急速な変化は人生の最初の数年間に起こります。睡眠と覚醒のEEGパターンの発達は、妊娠約24週から始まり、活動睡眠(REM)と静的睡眠(NREM)への分化は妊娠後期に起こります。新生児は1日に約14〜17時間睡眠をとり、未熟児はさらに多く睡眠をとる場合があります。乳児は生後数ヶ月間は強い日周性睡眠パターンを示しません。彼らは約3〜4時間の短い睡眠-覚醒サイクルと、活動-静的睡眠サイクルの短い長さ(約50分)を示します。出生時、活動睡眠は睡眠時間の約半分を占め、静的睡眠ではなく活動睡眠を通して入眠する傾向があります。生後約3〜4ヶ月で、いくつかの重要な発達的変化が起こります。乳児はNREMから睡眠を開始する成人様パターンに移行し、夜間の睡眠が統合され始め、睡眠EEGはNREMおよびREM睡眠に特徴的なより成熟した波形を示します。睡眠時間もわずかに減少し、1日12〜15時間になります。

図1.15-3. 上行性覚醒システムは、脳幹と後部視床下部から前脳全体に投射を送ります。外側背側被蓋核(LDT)と脚橋被蓋核(PPT)のニューロンは、視床を含む多くの前脳標的にコリン作動性線維(Ach)を送り、それが皮質活動を調節します。アミン作動性核は、前脳の大部分に拡散的に投射し、皮質視床下部の標的の活動を直接調節します。乳頭体核(TMN)のニューロンはヒスタミン(HIST)を含み、縫線核のニューロンはセロトニン(5-HT)を含み、青斑核(LC)のニューロンはノルアドレナリン(NA)を含みます。腹側外側視前野(VLPO)核の睡眠促進ニューロンは、γ-アミノ酪酸(GABA)とガラニン(Gal)を含みます。(Saper CB, Chou TC, Scammell TE. The sleep switch: hypothalamic control sleep and wakefulness. Trends Neurosci. 2001;24(12):726-731. Copyright © 2001, Elsevierの許可を得て転載。)
幼児期には、総睡眠時間は減少し続け、就学前の学齢期の子供たちの推奨睡眠量は一晩あたり9〜11時間となり、REM睡眠の割合は成人レベル(20%〜25%)にまで低下します。昼寝は通常、就学前期間中は続きますが、子供たちが全日制学校に通い始めるとしばしばなくなります。幼児はSWS(徐波睡眠)の割合が最も高く、特に覚醒閾値が高いです。これは、睡眠期間の開始時に彼らを目覚めさせるのが難しいことと、夜尿症や、夢遊病や夜驚症などのSWS関連のパラソムニア(睡眠時随伴症)の発生率が高いことの両方を説明します。 SWSの持続時間と徐波の振幅は、思春期に有意に減少し、これは皮質のシナプス刈り込みに関連している可能性があります。アーウィン・ファインバーグは、シナプス除去の異常が、睡眠パターンの成熟と、思春期後期から青年期初期にかけての統合失調症の発生率の増加という、見かけ上偶然の一致を説明するかもしれないと示唆しています。SWS持続時間の減少を示すだけでなく、思春期の若者は総睡眠時間を著しく減少させることがよくありますが、これは真の睡眠必要量の減少というよりも、行動の変化によるものと考えられます。彼らの推奨睡眠量は一晩あたり8〜10時間と推定されています。彼らはまた、「夜型」になる傾向を示し、早起きするよりも夜遅くまで起きていることを好みます。この「夜型」への移行は、概日時計の内因性周期の増加に関連している可能性があります。 SWS量の変化に加えて、頭皮の**徐波活動(SWA)**の局所性に劇的な変化が見られ、これは皮質の脳成熟のパターンを反映しています。最も早く発達する後頭部領域は、非常に幼い子供で最もSWAを示します。発達中に皮質が後方から前方へと成熟するにつれて、最大のSWAも前方に移動し、思春期後期から青年期初期には前頭皮質優位の成人パターンを示します。 高齢者は、睡眠を妨げる可能性のある原発性睡眠障害(例:睡眠時無呼吸症候群や周期性四肢運動[PLMs])、医学的疾患、および精神疾患の発生率が増加します。したがって、どの睡眠変化が正常な加齢を、どの変化が病的な加齢を意味するのかを判断することは困難です。SWSは成人期を通して減少し、60歳までには完全に消失することもあります。SWAは頭皮全体で全体的に減少します。睡眠もより断片化され、入眠潜時の延長、覚醒回数の増加、睡眠期間中の覚醒時間の増加、および日中の昼寝の増加が見られます。したがって、高齢者はベッドで過ごす時間が長くなる一方で、得られる睡眠は少なくなります。一部の個人では、5〜6時間の睡眠が十分な量である可能性もあります。高齢者はまた、朝早く目覚め、夕方よりも朝の方がより覚醒していると感じる傾向を示します。REM睡眠の割合は、正常な個人では年齢とともにわずかな減少しか示しません。しかし、アルツハイマー病やその他のCNSの変性疾患の患者は、REM睡眠の消失と睡眠-覚醒の日周パターンの悪化を示します。この悪化は非常に重度になることがあり、介護施設の患者は、一日中一貫して眠っているか覚醒しているかのどちらかの状態にある時間が1時間もない場合があります。
ヒトの睡眠モニタリング
ヒトの脳波における睡眠-覚醒関連の変化は、1929年にハンス・ベルガーによって最初に報告されました。この発見以来、脳波およびその他の電気生理学的パラメーターが、正常なヒトの睡眠を調査するために使用されてきました。1970年代から、研究者や臨床医は、睡眠障害を特徴づけ、診断するために同様のモニタリング技術を使用し始めました。脳波に加えて、眼球運動と筋活動をそれぞれ測定するためにEOGとEMGが記録されます。これらは、覚醒と睡眠段階を区別するために不可欠です。脳波は、国際10-20電極配置システムに従って、脳の特定の領域を覆う頭皮に貼付された電極から記録されます。覚醒と睡眠段階を定義する脳波の特徴は、脳の異なる領域から両側性に最も容易に記録されるため、最低限3つの戦略的に選択された領域(前頭、中心、後頭)が必要です。K複合波と徐波は、前頭の電極ペアで最適に記録されます。睡眠紡錘波(図1.15-1)は、代わりに中心領域に配置された電極から最もよく記録されます。3番目の電極ペアは、目を閉じたリラックスした覚醒状態と相関するアルファ活動の検出を最適化するために、後頭葉に配置されます。特定の研究または臨床状況下(例:睡眠関連てんかん性疾患の診断)では、脳波活動のより高い空間分解能を得るために追加の電極が適用されます。EOG記録は、覚醒およびREM睡眠に関連するREM、ならびにステージN1睡眠中に発生するゆっくりとした転がる眼球運動を検出するために使用されます。網膜は角膜と比較して電気的に負であるため、眼球運動は、目の近くの皮膚に貼付された電極から検出できる小さな電場を生成します。EMG記録は、行動状態の変化と相関する筋活動の緊張性および相性変化を検出するために使用されます。特に、骨格筋の緊張はREM睡眠中に最も低い緊張レベルに達し、この睡眠段階に関連する一般的な麻痺を反映しています。通常、EMGは顎に貼付された電極から記録されます。臨床現場では、下肢の動きと呼吸努力をそれぞれ検出するために、脛骨前筋と肋間筋の上に補助的なEMG電極が配置されます。提示された症状に応じて、臨床モニタリングには、呼吸努力と流量センサー、心電図、酸素飽和度、呼気終末および/または経皮CO2レベル、および四肢EMG記録などの追加モニタリングも含まれる場合があります。
標準的な睡眠段階スコアリング
標準化された視覚的スコアリングルールは、1968年にRechtschaffenとKalesによって最初に確立され、より最近の修正を加えて、覚醒と各睡眠段階に費やされた時間、および記録期間中の睡眠の時間的分布、またはアーキテクチャを定量化するために現在も使用されています。さらに、高速フーリエ変換に基づくパワースペクトル解析などの数学的手法は、全体的な脳波記録に対する様々な脳波周波数の相対的な寄与を定量化するためによく用いられます。例えば、パワースペクトル解析は、SWAが睡眠期間の早い時間帯に最大であり、SWSの連続する期間を通して徐々に減少することを示しており、この発見が睡眠調節の二過程モデルの基礎を提供しました。 睡眠段階のスコアリングは、睡眠量と質のいくつかの尺度をもたらし、これには睡眠および精神疾患の臨床的に関連するマーカーが含まれます。特定の臨床または研究状況では、各睡眠尺度にわずかに異なる定義が求められる場合があります。睡眠潜時は、記録開始から任意の睡眠段階の開始までの経過時間です。REM睡眠潜時は、睡眠開始からステージR睡眠の最初のエポックまでの経過時間として定義されます。総睡眠時間は、すべての睡眠段階に費やされた累積時間であり、睡眠効率は、総記録時間のうち、いずれかの睡眠段階に費やされた時間の割合です。その他の関心のある尺度には、各睡眠段階に費やされた睡眠の割合が含まれます。 臨床睡眠研究でスコア化されるその他の臨床事象には、呼吸イベントと四肢運動が含まれます。呼吸イベントには、無呼吸(呼吸センサー信号が少なくとも10秒間90%以上低下するもの)と低呼吸(呼吸センサー信号が少なくとも10秒間30%以上低下し、かつ酸素飽和度が少なくとも3%低下するもの)が含まれます。呼吸イベントは、呼吸努力が続く場合は閉塞性、吸気努力がない場合は中枢性に分類されます。睡眠時無呼吸症候群は、睡眠1時間あたり平均5回以上の呼吸イベントがある場合は軽度、15回以上のイベントがある場合は中度から重度とみなされます。四肢運動は、脛骨前筋の上に配置された電極から記録され、少なくとも0.5秒間続く8uV以上の増加がある場合に下肢運動としてスコア化されます。下肢運動が睡眠中に反復して発生する場合(すなわち、5〜90秒間隔で少なくとも4回の下肢運動)、これらは**周期性四肢運動(PLMs)**とみなされます。1時間あたり15回以上は異常とみなされます。
日中の眠気の測定
主要な睡眠期間全体にわたる睡眠パターンを特徴付けることに加えて、研究者や臨床医は、日中の眠気を定量化することに関心を持つことがあります。日中の眠気は、眠りに落ちる傾向の増加、および/または覚醒を維持する能力の低下として現れます。眠気は、主観的な質問票または客観的な電気生理学的モニタリングを使用して測定できます。**スタンフォード睡眠尺度(SSS)やエプワース眠気尺度(ESS)**などの睡眠質問票は、実験室や医師の診察室で簡単に使用できます。SSSは、個人に現在の眠気レベルを評価するよう求めますが、ESSは、さまざまな状況下で眠りに落ちる確率を評価するよう求めます。どちらの質問票も、個人の覚醒レベルや眠りに落ちる傾向を評価する能力、および治療を受ける動機によって影響を受ける可能性があります。
眠気の客観的な測定は、一般的に時間のかかる実験室ベースの検査を必要としますが、より信頼性の高い眠気の推定値が得られます。日中の眠気を測定するために、2つの標準化された客観的検査が一般的に使用されます。**複数睡眠潜時検査(MSLT)**は眠りに落ちる傾向を測定するのに対し、**覚醒維持検査(MWT)は覚醒を維持する能力を測定します。両方の検査は、上述の電気生理学的睡眠モニタリング技術を使用します。MSLTは、2時間間隔で4つまたは5つの睡眠潜時検査で構成されます。各検査の開始時に、被験者は暗い部屋で静かに横になり、眠りに落ちることを許可されます。入眠までの潜時が記録され、20分以内に眠りにつかない場合は、検査は終了します。臨床現場では、眠りに落ちた患者は、異常に短い期間でREM睡眠に入る傾向があるかどうかを判断するために、通常15分間眠ることを許可されます。平均睡眠潜時と、REM睡眠が検出された検査の回数が計算されます。平均睡眠潜時が8分未満は過度の眠気を反映しており、ナルコレプシーや特発性過眠症などのCNS過眠症を示唆する可能性がありますが、平均睡眠潜時が15分以上は正常とみなされます。慢性的な睡眠不足がないにもかかわらず、24時間のポリソムノグラフィー記録で660分以上睡眠をとる個人も特発性過眠症と診断される場合があります。他の症状と合わせて、2回以上のREM睡眠を伴う検査はナルコレプシーを示唆します。MWT中、被験者はMSLTで記述されたものと同様の条件に置かれますが、眠りに落ちるように求められるのではなく、目を覚ましているように求められます。20〜40分間の検査を使用できますが、40分間のプロトコルには、上限効果を最小限に抑えるという利点があります。40分MWTで平均睡眠潜時が35分を超える場合は正常とみなされます。MSLTとMWTは両方とも眠気の客観的検査ですが、個人の以前の睡眠履歴など、さまざまな要因によって結果が影響を受ける可能性があります。臨床現場では、夜間に正常な量の睡眠をとっているにもかかわらず、患者が病的な程度の眠気を示すかどうかを評価することが目標です。患者が明らかに睡眠不足である場合、MSLTでの短い睡眠潜時は臨床的有用性が限られます。したがって、患者の以前の睡眠履歴を、前夜の睡眠検査室でのモニタリングと、前週の睡眠習慣を記録した質問票によって評価することが不可欠です。特定の状況下では、患者は検査室での検査を受ける前に、数日間または数週間、手首に動きを検出し記録する小型デバイス(覚醒の相関物)を装着する場合があります。このような活動量計モニタリング(またはアクチグラフィー)**は、不眠症を訴える患者の自宅での推定睡眠を客観的に測定するためにも使用されます。脳波のパワースペクトル解析、瞳孔活動、および認知テストのパフォーマンスに基づくその他の眠気の客観的測定は現在開発中です。
睡眠中の生理学的変化
睡眠中に発生する生理学的変化を理解することは、正常な睡眠と障害された睡眠が医学的疾患に与える影響を理解するのに役立ちます。さまざまな神経内分泌および自律神経系(ANS)の生理学的パラメータは、概日リズムおよび/または睡眠自体に関連する変化を示します(表1.15-1)。
自律神経系
NREM睡眠中および緊張性REM睡眠中には、交感神経活動に対する副交感神経活動の相対的な増加が見られます。ANSは覚醒時と比較してSWS中に最も安定した状態に達します。例えば、血圧、心拍数、呼吸数はSWS中に最低平均値を示し、変動も最小限です。しかし、相性REM睡眠中には、交感神経活動と副交感神経活動の両方に短い急増が見られ、自律神経の高度な不安定性をもたらします。
循環器系
血圧、心拍数、心拍出量はNREM睡眠中に減少し、SWS中に最低平均値と最小変動に達します。平均して、これらのパラメータは覚醒時と比較してREM睡眠中もいくぶん減少したままですが、REM睡眠中にピーク値に達します。不整脈もREM睡眠中に多く発生し、これが早朝の心血管死亡率の増加に寄与している可能性があります。これはREM睡眠の傾向が最も高まる時間帯です。また、大うつ病に見られる心血管原因に関連する死亡率の増加は、うつ病患者がより多くの相性活動を伴うREM睡眠の量が増加する傾向と関連している可能性もあります。
呼吸器系
一時的な呼吸不安定性および/または周期性呼吸は、睡眠開始時に発生する可能性があり、覚醒関連の呼吸駆動の喪失およびpCO2に対する中枢化学受容器の感受性の低下に関連しています。pCO2に対する感受性はREM睡眠中にさらに低下し、pCO2の低下に対する換気応答も減少します。睡眠中の呼吸数と分時換気量は減少し、筋肉の弛緩により上気道抵抗が増加します。これはREM睡眠中に最も顕著です。これらの変化は、基礎となる肺疾患の悪化だけでなく、睡眠時無呼吸症候群などの睡眠関連呼吸障害にも寄与します。
体温調節
概日リズム関連の夜間の体温低下に加えて、睡眠は体温調節に直接影響を与えます。脳と体温はNREM睡眠中、特にSWS中に、視床下部の体温設定点の低下と能動的な放熱の両方により低下します。人々は、少し寒く感じながら眠りにつき、数時間後に目を覚ますと暑すぎて余分な毛布をはがす(汗をかいている場合もある)という現象をよく経験します。REM睡眠中には、発汗や震えによる体温調節能力が低下します。
神経内分泌変化
概日システムによって調節されるほとんどのホルモンは、睡眠-覚醒パターンと有意な相互作用を示します。**成長ホルモン(GH)**は主に夜の早い時間帯に放出され、SWSはその分泌を促進します。睡眠はまた、プロラクチン分泌を刺激しますが、プロラクチンはGHの後にピークに達し、通常は夜の中頃に分泌されます。しかし、GHとプロラクチンのパルスは、タイミングに関係なく、入眠後に発生する可能性があります。GHとプロラクチンの両方が睡眠にフィードバック効果を持つ可能性もあります。GHはSWSを促進するようですが、プロラクチンはREM睡眠を増加させる可能性があります。対照的に、TSHは入眠直前の夕方にピークレベルに達します。その分泌は睡眠によって抑制され、睡眠不足によって刺激されます。HPA軸は通常、夜間の入眠時に最も不活性な状態にあります。入眠はコルチゾールの放出を抑制する一方、ACTHとコルチゾールレベルは覚醒直前の睡眠期間の終わりに上昇し、朝の覚醒に寄与すると考えられます。重度の睡眠障害や睡眠不足は、内分泌系に重大な臨床的影響を与える可能性があります。例えば、閉塞性睡眠時無呼吸症候群の患者はGHとプロラクチンレベルの低下を示し、睡眠不足は剥奪後の日の夕方にHPA軸の活性化の証拠を生み出します。
メラトニン分泌は、概日制御と光-暗サイクル効果の組み合わせによって媒介されます。暗い場合にのみ夜間に放出されます。日中に暗くなってもメラトニン分泌は刺激されません。したがって、メラトニンは光周期の持続時間を変換することができます。一部の哺乳類では生殖機能のタイミングにおいて重要な役割を果たすものの、ヒトにおけるその機能はあまり明確ではありません。メラトニンは概日時計にフィードバックし、同調を維持するのに役立つ可能性があり、そのため時差ぼけや睡眠スケジュール障害の治療に推奨されることがあります。また、ヒトでは穏やかな催眠効果がある可能性がありますが、夜行性動物では覚醒を誘発することがあり、これは夜間行動の調節物質として作用することを示唆しています。
性機能
男性におけるREM睡眠の特徴の一つは、乳児期から高齢期まで持続する陰茎勃起の発生です。したがって、夜間陰茎腫脹検査は、インポテンスの症例が器質的または心因性の病因に関連しているかどうかを判断するのに役立ちます。女性では、REM睡眠は膣血流量の増加と陰核勃起を引き起こします。これらの変化は、関連する夢の性的内容に必ずしも関連しているわけではありません。
睡眠と覚醒の神経生物学
睡眠と覚醒は、別個でありながら相互作用するシステムによって制御されています。具体的なメカニズムは完全には解明されていませんが、延髄、脳幹、視床下部、および前脳基底部の複数の構造とシステムが、覚醒、NREM睡眠、およびREM睡眠のオーケストレーションに関与していることは明らかです。単一の脳病変が持続的な不眠症または睡眠を引き起こすことはできていません。これらの行動が生存にとって重要であることを考えると、それらのメカニズムに一定量の明らかな冗長性があることは驚くべきことではありません。
覚醒
上記で述べたように、覚醒時脳波は、低電圧の速い活動を伴う活性化パターンによって特徴づけられます。これに対応して、PET研究は、安静時の覚醒時において、脳血流と代謝活動がNREM睡眠時よりも高いことを示しています。局所脳血流量(rCBF)の増加によって示されるように、最も活動的な脳領域には、注意、認知、記憶に関与することが知られている前頭前野、前帯状回、頭頂葉皮質、および楔前部が含まれます。
覚醒の維持は、口腔橋脳および中脳被蓋、ならびに後部視床下部からの入力で構成される**上行性網様体賦活系(ARAS)**に依存しています(図1.15-4)。動物において、これらの領域の電気刺激は、活性化された脳波パターンと行動覚醒を引き起こします。病変は昏睡状態を引き起こす可能性がありますが、脳幹網様体形成以外の構造も覚醒維持に関与していることを示唆するように、十分な時間があれば皮質活動の回復が起こることもあります。臨床的には、中脳、間脳、または後部視床下部の病変は、傾眠、昏迷、または昏睡を引き起こす可能性があります。
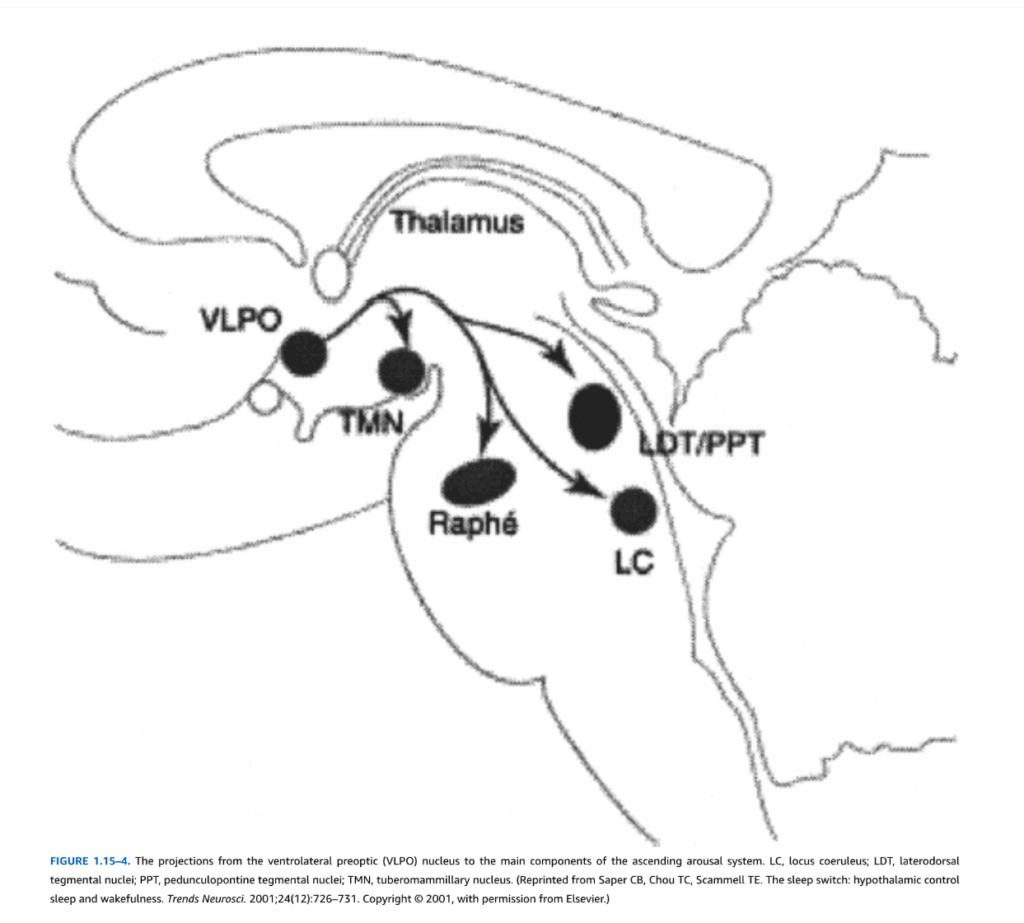
図1.15-4. 腹側外側視前野(VLPO)核から上行性覚醒系の主要な構成要素への投射。LC:青斑核、LDT:外側背側被蓋核、PPT:脚橋被蓋核、TMN:乳頭体核。(Saper CB, Chou TC, Scammell TE. The sleep switch: hypothalamic control sleep and wakefulness. Trends Neurosci. 2001;24(12):726-731. Copyright © 2001, Elsevierの許可を得て転載。)
覚醒には、複数の異なる構造と拡散性投射を持つ神経化学システムが関与していることが現在では知られています。これには、青斑核(LC)のノルアドレナリン作動性細胞、PPTおよびLDT核のコリン作動性細胞、後部視床下部のTMNのヒスタミン作動性細胞、視床下部外側部のオレキシン/ヒポクレチン細胞、およびCNS内のさまざまな構造のグルタミン酸作動性およびGABA作動性ニューロンが含まれます。ARASは、視床への入力だけでなく、視床下部および前脳基底部への投射を持つ視床外経路を介しても皮質活性化を生成します。
LCからのノルアドレナリン作動性細胞は、前脳と大脳皮質全体に直接投射し、覚醒中に最高の放電率を示します。これらの細胞は、NREM睡眠中には発火を減少させ、REM睡眠中には完全に発火を停止します。覚醒と睡眠は、行動、代謝、神経活動の観点だけでなく、遺伝子発現の観点でも異なると示唆する収斂的証拠があります。LC細胞は、覚醒と睡眠の間で脳で起こる遺伝子発現の変化の一部、特に覚醒中のシナプス増強に関与する可塑性関連遺伝子のアップレギュレーションの原因となります。LCは、長らく皮質に広範かつ均一な作用を持つ均質な細胞群と考えられてきましたが、最近の実験では、ラットの前頭前野の3つのサブ領域(内側前頭前野(mPFC)を含む)へのLC投射、またはこれらの前頭前野領域と一次運動野M1へのLC求心性線維の間の重複がほとんどないことがわかりました。さらに、M1を標的とするニューロンと比較して、mPFCに投射するLC細胞は自発的な発火率が3倍高く、興奮性が高いことから、意思決定に関わる前頭前野領域が、運動生成に関わる皮質領域よりもLCによってより強く調節されていることが示唆されます。
口腔橋領域からのコリン作動性細胞は、EEGが活性化しているとき(すなわち、覚醒時とREM睡眠時)には高い割合で発火しますが、NREM睡眠中には発火を減少させます。それらは視床、視床下部、および前脳基底部への入力を介して皮質活性化を促進します。さらに、基底核、無名質、ブローカ対角帯、および中隔を含む前脳基底部のコリン作動性細胞体は、ARASから入力を受け、その代わりとして皮質全体に興奮性入力を提供します。前脳基底部の刺激は、アセチルコリンの皮質放出、EEG活性化、および皮質ニューロンの脱分極をもたらします。さらに、前脳基底部のコリン作動性細胞も覚醒時とREM睡眠中に最大に発火し、NREM睡眠中に最小に発火します。マウスにおける光遺伝学実験は、橋のコリン作動性細胞が覚醒よりもREM睡眠を促進する一方で、前脳基底部のコリン作動性細胞は主にEEG活性化を促進する可能性があることを示唆しています。アルツハイマー病患者におけるコリン作動性細胞の喪失は、皮質EEGの徐波化と関連しています。三環系抗うつ薬やアトロピンなどの抗コリン作用を持つ薬物は、鎮静を引き起こし、REM睡眠を抑制し、SWAを増加させる可能性があります。しかし、コリン作動性アゴニスト(例:ニコチン)または抗コリンエステラーゼ阻害薬(例:ネオスチグミン)は覚醒を促進します。
後部視床下部のTMNにあるヒスタミン作動性ニューロンも、重要な覚醒促進機能を持っているようです。これは、抗ヒスタミン薬が通常鎮静作用をもたらすという事実から一部推測されます。この領域の覚醒にとっての重要性は、20世紀初頭にウイルス性脳炎の発生後、コンスタンティン・フォン・エコノモによって最初に特定されました。嗜眠性脳炎と呼ばれたその病気は、後部視床下部の病変と重度の傾眠状態を引き起こしました。ヒスタミン作動性TMNニューロンは皮質全体に投射し、ノルアドレナリン作動性細胞と同様に、覚醒中に最高の割合で発火し、睡眠中には抑制されます。しかし、橋のコリン作動性およびノルアドレナリン作動性細胞は、EEGが同期したNREM睡眠パターンから活性化された覚醒パターンに切り替わる数百ミリ秒、さらには数秒前に発火を増加させ、覚醒における因果関係を示唆する一方、ヒスタミン作動性ニューロンは覚醒開始時にのみ発火を増加させます。CNSへのヒスタミンの注入は覚醒を引き起こす一方、TMNの実験的病変は覚醒を減少させ、SWSとREM睡眠を増加させます。ヒスタミンの覚醒促進効果はH1受容体を介して媒介されます。ヒスタミンは、視床、皮質、前脳基底部、および橋被蓋におけるグルタミン酸作動性およびコリン作リン作動性伝達を増強することにより、覚醒を促進します。
ドーパミン作動性システムも覚醒を調節するようです。黒質とVTAのドーパミン含有ニューロンは、前頭皮質、前脳基底部、辺縁系構造を支配します。これらの細胞の平均発火率は、行動状態間で変化しません。しかし、シナプスドーパミン放出を誘発することが知られているそれらのバースト活動は、美味しい食べ物の摂取中やREM睡眠中にNREM睡眠中と比較して増加します。腹側中脳のドーパミン作動性細胞体を含む領域またはその上行経路の病変は、皮質活性化を維持しながら行動覚醒の喪失につながる可能性があります。ノルエピネフリン、ドーパミン、セロトニンを含むモノアミンの再取り込みを阻害するアンフェタミンやコカインなどの精神刺激薬は、覚醒を延長し、皮質活性化と行動覚醒の両方を増加させます。
ペプチドの**ヒポクレチン(オレキシン)**が覚醒維持に重要であることは、ナルコレプシーという疾患におけるその役割が発見されたことによって明確になりました。ヒポクレチンは、外側視床下部の細胞によって産生され、LC、PPTおよびLDT、VTA、前脳基底部、TMNを含むARASのすべての構成要素に興奮性入力を提供します。これらの細胞も、覚醒中、特に運動活動と探索行動に関連して最も活動的であり、NNREM睡眠とREM睡眠の両方ではほぼ完全に発火を停止し、覚醒時のEEG活性化の前に再び発火を開始します。ヒポクレチン細胞の光遺伝学刺激は、ノルアドレナリン作動性細胞の刺激ほど速くはありませんが、睡眠からの覚醒を促進します。動物モデルにおけるナルコレプシーは、ヒポクレチンシステムの欠損に関連しています。イヌのナルコレプシーは、ヒポクレチンタイプ2受容体遺伝子の変異によって引き起こされ、ヒポクレチンノックアウトマウスではナルコレプシー症状(睡眠発作と入眠時REM期)が発生します。マウス実験では、ヒポクレチン細胞のゆっくりとした進行性の除去が、ヒトのナルコレプシーの多くの側面を模倣することも示されています。睡眠断片化が最初の症状であり、カタプレキシーは全ヒポクレチン細胞の約95%が失われた後にのみ発生します。ヒトのナルコレプシー患者は、脳脊髄液中のヒポクレチン細胞および/またはタンパク質の喪失を示します。ヒポクレチン細胞の喪失は、ナルコレプシーと同様の睡眠障害を伴うことが多いパーキンソン病にも存在します。
背側縫線核からのセロトニン作動性細胞も皮質全体に広く投射します。セロトニン作動性ニューロンは、ノルアドレナリン作動性ニューロンと同様に、覚醒時には高いレベルで発火し、NREM睡眠時には低いレベルで発火し、REM睡眠中には沈黙します。しかし、ノルアドレナリン作動性ニューロンとは対照的に、セロトニン作動性ニューロンは顕著な刺激への定位中には不活性化され、その代わりに、運動、グルーミング、摂食などの反復的な運動活動中に活性化されます。選択的セロトニン再取り込み阻害薬(SSRI)は、睡眠時間を短縮し、睡眠中の覚醒を増加させる傾向があります。しかし、セロトニンの睡眠における役割は単純ではありません。セロトニンが睡眠誘発にも関与しているという証拠もあるからです(後述)。
他にもいくつかの神経伝達物質と神経調節物質が覚醒促進効果を持つようです。これらには、P物質、ニューロテンシン、エピネフリン、およびコルチコトロピン放出因子、VIP、甲状腺刺激ホルモン放出因子などの視床下部ペプチドが含まれ、これらはすべて覚醒レベルを増加させることができます。コルチゾールも覚醒を促進します。したがって、早朝覚醒を含むうつ病における睡眠障害は、部分的にHPA軸の関連する過活動に関連している可能性があります。
NREM睡眠
NREM睡眠の脳波は覚醒時のそれとは劇的に異なり、睡眠紡錘波、K複合波、徐波(0.5〜2 Hz)、徐波振動(主に0.7〜1 Hz)などの振動波形によって特徴づけられます。脳の活性化はNREM睡眠中、特にSWS中で一般的に減少し、SWSは全体的なCBFの減少によって特徴づけられます。PET画像研究は、脳幹、視床、前部視床下部、前脳基底部、大脳基底核、小脳、および前頭葉、頭頂葉、内側側頭皮質領域を含む多くの構造の不活性化を示しています。
NREM睡眠の制御は、覚醒と同様に、下部脳幹から視床、視床下部、および前脳に至る複数の構造を巻き込みます。動物における電気生理学的研究は、NREM睡眠の特徴的な波形を生成するさまざまな視床皮質振動の生成を明確にしました。睡眠振動の生成には、内在性細胞特性と、皮質-皮質、皮質-視床皮質、および視床-網様体ループによって媒介されるシナプス活動との相互作用が必要です。動物における研究は、覚醒から睡眠への移行直前に、ARASに属する拡散性投射を持つコリン作動性、ノルアドレナリン作動性、ヒスタミン作動性、ヒポクレチン作動性、およびグルタミン酸作動性神経調節システムの活動の変化が、視床および皮質ニューロンの発火モードの変化をもたらすことを示しています。視床皮質細胞は過分極し、網様体視床細胞は促進され、さらに視床皮質細胞を抑制します。その結果、感覚刺激は視床レベルでゲートされ、しばしば皮質に到達できません。視床皮質細胞の内在性電流の活性化による反跳発火は、局所的な視床網様体回路内で紡錘波周波数範囲の振動の出現につながります。局所的な視床紡錘波シーケンスは、皮質から発生する徐波振動によってグローバルに同期され、他の律動活動とグループ化されます。細胞内記録は、徐波振動が皮質ニューロンの短い過分極(数百ミリ秒持続)の結果であり、これは表面脳波では高振幅の負の波として見られることを示しています。ダウン状態としても知られる過分極相に続いて、アップ状態として知られるわずかに長い脱分極相があり、この間、皮質ニューロンの発火は視床ニューロンの紡錘波シーケンスを同調させ、同期させ、脳波で検出可能な紡錘波をもたらします。K複合波は、皮質脱分極相とその誘発された紡錘波で構成されます。徐波振動はまた、視床内および皮質内で生成されうる遅い(またはデルタ波と呼ばれる)波(0.5〜4.5 Hz)を組織化します。徐波振動の過分極相は、皮質ネットワーク内のシナプス活動の事実上の欠如と関連しています。対照的に、脱分極相中には、皮質細胞は覚醒時よりも高い割合で発火することがあります。さらに、脱分極相中には、視床皮質ニューロンはしばしばガンマ範囲(約40 Hz)で律動的に発火します。これは以前は、覚醒やREM睡眠などの活性化された状態に排他的に関連していると考えられていました。徐波振動は、事実上すべての皮質ニューロンで見られ、皮質-皮質接続によって皮質全体で同期されます。内在性電流も振動の開始と終了に関与しています。
睡眠誘発に対する視床下部構造の重要性は、前部視床下部の電気刺激が皮質におけるSWAの増加をもたらした初期の研究で認識されていました。逆に、後部視床下部ではなく前部視床下部に病変が生じた嗜眠性脳炎のいくつかの症例は、重度の不眠症によって特徴づけられました。数年前、前部視床下部の小部分であるVLPO領域が、睡眠スイッチとして注目されるようになりました。しかし、現在では、前部視床下部(例えば、正中視前核、MnPO)および前脳基底部に散在する他の多くのニューロンも、睡眠の開始と維持に主要な役割を果たすことが明らかになっています。これらのニューロンは睡眠中に発火する傾向があり、覚醒中には発火を停止します。MnPOニューロンは睡眠圧も追跡できます。これは、睡眠圧が高い最初の睡眠サイクルでは発火が高く、後のサイクルでは減少するためです。活動中には、多くのニューロンがGABAとペプチドであるガラニンを放出し、コリン作動性、ノルアドレナリン作動性、ヒスタミン作動性、ヒポクレチン作動性、セロトニン作動性細胞を含むほとんどの覚醒促進領域を抑制します。一方、後者の細胞群はいくつかの睡眠促進ニューロン群を抑制します。この相互抑制は、各状態がそれ自体を強化し、反対の状態を抑制するという点で、状態の安定性をもたらします。皮質GABA作動性細胞のサブセットも睡眠中に活動しており、睡眠圧を追跡している可能性があります。最後に、最近、延髄の傍顔面帯で睡眠促進性GABA作動性細胞が同定されました。この細胞群の刺激は、中脳と橋の接合部に位置する、グルタミン酸作動性投射を前脳基底部に送る腕傍核の覚醒促進ニューロンを抑制することにより、NREM睡眠を促進します。
NREM睡眠の神経化学に関しては、多くの物質が睡眠を調節しますが、特異的な睡眠因子は同定されていません。CNSの主要な抑制性神経伝達物質であるGABAは、視床皮質振動と、睡眠中に活動する細胞による覚醒中枢の抑制に関与しているようです。バルビツール酸系、ベンゾジアゼピン系、およびいくつかの新しい非ベンゾジアゼピン系催眠薬を含むほとんどの催眠薬は、GABA伝達を増強することによって作用します。しかし、脳幹と前脳基底部の多くのGABA作動性ニューロンは覚醒中に活動しています。
アデノシンは、睡眠における役割を持つことがますます認識されています。カフェインはその刺激効果をアデノシン受容体をブロックすることによって発揮すると考えられています。アデノシンは、アデノシン三リン酸(ATP)の分解産物であり、脳代謝の副産物であり、グルタミン酸作動性活動の増加の結果としてレベルが上昇します。それは長期の覚醒中に前脳基底部と大脳皮質に蓄積し、睡眠中に減少することから、睡眠のホメオスタシス信号を伝達する役割を果たす可能性があることを示唆しています。アデノシンは、橋と前脳基底部のコリン作動性ニューロン、ならびにヒポクレチンニューロンと皮質グルタミン酸作動性ニューロンを抑制します。対照的に、アデノシンはVLPOニューロンを興奮させ、その注入はNREM睡眠を促進します。
初期の研究では、背側縫線核のセロトニン作動性神経細胞の病変が不眠症につながることから、セロトニンもSWSに関与している可能性が示唆されました。しかし、最近の証拠は、初期の結果の一部が、病変によって誘発された体温調節の喪失によって混乱した可能性があり、それが体温を維持するための代償反応として運動活動の増加(したがって睡眠の減少)を引き起こしたことを示唆しています。セロトニン作動性ニューロンはNREM睡眠中には発火率を減少させ、REM睡眠中には完全に抑制されます。しかし、それらはコリン作動性ニューロンを抑制し、行動抑制を引き起こすため、直接的に睡眠の誘発や維持には関与しないかもしれないものの、入眠を促進するのに役立つ可能性を提起しています。セロトニンが睡眠と覚醒にどの程度寄与するかについては、依然として議論の余地があります。
ペプチドや神経調節物質を含む他の多くの物質が、睡眠促進作用を持つとされています。これらには、メラトニン、αMSH、GH放出因子、インスリン、CCK、ボンベシンなどのさまざまなホルモンが含まれます。インターロイキン-1、インターロイキン-6、TNFなどのサイトカイン。腸内細菌から産生されるムラミルペプチド。そして数十の他の物質が含まれます。これらの要因のほとんどは、その放出の通常のタイミング(例:夜間に通常放出されるメラトニンまたはGH放出因子)や生物の生理学的状態(例:感染症中に産生されるサイトカインは睡眠を促進する)と一致する穏やかな催眠作用および/または概日作用を持っています。
REM睡眠
REM睡眠は、活性化されたEEGと、神経活動およびCBFの増加によって特徴づけられます。機能画像技術を用いた最近の研究では、REM睡眠中には、覚醒時と比較して活性化が増加する脳領域と、活性化が減少する脳領域があることが示されています。中脳橋被蓋、視床、後部皮質領域、および辺縁系領域、特に扁桃体におけるREM睡眠生成に関与する領域は、REM睡眠中に高度に活性化されます。対照的に、前頭皮質と頭頂皮質は比較的非活性化されます。
REM睡眠は、特定の脳領域(橋と尾側中脳)がREM睡眠の主要な特徴を生成するために必要かつ十分であり、REM睡眠誘発のための最終的な共通経路を表すため、3つの状態の中でややユニークです。一連の切断研究により、REM睡眠はこれらの構造を含むCNSの部分でのみ保存されることが示されています。橋と尾側中脳内の両側性病変は、REM睡眠を完全に除去することができます。これらの発見はREM睡眠の脳幹メカニズムに焦点を当てる傾向を生み出しましたが、視前野を含むより吻側の脳領域も、REM睡眠の恒常性調節および夜間を通してのREMエピソードの組織化において重要です。
覚醒時と同様に、コリン作動性ニューロンはREM睡眠中にEEG活性化と海馬シータリズムを生成します。LDT/PPTニューロンは視床とコリン作動性前脳基底部のニューロンに入力を供給し、それが辺縁系と皮質を活性化させます。ホブソンとマッカーリーは、中脳橋接合部におけるコリン作動性ニューロンとアミン作動性ニューロンの相互作用に基づいて、NREM-REMサイクルを説明する相互作用仮説を提唱しました。PPTおよびLDT領域のコリン作動性および/またはコリン受容性REM-on細胞はREM睡眠中に活性化する一方、ノルアドレナリン作動性またはセロトニン作動性REM-off細胞はREM-on細胞を抑制します。アミン作動性細胞群は覚醒中に最も活動的であり、NREM睡眠中には活動がやや減少し、その間にコリン作動性活動が増加してREM睡眠をオンにします。REM睡眠エピソードは、REM-on細胞が自己抑制的であり、REM-off細胞に興奮性入力を提供するために終了します。最近の実験では、中脳橋被蓋のGABA作動性およびグルタミン酸作動性ニューロンもREM睡眠の制御に非常に重要であることが示されています。
REM睡眠の調節におけるコリン作動性-モノアミン作動性相互作用の役割は、さまざまな実験データによって裏付けられています。猫のLDT/PPT領域へのカルバコールなどのコリン作動性アゴニストの局所注入、またはヒトへのフィゾスチグミン、アレコリン、ピロカルピン、その他のコリン作動性アゴニストの全身投与は、REM睡眠エピソードの延長とREM睡眠までの潜時の短縮を引き起こします。REM睡眠のコリン作動性誘発は、主に橋網様体におけるM2ムスカリン受容体の活性化に関連しているようです。REM睡眠の促進は、脳幹モノアミン作動性活動の枯渇、例えば、トリプトファン欠乏食を与えられたヒト被験者におけるセロトニンの急性枯渇によっても生じます。ほとんどの抗うつ薬は、特にノルエピネフリンおよび/またはセロトニンのシナプス利用可能性を増加させる薬物は、REM睡眠を有意に減少させます。TCAsおよびMAOIsで見られる抗コリン作用もREM睡眠抑制に寄与する可能性があります。
REM睡眠中の筋アトニーは、LCの外側にある橋網様体または内側延髄の小さな病変によって除去できます。これらの病変は、この領域から脊髄運動ニューロンへの抑制性入力を排除します。脊髄運動ニューロンはGABAとグリシンの両方によって抑制され、NA、セロトニン、グルタミン酸によって興奮します。REM睡眠アトニーを担う脳幹回路には2つの主要な経路が含まれます。(1)青斑核下部領域から延髄網様体へのグルタミン酸作動性投射で、これはその後、運動ニューロンにGABA作動性およびグリシン作動性入力を送ります。(2)青斑核下部領域からGABA作動性介在ニューロンへのグルタミン酸作動性投射で、これはその後、運動ニューロンを抑制します。ノルアドレナリン作動性およびセロトニン作動性活動の減少に起因する脊髄運動ニューロンの弛緩も、REM睡眠中の筋緊張の抑制に寄与します。
いくつかの臨床状態は、アトニーがREM睡眠の状態からどのように分離されるかを示しています。ナルコレプシーでは、筋アトニーは覚醒中に発生する可能性があり、カタプレキシー(通常、感情的な刺激によって引き起こされる突然の筋緊張の喪失)または睡眠麻痺(REM睡眠から覚醒した直後にアトニーが短時間持続する状態)として現れます。対照的に、REM睡眠行動障害の患者はREM睡眠中にアトニーを発症せず、夢を演じることがあり、時には非常に激しい動作で自分自身やベッドパートナーを傷つけることもあります。TCAs、MAOIs、SSRIsなどのREM睡眠抑制性抗うつ薬は、一部の個人でREM睡眠行動障害を誘発する可能性があります。
動物では、橋、視床の外側膝状体、後頭皮質で順次発生する橋-膝状体-後頭(PGO)波は、REM期の開始直前、および眼球運動や筋けいれんを含むREM睡眠中の相性活動と同時に出現します。これらは腕傍領域のコリン作動性バースト細胞から発生し、縫線核のセロトニン作動性細胞によって抑制されます。REM睡眠中の眼球運動はPGO波と密接に関連しており、前庭ニューロンへの入力によって媒介され、それが眼球運動細胞を活性化します。PGO波は、覚醒中の驚愕反応でも観察されることから、定位反応の内部表現と考えられています。ヒトでは、PGO様電位がREM睡眠前およびREM睡眠中に橋と視床下核で記録されています。
REM睡眠中に前脳構造の活動が劇的に増加することを示す画像データに加えて、以前の解剖学的研究もREM睡眠調節における前脳の関与を示唆しています。前脳と橋を分離する切断研究では、切断部位より尾側でNREM-REMサイクリングが中断されます。扁桃体はREM生成脳幹領域と相互接続を持っており、扁桃体への電気刺激またはカルバコールの注入はREM睡眠を増加させることができます。うつ病では辺縁系構造の異常な活性化が起こり、REM睡眠に関連する変化に寄与している可能性があります。
睡眠の概日リズムと恒常性調節
NREM睡眠とREM睡眠の両方の睡眠調節には、少なくとも2つの主要な要素、すなわち概日要素と恒常性要素が関与しています。概日要素は、時間帯に結びついた睡眠傾向の変化を担っており、明らかな適応上の利点があります。恒常性要素は、覚醒時間が長くなるほど睡眠傾向が増大するという事実を指し、その機能はいまだ謎に包まれている睡眠の本質的な側面を表しています。
二過程モデル
概日過程と恒常性過程を仮定するいくつかの睡眠調節モデルが提案され、大量のデータに基づいて検証されています。最も影響力のあるモデルの1つは、アレクサンダー・A・ボルベーリと同僚によって開発された二過程モデルで、恒常性過程Sと概日過程Cの相互作用に基づいて睡眠傾向を予測します。過程Sは、覚醒によって引き起こされる睡眠圧の増加に応答して日中に蓄積し、睡眠中に減少します。しかし、睡眠傾向に関する概日過程Cは、夜の後半にピークに達します。したがって、夜間の入眠は主に過程Sによって駆動され、過程Cは夜の後半を通して睡眠を維持します。人間が夜中に短い覚醒期を持つことは一般的であり、これは過程Cが最大値に達する前に過程Sが低下することによる全体的な睡眠駆動の減少に関連している可能性があります。同様に、午後の昼寝の傾向は、夕方から夜の早い時間に過程Cが最低値に達する前に、日中に過程Sが増加することによって引き起こされる可能性があります。日中の昼寝は産業社会では比較的珍しくなっていますが、ほとんどの人は午後に眠気が増す期間を経験します。この午後の「落ち込み」は、すでにいくらか睡眠不足である個人、鎮静作用のある薬を服用している個人、および/または睡眠時無呼吸症候群などの過度の日中眠気を引き起こす睡眠障害を抱える個人において、有意な日中眠気を引き起こす可能性があります。
概日リズム
ヒトや他の哺乳類において、概日リズムを生成する主要なペースメーカーは視床下部のSCN(視交叉上核)に存在します。SCNは、過程Cによって測定される睡眠傾向を含むいくつかの神経内分泌および行動パラメータを調節し、生物の状態を24時間周期の光-暗サイクルと協調させます。概日睡眠調節は、内因性の体温リズムと強く関連しています。主観的な眠気、睡眠傾向、およびREM睡眠傾向はすべて、核心体温の最低点(最低値)で最大となり、通常は覚醒する数時間前の非常に早朝です。睡眠傾向は、夜間の体温曲線の下降期に大きくなります。朝の時間帯に核心体温が上昇期に入ると、人々は目覚める傾向があります。覚醒レベル、パフォーマンス、および認知機能は、日中の体温の上昇と関連して最大となります。
SCNに病変のある動物では、睡眠はもはや1つの主要なエピソードに集中せず、24時間サイクル全体に分散します。それでも、これらの動物では、以前の覚醒の関数として睡眠傾向が増加します。したがって、過程Cと過程Sは通常協力し、有意に相互作用しますが、かなりの程度まで分離することができます。ヒトにおける睡眠の概日調節を特に調査するために、いくつかの手法が使用されてきました。恒常的ルーチンプロトコルは、概日時計以外の要因が行動状態に与える影響を最小限に抑えるように設計されました。このプロトコルでは、被験者は通常24時間以上、薄暗い部屋のベッドに座って覚醒状態に保たれます。この技術は、外部の合図がない状態でのさまざまな概日出力の持続性を実証することに成功しましたが、睡眠不足を強制する必要があるため、実験の期間が制限されます。時間隔離では、被験者は時間的合図のない環境に数週間から数ヶ月間置かれます。睡眠の概日リズムは持続しますが、連続する就寝時刻によって定義される「日長」は25時間近くになります。これらの結果から、ヒトの概日時計の内因性周期は約25時間であり、光-暗サイクルがそれを24時間周期に同調させる役割を果たすという結論が導き出されました。
概日ペースメーカーの内因性周期を正確に決定するには、概日出力と睡眠または長期の睡眠不足の影響を区別する必要があります。しかし、上記で議論した2つのプロトコルでは、どちらもこれを満足に達成できません。1938年にナサニエル・クライットマンによって最初に開発された強制脱同期プロトコルは、被験者を時間的に隔離された状態で28時間の「日」で生活させるというものです。ヒトの概日時計を28時間の周期に同調させることは不可能であるため、十分な時間が経過すると、睡眠期間は概日サイクルのすべての相で発生します。したがって、ヒトの睡眠組織に対する概日および恒常性からの影響を区別することができます。強制脱同期研究のデータは、ヒトの内因性概日周期が実際には24時間に近い(24.1〜24.2時間)ことを示唆しています。さらに、SWSは主に恒常性睡眠駆動によって調節されるのに対し、REM睡眠は主に概日時計によって調節されることを示しています。しかし、REM睡眠も恒常性によって調節されており、その段階の睡眠が妨げられた場合にREM睡眠を開始しようとする試みが増加することによって示されます。
最近の研究では、概日時刻管理がより複雑であることが示されています。SCNの中枢ペースメーカーに加えて、多くの細胞や臓器に末梢時計が存在します。これらの末梢時計は、局所的な概日振動を伴い、複数のホルモンの分泌調節において重要である可能性が高く、中枢SCN発振器と光-暗サイクルとの不整合、およびSCNと末梢発振器との間の内部脱同期の両方が、代謝および内分泌疾患、ならびに多くの精神疾患に寄与する可能性があります。
睡眠の恒常性調節と睡眠不足の影響
ヒト、および睡眠が注意深く研究されてきた事実上すべての動物種において、睡眠不足は眠気を引き起こし、やがて圧倒的な睡眠圧の増加をもたらします。睡眠不足の後には「睡眠リバウンド」、すなわち、睡眠の持続時間や強度における代償的な増加が起こります。睡眠不足の後、睡眠潜時は短縮され、睡眠効率は向上します。つまり、睡眠が断片化されにくくなります。NREM睡眠の量(特にヒトのステージN3)は増加し、皮質脳波における徐波の優位性を測定するSWAなどのNREM睡眠強度のマーカーも増加します。REM睡眠量も増加しますが、これがREM睡眠の「強度」にも当てはまるかどうかは不明です。このような精巧な恒常性調節は、睡眠の開始が延期された場合に、脳内で通常のレベルを超えて蓄積する明確な生理学的、生化学的、または分子プロセスが存在しなければならないことを示す最も重要な兆候の1つです。
ヒトにおける完全な睡眠不足の最も顕著な影響は認知機能障害であり、これは驚くべき実際的な結果をもたらします。アメリカ人の35%から40%が、入眠困難や日中の眠気をもたらす慢性的な睡眠障害に苦しんでいると推定されています。毎年、治療の直接費用だけでなく、欠勤、生産性の低下、事故、罹患率と死亡率の増加といった間接費用を含め、睡眠問題に起因する費用は、米国だけで数千億ドルに上ります。さらに、国家幹線道路交通安全局は、2017年に眠気運転が少なくとも91,000件の自動車事故の原因となり、警察の報告によると50,000人の負傷者と800人の死亡者を出したと報告しましたが、疾病管理予防センターの分析によると、眠気運転による年間の実際の死亡者数は約6,000人である可能性が高いとされています。睡眠不足の人は、刺激への反応に時間がかかる傾向があり、特に単調で認知的要求の低い作業の場合に顕著です。しかし、睡眠不足は単に覚醒度の低下以上のものを引き起こします。論理的推論、複雑な文の符号化、復号化、解析。複雑な引き算課題。多数の目標に同時に焦点を当てる能力を伴うような発散的思考を必要とする課題など、より高次の認知機能を必要とする課題は、たった一晩の睡眠不足でもすべて著しく影響を受けます。目標志向的な活動を含むような持続的注意を必要とする課題も、ほんの数時間の睡眠不足でも損なわれる可能性があります。したがって、睡眠不足は注意欠陥、短期記憶の低下、言語障害、固執、柔軟性のない思考を引き起こします。これらの欠陥は、睡眠不足の被験者が自分の認知機能障害の重症度を過小評価する理由を説明でき、しばしば悲劇的な結果をもたらします。人々が睡眠不足による障害を過小評価するもう一つの理由は、睡眠不足がパフォーマンス能力を完全に排除するわけではなく、むしろパフォーマンスを一貫性のない、信頼できないものにするためです。したがって、眠い運転者は、覚醒状態の急速な変化と覚醒中のマイクロスリープの突然の侵入により、緊急事態に通常通り反応するか、まったく反応しないかのどちらかになります。同様に、被験者は3〜4日間の睡眠不足の後でも、短いテストでは一時的にベースラインレベルでパフォーマンスできる場合があります。しかし、同じ被験者は、持続的注意を必要とするタスクでは非常に低いパフォーマンスを示します。新しい証拠は、数時間の睡眠だけでなく、数日間の正常な睡眠-覚醒パターンが、睡眠不足後の認知パフォーマンスを正常化するために必要であることを示唆しています。
認知機能障害は、完全な睡眠不足の結果だけではありません。認知パフォーマンスは、慢性的な痛み、睡眠時無呼吸症候群、その他の睡眠障害の患者に見られるような睡眠制限(一晩あたり6時間以下)が数日間続く場合や、慢性的な睡眠の途切れによっても影響を受けます。National Sleep Foundationが2020年に実施した、米国在住の18歳以上の住民を対象とした「Sleep in America」世論調査によると、44%が週に2〜4日間眠気を感じると報告し、28%が週に5〜7日間眠気を感じると報告しました。女性は平均して週に3.4日眠気を感じると報告したのに対し、男性は平均して週に2.7日眠気を感じると報告しました。回答者は、眠気の原因を十分に眠れていないこと(55%)または睡眠時間が足りないこと(44%)のいずれかに起因するとしました。眠気を感じると報告した人たちは、気分、注意、仕事のパフォーマンスへの影響を報告する可能性がはるかに高かったのです。National Health Interview Surveyから得られた睡眠時間の最近の分析では、睡眠時間が2013年から2017年にかけて減少しており、ヒスパニック系と非ヒスパニック系の黒人の間でより顕著であることが判明しました。全体として、成人の32.9%が一晩あたり6時間未満の睡眠を報告しました。睡眠機会の不足または睡眠の質の低下による慢性的な睡眠制限が、認知パフォーマンスの客観的な測定に影響を与えるのに十分かどうかは不明ですが、障害とパフォーマンスの低下を示す睡眠制限研究のデータがあることを考えると、確かに懸念されます。総睡眠時間やSWSの持続時間、NREM睡眠中の皮質脳波におけるSWAの量など、ほとんどすべての睡眠測定値は、異なる被験者間で大きなばらつきを示すものの、同じ個人では一晩から別の一晩にかけて高い一貫性を示すことが明らかになりつつあります。睡眠不足による認知機能障害の程度も、被験者間で大きく異なります。収斂する証拠は、睡眠不足によって引き起こされる認知機能障害における個人の違いが時間的に安定しており、特性のようであることを示唆しており、遺伝的基盤を示唆しています。
脳と末梢組織は睡眠不足に異なる反応を示します。睡眠不足の動物と同様に、睡眠不足のヒト被験者や、ベースラインの夜と比較して睡眠の質が悪い夜の正常な睡眠者では、末梢代謝率が増加します。この増加した率は、一般的に不眠症の人でも正常な睡眠者と比較して見られます。動物とヒトの両方で、グルコース代謝は覚醒時の方がNREM睡眠時よりも多くの脳領域で高くなります。1日睡眠不足の後でも、特定のタスクに従事している場合、選択的な脳領域は代謝的に活性化され続けることができます。しかし、全体的な脳代謝率は増加せず、実際には視床や中脳などの領域では正常な覚醒時の値に比べて減少します。したがって、睡眠不足中に末梢代謝率は持続的に増加する一方で、脳代謝率は増加しません。これは、脳が長期間にわたって高エネルギー代謝を維持できない可能性を示しているのかもしれません。
認知機能障害を引き起こすことに加えて、ヒトの睡眠不足は、全体的な健康に影響を与えるさまざまな生理学的システムにも影響を与える可能性があります。睡眠不足は宿主防御システムに影響を与える可能性があると示唆されています。例えば、睡眠不足のラットは菌血症の発生率が増加します。睡眠不足はまた、耐糖能の低下、交感神経系(SNS)活動の増加、およびコルチゾールレベルの上昇を引き起こすことが示されており、これは糖尿病、高血圧、肥満などの疾患に寄与する可能性があることを示唆しています。不眠症の患者は心疾患を含む健康問題の発生率が増加しており、睡眠時間の短縮と健康転帰との間の因果関係の可能性をさらに示唆しています。ヒトと動物の両方で行われたいくつかの研究は、長期的な睡眠障害と寿命の短縮を関連付けています。他の研究では、実際には短時間睡眠と不眠症は、併存疾患とは異なるリスクがほとんどないことを示唆しています。睡眠時間と死亡リスクとの間にU字型の関連(すなわち、短時間睡眠と長時間睡眠の両方が死亡率の増加と関連している)があるかどうかは不明であり、メタアナリシスは相反する結論に達しています。2019年と2020年に発表された最近のメタアナリシスは、長時間睡眠が男性と女性の全死因死亡リスクの増加と関連していると結論付けましたが、短時間睡眠は男性のみで、かつ分析の1つでのみ全死因死亡と有意に関連しているとされました。しかし、不眠症は睡眠不足と同義ではなく、必ずしも睡眠時間の短縮を示すものではないことに注意することが重要です。
ヒトにおける長期的な睡眠不足の最も極端なケースは、致死性家族性不眠症(FFI)の患者に観察されます。これは、ほぼ完全な睡眠喪失を特徴とし、さまざまな神経学的症状と、選択された脳領域における海綿状変性を伴うプリオン病です。この病気は、数ヶ月から2〜3年後に例外なく死に至ります。短い臨床経過(1年未満で死亡)のFFIでは、不眠症が発症時からほぼ完全であり、海綿状変性は主に視床と下オリーブ核に限局し、大脳皮質には及びません。より長い臨床経過(2〜3年で死亡)のFFI症例では、不眠症はより徐々に発症し、ほとんどの皮質領域で海綿状変性が見られます。FFIのいくつかの臨床的側面はびまん性海綿状変性に起因すると考えられますが、睡眠喪失自体が疾患の進行、特に短期間のFFIにおいて重要な役割を果たしている可能性が高いです。実際、臨床経過の重症度は、プリオンタンパク質の蓄積よりも不眠症の重症度と相関しています。
ヒトでは、睡眠不足が3〜4日以上強制されることはありません(記録は11日ですが、被験者は1人だけです)。そのため、非常に長期的な睡眠不足による他のより重篤な影響があるかどうかを判断することは不可能です。動物では、強制的な運動からアンフェタミンによる薬理学的刺激まで、いくつかの技術が使用されており、長期的な睡眠不足が可能です。使用される方法に関係なく、重要な一貫した発見は、脳の電気刺激のような極端な操作であっても、最初の24時間後には完全かつ中断のない覚醒を強制できないことです。長期的な睡眠不足の試みでも、1日を超えて完全かつ中断のない覚醒を強制することはできません。明らかに、睡眠圧は、動物でもヒトでも、覚醒を維持するために使用されるどんな方法をも克服します。この圧力はさまざまな形で現れます。最も明白な方法は「マイクロスリープ」であり、覚醒時の脳波が明らかに睡眠パターンに切り替わる数秒間続く短い中断です。マイクロスリープは、例えば運転中に車の制御を失うなど、パフォーマンスに明らかな障害を引き起こす可能性があります。あまり明白ではない変化は、低周波数帯域(デルタ/シータ活動)の増加を伴う全体的な「脳波の緩徐化」にあります。この変化は、脳波の定量的分析によって検出できますが、単純な視覚観察では検出できませんが、認知タスクのパフォーマンスには依然として影響を与える可能性があります。最後に、さらに微妙な変化は、最近特定された「局所睡眠」と呼ばれる現象です。この現象は、皮質内記録を用いたげっ歯類で最初に記述され、長期覚醒中にラットが動き回り、正常な覚醒活性化脳波を示す一方で、一部の皮質ニューロンが「オフライン」になり、発火を停止し、通常NREM睡眠中にのみ存在するような膜の過分極と神経細胞の沈黙のダウン状態を示すという事実を指します。これらのダウン状態は局所的かつ短期間であるため、侵襲的な皮質内記録でしか検出できません。しかし、ヒトでは、この現象の有用な脳波相関は、高密度脳波(hd-EEG、256チャンネル)を使用して識別できる局所的なデルタ/シータ波(2〜6 Hz)の発生です。ヒトの被験者が24時間覚醒し、集中的な認知タスク学習に従事する場合、hd-EEGは、これらのタスクに最も関与する皮質領域で、デルタ/シータ波の局所的な増加を検出できます。睡眠不足後の回復睡眠中には、同じ領域でSWAの局所的な増加が見られます。
動物における最も包括的な睡眠不足研究シリーズは、ディスク・オーバー・ウォーター(DOW)装置を用いて実施されており、これにより数日、さらには数週間の睡眠を妨げることができます。この方法は、睡眠不足のラットに慢性的な睡眠不足を強制するために最小限の刺激を使用し、同時に同じ刺激を対照ラットにも適用しますが、その睡眠を厳しく制限することはありません。DOWを用いたラットの睡眠不足は、睡眠喪失から2〜3週間後に必ず死に至る劇的な生理学的変化を引き起こします。最初の1〜2日以内に、ラットは食物摂取量、エネルギー消費量、心拍数の増加を特徴とする症候群を発症し、続いて体重の減少と体温および脳温の低下が見られます。睡眠不足症候群とその致死的結果は、選択的REM睡眠不足後にも観察されていますが、睡眠喪失に伴う病状が出現するまでに時間がかかり、生存期間も長く(2〜3週間ではなく4〜5週間)、体温および脳温の有意な低下は見られません。一連の長期にわたる研究にもかかわらず、DOW睡眠不足症候群は完全に説明されておらず、なぜ動物が睡眠不足で死に至るのかも不明です。しかし、DOWによって引き起こされる症候群は独特ではなく、異なる動物種で用いられた他の慢性睡眠不足の方法も同様の効果を生み出していることは明らかです。また、イヌ、ウサギ、そして程度は低いですがネコにおいても、数日間の睡眠不足は食物摂取量と心拍数の増加、体重減少、そして最終的には死を引き起こします。たとえショウジョウバエでも、数日間睡眠を妨げられると、睡眠不足で死に至ります。これらの発見は、睡眠に少なくとも1つの潜在的に重要な機能があり、この機能が異なる動物種間で保存されていることを示唆しています。
夢
長い間、睡眠は意識の消滅と見なされてきましたが、目覚めたときに時折覚えている夢を除いて、そうでした。睡眠中に脳が静止しているという古い概念が否定されたように、睡眠中の認知の死という神話も否定されました。ほとんどの被験者は、起こされて心に浮かんだことを報告するように求められると、ほとんどの場合、何らかの精神活動を報告します。多くの場合、そのような精神活動は夢を構成しており、夢は睡眠中に発生する複雑で時間的に展開する幻覚エピソードとして定義できます。
夢と通常の覚醒意識の関係
夢の幻覚は、通常、覚醒時のイメージよりも鮮明です。イメージは主に視覚的ですが、すべての感覚様式が表現されることがあり、飛ぶことなどの不可能な運動活動が発生することもあります。話声や会話を聞くことは非常に頻繁です。夢は一般的に妄想的であり、夢の中の出来事や登場人物は現実のものと受け止められます。また、作話的であり、夢は物語を作り上げることを含みます。しばしば見当識障害があり、空間(夢の中で自分がどこにいるか)、時間(個人的な歴史の中で夢がいつ起きているか)、および夢の登場人物の性別、年齢、アイデンティティに関する混乱があります。しかし、夢はリアルタイムで進行しているようで、夢の主観的な持続時間、夢の報告の長さ、および夢を再現するのにかかる時間との間には良好な相関関係があります。多くの夢では、特に恐怖と不安といった感情が顕著です。自己はほぼ常に夢の中心にありますが、反射的意識はいくらか低下しています。夢は単一志向的であると記述されており、覚醒を特徴づける一次的意識と反射的意識の交代を欠いています。自己監視、方向づけられた思考、および意志が減少するため、状況を分析したり、前提を疑ったり、適切な決定を下したりすることができなくなります。新しい記憶を形成する能力は劇的に障害されており(夢健忘)、これは部分的にノルアドレナリン作動性活動の低下によるものです。当然のことながら、精神科医は夢の認知のいくつかの側面と特定の精神病症状、およびせん妄との類似点を指摘しています。
これらの精神病理学的特徴にもかかわらず、夢の意識に関するおそらく最も重要な事実は、それが覚醒意識と驚くほど類似していることです。「現実」の世界から切り離された睡眠中の脳は、想像上の世界、「仮想現実」を生成することができ、それは現実の世界とかなり類似しており、実際に同じくらい現実として体験されます。覚醒状態の視点から夢を考えると、人々はしばしば一部の夢、特に朝の夢の奇妙さに興味をそそられます。奇妙な夢は記憶に残りやすいかもしれませんが、夜を通して系統的に収集すると、夢ははるかに平凡であり、覚醒生活の忠実なレプリカです。原則として、人は想像できることしか夢に見ることはできませんが、外部信号からの競合が減少するためか、夢ははるかに鮮明である可能性があります。
覚醒中に人々の脳に影響を与える状態は、彼らの夢にも及びます。例えば、盲目の人が視覚的なイメージを構築できる場合、彼らは視覚的な夢を見ます。そうでなければ見ません。脳卒中が覚醒中に色を認識する能力を奪うと、視覚的なイメージだけでなく、夢もアクロマートプシアになります。精神的なイメージを形成する能力と同様に、夢は一次視覚野よりも高次の皮質領域の完全性に最も強く依存しているようです。同様に、片麻痺患者や失語症患者の夢では、体性感覚/運動および聴覚言語/運動イメージが正常です。覚醒と夢の認知能力の密接な関連のもう一つの例は、子供の夢の研究から来ています。夢の報告は、4〜5歳になるまではまれで非常に短いです。これは、その年齢以下の子供たちの感情的な内容の高い複雑な物語を想像し、語る能力が限られていることと一致しています。最後に、覚醒時の気分と夢の気分、想像力、および性格の間には良好な相関関係があります。精神医学集団、特にうつ病とPTSDにおける夢の内容の研究は、一般的に目立つものではありませんでした。しかし、いくつかの興味深い発見が報告されており、例えば、夢の内容の変化が障害の経過の変化を予測する可能性があるというものです。
夢と睡眠段階
当初は、完全な夢はほぼ排他的にREM睡眠中に誘発されると示唆されていました。しかし、その後の研究では、夢のような精神活動がNREM睡眠中、特に睡眠開始時と夜の最後の部分(NREM睡眠がそれほど深くはない時間帯)にも誘発されることが決定的に示されています。ただし、被験者の最大15%は、NREM睡眠から覚醒したときに精神的な内容をまったく思い出せません。さらに、典型的なREM夢の報告は、NREM夢の報告よりも平均してはるかに長く(最大7倍)、容易に区別できます。夢の報告が長い場合、これは実際の夢の持続時間が長いことを示唆しますが、経験した場面の密度または奇妙さが増加したことによる場合もあります。REM夢が長いだけでなく、質的にも異なり(NREM夢よりも奇妙で、幻覚的で、妄想的で、物語的で、感情的であるか)は、依然として議論の余地があります。NREM夢が、NREM睡眠中のREM特徴の侵入による「潜在的な」REM夢であるという示唆も同様です。しかし、典型的な夢、および悪夢が、NREM睡眠の特定の段階で経験されうることは間違いありません。幻覚的-妄想的な性質を持つ夢のような精神活動は、特に感覚入力が減少した状態(白昼夢)では、静かな覚醒時にも発生する可能性があります。逆に、非幻覚的で非妄想的な、覚醒時のような精神活動が、入眠時に時折報告されます。混合状態の良い例は明晰夢であり、夢を見ている人が夢を見ていることを認識しており、ある程度夢の進行を制御できる状態です。
夢の認知状態とREM睡眠の生理学的状態を最初に同等と見なすことは、REM睡眠の脳波が意識的な覚醒時の脳波と著しく類似しており、NREM睡眠の脳波との違いが同等であることによって促進されました。覚醒時とREM睡眠の活性化された(低電圧、高周波)脳波が鮮明な意識体験をサポートする一方、NREM睡眠の非活性化された(高電圧、低周波)脳波はそうではないと推論するのは自然なことでした。入眠時の頻繁な夢の報告は、ステージN1睡眠の混合脳波と依然として両立できる一方で、脳波の徐波によって特徴づけられるNREM段階中に、より短いとはいえ夢のような体験が存在することは逆説的に思えました。この逆説は、NREM睡眠の徐波振動中の神経興奮性の時間経過を考慮することで解決できるかもしれません。現在では、徐波振動の脱分極相中には、神経活動が覚醒時やREM睡眠時と同じくらい激しく、ニューロンが非常に興奮性であることが知られています。しかし、睡眠中には、脱分極相は過分極相によって中断され、その間、大脳皮質全体で神経活動が停止し、ニューロンの興奮性がはるかに低下します。脱分極期間(アップ状態)の後に過分極(ダウン状態)が必然的に発生するのはNREM睡眠中のみであり、皮質回路の独特な二安定性を反映しています。この二安定性は、夜の早い時間のSWS中に特に強く、脱分極相は過分極相に続く前に1秒程度しか持続しないかもしれません。そして、夜遅くのステージN2睡眠中には、より長い脱分極期間が可能になり、あまり顕著ではなくなります。したがって、夢のような体験が脱分極相中に発生する場合、夜の早い時間のSWS中には短く貧弱であり、夜遅くになるにつれて徐々に長く豊かになります。全体として、睡眠中の意識体験の可能性は、刻々と変化する皮質活性化に関連していると思われ、活性化は、皮質ニューロンが入力信号に豊かで分化した方法で応答する準備状態として理解されるべきです。
夢意識の神経相関
最近の病変研究と画像研究は、夢意識と覚醒意識の間の特徴的な違いの脳相関に関する新しい洞察を提供しています。最も明白な違いは、夢意識が外部刺激によってほとんど影響を受けず、ごくわずかな刺激しか夢の物語に組み込まれないことです。NREM睡眠中には、部分的な機能的切断が視床抑制によって媒介されます。REM睡眠中には、外部刺激は視床のゲートをより容易に通過して一次皮質領域に到達しますが、脳がそれらに注意を払っていないかのように、高次の皮質領域には影響を与えないようです。夢の幻覚的性質は、明らかにそのような感覚的切断によって促進されます。夢の視覚幻覚は、実際には高次視覚野の活動増加と関連しており、PET研究によって示されているように、一次視覚野の活動は低下しています。夢の特徴である強烈な視覚体験と場面の変化が、主に脳幹からの相性信号、視覚イメージに関与する領域、またはその両方によって引き起こされるのかは未解決の問題です。
夢意識と覚醒意識のもう一つの関連する違いは、自己と自分の経験を反省する能力、特に夢の経験の真実味を判断する能力に関することです。画像研究は、意志的制御と自己監視に関与する脳領域である**背外側前頭前野(DLPFC)**が、覚醒時と比較して睡眠中には活動が低いことを示しています。DLPFCの活動低下は、夢で観察される見当識障害と方向性思考およびワーキングメモリの減少にも寄与し、夢健忘に貢献する可能性があります。最近のエピソード記憶は夢には目立って存在せず、夢の記憶は、目覚めて夢を反芻しない限り、驚くほど不安定です。
夢はまた、特に恐怖と不安といった高度な感情的関与によって特徴づけられます。これに対応して、画像研究では、REM睡眠中に扁桃体、前帯状回、島皮質、内側眼窩前頭皮質などの辺縁系および傍辺縁系構造の著しい活性化が明らかになっています。全体として、睡眠中の認知活動は、いくつかの精神疾患に関与する機能不全が、健康な被験者の精神機能にどの程度影響を与えるかを示す強力な指標となります。実際、ホブソンは、夢の認知のほとんどの側面は、脳の活性化、入力源(外部または内部)、神経調節の3つのプロセスのレベルを睡眠-覚醒連続体全体で考慮することによって説明できると示唆しています。
最近では、高密度脳波(hd-EEG)も睡眠中の意識体験の神経相関を特徴付けるために使用されています。これらの実験では、hd-EEGで記録された睡眠中の被験者が、意識があったかどうかを事後的に報告する課題なし、状態内パラダイムが使用されました。NREM睡眠とREM睡眠の両方における意識の神経相関は、2つの局所的なホットスポットにマッピングされることがわかりました。(1)低周波脳波活動の減少を特徴とする頭頂-後頭ホットスポットと、(2)高周波脳波活動の増加を特徴とする前頭ホットスポットです。前頭ホットスポットは非常に思考のような経験に関与し、頭頂-後頭ホットスポットは非常に知覚のような経験に関与していることもわかりました。これは、睡眠中の意識の神経相関が単一のホットスポットに限定され、被験者の夢の性質に応じて位置が変化する可能性があることを示唆しています。これらの研究はまた、被験者の夢の特定のコンテンツ(顔や空間設定など)が、覚醒時の同じコンテンツの知覚中に活動する皮質領域と密接に一致する特定の皮質領域における高周波脳波活動の増加と関連していることを示しています。これらの結果は、夢の報告が睡眠中に起こる意識体験を反映しており、単に覚醒時に生成される作話ではないという強力な証拠を提供します。
はい、承知いたしました。夢の理論と睡眠の機能に関する文章を日本語に翻訳します。
夢の理論
フロイトは、自身の最も重要な著作と考える『夢判断』の中で、夢は偽装された願望の充足を提供し、適切に解釈されれば、精神生活の最も深遠な決定要因、すなわち「無意識への王道」となる本質的な手がかりを提供すると提唱しました。しかし、夢の体系的な調査は、この考えをあまり支持していません。
ホブソンとマッカーリーは、脳幹におけるレム睡眠生成メカニズムに関する神経生理学的研究に基づいて、根本的に異なる提案をしました。彼らの活性化-統合仮説によれば、夢は、音楽的でない指がピアノの鍵盤上をさまようことで音楽が生み出されるように、上位脳幹による視床皮質ネットワークのランダムな活性化を前脳が理解しようとする試みであるとされます。一方、フォークスらが夢の報告を包括的に評価して行った別の提案では、夢は精神力学的な無意識ではなく、覚醒時の認知と同様に、夢を見ている人の認知発達、能力、様式を明らかにすると述べています。この見解は、夢とレム睡眠の一対一の混同を注意深く避けています。
これに沿って、ソルムスは最近、神経心理学的証拠を再検討し、夢を見る能力は上位脳幹ではなく前脳領域に依存することを示しました。100件以上の夢の中止事例において、原因となる病変は、頭頂側頭後頭接合部(片側または両側)か、眼窩内側前頭前野(両側)近くの白質でした。夢の中止にもかかわらず、レム睡眠はほとんど常に保たれていました。頭頂側頭後頭接合部は、心的イメージ、空間認知(右側)、記号認知(左側)に重要であり、これらはすべて夢の中心的な特徴です。夢に必要とされる腹内側前頭前野の深部白質は、改良された前頭葉白質切断術の標的となる脳領域と同じです。この病変は統合失調症の陽性症状を軽減しますが、無気力状態を引き起こします。アンフェタミンなどの興奮剤や、3,4-ジヒドロキシ-L-フェニルアラニン(L-DOPA)によるこれらの回路の化学的活性化は、幻覚や妄想を引き起こす可能性があり、夢は中脳辺縁系および中脳皮質ドパミン作動系*の活性化によって促進される可能性を示唆しています。
睡眠の機能
睡眠の機能は依然として謎に包まれています。睡眠は概日リズムにおける休息-活動サイクルから進化した可能性があり、それゆえデフォルト状態を表しているのかもしれません。しかし、睡眠がより根本的な機能を持つ可能性が高いです。そうでなければ、なぜ動物は環境中の潜在的な危険を監視できない、覚醒閾値が上昇する長時間の静止状態に入るのでしょうか?睡眠は普遍的であるようです。これまでに研究されたすべての動物種、例えばショウジョウバエやミツバチのような無脊椎動物から鳥類や哺乳類までが睡眠をとりますが、哺乳類と鳥類は一般的にノンレム睡眠とレム睡眠の交互のサイクルを含む、より精巧な睡眠サイクルを示します。体の睡眠の必要性をなくしたり減らしたりすることは容易ではないようです。特定のイルカやネズミイルカのように、飛行中や遊泳中に継続的な警戒が必要な一部の海洋哺乳類は、睡眠を完全に排除する代わりに、交互に片側脳睡眠を発達させています。研究されたすべての種における睡眠不足は、眠気として現れる睡眠圧の増加につながり、これは急速に抵抗しがたいものになります。睡眠圧は、認知機能の低下をもたらすマイクロ睡眠や断片的な睡眠につながる可能性があります。睡眠不足の後には、より長くより強度の高い睡眠が続き、これは睡眠に対する調整された必要性を示唆しています。もし数週間にわたって睡眠が妨げられると、その結果は致命的です。2〜3週間以上睡眠を奪われたラットは例外なく死亡します。稀なプリオン病であるFFIに罹患した人間も死亡しますが、死が睡眠不足そのものによるものかどうかは定かではありません。
睡眠の機能については多くの仮説が立てられています。良い仮説は以下の事実を説明できるはずです。(1) 睡眠は環境からの部分的な切断を伴い、これは潜在的に危険です。したがって、睡眠は静かな覚醒では得られない何かを提供しなければなりません。(2) 睡眠中はほとんどの脳領域で激しい神経活動が伴います。明白な行動がない状態での脳の活動について説明が必要です。(3) 睡眠は普遍的な要件であるようですが、その量は種によって大きく異なります。睡眠パターンの主要な違いに対応しながら、種間の睡眠の保存を説明する必要があります。(4) ほとんどの種で、睡眠は生命の初期に多く見られます。睡眠は発達期と成人期の両方で重要な機能を果たすべきです。(5) 睡眠はしばしばノンレム睡眠とレム睡眠の2つの段階で構成されます。2つの段階の順序が重要であるか、両方の段階が同様の機能を果たすかを説明する必要があります。これらの睡眠の様々な機能と特徴は、一つの仮説に収めるのが難しいことが証明されています。これらの事実すべてを説明できる単一の仮説は提案されていません。
睡眠と脳の回復
現在調査中のほとんどの仮説は、睡眠が何らかの代謝機能を回復させる役割、あるいは神経可塑性に役立つ役割に関心を持っています。睡眠は代謝率の高い動物において身体の休息を強制することでエネルギーを節約する可能性があります。実際、動物や人間は睡眠不足中に多く食べます。しかし、人間において、睡眠の代謝効率は静かな覚醒時と比べてわずかに良いに過ぎません。脳以外のほとんどの身体器官は、静かな覚醒状態でも休息を得ることができます。したがって、睡眠は脳にとって特に重要である可能性があります。覚醒中に脳内の何らかの分子経路や化学物質が枯渇し、睡眠中に回復するのかもしれません。例えば、睡眠がグリア細胞のグリコーゲン貯蔵の補充を促進する可能性が示唆されていますが、最近の証拠はこれが一部の脳領域に限られる可能性を示しています。あるいは、睡眠はシナプス疲労に対抗し、シナプス前貯蔵におけるカルシウムの補充、グルタミン酸小胞の補充、ミトコンドリアの休息、膜のリサイクル、または軸索や樹状突起に沿ったタンパク質の輸送を促進する可能性があります。最近の研究では、睡眠と覚醒の間、および睡眠不足後に分子レベルの変化が実際に起こることが明らかになっていますが、そのような変化の意義はまだ不明です。もし睡眠が覚醒中に失われた何かを回復させるのだとしたら、それが何であるかは分かっていません。
睡眠、学習、記憶
睡眠と記憶の関連性はかなり以前から指摘されていました。例えば、一日中新しい曲を学ぶのに苦労した後、一晩眠るとしばしばその曲をより上手に演奏できるようになります。最近では、特定の宣言的および非宣言的学習の後に行われる睡眠や昼寝の重要性が、十分に管理された実験で文書化されています。さらに、最近の証拠は、睡眠不足が以前に学習した課題を固定する能力を損なうだけでなく、新しい情報を獲得する能力も損なうことを示唆しています。睡眠は、学習と記憶の特定の側面にとって有利な状況を提供する可能性があります。睡眠に伴う感覚の切断は、進行中の活動と以前に獲得された記憶の固定との間の干渉を減らします。さらに、睡眠は、記憶に残る経験中に最初に活性化された神経回路を、オフラインモードで繰り返し再活性化させることを可能にすると示唆されています。動物での多電極記録や人間でのPETを用いた研究では、覚醒中に活性化された脳領域や細胞が、その後の睡眠中に優先的に再活性化されることが示されていますが、この再活性化は学習経験後の静かな覚醒期間中にも発生します。睡眠のさらなる利点は、関連する神経回路が、間隔を空けて交互に再活性化できることかもしれません。これにより、新しい記憶と古い記憶の統合が促進され、壊滅的な干渉が回避されます。睡眠中に発生する激しい高周波の自発的な神経活動のバーストは、シナプス固定の分子メカニズムをトリガーし、結合のネットワークを拡大する上で特に重要である可能性があります。
しかし、睡眠が新しく確立された記憶の固定を促進するのか、古い記憶の維持を促進するのかについては、まだ多くの未知の点が残されています。そのようなプロセスの分子レベルでの相関関係はまだ分かっていません。記憶獲得の分子マーカーは睡眠中にオフになり、これは動物が環境から切り離されている間に睡眠の激しい神経活動が発生することを考えると有利かもしれません。睡眠と記憶を結びつける初期の文献の多くはレム睡眠に関心を持っていました。しかし、MAO阻害剤による人間のレム睡眠の長期的な抑制は記憶を妨げないようですし、特定の脳幹病変後のレム睡眠の完全な消失も同様です。おそらく最も説得力のある証拠は、発達的可塑性における睡眠の役割に関するものです。最近の実験では、新生ラットのレム睡眠剥奪と子猫のノンレム睡眠剥奪が、視覚系回路の活動依存的発達に影響を与えることが示されています。もし睡眠がシナプスの成熟と可塑性に影響を与えるのであれば、早期の睡眠障害が精神病理学的発達に影響を与える可能性があると予想できます。
睡眠と精神医学
歴史的に、精神科医は睡眠と夢、そしてそれらと精神疾患との関係に興味を抱いてきました。19世紀後半のジークムント・フロイトやカール・ユング以来、夢の解釈は精神分析的心理療法において重要なツールとなりました。1953年のレム睡眠の発見後、精神科医は特定の睡眠異常と精神障害が相関するかどうかを探求し始めました。最初に取り組まれた問題の一つは、夢と精神病の類似性を考慮すると、統合失調症がレム睡眠の障害であるかどうかでした。精神病はレム睡眠障害として説明できるものではありませんでしたが、後にレム睡眠と統合失調症の両方がDLPFC(背外側前頭前野)の活動低下と関連していることが判明しました。しかし、ナルコレプシーは、レム睡眠現象が覚醒中に異常に侵入することによって引き起こされることが判明しました。
これまでのところ、うつ病における睡眠に関する研究は、睡眠の他の精神医学的側面よりもはるかに多く注目されてきました。レム睡眠が発見される前から、うつ病患者は睡眠障害があることが知られていました。1950年代と1960年代の睡眠脳波記録でも、彼らが同年齢の対照群と比較してSWS(徐波睡眠)の相対的な喪失を示し、さらにレム睡眠において特有の変化、すなわちレム睡眠潜時の短縮、夜間前半のレム睡眠の割合増加、レム睡眠中のREM(急速眼球運動)の頻度増加(すなわち、レム密度の上昇)、および睡眠時間全体に占めるレム睡眠の割合増加が示されました。すべてのうつ病患者がレム睡眠の変化を示すわけではなく、レム潜時が短いすべての患者がうつ病であるわけではありませんが、レム睡眠異常はうつ病の最も堅牢な生物学的マーカーの一つです。レム睡眠潜時の短縮とSWSの喪失は、臨床的寛解期でも持続し、うつ病患者の第一度近親者でより高い割合で見られることから、うつ病の特性マーカーであると考えられます。うつ病における睡眠変化のメカニズムは完全には理解されていませんが、睡眠と気分が共通のシステムによって調節されていることを示唆するデータが収束しています。例えば、うつ病のコリン作動性-モノアミン作動性不均衡仮説は、コリン作動性活動の増加によって引き起こされるであろうレム睡眠の増加とSWSの減少という観察結果と一致しています。うつ病患者は、非うつ病の対照群と比較して、コリン作動薬によるレム睡眠誘発に対する感受性が高いことも示されています。
睡眠剥奪研究は、睡眠と気分との機能的関係をさらに強く示唆しています。一晩の全睡眠剥奪、あるいは夜間後半の部分的な睡眠剥奪でも、多くの中等度から重度のうつ病患者において即効性の抗うつ効果をもたらすことがあります。睡眠不足は、双極性障害患者において躁病を誘発または持続させることがあり、彼らはほとんどまたはまったく眠らずに数日間を過ごすことがあります。対照的に、短い睡眠でも睡眠剥奪の抗うつ効果を逆転させることができ、長時間の睡眠は一部の個人でうつ病を誘発することがあります。機能的画像研究では、睡眠剥奪が抗うつ薬療法と同様に、うつ病患者の前帯状回で見られる代謝活動の増加を正常化することが示されています。選択的なレム睡眠剥奪も抗うつ効果があることが示されており、レム睡眠抑制性抗うつ薬が部分的に睡眠への作用を介して作用する可能性が示唆されています。しかし、レム睡眠の抑制は抗うつ効果の必須条件ではありません。ブプロピオンやネファゾドンなどの一部の薬剤は、レム睡眠を有意に減少させないようです。より最近の証拠は、睡眠剥奪と抗うつ薬の両方が、神経可塑性とシナプス増強に関与する遺伝子を選択的にアップレギュレートするという、同様のメカニズムで作用する可能性があることを示唆しています。
治療的睡眠剥奪は一部のうつ病患者に有益である可能性がありますが、多くの証拠は、睡眠障害が精神疾患の発症リスク因子であることを示唆しています。不眠症および過眠症の患者は、精神障害、特に気分障害と不安障害の発生率が高いです。プライマリケアの現場では、不眠症は他のどの医学的疾患よりも強くうつ病と関連しています。ストレス時に不眠症になったり、眠りにくいと感じたりする個人は、将来的にうつ病を発症する可能性が有意に高くなります。睡眠とうつ病の間の因果関係はまだ確立されていませんが、睡眠不足とうつ病の両方が社会でより蔓延しているという事実は、両者の関係を明確にする必要があることを示唆しています。精神疾患の患者だけでなく、既知の精神疾患がない患者においても、不眠症は自殺行動の独立したリスク因子です。
疫学的な観点から見ると、睡眠障害は精神障害と最も強く関連していますが、他にもいくつかの重要な健康関連の相関関係があります。不眠症の人は、他の医学的疾患の発生率が高く、より多くの医療サービスを利用し、欠勤、事故、障害の発生率が高く、心臓病を含む一部の医学的疾患において予後不良です。睡眠問題の治療がこれらの併存疾患の発症を予防できるかどうかは、今後の研究で明らかになるでしょう。
睡眠異常は、他のほぼすべての精神障害、特に睡眠開始までの潜時の延長、睡眠効率の低下、総睡眠時間の減少を含む睡眠の連続性の障害でも見られます。ノンレム睡眠中、不眠症の患者は、全体的に速いベータ活動(16〜32 Hz)の増加と、より中心的にアルファ活動(8〜12 Hz)の増加を示し、睡眠中の過覚醒を示唆しています。うつ病と同様のレム睡眠異常は、統合失調症、アルコール依存症、摂食障害、境界性パーソナリティ障害の患者に関するいくつかの研究で報告されています。パニック障害の患者は、睡眠中に、通常はSWSへの移行時にパニック発作を起こすことがあり、これはこの障害の生物学的病因をさらに強調しています。最近のhd-EEGを用いた研究では、統合失調症患者において紡錘波活動の喪失とSWA(徐波活動)の低下が実証されており、これは視床皮質ネットワークの機能不全と関連し、睡眠障害や認知機能障害の臨床的特徴と関連している可能性があります。さらに、紡錘波の欠陥は、統合失調症の疾患初期の患者と、影響を受けていない第一度近親者の両方で報告されており、これは統合失調症のバイオマーカーやリスク因子である可能性を示唆しています。
精神科患者はしばしばその疾患に伴う睡眠問題を抱えており、ほとんどの精神科薬が睡眠に有意な影響を与えるため、睡眠神経生物学の理解は臨床医にとって不可欠です。これらの影響は、多くの抗精神病薬、ベンゾジアゼピン系薬剤、三環系抗うつ薬(TCAs)、抗パーキンソン病薬による鎮静から、MAO阻害剤、SSRI、精神刺激薬による睡眠障害まで多岐にわたります。抗うつ薬は、睡眠中の周期性四肢運動やレム睡眠行動障害などの睡眠障害を誘発することがあり、三環系抗うつ薬、MAO阻害剤、SSRIなどのレム睡眠抑制性抗うつ薬の突然の中止は、レム睡眠の持続時間と強度の増加および睡眠障害を特徴とするレム睡眠リバウンドを引き起こす可能性があります。睡眠時無呼吸は、筋弛緩作用のある薬剤(例:ベンゾジアゼピン系薬剤やバルビツール酸系薬剤)や体重増加を引き起こす薬剤(例:抗精神病薬、抗うつ薬、気分安定薬)によって悪化する可能性があります。
睡眠は、まだ完全に透明ではないものの、人間の脳の機能状態を明らかにする窓です。睡眠の研究は、意識の多くの側面と人間の脳の働きに光を当ててきました。睡眠の機能とメカニズムを解明することは、間違いなく精神障害とその治療法についてより深い理解をもたらすでしょう。
参考文献
- Anafi RC, Kayser MS, Raizen DM. Exploring phylogeny to find the function of sleep. Nat Rev Neurosci. 2019;20(2):109-116.
- Benca RM, Obermeyer WH, Thisted RA, Gillin JC. Sleep and psychiatric disorders: a meta-analysis. Arch Gen Psychiatry. 1992;49:651-668.
- Borbely AA, Achermann P. Sleep homeostasis and models of sleep regulation. J Biol Rhythms. 1999;14:557-568.
- Brown RE, Basheer R, McKenna JT, Strecker RE, McCarley RW. Control of sleep and wakefulness. Physiol Rev. 2012;92:1087-1187.
- Cirelli C. Cellular consequences of sleep deprivation in the brain. Sleep Med Rev. 2006;10:307-321.
- Cirelli C, Tononi G. Is sleep essential? PLoS Biol. 2008;6(8):e216.
- Cirelli C, Tononi G. Cortical development, EEG rhythms, and the sleep/wake cycle. Biol Psychiatry. 2015;77(12):1071-1078.
- Colten HR, Altevogt BM, eds. Sleep Disorders and Sleep Deprivation: An Unmet Public Health Problem. The National Academies Press; 2006.
- Consensus Conference Panel; Watson NF, Badr MS, et al. Joint Consensus Statement of the American Academy of Sleep Medicine and Sleep Research Society on the Recommended Amount of Sleep for a Healthy Adult: Methodology and Discussion. J Clin Sleep Med. 2015;11(8):931-952
- Dang-Vu TT, Schabus M, Desseilles M, Sterpenich V, Bonjean M, Maquet P. Functional neuroimaging insights into the physiology of human sleep. Sleep. 2010:33(12):1589-1603.
- Ferrarelli F. Endophenotypes and biological markers of schizophrenia: from biological signs of illness to novel treatment targets. Curr Pharm Des. 2013;19(36):6462-6479.
- Foster RG, Peirson SN, Wulff K, Winnebock E, Vetter C, Roenneberg T. Sleep and circadian rhythm disruption in social jetlag and mental illness. Prog Mol Biol Transl Sci. 2013;119:325-346.
- Gamble KL, Berry R, Frank SJ, Young ME. Circadian clock control of endocrine factors. Nat Rev Endocrinol. 2014;10:466-475.
- García-Perdomo HA, Zapata-Copete J, Rojas-Cerón CA. Sleep duration and risk of all-cause mortality: a systematic review and meta-analysis. Epidemiol Psychiatr Sci. 2018;28:578-588.
- Goel N, Basner M, Rao H, Dinges DF. Circadian rhythms, sleep deprivation, and human performance. Prog Mol Biol Transl Sci. 2013;119:155-190
- He M, Deng X, Zhu Y, Huan L, Niu W. The relationship between sleep duration and all-cause mortality in the older people: an updatd and dose-response meta-analysis. BMC Public Health. 2020;20:1179.
- Hirshkowitz M, Whiton K, Albert SM, et al. National Sleep Foundation’s sleep time duration recommendations: methodology and results summary, Sleep Health. 2015;1:40-43.
- Iber C, Ancoli-Israel S, Chesson AL, Quan SF. The AASM Scoring Manual for the Scoring of Sleep and Associated Events. American Academy of Sleep Medicine; 2007.
- Klinzing JG, Niethard N, Born J. Mechanisms of systems memory consolidation during sleep. Nat Neurosci. 2019;22(10):1598-1610.
- Kryger MH, Roth T, Dement WC. Principles and Practices of Sleep Medicine. WB Saunders; 2017.
- Kurina LM, McClintock MK, Chen JH, Waite LJ, Thisted RA, Lauderdale DS. Sleep duration and all-cause mortality: a critical review of measurement and associations. Ann Epidemiol. 2013;23:361-370.
- Kurth S, Olini N, Huber R, LeBourgeois M. Sleep and early cortical development. Curr Sleep Med Rep. 2015;1(1):64-73.
- Neske GT. The slow oscillation in cortical and thalamic networks: mechanisms and functions. Front Neural Circuits. 2016;9:88
- Palagini L, Baglioni C, Ciapparelli A, Gemignani A, Riemann D. REM sleep dysregulation in depression: state of the art. Sleep Med Rev. 2013;17(5):377-390.
- Rasch B, Born J. About sleep’s role in memory. Physiol Rev. 2013;93(2):681-766.
- Scammell TE, Arrigoni E, Lipton JO. Neural circuitry of wakefulness and sleep. Neuron. 2017;93(4):747-765.
- Sheehan CM, Frochen SE, Walsemann KM, Ailshire JA. Are U.S. adults reporting less sleep ?: findings from sleep duration trends in the National Health Interview Survey, 2004-2017. Sleep. 2019;42(2):zsy221.
- Siclari F, Baird B, Perogamvros L, et al. The neural correlates of dreaming. Nat Neurosci. 2017;20(6):872-878.
- Silber MH, Ancoli-Israel S, Bonnet MH, et al. The visual scoring of sleep in adults. J Clin Sleep Med. 2007;3:121-131.
- Tononi G, Cirelli C. Sleep and the price of plasticity: from synaptic and cellular homeostasis to memory consolidation and integration. Neuron. 2014;81:12-34.
- Tononi G, Koch C. The neural correlates of consciousness: an update. Ann N Y Acad Sci. 2008;1124:239-261.
1.16 疼痛システム:情動および動機付けメカニズムとの接点
ジョン・ロトフィ医学博士、法学博士、ジョン=カー・ズビエタ医学博士、博士
痛みは多くの身体疾患の主要な症状です。急性期には、危険を警告し、刺激を引き起こす環境を避けるように行動を形成する役割を果たします。また、感覚的(例:強度、部位、性質)、情動的、認知的側面を統合した主観的な経験でもあります。その慢性化は、痛みの経験を永続させる適応的および不適応的な神経生物学的変化と関連しており、その嫌悪的および動機付け的意義の増加につながります。急性痛が持続的な状態に移行する個人では、その経験はもはや保護的な役割を果たさず、約50%の症例でうつ病や不安の併存疾患の発症と頻繁に関連しており、双方向的な悪化が見られます。
急性痛の調整は、侵害受容性入力を減少させる薬剤(例:オピオイド化合物、薬理学的伝導遮断と調節、モノアミン再取り込み阻害薬)の導入によって薬理学的に達成できますが、多くの病態、特に明白または特定可能な病態生理学がないもの(例:線維筋痛症、過敏性腸症候群、非神経病性腰痛)では、持続的な痛みの緩和は適切に達成されていません。慢性的なオピオイド使用の負の影響は、これらの化合物に対する耐性の発生、離脱症状、および誤用の可能性のために大きな注目を集めてきました。このような状況において、米国ではオピオイド使用障害が公衆衛生上の危機に発展しています。現在、年間薬物関連死者数は、自動車または銃器による死傷者数を上回っています。2015年には、疾病管理予防センター(CDC)によると、33,000人以上がオピオイド過剰摂取により偶発的に死亡しました。3年後の2018年には、オピオイド過剰摂取による死者数はさらに増加し、48,802人に達しました。オピオイド危機とCOVID-19パンデミックの組み合わせは、特に複雑な併存疾患を持つ患者にとって、脆弱な医療インフラにさらなる負担をかけています。
痛みの重症度と併存疾患を軽減するための主要な非オピオイド戦略には、再取り込み阻害または類似のメカニズムを介したモノアミン作動性神経伝達の増強が含まれます。しかし、急性痛から慢性痛への移行中に生じる神経可塑性変化を逆転させるために、炎症反応と神経興奮性を抑制する薬剤の研究がますます進められています。

