疼痛システム
痛みの知覚は通常、末梢の侵害受容器の活性化によって開始されます。侵害受容器は、皮膚、筋肉、関節、および内臓にある感覚終末器官であり、有害な、または潜在的に損傷を与える刺激に選択的に反応します。侵害受容器の重要な特性は、組織損傷や炎症の結果として感作されることであり、これにより反応閾値が低下し、有害な刺激に対する反応の大きさが増加します。これは薬理学的介入の新たな潜在的標的となります。組織内の侵害受容器終末は被包されておらず(「自由終末」)、一般的に、(1) 急性で局在のはっきりした「一次痛」信号を伝達する中径有髄Aδ軸索、または (2) 局在が不明瞭な「二次痛」、「灼熱痛」、または緩慢な痛みを伝える小径無髄の遅い伝導C線維のいずれかと関連しています。AδおよびC侵害受容器はさらに、多様な感受性で機械的、化学的、または熱的刺激に反応する多モード型またはより特殊なタイプに細分されます。より大きく、伝導速度の速い有髄Aβ線維は、触覚のような無害な機械的刺激に反応します。
体の侵害受容器の細胞体は脊髄の後根神経節(DRG)に位置し、顔の侵害受容器の細胞体は三叉神経節にあり、三叉神経脊髄核を介して情報を伝達します。DRGニューロンからの軸索投射は、興奮性のグルタミン作動性およびペプチド作動性の神経伝達を介して、脊髄後角の第二次ニューロンに情報を伝達します。第二次ニューロンの軸索はその後、反対側に交差し、脳幹(脊髄網様体視床路)および視床核(脊髄視床路)にシナプス結合する上行路を形成します。これらはそれぞれ、より局在性が低い痛みと、より感覚弁別的(例:強度と局在)な痛みの要素を司ると考えられています。
脊髄網様体視床路から吻側腹側髄質(RVM)および中脳水道周囲灰白質(PAG)への投射は、後角ニューロンの興奮性を調節するフィードバックループにおいて下行性疼痛抑制経路を関与させ、視床核は皮質構造に投射します。他の脊髄網様体視床路投射は、橋の腕傍核に達し、これは扁桃体と直接接続しています。扁桃体は、痛みの経験の嫌悪的で情動的に負の要素の表現と調節に関与する領域であり、さらに島皮質に情報を提供します。
PAGとRVMの調節機能は、侵害受容性信号の調節メカニズムとして関与しているため、大きな注目を集めています。このメカニズムは、エンケファリン作動性内因性オピオイド、セロトニン、ノルエピネフリンシステムなどの神経伝達物質によって強く影響を受けます。これらは、モノアミン再取り込み阻害薬である抗うつ薬やオピオイド薬などの一般的に使用される疼痛制御薬の標的です。PAGへの疼痛信号は、興奮性およびペプチド作動性伝達を活性化し、RVMに投射します。RVMでは、「オン」細胞が有害な痛みの刺激に反応して活性化され、引き込み反射のような保護的な**「侵害防御性」行動**の形成に関与します。一方、「オフ」細胞は、内因性オピオイド、GABA、セロトニンに急性的に反応し、脊髄後角への下行性接続を介して鎮痛反応を誘発します。ノルエピネフリンは、α1およびα2受容体を介して、RVMの「オン」および「オフ」細胞の調節によって、侵害促進作用と侵害抑制作用の両方を持つことができます(図1.16-1)。
体性感覚皮質に到達する視床からの入力は、感覚弁別機能に関与していると考えられています。一方、前帯状回や島皮質などの領域への投射は、痛みの経験の感覚的および情動的側面を統合すると考えられています。しばしば「外側」(感覚弁別)および「内側」(情動-認知)投射と呼ばれるこれらの経路は、痛みの複雑で多面的な経験を反映し、処理する大規模で分散型の脳ネットワークである「疼痛マトリックス」を形成します。急性痛の間、一次および二次体性感覚皮質、島皮質、前帯状回、および前頭前野が継続的に活性化されます。基底核、扁桃体、海馬もこれらのプロセスに関与しています。
これらの「内側投射」の統合領域の多くは、他の非痛性で顕著な、またはストレスの多い刺激の表現に関与する領域と重複しており、痛みが慢性化すると機能不全になると考えられています。これは、持続性疼痛状態で見られる報酬および動機付けメカニズムの変化を反映しています。特にこれらのうち、前部島皮質、前帯状回、前頭前野、ならびに側坐核および扁桃体は、以下でさらに詳細に議論するように、痛みの経験の情動的、動機付け的、および評価的側面を表現および調節することに関与していると考えられています。逆に、腹外側視床、体性感覚皮質、背側後部島、および前帯状回と前部島皮質の一部細胞群は、より疼痛特異的であると考えられており、痛みの強度の変動に反応し、非痛性特異的感覚刺激や痛みの経験の他の要素とは異なって痛みの刺激によって活性化されます。PAGとRVMの侵害受容抑制に対する調節的役割に加えて、背外側前頭前野、前帯状回、島皮質、視床、側坐核、扁桃体を含む終脳領域は、内因性オピオイドやノルアドレナリン作動性、GABA、エンドカンナビノイド、グリシン作動性などの他の神経伝達物質システムの局所的な活性化、およびPAGとRVMへの下行性投射を介して、感覚的および情動的(例:不快感)な要素を横断して痛みの経験を調節することに関与しています(図1.16-2)。
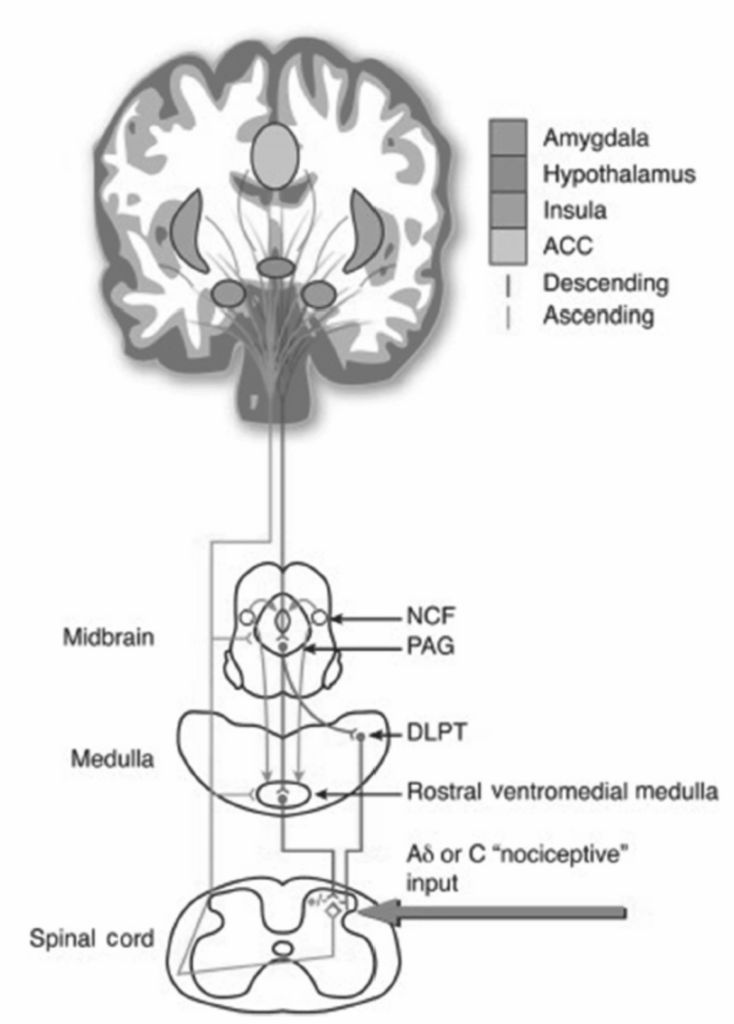
図1.16-1. 下行性疼痛調節システム
この図は、下行性疼痛調節システムを示しています。主要な構成要素として、楔状核(NCF)、中脳水道周囲灰白質(PAG)、背外側橋被蓋(DLPT)、**前帯状皮質(ACC)**が挙げられます。図中の「+/-」は、それぞれ侵害促進的および侵害抑制的な影響の両方があることを示しています。
(図はTracey I, Mantyh PW. The cerebral signature for pain perception and its modulation. Neuron. 2007;55(3):377-391. Copyright @ 2007, Elsevierの許可を得て転載。)
痛みと動機付けメカニズム
進化の観点から見ると、痛みは負の情動的意味合いを持つ強力な動機付け信号であり、痛みの緩和は安堵と報酬の一形態として概念化できます。したがって、痛みは行動を方向付ける強力な要因となります。大脳基底核および関連する辺縁皮質は、内外の信号を統合して、受け取った感覚信号の価値を符号化すると考えられています。これらは痛みの予測や痛みの緩和の期待に関与し、前頭前野皮質構造とともに、感覚情報の統合だけでなく、内因性オピオイド調節システムを介した痛みの調節にも関与しています。
急性痛の間、眼窩前頭皮質、側坐核、腹側被蓋野を含む顕著性/報酬/動機付けネットワークの脳機能活動は増加し、ヒトにおける内因性オピオイド鎮痛を発現する能力と関連しています。側坐核が報酬価値に反応する能力の個人差は、プラセボ誘発性鎮痛反応を発現する能力とさらに関連しており、報酬および顕著性評価メカニズムが、恒常性を維持するために必要な場合に適切な鎮痛反応を誘発するためにも関与していることを示唆しています。
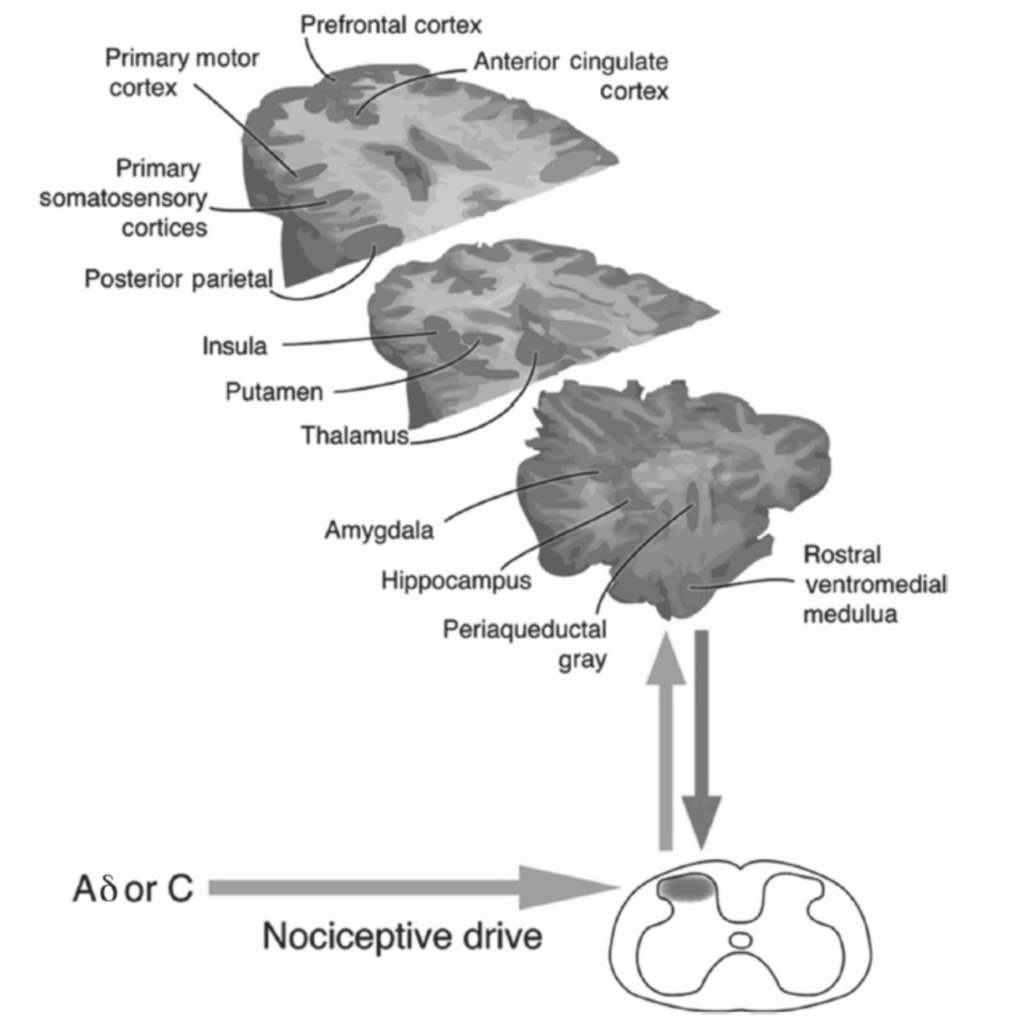
図1.16-2. 疼痛処理の神経解剖学
この図は、痛みを感じる経験中に活性化する脳領域を示しており、両側性に(有害な刺激とは反対側にオレンジ色で)表現されています。
(図はTracey I, Mantyh PW. The cerebral signature for pain perception and its modulation. Neuron. 2007;55(3):377-391. Copyright @ 2007, Elsevierの許可を得て転載。)
側坐核は、前頭前野、前帯状回、扁桃体などの痛みと情動処理に関わる領域を介して痛みの情報を受け取ります。また、脊髄ニューロンから側坐核への直接投射も報告されています。ヒトの実験的な痛みにおいて、大脳基底核でドーパミン神経伝達が活性化されます。体性感覚皮質から入力される背側領域では、ドーパミンは痛みの信号の強度と感覚要素に比例して放出されますが、側坐核では、ヒトの負の情動反応と関連していました。この効果は、動物モデルのデータに基づくと側坐核のコア領域に局在しているようです。一方、この領域のシェル領域では、痛みの刺激が終了した後に放出されます。これは、持続性疼痛と診断されたヒトの神経画像データで示されているように、痛みの緩和がその終了時の正の強化の一形態であるという概念と一致しています。ヒトにおける損傷と急性痛から持続性腰痛への移行は、大脳基底核から前頭前野皮質構造への機能的結合の変化とさらに関連しており、持続性疼痛によって誘発される動機付けシステムの変調が、ヒトにおける痛みの経験の永続化において重要な部分を形成していることを示唆しています。
線維筋痛症や慢性腰痛などの持続性疼痛状態と診断された患者では、側坐核のドーパミン受容体とドーパミン作動性神経伝達が、健常者と比較してダウンレギュレーションされています。これらの減少は本質的に適応的であると考えられ、慢性的な有害刺激の顕著性を妨げますが、下流の抗侵害受容性内因性オピオイドメカニズムの機能的能力も高めます。しかし、慢性疼痛における側坐核機能の機能不全は、動物モデルにおいて報酬を得るための努力を要するタスクを実行する能力など、動機付けの低下とも関連付けられています。したがって、側坐核の機能とこの領域のドーパミン作動性神経伝達は、有害な入力の負の価値と顕著性のシグナル伝達に関与し、急性痛から持続性疼痛への移行にも関与しています。ドーパミン作動性メカニズムもまた、持続性疼痛の状況において適応的にダウンレギュレーションされるようですが、それは、動機付けメカニズムへの関与能力の低下や、努力を要する報酬の追求能力の低下といった、快感消失やうつ病の中心的な特徴である潜在的に負の行動的結果を伴います。
痛みと情動調節およびその機能不全
持続性疼痛は、負の気分状態を誘発する身体的および情動的ストレス要因の一形態であり、慢性的な有害刺激に対する不適応反応の一部です。持続性疼痛状態と診断された患者の約半数に、臨床的に有意なうつ病および不安症状が現れ、慢性疼痛に関連する併存する病態の一部を形成します。下行性の神経因性疼痛経路も調節する可能性のある併存するうつ病と不安に対する精神薬理学的治療法については、以下で議論します。
視床脊髄路を介して侵害受容信号を受け取る前帯状回などの脳領域は、痛みの不快感の符号化に関与しています。この不快感は、催眠誘導のような認知プロセスによって調節することができ、プラセボ投与時の鎮痛の示唆という文脈で内因性オピオイドメカニズムが関与します。内因性オピオイド鎮痛を媒介するオピオイド受容体は、慢性疼痛状態(炎症性、中枢性、神経因性疼痛、線維筋痛症など)において、この領域や視床、側坐核、扁桃体などの他の領域でダウンレギュレーションされていることが見られ、それに伴い負の情動と痛みの不快感の評価が増強されます。同様に、慢性腰痛患者では、扁桃体において内因性オピオイド神経伝達の欠損が認められています。扁桃体は、抗侵害受容だけでなく、情動的に価を持つ刺激への反応と調節に関与する領域であり、臨床的な痛みの評価とより大きな負の情動の両方と関連付けられています。これらの知見は、大うつ病と診断された患者で見られるものと類似しており、病態間で重複する生物学的プロセスの変化の一例です。
情動刺激への反応を媒介し、うつ病の病態生理に関与する領域の一つである前部島皮質は、痛みの文脈における内受容情報の符号化において重要な役割を果たすことも示されています。それは、痛みを含む身体生理的手がかりに対する注意バイアスの形成に関連しており、痛みを伴う刺激に対する恐怖学習と不安反応に関与しています。持続性疼痛と診断された患者において、内受容感受性と不安の軽減を目指した瞑想に基づく治療などの臨床介入は、前帯状回と前部島皮質を臨床的利益に比例する形で調節することが示されています。
慢性神経因性疼痛における併存するうつ病と不安に対する精神薬理学的治療で、下行性の神経因性疼痛経路も調節する可能性のあるものには、セロトニン・ノルエピネフリン再取り込み阻害薬(SNRIs)、三環系抗うつ薬(TCAs)、ガバペンチノイド、カルバマゼピンが含まれます。SNRIは、セロトニンとノルエピネフリンの再取り込みを阻害することで、これらの神経伝達物質の相対的な利用可能性を高め、抗うつ作用と抗不安作用を発揮します。このセロトニンとノルエピネフリンの利用可能性の増加が、SNRIが下行性疼痛経路を阻害する能力のメカニズムである可能性がありますが、オピオイドメカニズムも間接的に関与している可能性があります。TCAsも同様に、抗うつ作用と抗不安作用のためにセロトニンとノルエピネフリンの再取り込みを阻害します。しかし、TCAsはムスカリン性アセチルコリン受容体、ヒスタミン受容体、アドレナリン受容体のアンタゴニストとしても作用するため、SNRIよりも副作用プロファイルが大きくなります。ガバペンチノイドは、電位依存性カルシウムチャネルのアルファ-2-デルタサブユニットに高い親和性で結合し、興奮性神経伝達物質の放出を阻害しますが、その抗不安作用と下行性疼痛経路調節の正確なメカニズムは不明なままです。カルバマゼピンは、使用依存性電位感受性ナトリウムチャネル遮断薬として作用し、グルタミン酸の放出を阻害し、疼痛経路を調節するだけでなく、急性治療抵抗性うつ病の管理にも作用します。カルバマゼピンと構造的に関連するオクスカルバゼピンも同様の効果を持つ可能性がありますが、さらなる研究が必要です。NMDA受容体アゴニストであるケタミンも、最近のメタアナリシスでは持続性疼痛の軽減に効果があることが示されており、大うつ病で記述されたのと同様の形で作用します。
上記のように、情動的に顕著な刺激の処理に関与する脳領域と神経生物学的メカニズム、および痛みの信号伝達を表現し調節することが見出された領域との間には、かなりの重複が存在します。これは、持続性疼痛が負の情動反応を促進し、うつ病と不安症状を発症する個人の傾向を高めるアロスタティックプロセスであるという概念と一致しています。異なる精神薬理学的治療法は、併存するうつ病と不安を標的としながら、疼痛経路も調節することができます。
認知処理と痛み
痛みの知覚は、有害な刺激に対する注意バイアスなどの精神プロセスに敏感です。痛みを伴う刺激に対する注意と脅威の期待が高まると、破局的思考と高い疼痛感受性を誘発することが示されています。逆に、痛みからの気晴らしやその意味の再構築は、体性感覚皮質、視床、島、前帯状回の痛み関連反応の減少と関連しており、痛みを伴う刺激の感覚的、認知的、情動的評価における変化を伴います。したがって、痛みの報告の増強と減少の両方は、高次認知プロセスの影響によって達成され、これは少なくとも部分的に、PAGと下行性疼痛調節回路のトップダウン関与を介して脊髄侵害受容伝達に影響を与えることで起こります。背外側および腹外側前頭前野などの実行皮質領域は、前帯状回、島、視床の回路に入力を提供すると考えられており、これらは脊髄からの上行信号の強度に強力に影響を与える領域であるPAGに投射します。
認知プロセスが痛みの処理に影響を与えるもう一つの例は、いわゆるプラセボ鎮痛効果です。プラセボ効果が潜在的な治療薬の対照試験を混乱させるという見方がある一方で、これまでに得られた情報は、正の期待によって活性化され、報酬学習によって維持されるときに、鎮痛の経験と情動状態の改善につながる生理学的変化を誘発できる神経生物学的システムを指し示しています。この研究分野では、プラセボ鎮痛反応の形成に関与する神経ネットワークと神経伝達物質システムが記述されています。これらには、環境の手がかりと期待の処理に関与する背外側前頭前野、ならびに腹外側前頭前野、前帯状回、島皮質、側坐核、扁桃体、PAGが含まれます。側坐核におけるドーパミン神経伝達によって媒介される顕著性評価は、これらの領域にわたる疼痛調節ネットワークを関与させ、痛みと情動調節神経伝達物質と神経ネットワークの適応的な活性化を誘発します(または、ノセボ反応、治療的な手がかりに対する有害な影響の場合には不適応的)。内因性オピオイドは、エンドカンナビノイドおよびコレシストキニンシステムと同様に、これらのプロセスに中心的に関与しています。したがって、生物学的プラセボ効果の形成は、遺伝的要因によって部分的に決定され、治療環境によって生み出される期待の認知情動的統合によって明らかにされる回復力メカニズムの関与を示唆しているようです。注目すべきは、プラセボ抗うつ効果の形成にも同様のメカニズムが関与しているようで、プラセボ誘発鎮痛の発現中に活性化される領域との部分的な重複があります。
将来の展望
痛み知覚と調節の研究においてこれまでに実施されてきたほとんどの作業は、末梢、脊髄、脳幹構造のレベルでの侵害受容入力の伝達とその調節に関心があり、これらのプロセスに関する精緻な詳細が提供されてきました。急性痛から持続性疼痛への移行とそのさらなる慢性化において、グリア細胞とニューロンの両方における炎症性メカニズム、および興奮性経路における神経可塑性変化の寄与に関して、ますます多くの情報が収集されています。また、特にヒトにおいて、急性、持続性、および慢性痛の際に活性化する終脳メカニズムに関する新たな洞察も得られており、これらは間違いなく痛みの慢性化とうつ病、不安、報酬と動機付けの変化との併存に寄与しています。現れつつある文献は、痛みに関与する神経系と、他のストレス要因に反応する神経系との間に実質的な重複があることを示しており、これらの機能不全が、持続性疼痛状態と診断された患者の複雑な症状を説明するでしょう。この分野における将来の進歩は、痛みの慢性化と、頻繁に併存する物質使用障害を含む関連する神経精神症状において実際の変化をもたらすために、これらのインターフェースに特に注意を払う必要があり、これらの状態に対する新たな治療標的に関する新しい洞察を提供する必要があります。
公衆衛生の観点から、そして痛み、精神衛生、薬物乱用、経済的および社会的地位の格差間の複雑な関係性を考慮すると、医療が「サイロ化」して断片化していることは非常に非生産的です。併存疾患は健康転帰に深く影響を及ぼすことが知られており、メディケアの支出の80%は4つ以上の慢性疾患を持つ患者に向けられています。しかし、疾患または臓器に基づく診療が依然として医療の主流のアプローチであり、医療従事者が併存疾患を持つ人々に個別化されたケアを提供する能力を低下させています。
参考文献
- Apkarian AV, Bushnell MC, Treede R-D, Zubieta J-K. Human brain mechanisms of pain perception and regulation in health and disease. Eur J Pain. 2005;9:463-484.
- Baliki MN, Geha PY, Fields HL, Apkarian AV. Predicting value of pain and analgesia: nucleus accumbens response to noxious stimuli changes in the presence of chronic pain. Neuron. 2010;66:149-160
- Baliki MN, Petre B, Torbey S, et al. Corticostriatal functional connectivity predicts transition to chronic back pain. Nat Neurosci. 2012;15:1117-1119.
- Basbaum AI, Bautista DM, Scherrer G, Julius D. Cellular and molecular mechanisms of pain. Cell. 2009;139:267-284.
- Bushnell MC, Ceko M, Low LA. Cognitive and emotional control of pain and its disruption in chronic pain. Nat Rev Neurosci. 2013;14:502-511.
- Fields H. State-dependent opioid control of pain. Nat Rev Neurosci. 2004;5:565-575.
- Gold MS, Gebhart GF. Nociceptor sensitization in pain pathogenesis. Nat Med. 2010;16:1248-1257.
- Harris RE, Clauw DJ, Scott DJ, McLean SA, Gracely RH, Zubieta JK. Decreased central mu-opioid receptor availability in fibromyalgia. J Neurosci. 2007;27:10000-10006.
- Hsu DT, Sanford BJ, Meyers KK, et al. It still hurts: altered endogenous opioid activity in the brain during social rejection and acceptance in major depressive disorder. Mol Psychiatry. 2015;20:193-200
- Lutz A, McFarlin DR, Perlman DM, Salomons TV, Davidson RJ. Altered anterior insula activation during anticipation and experience of painful stimuli in expert meditators. Neuroimage. 2013;64:538-546
- Martikainen IK, Nuechterlein EB, Pecina M, et al. Chronic back pain is associated with alterations in dopamine neurotransmission in the ventral striatum. J Neurosci. 2015;35:9957-9965.
- Martikainen IK, Pecina M, Love TM, et al. Alterations in endogenous opioid functional measures in chronic back pain. J Neurosci. 2013;33:14729-14737.
- Navratilova E, Porreca F. Reward and motivation in pain and pain relief. Nat Neurosci. 2014;17:1304-1312.
- Peciña M, Bohnert AS, Sikora M, et al. Association between placebo-activated neural systems and antidepressant responses: neurochemistry of placebo effects in major depression. JAMA Psychiatry. 2015;72:1087-1094.
- Peciña M, Zubieta JK. Molecular mechanisms of placebo responses in humans. Mol Psychiatry. 2015;20:416-423.
- Pertovaara A. The noradrenergic pain regulation system: a potential target for pain therapy. Eur J Pharmacol. 2013;716:2-7.
- Phan KL, Wager T, Taylor SF, Liberzon I. Functional neuroanatomy of emotion: a meta-analysis of emotion activation studies in PET and fMRI. Neuroimage. 2002;16:331-348.
- Rainville P, Carrier B, Hofbauer RK, Bushnell MC, Duncan GH. Dissociation of sensory and affective dimensions of pain using hypnotic modulation. Pain. 1999;82:159-171.
- Ru-Rong J, Chamessian A, Yu-Qiu Zhang Y. Pain regulation by non-neuronal cells and inflammation. Science. 2016;354(6312):572-577.
- Schwartz N, Temkin P, Jurado S, et al. Chronic pain. Decreased motivation during chronic pain requires long-term depression in the nucleus accumbens. Science. 2014;345:535-542.
- Scott DJ, Heitzeg MM, Koeppe RA, Stohler CS, Zubieta JK. Variations in the human pain stress experience mediated by ventral and dorsal basal ganglia dopamine activity. J Neurosci. 2006;26:10789-10795
- Scott DJ, Stohler CS, Egnatuk CM, Wang H, Koeppe RA, Zubieta JK. Individual differences in reward responding explain placebo-induced expectations and effects. Neuron. 2007;55:325-336.
- Scott DJ, Stohler CS, Egnatuk CM, Wang H, Koeppe RA, Zubieta J-K. Placebo and nocebo effects are defined by opposite opioid and dopaminergic responses. Arch Gen Psychiatry. 2008;65:220-231.
- Segerdahl AR, Mezue M, Okell TW, Farrar JT, Tracey I. The dorsal posterior insula subserves a fundamental role in human pain. Nat Neurosci. 2015;18:499-500.
- Simons LE, Elman I, Borsook D. Psychological processing in chronic pain: a neural systems approach. Neurosci Biobehav Rev. 2014;39:61-78.
- Skolnick P, Volkow ND. Re-energizing the development of pain therapeutics in light of the opioid epidemic. Neuron. 2016;92(2):294-297.
- Smith TH, Sim-Selley LJ, Selley DE. Cannabinoid CB1 receptor-interacting proteins: novel targets for central nervous system drug discovery? Br J Pharmacol. 2010;160:454-466.
- Tracey I, Mantyh PW. The cerebral signature for pain perception and its modulation. Neuron. 2007;55:377-391.
- Vandenberg RJ, Ryan RM, Carland JE, Imlach WL, Christie MJ. Glycine transport inhibitors for the treatment of pain. Trends Pharmacol Sci. 2014;35:423-430.
- Wager TD, Atlas LY, Lindquist MA, Roy M, Woo CW, Kross E. An fMRI-based neurologic signature of physical pain. N Engl J Med. 2013;368:1388-1397.
- Wanigasekera V, Lee MC, Rogers R, et al. Baseline reward circuitry activity and trait reward responsiveness predict expression of opioid analgesia in healthy subjects. Proc Nat Acad Sci USA. 2012;109:17705-17710.
- Wiech K, Ploner M, Tracey I. Neurocognitive aspects of pain perception. Trends Cogn Sci. 2008;12:306-313.
- Wood PB, Schweinhardt P, Jaeger E, et al. Fibromyalgia patients show an abnormal dopamine response to pain. Eur J Neurosci. 2007;25:3576-3582.
- Zubieta JK, Smith YR, Bueller JA, et al. mu-opioid receptor-mediated antinociceptive responses differ in men and women. J Neurosci. 2002;22:5100-5107.
- Zubieta JK, Smith YR, Bueller J M, et al. Regional mu opioid receptor regulation of sensory and affective dimensions of pain. Science. 2001;293:311-315.

