1.17 食欲の基礎科学
ノリ・ギアリー博士、ティモシー・H・モラン博士
食欲は、食事に関連する、複雑に決定され、高度に個別化された行動的および主観的現象から構成されます。本章では、(1) 摂食行動、それを制御する感覚信号、これらの信号を統合する脳メカニズム、および食欲のいくつかの重要な調節因子を含む、食欲の核心となる生理学の理解における進展を要約し、(2) 摂食障害の理解に対する基礎研究の貢献例を提供します。多くのことが解明されてきましたが、正常な摂食と摂食障害の両方はいまだ十分に理解されていません。したがって、さらなる研究は、現在利用可能なものよりも効果的な治療戦略、精神科摂食障害として現れるか単純な肥満として現れるかにかかわらず、摂食障害に対する治療戦略の開発を促進する可能性があります。
食欲はネットワーク機能である
摂食は、脳内の広範に分布した神経ネットワークによって制御されており、このネットワークは、口腔、鼻腔、咽頭からの食物刺激、消化管(GI)信号、代謝信号(体脂肪に関連する信号を含む)、その他多数の内部刺激(例:概日信号、ストレス反応、免疫反応、生殖軸機能)、および学習された意味を持つ外部刺激を統合します。さらに、このネットワークは生涯を通じて構造的および機能的な可塑性を示します。この視点は、摂食に影響を与える複数の要因、脳の情報処理に対する多様な影響、およびそれらの複雑な相乗的・拮抗的相互作用を強調します。これは、少数の限定された視床下部部位に作用する少数の信号、例えば血糖値だけが食欲の統一的な制御を生み出すという伝統的な見方とは対照的です。
食欲が単一の脳領域の特性ではなく、神経ネットワークの特性であるという見方には、いくつかの重要な示唆があります。(1) 食欲を制御するすべての神経信号が収束する単一の脳部位はない可能性があります。(2) 食欲に対する統一的な動機付けプロセスの神経基盤が見つかる可能性は低いでしょう。(3) ネットワークの異なる部分で精緻化される摂食の制御は、常に協調して機能するとは限りません。例えば、摂食は一部の制御(例:代謝燃料の利用可能性に関連する恒常性信号)によって同時に抑制され、他の制御(例:風味の快楽)によって刺激される可能性があります。このため、食事中の摂食速度のパターンや自発的な食事の量と頻度のパターンは、摂取総量に変化がない場合でも変化する可能性があります。(4) このような部分的に自律的な制御の存在は、単一のシグナル伝達分子の操作に基づく摂食障害の薬理学的治療の控えめな効果に寄与している可能性があります。
食事を分析単位として
食事は、食欲の機能的および生理学的分析の両方にとって最も適切な分析単位です。食事は摂食の機能単位です。(1) 食事のタイミング、量、内容物は、上述した食欲に影響を与えるすべての影響に対する生物の反応を完全に記述します。(2) 食事開始、食事中の摂食速度、食事終了、食事量、食事間隔は、食欲の研究のための具体的な指標を提供します。例えば、空腹感の説明は、食事開始のタイミングを説明できなければ成功しません。(3) 異常な食事は、摂食障害の行動現象学です。異常に大量の食事は、神経性過食症およびむちゃ食い障害の定義的な行動変化であり、異常に少量の食事は、神経性食欲不振症の定義的な行動変化です。
食事はまた、摂食の生物学的単位でもあります。人間と他のほとんどの脊椎動物は、摂食を、摂食しない期間によって区切られた個別の発作または食事として組織化しており、概日リズム、季節、その他の影響に関連する種特有の変動があります。食事終了時の満腹は積極的なプロセスです。食後には鎮静または睡眠の期間が続き、これは動物や乳児で最も明確です。これらの特徴は、生食ではなく調理済み食品の消化結果や、食品の入手と準備の物流などの影響によって形成された、自然選択と文化進化の両方の産物であることは間違いありません。
摂食の行動神経科学
摂食の行動神経科学は、3つの一般的なアプローチに従います。(1) 入力アプローチは、摂食に影響を与える環境的および経験的偶発性、外受容性刺激、および内受容性感覚信号を理解することを目的としています。外受容性刺激には、その意味が学習される刺激だけでなく、甘味の快楽的意義のような生得的に意味のある少数の刺激も含まれます。重要な内受容性刺激には、ホルモンと代謝物の循環レベル、ならびに末梢器官から脳への神経信号が含まれます。(2) ネットワークアプローチは、入力を統合し、摂食を駆動する動機付けプロセスを生成する中枢神経ネットワークに焦点を当てています。これは現在、動物におけるますます洗練された分子遺伝学的手法、およびヒトにおける機能的脳画像診断手法を用いて行われています。画像診断の重要な利点は、主観的反応と脳反応を関連付ける能力です。これらのアプローチは、1日あたりの摂取カロリーなどの要約測定値のみや、主観的測定値のみではなく、食事が研究される場合に最も意味があります。(3) 運動アプローチには、しばしば摂食の微細構造と呼ばれる摂食運動の神経制御を理解する努力が含まれます。食物は、舌と口蓋の運動によって口腔咽頭に移動し、嚥下される前に、舐められ、吸われ、噛まれ、または咀嚼されます。これらの運動の分析は、三叉神経、顔面神経、舌咽神経、迷走神経、舌下神経の脳神経の下位運動ニューロンを介して、(i) これらの神経の運動核の局所回路、(ii) これらの核に投射する後脳の中枢パターン発生器、(iii) 上流の統合性介在ニューロンネットワーク、そして (iv) 最終的には記憶、概日リズムなどの感覚入力および脳自律入力への神経制御を追跡する可能性を秘めています。
食事開始の信号
空腹感のプロセスと学習
食物探索と食事開始につながる神経活動のパターンは、空腹感の動機付けとして概念化されます。3つの異なる動機付けプロセスが関与していると考えられています。(1) 負の強化プロセス、(2) 風味の快楽に関連する正の強化プロセス、そして (3) 摂取後の結果に関連する正の強化プロセスです(図1.17-1)。これらの一つ一つが摂食を刺激するのに十分であり、摂食は空腹感を減らす負のフィードバックにつながります。しかし、負の強化による空腹感だけが、逃れたいと願う嫌悪状態を伴います。対照的に、満腹感やポジティブな快楽状態の期待は通常、快適です。ほとんどの人は、強い剥奪による空腹感という嫌悪状態を経験することはめったにありません(経験するのは、貧しい人々、厳格なダイエット中の人々、そして神経性食欲不振症の人々などです)。一晩の絶食後には上部消化管が比較的空になりますが、人々は一般的に朝に強い空腹感を報告することはなく、朝食は通常、その日の中で最も少ない食事です。したがって、正常な成人の空腹感は、おそらく一生にわたる正の強化学習を表しており、生得的な「恒常性」メカニズムは通常重要な役割を果たしていません。
動物における研究は、動機付けの側面であるインセンティブ動機付けまたは**欲求(wanting)と、主観的な側面である好き嫌い(liking)**という、部分的に独立した脳プロセスが快楽を媒介することを示唆しています。この区別は、以下で議論する食物選択における風味の快楽と風味-栄養学習の分離可能な影響に関連している可能性があります。
概日リズム
概日リズムは摂食に重要な影響を与え、朝の空腹感が低いことを説明する可能性があります(図1.17-2)。このような概日リズムは、おそらく視床下部の視交叉上核(SCN)にある概日ペースメーカーから発せられると考えられます。この領域は、以下でレビューするように、視床下部の弓状核(ARC)、背内側核(DMN)、外側視床下部領域(LHA)、および摂食を制御する神経および内分泌信号を調節できる他の領域と広範な神経接続を持っています。
代謝信号
グルコースまたは脂肪酸の利用が減少することによって生じる刺激は、空腹感と食事開始を誘発する可能性があります。これらの効果は、長時間の栄養枯渇、食事の主要栄養素組成の急激な変化、生化学的低血糖症などの極端な条件下では明らかです。しかし、通常の生理学的条件下では作用する可能性は低いと思われます。
ラットやヒトでは、自発的な食事の前に血漿グルコースの小さな一時的な減少が起こることがあり、これが正常に機能する空腹刺激である可能性があります。これらは細胞のグルコース利用可能性に影響を与えるには小さすぎます(約10%)。むしろ、減少の時間的ダイナミクスが空腹感を伝えるのかもしれません。
内分泌信号
2つの消化管ホルモンが空腹感の候補となる内分泌信号であり、それはグレリンとモチリンです。これまでのところ、グレリンがより注目されています。グレリンは、主に胃と近位小腸の腸内分泌細胞によって合成・放出されるペプチドホルモンです。これは不活性な形で分泌され、酵素グレリンO-アシル転移酵素によって生物学的に活性な**アシル化型(オクタノイル-またはアシルグレリン)**に代謝されます。血漿中濃度は朝に高く、食後に減少し、食事間隔中に増加します。グレリン分泌を刺激するメカニズムは不明です。食後数時間の消化管内容物の徐々の減少は、グレリン分泌に対する抑制からの持続的な刺激制御を解除すると考えられています。栄養素が食事中および食後に小腸に達すると、抑制が再確立されます。炭水化物とタンパク質は、等エネルギー的な脂質負荷よりもグレリン分泌を抑制します。
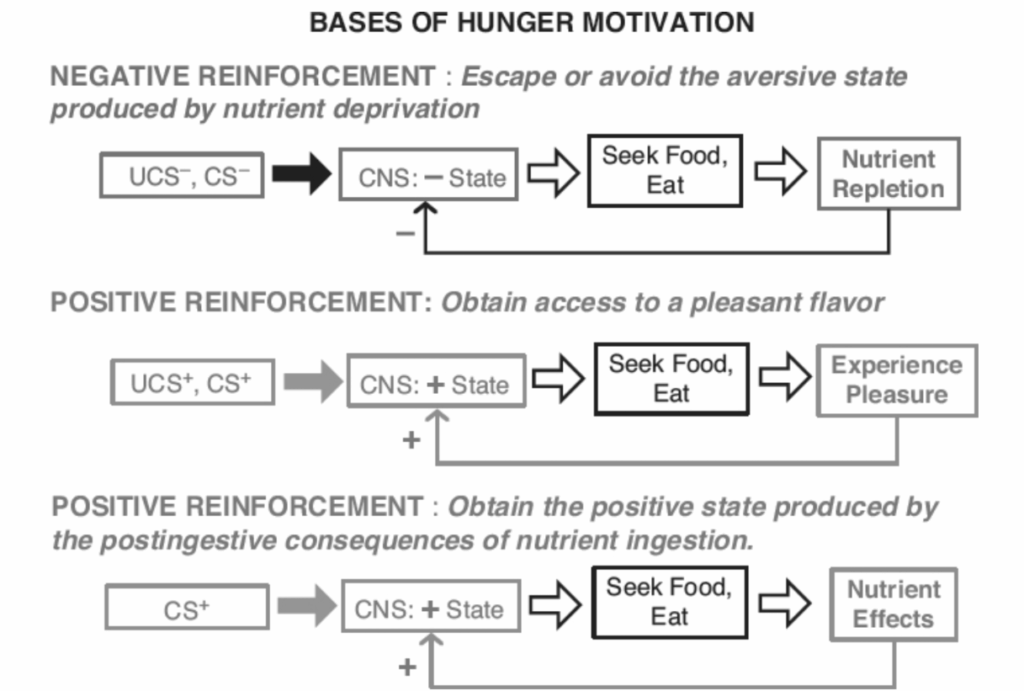
食事開始の信号
図1.17-1. 食物探索、食事開始、摂食を説明するために考案された空腹感の動機付け構造
この図は、食物探索、食事開始、および摂食を説明するために考案された、空腹感の動機付けの3つの異なる概念を示しています。
上段:負の強化による空腹感 これは、栄養枯渇や恒常性維持の必要性によって生じる古典的な空腹感の概念です。代謝エネルギー供給やナトリウムなどの特定の微量栄養素の枯渇は、嫌悪的な中枢神経系(CNS)の状態(UCS-:無条件嫌悪刺激)につながり、適切な食物の摂取によってこの状態から逃れることができます。このような嫌悪状態は無条件の負の強化因子として作用し、経験を積むことで、当初は任意であった刺激が同様の状態を引き起こすようになります。これらの条件付けられた嫌悪刺激(CS-)は、回避と逃避の両方を可能にします。
中段:風味の快楽によって生じる正の強化による空腹感 甘い風味のような一部の風味は、接近と摂取を誘発するポジティブなCNSの状態(UCS+:無条件報酬刺激)につながります。他の風味刺激(CS+:条件付けられた報酬刺激)は、さまざまな学習メカニズムを介して同様の状態を引き起こすようになります。これは必ずしもUCSと直接関連しているわけではありません。チリペッパーのような当初は嫌悪的な風味でさえ、このようなCS+になり得ます。このようなCS+は、裕福な人々にとって最も重要な空腹感の動機付けメカニズムであると考えられます。
下段:摂取された食物によって生じる、食後の消化管(GI)または代謝効果に関連する刺激によって生じる正の強化による空腹感 これらの効果は、無条件の正の強化因子として作用するポジティブなCNSの状態を生み出し、経験を積むことで、接近と摂取を誘発する条件付けられた満腹刺激(CS+)が発達する可能性があります。このプロセスは、それを生み出す消化管および代謝刺激が満腹感を生み出すものと同一であるかどうかは明らかではないため、「食欲刺激(appetition)」と呼ばれてきました。
注記: (i) 負の強化による空腹感は負のフィードバックプロセスであるのに対し(黒い実線矢印)、正の強化による空腹感は正のフィードバックプロセスであること(灰色の矢印)。 (ii) これら3つのタイプの空腹感の動機付けすべてにおいて、条件付けられた刺激は飢餓状態なしに摂食を動機付けるようになる可能性があり、これはおそらく過食の一因となります。
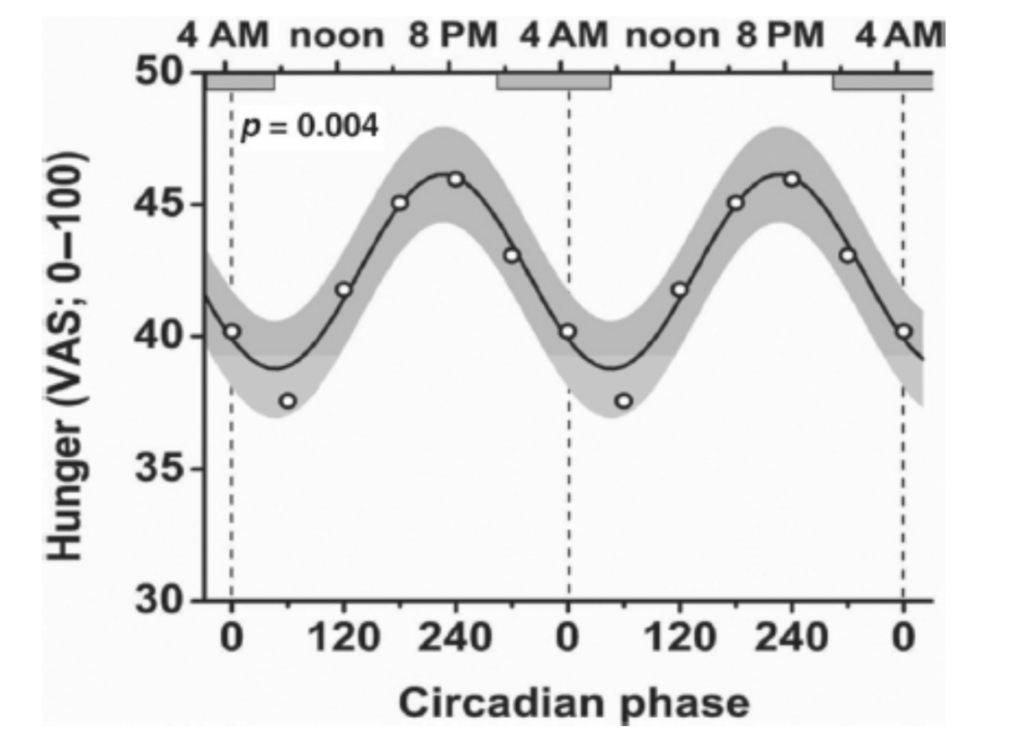
図1.17-2. 空腹感の概日リズム
この図は、健康な正常体重の男性が13日間の「強制非同期化」プロトコルを受けた際の空腹感を、視覚アナログ尺度(VAS; 0 = まったく空腹でない、100 = 極めて空腹)で評価したデータを示しています。このプロトコルでは、食事や睡眠期間を含むすべての行動が、一定の薄暗い光の下で内因性概日サイクル全体にわたって均等に配分されました。
データは二重にプロットされており、点は4時間ごとの平均評価値です。黒い線は、評価データに適合させたコサイン関数±95%信頼区間(灰色領域)を示しています。横方向の灰色の長方形は、平均的な習慣的な睡眠時間帯を示しています。
注目すべきは、空腹感の最小値が生体的な朝に、最大値が夕方に発生していること、そして**最大と最小の差が17%**であったことです。
(Shear FA, Morris CJ, Shea SA. The internal circadian clock increases hunger and appetite in the evening, independent of food intake and other behaviors. Obesity (Silver Spring). 2013;21:421-423より許可を得て転載。)
グレリンは、グレリン注入がラットやマウスの摂食潜時を短縮し、食事量を増加させることが発見された際に、内分泌性の空腹信号の候補となりました。実際、グレリンの繰り返し投与は肥満を誘発しました。動物実験は、グレリンが負の強化と正の強化の両方の空腹感を活性化する可能性を示唆しています。(1) 全身性のグレリン投与は、ラットの嗜好性の高い食物の摂取を通常の飼料よりも促進し、条件付けられた場所嗜好の形成につながったことから、グレリンが正の強化による空腹感を刺激することを示唆しています。(2) 第三脳室へのグレリン注入は、快楽的空腹感の指標であるラットの食事開始時の摂食速度には影響を与えなかったものの、動機付けの指標である漸進比試験における反応速度を増加させました。これらを合わせると、グレリンが負の強化による空腹感を誘発したことを示唆しています。これらの結果はまた、グレリンが複数の脳部位に作用して摂食を刺激することを示唆しています。グレリン受容体の存在する部位で空腹感を媒介すると考えられているのは、弓状核(ARC)、孤束核(NTS)、腹側被蓋野(VTA)、**側坐核(NAc)**であり、これらの領域については以下でさらに詳しく議論します。
生理学的内分泌シグナリングの評価
内分泌学と神経科学は、化学信号の正常な生理学的機能を特定するための基準を発展させてきました。表1.17-1は、現在の基準を示しています。基準1と2は、候補となるホルモン信号が特定の機能を制御する妥当性に対処し、基準3から5は、その十分性に関し、基準6は、その必要性に関します。グレリンのような候補内分泌信号の場合、血漿測定と静脈内注入でこれらの基準を試験するのに十分です。しかし、以下で述べるように、一部の消化管ホルモンは局所的にも作用します。消化管ホルモンの局所作用の様式には、パラクリン効果や、神経ポッドと呼ばれる腸内分泌細胞の突起と迷走神経求心性神経との間のシナプス結合が含まれます。このような局所作用の生理学的関連性を評価するには、局所環境、すなわち腸管固有層、あるいは他の神経伝達物質や神経修飾物質と同様に、シナプス間隙における測定と投与が必要です。
表1.17-1.
食事関連機能における化学信号の生理学的状態を評価するための経験的基準
- 分子の濃度が作用部位で効果と一致するパターンで変化する。
- その分子の同族受容体が作用部位に発現している。
- 内因性パターンの食事関連の変化を模倣する量の外因性分子投与が効果を生み出す。
- その分子の分泌促進物質の投与が、ホルモンの効果と同様の効果を生み出す。
- その分子の効果が、異常な行動、生理学的、または主観的効果なしに起こる。
- その分子の受容体の選択的アゴニストおよびアンタゴニストの投与が、それらの受容体薬理学と一致する効果を生み出す。
*a シグナル伝達分子には、ホルモン、サイトカイン、神経伝達物質などが含まれる。 *b 提案された信号の濃度変化は、効果に先行する必要がある。 *c 例えば、特異的かつ強力な受容体拮抗薬の投与は、空腹信号の場合は摂食を遅らせるか減少させ、満腹信号の場合は摂食を増加させるべきである。 *d この基準には、グローバルなトランスジェニックまたは自発的な遺伝子機能喪失モデルの表現型評価は含めない。これらは貴重な研究ツールであるが、発生補償効果、多面作用、種差による合併症のため、生理学的機能の「必要性」基準として使用することはできない。ただし、急速に誘発可能な組織特異的な遺伝子機能の減少は、必要性を確立する上で受容体拮抗薬の使用を補完する可能性がある。
現在、グレリンはこれらの基準の一部を満たしていますが、すべてではありません。グレリンは妥当な空腹信号であると考えられます(基準1および2)。なぜなら、動物とヒトにおいて、血漿グレリン濃度は食前に増加し、食物剥奪中に増加し、食後に減少するからです(図1.17-3)。また、グレリン受容体を含む脳領域へのグレリン注入は、動物の摂食を刺激するからです。このような効果は副作用なしに得られます(基準5)。しかし、2つの主要な基準がヒトではまだ満たされていません。食前の内因性グレリンの増加によって生じるグレリンの変化を模倣するグレリン注入が、摂食を刺激するのに十分であるかどうか(基準3)、あるいは食前の内因性グレリンシグナル伝達の拮抗が食事開始を遅らせるのに十分であるかどうか(基準6)は不明です。ただし、これらは動物では示されています。最近、内因性GHS拮抗薬である肝臓エンリッチ抗菌ペプチド2(LEAP2)が、摂食と体重に伴うグレリン濃度の変化とは逆方向にレベルを変化させることが発見されました。これは、摂食開始の重要な刺激がグレリン/LEAP2比である可能性を示唆しています。
食事の維持
風味の快楽
食事中の摂食の維持は、上記でレビューした空腹感プロセスの継続的な影響と、ポジティブな風味の快楽による摂食刺激効果に起因するとされています。摂食中に生じる風味刺激は、口腔咽頭にある嗅覚(脳神経I)、味覚(VII, IX, X)、体性感覚(V)受容体から生じます。風味刺激は、(1) 食物の検出と選択、(2) 主にポジティブまたはネガティブな快楽プロセスを介した摂食の刺激または抑制(おそらく上記で議論した快楽的空腹感を生み出すメカニズムと重複するメカニズムを介して)、および (3) 条件付け刺激(CS)として、また甘味と脂肪風味の場合には、無条件刺激または強化刺激として、連想学習プロセスに寄与します。重要な例は、学習されたインセンティブ顕著性です。このプロセスでは、好まれる風味に関連する刺激の知覚顕著性(salience)と価(valence)が経験とともに増加し、それらの風味を持つ食品の識別、選択、摂取の増加につながります。
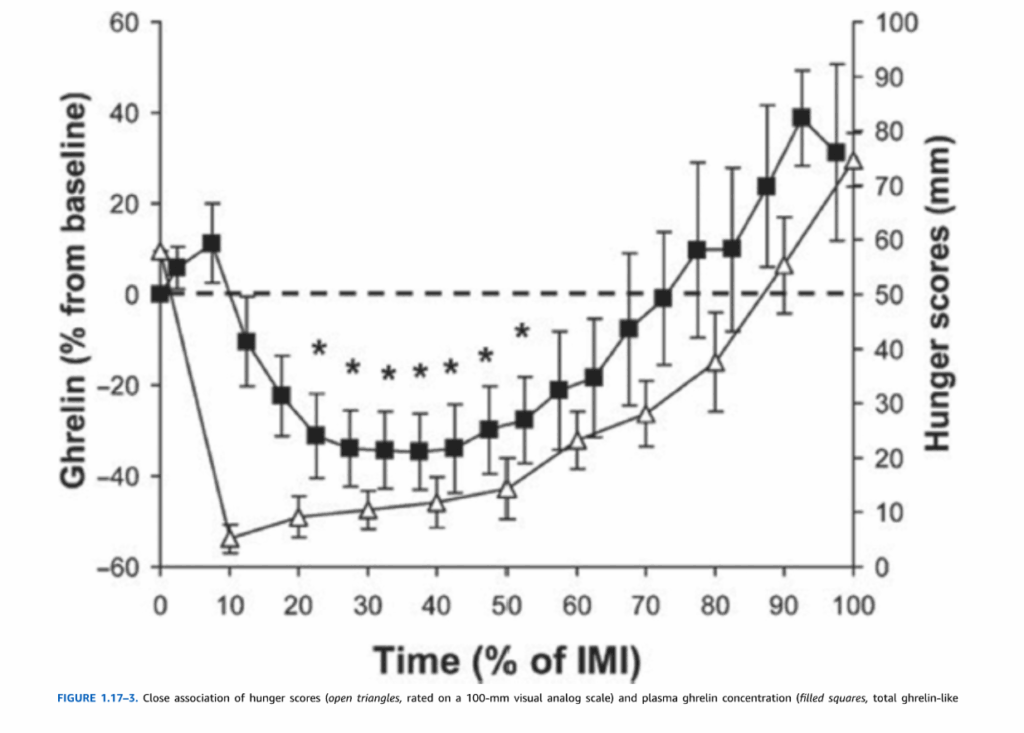
図1.17-3. 空腹度スコアと血漿グレリン濃度の密接な関連性
この図は、健康な正常体重の男性6名を対象に、昼食開始(時間0%)から自由にリクエストされた夕食(時間100%)までの間隔における、空腹度スコア(白い三角、100mmの視覚アナログ尺度で評価)と血漿グレリン濃度(黒い四角、総グレリン様免疫反応性)の関連性を示しています。平均的な昼食量は800kcal、平均的な昼食時間は20分、平均的な食事間隔は359分でした。
データは平均値±標準誤差で示されています。ベースラインは昼食開始時の値です。アスタリスク(*)は時間0%と有意に異なることを示します。
(Cummings DE, Fayo RS, Marmonier C, Aubert R, Chapelot D. Plasma ghrelin levels and hunger scores in humans initiating meals voluntarily without time- and food-related cues. Am J Physiol. 2004;287(2):E297. doi:10.1152/ajpendo.00582.2003より許可を得て転載。)
精神物理学
風味の快楽の主観的側面は、しばしば視覚アナログ尺度(VAS)で測定されます。一般的な方法としては、被験者に「まったく〜でない」と「極めて〜である」と両端に表示された100mmの線に印を付けて、ある風味がどれだけ快いかを示すよう指示します。ほとんどの被験者は信頼性があり一貫したVAS評価を行いますが、神経性食欲不振症の患者はしばしばそうではありません。さらに、VAS評価は個人差に対して比較的鈍感であり、男性対女性、肥満の有無など、尺度を異なる方法で使用する可能性のある異なる種類の被験者間の比較には適していないことが明らかになっています。この問題は、極端な値があらゆる種類の最も強い想像しうる情動経験で表示された一般化された尺度を使用することで回避できます。
シャム摂食と短時間アクセス摂食
シャム摂食(Sham eating)と短時間アクセス摂食(brief-access eating)テストは、食後効果がない状態で風味刺激による摂食制御を単離するために設計されています。ラットにおける短時間アクセステストの洗練された方法は、異なる流体の舐め量を、繰り返し10秒間の提示期間中に測定することを含みます。提示順序はランダム化されており、流体は通常通り胃に入りますが、それらの混合物によって特定の風味と食後効果との関連付けが妨げられます。
シャム摂食は、食後の食物刺激を完全に排除します。これは、胃に外科的に挿入された胃瘻チューブを持つラットで行われます。このチューブを開くと、液体食物が胃に蓄積したり腸に有意な量が入ったりするのではなく、排出されます。ラットの甘い溶液や油性乳剤に対する短時間アクセスとシャム摂食による摂取量は、広い濃度範囲にわたって線形に増加し、風味の快楽が摂食に及ぼす強力な効果を示しています(図1.17-4)。
ヒトにおけるシャム摂食は、被験者に食べ物を口に入れ、飲み込まずに吐き出すことで簡単に行われます。この方法は、神経性食欲不振症や神経性過食症の女性に成功裏に用いられてきました。興味深いことに、摂食障害の既往がない女性と比較して、神経性過食症の女性ではシャム摂食に対する高い傾向が明らかになりました。
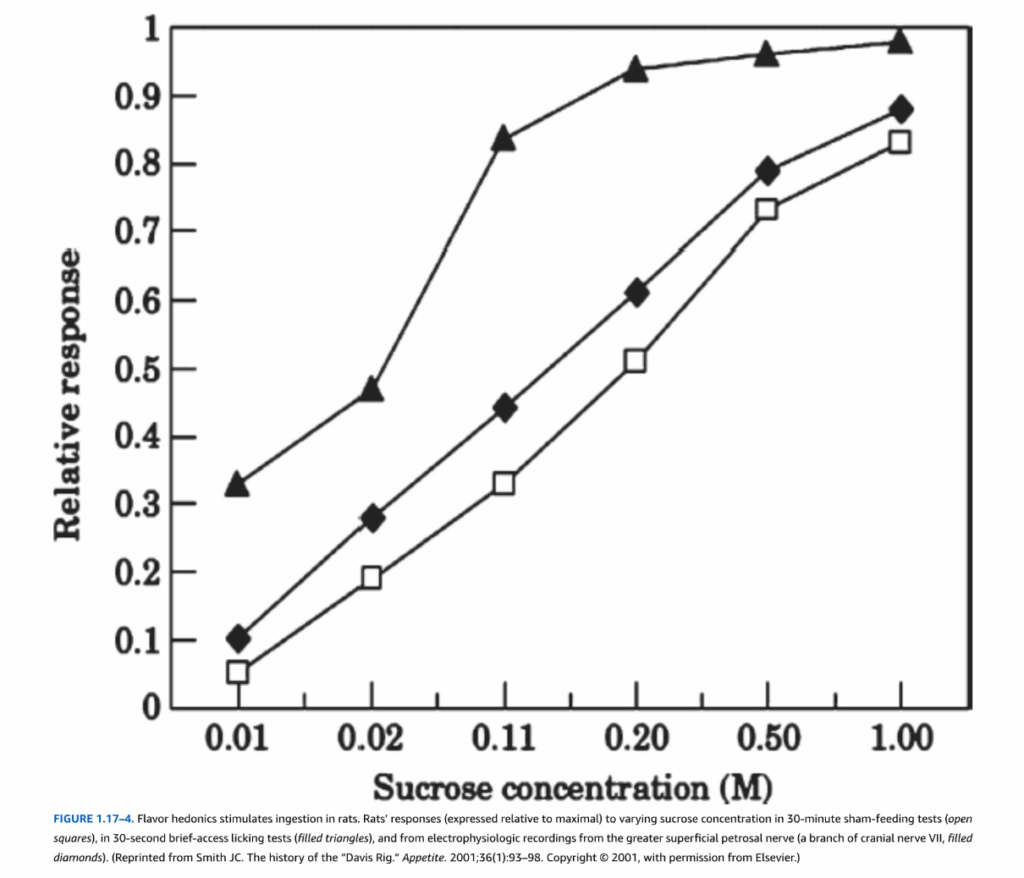
図1.17-4. 風味の快楽はラットの摂取を刺激する
この図は、ラットがさまざまなスクロース濃度に対して示す反応を、30分間のシャム摂食テスト(白い四角、最大値に対する相対値)、30秒間の短時間アクセス舐めテスト(黒い三角)、および大浅錐体神経(脳神経VIIの枝、黒いひし形)からの電気生理学的記録から得られたデータで示しています。
(Smith JC. The history of the “Davis Rig.” Appetite. 2001;36(1):93-98. Copyright @ 2001, Elsevierの許可を得て転載。)
飢餓がない状態での摂食
**飢餓がない状態での摂食(EAH)**とは、嗜好性の低い食物で満腹感が得られた後に、快楽によって駆動される摂食を指します(表1.17-2)。小児のEAHは、標準的な食事の後にスナック菓子を提供することで評価され、過体重や肥満と強く関連しています。EAHは、負の強化による空腹感が存在しないと推定される場合にのみ言及されることに注意してください。したがって、「快楽的空腹感(hedonic hunger)」の方がより曖昧さが少ないでしょう。
風味の快楽の生得的および学習された側面
基本的な味覚刺激に対する一部の嗜好(甘味)と嫌悪(苦味や酸味)は生得的であるように見えますが、フレーバーの大部分に対する嗜好と嫌悪は主に学習によって形成されます。食物の消化管および代謝の結果は、このような学習を強化することができます。これは、条件付けられた満腹感、条件付けられた嫌悪感(急性上部消化管疾患に関連する風味に対する顕著な嫌悪感を含む)、および「特異的飢餓」(栄養欠乏状態で学習され得る、一部のビタミンやミネラルを含む食物に関連する風味への嗜好)において発生します。これらの状況では、ナトリウム枯渇時のナトリウム食欲を除いて、学習される内容には快楽反応の増加または減少が含まれますが、重要となるのは風味刺激の快楽的側面よりも弁別的側面であることに注意してください。
ヒトの風味の嗜好はまた、食物の栄養的または生理学的特性とは無関係に、さまざまな食物に付随する情動的、認知的、文化的関連性から生じます。ほとんどの個人は、特定の食物に対する特に強い嗜好、あるいは**切望(craving)**を強く支持します。これらは個人の食物摂取の定常レベルと治療的食事療法への遵守に劇的な影響を与えるため、ヒトの食物嗜好の起源と可塑性は重要な研究課題です。
表1.17-2.
「飢餓がない状態での摂食」の2つの実証例
| 食事 | 標準食(kcal) | 大量選択食(kcal) |
|---|---|---|
| 食事量 | 861 ± 30 | 1,309 ± 55* |
| EAH | 365 ± 20 | 295 ± 18 |
Google スプレッドシートにエクスポート
思春期の被験者に、まず昼食として、ビュッフェ形式の多種多様な昼食メニュー、またはそのサブセットの食品(チキンナゲット、ブドウ、ベビーキャロット、トルティーヤチップス、クッキー、2%脂肪乳など)を過剰に提供する単一の標準食のいずれかが提供されました。被験者は空腹でなくなるまで食べ、終了したら部屋を出るように指示されました。多様性の効果に注目してください。被験者は大量選択条件下で有意に多くの食事を摂取しました(*)。「飢餓がない状態での摂食」(EAH)を測定するために、被験者には食後30分後に、予想外に新しい嗜好性の高いスナック食品が提供されました。最初の食事の種類にかかわらず、300〜400 kcal多く摂取したことに注目してください。ただし、条件間で有意差がありました(’)。データは平均値±標準誤差です。(Shomaker LB, Tanofsky-Kraff M, Zocca JM, et al. Eating in the absence of hunger in adolescents: intake after a large-array meal compared with that after a standardized meal. Am J Clin Nutr. 2010;92:697より。)
多様性
多様性は、摂食に対する強力な快楽的制御因子です。栄養的に類似した異なる嗜好性の高い風味を持つさまざまな食物を提供すると、唯一の最も好まれるものを含む単一の選択肢を提供する場合よりも、より多くの食事につながります。表1.17-2にその例を示します。摂取に対する多様性の効果は、感覚特異的満腹感と呼ばれ、最近摂取された食品に対する嗜好が、最近摂取されていない食品に対する嗜好と比較して低下することを反映しています。風味の多様性は、ラットの摂取量を恒常的に増加させ、体重を増加させる可能性があります。
慣れ
慣れは、風味の嗜好を条件付けるのに十分です。この現象は、嗜好される食品の顕著な文化的多様性、それらが食べられる社会的状況や時間帯などを説明する可能性が高いです。例えば、美味しくないと感じる食物に繰り返し直面し、大人が楽しんで食べているのを見る子供たちは、同様にそれらを楽しんで食べるようになることを学習します。この学習は、特に幼い子供に強い**新しい風味を避ける生得的な傾向(新奇恐怖)**を克服する必要があります。
社会的促進
知人と一緒に食事をすると、一人で食事をする場合と比較して摂取量が著しく増加しますが、見知らぬ人と食事をする場合には促進効果は明らかではありません。人々が他者と一緒に食事をする頻度を考えると、この効果の特徴とメカニズムは分析に値します。
個人差
ヒトの味覚能力の多様性は、快楽における個人差の源です。例えば、前舌の茸状乳頭の密度は通常、女性の方が男性よりも高く、これは苦味と甘味の知覚および快楽における個人差と性差の両方と関連しています。さらに、甘味または苦味の味覚能力の個人差は、さまざまな風味の快楽価(valence)と関連しています(図1.17-5)。このような快楽の差は、**肥満度指数(BMI; 体重kg/身長m$^2$)**と関連しており、これらが食事量とカロリー摂取量を恒常的に増加させることを示しています。最近の研究では、甘味嗜好の程度と手術後の変化が、ルーワイ式胃バイパス術による体重減少の予測因子として機能する可能性が示されており、嗜好の変化がカロリー摂取量の調節に役割を果たす可能性を示唆しています。
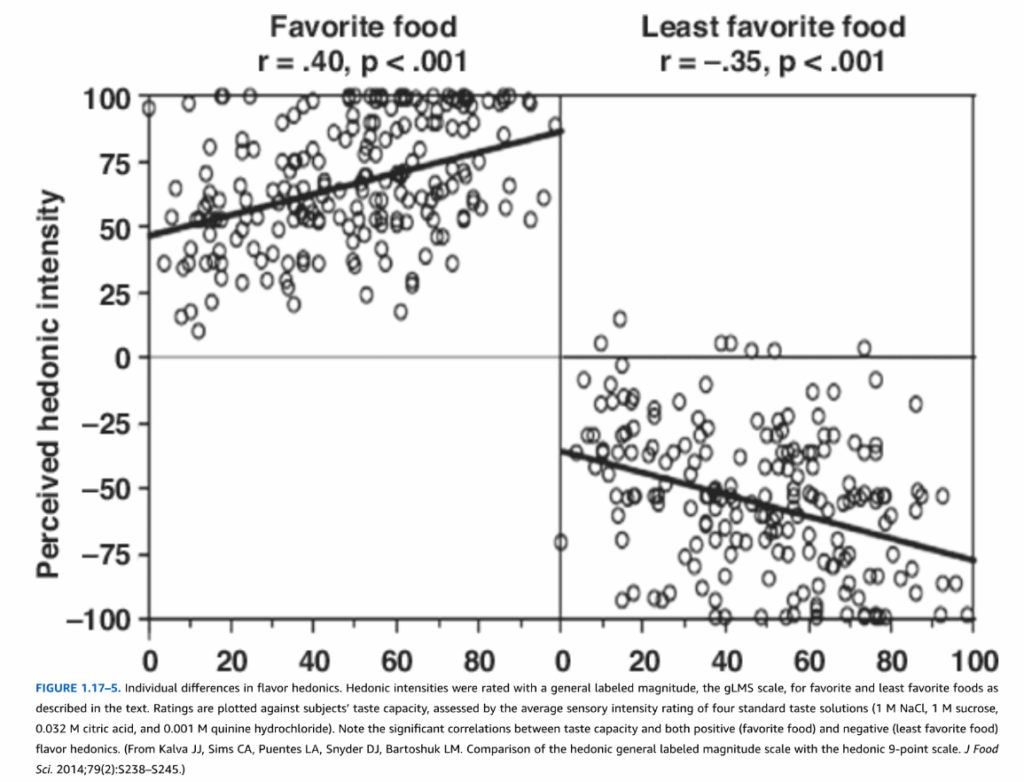
図1.17-5. 風味の快楽における個人差
この図は、テキストで説明されているように、最も好きな食べ物と最も嫌いな食べ物に対する快楽強度を、一般標識量尺度(gLMS尺度)で評価したものです。評価値は、被験者の味覚能力に対してプロットされています。味覚能力は、4つの標準的な味覚溶液(1 M NaCl、1 M スクロース、0.032 M クエン酸、および0.001 M キニーネ塩酸塩)の平均感覚強度評価によって評価されました。
味覚能力と、正の(好きな食べ物)および負の(嫌いな食べ物)風味の快楽の両方との間に有意な相関があることに注目してください。
(Kalva JJ, Sims CA, Puentes LA, Snyder DJ, Bartoshuk LM. Comparison of the hedonic general labeled magnitude scale with the hedonic 9-point scale. J Food Sci. 2014;79(2):S238-S245より。)
満腹感と食後満腹感
食事中に起こり、食事の終了に寄与する摂食抑制プロセスは、満腹(satiation)プロセスとして知られています。これらは、その後の食事間隔中に摂食を抑制する、より長く持続するプロセスである食後満腹(postprandial satiety)プロセスまたは食事間満腹(across-meal satiety)プロセスとは区別されます。一部の信号は両方に寄与するように見えるため、これらのプロセスはまとめて議論されます。
胃の機械受容
摂食制御における胃および胃後部の信号の実験的解剖は困難ですが、様々な証拠が、胃の容積が張力と伸展または長さの両方に調整された機械受容器を介して満腹に直接寄与することを示しています。例えば、(1) 画像研究は、満腹感と胃容積との間に有意な相関を明らかにしました。(2) 食事に空気を混ぜて容積を増やすと、食事量が減少しました。(3) 食品に水を混ぜ込むと、胃容積がより高いレベルで維持され、満腹感が増加し、同じ量の食物と水を別々に摂取した場合よりもその後の摂取量が減少しました。胃の機械受容器は、主に迷走神経求心性神経によって脳と連結されています。
腸の栄養素感知
小腸内の食物刺激は、機械受容器、浸透圧受容器、化学受容器を活性化し、多くの強力な満腹信号を開始します。最も重要なのは、グルコース、脂肪酸、アミノ酸、その他の消化産物の検出に調整された化学受容器です。これらの栄養センサーによって生成される負のフィードバック信号は、内分泌経路と神経経路を介して脳に伝達され、その一部は以下に記述されています。
経口負荷は、食物の代謝エネルギー含有量、栄養組成、結合性および浸透圧特性などが、その満腹効果にどのように寄与するかを調査するために使用できます。混合栄養素の負荷が使用される場合、摂食量の減少はしばしば負荷のサイズ、つまりその代謝可能なエネルギー含有量に比例します。しかし、負荷のマクロ栄養素組成が異なる場合、タンパク質は通常、カロリーベースで炭水化物や脂肪よりも満腹効果が高いです。十二指腸内および静脈内注入の比較は、腸内信号が食後信号よりも強力に摂食を抑制することを示しています。例えば、全身のグルコースレベルに同一の増加をもたらす十二指腸内および静脈内グルコース注入の一比較では、十二指腸内グルコースのみが食前の空腹度評価を低下させ、静脈内グルコースは低下させませんでした。
次のセクションでは、満腹感と食後満腹感に寄与すると考えられる多くの腸管ホルモンのうち、わずか3つについて記述します。満腹のための多数のシグナル伝達メカニズムが考えられることは、それらの相互作用と、様々な正常および異常な状況における相対的な寄与という疑問を提起します。しかし、これらの疑問についてはまだほとんど知られていません。最後に、消化管ホルモンの末梢起源と、ほとんどの場合、摂食に対する末梢作用部位は、薬理学的治療の開発のための魅力的な標的となっています。
コレシストキニン
**コレシストキニン(CCK)**は、小腸の腸内分泌細胞から分泌されます。CCK分泌は、グルコースおよび他の糖類、アミノ酸、長鎖脂肪酸によって刺激されます。分泌は食後すぐに始まり、通常、食事間隔中に基礎レベルに戻ります。
CCKの内分泌性満腹信号としての役割は、他に類を見ないほど確立されています。食後の血漿レベルを模倣する静脈内CCK注入は、男性と女性において有害な身体的または主観的効果なしに食事量を減少させました(表1.17-1、基準3)。十二指腸内脂質注入は満腹感を刺激し、これはCCKA受容体拮抗薬によって逆転しました(基準4および6)。また、拮抗薬単独の注入は食事量を増加させました(基準6)(図1.17-6)。他の仮説上の内分泌摂食制御に関して、ヒトで同等の拮抗効果は報告されていません。最後に、CCKA(またはCCK1)受容体のヌル変異を持つごく一部の個人は極度の肥満であり、より一般的なCCKA受容体多型は、食事量の増加、食物摂取量の増加、および肥満と関連しています。CCKは動物においても正常な生理的満腹信号の基準を満たしています。実際、ラットとマウスにおけるCCK研究は、動物モデルにおける摂食制御の研究のパラダイムとなっています。
CCKは、食事量の高度に特異的な、用量依存的な減少を誘発します。その特異性は以下によって示されます。(1) CCKは、液体食物の摂取を抑制する条件下でも、水剥奪ラットの水分摂取を抑制しません。(2) CCKは、胃瘻チューブが開いた状態でシャム摂食を行っているラットにおいて、食後のグルーミングや睡眠を含む満腹の行動的兆候を誘発します。これらのラットは、そうでなければ本質的に無限にシャム摂食を続けます。(3) CCKは、異食症や条件付けられた味覚嫌悪の形成といった病気の兆候なしに食物摂取量を減少させることができます(もちろん、大量投与は病気を誘発する可能性があります)。要約すると、CCKは満腹の自然なプロセスにおける重要な部分であることを広範なデータが示しています。これらのデータはまた、満腹を制御する生理学的システムが、いかに複雑であっても、完全に冗長ではないことも示しています。
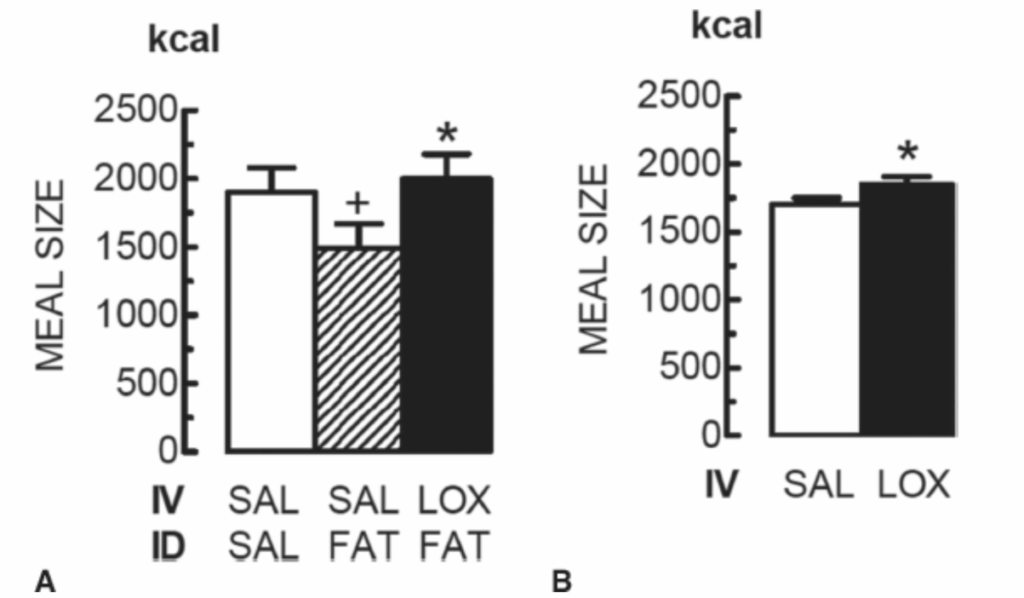
図1.17-6. CCKA受容体拮抗薬研究からの、内因性CCKが生理学的満腹信号であることの証拠
この図は、内因性コレシストキニン(CCK)が生理学的な満腹信号であることを示唆する、CCKA受容体拮抗薬であるロキシグルミド(LOX)を用いた2つの研究結果を提示しています。
A: ロキシグルミド(LOX)が、脂肪乳剤の十二指腸内(ID)注入によって刺激された内因性CCKの満腹作用を拮抗した例 健康体重の成人男性が、標準的な朝食の4時間後、10 µmol・kg⁻¹・h⁻¹のLOXまたは生理食塩水(SAL)の静脈内(IV)注入開始から90分後、および0.4 mL・min⁻¹のコーン油(FAT)またはSALのID注入開始から60分後、さらに低脂肪バナナミルクシェイク400 mLの経口プリロード(バナナはCCK分泌を誘発しないため使用された)から20分後に、昼食ビュッフェを開始しました。注入は食事中継続されました。ID脂肪注入は昼食の食事量を有意に減少させ(+)、この効果はLOXによって逆転しました(*)。いずれの条件下でも、身体的または主観的な副作用は発生しませんでした。(データはMatzinger D, Gutzwiller JP, Drewe J, et al. Inhibition of food intake in response to intestinal lipid is mediated by cholecystokinin in humans. Am J Physiol. 1999;277:R1718より。)
B: CCKA受容体拮抗薬であるLOXによるCCKシグナル伝達の拮抗が摂食を刺激した例 健康体重の成人男性が、標準的な朝食の4時間後、および22 µmol・kg⁻¹・h⁻¹のLOXまたはSALのIV注入開始から60分後に、昼食ビュッフェを開始しました。注入は食事中継続されました。LOXは、身体的または主観的な副作用なしに食事量を有意に増加させました(*)。(データはBeglinger C, Degen L, Matzinger D, D’Amato M, Drewe J. Loxiglumide, a CCK-A receptor antagonist, stimulates calorie intake and hunger feedings in humans. Am J Physiol. 2001;280(4):R1149より。)
CCKは、幽門領域、肝臓、および脳のCCKA受容体に作用して満腹を誘発すると考えられています。少なくともラットでは、CCKは吸収前に腸管固有層で局所的に作用して満腹を誘発します。例えば、毛細血管から固有層に拡散すると推定される小分子CCKA受容体拮抗薬の静脈内注入は食物摂取量を増加させましたが、血管外に出ないCCK抗体の注入は増加させませんでした。腹部CCKA受容体の活性化は、フィードバック情報を孤束核(NTS)に中継する迷走神経求心性ニューロンを刺激します。
グルカゴン様ペプチド-1
**グルカゴン様ペプチド-1(GLP-1)は、小腸と大腸の両方の腸内分泌細胞、およびごく少数の孤束核(NTS)ニューロンによって産生されます。3つの主要栄養素すべてが腸のGLP-1分泌につながります。分泌されたGLP-1は、毛細血管内皮細胞の管腔表面、肝臓、および血液中に見られるプロリン/アラニン特異的ペプチダーゼであるジペプチジルペプチダーゼ-IV(DPP-IV)**によって急速に不活性化されます。これにもかかわらず、CCKとは対照的に、GLP-1の分泌と血漿レベルは食後数時間上昇し、夜間のみ基礎レベルに戻ります。したがって、GLP-1は、満腹信号、食後満腹信号(すなわち、次の食事の開始を遅らせる)、または食事間満腹信号(すなわち、次の食事の量を減少させる)として機能する可能性があります。腹部迷走神経求心性神経およびおそらく脳のGLP-1受容体が、GLP-1の満腹を媒介します。
GLP-1がヒトにおいて満腹を伝える信号であるかどうかは、まだ完全に確立されていません。満腹効果と一致して、生理学的用量のGLP-1の静脈内注入は、正常体重の男性において副作用なしに食事量を減少させました(女性ではテストされていません)。しかし、2つのテストでは、GLP-1受容体拮抗が食事量を増加させることができませんでした。ただし、同じ拮抗薬は他のテストではインスリン分泌と血糖値に明確な影響を与えました。GLP-1の正常な満腹信号としての地位は、いくつかの理由からさらなる研究に値します。(1) GLP-1拮抗がグルカゴンとPYY(3-36、後述)の分泌を刺激した可能性があり、それが脱満腹効果を妨げた可能性があります。(2) 同じ拮抗薬がラットとマウスのいくつかのテストで摂食を増加させました。(3) 拮抗薬が満腹に重要である可能性のある固有層のGLP-1受容体に到達しなかった可能性があります。(4) GLP-1が食事間の摂食制御として機能する可能性が明示的にテストされていません。(5) リラグルチド(VictozaまたはSaxenda、Novo Nordisk)やセマグルチド(Ozempic、Novo Nordisk)のような長期作用型GLP-1アゴニストは、末梢と脳の両方の作用部位を介して、肥満患者の摂食と体重を減少させます。
ペプチドチロシンチロシン
**ペプチドチロシンチロシン(PYY)を分泌する腸内分泌細胞は、主にCCK細胞やGLP-1細胞よりも遠位に位置するため、食後の血漿レベルはよりゆっくりと増加します。3つの主要栄養素すべてがPYY分泌を刺激し、長鎖脂肪酸が最も強力です。DPP-IVは分泌されたPYY(すなわちPYY[1-36])に作用して、活性型であるPYY(3-36)**を産生します。興味深いことに、ラットでは、PYY(3-36)の末梢投与は選択的にY2受容体を刺激し、摂食を抑制しますが、PYY(1-36)の中枢投与は他のY受容体タイプを刺激し、摂食を刺激します。
PYY(3-36)の食後満腹における役割は、標準的な食事後に開始され、試験食前に終了する食事間注入を用いてテストされてきました。これらのテストは病気の兆候なしに摂食量の減少をもたらしましたが、投与量が生理学的であったかどうかは不明でした。食事中の生理学的用量を超えるPYY(3-36)の注入も摂取量を減少させましたが、この場合、被験者は通常病気になりました。したがって、PYY(3-36)が摂食制御に正常な役割を果たしているかどうかは不確かです。この問題に関する将来の研究では、PYYが神経ポッドシグナル伝達を介して局所的にシグナルを送る可能性に焦点を当てること⁸が重要となるでしょう。
迷走神経求心性シグナル伝達
様々な末梢の摂食抑制フィードバックは、迷走神経求心性神経を介して脳に伝えられます。迷走神経求心性神経終末は、消化管のほとんどの領域の固有層に密に神経支配しており、肝臓傍神経節、門脈、胆管には疎に神経支配しています。内臓神経の脊髄内臓求心性神経は同様の神経支配パターンを持っていますが、摂食におけるその役割はあまり理解されていません。腹部迷走神経求心性神経は、グルコースやその他の消化産物、CCK、GLP-1、その他のホルモン、およびセロトニン(5HT)や食物刺激によって放出されるその他のシグナル伝達分子によって刺激されます。満腹におけるそれらの重要性は、ラットにおける感覚腹部迷走神経線維の選択的切断後に食事量が増加することに反映されています(表1.17-3)。完全な迷走神経切断は、迷走神経遠心性神経の喪失によって引き起こされる消化管運動機能の障害のため、食事量の増加につながらない可能性があります。
迷走神経求心性神経は、神経信号を脳に中継するだけでなく、統合も行います。例えば、ラットでは、(1) 一部の個々の迷走神経求心性線維は、胃の充満とCCK注入の両方によって刺激され、両者の組み合わせは迷走神経反応を大幅に増幅します(図1.17-7)。(2) 他の線維はグレリンとCCKの両方に敏感であり、これら2つの機能的拮抗刺激は、純粋な迷走神経電気生理学的反応を決定するために合計されます。孤束神経節の迷走神経求心性細胞体も、食欲促進性および食欲抑制性ペプチドと受容体のmRNA発現パターンが栄養状態によって変化するという点で、統合的特性を示します。迷走神経(および脊髄内臓)求心性神経は、中枢神経系セクションで記述されたように、NTSに投射します。最近のマウス研究では、迷走神経求心性線維の機能に左右差があることが示唆されており、左側の孤束神経節から発生する線維は満腹フィードバックを媒介し、右側の孤束神経節から発生する線維は摂取の報酬または食欲刺激側面を媒介します。
表1.17-3.
横隔膜下迷走神経求心性神経切断(SDA)がラットの自発的な食事量の慢性的な増加につながる例
| 食事量(舐め回数) | 食事間隔(分) | |
|---|---|---|
| 対照 | 1,657 ± 109 | 78 ± 6 |
| SDA | 2,309 ± 102* | 92 ± 5* |
Google スプレッドシートにエクスポート
横隔膜下迷走神経求心性神経切断(SDA)は、脳幹での片側性背側迷走神経後根切断と、対側脳幹から発生する同側腹部迷走神経幹の切断を組み合わせたものです。ラットは液体食(Ensure, Ross Laboratories)で維持されました。対照ラットにはシャム手術が施されました。SDAは自発的な食事量を約1/3増加させ(*)、食事間隔を約15%増加させました。これはおそらく、食事量の増加に対応したものです。データはSDA手術後3週目の3日間の平均値であり、平均術後体重と体重増加率は術前値に達していました。平均±標準誤差で示されています。(Schwartz GJ, Salorio CF, Skoglund C, Moran TH. Gut vagal afferent lesions increase meal size but do not block gastric preload-induced feeding suppression. Am J Physiol. 1999;276:R1623より許可を得て改変。)
エネルギー恒常性
脂肪組織とエネルギー恒常性
体には、エネルギー代謝のためのオンライント基質(online substrates)と貯蔵基質の両方が存在します。これら両方は恒常的に調節されています。オンライントエネルギー基質は、血液中を循環し、細胞に取り込まれてATPを生成するために使用される代謝物です。最も顕著なのは血糖値であり、そのレベルは積極的に調節されています。貯蔵エネルギー基質には、筋肉と肝臓のグリコーゲンが含まれ、これは数千カロリーに相当し、健康な体重の人の脂肪細胞に貯蔵されているトリアシルグリセロールは、70,000kcal以上にもなります。ほとんどの人が成人期を通じて示す体重の相対的な恒常性、その間に脂肪組織に貯蔵されるカロリーの約10倍のカロリーを毎年摂取していることから、脂肪組織量が生理学的に調節されていることが強く示唆されます。エネルギー貯蔵の摂食への影響は、主に食事量の制御を介して媒介されます。最近の研究は、エネルギー貯蔵による摂食制御が、単純な負のフィードバック制御システムによって正確にモデル化できることを示しています。同時に、多くの社会における2型糖尿病と肥満の流行率は、これらの社会のライフスタイルが、血糖値と脂肪組織量の調節能力を過剰摂取に対応できる能力を超えて圧迫していることを示しています。脳が脂肪組織量の増加を検出するために使用するフィードバック信号は、まだ特定されていません。
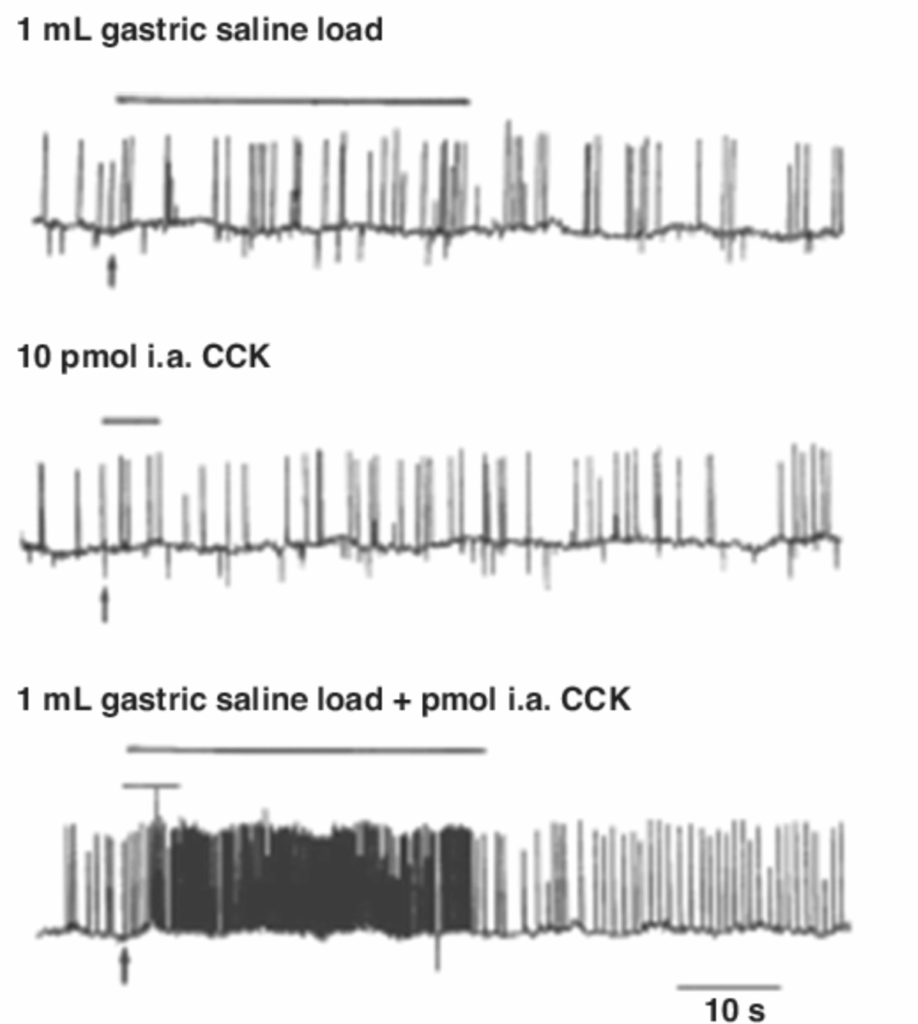
図1.17-7. 麻酔下のラットにおける胃の機械受容とCCKの迷走神経求心性シグナル伝達への相乗効果
この図は、麻酔下のラットにおける単一迷走神経求心性ニューロンの活動電位の細胞外記録データを示しています。これらのデータは、胃内生理食塩水負荷(1 mL)と動脈内(i.a.)10 pMol CCK注入に対する反応として得られました。
(Schwartz GJ, McHugh PR, Moran TH. Gastric loads and cholecystokinin synergistically stimulate rat gastric vagal afferents. Am J Physiol. 1993;265:R872-R872より転載。)
レプチン
レプチンは、脂肪細胞からその容積に比例して分泌されるホルモンです。レプチンのエネルギー恒常性における役割は、体重減少に対する防御であり、過体重に対する防御ではありません。つまり、通常のレベルを下回るレプチンレベルの低下は、摂食を増加させ、エネルギー消費を減少させるのに十分ですが、通常のレベルを上回るレプチンレベルの増加はほとんど効果がありません。「通常のレベル」とは、生物が適応しているレベルを意味します。したがって、長期にわたる肥満の人は、レプチンレベルが非肥満の人よりもはるかに高いレベルに低下した場合でも、摂食を増加させ、エネルギー消費を減少させます。このような適応のために安定した体重レベルをどのくらいの期間維持する必要があるかは不明です。レプチンの生理学は、レプチン単独療法が肥満に対して無効であることを示しています。しかし、アミリン、GLP-1、CCKなどの長期作用型ホルモンベースの治療法と組み合わせて投与された場合、レプチンは前臨床研究で有望な結果を示しています。持続的な体重減少に伴い、レプチンレベルは脂肪量から予測されるよりも低下します。外因性投与によるレプチンレベルの回復は、エネルギー消費を増加させ、摂食を減少させることから、レプチン療法が体重減少の維持に役割を果たす可能性が示唆されます。レプチンは血液脳関門(BBB)を介して活発に輸送され、脳の様々な部位に作用して、摂食、エネルギー消費、生殖軸機能などに影響を与えます。
食欲の脳メカニズム
摂食は、脳幹尾側から大脳皮質前頭葉まで広がる、複雑で解剖学的に拡散した神経ネットワークによって媒介されます。図1.17-8は、その一般的な組織を模式的に示しています。このネットワークに関与する多数の介在ニューロン信号分子が特定されており、ますます強力な分子遺伝学的手法と洗練された行動学的手法の適用により、少なくとも初歩的な「配線図」の構築が進んでいます。この骨の折れる作業が真に生理学的ではない、あるいはそれに完全に達していないと言うことは、批判ではありません。つまり、これらのニューロンの興奮と抑制が通常何によって引き起こされるのか、また関与するシグナル伝達分子が内因性神経分泌機能の表1.17-1の基準をどの条件下で満たすのかは、まだ明らかではありません。
脳幹
脳幹は、摂食に関連する重要な感覚、運動、および統合機能を持っています。前述のように、孤束核(NTS)は迷走神経求心性神経と脊髄内臓求心性神経を受け取ります。また、一次味覚求心性神経の標的でもあります。さらに、摂食関連情報を直接感知するさまざまな代謝物受容体やホルモン受容体(例:グレリン、GLP-1、レプチン)を発現しています。NTSはまた、最後野からの神経遠心性神経の標的でもあります。最後野は、他の脳室周囲器官と同様に、正常な血液脳関門を持たず、以下を含むさまざまな循環分子の受容体を持っています。(1) 満腹信号の候補であるホルモンアミリンの受容体。(2) 条件付けられた味覚嫌悪学習を媒介し、嘔吐反射を誘発するいくつかの毒素の受容体。(3) 浸透圧受容器。脳幹には、摂食と嚥下運動を生み出す下位運動ニューロン、下位運動ニューロンを駆動する上位運動ニューロン、およびこれらの運動を協調させる中枢パターン発生器も含まれています。したがって、摂食と嚥下の困難は、球麻痺のようにこれらの運動ネットワークに影響を与える運動ニューロン疾患の兆候です。最後に、NTSは摂食の制御に寄与する多種多様な情報を統合します。上記の感覚入力に加えて、NTSは、脳幹および視床下部の様々な領域からの投射の標的であり、その一部は以下に記述されています。
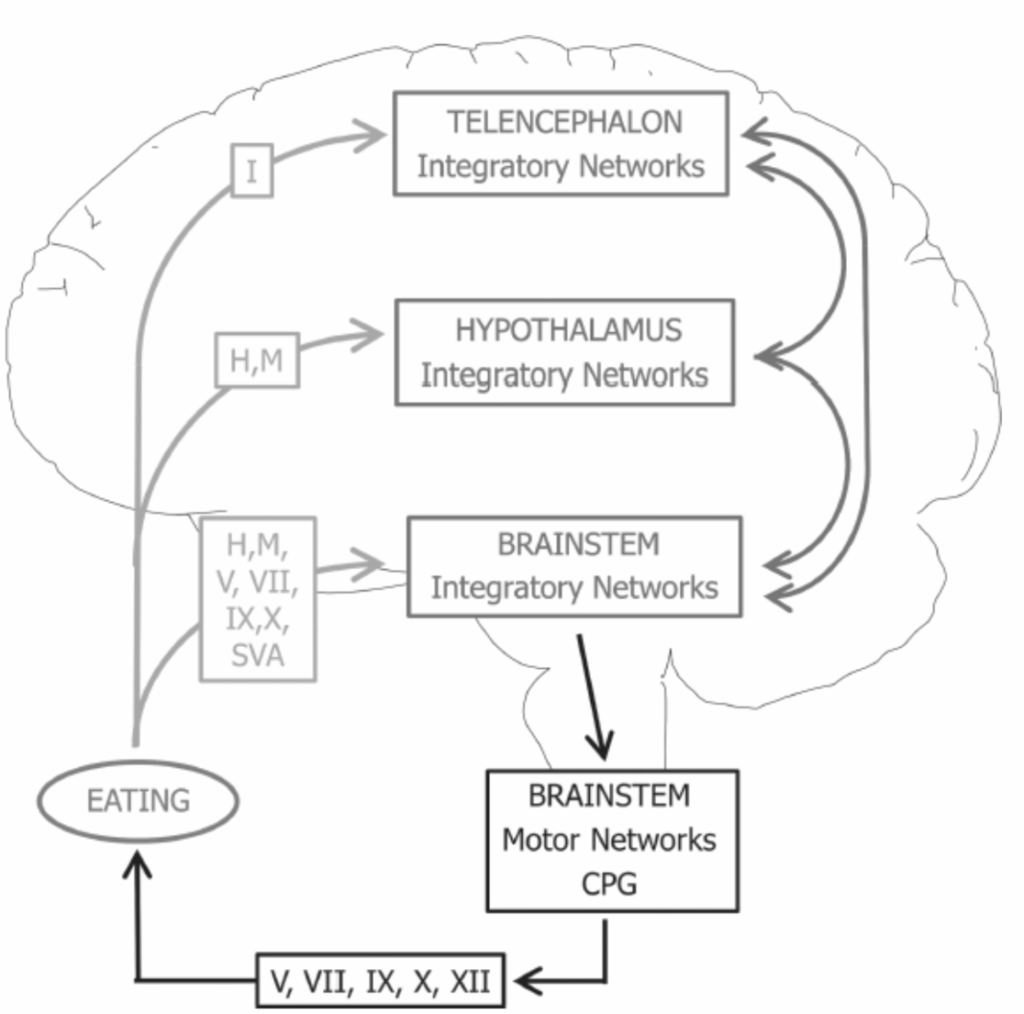
図1.17-8. 摂食制御に関与する主要な脳領域とその主な求心性接続、相互接続、および運動出力の模式図
この図は、摂食を制御する脳の主要な領域と、それらの間の繋がりを簡潔に示しています。
- 薄い灰色の矢印は、入力信号(求心性接続)を示します。
- 濃い灰色の矢印は、脳領域間の相互の接続(相互接続)を示します。
- 黒い矢印は、運動指令(運動出力)を示します。
図中の記号は以下の意味を表します。
- ローマ数字は脳神経を示します。
- Hはホルモンを示します。
- Mは代謝物を示します。
- SVAは脊髄内臓求心性神経を示します。
- CPGは中枢パターン発生器を示します。
脳幹の機能
中脳レベルで脳を切断されたラット、すなわち除脳ラットを用いたテストは、脳幹尾側の驚くべき統合能力を明らかにしています。経口カテーテルを介して液体食物が口に注入されると、除脳ラットは以下の行動を示します。
- 食事のようなパターンで食物を摂取し(口から食物を排出することで食事を終了します)、食後は無傷のラットと同様にグルーミングを行い、静止します。
- より甘い食物を次第により多く摂取します(図1.17-9)。
- 無傷のラットが好む食物とそうでない食物に関連して示す口腔顔面運動を示します。
- CCK注射後に摂食量が減少します。
- グルコース代謝の薬理学的遮断後に摂食量が増加します。
しかしながら、脳幹尾側には、自発的に摂食を開始したり、食物剥奪に応答して摂食を増加させたりする能力はありません。したがって、これらの機能には前脳が必要です。
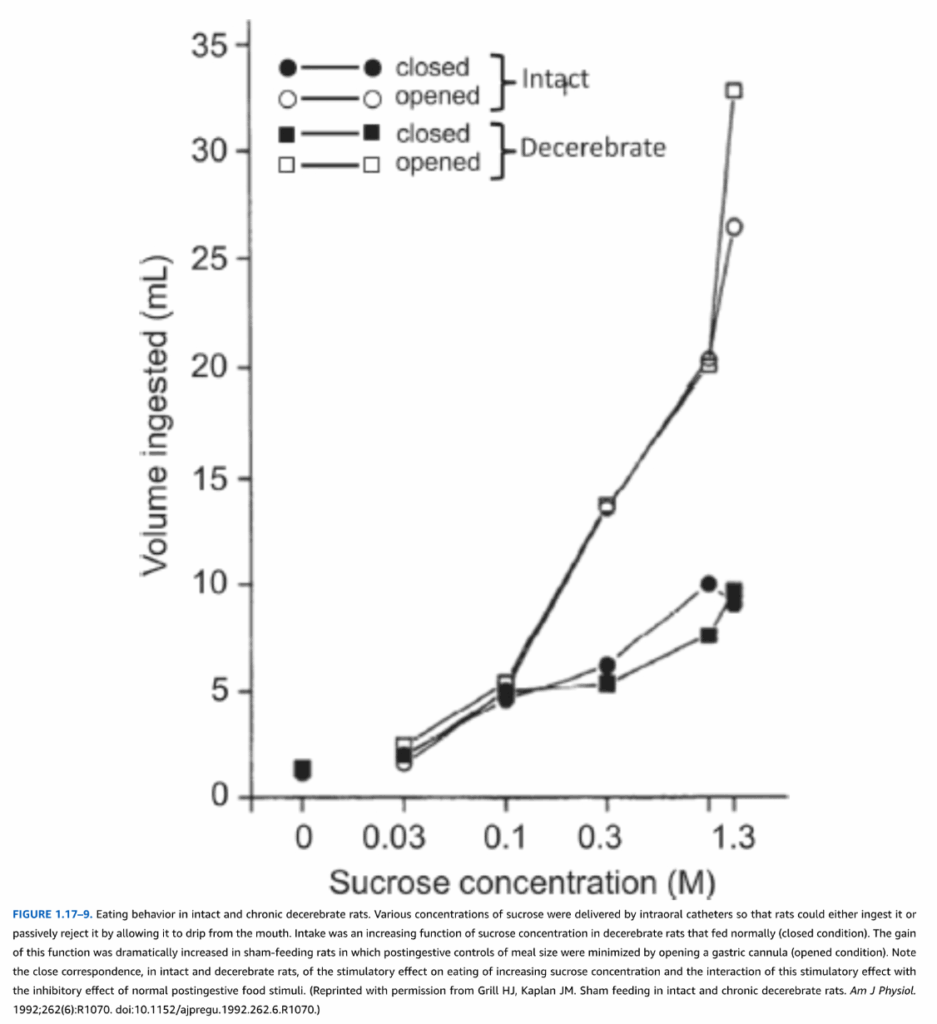
図1.17-9. 無傷および慢性除脳ラットにおける摂食行動
この図は、無傷のラットと、慢性的に除脳されたラット(中脳レベルで脳が切断されたラット)の摂食行動の違いを示しています。口腔内カテーテルを通して様々な濃度のスクロースが供給され、ラットはそれを摂取するか、口から垂れ流すことで受動的に拒否することができます。
**除脳ラット(閉鎖条件)**では、スクロース濃度が上がるにつれて摂取量が増加しました。これは正常に摂食するラットと同様の行動です。
**シャム摂食ラット(開放条件)**では、胃瘻チューブを開放することで食後の食事量制御が最小限に抑えられたため、この機能のゲイン(傾き)が劇的に増加しました。
この図は、無傷のラットと除脳ラットの両方で、スクロース濃度の上昇が摂食を刺激する効果と、この刺激効果が通常の食後食物刺激の抑制効果とどのように相互作用するかを密接に示している点に注目してください。
(Grill HJ, Kaplan JM. Sham feeding in intact and chronic decerebrate rats. Am J Physiol. 1992;262(6):R1070. doi:10.1152/ajpregu.1992.262.6.R1070より許可を得て転載。)
上行性投射
いくつかの上行性神経投射は脳幹に起源を持ちます。それぞれが摂食に関連する様々な覚醒、情動、および動機付け機能に貢献しています。
A2ノルアドレナリン作動性ニューロン
A2ノルアドレナリン作動性ニューロンは、孤束核(NTS)を含む延髄尾部の領域に細胞体を持っています。これらは複数の入力を受け取り、視床下部、大脳皮質、および脳全体の他の多くの部位に直接投射します。これらは、迷走迷走反射、満腹感(CCKによる満腹感を含む)、および情動と学習のいくつかの側面、特にストレスや病気に関連するものに貢献しています。青斑核(A4およびA6細胞群)に起源を持つノルアドレナリン作動性ニューロンは、ストレスの研究においてより注目されていますが、摂食におけるストレス関連の変化は、A2ノルアドレナリン作動性ニューロンが関与する可能性が高いです。なぜなら、これらが視床下部の室傍核(PVN)、扁桃体の中央核(CeA)、側坐核(NAc)、および摂食を媒介する他の部位により大きな入力を提供するからです。
ドーパミン
腹側被蓋野(VTA)には、中脳皮質辺縁系経路を介して多くの視床下部および終脳標的、ならびに孤束核(NTS)および他の尾側部位に投射するドーパミン作動性ニューロンが含まれています。これらの各領域もまた、VTAと相互に接続しています。このネットワークは、以下でさらに議論するように食物報酬において重要であり、その他にも多数の情動および認知機能を持っています。重要なのは、異なる脳領域におけるドーパミンは摂食に対して非常に異なる影響を与える可能性があるということです。例えば、側坐核(NAc)におけるドーパミン神経伝達は摂食を刺激しますが、脳室周囲視床下部におけるドーパミンは摂食を抑制します(この現象は、ドーパミンを拮抗する抗精神病薬が、食物摂取量を増加させることによって体重を増加させるという臨床所見を説明する可能性があります)。
セロトニン
中脳縫線核のセロトニン(5-ヒドロキシトリプタミン、5HT)ニューロンは、摂食の制御を含む情動と動機付けに関与する、もう一つの拡散性上行投射システムを形成しています。例えば、2C受容体を介した5HTシグナル伝達は、CCK、GLP-1、レプチン、および細菌毒素LPSの摂食抑制効果に関与しているとされています。これらの効果の一部は、弓状核(ARC)におけるメラノコルチンシグナル伝達(下記参照)が関与している可能性があります。
視床下部
視床下部が摂食の神経制御において重要であることは、20世紀半ばにジョン・ブロベックとその同僚が報告した、内側基底部(VMHおよびARC)および外側視床下部(LHA)の病変に起因する過食症と無食症の症候群に関する古典的な記述以来認識されてきました。当初は機能的な中枢として理解されていましたが、これらの領域と他のいくつかの視床下部領域は、現在では分散型神経ネットワークにおけるノードとして概念化されています。
図1.17-10は、弓状核(ARC)内の2つの異なるニューロン集団に基づくネットワーク要素を示しています。
- 一つの集団はα-メラノサイト刺激ホルモン(αMSH)の前駆体を発現します。
- もう一つの集団はNPY、アグーチ関連ペプチド(AgRP)、およびGABAを発現します。
これら両方のニューロン群は、グレリンとレプチンに対する受容体を発現しており(加えて様々な追加の入力も受け取ります)、ホルモンの電気生理学的効果は、ARCニューロンの2つの群内および群間で符号が逆になります。動物研究では、AgRPニューロンの刺激が負の強化による空腹感を刺激することが示されており、これは体重の恒常性調節に関する古典的な負のフィードバックモデルと一致しています。しかし、より最近の研究では、マウスが食物を摂取する前に食物を見るとAgRPニューロンの活動が減少することが示されており、これは予測的な正の強化による空腹感を示唆しています。個々のニューロンの遺伝子発現プロファイルを生成し、これらの領域におけるニューロンの異なるサブセットを特定する現在の研究は、ARCおよび他の視床下部および視床下部外領域の組織と機能に関するさらなる洞察を可能にするでしょう。
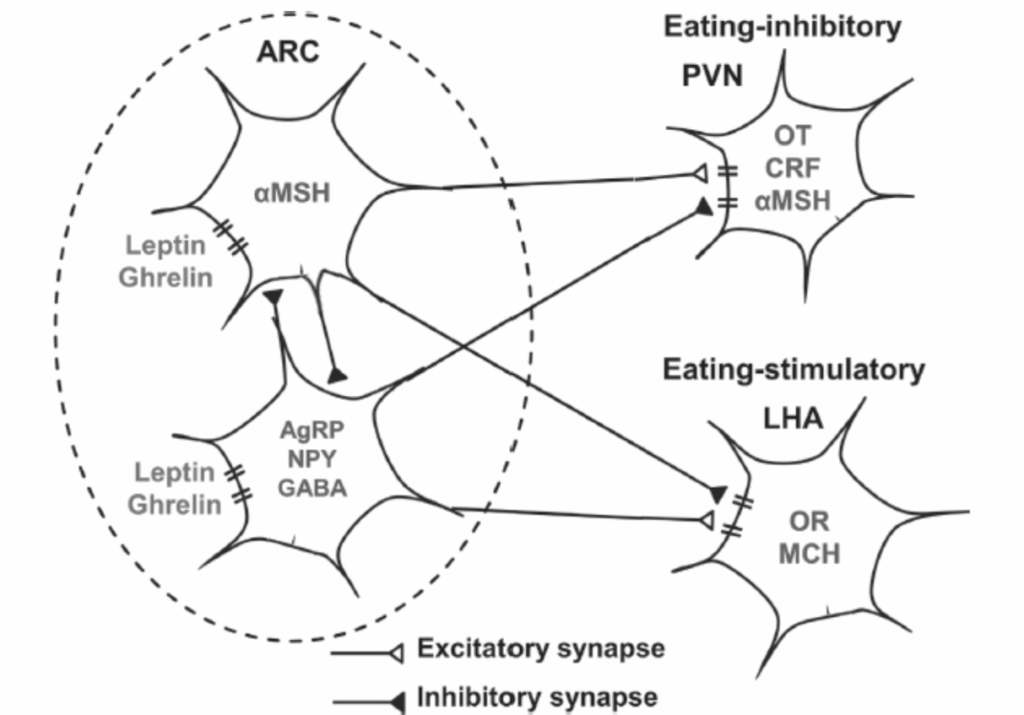
図1.17-10. 摂食を制御する神経ネットワークの視床下部成分の一部模式図
この図は、摂食制御に関わる神経ネットワークの視床下部における構成要素の一部を示しています。視床下部の弓状核(ARC)にある2つのニューロン集団は、ホルモンであるレプチンとグレリン、さらには他の体液性信号や神経求心性入力(図には示されていません)からの入力を受け取ります。
- これらの集団の1つは、神経伝達物質として**α-メラノサイト刺激ホルモン(αMSH)**を発現します。これらのニューロンはレプチンによって刺激され、グレリンによって抑制されます。
- もう1つの集団は、神経伝達物質としてアグーチ関連ペプチド(AgRP)、ニューロペプチドY(NPY)、および**γ-アミノ酪酸(GABA)**を発現します。これらのニューロンはレプチンによって抑制され、グレリンによって刺激されます。
ARCニューロンの2つの集団は相互抑制的な接続を持っています。それらの主な投射標的の中には、神経伝達物質としてオキシトシン(OT)、コルチコトロピン放出因子(CRF)、およびαMSHを発現する視床下部の**室傍核(PVN)のニューロン、ならびに神経伝達物質としてオレキシン(OR)およびメラニン凝集ホルモン(MCH)を発現する外側視床下部領域(LHA)**のニューロンがあります。
- αMSHニューロンはPVNニューロンを刺激し、AgRP/NPY/GABAニューロンはそれらを抑制します。
- 対照的に、αMSHニューロンはLHAニューロンを抑制し、AgRP/NPY/GABAニューロンはそれらを刺激します。
このネットワークにおける活動の正味のバランスがLHAニューロンを刺激する方向であれば、摂食が刺激されます(したがって、AgRP、NPY、OR、MCHはしばしば食欲増進ペプチドと呼ばれます。GABAは広範に発現しているため、このような単純な呼称はできません)。正味のバランスがPVNニューロンを刺激する方向であれば、摂食は抑制されます(したがって、αMSH、OT、CRFは食欲抑制ペプチドと呼ばれます)。これらのLHAニューロンとPVNニューロンの両方が、脳の多くの部位に投射して摂食を制御します。
αMSHおよびAgRP/NPY/GABA ARCニューロンの両方がPVNおよびLHAに投射し、これらの部位で電気生理学的に逆の作用を示します。これは、この回路における神経活動の正味の結果がPVNニューロンを刺激し、LHAニューロンを抑制することであれば摂食は抑制され、逆にLHAニューロンを刺激し、PVNニューロンを抑制することであれば摂食が刺激されるというモデルを示唆しています。興味深いことに、αMSHとAgRPの効果は、**メラノコルチン-4受容体(MC4R)という単一の受容体に対する逆の作用によって主に媒介されます。αMSHはこの受容体を刺激し、AgRPはインバースアゴニスト、すなわち機能的拮抗薬です。MC4RまたはαMSHを発現する遺伝子であるPOMCの機能喪失変異は、単一遺伝子性ヒト肥満の最も一般的な形態であり、肥満患者の1%から2%に発生します。メラノコルチンアゴニストであるセトメラノチド(Imcivree, Rhythm Pharmaceuticals)**は最近、POMC、レプチン受容体遺伝子LEPR、またはニューロペプチド合成に関与するセリンエンドプロテアーゼをコードするPCSK1の機能喪失変異による肥満の治療薬として承認されました。
下行性投射
前脳からの摂食制御信号は、摂食のための運動ネットワークに直接送られるのではなく、脳幹尾部の統合ネットワークに中継されます。例えば、(1) 無傷のラットにおけるレプチン投与は、胃の負荷とCCKの両方の満腹効果を増加させました。(2) レプチンはNTSにおける胃の負荷とCCKによって引き起こされるニューロン活性化を増加させました。(3) レプチン受容体の変異を持つラットは、外因性CCKに対する感受性が低下しました。(4) これらのラットのARCへのレプチン受容体機能の遺伝子導入による回復は、CCKの摂食抑制とNTS活性化の効果を回復させました。これらの効果を媒介する神経経路の一部が特定されています。図1.17-11に示すように、ARCのレプチン感受性αMSHニューロンはオキシトシンニューロン(PVN)に投射し、それがさらにCCKによる満腹を媒介するNTSニューロンに投射します。
終脳
食欲に対する終脳の最もよく理解されている貢献は、終脳報酬ネットワークです。これは、いくつかの皮質下領域(例:側坐核[NAc]、腹側淡蒼球[VP])と皮質領域(例:辺縁系、眼窩前頭皮質、前帯状回、弁蓋部、島皮質)から構成されます。これらの構造のほとんどは、ドーパミン作動性、ノルアドレナリン作動性、およびセロトニン作動性入力を受け取ります。加えて、オピオイド、カンナビノイド、アセチルコリン、オレキシン、ベンゾジアゼピン、グルタミン酸、およびGABA神経伝達が風味報酬に関与しているとされています。摂食に関連する快楽と強化における役割に加えて、このネットワークは性などの他の自然な報酬や、薬物報酬にも関与しています。
皮質下報酬ノード
**側坐核(NAc)と腹側淡蒼球(VP)**は齧歯類で広範に分析されてきました。それぞれが互いに接続を持ち、より吻側および尾側に位置する構造とも多数の接続を持っています。ラットがスクロースまたは液体脂肪をシャム摂食すると、NAcでは用量依存的にドーパミンが放出され(図1.17-12)、NAcへのドーパミン受容体拮抗薬の局所投与はスクロース溶液のシャム摂食を減少させます。これは、NAcのドーパミン神経伝達が風味報酬において重要な役割を果たしていることを示しています。このことは、風味に関与するすべての感覚モダリティ、すなわち味覚、嗅覚、体性感覚がNAcに収束することを示す解剖学的研究によってさらに裏付けられています。さらに、これらの投射は比較的直接的であり、つまり、最小限のシナプス結合しか含んでいません。
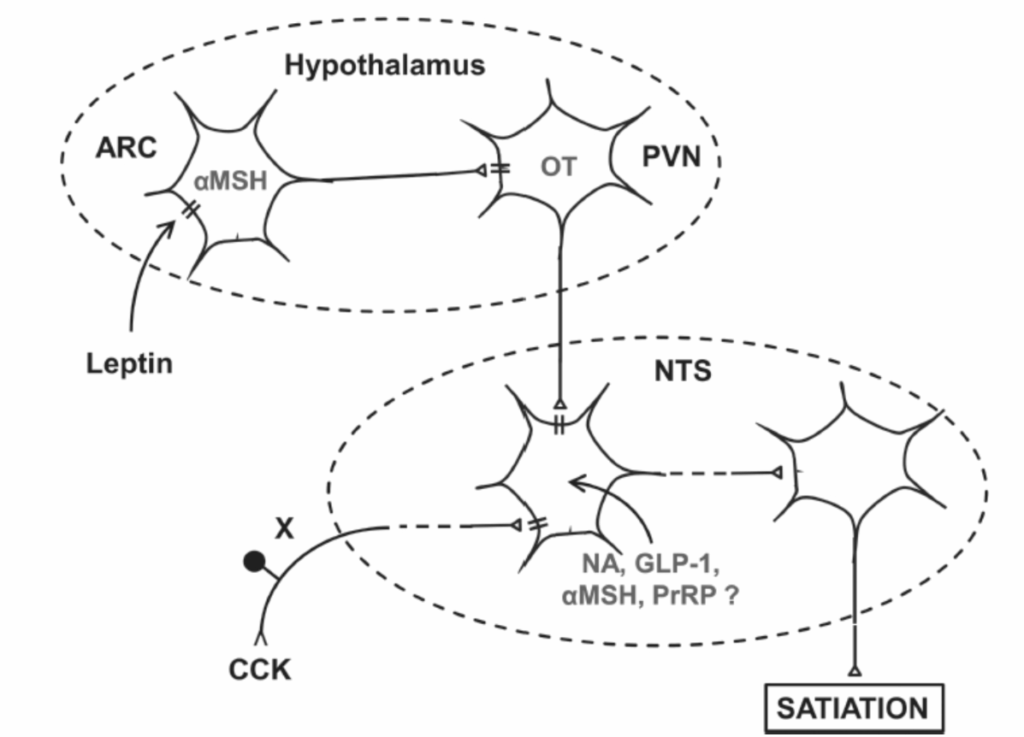
図1.17-11. 血漿レプチンレベルがコレシストキニン(CCK)の満腹効果を調節する神経ネットワークの模式図
この図は、血漿レプチンレベルがどのようにして**コレシストキニン(CCK)**の満腹効果に影響を与えるかを示す神経ネットワークを模式的に描いています。
血漿レプチンレベルの増加は、視床下部の**弓状核(ARC)にあるα-メラノサイト刺激ホルモン(αMSH)**を発現するニューロンを刺激し、レプチンレベルの減少はこれらのニューロンを抑制します(後者の効果がより生理学的に関連性が高いと考えられます)。
ARCのαMSHニューロンは、視床下部の**室傍核(PVN)にあるオキシトシン(OT)を発現するニューロンに投射します。これらのOTニューロンは、次に脳幹の孤束核(NTS)にあるニューロンに投射します。NTSニューロンは、CCKによって刺激される迷走神経求心性ニューロン(X)**から直接的または間接的な入力も受け取ります。
このネットワークの活動の増減は、満腹感と食事量の増減につながります。CCKによる満腹を媒介するNTSネットワークには、ノルアドレナリン作動性(NA)、グルカゴン様ペプチド-1(GLP-1)、αMSH、および**プロラクチン放出ペプチド(PrRP)**による神経伝達が関与していると考えられます。
注記: 模式図の軸索上の破線は多シナプス結合を示します。
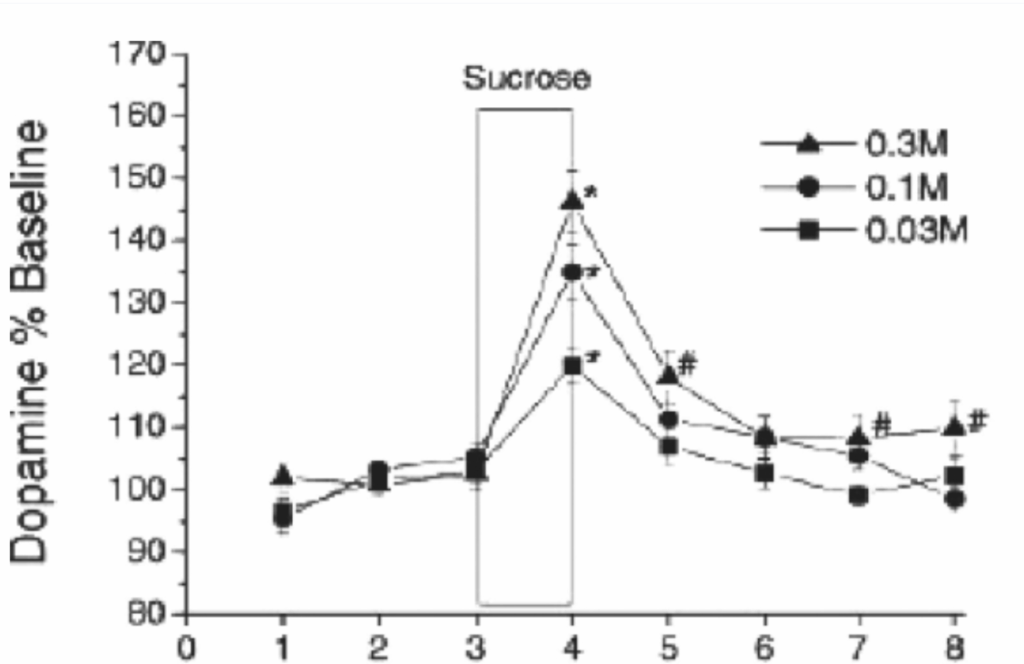
図1.17-12. 側坐核(NAc)におけるドーパミン神経伝達の甘味報酬における役割を示す証拠
この図は、甘味の報酬における側坐核(NAc)のドーパミン神経伝達の役割を示唆する証拠を提示しています。自由に摂食させたラットに、胃瘻チューブを開放して食後の負のフィードバックを最小限に抑えながら(シャム摂食)、異なるモル濃度のスクロースが1日20分間提示されました。
ラットは、より濃いスクロースを増加量で摂取し(平均で0.03Mスクロース18 mL、0.1Mスクロース31 mL、0.1Mスクロース43 mL)、同時に行われた細胞外マイクロダイアリシスでは、摂取中にNAcでのドーパミン放出が段階的に増加することが明らかになりました。対照テスト(図示せず)では、摂取されるスクロースの量が一定に保たれた場合でも同様の段階的なドーパミン放出が起こることが示されました。
データは20分間の期間の平均±標準誤差で示されています。 *P < .01; #P <. 05 はベースラインと比較して有意差があることを示します。
(Hajnal A, Smith GP, Norgren R. Oral sucrose stimulation increases accumbens dopamine in the rat. Am J Physiol. 2004;286(1):R31. doi:10.1152/ajpregu.00282.2003より許可を得て転載。)
NAcからの密な投射は、無名質の細分化である腹側淡蒼球(VP)を標的としています。μ-オピオイド受容体を介したオピオイド神経伝達がこの領域での報酬を媒介すると考えられています。興味深いラットの研究では、尾側VPの病変が、ラットにスクロースに対する肯定的反応ではなく嫌悪的な顔の反応を示させたことから、この領域における神経処理がポジティブな風味の快楽の生成に必要であることが示唆されています。
皮質報酬ノード
大脳皮質の前頭葉および側頭葉のいくつかの領域が、風味の報酬に関与しているとされています。これには、進化的に古い領域(例:海馬や帯状皮質)と、進化的に新しいまたは新皮質領域(例:眼窩前頭皮質や前頭前野)の両方が含まれます。ヒトを対象とした機能的画像研究やサルを対象とした単一ニューロン記録研究は、風味の快楽が中前部眼窩前頭皮質の活動に反映されていることを示しています。例えば、空腹時に嗜好性の高い食品を試食した場合の眼窩前頭皮質活動は、満腹時よりもはるかに高くなります。対照的に、内側眼窩前頭皮質、腹内側前頭前野、および中前部島皮質は、風味の快楽体験を生成することよりも、風味の報酬を監視し予測することに関与している可能性があります。
食欲の生理学的調節因子
学習
食事開始、食物選択、満腹、および食事量のすべては、動物とヒトにおいて容易に条件付け可能です。古典的(またはパブロフ的)条件付けと道具的(またはオペラント)条件付けの両方が関与します。環境的文脈と風味が通常、条件刺激(CS)を提供します。
例えば、音/光のCSが、数日間にわたってスケジュールされた6回の食事のそれぞれに先立ってラットに提示され、その後「消去」(つまり、ラットが同じ飼料に自由にアクセスできる状態)中にテストされた場合、CSは3週間毎日、非常に大量の食事の開始を誘発しました。したがって、食物剥奪中に食物の入手可能性を予測する手がかりは、剥奪がない状態でも大量の食事の開始を誘発することができます。このような条件付けられた空腹の無条件刺激(UCS)は特定されていません。
満腹と食物選択もまた条件付け可能であり、シャム摂食中の食事量の条件付けられた制御の消去(図1.17-13)によって示されています。この場合、UCSは摂食の食後効果です。例えば、栄養素が胃、十二指腸、空腸、または肝臓に注入されている間に風味付きの水を飲むラットは、その後、その風味の食物を少なく摂取します(風味-栄養条件付け)。これは嫌悪ではなく満腹であり、なぜなら食物の選択が提供されたとき、ラットは栄養注入に関連する風味を選択するからです。ヒトとラットの研究は、食物選択と摂取量が、風味の快楽よりも風味-栄養条件付けによって駆動されることが多いことを示しています。最近の研究は、注入された脂肪の場合、迷走神経求心性神経がUCS信号を中枢に伝え、線条体におけるドーパミン放出につながることを示しています。
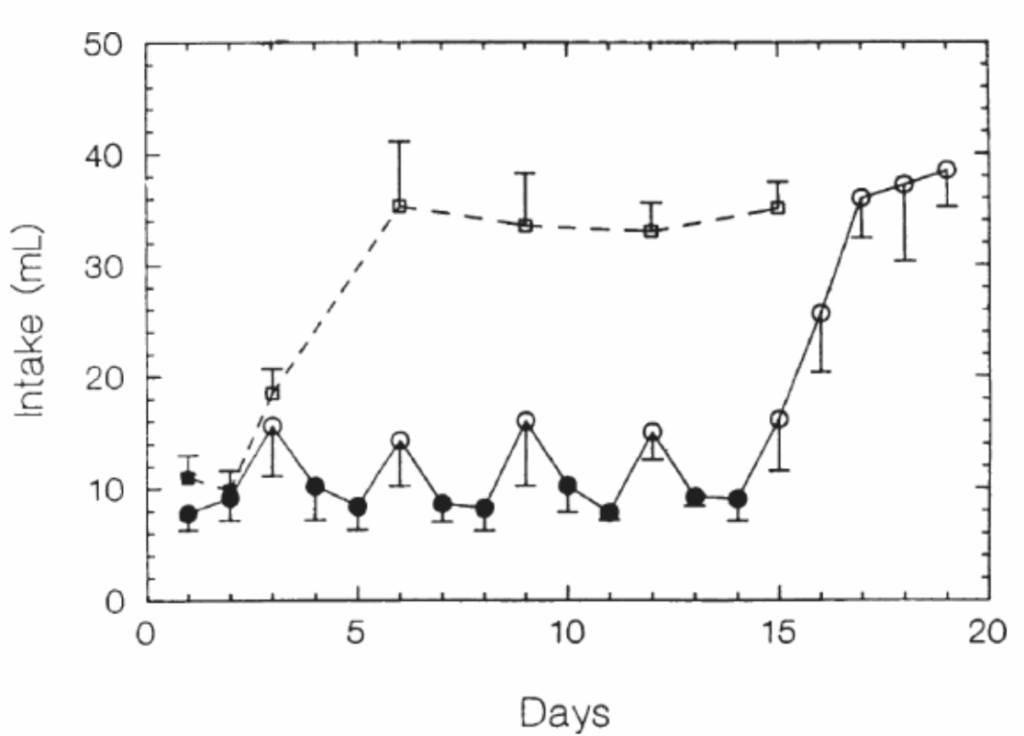
図1.17-13. ラットにおける条件付けられた満腹の摂食における役割
この図は、2つのグループのラットにおける連続テストでの0.8 Mスクロースの30分間摂取量を示しています。ラットには、実際の摂食テストでは閉じた状態の(黒い記号)、シャム摂食テストでは開いた状態の(白い記号)スチール製胃瘻チューブが装着されました。シャム摂食テスト中、スクロースは胃に蓄積したり腸に入ったりしませんでした。
- **一方のグループ(四角)**は、1回スクロースを実際に摂食した後、シャム摂食を行いました。
- **もう一方のグループ(丸)**は、実際の摂食テストとシャム摂食テストを交互に行いました。
連続するシャム摂食テスト中のスクロース摂取量の漸進的な増加は、各シャム摂食テストの間に2回の通常の摂食テストを挟むことによって阻止されました。これが行われた場合、シャム摂取量は実際の摂取量よりも有意に多かったものの、漸近的なシャム摂取量よりも有意に少なかったです。
これらのデータは、スクロースの通常の摂食が、スクロースの味と食後効果との間に学習された関連性を生み出し、この関連性が摂取量を制限すること、そしてそれが連続するシャム摂食テスト中に消去されることを示しています。
(Davis JD, Smith GP. Learning to sham feed: Behavioral adjustments to loss of physiological postingestional stimuli. Am J Physiol. 1990;259(6):R1228. doi:10.1152/ajpregu. 1990.259.6.R1228より許可を得て転載。)
高次条件付けは、ヒトの摂食において重要な役割を果たす可能性が高いです。例えば、文化的社会化は、すべての乳幼児が避けるカプサイシン(唐辛子)の風味に対する明らかな正の快楽反応と選択をもたらす可能性があります。実際、いくつかの無条件の味覚の嗜好と嫌悪(甘味や苦味など)を除けば、すべての食物選択は学習されたものであると考えられます。
摂食の学習された制御の一部は、特殊な条件付けの形態です。例えば、上部消化管の食中毒によって条件付けられた風味の嫌悪は、わずか1回のCS-UCSの対提示で学習され、CS-UCSの遅延が異常に長い(数時間)にもかかわらず、異常に長く持続します。
学習された食物嗜好に関する基礎および臨床研究は、高い優先順位に置かれるべきです。例えば、行動療法プログラムは、比較的構造化されており、特定の食物刺激を提示できるため、摂食の条件付けられた生理学的制御を臨床で利用するための優れた機会を提供するはずです。
相互作用
このレビューは、摂食を制御する異なる機能プロセスとその生理学的基盤が、それらの境界が単なるヒューリスティックであることを示すような方法で相互作用することを強調しています。風味刺激と消化管または代謝制御との間の根本的な学習された相互作用は、前のセクションで記述されました。
また、生理学的状態に関連した風味の快楽における無条件の変化も存在します。それは、空腹の被験者の方が満腹の被験者よりも風味刺激をより快いと評価することです(「アリエステジア」)。
消化管信号と脂肪量信号の間にも相互作用があります。上記で記述したように、レプチン受容体の機能喪失変異を持つラットではCCKによる満腹が減少し、ARCにおけるレプチン受容体の遺伝子導入による回復によって救済されました。同様の相互作用は、脂肪量シグナル伝達とGLP-1または他の食事量制御因子との間でも記述されています。
エネルギー消費
安静時代謝率(RMR)
安静時代謝率(RMR)は、主に除脂肪体重によって決定され、1日のエネルギー摂取量と線形に相関し、分散の約50%を説明し、食事量とも相関します。脂肪量と1日のエネルギー摂取量の間には強い相関はありません。これらのデータは、RMRが持続的に食欲を刺激することを示唆しています。目的論的には、生物が脳、肝臓、腎臓などの機能を維持するのに十分なエネルギーを確保することは理にかなっているように思われます。関与するメカニズムは不明です。RMRは調節される変数である可能性は低いことに注意してください。つまり、RMRは食欲を駆動しますが、RMRを特定のレベルに維持するフィードバックループはありません。
運動
エネルギー摂取量は、習慣的な運動レベルまたは身体活動エネルギー消費とも関連していますが、急性の運動が摂食に影響を与えるかどうかは明らかではありません。最近の研究では、肥満の動物モデルである大塚ロングエヴァンス徳島脂肪(OLETF)ラット(CCK1受容体を欠き、過食症で肥満である)において、運動と食物摂取量の間に興味深い関係が明らかになりました。
ランニングホイールにアクセスできると、OLETFラットは対照株と同程度に活動しますが、1日以内に食物摂取量を対照ラットのレベルまで減らし、ランニングホイールへのアクセスが維持されている間はこの低い摂取量を維持します。これにより、体重が正常化します。ランニングホイールへのアクセスがなくなると、食物摂取量は増加します。重要なのは、増加の規模と範囲が、運動を経験する発達段階に依存することです。成熟したラットでは、摂取量と体重は運動前のレベルに戻ります。しかし、若いOLETFラットに運動へのアクセスが提供された場合、その効果は永続的であるように見えます。食物摂取量は一時的に増加しますが、ランニングホイールにアクセスしなかったOLETFラットのレベルには達せず、体重はランニングホイールにアクセスしなかったラットよりも有意に低いレベルに維持されます。同様の運動の効果は、食事性肥満に感受性を持つように繁殖されたラットや、メラノコルチン-4受容体を欠くマウスでも実証されています。このような作用の根底にあるメカニズムはまだ解明されていません。
ラットにおける他の最近の研究では、運動が食事選択に与える影響も示されています。ランニングホイールへのアクセスは、以前好んでいた高脂肪食の選択を減少させ、通常は好む新しい嗜好性の高い食事の回避を引き起こす可能性があります。
生殖軸
卵巣周期やその他の生殖状態は摂食に影響を与えます。成人女性と多くの哺乳類種のメスは、サイクルの卵胞期および排卵期に摂食量が減少します。女性の場合、この減少は意識的には認識されませんが、1日あたり数百キロカロリーに達し、長期的には体重に影響を与える可能性があります(図1.17-14)。ラットとマウスにおける卵巣摘出術とエストロゲン治療の研究は、**内側孤束核(NTS)のエストロゲン受容体-1(またはα)**に作用するエストロゲンがこれらの効果を媒介することを示しています。エストロゲンレベルは黄体中期にも高いです。プロゲスチンはエストロゲンの摂食抑制効果に対抗し、サイクルの黄体中期に食物摂取量をより高いレベルに維持すると考えられています。
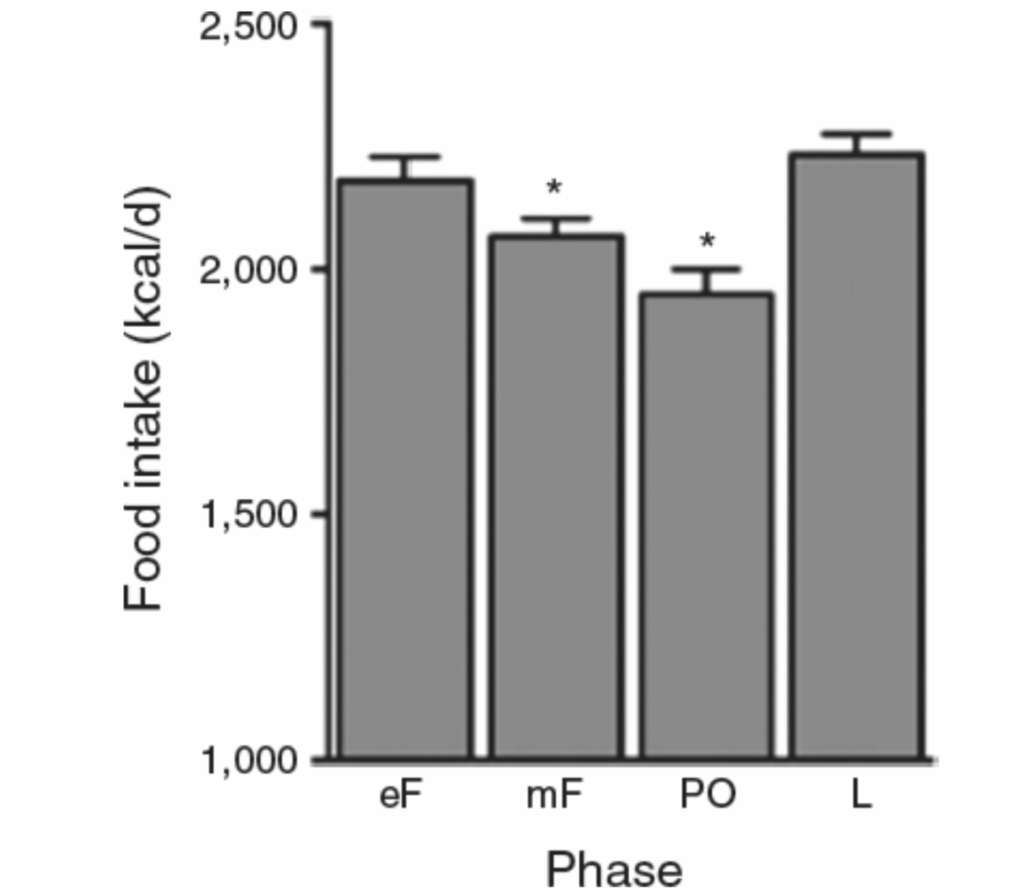
図1.17-14. 女性の卵巣周期中の1日あたりの食物摂取量
この図は、女性の卵巣周期における1日あたりの食物摂取量を、**卵胞期初期(eF;4日間)、卵胞中期(mF;約9日間)、排卵期(PO;4日間)、黄体期(L;約11日間)**にわたって平均したものです。
卵胞期中に食物摂取量が漸進的に減少することに注目してください。人間の周期とほぼ同じである旧世界のサルも、同様の卵胞期における1日あたりの食物摂取量の減少を示し、また黄体期のほとんどの間、高い一定レベルの食物摂取量を示します。これは女性ではまだ確認されていません。
アスタリスク(*)は、黄体期と有意に異なることを示します。
(Asarian L, Geary N. Sex differences in the physiology of eating. Am J Physiol Regul Integr Comp Physiol. 2013;305:R1215-R1267より転載。)
ラットとマウスでは、排卵期における食物摂取量の減少と、卵巣摘出後の食物摂取量の増加は、食事量の選択的な変化によって引き起こされます。食事頻度は寄与しません。実際、卵巣摘出ラットの過食が体重が約20%増加した後に収まるのは、食事頻度が減少するためです。卵巣摘出によって誘発された食事量の増加は永続的です。これは、摂食制御を理解する上で食事パターン分析の重要性を示す良い例です。エストロゲンは、ラットの排卵期において、少なくとも部分的にはCCKの満腹効果を選択的に高めることによって、食事量を減少させます。
ヒトと動物の両方の研究は、甘味への嗜好に性差があることを示しており、女性は男性よりも甘味を好む傾向があります。この一因として、女性は甘いものを最も好きな食べ物や切望する食べ物としてより頻繁に挙げるのに対し、男性はより頻繁にしょっぱい食べ物を挙げることが挙げられます。この性差の根底にあるメカニズムは不明です。
生殖軸の機能は、下記で述べるように、**過食(bige eating)**にも影響を与えるようです。
病気による食欲不振
様々な強度と期間の食欲不振は、感染症、外傷、腫瘍、その他の病因に対する生得的および獲得免疫応答の共通要素です。発熱のように、自然免疫系の急性期反応における一時的な食欲不振は、不快ではあるものの、回復を促進し得る適応的な反応です。しかし、より慢性的な病気による食欲不振は、病気の重症度を増大させ、治療を妨げ得る不適応な反応です。
インターロイキン-1やTNF-αを含む多くのサイトカイン、ならびにプロスタグランジン-E2やその他の免疫シグナル伝達分子が、病気による食欲不振に関与しています。末梢免疫信号は、内分泌および末梢神経応答を介して脳に直接的および間接的に影響を与え、正常な摂食を媒介するのと同じ神経ネットワークに収束すると考えられています。例えば、視床下部と終脳に投射する背側縫線核(DRN)のセロトニン作動性ニューロンは、正常な摂食制御と病気による食欲不振の両方に関与しているとされています。動物では、病気は食事量の減少、食事回数の減少、またはその両方につながる可能性があります。ヒトにおける病気による食欲不振は、まだ十分に理解されていません。
精神疾患としての摂食障害
摂食障害患者における検査室研究
神経性食欲不振症患者における主観的食欲
摂食障害患者の食事周辺の主観的食欲の障害を研究することは、摂食障害に関する重要な洞察を提供します。神経性食欲不振症の患者は、主観的食欲において顕著な個人差を示します。生理学的に根ざした食欲の知覚は、しばしば身体イメージ、摂食制御を失うことへの恐怖、条件付けられた食物嗜好などに関連する心理的影響によって上回られるようです。図1.17-15はその例を示しています。これらの異なる要因を解明することは、依然として困難です。
過食症患者における摂食
過食(Binge eating)は検査室での研究が可能です。被験者が様々な食物に自由にアクセスできる居住型検査室環境において、神経性過食症の患者と対照被験者は、通常、同様の回数の食事を摂り、通常、同様の大きさの食事(40〜980 kcal)を摂りました。しかし、患者が摂った食事の約4分の1ははるかに大量でした(1,058〜6,728 kcal)。これらの食事は主に一日の遅い時間帯に起こり、ほとんどが甘いものとスナック食品でした。驚くべきことに、実験的に操作された認知的刺激、すなわち「もし可能なら過食を試みなさい」という誘いは、自発的な過食を示す過食症患者において、検査室で過食を誘発するのに十分でした。これにより、正常な食事と過食の行動的および神経的な違いに関する個体内研究の可能性が開かれます。
過食症患者では、食後負のフィードバックによる満腹信号の効力が低いです。(1) 同量の食物のプリロードは、対照群よりも過食症患者、特に大量の食事を摂っている患者において、摂取量をより少なく減少させません。(2) 過食症患者は、食事中に同等の満腹感の自己申告を得るために、より多くの食物を摂取する必要があります。(3) 胃の容積拡張は、過食症患者において知覚的および機械的反応の低下を引き起こします。これはおそらく、彼らの胃が大量の食事を頻繁に摂取することに適応した結果、通常よりも大きくなっているためと考えられます。(4) 食事刺激によるCCK放出は、過食症患者では対照群よりも少ないです(図1.17-16)。これらの異常は、過食が減少するにつれて解消するようです。これは、それらが過食症の初期原因ではないことを示唆しています。しかし、ひとたび発症した障害の進行を促進し、回復を妨げる可能性はあります。
過食は卵巣周期とも関連しています。神経性過食症の女性では、過食の頻度はサイクルの黄体中期から後期にかけて最大になり、卵胞期には最小になります。過食の頻度と感情的摂食(負の感情に応答して過食または過食する傾向)は、コミュニティサンプルにおいても同様の周期的影響を示し、高レベルのエストラジオールとプロゲステロンの両方に関連する摂食障害の傾向が高い一方、高レベルのエストラジオールと最小レベルのプロゲステロンに関連する傾向は低いです。
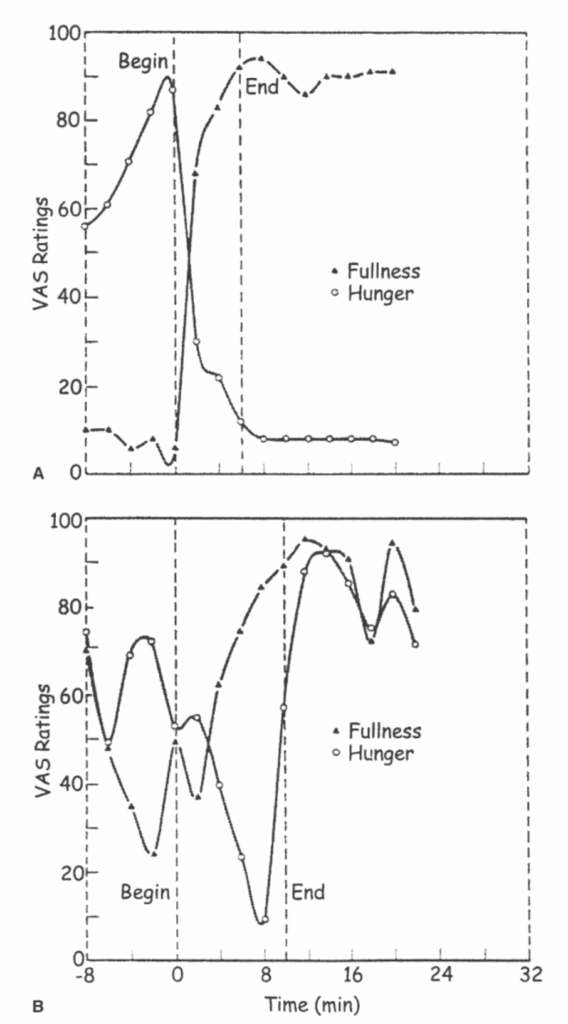
図1.17-15. 神経性食欲不振症の女性における主観的な食欲の乱れ
この図は、神経性食欲不振症の女性に見られる、食事周辺での主観的な食欲の乱れを示しています。空腹感と満腹感の瞬間的な強度は、視覚アナログ尺度を用いて評価されました。
A: 健康な女性の場合 食事前は空腹感が高く、満腹感は低いです。これら2つの知覚は、食事前、食事中、食事後に互いに逆の関係で変化しています。これはほとんどの健康な被験者に典型的なパターンです。
B: 神経性食欲不振症の女性の場合 対照的に、この患者では、空腹感と満腹感が食事前、食事中、食事後に不規則に変化し、しばしば互いに逆の関係を示しません。他の神経性食欲不振症患者では様々な反応が見られ、一部は健康な女性の通常の反応に似ているものもあれば、そうでないものもありました。
この図では、快感や鎮静といった食事に伴う他の経験は示されていないことに注意してください。この研究の課題は、これらの知覚を生み出す様々な心理的および生理学的影響を解明することです。
(Owen WP, Halmi KA, Gibbs J, Smith GP. Satiety responses in eating disorders. J Psychiatr Res. 1985;19(2-3):279-284. Copyright @ 1985, Elsevierの許可を得て転載。)
セロトニンと摂食障害
脳機能画像診断、特に神経伝達物質機能を特定するための放射性標識法を伴う研究は、摂食障害研究における主要な焦点です。これまでのところ最も進展が見られるのは、セロトニン作動性メカニズムの研究です。
- 神経性過食症から回復した女性は、眼窩前頭皮質における5HT2A受容体結合の減少を示しました。これは、この障害の脆弱性の根底にある特性差を反映している可能性を示唆しています。
- 神経性食欲不振症から回復した女性も、異なる脳領域ではあるものの、5HT2A受容体結合の減少を示しました。
精神疾患としての摂食障害
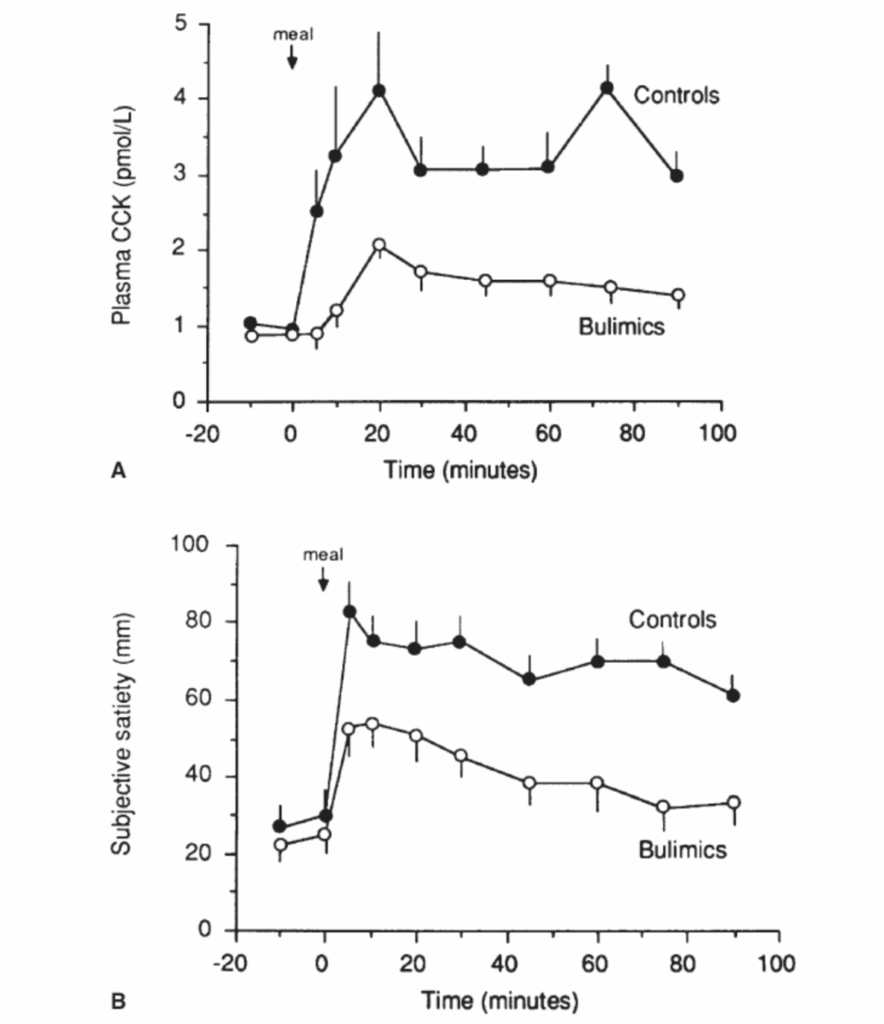
図1.17-16. 神経性過食症患者では、食後のコレシストキニン(CCK)濃度(A)と食後満腹感の主観的経験(B)が減少している
この図は、神経性過食症患者における食後のコレシストキニン(CCK)濃度と食後満腹感の主観的経験の低下を示しています。
14人の患者と年齢および体重を合わせた10人の対照女性が、一晩絶食後(矢印)、400 mLの液体食を提供され、1〜2分でそれを摂取しました。血漿CCKは選択的バイオアッセイによって測定されました。満腹感は100 mmの視覚アナログ尺度(0 = 空腹;100 = 満腹)で測定されました。
神経性過食症患者では、CCKのピーク濃度と統合CCK応答(曲線下面積)の両方が有意に減少し、これは食後5分から始まる有意に少ない満腹感の報告と相関していました。
(Geracioti TD, Jr., Liddle RA. Impaired cholecystokinin secretion in bulimia nervosa. N Engl J Med. 1988;319:683-688より許可を得て転載。)
この種の研究における主要な課題は、脆弱性に寄与する因果関係のある要因を特定することです。例えば、セロトニン作動性の変化は、摂食制御の障害に特異的であるというよりも、神経性食欲不振症と過食症患者の大多数に発生する不安障害に関連している可能性があります。残念ながら、摂食障害患者を対象とした脳画像研究で、摂食という文脈で行われたものは比較的少ないです。この種のさらなる研究は、摂食障害における食欲の生理学に関連する状態差や特性差を明らかにし、より良い治療のための新たな標的を示唆するかもしれません。
急性トリプトファン枯渇(ATD)テストは、摂食障害行動におけるセロトニンの役割を調査するために使用されてきました。このテストは、トリプトファンを含まないタンパク質負荷の摂取を伴い、これにより血漿トリプトファンが末梢タンパク質合成に転用され、中枢セロトニン合成の低下につながります。ある研究では、ATDが神経性過食症患者と健康な対照者の両方で気分を低下させ、テスト時にセロトニン再取り込み阻害薬(SSRI)を服用していた患者では過食衝動を増加させたものの、服用していなかった患者や対照者では増加させませんでした。これらのデータは、急性過食衝動におけるセロトニンの特異的な役割と一致しています。
ATDがなぜ薬物療法を受けているグループでのみ過食に影響を与えたのか(おそらくそのグループはより重度の障害を持っていたか、ATDがSSRI治療の有益な効果を逆転させたが、セロトニン自体は過食障害に関与していないか)、セロトニン神経伝達における重要な効果が脳のどこで発生したのか、そしてそれがどの機能システムに影響を与えたのかを特定するためには、さらなる研究が必要です。
精神科摂食障害の動物モデル
神経性食欲不振症
**活動誘発性食欲不振(ABA)**は、神経性食欲不振症の広く用いられているモデルです。このモデルでは、ラットやマウスは一日のほとんどをランニングホイールにアクセスでき、食物へのアクセスは1日1〜2時間のみに制限されます。数日のうちに、動物は徐々に多く走り、徐々に少なく食べ、自己餓死する点まで至ります。一部の研究では不安や快楽消失の兆候が見られますが、すべてではありません。ABAはまた、神経性食欲不振症に関連する多くの内分泌および神経伝達物質の変化を誘発します。さらに、神経性食欲不振症と同様に、思春期は脆弱性が増加する期間です。個体差もABAに影響を与えます。例えば、最近の成人メスC57BL/6Nマウスの研究では、動物の約半分のみが漸進的な体重減少を示し、残りは初期体重を維持しました。しかし、ドーパミントランスポーターの遺伝子ノックダウンとドーパミンレベルの増加を持つマウスがテストされた場合、車輪走行活動の過度な増加により、より多くのマウスが脆弱性を示しました。
過食
過食様摂食は、様々な方法でラットやマウスに誘発することができます。
- 非常に好ましい食物へのアクセスを制限する(通常週3日、1日1〜2時間)と、毎日1〜2時間アクセスする場合と比較して摂取量が増加します。
- 電気ショックやその他の身体的ストレス因子の後に1日1〜2時間食物が提供されると、好ましい食物の摂取量も増加します。
- 好ましい食物をケージのすぐ外に置くことによって引き起こされる心因性ストレスも、過食様摂食を誘発するのに十分です。
いくつかの研究が、生殖軸が過食様摂食に与える影響に取り組んできました。エストラジオール治療は、卵巣摘出ラットの過食様摂食を減少させました。これは女性で見られる効果と同様ですが、女性とは異なり、この効果は周期的に変化せず、プロゲステロンによって逆転しませんでした。
メスのラットは、オスのラットよりも過食様摂食を示す脆弱性が著しく高いです(表1.17-4)。この「過食傾向」特性の発達は、思春期にエストロゲンレベルが低い少女では過食の遺伝率が増加するという報告を追跡するために研究されました。思春期前に卵巣摘出されたラットは、正常な思春期発達を示さず、成人として過食様摂食のリスクが増加しました(表1.17-4)。これらのデータは、ヒトのデータと一致しており、正常な思春期のエストロゲンレベルが過食の発達に対する防御的な役割を果たすことを示唆しています(このエストロゲンの明らかな組織化効果は、女性における過食と動物における過食様摂食を減少させるエストロゲンの活性化または急性効果とは対照的であることに注意してください)。最後に、別の最近の研究では、エストロゲンがDRNのセロトニン作動性ニューロンに作用して、成人メスのマウスの過食様摂食を抑制することが示されました。
表1.17-4.
性別と思春期の発達がラットの過食様摂食の傾向に与える影響
A. 性別
| メス (%) | オス (%) | |
| BER | 37 | * |
| BEP | 47 | M |
- オスとメスのラットに、標準的な餌を自由に与え、嗜好性の高い市販のケーキフロスティングを週3日、1日4時間、2週間にわたって提供しました。この方法は、同じ食物を自由に与える場合と比較して、嗜好性の高い食物摂取量が増加します。
- 6回のテストにおける嗜好性の高い食物摂取量は、すべてのラットで順位付けされ、過食様摂食の傾向は、過食傾向フェノタイプ(BEP)(6回のテスト中3回以上で嗜好性の高い食物摂取量が上位3分の1にスコアされ、かつ下位3分の1にスコアされたことがない)または過食抵抗性フェノタイプ(BER)(6回のテスト中3回以上で嗜好性の高い食物摂取量が下位3分の1にスコアされ、かつ最上位3分の1にスコアされたことがない)としてスコア化されました。
- メスはオスよりも有意にBEPフェノタイプを発達させる可能性が高く(*)、BERフェノタイプを発達させる可能性が有意に低かった(*)。データは各フェノタイプのラットのパーセンテージです(中間スコアのラットは示されていません)。 (Klump KL, Racine S, Hildebrandt B, Sisk CL. Sex differences in binge eating patterns in male and female adult rats. Int J Eat Dis. 2013;46(7):729より許可を得て改変。)
B. 思春期前の卵巣摘出
| BEPの可能性(オッズ比) | |
| BER | 0.6 (0.3-1.3) |
| BEP | 2.4* (1.0-5.7) |
- 思春期前のメスラットが卵巣摘出され、上記のように成人としてフェノタイプ分類されました。卵巣摘出は、膣開口によって評価された正常な思春期発達を妨げ、BEPフェノタイプを発達させるオッズを有意に増加させました(*)。
- データは、非卵巣摘出ラットに対する卵巣摘出後のBERまたはBEPフェノタイプを発達させる可能性のオッズ比(95%信頼区間)です。 (Klump KL, Sinclair EB, Hildebrandt BA, et al. The disruptive effects of estrogen removal before puberty on risk for binge eating in female rats. Clin Psychol Sci. 2020;8:839-856より許可を得て転載。)
まとめ
摂食の行動的および主観的側面は、脳幹尾側から前頭葉まで広がる、広く分布した神経ネットワークによって生成されます。このネットワークの基本的な出力、したがって食欲の行動神経科学の焦点は、食事です。
食事開始のための生理学的刺激には、概日リズム、代謝信号、内分泌信号が含まれ、その中でグレリンが最も注目されています。しかし、条件付けされた信号が通常より重要です。
摂食が始まると、風味の快楽が摂食を増減させます。甘味の嗜好を除けば、これらは主に、食後の栄養感知から社会的・文化的要因に至るまで、様々なメカニズムで条件付けられており、寄与しています。
食事を終了させる満腹は、胃の機械受容やCCK、GLP-1などの胃腸ホルモンを含む生理学的信号によって、また条件付けられた影響によって制御されます。これらのメカニズムの一部は、食後の満腹感を維持します。
視床下部における基礎となる神経ネットワークのノードを明確にする上で大きな進展がありました。これは主にエネルギー恒常性の文脈においてです。また、腹側前脳では主に食物報酬の文脈においてです。AgRP、NPY、GABA、およびαMSHは、エネルギー恒常性への視床下部の寄与の重要なメディエーターです。低体重におけるレプチンの減少は、このシステムを活性化して食欲を刺激するようですが、過体重が調節的な代償作用をどの程度引き起こすかは依然として疑問です。
いくつかの皮質下部位(NAc、VPなど)および皮質部位(海馬、帯状皮質、島皮質、眼窩前頭皮質、前頭前野)は、空腹感、満腹感、特に食物報酬に重要な貢献をしています。脳幹および中脳からのα-アドレナリン作動性、セロトニン作動性、およびドーパミン作動性ニューロンの上行性投射は、これらの領域のほとんどに重要な入力をもたらします。一般的な原則として、食欲の機能的区分は、言及されたすべての生理学的メカニズム間の相互作用の結果として理解が深まっています。
不顕性摂食障害や精神科摂食障害は、動物モデルでの研究と同様に、直接的な実験研究の対象となります。
参考文献
- Asarian L, Geary N. Sex differences in the physiology of eating. Am J Physiol Regul Integr Comp Physiol. 2013;305:R1215-R1267.
- Asarian L, Gloy V, Geary N. Homeostasis. In: Ramachandran VS, ed. The Encyclopedia of Human Behavior, Vol. 2. Academic Press; 2012.
- Asarian L, Langhans W. A new look on brain mechanisms of acute illness anorexia. Physiol Behav. 2010;100:464-471.
- Beeler JA, Mourra D, Zanca RM, et al. Vulnerable and resilient phenotypes in a mouse model of anorexia nervosa. Biol Psychiatry. 2020;90:829-842.
- Blundell J, de Graaf C, Hulshof T, et al. Appetite control: methodological aspects of the evaluation of foods. Obes Rev. 2010;11:251-270.
- Blundell JE, Gibbons C, Beaulieu K, et al. The drive to eat in homo sapiens: energy expenditure drives energy intake. Physiol Behav. 2020;219:112846.
- Brobeck JR. Remembrance of experiments almost forgotten. Appetite. 1993;21:225-231.
- Bruce KR, Steiger H, Young SN, Kin NM, Israël M, Lévesque M. Impact of acute tryptophan depletion on mood and eating-related urges in bulimic and nonbulimic women. J Psychiat Neurosci. 2009;34:376-382.
- Cao X, Xu P, Oyola MG, et al. Estrogens stimulate serotonin neurons to inhibit binge-like eating in mice. J Clin Invest. 2014;124:4351-4362.
- de Araujo IE, Schatzker M, Small DM. Rethinking food reward. Annu Rev Psychol. 2020;71:139-164.
- Fowler N, Klump KL. A virtual issue highlighting animal studies of eating disorders as valuable tools for examining neurobiological underpinnings and treatment of eating disorders. Int J Eat Disord. 2020;53:1569-1578
- French SA, Epstein, LH, Jeffrey, RW, Blundell JE, Wardle J. Eating behavior dimensions. Associations with energy intake and obesity. A review. Appetite. 2012;59:541-549.
- Geary N. Control-theory models of body-weight regulation and body-weight-regulatory appetite. Appetite. 2020;144:104440.
- Han W, Tellez LA, Perkins MH, et al. A neural circuit for gut-induced reward. Cell. 2018;175:665-678.e23.
- Kaelberer MM, Buchanan KL, Klein ME, et al. A gut-brain neural circuit for nutrient sensory transduction. Science. 2018;361:eaat5236.
- Kaye WH, Weltzin TE, McKee M, McConaha C, Hansen D, Hsu LK. Laboratory assessment of feeding behavior in bulimia nervosa and healthy women: methods for developing a human-feeding laboratory. Am J Clin Nutr. 1992;55:372-380
- Levin BE, Magnan C, Dunn-Meynell A, Le Foll C. Metabolic sensing and the brain: who, what, where and how? Endocrinology. 2011;152:2552-2557.
- Lowell BB. New neuroscience of homeostasis and drives for food, water, and salt. N Engl J Med. 2019;380:459-471.
- Ma R, Mikhail ME, Culbert KM, Johnson AW, Sisk CL, Klump KL. Ovarian hormones and reward processes in palatable food intake and binge eating. Physiology (Bethesda). 2020;35:69-78.
- Mani BK, Puzziferri N, He Z, et al. LEAP2 changes with body mass and food intake in humans and mice. J Clin Invest. 2019;129:3909-3923.
- Moody L, Liang J, Choi PP, Moran TH, Liang NC. Wheel running decreases palatable diet preference in Sprague-Dawley rats. Physiol Behav. 2015;150:53-63.
- Morton GJ, Blevins JE, Williams DL, et al. Leptin action in the forebrain regulates the hindbrain response to satiety signals. J Clin Invest. 2005;115;703-710.
- Polidori D, Sanghvi A, Seeley RJ, Hall KD. How strongly does appetite counter weight loss? Quantification of the feedback control of human energy intake. Obesity. 2016;24:2289-2295.
- Ravussin Y, Leibel RL, Ferrante AW Jr. A missing link in body weight homeostasis: the catabolic signal of the overfed state. Cell Metab. 2014;20:565-572
- Ruddock HK, Brunstrom JM, Vartanian LR, Higgs S. A systematic review and meta-analysis of the social facilitation of eating. Am J Clin Nutr. 2019;110:842-861.
- Schalla MA, Stengel A. Activity based anorexia as an animal model for anorexia nervosa-a systematic review. Front Nutr. 2019;6:69.
- Schwartz GJ, Moran TH. Sub-diaphragmatic vagal afferent integration of meal-related gastrointestinal signals. Neurosci Biobehav Rev. 1996;20:47-56.
- Smith KR, Papantoni A, Veldhuizen MG, et al. Taste-related reward is associated with weight loss following bariatric surgery. J Clin Invest. 2020;130:4370-4381.
- Steinert R, Feinle-Bisset C, Asarian L, Horowitz M, Beglinger C, Geary N. Ghrelin, CCK, GLP-1 and PYY(3-36): secretory controls and physiological roles in eating and glycemia in health, obesity, and after RYGB. Physiol Rev. 2017;97:411-463.
- Treesukosol Y, Moran TH. Analyses of meal patterns across dietary shifts. Appetite. 2014;75:21-29.
- Walsh BT, Kissileff HR, Cassidy SM, Dantzic S. Eating behavior of women with bulimia. Arch Gen Psychiat. 1989;46:54-58.

