- 1.21 薬理遺伝学
- 個別化された精神薬理学の探求
- 薬理遺伝学と薬理ゲノミクス
- 薬物動態学と薬力学
- 薬物動態学の薬理遺伝学
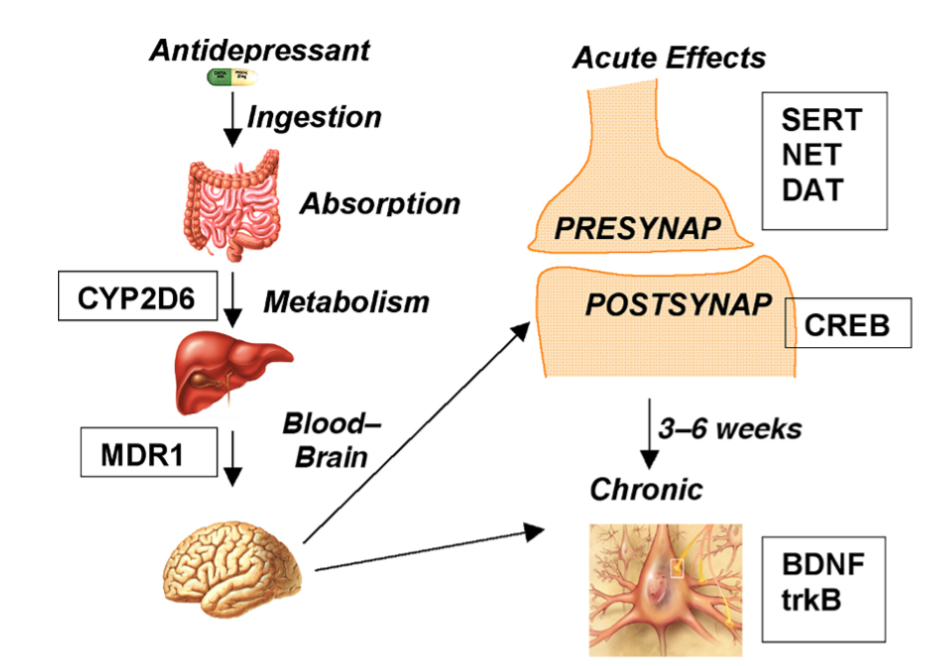
- 図 1.21-1. 抗うつ薬が摂取されてから薬物動態学(左側の列)を経て薬力学(右側の列)に至るまでの軌跡。
- CYP3A4
- CYP2C19
- CYP2D6
- 図 1.21-2. 選ばれたCYP2D6の遺伝子多型とその機能的影響。
- 図 1.21-3. 異なる治療領域で使用される薬剤との関連性に応じて認識されている(非HLA)薬理遺伝子を示すベン図。
- 親薬物の血中濃度を超える薬物動態学
- 図 1.21-4. コデイン代謝経路。
- 1つの薬物の薬物動態が複数の活性化合物を生成する可能性
- 薬物動態学とアルコール依存症
- 薬物動態学、薬理遺伝学、および薬物の脳への移行
- 地理的および民族的な薬物動態学的変動性
- FDA薬理遺伝学的関連性表:精神医学および神経学に関連する遺伝子-薬物組み合わせ(抜粋)
- FDA薬理遺伝学的関連性表:精神医学および神経学に関連する遺伝子-薬物組み合わせ(抜粋)
- FDA薬理遺伝学的関連性表:精神医学および神経学に関連する遺伝子-薬物組み合わせ(抜粋)
1.21 薬理遺伝学
ジュリオ・リシニオ医師、博士、MBA、MS、および マリ・ウォン医師、博士
なぜ、ある個人は薬理学的治療によく反応し、他の個人はそうではないのでしょうか?この根本的な問いは、治療反応の不均一性の根底にあり、これは精神疾患の薬理学的治療における最大の課題の一つです。精神薬理学的介入に非常に良く反応する人もいれば、そうでない人もいます。同様に、臨床的に意味のある副作用を示す人もいれば、そうでない人もいます。治療結果は、肯定的および否定的な治療反応の複数の組み合わせから構成されます。これらの組み合わせは、大まかに以下の6つのカテゴリに分類できます。
- 完全に肯定的な臨床反応、すなわち、最小限または時折の副作用を伴う寛解または治癒。
- 完全に肯定的な臨床反応だが、臨床的に影響のある副作用を伴う。
- 最小限の副作用を伴う部分的な臨床反応。
- 著しい副作用を伴う部分的な臨床反応。
- 最小限の副作用を伴う限定的な臨床反応。
- 著しい副作用を伴う限定的な臨床反応。
精神疾患の薬物療法は、患者との共同意思決定のプロセスであり、両当事者はリスクと利益のバランスを取らなければなりません。選択には、治療の忍容性を向上させるために有効性を妥協することが含まれる場合があります。医師が患者にとってのリスクと利益をより正確に予測できればできるほど、医師と患者双方の共通の目標を達成するために治療を最適化できる可能性が高まります。このプロセスにおける大きな課題は、治療を開始する前に医師が臨床的有効性や薬剤忍容性を予測する能力が限られていることです。
個別化された精神薬理学の探求
何十年もの間、臨床医は薬理学的治療が施される前に、良好な結果の可能性を特定するマーカーを求めてきました。これらのマーカーがあれば、臨床実践は治療が個別化された(個別化医療)または精密に与えられる(精密医療)状況へと移行するでしょう。現在の日常的な臨床実践では、薬剤標的を考慮する際、選択は薬物有害反応(ADRs)の問題に焦点を当てる傾向があります。例えば、第一選択治療として、心機能障害や心疾患を持つ人に、潜在的な心臓の副作用を持つ薬剤を与えることは避けるでしょう。
臨床反応を予測する能力が限られていることの代償は、多くの患者が意味のある臨床反応を達成する前に治療を中断してしまうことです。この点は、国立精神衛生研究所(NIMH)が資金提供した「うつ病を緩和するためのシーケンス治療代替案(STARD)研究」によって示されました。これは、うつ病治療を評価するためにこれまでに行われた中で最大かつ最長の研究です。STARD試験の全体目標は、プライマリケアおよび専門医療施設において、大うつ病性障害(MDD)と診断された患者のうつ病治療の有効性を評価することでした。この研究は4つのレベルに分かれており、各レベルで異なる薬剤または組み合わせをテストしました。各レベルの主な目標は、そのレベルで使用された治療法が参加者のMDDを適切に治療できるかどうかを判断することでした。寛解しなかった者(すなわち、軽度を超える症状がない者)は次のレベルの治療に進むことができました。レベル1では、参加者の約3分の1が寛解に達し、さらに約10〜15%が反応したが寛解には至りませんでした。ほぼ70%が寛解したことは注目に値し、臨床的に非常に重要です。しかし、参加者が試験を中断する割合は大きく、レベルが上がるごとに増加しました。レベル1後には21%が、レベル2後には30%が、レベル3後には42%が中断しました。
今日のほとんど不正確な精神薬理学を、精密なものへと変革するパラダイムシフトは、臨床精神医学にとって真に革新的なものとなるでしょう。
薬理遺伝学の絶大な魅力は、科学に導かれ、患者の遺伝子構成に基づいて精密に提供される、現実の臨床薬理学的治療の約束から来ています。同様の臨床症状を呈し、同じ薬剤と用量で治療された患者でも、異なる結果を示すことがあります。薬理遺伝学の根底にある中心的な仮説は、個人の遺伝的およびエピジェネティックな構成が治療反応の重要な決定要因であるということです。したがって、特定の薬剤による治療結果と相関する遺伝子配列を特定できれば、これらの配列は特定の患者を特定の治療に適合させるためのバイオマーカーとして機能することができます。逆に、特定の薬剤に対する有害な結果を予測する遺伝的またはエピジェネティックなバイオマーカーは、患者を代替薬剤に誘導し、これらの悪い結果を防ぐために使用することができます。
薬理遺伝学と薬理ゲノミクス
薬理遺伝学には2つの歴史的段階があります。それは、ヒトゲノム全体の粗いドラフトが完成した2000年以前と以後です。2000年以前は、ヒトゲノムの青写真が必要であったため、遺伝子シーケンスは高価で限定的でした。それまでは、特定の遺伝子バリアントを高コストで検査することができました。対照的に、2000年以降は技術が目覚ましいペースで発展し、現在では適度なコストで個人の全ゲノムをシーケンスできるようになりました。参考までに、ヒトゲノムプロジェクトの総費用は30億米ドルと報告されています。今日、全ゲノムシーケンスは、DNAシーケンスの深度レベルに応じて、300〜800米ドルの消費者直販価格で提供されています。
一部の界隈でゲノムワイドデータを見る際、特定の配列の検査に基づく薬理遺伝学と、全ゲノム配列データに基づく薬理ゲノミクスの間で区別が設けられました。しかし、本書のこの章を含む多くの設定では、薬理遺伝学と薬理ゲノミクスという用語は交換可能に使用されています。
薬物動態学と薬力学
治療反応を最適化しようとするとき、薬理遺伝学に直接関連する薬理学の2つの重要な側面、すなわち薬物動態学と薬力学を理解することが不可欠です。異なるタンパク質とそのエンコード遺伝子がそれぞれを媒介しています。したがって、一部の薬理遺伝学的標的は薬物動態経路にマッピングされ、他の標的は薬力学に関連するでしょう(図1.21-1)。
薬物動態学の薬理遺伝学
薬物動態学とは、薬物の利用可能性を調節するすべての因子を指します。薬物は体内に入り、代謝されます。その生体利用能は、薬物投与、代謝、および排泄のバランスを反映しています。薬物代謝は主に肝臓で起こり、特に薬物が門脈血から肝臓に入り、全身循環に達する前の「肝初回通過」で発生します。薬物排泄は主に腎臓を介して行われます。
はい、承知いたしました。提供された文章を逐語的に正確に日本語に翻訳します。
図 1.21-1. 抗うつ薬が摂取されてから薬物動態学(左側の列)を経て薬力学(右側の列)に至るまでの軌跡。
四角は代表的な薬理遺伝学的標的を示します。CYP2D6、シトクロムP450ファミリー2サブファミリーDメンバー6;MDR1、多剤耐性タンパク質1、別名アデノシン三リン酸(ATP)結合カセットサブファミリーBメンバー1、ABCB1;SERT、セロトニントランスポーター、別名溶質キャリアファミリー6メンバー4、SLC6A4;NET、ノルエピネフリントランスポーター、別名溶質キャリアファミリー6メンバー2、SLC6A2;DAT、ドーパミン活性トランスポーター、別名溶質キャリアファミリー6メンバー3、SLC6A3;CREB、サイクリックアデノシン一リン酸(cAMP)応答エレメント結合タンパク質;BNDF、脳由来神経栄養因子、およびtrkB、チロシン受容体キナーゼB、BDNFの受容体。(カラー画像はeBookを参照。)
薬物代謝酵素はシトクロムP450(CYP)スーパーファミリーに属します。ヒトゲノムプロジェクトのデータによると、様々なCYP酵素をコードするヒト遺伝子は57個あります。そのうち、ごく少数ですが非常に重要なサブセットが精神医学に特に関連しています。なぜなら、それらは私たちの分野で用いる多くの薬剤を代謝するからです。さらに、それらは機能的に関連する複数の遺伝子変異を持ち、薬理遺伝学に基づいた治療最適化の主要な標的となります。具体的には、6つのCYPが薬剤の90%を代謝します。最も重要な2つの酵素はCYP3A4とCYP2D6です。
複数の薬剤とCYP酵素の間には複雑な関係があることに注意してください。一方で、1つの薬剤が複数のCYPによって代謝されることがあります。他方で、異なる薬剤が同時に摂取された場合、ある薬剤がCYP450酵素の機能に与える影響が、その同じ酵素による別の薬剤の代謝に影響を与えることがあります。具体的には、一部の薬剤はCYP酵素の単なる基質ですが、他の薬剤やハーブ製品はCYP450酵素の活性を誘導または阻害する可能性があります。したがって、CYP2D6の活性を誘導する薬剤(例:ハロペリドール)または阻害する薬剤(例:ブプロピオン、メチルフェニデート、セルトラリン、エスシタロプラム)を服用すると、イミプラミン、フルオキセチン、ベンラファキシン、デュロキセチン、ミルタザピン、オキシコドンなど、CYP2D6の基質となる薬剤の代謝に影響を与えます。臨床的には、ADHDとうつ病を併発している人が、CYP2D6阻害剤であるメチルフェニデートと、フルオキセチン、ベンラファキシン、デュロキセチン、ミルタザピンなどのCYP2D6基質である抗うつ薬の組み合わせで治療されることは比較的よくある状況です。このような場合、患者は(CYP2D6基質である)抗うつ薬を低用量で服用した方がより良く反応する可能性があります。
CYP3A4
この酵素は、トリシクリック抗うつ薬(TCAs)、選択的セロトニン再取り込み阻害薬(SSRIs)、その他の抗うつ薬、ブスピロン、複数の抗精神病薬、オピオイド(主に鎮痛薬)、メサドン、ベンゾジアゼピン、抗けいれん薬、気分安定薬、バルビツール酸塩など、市場に出回っている全薬剤の約50%を代謝します。CYP3A4遺伝子には38を超える**一塩基多型(SNPs)**が同定されており、これらは染色体7q22.1上のCYP450遺伝子クラスターの一部であり、野生型CYP3A4代謝と比較して、特定のリガンド薬剤に対する触媒活性を減少させるものや増加させるものがあります。特筆すべきは、CYP3A4が基質への曝露によって誘導されうることです。CYP3A4活性レベルは、酵素が腸粘膜に広範に存在することを考えると、食生活や異種生体物質への曝露期間、栄養状態などの環境要因とも関連しています。したがって、薬理遺伝学をin vivoでの有意な個体間変動に直接変換することは容易ではありません。
CYP2C19
CYP2C19は、プロトンポンプ阻害薬や抗てんかん薬などの異種生体物質の代謝に関与する酵素を含む、混合機能オキシダーゼ系のCYP2Cサブファミリーのメンバーです。ヒトでは、染色体10q24に位置するCYP2C19遺伝子は、主に肝臓に存在するCYP2C19タンパク質をコードしており、現在臨床で使用されている薬剤の少なくとも10%の代謝に関与しています。これには、抗血小板治療薬として使用されるクロピドグレル(プラビックス)、オメプラゾールなどの鎮痛薬、メフェニトインなどの抗けいれん薬、ジアゼパム、および一部のバルビツール酸塩が含まれます。CYP2C19はエポキシゲナーゼ活性にも関与しており、長鎖多価不飽和脂肪酸の二重結合を攻撃することによってシグナル伝達物質の形成に重要な役割を果たしています。
機能喪失アレルとしても知られるCYP2C192と3は酵素活性の低下に関連しており、機能獲得アレルであるCYP2C19*17は活性の増加につながります。これら3つの変異アレルは、最小限の臨床薬理ゲノム検査パネルに含めることが推奨されています。
CYP2C19は、イミプラミン、アミトリプチリン、トリミプラミン、クロミプラミンなどのいくつかのTCAs、および二次アミンTCAであるノルトリプチリンの代謝にも関与しています。CYP2C19の**低代謝者(PMs)**では、これらのTCAsがより高い血漿濃度と活性代謝物レベルをもたらし、有害作用のリスクが高まることが確認されています。CYP2C19は、シタロプラム、セルトラリン、フルオキセチン、ベンラファキシンなどのSSRIs、および可逆的モノアミン酸化酵素阻害薬モクロベミドの代謝にも関与しています。CYP2C19遺伝子型はシタロプラムの血清濃度に影響を与えることが分かっており、1つまたは2つの機能喪失アレルを持つ患者は、正常代謝者よりも高い用量調整済みセルトラリン血清濃度を有し、これが結果を予測できる可能性があります。
CYP2C19の**超高速代謝者(UMs)**の臨床的関連性はまだ調査中であり、CYP2C19*17は、正常代謝者と比較して、いくつかの抗うつ薬の血清濃度低下に関連していることが確認されています。しかし、抗うつ薬治療におけるUM遺伝子型の臨床的重要性を確認するためには、さらなる研究が必要です。
CYP2D6
CYP2D6は肝臓のCYP含有量の最大2%を占め、水酸化、脱メチル化、脱アルキル化などの特定の機能基の付加または除去により、臨床で使用される薬剤の約25%の代謝と排泄に関与しています。CYP2D6はヒトの22番染色体上の遺伝子によってコードされています。CYP2D6には複数の機能性アレルがあり、その一部は標準的な効果を示しますが、他のものは低い活性または高い活性を持ちます。CYP2D61アレルは一般的に参照アレルとして使用され、遺伝子型検査で変異が検出されない場合に仮定されます。正常な酵素活性を持ち、変異が検出されない個人は、CYP2D61アレルと関連していることが多く、これは広範な代謝者表現型として知られています。一部のグループでは、この用語をこの表現型を持つ個人を指すのに使用しています。CYP2D6遺伝子は、一部の個人で重複または多重重複している場合があり、その場合、非常に高いCYP2D6酵素活性を持ちます。詳細については図1.21-2を参照してください。これらの薬剤は、医学および精神医学で最も広く使用されているものの一つです。異なる治療領域で使用される薬剤との関連性に応じて認識されている薬理遺伝子を示す図については、図1.21-3を参照してください。
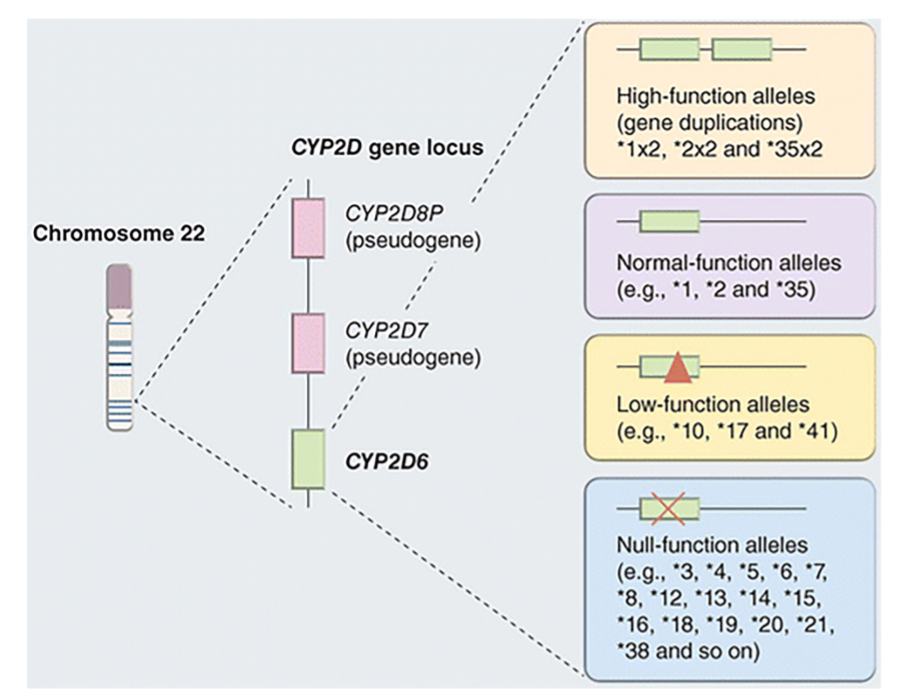
図 1.21-2. 選ばれたCYP2D6の遺伝子多型とその機能的影響。
遺伝的変動性は、CYP2D6における個体間の表現型の多様性の主要な原因です。CYP2D6の遺伝子スペクトルは、ヌルアレル、機能的バリアント、スプライシングバリアント、そして完全な遺伝子喪失、遺伝子増幅、ハイブリッド遺伝子を含む構造的バリアントなど、数百に及ぶ明確に定義されたアレルバリアントから構成されます。少なくとも1つの完全に機能するアレルを持つ**広範な代謝者(EMs)**と比較して、**劣代謝者(PMs)**に分類される個人は2つの非機能性アレルを持ち、CYP2D6薬物基質を排泄する能力が著しく低下しています。**中間代謝者(IM)**表現型は、機能低下アレルが存在することによって生じる、もう一つの遺伝的に決定された形質であり、一方、**超高速代謝者(UM)**表現型は、機能性アレルのCYP2D6遺伝子重複によって引き起こされます。(カラー画像はeBookを参照。)(許可を得て引用元:Zanger UM. Genetic variability of CYP2D6: basic and clinical aspects. In: Baumann P, ed. CYP2D6: Genetics, Pharmacology and Clinical Relevance. Future Medicine Ltd, Future Science Group; 2014:28-41. https://doi.org/10.2217/fmeb2013.14.16.)
CYP3A4はより多くの薬剤を代謝しますが、CYP2D6は最も広く使用されている薬剤の多くを代謝するため、臨床的にはより重要である可能性があります。CYP2D6は精神医学に特に関連しており、全てのTCAs、ほとんどの選択的セロトニン受容体再取り込み阻害薬(フルオキセチン、パロキセチン、フルボキサミンなど)、さらにベンラファキシン、デュロキセチン、ミアンセリン、ミルタザピン、ミナプリン、オピオイド、コデイン、オキシコドン、ヒドロコドン、抗精神病薬(ハロペリドール、リスペリドン、ペルフェナジン、チオリダジン、アリピプラゾール、クロルプロマジン、レボメプロマジン、レモキシプリドなど)、コカイン、アンフェタミン、メトキシアンフェタミン、デキストロメタンフェタミン、リスデキサンフェタミン、アトモキセチンを代謝します。CYP2D6はまた、ベータ遮断薬、抗不整脈薬、カルシウムチャネル遮断薬、H3受容体拮抗薬、抗ヒスタミン薬、およびタモキシフェンなどの他の複数の治療上重要な薬剤も代謝します。
個人のCYP2D6遺伝子アレルの組み合わせに基づいて、個人は機能的に劣代謝者(PMs)(CYP2D6機能がほとんどまたは全くない)、中間代謝者(IMs)(劣代謝者と広範な代謝者の中間程度の速度で薬剤を代謝する)、広範な代謝者(標準的なCYP2D6機能)、および超高速代謝者(UMs)(CYP2D6遺伝子を複数コピー持ち、正常よりも高い機能を持つ)に分類できます。CYPアレルの頻度と代謝者状態は、世界中の集団で異なります。したがって、ある集団からの規範的データが、他の集団に全面的に適用できるとは限りません。

図 1.21-3. 異なる治療領域で使用される薬剤との関連性に応じて認識されている(非HLA)薬理遺伝子を示すベン図。
CYP2D6は4つの異なる治療領域と重複しています。BCHE、ブチリルコリンエステラーゼ;CFTR、嚢胞性線維症膜貫通コンダクタンス制御因子;CYP2B6、CYP2C9、CYP2C19、CYP3A5、CYP4F2、シトクロムP450スーパーファミリーのメンバー;DPYD、ジヒドロピリミジンデヒドロゲナーゼ;F5、因子5;G6PD、グルコース-6-リン酸デヒドロゲナーゼ;IFNL3、インターフェロンラムダ3;ITPA、イノシン三リン酸ピロホスホヒドロラーゼ;NAT2、N-アセチルトランスフェラーゼ2;NUDT15、ヌディックスヒドロラーゼ15;POLG、DNAポリメラーゼサブユニットガンマ;RARG、レチノイン酸受容体ガンマ;SLCO1B1、溶質キャリア有機アニオントランスポーターファミリーメンバー1B1;SLC28A3、溶質キャリアファミリー28メンバー3;TPMT、チオプリンS-メチルトランスフェラーゼ;UGT1A1、UDP-グルクロン酸転移酵素;VKORC1、ビタミンKエポキシド還元酵素複合体。(カラー画像はeBookを参照。)(許可を得て引用元:Taylor C, Crosby I, Yip V, Maguire P, Pirmohamed M, Turner RM. A review of the important role of CYP2D6 in pharmacogenomics. Genes. 2020;11:1295. doi:10.3390/genes11111295. License: https://creativecommons.org/licenses/by/4.0/)
CYP2D6がより活性であるほど、この酵素によって代謝される薬剤はより速く除去されます。したがって、標準用量ではUMにとって不十分な場合があり、より高用量が必要となります。CYP2D6 UMは、単に標準用量が低すぎるために、精神科の薬剤に反応しない場合があります。その場合、彼らにとって優れた薬剤である可能性があるにもかかわらず、適切な用量を受けていないのに、不適切に非反応者とレッテルを貼られてしまいます。逆に、劣代謝者と中間代謝者は、標準的なCYP2D6機能を持つ人よりも処方薬をより遅く分解します。少なくとも15種類のCYP2D6のアレルバリアントがPM表現型を引き起こす可能性がありますが、PMの75%はCYP2D6*4ホモ接合体です。したがって、彼らは標準用量を服用することで、生物活性を持つ薬剤を蓄積し、重篤な副作用を急速に引き起こす可能性があります。患者は、実際には代謝能力をはるかに超える用量で与えられた薬剤に対して不耐性であると誤ってレッテルを貼られてしまいます。この場合、遅い代謝を相殺するために用量を下げる必要があり、個人に合わせた用量で良好に反応する可能性があります。
複数の報告により、治療抵抗性であると見なされた個人が、UMまたはPMのいずれかであることが示されています。UMは十分な薬剤用量を受け取っておらず、PMは薬剤を代謝する能力を超える用量を受け取っていました。したがって、彼らは意図せず急速に過剰摂取となり、臨床効果が得られる前に治療中止につながる薬物有害反応(ADRs)を経験しました。
CYP2D6のフェノコピーとオートフェノコピー。 CYP2D6基質の治療での使用は、遺伝的変動性だけでなく、薬物間相互作用によっても複雑になることがあります。スタチンなどのいくつかの薬剤はCYP2D6阻害剤であり、CYP2D6基質との併用は患者の**見かけの表現型(apparent phenotype)を変化させる可能性があります。この現象はフェノコピー(phenocopying)と呼ばれます。このような状況では、標準的な代謝者表現型を持つ個人が、利用可能な酵素のほとんどが混在する薬剤によって阻害されているため、IMまたはPMのように見えることがあります。CYP2D6薬剤の慢性的な投与で生じる別の関連する表現型はオートフェノコピー(autophenocopying)**と呼ばれ、薬剤濃度が定常状態に達すると、基質が自身の代謝を阻害する現象です。その結果、フェノコピーを示す薬剤の場合、単回投与と反復投与での薬物動態プロファイルが大きく異なる可能性があります。
親薬物の血中濃度を超える薬物動態学
P450遺伝子型が薬剤の生体利用能に与える影響は、親化合物のレベルの単純な薬理学的予測を超えています。多くの場合、薬剤開発は薬物代謝を考慮に入れており、処方され摂取される薬剤は、生物活性を発揮するために代謝を必要とするプロドラッグです。このような場合、上記で説明した状況とは逆の状況が生じます。PMは親薬物をうまく代謝できないため、活性薬剤が不十分である可能性があり、UMは親化合物を非常に速く代謝するため、活性薬剤が過剰に急増する可能性があります。
薬剤は様々な理由でプロドラッグとして製剤化されることがあります。これには、製造および保管中の安定性の向上、体内での吸収の促進、または優れた薬物動態学が含まれます。プロドラッグのこれらすべての利点により、薬剤製剤での使用が魅力的になります。1958年にアルバートによって提唱されたプロドラッグの概念は、それ以来、薬剤が体内で代謝されて薬理学的に不活性になるまで、その物理的および化学的特性を変化させるために使用されてきました。
リスデキサンフェタミン
リスデキサンフェタミン(LDX)は、ADHDおよび過食性障害の治療のための最初の長期作用型刺激剤プロドラッグという独自のタイプです。他の薬学的アンフェタミンと同様に、適応外使用もされています。LDXは不活性であり、強力な中枢神経系(CNS)刺激剤であるデキストロアンフェタミンに変換されるために加水分解を必要とします。LDXの化学構造は、アミノ酸L-リジンがデキストロアンフェタミンに結合したものです。薬物の有効性は薬物動態特性に直接関連しないかもしれませんが、LDXの症状に対する significant な影響は、不活性プロドラッグからの加水分解による活性成分であるd-アンフェタミンの予測可能な生体利用能と関連している可能性があります。米国では2007年にLDXの医療使用が承認され、2020年には国内で85番目に多く処方された薬剤となり、800万件以上の処方がありました。LDXは、英国ではクラスB規制物質、米国ではスケジュールII規制物質に分類されています。
コデイン
コデインは、図1.21-4に示されているように、CYP2D6酵素によって強力なミューオピオイド受容体アゴニストであるモルヒネに変換されるプロドラッグです。超高速代謝者(UM)は、モルヒネやモルヒネ-6-グルクロニドなどのより高レベルの活性代謝物を産生するため、呼吸抑制を含むオピオイド関連の副作用のリスクが増加します。いくつかの症例報告では、CYP2D6遺伝子の機能的重複によるUM患者において、重篤で生命を脅かすオピオイド中毒が記録されています。さらに、臨床研究では、母親が超高速代謝の遺伝子型を持つ母乳育児の新生児は、呼吸抑制のリスクが高いことが示されました。その結果、臨床薬理遺伝学実施コンソーシアムは、コデインを処方する前に遺伝子型検査を推奨するガイドラインを発表しました。さらに、分娩後の鎮痛に関する観察研究では、劣代謝遺伝子型を持つ患者はコデインから鎮痛効果を得られず、超高速代謝遺伝子型を持つ患者は鎮静を経験したことが明らかになりました。
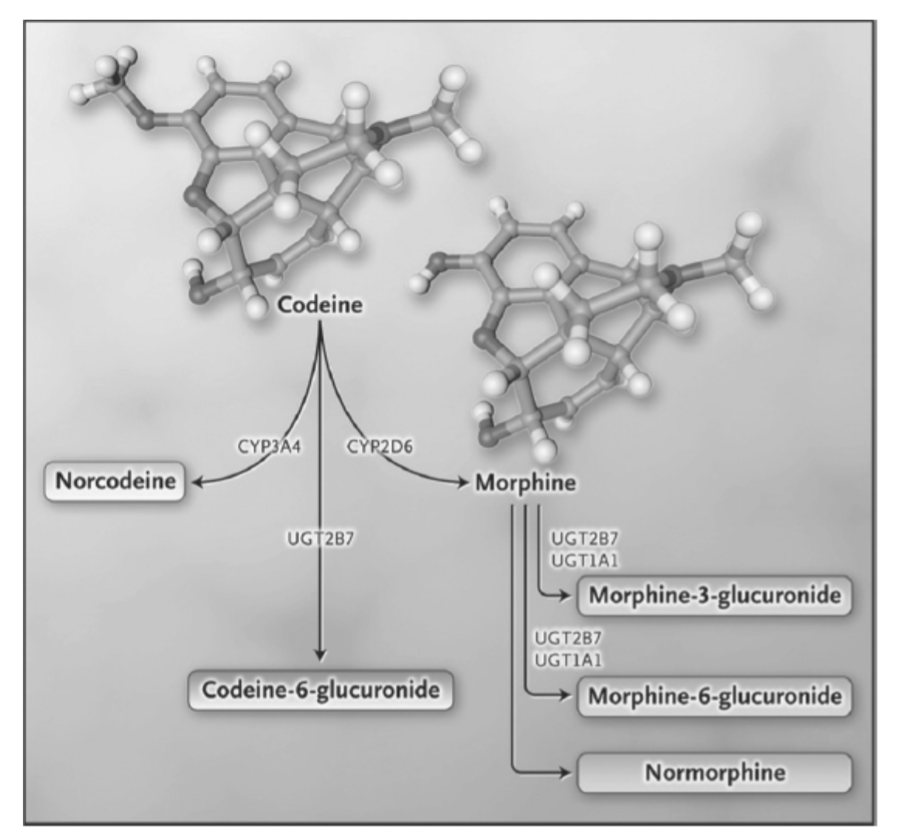
図 1.21-4. コデイン代謝経路。
コデインの活性は、CYP2D6によるモルヒネへの変換に依存しています。モルヒネはその後、UDP-グルクロノシル転移酵素2B7によって活性なモルヒネ-6-グルクロニドに代謝されます。CYP2D6をコードする遺伝子には多くの遺伝子変異があり、これがコデインが活性型に変換される量に影響を与え、その結果、薬物の効果にばらつきが生じます。(Racoosin JA, Roberson DW, Pacanowski MA, Nielsen DR. New evidence about an old drug-risk with codeine after adenotonsillectomy. N Engl J Med. 368;23:2155-2157より。)
トラマドール
同様に、もう一つのプロドラッグであるトラマドールは、CYP2D6によってO-デスメチルトラマドール、別名(+)-M1に代謝され、これはμ-オピオイド受容体活性を有します。UM遺伝子型を持つ患者は、トラマドール代謝産物レベルが高く、実験的な疼痛からの不快感が軽減されることが分かっています。対照的に、PM遺伝子型を持つ患者は、検出可能な代謝物レベルが低く、臨床効果が最小限でした。症例報告では、UM遺伝子型を持つ患者における呼吸抑制の潜在的リスクも強調されています。
1つの薬物の薬物動態が複数の活性化合物を生成する可能性
その他のより複雑なケースでは、親薬物とその代謝物の両方が生物活性を持ちます。投与された薬物の薬物動態が、親化合物とは異なる特性を持つ活性代謝物を生み出す例はいくつかあります。CYP酵素の薬理遺伝学は、CYP酵素アイソフォームの生物活性により生成される親化合物と代謝物の異なる組み合わせに基づいて、最終的な治療効果を決定する可能性があります。精神薬理学にはそのようなケースがいくつかあります。ここでは、いくつかの例を挙げます。
クロザピンとデスメチルクロザピン
クロザピンとその活性代謝物であるN-デスメチルクロザピン(NDMC)は、CYP1A2、CYP2D6、CYP3A4、CYP2C19を含むいくつかのCYP酵素によって代謝されます。CYP1A2の活性は、クロザピンの必要量を決定する上で特に関連があります。クロザピンはD2/D3受容体拮抗薬として作用する非定型抗精神病薬ですが、NDMCはこれらの受容体に内在的な活性を持ち、アリピプラゾールやビフェプルノックスと同様に弱い部分アゴニストとして作用します。さらに、NDMCはクロザピンとは異なり、M1およびデルタオピオイド受容体に対して強力なアゴニストであることが示されています。NDMCのこれらの独自の作用は、クロザピンが他の抗精神病薬よりも臨床的に優れていることの責任があるという仮説につながりました。しかし、臨床試験では、NDMC単独では統合失調症の治療、特に陽性症状の管理には効果がないことが示されています。それにもかかわらず、NDMCが疾患の認知症状や陰性症状の治療におけるクロザピンの有効性に寄与する可能性は依然としてあります。M1受容体アゴニズムを標的とすることは、統合失調症や他の神経精神疾患における認知機能障害に対処できる薬剤を開発するための有望な道筋となる可能性があります。
クロミプラミンとデスメチルクロミプラミン
TCAであるクロミプラミンは、排泄前に著しい生体内変換を受けます。肝臓初回通過代謝の主要な経路の1つは、CYP2C19、CYP3A4、CYP1A2を含むいくつかのCYP酵素によるデスメチルクロミプラミンへの脱メチル化です。in vivo研究ではCYP2C19がこのプロセスに関与していることが示されており、in vitro研究ではCYP3A4とCYP1A2の関与が示されています。特筆すべきは、喫煙者は非喫煙者よりもクロミプラミンの血漿濃度が低いことであり、これは喫煙誘発性のCYP1A2の役割を示唆しています。デスメチルクロミプラミンは活性代謝物であり、親薬物よりも強力なノルエピネフリン再取り込み阻害薬であり、より弱いセロトニン再取り込み阻害薬です。親薬物と活性代謝物の両方は、CYP2D6によって触媒される水酸化を受け、8-ヒドロキシデスメチルクロミプラミン、8-ヒドロキシクロミプラミン、2-ヒドロキシクロミプラミン、2-ヒドロキシデスメチルクロミプラミンを含むいくつかの代謝物を形成します。2-および8-水酸化された代謝物は、主にグルクロニド抱合体として腎臓から排泄されます。デスメチルクロミプラミンは、さらに脱メチル化されてジデスメチルクロミプラミンを生成することもあります。消失半減期は、クロミプラミンで約24時間、デスメチルクロミプラミンで96時間です。通常、定常状態濃度に達するまでには約3週間かかります。
デキストロメトルファンとデキストロルファン
デキストロメトルファン(DM)とその活性代謝物であるデキストロルファン(DXO)は、抗うつ薬ケタミンと薬力学的類似性を共有しており、速効性、従来の、および治療抵抗性抗うつ薬の特性を持つことが示唆されています。DMは主にCYP2D6によってDXOに代謝されます。DXOはN-メチル-D-アスパラギン酸(NMDA)拮抗薬であり、DMの精神作用効果に寄与し、動物にフェンサイクリジン様の行動効果を産生します。さらに、DXOは様々な実験モデルで抗けいれん作用と神経保護作用を示します。
ジアゼパムとオキサゼパム
ジアゼパムは、CYP2C19によってノルジアゼパムに、またはCYP3A4によってテマゼパムに代謝されます。ノルジアゼパムとテマゼパムは水酸化および脱メチル化されてオキサゼパムになります。オキサゼパムはその後グルクロン酸抱合されて尿中に排泄されます。したがって、その薬物動態により、ジアゼパムを服用する人は、ノルジアゼパム、テマゼパム、オキサゼパムを含む複数の活性代謝物の組み合わせを持つことになります。ジアゼパムは不安を治療しますが、依存症を引き起こす可能性が高くなります。オキサゼパムは短期的な不安や不眠症を治療し、アルコール離脱症状の予防のための第一選択薬としても使用されます。
薬物動態学とアルコール依存症
薬物代謝(薬物動態学)は、アルコール使用障害(AUD)への感受性を決定する可能性があります。脳を含む様々な臓器に対するアルコールの影響は、エタノールの量と曝露期間によって左右されます。これらの要因は、エタノールが血流および組織に吸収される速さと、それが効率的に代謝される速さによって影響を受けます。肝臓はエタノール代謝の主要な部位であり、エタノール代謝の主なプロセスは、アルコール脱水素酵素(ADH)酵素を介してアセトアルデヒドに変換され、次にアルデヒド脱水素酵素(ALDH)酵素によって酢酸に変換されることを含みます。CYP2E1などの他の酵素は、摂取されたエタノールの少量部分を代謝します。複数の遺伝子がADHおよびALDH酵素をコードしており、これらの酵素のバリアントは、エタノールおよびアセトアルデヒドの代謝および産生レベルの速度が異なります。これらのバリエーションは、個人の飲酒パターンとアルコール依存症を発症する可能性に影響を与える可能性があります。特定のADHおよびALDHアレルは、アルコール依存症になるリスクを軽減することが示されており、これらの遺伝子関連は広く認識され、重要です。しかし、ADHおよびALDHバリアントの頻度は民族グループによって異なります。
ADHおよびALDHバリアントがアルコール依存症のリスクに影響を与えるメカニズムは、アセトアルデヒドレベルの増加を伴います。これは、エタノールのより速い酸化(より活性なADHバリアントの場合)またはアセトアルデヒドのより遅い酸化(より活性の低いALDHバリアントの場合)のいずれかによる可能性があります。アセトアルデヒドは、顔の紅潮、吐き気、頻脈などの不快な反応を引き起こす可能性のある毒性物質です。高速エタノール酸化に関連するADH1B2アレルは、様々な集団でアルコール依存症に対する防御効果を示します。
東アジア人では、ADH1B1アレルを2つ持つ人と比較して、ADH1B2アレルを1つ持つことでアルコール依存症の発症オッズ比が0.19に、ADH1B2アレルを2つ持つことで0.12に減少します。ADH1B2アレルはヨーロッパおよびアフリカの集団ではあまり一般的ではありませんが、依然としてアルコール依存症に対する防御効果を発揮します。ユダヤ系の人々の間では、ADH1B2アレルは中程度の頻度で発生し、大量飲酒とアルコール依存症のリスクを軽減します。しかし、ADH1B2の防御効果は、ヨーロッパの集団ではアジアの集団よりも弱く、これは社会環境要因の変動による可能性があります。また、ヨーロッパ人とアジア人の間で異なる可能性のある、アルコール依存症のリスクに影響を与える他の未同定のADH変異と共遺伝している可能性もあります。
薬物動態学、薬理遺伝学、および薬物の脳への移行
肝臓酵素に加えて、精神疾患の治療に用いられる薬剤など、脳内で作用する薬剤の薬物動態は、薬剤のCNSへの移行を調節するタンパク質に依存します。例として、アデノシン三リン酸(ATP)結合カセット(ABC)サブファミリーBメンバー1(ABCB1)、別名**多剤耐性タンパク質1(MDR1)**は、ヒトABCトランスポーターのスーパーファミリーに属する49の推定メンバーの1つであり、排出ポンプとして機能するトランスポーターおよびチャネルタンパク質をコードしています。ABCB1/MDR1は、いくつかの抗うつ薬の脳内濃度を調節しているようです。
地理的および民族的な薬物動態学的変動性
CYP酵素は非常に多型性であり、膨大な遺伝的変動性を持っています。この変動性は、連邦政府の資金提供を受けた2つの接続されたデータベース、すなわちファーマコジーン・バリエーション・コンソーシアム(PharmVar、https://www.pharmvar.org)とファーマコゲノミクス知識ベース(PharmGKB、https://www.pharmgkb.org)に蓄積され、自由に利用可能です。例として、PharmVarは171種類のCYP2D6アレルを示しており、そのほとんどが複数のバリアントを持ち、数百種類のCYP2D6アレルバリアントの存在を実証しています。CYP2C19については、PharmVarは39種類のアレルを示しており、その一部はいくつかのバリアントを持っています。一方、CYP2C19についても、PharmVarは38種類のアレルを示しており、その一部もいくつかのバリアントを持っています。これらのアレル頻度は、世界中の異なる地域や民族グループ間で大幅に異なります。したがって、特定の薬剤の治療域は、世界中の多様な集団の遺伝子構成によって大きく異なる可能性があります。
CYP2D6 UMを例にとると、UMにおけるアレル頻度にはかなりの変動性が見られます。これは、CYP2D6によって代謝される薬剤の標準用量が体から急速に排泄されるため、これらの個人が治療不足になる傾向があるためです。したがって、UMがより高い入院率を持つのは驚くべきことではありません。おそらく、これは彼らの基礎疾患が十分に治療されていないためと考えられます。集団間のUMの割合の非常に劇的な変動を示すために、米国ケンタッキー州で実施された大規模な研究では、CYP2D6 UMの全体的な有病率は白人で1.5%、アフリカ系アメリカ人で2.0%でした。これは他の研究とも一致しています。対照的に、Aklilluら(2006年)による別の研究では、エチオピアの人口の29%がCYP2D6遺伝子の重複または多重重複アレルを持っていたことが示されています。サウジアラビアでは、McLellan RAら(1997年)によって文書化されているように、研究された被験者の21%がCYP2D6遺伝子重複を示す遺伝子プロファイルを持っていたことが示されています。
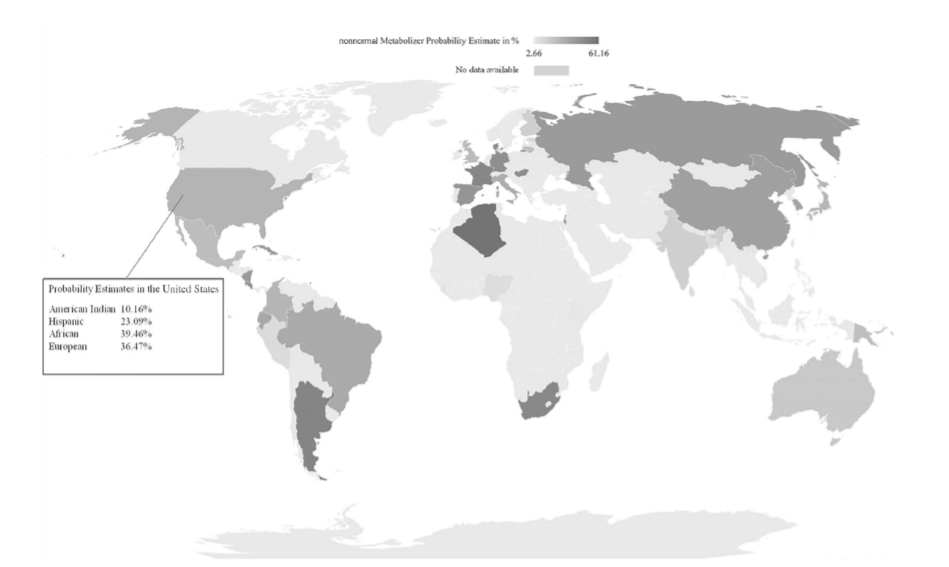
FIGURE 1.21-5. 世界のCYP2D6非正常代謝能者予測の推定値
(Koopmans AB、Braakman MH、Vinkers DJ、Hoek HW、van Harten PN. Meta-analysis of probability estimates of worldwide variation of CYP2D6 and CYP2C19. Transl Psychiatry. 2021;11:141. doi:10.1038/s41398-020-01129-1. ライセンス:https://creativecommons.org/licenses/by/4.0/より)
Koopmansらは、CYP2D6とCYP2C19の世界的な多様性の確率推定値のメタアナリシスを実施した。対立遺伝子の重複頻度が高いため、北アフリカのサハラに住むベルベル系民族であるモザブ人ではCYP2D6のUM(超迅速代謝能者)の割合が高く(39.5%)、非オーストロネシア系メラネシア人では21.5%、中東のドルーズ民族では21.4%であった。一方、CYP2D6*4の頻度が高いため、ヨーロッパ人ではCYP2D6のPM(低代謝能者)の割合が高く、例えばイギリス人では12.1%、デンマーク人では10.6%、バスク人(フランス)では9.7%であった。世界中の民族別のCYP2D6予測表現型の頻度は、図1.21-5にまとめられている。
このような証拠は、UMを一例として示している。CYP2D6のPMについても、集団間で大きなばらつきが存在する。Bertilssonらは、スウェーデンの白人では6.3%がPMであると報告した。この発生率は、他のヨーロッパ系白人集団(7%〜10%)と非常によく似ている。北京のLouおよび共同研究者との共同研究により、中国人におけるPMの発生率はわずか1%であることが示された。日本人と韓国人でも同様にPMの発生率が低いことが示されている。彼らが様々なコミュニティでPMを評価した際、アフリカの様々な黒人集団の遺伝的異質性について議論した。世界中の集団におけるCYP2D6表現型を遺伝子型から見て、Gaedigkらは、PM状態(活性スコア、AS = 0)を予測する主要な民族グループ間で対立遺伝子頻度が世界中の集団で0.4%から5.4%の間で大きく異なることを示した。遺伝子型の中間(AS = 0.5)および標準(AS = 1、1.5、または2)代謝能者の有病率は、それぞれ0.4%から11%および67%から90%の間で変動する。最後に、被験者の1%から21%(AS >2)はUM状態であると予測されている。0.4%から5.4%および1%から21%の範囲は広範であり、標準用量が世界中の集団で標準ではないことを示している。
文化または民族に関連する薬理遺伝学?
考慮すべきもう1つの点は、文化と対立遺伝子頻度の両方が集団によって異なり、時には薬理遺伝学的変異が文化的な要因と誤解される可能性があることである。例えば、ヒスパニック系女性では、うつ病の症状やADR(有害薬物反応)が身体症状として現れることがよくある。これらの症状には、疲労、頭痛、腰痛、不眠症、食欲不振などが含まれる可能性があり、ヒスパニック系の人々では、遺伝的背景によるものである可能性があるにもかかわらず、文化的な要因に誤って起因させられることがある。我々の薬理遺伝学的研究では、CYP2D6*4のホモ接合体であり、結果としてPMであったヒスパニック系の患者について報告した。低用量の抗うつ薬を服用しているにもかかわらず、治療薬の血中濃度は治療域を大幅に超え、不安の悪化、動悸、過換気、筋肉痛などの身体症状を含むADRを伴っていた。彼らは抗うつ薬の将来の薬理遺伝学研究に参加していたため、適切に管理された。彼らの遺伝的に決定された身体症状は、他の状況では容易に文化的な要因に起因させられた可能性がある。
薬力学の薬理遺伝学
薬力学とは、薬物と標的、この場合は中枢神経系(CNS)との相互作用、および薬物の効果と作用機序に関連するすべての下流の効果を指す。薬物は、薬物動態学的要因の文脈で標的に十分な濃度を達成する必要があるため、失敗する可能性がある。一方、標的細胞で十分な、あるいは高いレベルであっても、受容体や輸送体などの薬物標的のレベル、または下流のセカンドメッセンジャー経路のレベルで機能的に関連する遺伝的変異があるため、一部の個人は薬物に十分に反応しない可能性がある。臨床薬理学は、薬物代謝に関与する酵素とその遺伝子に基づく機能的変動性を特定するために大きく進化してきたが、ほとんどの向精神薬の最終的な作用機序と治療経路を完全に特定するにはまだ至っていない。不安やADHDの治療に使用される薬物など、いくつかの例外を除いて、精神医学で使用されるほとんどの薬物は、すぐに直接的な標的に到達するにもかかわらず、治療効果を発揮するのに長い時間がかかる。これらの標的には、SSRIsの標的であるSLC6A4遺伝子によってコードされるヒトセロトニントランスポーター、および抗精神病薬の標的であるDRD2遺伝子によってコードされるD2Rとしても知られるドーパミン受容体D2が含まれる。臨床効果は、連続的な薬物治療に数日から数週間を要するため、薬物作用機序は初期標的を超えており、最終的な治療目的はまだ特定されていない。精神医学で使用されるほとんどの薬物の作用機序を完全に解明することなく、薬力学的レベルで治療反応の薬理遺伝学的バイオマーカーを開発することは困難である。この知識基盤が成長するにつれて、潜在的な薬力学的薬理遺伝学的標的の数は指数関数的に増加する。例えば、2011年に我々は抗うつ薬の薬理遺伝学における29の薬力学的標的をカバーする論文を発表した(Licinio & Wong, 2011)。2023年にPharmGKB.orgで抗うつ薬の薬理ゲノミクスを検索すると、1,300の変異アノテーションと334の臨床アノテーションが見つかる。
良い点として、治療反応の新しい薬力学的経路が特定されるにつれて、それらの経路に関連する遺伝子が将来の薬理遺伝学的検査の自然な目標となるだけでなく、概念的に新しい治療法の治療標的となる可能性も秘めている。
特定の精神疾患の薬理遺伝学
この進化する分野は、他の場所で専門的にレビューされている。我々は、このトピックに関する最初の本の1つを編集した(Licinio & Wong, 2009)。読者には、主要なうつ病や双極性障害の薬理遺伝学、リチウム治療反応の薬理遺伝学に関する興味深い研究、ケタミンの薬理遺伝学の進歩など、我々の参考文献セクションに記載されている各疾患に関する関連する最新の論文を参照していただきたい。統合失調症では、抗精神病薬の使用、特にクロザピンに限らず、大幅な体重増加や代謝合併症を発症しやすい患者を特定するための薬理遺伝学の利用が特に注目されている。その他の新たな薬理遺伝学的関心分野には、ADHD、強迫性障害(OCD)、神経性食欲不振症などが含まれるが、これらに限定されない。
抗うつ薬を例にとると、図1.21-1は薬物摂取から作用までのステップを示しており、その途中に代表的な薬理遺伝学的標的がある。抗うつ薬と抗精神病薬を事例として、図1.21-6と図1.21-7は、CYP2D6を介した抗うつ薬(図1.21-6参照)と抗精神病薬(図1.21-7参照)の薬物動態への定量的影響を示している。
薬理遺伝学的検査:簡単な概要
CYP酵素に関連する遺伝子プロファイルに基づいて薬物用量を最適化することは、臨床現場にすぐに翻訳できる薬理遺伝学の構成要素である。新たな翻訳の例として、現在では、CYP酵素遺伝子型とその予測される機能的能力を考慮して薬物と用量を調整することにより、抗うつ薬の最適な処方に関する情報を提供する様々なメディケア資金提供の薬理遺伝学的検査が存在する。
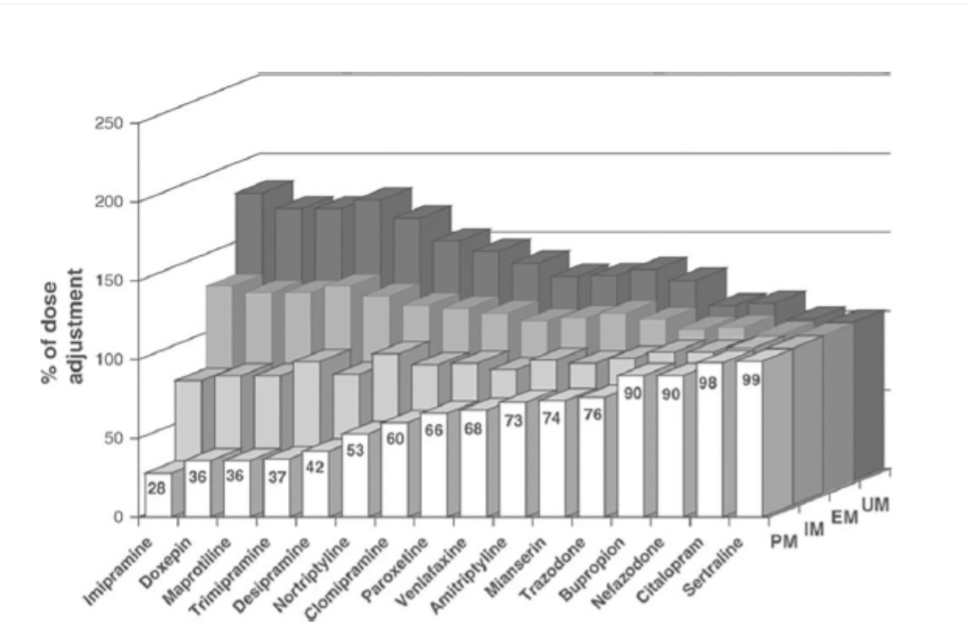
FIGURE 1.21-6. 抗うつ薬の薬物動態に及ぼすCYP2D6を介した定量的影響(用量調整率で表示):PM(白)、IM(灰色)、EM(濃い灰色)、UM(黒)。活性薬物部分(活性のある代謝物とラセミ体の活性型エナンチオマーの親薬物から構成される)に関するデータが提供されている場合、用量推奨はこれらのデータのみに基づいて行われた(そのような詳細な情報を提供していない他の研究は組み込まれなかった)。複数の研究が統合された場合、各研究における低代謝能者の数に応じて、用量調整の加重平均が採用された。ミルタザピン、モクロベミド、フルオキセチン、およびマプロチリンに関するデータは、現在、CYP2D6に基づく用量調整が推奨できないため、図には示されていない。(Kirchheiner J, Nickchen K, Bauer M, et al. Pharmacogenetics of antidepressants and antipsychotics: the contribution of allelic variations to the phenotype of drug response. Mol Psychiatry. 2004;9:442-473. doi: 10.1038/sj.mp.4001494より許諾を得て転載。)
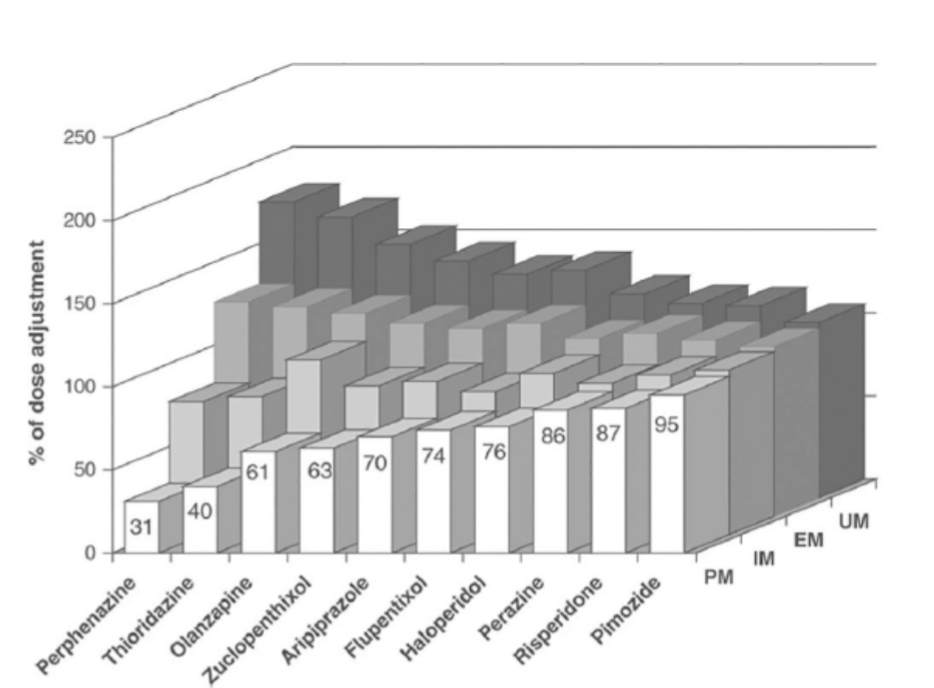
FIGURE 1.21-7. 抗精神病薬の薬物動態に及ぼすCYP2D6を介した定量的影響(用量調整率で表示):CYP2D6 PM(白)、IM(灰色)、EM(濃い灰色)、UM(黒)。(Kirchheiner J, Nickchen K, Bauer M, et al. Pharmacogenetics of antidepressants and antipsychotics: the contribution of allelic variations to the phenotype of drug response. Mol Psychiatry. 2004;9:442-473. doi: 10.1038/sj.mp.4001494より許諾を得て転載。)
薬物動態に関連するトランスレーショナル薬理遺伝学の潜在的な容易さにもかかわらず、この薬理学の構成要素が主に生物学的利用能に対処していることを強調する必要がある。したがって、薬理遺伝学を通じて薬物動態を最適化することで、適切な量の薬物が治療標的に到達することを確実にするだけである。しかし、それは薬力学に依存する治療効果を保証するものではない。
薬力学的標的に関する知識の限界は、薬理遺伝学の臨床現場への完全な翻訳を妨げている。現在ウェブサイトで提供されている情報に基づく例として、メディケアが資金提供するCastle’s IDgenetix Pharmacogenetic Testingは、以下の15遺伝子をカバーすることで精神薬理学の実践をサポートしている。薬物動態側では、ABCB1、CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP3A4、CYP3A5。対照的に、薬力学側では、ADRA2A、COMT、HTR2A、HTR2C、MTHFR、NAT2、OPRM1、SLC6A4の遺伝子が検査される。MyriadのGeneSightは8遺伝子にわたる変異をカバーしており(薬物動態:CYP1A2、CYP2C9、CYP2C19、CYP3A4、CYP2B6、CYP2D6、薬力学:HTR2A、SLC6A4)、Invitae Mental Health Pharmacogenomics Panelは、以下の15遺伝子の変異を検査する。そのうち7つはCYP酵素をコードしており、CYP1A2、CYP2B6、CYP2C19、CYP2C9、CYP2D6、CYP3A4、CYP3A5、COMT、GRIK4、HLA-A、HLA-B、HTR2A、HTR2C、MTHFR、UGT2B15である。
市販の薬理遺伝学的検査:重大な翻訳上の限界
市販の検査が実際の治療反応を予測できるようになるには、精神疾患の治療に一般的に使用される薬物の作用機序と関連する薬理遺伝学について、さらに多くの知識が必要である。Hicksら(2020)が述べているように、2018年、食品医薬品局(FDA)は、臨床薬理遺伝学的検査の有用性を裏付ける臨床的証拠が不足している可能性があると注意を促した。さらに、FDAは、ある検査機関に対し、その臨床薬理遺伝学的検査のマーケティングと遺伝子内容に関して警告書を発行した。しかし、2020年2月20日のプレスリリース「遺伝情報間の関連性を裏付ける科学的証拠の共同レビューを発表(FDA Announces Collaborative Review of Scientific Evidence to Support Associations Between Genetic Information)」において、FDAは「遺伝子検査は、薬剤の選択や用量を改善し、患者に合わせた治療を行うことで患者管理を強化できるが、それは確固たる科学に基づいている場合に限られる。だからこそ、[彼らは]FDAの医療機器・放射線保健センターと医薬品評価研究センターとの協力を開始し、薬理遺伝学における現在の科学の状況に関する機関の見解を提供するつもりである」と認識している。この「新しいウェブベースのリソースには、特定の遺伝的変異、または遺伝的変異から推測される表現型と薬物代謝の変化、そして場合によっては、有害事象のリスクの違いを含む、異なる治療効果との間で記述されている関連性を裏付けるのに十分な科学的証拠があると我々が考える遺伝子-薬物相互作用の一部を記述する表が含まれている」。その声明で約束されたように、FDAは現在、薬理遺伝学的関連性の表を維持し、常に更新している(参照:Rubinstein and Pacanowski, 2021)。本章では、表1.21-1は、精神医学と神経学に関連する薬剤のみに焦点を当てたFDAの大きな表を要約している。表1.21-1を見ると、強調表示されているすべての遺伝子は、薬物動態またはADRのみに関与している。この表には薬力学的標的は特定されていない。
例えば、抗うつ薬の作用機序は、薬力学的レベルで、現在の市販の薬理遺伝学的検査によって検査されるよりもはるかに多くの遺伝子とその変異を伴うことは自明である。したがって、この種の検査は用量調整(薬物動態)には役立つ可能性があるが、多くの患者は、用量にかかわらず、特定の薬物にうまく反応しない(薬力学)であろう。
2020年の社説で、SmithとNemeroffは「PGx(薬理遺伝学)の分野は急速に進歩しているが、その有用性の証拠は乏しい。抗うつ薬治療の決定を導くためのPGx検査の普遍的な使用を裏付ける証拠が不十分であることは明らかである。もちろん、遺伝子構造は、抗うつ薬反応の個人差に寄与するパズルのピースの1つにすぎない。併用薬、民族性、性別、喫煙状況、併存疾患などの個人的または環境的変数も重要である。」と述べている。
精神医学における薬理遺伝学の臨床応用における根本的な限界は、連邦政府または財団から資金提供を受け、したがって製薬会社や検査会社の偏りのない、精神科治療の有効性に関する厳格な査読済みの前向き多施設研究が不十分であることである。例えば、20年間にわたり、小児急性リンパ性白血病(ALL)の治療のための新薬はなかった。しかし、その期間中に、厳格な多施設研究に導かれた既存の薬物のより良い使用により、臨床転帰は大幅に改善し続けた。薬理遺伝学を研究デザインの不可欠な部分として含む可能性のある、そのような大規模で厳格な前向き多施設査読済み研究は、癌、心臓病、糖尿病、神経疾患などの様々な治療分野で実施されてきた。しかし、精神疾患については必要とされるほど実施されていない。上記のSTARDは重要な前進であったが、NIH(米国国立衛生研究所)による契約であり、査読済みの多施設R01または類似の研究助成金研究ではなかった。STARDの重大な限界は、薬理遺伝学が研究デザインの一部ではなく、後から付け加えられたことであった。それが追加されたとき、研究はすでに進行中であり、その目的のために血液が採取された。ADRに関連する薬理遺伝学を含む複数の理由で早期に脱落した参加者は失われ、彼らのDNAはシーケンスされなかった。大規模で(そして費用のかかる)、全国的、査読済み、多施設、厳格に管理された臨床研究がない場合、精神医学におけるエビデンスに基づく薬理遺伝学的検査の成長には重大な限界がある。
表1.21-1.
2023年2月時点でFDA薬理遺伝学的関連性表から抽出された、精神医学および神経学に関連する代表的な遺伝子-薬物組み合わせ
セクション1:データが治療管理の推奨を裏付ける薬理遺伝学的関連性
FDA薬理遺伝学的関連性表:精神医学および神経学に関連する遺伝子-薬物組み合わせ(抜粋)
| 影響を受けるサブグループ | 薬物 | 遺伝子 | 遺伝子-薬物相互作用の記述 |
| 低代謝能者 | アンフェタミン | CYP2D6 | 全身濃度および有害反応リスクに影響を与える可能性がある。低用量から開始するか、代替薬剤の使用を検討する。 |
| 低代謝能者 | アリピプラゾール | CYP2D6 | 全身濃度が高くなり、有害反応リスクが高まる。用量調整が推奨される。具体的な用量推奨についてはFDAの添付文書を参照すること。 |
| 低代謝能者 | アリピプラゾールラウロキシル | CYP2D6 | 全身濃度が高くなる。用量調整が推奨される。具体的な用量推奨についてはFDAの添付文書を参照すること。 |
| 低代謝能者 | アトモキセチン | CYP2D6 | 全身濃度が高くなり、有害反応リスクが高まる。漸増期間を調整し、忍容性があれば用量を増やす。具体的な用量推奨についてはFDAの添付文書を参照すること。 |
| HLA-B*15:02アレル陽性 | カルバマゼピン | HLA-B | 有害反応リスクが高まる(重度の皮膚反応)。潜在的な利益がリスクを上回らない限り使用を避けるか、代替療法の検討を考慮する。HLA-B*15:02陽性の患者は、スティーブンス・ジョンソン症候群/中毒性表皮壊死症(SJS/TEN)のリスクに関連する他の薬剤で重度の皮膚反応のリスクが増加する可能性がある。遺伝子型検査は臨床的警戒の代替ではない。 |
| 低代謝能者 | シタロプラム | CYP2C19 | 全身濃度が高くなり、有害反応リスク(QT延長)が高まる。最大推奨用量は20 mgである。 |
| 中間代謝能者または低代謝能者 | フェニトイン | CYP2C9 | 全身濃度が高くなり、有害反応リスク(中枢神経系毒性)が高まる可能性がある。具体的な用量推奨についてはFDAの添付文書を参照すること。CYP2C93アレル保持者は、重度の皮膚有害反応のリスクが高まる可能性がある。CYP2C93保持者の患者では、カルバマゼピンの代替としてフェニトインの使用を避けることを検討する。遺伝子型検査は臨床的警戒と患者管理の代替ではない。 |
| HLA-B*15:02アレル陽性 | フェニトイン | HLA-B | 有害反応リスク(重度の皮膚反応)が高まる可能性がある。HLA-B15:02陽性の患者は、スティーブンス・ジョンソン症候群/中毒性表皮壊死症(SJS/TEN)のリスクが増加する可能性がある。HLA-B15:02陽性の患者では、カルバマゼピンの代替としてフェニトインの使用を避けることを検討する。遺伝子型検査は臨床的警戒と患者管理の代替ではない。 |
| 低代謝能者 | チオリダジン | CYP2D6 | 全身濃度が高くなり、有害反応リスク(QT延長)が高まる。CYP2D6阻害剤の経験に基づく予測効果。低代謝能者には禁忌。 |
| 低代謝能者 | ベンラファキシン | CYP2D6 | 全身の親薬物および代謝物の濃度を変化させる。用量減量を検討する。 |
| 低代謝能者 | ボルチオキセチン | CYP2D6 | 全身濃度が高くなる。最大推奨用量は10 mgである。 |
セクション2:データが安全性または反応への潜在的な影響を示す薬理遺伝学的関連性
FDA薬理遺伝学的関連性表:精神医学および神経学に関連する遺伝子-薬物組み合わせ(抜粋)
| 影響を受けるサブグループ | 薬物 | 遺伝子 | 遺伝子-薬物相互作用の記述 |
| HLA-A*31:01アレル陽性 | カルバマゼピン | HLA-A | 有害反応リスクが高まる(重度の皮膚反応)。HLA-A*31:01陽性の患者におけるカルバマゼピンの使用の危険性と利益を考慮する。遺伝子型検査は臨床的警戒の代替ではない。 |
| HLA-B*15:02アレル陽性 | オキスカルバゼピン | HLA-B | 有害反応リスクが高まる(重度の皮膚反応)。HLA-B*15:02陽性の患者は、スティーブンス・ジョンソン症候群/中毒性表皮壊死症(SJS/TEN)のリスクに関連する他の薬剤で重度の皮膚反応のリスクが増加する可能性がある。遺伝子型検査は臨床的警戒の代替ではない。 |
| 低代謝能者 | ペルフェナジン | CYP2D6 | 全身濃度が高くなり、有害反応リスクが高まる。 |
セクション3:データが薬物動態学的特性にのみ潜在的な影響を示す薬理遺伝学的関連性
FDA薬理遺伝学的関連性表:精神医学および神経学に関連する遺伝子-薬物組み合わせ(抜粋)
| 影響を受けるサブグループ | 薬物 | 遺伝子 | 遺伝子-薬物相互作用の記述 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | アミトリプチリン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | アモキサピン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | クロミプラミン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | デシプラミン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 低代謝能者 | ジアゼパム | CYP2C19 | 全身濃度に影響を与える可能性がある。 |
| 超迅速代謝能者または低代謝能者 | ドネペジル | CYP2D6 | 全身濃度を変化させる。 |
| 中間代謝能者または低代謝能者 | ドキセピン | CYP2C19 | 全身濃度が高くなる。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | ドキセピン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | エスシタロプラム | CYP2C19 | 全身濃度を変化させる可能性がある。 |
| 低代謝能者 | フルボキサミン | CYP2D6 | 全身濃度が高くなる。注意して使用すること。 |
| 低代謝能者 | ガランタミン | CYP2D6 | 全身濃度が高くなる。忍容性に基づいて用量を調整すること。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | イミプラミン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | ノルトリプチリン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | パロキセチン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 低代謝能者 | プロプラノロール | CYP2D6 | 全身濃度に影響を与える可能性がある。 |
| 低代謝能者 | プロトリプチリン | CYP2D6 | 全身濃度が高くなる。 |
| 低代謝能者 | リスペリドン | CYP2D6 | 親薬物および代謝物の全身濃度を変化させる。 |
| 超迅速代謝能者、中間代謝能者、または低代謝能者 | トリミプラミン | CYP2D6 | 全身濃度を変化させる可能性がある。 |
| 低代謝能者 | ビロキサジン | CYP2D6 | 全身濃度が高くなる可能性がある。 |
注:この表には選択された例が含まれており、家庭医にとって潜在的な関心のあるすべての遺伝子-薬物組み合わせを表すものではなく、薬物クラス内のすべての相互作用が含まれていない場合がある。定期的に更新される完全なリストについては、https://www.fda.gov/medical-devices/precision-medicine/table-pharmacogenetic-associationsを参照のこと。表はFDAが発行したとおりに掲載されている。
FDA:米国食品医薬品局、INR:国際標準化比、NAT:アリールアミンN-アセチルトランスフェラーゼ。
*この表は、遺伝子と薬剤の相互作用を記述し、その相互作用が適用される特定のサブグループを示しています。影響を受けるサブグループは、特定の遺伝子変異(例:HLA-B*15:02)の保因者、または遺伝子型から推測される表現型(超迅速代謝能者、正常代謝能者、中間代謝能者、低代謝能者)であるか、薬物代謝酵素/薬物トランスポーターの機能不全トランスポーターである場合があります。正常代謝能者または正常トランスポーターは、代謝または輸送機能に影響を与えると予想される遺伝子変異を持っていません。一般に、超迅速代謝能者は、代謝機能を増加させる遺伝子変異を2つ以上持っています。中間代謝能者または機能低下トランスポーターは、薬物を代謝または輸送する能力を低下させる遺伝子変異を1つまたは2つ持っている個人です。低代謝能者または機能不全トランスポーターは、一般に、薬物を代謝または輸送する能力がほとんどないか全くない遺伝子変異を2つ持っている個人です。
食品医薬品局より。薬理遺伝学的関連性表。2022年。https://www.fda.gov/medical-devices/precision-medicine/table-pharmacogenetic-associations。
薬理遺伝学に基づいた個別化医療および精密医療の可能性は、患者や医師にとって刺激的で魅力的ですが、様々な検査会社のマーケティング上の主張にもかかわらず、薬理遺伝学的検査のみに基づいて、特定の向精神薬に特に良く反応する人を予測するのに、現在の科学的知識はまだ不十分です。
結論
医療に携わる人々は、患者が同じ治療に対して異なる反応を示すことを知っています。一般に、薬物反応の最良の予測因子は、患者の個人的または家族的な治療反応の履歴であり、これは治療反応に遺伝的、したがって遺伝的な基礎があることを示唆しています。しかし、この種の情報を常に入手できるわけではありません。臨床医はしばしば、同じ薬剤を同じ用量で服用している特定の患者が症状の完全な寛解を示す一方で、他の患者は重度の副作用のみを報告するか、全く反応しないことを観察します。医師は、様々な抗うつ薬を処方する際に、患者の健康と薬物有害相互作用とのバランスを取る必要があります。しかし、これは薬物反応を予測できない場合があります。
我々のグループや他のグループによる精神疾患のトランスレーショナルおよび臨床薬理ゲノミクスに関する研究は、肯定的および否定的な治療結果の予測因子として遺伝子マーカーを特定することに焦点を当ててきました。遺伝子型と薬物反応表現型との関係を綿密に調べるために、厳格な臨床研究を引き続き実施する必要があります。適切に実施された臨床試験では、肯定的な臨床反応と有害事象は、特定の遺伝子多型に関連付けることができます。このような研究は、治療反応と有意に関連するマーカーを特定するために設計されています。この研究分野は、薬物療法の個別化に計り知れない可能性をもたらします。
薬物を投与する前に、好ましい反応または有害反応の可能性がわかっていれば、公衆衛生にとって非常に有益でしょう。莫大な見返りが期待できるにもかかわらず、そのような研究を実施する際には無数の問題が発生します。問題となる臨床的要因には、プラセボ反応、サンプルサイズの問題、遺伝的背景、民族層別化、連続的またはカテゴリー的アウトカム測定、薬物選択と治療戦略、治療レジメンの遵守、および環境が治療結果に与える影響が含まれます。この研究分野の遺伝的要素によって引き起こされるジレンマも大きく、他の場所で議論されています。重大な困難の1つは、薬物反応に関連する適切な遺伝子多型を選択することです。互いに部分的に関連している複数の変数(そのような相互作用の正確な性質に関する事前の知識なしに)を評価する必要があることによって統計的難題が生じ、標準化された臨床研究治療を必要とするサンプルサイズではわずかな効果しか生み出せず、したがって非常に費用がかかり、しばしば望ましいほど大きくできない場合があります。これらの限界にもかかわらず、薬理遺伝学的検査は、研究室から臨床現場へと翻訳され、大うつ病の治療など、特定の治療を個別化するのに役立っています。
精神疾患の生物学も向精神薬の作用機序も、現在までに完全に解明されておらず、知識は継続的に蓄積されています。薬理遺伝学的視点は、個別化された治療法の開発に大きく貢献し、精神疾患の根底にある病態生理学的メカニズムを理解するための良い出発点となります。すべての薬理遺伝学的研究は、これらの疾患に関する神経生物学的研究理論に基づいています。
薬理ゲノミクスは、ヒトゲノムプロジェクトの完了以来出現している新しいデータベースに基づく医学科学の新しい分野です。研究者が膨大なゲノムデータを活用して治療法を改善できるよう、ハイスループット技術が開発されてきました。さらに、ゲノミクスは現在、治療最適化と研究の新しい道を提供することで、新しいバイオマーカーと治療標的を探索するツールを我々に与えています。最後に、高度な分子生物学技術の適用と、治療反応に関連するヒトゲノム配列の完全な理解は、精神疾患の概念的に新しい治療標的部位の探索を促進するでしょう。
参考文献
- Aklillu E, Persson I, Bertilsson L, Johansson I, Rodrigues F, Ingelman-Sundberg M. Frequent distribution of ultrarapid metabolizers of debrisoquine in an ethiopian population carrying duplicated and multiduplicated functional CYP2D6 alleles. J Pharmacol Exp Ther. 1996;278:441-446.
- Bertilsson L, Dahl ML, Dalén P, Al-Shurbaji A. Molecular genetics of CYP2D6: clinical relevance with focus on psychotropic drugs. Br J Clin Pharmacol. 2002;53:111-122.
- Bunka M, Wong G, Kim D, et al. Evaluating treatment outcomes in pharmacogenomic-guided care for major depression: a rapid review and meta-analysis. Psychiatry Res. 2023;321:115102.
- Campos AI, Byrne EM, Mitchell BL, et al. Impact of CYP2C19 metaboliser status on SSRI response: a retrospective study of 9500 participants of the Australian Genetics of Depression Study. Pharmacogenomics J. 2022;22:130-135.
- Cuéllar-Barboza AB, McElroy SL, Veldic M, et al. Potential pharmacogenomic targets in bipolar disorder: considerations for current testing and the development of decision support tools to individualize treatment selection. Int J Bipolar Disord. 2020;8:23.
- Edenberg HJ. The genetics of alcohol metabolism: role of alcohol dehydrogenase and aldehyde dehydrogenase variants. Alcohol Res Health. 2007;30:5-13.
- Flores DL, Alvarado I, Wong ML, Licinio J, Flockhart D. Clinical implications of genetic polymorphism of CYP2D6 in Mexican Americans. Ann Intern Med. 2004;140:W71.
- Gaedigk A, Sangkuhl K, Whirl-Carrillo M, Klein T, Leeder JS. Prediction of CYP2D6 phenotype from genotype across world populations. Genet Med. 2017;19:69-76.
- Goodman DW. Lisdexamfetamine dimesylate (vyvanse), a prodrug stimulant for attention-deficit/hyperactivity disorder. P T. 2010;35:273-287.
- Gray K, Adhikary SD, Janicki P. Pharmacogenomics of analgesics in anesthesia practice: a current update of literature. J Anaesthesiol Clin Pharmacol. 2018;34:155-160.
- Howland RH. Sequenced treatment alternatives to relieve depression (STAR*D). Part 2: study outcomes. J Psychosoc Nurs Ment Health Serv. 2008;46:21-24.
- Kirchheiner J, Nickchen K, Bauer M, et al. Pharmacogenetics of antidepressants and antipsychotics: the contribution of allelic variations to the phenotype of drug response. Mol Psychiatry. 2004;9:442-473.
- Koopmans AB, Braakman MH, Vinkers DJ, Hoek HW, van Harten PN. Meta-analysis of probability estimates of worldwide variation of CYP2D6 and CYP2C19. Transl Psychiatry. 2021;11:141.
- Krishnan S, Zhang Y. Relative bioavailability of lisdexamfetamine 70-mg capsules in fasted and fed healthy adult volunteers and in solution: a single-dose, crossover pharmacokinetic study. J Clin Pharmacol. 2008;48:293-302.
- Lett TAP, Wallace TJM, Chowdhury NI, Tiwari AK, Kennedy JL, Müller DJ. Pharmacogenetics of antipsychotic-induced weight gain: review and clinical implications. Mol Psychiatry. 2012;17:242-266.
- Li Z, Huang M, Ichikawa J, Dai J, Meltzer HY. N-desmethylclozapine, a major metabolite of clozapine, increases cortical acetylcholine and dopamine release in vivo via stimulation of M1 muscarinic receptors. Neuropsychopharmacology. 2005;30:1986-1995.
- Licinio J, Wong ML. Pharmacogenomics: The Search for Individualized Therapies. John Wiley & Sons; 2009.
- Licinio J, Wong ML. Pharmacogenomics of antidepressant treatment effects. Dialogues Clin Neurosci. 2011;13:63-71.
- Llerena A, Naranjo MEG, Rodrigues-Soares F, Penas-LLedó EM, Fariñas H, Tarazona-Santos E. Interethnic variability of CYP2D6 alleles and of predicted and measured metabolic phenotypes across world populations. Expert Opin Drug Metab Toxicol. 2014;10:1569-1583.
- Lynch T, Price A. The effect of cytochrome P450 metabolism on drug response, interactions, and adverse effects. Am Fam Physician. 2007;76:391-396.
- McLellan RA, Oscarson M, Seidegård J, Evans DA, Ingelman-Sundberg M. Frequent occurrence of CYP2D6 gene duplication in Saudi Arabians. Pharmacogenetics. 1997;7:187-191.
- Meshkat S, Rodrigues NB, Di Vincenzo JD, et al. Pharmacogenomics of ketamine: a systematic review. J Psychiatr Res. 2021;145:27-34.
- Milosavljevic F, Bukvic N, Pavlovic Z, et al. Association of CYP2C19 and CYP2D6 poor and intermediate metabolizer status with antidepressant and antipsychotic exposure: a systematic review and meta-analysis. JAMA psychiatry. 2021;78:270-280.
- Patrick KS, Radke JL, Raymond JR, et al. Drug regimen individualization for attention-deficit/hyperactivity disorder: guidance for methylphenidate and dexmethylphenidate formulations. Pharmacotherapy. 2019;39:677-688.
- Racoosin JA, Roberson DW, Pacanowski MA, Nielsen DR. New Evidence about an old drug-risk with codeine after adenotonsillectomy. N Engl J Med. 368;23:2155-2157.
- Rubinstein WS, Pacanowski M. Pharmacogenetic gene-drug associations: FDA perspective on what physicians need to know. Am Fam Physician. 2021;104:16-19.
- Smith S, Woodside B. Is there a role for pharmacogenetics in the treatment of anorexia nervosa? Pharmacogenomics. 2016;17:1381-1383.
- Smith TL, Nemeroff CB. Pharmacogenomic testing and antidepressant response: problems and promises. Braz J Psychiatry. 2020;42:116-117.
- Takahashi PY, Ryu E, Pathak J, et al. Increased risk of hospitalization for ultrarapid metabolizers of cytochrome P450 2D6. Pharmgenomics Pers Med. 2017;10:39-47.
- Taylor C, Crosby I, Yip V, Maguire P, Pirmohamed M, Turner RM. A review of the important role of CYP2D6 in pharmacogenomics. Genes (Basel). 2020;11.
- Vecera CM, Fries GR, Shahani LR, Soares JC, Machado-Vieira R. Pharmacogenomics of lithium response in bipolar disorder. Pharmaceuticals (Basel). 2021;14.
- Wong ML, Arcos-Burgos M, Liu S, et al. Rare functional variants associated with antidepressant remission in Mexican-Americans: short title: antidepressant remission and pharmacogenetics in Mexican-Americans. J Affect Disord. 2021;279:491-500.
- Wong ML, Licinio J. Research and treatment approaches to depression. Nat Rev Neurosci. 2001;2:343-351.
- Zai G. Pharmacogenetics of obsessive-compulsive disorder: an evidence-update. Curr Top Behav Neurosci. 2021;49:385-398.
- Zanger UM. Genetic variability of CYP2D6: basic and clinical aspects. In: Baumann P, ed. CYP2D6: Genetics, Pharmacology and Clinical Relevance. Future Medicine Ltd; 2014:28-41. https://www.futuremedicine.com/doi/abs/10.2217/fmeb2013.13.270

