1.23 基礎システム神経科学
アンドレ・A・フェントン博士、ディノ・ドヴォラック博士
システム神経科学者は、外部世界における変数の内部神経表現を生成することで、神経回路がどのように情報を表現、分析、計算し、知識を創造し、意思決定を行い、行動を実行するのかを研究します。システム神経科学は、脳の構造と機能の分子レベルおよび細胞レベルの理解と、神経回路のシステムが実装する高次の精神機能との間の因果関係を理解することを目指します。基礎システム神経科学者にとって、統合失調症は、熟考する上で同時に魅力的で、かつ苛立たしい主題です。統合失調症が魅力的なのは、その中心症状が非常に重大な結果をもたらすからです。そのため、統合失調症の症状は、思考や神経表現が神経生物学的に機械的な構築物であり、見かけ上の計り知れない複雑さにもかかわらず、私たちが理解し解読できるはずだということを深く思い起こさせます。しかし、統合失調症の機械論的な理解の欠如は、より効果的な治療法に向けた科学的進歩を大いに加速させる可能性のあるモデル生物やモデルシステムを開発する努力に対する根本的な課題となっています。統合失調症の問題は、あらゆる精神現象を理解することと同様に、遺伝子や分子から細胞や回路、脳領域の特殊化、そして個人や社会行動に至るまで、生物学的機能と理解のあらゆるレベルにわたる統合を必要とし、要求する、根本的にシステムの問題であるという事実を受け入れる、現在の先進的な研究ツールを享受している今、振り子は明らかに楽観的な方向に振れています(図1.23-1)。
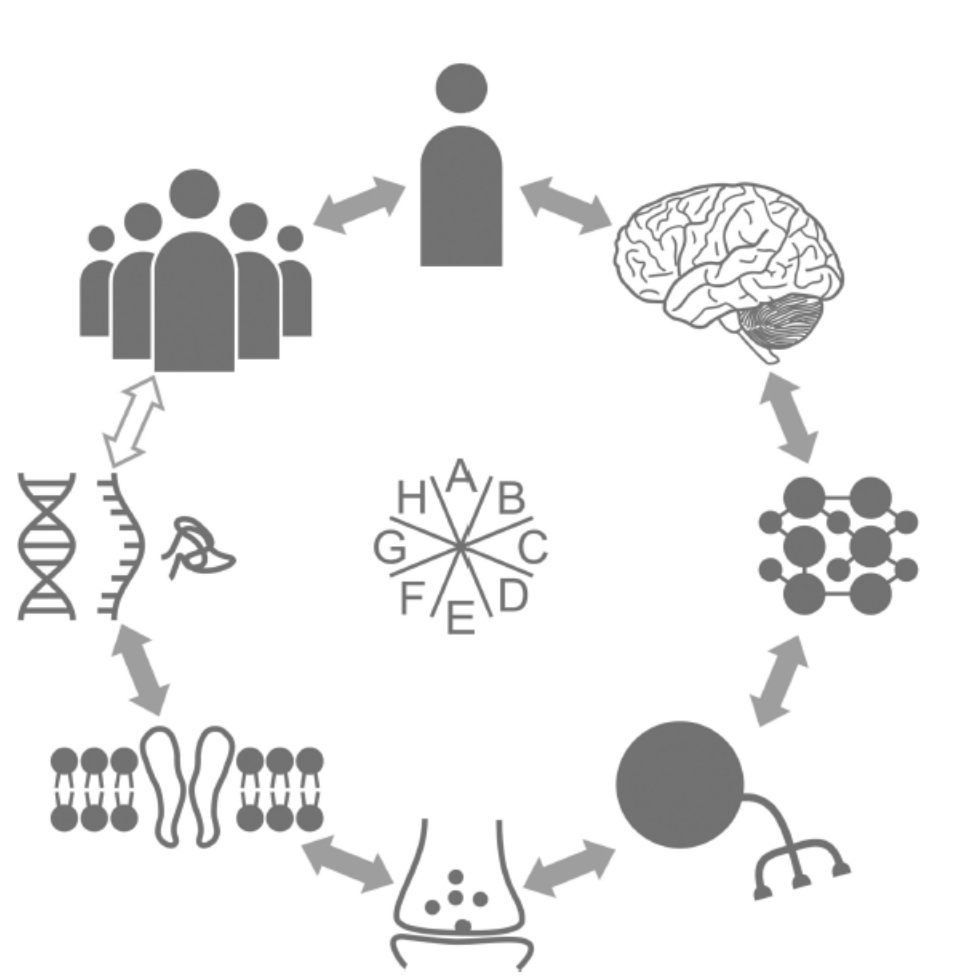
図1.23-1.存在の環。この漫画は、生物学的組織の異なるレベルを示しており、それぞれのレベルが隣接する生物学的機能レベルに直接的な機械論的影響を及ぼし、それによって他のあらゆるレベルに間接的な影響を及ぼします。個人の行動レベル(A)から恣意的に始めると、この模式図は、個人の行動が社会行動(H)と脳活動(B)の両方に影響を与え、またそれらから影響を受けることを示しています。脳活動は神経回路の操作(C)に影響を与え、またそれから影響を受け、その活動は単一細胞の活動と特性(D)に影響を与え、またそれらから影響を受けます。単一細胞の活動はシナプス機能(E)に影響を与え、またそれから影響を受けます。シナプス特性と機能は膜とチャネルの特性(F)によって決定され、それらは今度は遺伝子機能、ここではDNA、RNA、およびペプチド(G)として描かれているものに影響を与え、またそれらから影響を受けます。遺伝子機能が社会行動に直接影響を与えることは知られていませんが、その影響はここで示されている他の生物学的機能レベルを介して間接的です。にもかかわらず、精神疾患の遺伝学について知られていることの多くは、遺伝子機能と社会行動および個人行動との相関関係を求める研究から得られており、これはこの遺伝的知識を治療的介入に利用する試みにまで及んでいます。
本章では、統合失調症の概念に関連する可能性のある、げっ歯類モデルにおける認知回路機能の基礎的なシステム神経科学について概説します。統合失調症において海馬が特異的に異常であるからというだけでなく、海馬回路が神経計算に対するシステム神経科学の視点が発展してきた、特に特徴がよく研究されているモデルシステムであるため、海馬に焦点を当てます。この点は、特に統合失調症、そして一般的にあらゆる神経精神疾患の動物モデルに、少なくともシステム的な観点から、生産的に何を期待できるかを明確にする機会を与えてくれます。
動物モデルの重要性と有用性
統合失調症のような精神疾患を理解するために基礎科学を応用する上での動物研究の重要性は、基礎的な神経および薬理学的メカニズムに関する知識が飛躍的に増加している一方で、治療選択肢の拡大がはるかに緩やかであるという事実によって強調されます。中心的な困難は、臨床症状の行動的および精神的領域と、治療法および潜在的な介入の生化学的領域との間に、生物学的レベルの大きな隔たりがあることです。この隔たりは「失われた中間層の問題」として知られています。つまり、研究ツールは、生物学的機能の微視的レベル(遺伝子、タンパク質、細胞)での研究や、機能的磁気共鳴画像法(fMRI)や脳波計(EEG)などの大規模システムレベルの方法論に最適化されていますが、生物学的機能の中間レベルを調査するための技術と概念は、開発がはるかに遅れており、またはヒトで実施することが困難です。これらの失われたレベルには、アンサンブル、すなわち単一ニューロンの亜集団内での時間的に組織化された活動電位放電、時間的に活性化されたシナプスの亜集団、および細胞内・細胞外電流の流れのパターンの結果が含まれます。この中間レベルなしには、受容体や伝達物質の細かい部分と、治療決定を左右する臨床的観察結果とを結びつけることは、かなり困難であることが判明しています。この中間レベルの調査は極めて重要ですが、動物研究においてのみ実用的であり、特にげっ歯類では数十から数千の単一ニューロンからの細胞外電気放電を記録することが可能であり、同時に局所電場電位(LFP)の振動として現れるシナプス電流の集団レベルの総和を測定することが可能であるため、非常によく発展しています。
本章の多くは、統合失調症関連の問題を理解しようとする動物研究に関係するため、「動物モデル」という用語の意味を明確にすることが必要です。この用語は、動物が臨床疾患の何らかの側面を模倣するために使用されていることを示すためによく使われますが、これは有効な、あるいは生産的な概念化である可能性は低いでしょう。統合失調症の診断の基礎となる精神現象は、動物にはほとんど適用できません。動物が対応する精神能力を持っているかどうかについては大きな不確実性があり、もし持っていたとしても、ヒトのように現れる可能性は非常に低いでしょう。現在のDSMベースの診断基準の妥当性、および国立精神衛生研究所のResearch Domain Criteria (RDoC)プロジェクトが提案するような客観的な生物学的基準により重点を置くべきかどうかについては、かなりの議論がなされてきました。動物研究の観点から見た結果として、疾患の定義における不確実性は、定義が不十分なものを模倣することを不可能にする、ということを意味します。しかし、注意、ワーキングメモリ、長期記憶などの機能の測定といった客観的な基準に基づいて診断する場合でも、そのような機能が種特異的な形で現れる可能性があることに注意し、慎重でなければなりません。例えば、認知制御を評価するツールとしてのストループテストを考えてみましょう。げっ歯類も確かに認知制御を使用しますが、げっ歯類における認知制御の効果的な評価は、ストループテストとは確かに似ていません。
自閉スペクトラム症、注意欠陥多動性障害(ADHD)、双極性障害、大うつ病性障害、統合失調症に分類される多様な病態に素因となる遺伝的異常には、かなりの重複があります。マウスにおける遺伝的異常は、どの障害をモデル化することになるのでしょうか?統合失調症に関連する遺伝的変化を変異マウスで模倣することは明らかに実用的であり有利である一方で、多型性が種特異的な結果をもたらす可能性があることにも警戒しなければなりません。ある種で発現する遺伝子が、異なる種ではかなり異なる表現型を与える可能性があり、ヒトの遺伝的変化がモデル生物でどのように模倣されるかを解釈することさえ困難にしています。最後に、遺伝子変異の浸透率は通常数パーセントであり、模倣の観点からすると、特定の遺伝子改変が異常な表現型につながることを検出する確率は低いことを意味するはずです。神経精神疾患の動物モデルが疾患を模倣していると真剣に考えるべきではない理由は数多くあります。しかし、失われた中間層の問題を超えて、動物モデルは統合失調症やその他の神経精神疾患に関する仮説を検証するための最も強力なツールの1つです。ここで概説するげっ歯類モデルのいずれも、統合失調症そのもののモデルとは考えていません。動物自体はツールであり、試薬にいくぶん似ており、統合失調症の理解を推進する主要な仮説を効果的に評価するために使用できます。
承知いたしました。以下に、ご提供いただいた英文の日本語訳を逐語的に正確に示します。
神経の電気活動と神経コード
統合失調症のシステムレベルでの理解に向けた進歩の機会を特に提供する可能性のある、神経科学における主要な一般的な課題は、情報がニューロンの電気活動においてどのように表現されるかを決定することです。この根本的な問題に対する標準的な教科書の説明は、「専用コーディング」仮説であり、単一ニューロンの活動電位放電が、物体のような複雑な刺激の存在(または不在)や、動きや特定の空間位置にいることのような複雑な事象の発生をシグナルすると解釈されます。これは、海馬の場所細胞の場合(図1.23-2参照)も同様です。専用コーディング仮説には、十分な枢機細胞の証拠があります。これらは、「顔」や「おばあさん」のような高次刺激や概念をシグナルするために特化されたニューロンです。特に劇的でよく研究されている例は、げっ歯類の海馬および関連する構造における場所細胞、頭部方向細胞、境界細胞、グリッド細胞であり、これらは外部空間における位置、方向、環境境界、距離をシグナルします。ヒトのてんかん手術候補者の同じ脳領域から記録されたもう一つの劇的な例は、女優のジェニファー・アニストンやハル・ベリーのような有名人に発火が調整されている細胞です。専用コーディングの問題は、専用コードの容量が機能的な細胞型の数に限定されることですが、この仮説の大きな魅力は、例えば、方向や境界までの距離といった低次概念を表現するニューロンからの収束する接続の統合から場所の高次表現が出現するように、ニューロンがどのようにして枢機細胞の発火における情報を読み取り、変換することが可能であるかを概念的に捉えるのが単純明快である点です。
統合失調症に関連する動物モデルにおける情報表現の神経活動相関に関する現代の研究の多くは、代替の「アンサンブルコーディング」仮説の枠組み内で実施され、解釈されてきました。この仮説は、情報が多くのニューロンにわたる活動パターンによって符号化されると主張します。アンサンブルコードは、多数の電球を使ってメッセージを表現するスタジアムの巨大スクリーン表示に例えることができます。海馬および関連する新皮質領域の同じ空間調整細胞からでさえ、アンサンブルコーディングの十分な証拠があり、これらは専用コーディングの証拠と解釈されています(図1.23-2および図1.23-3)。巨大スクリーンの電球に例えるように、あるニューロンの活動は複数の表現に寄与しますが、特定のニューロンが表現に不可欠であることはなく、ニューロンの数よりもはるかに多くの表現を符号化でき、そして決定的に、同じニューロンは一度に一つのメッセージしか表現できません。巨大スクリーンのように、これらの特性は、ニューロン(または電球)のシステム内の活動が時間的に協調していることを必要とし、適切な細胞のサブセットが適切な時間間隔で共活動し、おそらく複数の時間スケールで情報を表現し伝達するようにします。活動している細胞と活動していない細胞のパターンによって情報を表現するために一緒に発火する細胞の集合体であるヘッブの細胞アセンブリのアイデアは、アンサンブルコードの一例です。哺乳類および無脊椎動物の脳でアンサンブルコードが機能しているという実質的な証拠がある一方で、この仮説には主要な問題があります。専用コードとは異なり、ニューロンがアンサンブルコードから情報をどのように検出、読み取り、変換するのかは不明確です。この困難は、(a) アンサンブルコードの情報が時間と空間(すなわち、細胞の多様な位置)に分散していること、そして (b) 単一ニューロンが情報を運ぶ表現パターンを定義するすべての細胞活動の全体像を収集するために必要な結合を所有する傾向がないという事実から生じます。もし各人が電球のサブセットしか見ることができないとしたら、巨大スクリーン表示のメッセージを読み取る上で、私たち個人または集団として、どのようにうまくやっていけるでしょうか?
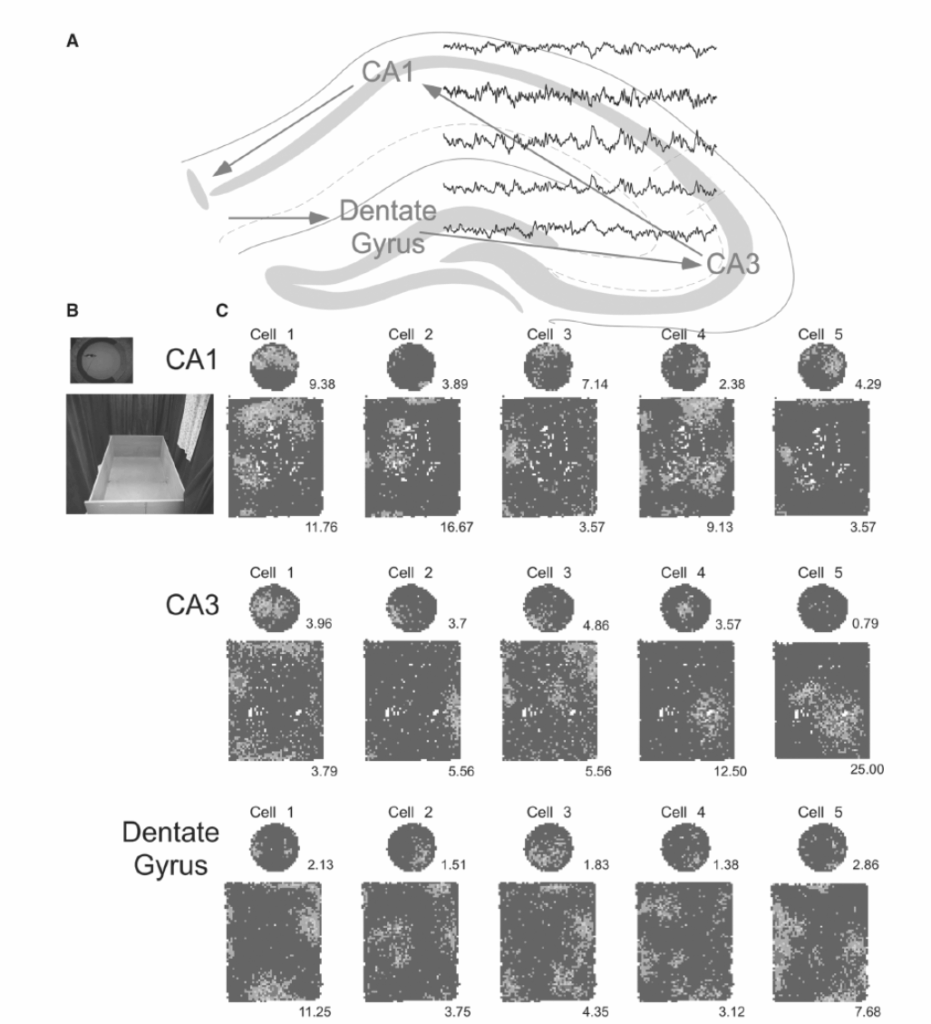
図の説明:
A: 背側海馬の模式図。主要な区分が示され、矢印は三シナプス回路を介した情報のフィードフォワードの流れを示しています。2秒間の場所特異的LFP(局所電場電位)の例が重ね合わされており、LFPの開始位置はそれが記録された場所に対応しています。
B: 場所細胞が記録された2つの馴染みのある環境、直径76cmの円筒と1.8 x 1.4mの箱の写真。
C: 青から赤に色分けされた平均発火率マップは、ラットが円筒形と箱の中で散らばった餌を探しているときに記録された場所細胞の空間的調整を記録したものです。それぞれの5つの細胞のセットは、海馬回路の同じ解剖学的区分から同時に記録されました。
円筒形では、ほとんどの場所細胞が単一の場所で強力に発火することに注目してください。これは細胞の場所野と呼ばれ、この発火が場所に対する専用の神経コードを提供することを示唆しています。しかし、場所コードの根本的な性質は実際にはアンサンブルコードです。なぜなら、箱というより大きな環境では、同じ細胞が通常、複数の場所野で発火するからです。もし箱の中での各細胞の発火が専用コードとして解釈されるならば、各細胞の活動は場所の曖昧な指示を提供することになり、専用コーディングの枠組み内では確実に曖昧さを解消できません。しかし、もし発火がアンサンブルコードとして解釈されるならば、細胞群にわたる活動のパターンは場所の正確な指示を提供します。なぜなら、細胞間の活動パターンが各場所でユニークだからです。赤色(最高発火率)カテゴリの最小発火率(スパイク/秒で測定)は、各発火率マップの下に示されています。青色は0スパイク/秒の発火率を示します。(カラー画像はeBookを参照。)(B&Cは、Park E, Dvorak D, Fenton AA. Ensemble place codes in hippocampus: CA1, CA3, and dentate gyrus place cells have multiple place fields in large environments. PLoS ONE. 2011;6(7):e22349. doi: 10.1371/journal.pone.0022349.より転載。)
アンサンブルコーディング仮説は、統合失調症で観察される認知および知覚の異常に対する自然なシステムレベルの説明を提供します。巨大スクリーン表示と同様に、アンサンブルコードで情報を表現するために機能する神経ネットワークは、同じ細胞で複数の表現を同時に活性化することによって生じる情報の完全な損失を回避しなければなりません。巨大スクリーンは同じライトで2つのメッセージを表示できますが、同時にではなく、時間的に調整された一連のパターンとして、次々にしか表示できません。同様に、ニューロンを共有し、それぞれが共活動するニューロンのサブセットとして定義される2つの細胞アセンブリは、2つの共活動パターンが時間的に分離されている限り、複数の項目を表現できます。しかし、2つの細胞アセンブリパターンが共活動すると、すべての活動細胞が別個の、共活動によって定義された細胞アセンブリに統合され、そこにあるものや意図されたものとは異なる何かを表現するため、壊滅的な情報損失が発生します。アンサンブルコードを使用するあらゆるシステムと同様に、神経システムは、単一のアセンブリ内の細胞が共活動し、複数の共活動によって定義されたアセンブリが共活動しないように調整するメカニズムが整っている場合にのみ、効果的に機能できます。私たちは現在、これらの調整メカニズムの一種として神経振動を検討しますが、その前に、複数の神経アンサンブルによる情報表現を調整する能力にどのような種類の条件が課題を提示するかを考えてみましょう。
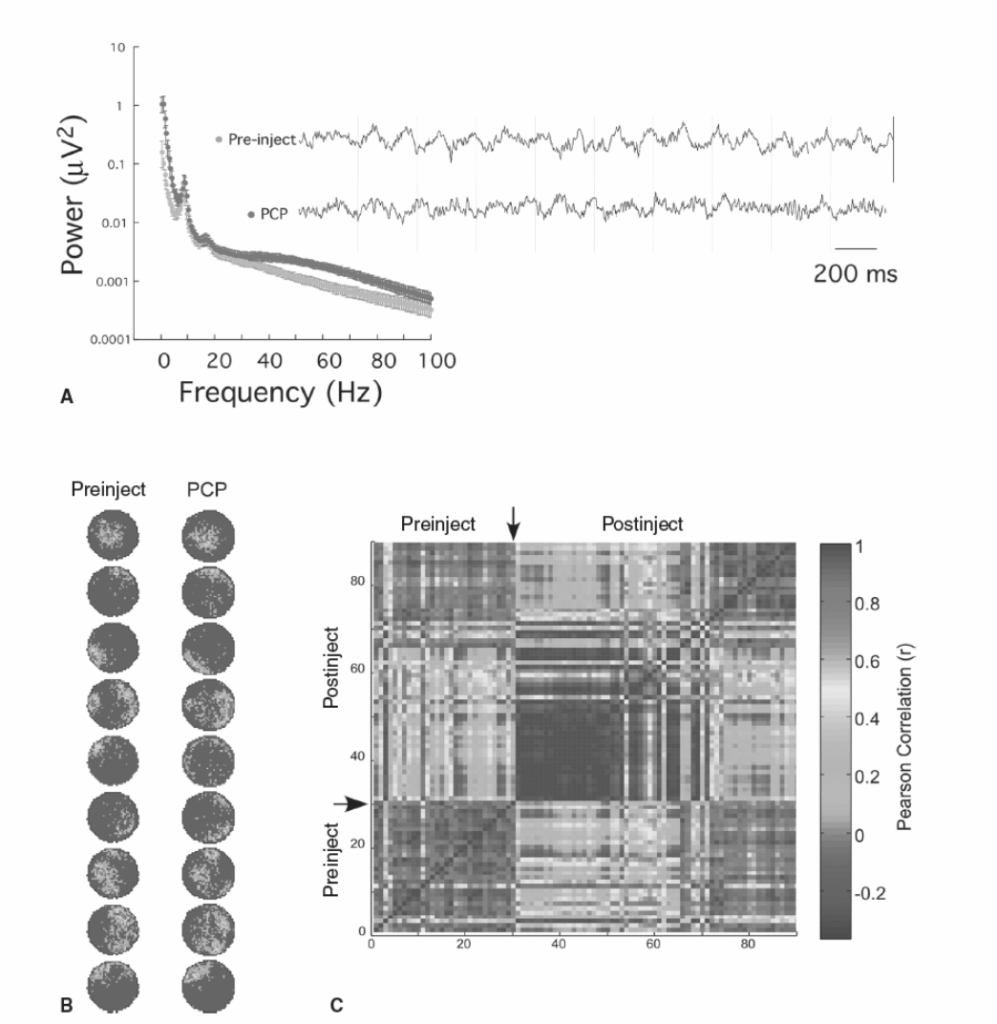
図の説明:
図1.23-3: 精神作用薬フェンサイクリジン(PCP)が個々の場所細胞の空間的調整に最小限の影響しか与えずに神経発火を非協調化させることを示しています。
A: ラットが慣れた円筒形の中で散らばった餌を探しているときに記録された9つのCA1場所細胞のアンサンブルの、PCP全身注射前後の青から赤への色分けされた発火率マップ。PCPは個々の場所細胞の空間発火に認識できる影響を与えませんでした。
B: 対照的に、同じデータを発火の時間的に変動する細胞間パターンとして調査すると、PCPが細胞のアンサンブル発火を根本的に変化させたことは明らかです(PCPは30分で投与されました)。示されている相関行列を生成するために、毎分、各細胞が発火したスパイク数がカウントされ、集団全体の発火の時間パターンを記述する活動ベクトルとして整理されました。各活動ベクトルは他のすべての活動ベクトルと相関され、その相関は色コードを使用して表現されています。行列の任意の点における相関は、時間xにおける活動と時間yにおける活動との相関を表します。x = yの線に沿った相関は、活動ベクトル自体と相関しているため、正確に1です。PCP下の活動ベクトルは、注射前のベクトルと比較して直ちに変化しましたが(独立または負の相関)、PCP活動は約1の相関によって示される安定したパターンを形成しました。PCP投与後30〜40分で、場所細胞のアンサンブル活動は注射前パターンとPCPパターンとの間で切り替わり、最終的に注射前パターンに戻りました。注射前の期間の3分と11分に、PCPパターンが(PCPがないにもかかわらず)発現されたことに注目してください。これらのデータは、個々のニューロンの情報調整に影響を与えることなく神経活動の非協調性を示しているだけでなく、アンサンブル活動が多安定であることを示しています。システムは効果的に安定した活動パターンの1つに存在することを好み、PCPは異なるパターンを観察する確率を根本的に変化させます。(カラー画像はeBookを参照。)(データはKao HY, Dvorak D, Park E, Kenney J, Kelemen E, Fenton AA. Phencyclidine discoordinates hippocampal network activity but not place fields. J Neurosci. 2017;37(49):12031-12049.より。)
アンサンブルコーディングのこれまでの議論から、統合失調症における情報処理、知覚、および認知の障害に関する仮説が導き出されます。神経活動の喪失または異常な協調性は、ニューロンのネットワークにおける情報処理の失敗を引き起こし、このような失敗は、対立する複数の情報源が同じ神経資源を競合する場合に発生する可能性が高くなります。このような考え方は、さまざまな形で提唱されてきました。本質的に、この考え方は、電気的な神経活動の非協調化されたパターンが統合失調症の核心的な欠損であり、他の欠損はそこから派生すると主張しています。この「非協調化」仮説は、統合失調症における認知機能障害を説明しようとするシステムレベルの試みです。これは、概して、この疾患の認知および知覚の欠損は、神経ネットワークまたは回路を構成する多数の個々に「正常な」ニューロンの異常な協調によって引き起こされると主張しています。この非協調化は、神経ネットワーク内および神経ネットワーク間で発生すると主張されています。神経活動の協調と非協調は、2つ以上のニューロン間の神経放電のタイミング関係を測定するか、頭皮からEEGとして、または神経回路の特定の場所に局在化できる場合はLFPとして記録できるシナプス電流の時空間パターンを反映するEEGなどの他の神経活動の尺度によってのみ、直接的に調査および評価できることに注意してください。
統合失調症における認知機能障害の根底にあると仮説されている神経の非協調性の示唆的な例は、精神作用薬フェンサイクリジン(PCP)がラット海馬の場所細胞に与える影響によって示されます。この薬は、海馬LFPにおけるガンマ振動(30〜100 Hz)のパワーを選択的に増加させますが(図1.23-3A)、海馬場所細胞の空間的調整には検出可能な変化を引き起こしません(図1.23-3B)。場所細胞への影響を専用コーディングの観点から解釈すると、PCPがこれらの認知関連細胞の発火に最小限の影響しか与えないと結論付けなければなりません。驚くべきことに、同じデータがアンサンブルコーディングの観点から解釈され、細胞間発火パターンとして評価されると、結論はかなり異なります(図1.23-3C)。相関行列は、PCPが海馬場所細胞のサンプル全体の発火の時間的に組織化されたパターンに大きく即座な影響を与えることを示しています。PCPは、慣れた安定した発火パターンを、この慣れた環境の慣れた表現に対応しない新しい異なる安定した発火パターンに変化させます。PCPの効果が薄れ始めると、投与後約30分で、神経活動パターンは注射前パターンとPCPパターンとの間で交互に現れ、最終的に慣れた注射前パターンに戻ります。注目すべきは、PCPが投与される前の記録の3分と11分に、PCP発火パターンが一時的に発現していたことです。これらのデータは、海馬の神経活動が多安定であることを示しており、PCPがシステムが慣れた注射前状態と異常なPCP状態にある確率を変化させたことを明らかにしています。ここでネットワーク状態は、個々の細胞の発火特性の測定に基づいてではなく、協調的な時間的に定義されたアンサンブルの発火パターンによって定義されます。アンサンブルの機能不全は、統合失調症に関連する遺伝的および慢性ケタミンマウスモデルにおける新皮質アンサンブルでも測定されています。
非協調性仮説は、協調プロセスを、発火率や個々のニューロンの調整曲線、そして頭皮からEEGとして、または神経回路の特定の場所に局在化できる場合はLFPとして記録できる電場電位の振動周波数のような神経活動を特徴付ける、より単一的なプロセスとは別個の、あるいは少なくとも分離可能なものとして概念化しています。しかし、細胞の単一的な生理学的特性とその協調プロセスは、タンパク質チャネルを含む細胞機構の展開と動作の結果であるため、十分に詳細なレベルでは、協調活動の変化もこれらの単一的な特性に影響を与えます。現在構想されているように、非協調性仮説は、基本的な特性や、刺激に対する神経応答の調整、単純な単一刺激に対する行動応答、記憶の表現と使用といった神経ネットワーク機能が、対立する情報が最小限である場合には比較的正常であると予測します。一方、機能的および非協調性の異常は、競合する要求を管理し満たすために、アクセス可能な情報を無視し選択的に使用する必要がある複雑な条件下で、ますます高い可能性で顕著になるでしょう。このような状況の典型的な例は、ストループテストとして形式化されています。このテストの基本的な形式は、被験者に2つの異なる形式の情報を提供する刺激を提示します。例えば、「青」や「赤」といった色を表す単語が、一致する色(青いインクで「青」と書かれている)または不一致な色(赤いインクで「青」と書かれている)のいずれかで書かれています。被験者は色を報告し、単語の意味を無視するように指示されるため、効果的に機能するには、被験者の関連する脳回路が選択的に色を表現し、意味を表現しない必要があります。このように認知制御の課題を提示するタスクを使用すると、げっ歯類のニューロンのアンサンブル全体の発火が、ある種類の情報を表現する共活動によって定義される細胞のグループまたはアセンブリに凝集するのが観察できますが、活動は共活動する細胞の異なるパターン間で切り替わり、それぞれが一方または他方の種類の情報を表現します。どの瞬間でも、細胞のネットワークは、より行動的関連性の高い情報を表現することを好みます。
Local Field Potentialsと神経振動の起源
単一ニューロンの活動電位であろうと、シナプス電位のアンサンブルであろうと、神経電気活動は、ニューロンのような興奮性細胞の膜電位の変化に由来します。細胞外電流は導電性の細胞外媒体を介して放出され、電場電位として記録されます。その起源は頭蓋内電極の近傍に局在化できるためLFPと呼ばれます。頭皮電極で記録されるEEGの場合も同様ですが、EEG電位の神経起源の空間的局在性は大幅に減少します。しかし、十分な密度の頭皮電極サイトで収集されたEEGから機能的な脳活動をfMRIのように画像化することを可能にした、発生源局在化計算の能力の進展があります。
細胞外電場は、正または負に帯電したイオンがニューロンの半透膜を介して流れることによって生成されます。正に帯電したイオン(例:Na+またはCa2+)が細胞内の細胞外空間から離れると、局所的な電気シンクを引き起こし、これは活動膜の近傍で測定されたLFPにおいて負の偏位として現れます。反対方向の受動電流は電流の流入を相殺し、帰還電流と呼ばれます。グルタミン酸という神経伝達物質を放出するような興奮性ニューロンは、シナプス後細胞に電流の流入を引き起こし、したがって、静止電位からのシナプス後膜の脱分極と、シナプス後活動電位の確率の増加をもたらします。抑制性細胞は通常、ガンマアミノ酪酸(GABA)を放出します。これはシナプス後細胞において過分極および/またはシャント抑制を引き起こし、負の塩化物イオンがGABA受容体に関連する塩化物イオンチャネルを介して細胞に出入りできます。これにより、シナプス後細胞の膜電位は過分極または静止状態に安定化され、両方ともシナプス後活動電位の可能性を低くします。膜を介する電流は非常に小さいため、LFPの測定可能な変化は、多くの空間的に均一で時間的に同期した事象の結果です。LFPへの最大の寄与は、抑制性ニューロンによって活性化される遅く同期した電流に由来します。高速のNa+およびK+コンダクタンスベースの活動電位は最大の細胞外電流(細胞外活動電位またはスパイク)を生成しますが、活動電位事象の持続時間が短いため(1ms未満)、100Hz以下のLFPスペクトルへの寄与は限られています。
神経振動は、中枢神経系における神経活動の周期的な変動です。振動は複数の空間スケールで観察できます。単一ニューロンのレベルでは、膜電位のリズミカルな閾値下変化、または活動電位活動のリズミカルな変化のいずれかの形をとります。多数のニューロンの同期活動は、LFPで侵襲的に細胞外電極を用いて、またはEEGで非侵襲的に頭皮電極を用いて観察できる巨視的な振動電場を生じさせます。振動は、典型的な周波数、解剖学的局在、生成メカニズム、相対的なパワー、進行中の脳状態との関係など、いくつかの側面で異なります。ここでは、シータ(5〜12Hz)およびガンマ(30〜100Hz)振動の重要性を強調します。なぜなら、それらの生物物理学的起源はよく理解されており、それらの相互作用は、情報伝達活動電位が組織化され制御される機能的な協調インフラストラクチャを提供するからです。
シータ振動は、海馬、嗅内皮質、扁桃体、感覚皮質、前頭前野などの脳構造で検出できます。シータリズムは、記憶の符号化と想起、シナプス可塑性、長距離同期、そして注意や認知制御などの認知機能のトップダウン制御と関連付けられています。海馬シータリズムは、海馬のオンライン状態に関連する最も顕著な振動であり、活発な運動、ひげの動き、匂いを嗅ぐなどの感覚情報摂取中に最も顕著ですが、レム睡眠期にも常に存在します。シータリズムは、ブローカの対角帯内側中隔に位置するペースメーカー細胞によって生成され、海馬CA1介在ニューロンにGABA作動性およびコリン作動性の駆動を提供します。一方、興奮性のCA3海馬下野および嗅内皮質からCA1海馬下野の樹状突起への入力も、より強く高周波のシータ振動を生成する可能性があります。複数の弱く結合したシータ発振器の存在は、様々な認知タスクに適した細胞アセンブリの選択に必要な柔軟性を可能にするかもしれません。シータリズムの最も重要な特徴の1つは、GABA放出のシナプス後抑制効果によって局所ガンマ振動を生成する介在ニューロンの発火を調節する能力です。このメカニズムは、脳全体にわたる情報のチャンキングの一般的なメカニズムとして提案されました。このようなバイアスまたは「振動の入れ子構造」の結果は、遅い(シータ)リズムの位相が速い(ガンマ)リズムの振幅を調節するという観察を反映しています(図1.23-4)。
ガンマ振動は最も遍在性の高いリズムです。それらは、速いGABA介在抑制がソマターゲット介在ニューロンによって提供されるすべての脳構造に局在化されています。これほど広範囲にわたるものが、知覚、注意、記憶、シナプス可塑性、意識と関連付けられているのは驚くことではありません。シータリズムとは対照的に、ガンマ振動はより局所的に生成され、30Hzから約150Hzまでの広範囲の周波数をカバーするより速い振動です。ガンマ帯域の上限は活発な議論の対象となっています。ガンマリズムはもともと35〜85Hzの帯域として定義されていましたが、より最近の研究では、著者らは海馬ガンマ帯域を遅い(<50Hz)、中周波(60〜90Hz)、および「高い」または「速い」(>100Hz)成分に細分しています。ただし、100Hzを超える振動活動については、活動電位および関連する後電位の広帯域スペクトル内容による汚染の可能性があるため注意が必要です。ガンマ振動は、興奮性ニューロンと抑制性ニューロンの相互作用によって生成されます。GABA作動性介在ニューロン、特にCa2+結合タンパク質パルブアルブミンを発現する介在ニューロンは、ガンマ周波数振動を生成するペースメーカーシステムの特に重要な部分であることが示されています。これらの介在ニューロンは、グルタミン酸受容体を介した興奮性入力を受け取ります。電気的ギャップ結合とGABA作動性シナプスを介して相互接続されたパルブアルブミン発現介在ニューロンのネットワークの一時的な興奮は、リズミカルな抑制性シナプス後電位を生成し、これにより多数の錐体ニューロンの発火を同期させることができます(図1.23-5)。
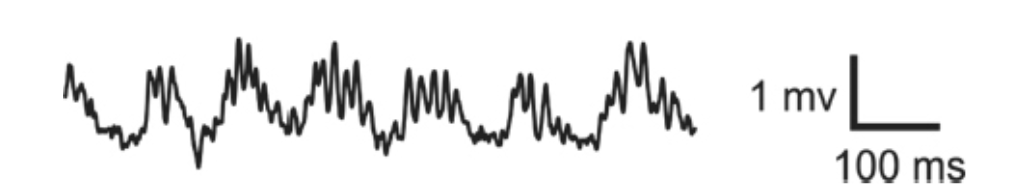
図1.23-4.異なる神経振動の位相振幅カップリング
このLFPの例は、速い(60〜100Hz)ガンマ振動がシータ(約8Hz)振動の中に「ネスト」している様子を示しています。ここには約6.5個のシータ周期が描かれています。最大のガンマ振動は、同期するシータ振動のピークに続いて優先的に発生する傾向があることに注目してください。
神経電気活動と神経コード
典型的なパターン生成ネットワークを図1.23-6に示します。
フィードフォワード抑制(図1.23-6 左)は、求心性興奮の減衰メカニズムを提供します。ここでは、遠隔の興奮性細胞が局所の介在ニューロン、またはギャップ結合によって結合された局所の介在ニューロンのグループを活性化し、それが今度は局所ネットワーク内の複数の主細胞を抑制します。このメカニズムは、主ニューロンの発火確率の時間窓を狭めることによって、発火の時間精度を高めます。主ニューロン発火の「好機」の周期的な繰り返しが抑制性ニューロンの時定数によって定義されるため、この興奮性ニューロンと抑制性ニューロンの組み合わせは、ガンマおよび他の種類の振動の生成メカニズムの1つとして提案されています。
フィードバック抑制(図1.23-6 中央)では、介在ニューロンは局所の主細胞から興奮性のグルタミン酸作動性入力を受け取り、その代わりに同じネットワーク内の主細胞の特定のコンパートメントに抑制を提供します。フィードバック抑制は、主細胞の興奮性を低下させるメカニズムと、主細胞の特定の樹状突起セグメントの抑制メカニズムを提供します。
側方抑制(図1.23-6 右)は、選択された主ニューロン(左の集団)の活性化を増強することによって、異なるアンサンブルパターンの選択的活性化のための効果的な「勝者総取り」メカニズムを提供します。これは、今度は他のニューロンネットワークを抑制し、したがってそれらの発火の機会を減少させます(右の集団)。

図1.23-5. パルブアルブミン発現バスケット細胞型介在ニューロンのシータ調律ガンマ周波数発火
電場電位におけるシータおよびガンマ振動の潜在的な発生源が、パルブアルブミン発現バスケット細胞の細胞内記録とLFPの細胞外記録という、この一対の同時記録によって示されています。(Ylinen A, Soltesz I, Bragin A, Penttonen M, Sik A, Buzsaki G. Intracellular correlates of hippocampal theta rhythm in identified pyramidal cells, granule cells and basket cells. Hippocampus. 1995;5(1):78-90. doi: 10.1002/hipo.450050110.より改変。)
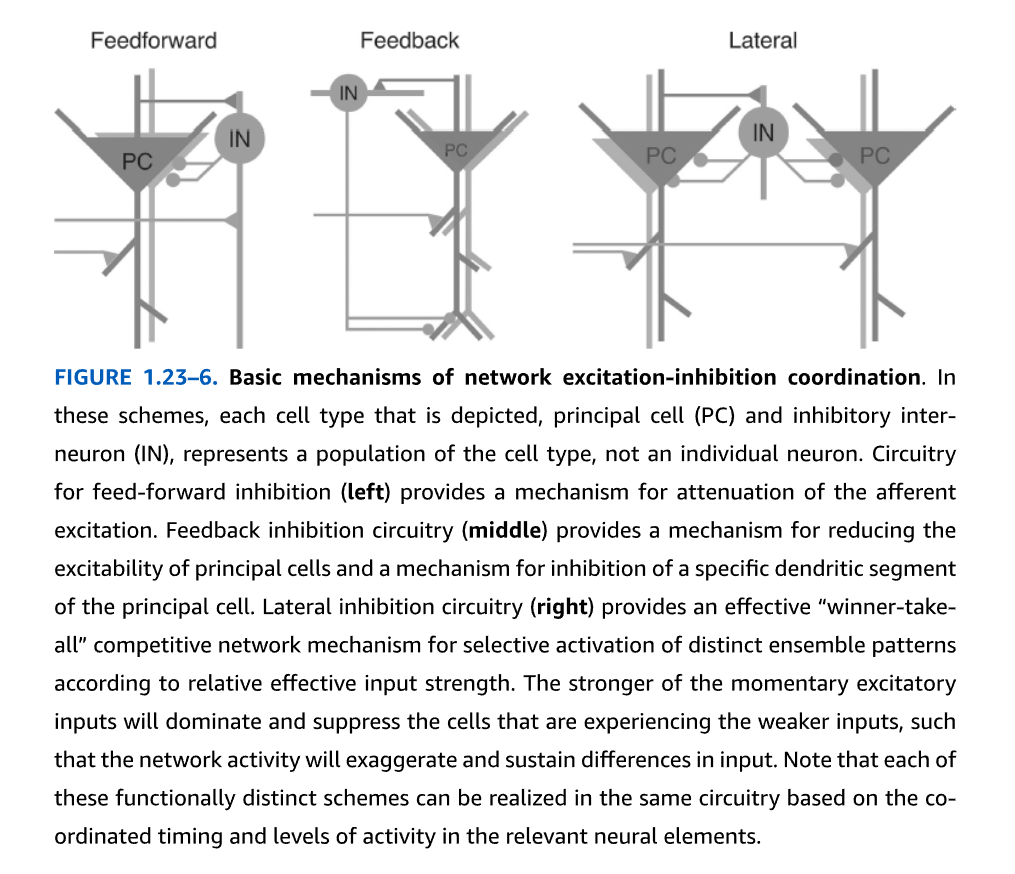
図1.23-6. ネットワークの興奮-抑制協調の基本メカニズム
これらの模式図では、描かれている各細胞型(主細胞(PC) および 抑制性介在ニューロン(IN))は、個々のニューロンではなく、その細胞型の集団を表しています。
フィードフォワード抑制回路(左)は、求心性興奮の減衰メカニズムを提供します。
フィードバック抑制回路(中央)は、主細胞の興奮性を低下させるメカニズムと、主細胞の特定の樹状突起セグメントの抑制メカニズムを提供します。
側方抑制回路(右)は、相対的な有効入力強度に応じて、異なるアンサンブルパターンの選択的活性化のための効果的な「勝者総取り」競争ネットワークメカニズムを提供します。瞬間的な興奮性入力の強い方が優位になり、弱い入力を受けている細胞を抑制することで、ネットワーク活動は入力の差異を強調し、維持します。
これらの機能的に異なる各スキームは、関連する神経要素における協調されたタイミングと活動レベルに基づいて、同じ回路内で実現できることに注意してください。
ガンマ活動は能動的に伝播されるのではなく、その神経協調における役割は、ニューロンのスパイクを同期させることです。専用コーディング仮説の観点からは、抑制が同期をもたらすというのは直感に反するように思えるかもしれません。しかし、アンサンブルコーディング仮説の観点からは、抑制は主細胞が放電する狭い機会の窓を定義することによって同期をもたらします。スパイク活動とガンマ振動の間の結合は、局所抑制性ニューロン(ガンマ生成に不可欠)が局所ガンマサイクルの谷で優先的に発火するために生じる可能性があります。このメカニズムは、抑制が弱くなるオフセット位相で興奮性投射ニューロンのスパイクが発生する可能性を高めます。ガンマとスパイクの間の結合のこの特徴は、皮質処理の中心的な側面として仮説化されています。
ガンマリズムの役割についてもいくつかの仮説が提案されています。ある仮説によれば、ガンマに対する発火の位相が刺激強度を符号化します。なぜなら、より強い求心性興奮は、進行中のガンマ振動によって設定される機会の窓のより早い段階での発火を可能にするからです。もう一つの考えは、ガンマがニューロン集団間の通信に影響を与え、2つの集団でガンマ位相コヒーレントなスパイクがある場合に通信が引き込まれ、増加するということです。
神経協調 – 神経振動における同期の多様性の測定
様々な形態の神経同期、すなわち同じ機能を持つ細胞の協調的かつ同期した活性化、および異なる機能を持つ細胞の能動的な非同期化が、神経計算の基本的なメカニズムとして提案されてきました。神経同期は複数のスケールにわたって現れます。細胞(微視的)スケールでは、活動電位とシナプス活動によって媒介される神経同期は、機能的に異なるニューロン亜集団間の一過性の結合として現れます。この神経亜集団の結合は、LFPにおける振動として現れる同期の形態と、神経ネットワークの中規模スケールで観察される同期を生成します。多数の神経ネットワークの同期活動は、頭皮EEGのような巨視的レベルで観察される信号を引き起こします。
神経同期の重要な側面は、そのクロススケール性です。例えば、ガンマのような神経振動は、ニューロンネットワーク内およびネットワーク間の活動電位を同期させます。さらに、シータのような遅い振動は、ガンマのような速い振動の一過性のバーストを同期させます(図1.23-5および1.23-6)。したがって、協調的な神経相互作用は、スケール全体および周波数帯域全体にわたって現れます。非常に重要でよく研究されている分野であるにもかかわらず、臨床現場でのスパイクデータ記録の困難さのため、ここではスパイク-電場同期についてはこれ以上議論せず、代わりに電場電位の振動内および振動間の同期に焦点を当てます。
振動は、複数の時間的および空間的スケールで観察できます。皮質振動は、従来のEEGによって非侵襲的に記録できます。直径約10mmの円形カップ電極が頭皮に配置され、頭皮と電極の間には少量の導電性ゲルが塗布されます。電極を頭の特定の位置に固定しやすくするため、電極は布製のキャップに埋め込まれることがあり、これにより記録中の位置が安定します。電極の位置は、国際10-20システムのように標準化されています。電極からの信号は通常、差動増幅器を使用して記録され、共通のリファレンスは電極の1つ(通常は10-20システムの中央にあるCZ電極)または結合された乳様突起電極です。頭皮EEGにはいくつかの重要な制限があります。皮質と電極の間の組織は、脳脊髄液、軟膜、クモ膜、硬膜、頭蓋骨、骨膜、頭皮によって形成されています。この組織は非常に不均一であり、最も重要なのはその導電性です。低導電性の骨の存在は、信号のぼやけを引き起こし、空間分解能と発生源局在性を低下させます。もう一つの問題は、電極と記録される神経組織との距離に関連しています。電場の強度は距離の2乗に反比例するため、電極上で測定可能な電圧変化(数十マイクロボルト)は、電気的双極子層を形成する6,000万個のニューロンに対応する約6cm²の皮質脳回組織の同期活動に相当します。頭皮EEGの最後の重要な制限は、その周波数範囲です。脳振動のスペクトル振幅は、べき乗則に従ってその周波数に反比例するため、信号/ノイズ比が徐々に悪化するため、頭皮上で高周波を記録することはますます困難になります。この事実により、EEGの上限帯域幅は約70Hzに制限されますが、**試行平均法(イベント関連電位、ERP)**などのいくつかの技術がこの制限を回避するために使用されてきました。
EEGよりも高い空間分解能と周波数分解能は、脳組織と直接接触する硬膜下電極を使用する脳波皮質電図(ECoG)によって達成できます。ヒトでは、この技術はてんかん患者の術前モニタリングに限定されており、てんかん原性発生源の局在化がこの高度に侵襲的な技術の正当性を提供します。標準的なEEG電極と比較して、硬膜下電極は通常、直径2〜3mm、電極間隔10mmのグリッドまたはストリップの形で実装されます。電極と神経組織の間の密接な接触により、最大500HzのLFPの記録が可能です。
最高の空間分解能と周波数分解能は、少数のニューロンの電気信号を記録するために、ニューロンの双極子シートに直接挿入された貫通型高インピーダンス微小電極を使用することによって得られます。微小電極には、主に非ヒト霊長類研究で使用される高密度微小電極アレイや、主にげっ歯類で使用されるマイクロマシン加工された多点シリコンプローブなど、いくつかの異なる形態があります。微小電極が海馬のCA1領域に配置されると、半径140μm以内の最大1,000個のニューロンの合計活動を記録できます。
記録システムの残りの部分は、頭皮EEGであろうとLFPであろうと、原理的に同じです。従来、信号はまず信号フォロワー、つまりユニティゲインのオペアンプに送られますが、新しい低電力デジタル電子機器は、このステップをスキップできます。目標は、被験者をメインアンプとデジタル化段階に接続するケーブルを介して信号が通過することによって引き起こされる追加の電気ノイズを最小限に抑えるために信号インピーダンスを低減することであり、デジタル化が電極サイトで行われる場合はこれを回避できます。この段階の後、信号は1つまたは複数のオペアンプを使用して増幅され、信号の電圧は数十から数百マイクロボルトから数ボルトに増加します。この時点で、信号はアナログ-デジタルコンバータ(ADC)の飽和を避けるためにハイパスフィルタリングされ、次にADC段階でのエイリアシング効果を避けるためにローパスフィルタリングされ、最終的にデジタル変換のためにADCに送られます。ADCの出力は、活性電極と参照電極間の電圧に対応する16または24ビットのバイナリ数値です。このバイナリ数値は、さらなる処理のためにコンピュータメモリに保存されます。金属酸化物半導体シリコン製造技術の使用における最近の進歩により、電極接触部がアンプおよびデジタル化回路と統合された高密度電極アレイを設計することが可能になりました。限られた数の電極を特定のターゲットに配置する代わりに、この技術は、関心のある領域にあるサブセットのみが記録されるように、多数の余分な電極を配置することを可能にします。例えば、この技術で設計されたNeuropixels 2.0は、4つのシャンクに5,120個の15μm角の記録サイトが分布しており、コンピュータ制御の電子スイッチを使用して、ユーザーは384個のサイトから電気活動を記録することを選択できます。384個のデジタル信号は1つのデジタルデータストリームに多重化され、1本のワイヤで送信されるため、数千個の細胞からの電気活動を1.1gの記録システムで記録できます。この電子技術の進歩は特に重要です。なぜなら、遺伝子組み換えカルシウムインジケーター(GECI)を使用して活動電位に関連するカルシウム過渡現象を蛍光信号に変換することで、数千個のニューロンの電気活動を記録することは可能であったにもかかわらず、最新のGCaMP8 GECIでさえ、個々の活動電位を分解したり、進行中のLFPの振動と関連付けたりするには時間分解能(〜10ミリ秒)が遅すぎるからです。現在開発中の無毒の遺伝子組み換え電圧センサーは、記録技術に新たな革命をもたらすことを約束しています。このような電圧センサーは、覚醒行動中の脳内の数十から数百個の個々の細胞から、サブスレッシュホールドの膜内変動と活動電位の両方を、高時間忠実度とマイクロメートル空間分解能で記録することを可能にするでしょう。これらの前例のない可能性は、新たな洞察をもたらし、新たな疑問や特定の生物物理学的仮説を評価することを可能にするでしょうが、その間、神経振動の分析は患者記録の最先端技術です。
振動の分析
振動の分析における最も基本的なアプローチはフーリエ解析に基づいています。これは、電圧信号の時間表現を高速フーリエ変換(FFT)を用いて周波数領域に変換するものです。この変換の結果はパワースペクトルであり、元の電圧時系列信号を異なる周波数の振動の関数として定義します。具体的には、パワースペクトルは、元の電圧時系列信号が構成されている各周波数で定義された正弦関数の量(パワー)です。重要なことに、FFTの計算には十分に長い時系列データが必要であり、信号の周波数成分が時間的に有意な変動をしなかったと仮定されます。したがって、パワースペクトルを用いた適切な分析は、信号の定常性を仮定しており、そのため、定常性の仮定が無効である場合、振動の動態に関する情報を提供することはできません。
神経信号は時間的に変化する性質を持つこと、特に認知プロセスに寄与する可能性のある信号は、デジタル信号処理工学の応用として開発されたいくつかの手法が現在利用可能であり、システム神経科学の応用においてその使用と有用性が増していることを認識することが重要です。そのような発展の1つに、フーリエ変換の拡張である短時間フーリエ変換(STFT) があります。STFTはパワースペクトルに時間の次元を加え、個々の周波数におけるパワーの時間的変化を分析することを可能にします。STFTの時間周波数分解能の限界は、ウェーブレット解析によって部分的に克服されており、これにより様々な詳細レベル、またはスケールでの時間周波数分析が可能になります。複素ウェーブレットを使用すると、信号から瞬時位相と振幅情報も推定できます。この概念は、バンドパスフィルターを適用し、その後にヒルベルト変換を行うことで、周波数で定義された信号の位相と振幅の時系列も得られるという考え方と類似しています。EEGおよびLFP信号の時間的に変動するスペクトル成分を測定する能力は、図1.23-3および図1.23-4のLFP断片に見られるシータ振動とガンマ振動のような、異なる振動の相互作用を研究することを可能にしました。
振動の相互作用は、二変量データ分析の手法によって研究できます。一般的に、これらの手法は、信号の様々な側面間の関係を分析します。例えば、時間における振幅(相互相関)、それらの位相関係(コヒーレンス、位相ロッキング)、または振幅と位相の関係(クロス周波数カップリング [CFC])などです。位相ロッキングやCFCのような最も高度な手法は、類似のスキームに基づいています。まず、分析対象の両信号がバンドパスフィルターされます。その後、ヒルベルト変換が両信号の位相情報と振幅情報を分離します。次のステップでは、位相および/または振幅情報が円形分散や相互エントロピーなどの指標を使用して比較されます。最後の重要なステップは、例えば代理データ手法を用いて、位相および/または振幅関係の統計的有意性を検定することです。
容易に測定できる同期にはいくつかの種類があります。振幅同期(図1.23-7 左)は、2つの信号の振幅が共変動し、時間的に一致するときに最大になります。この同期形式は、線形相互相関によって検出できます。位相同期(図1.23-7 中央)は、2つの信号の瞬時位相の差が一定であるときに最大になります。位相同期は、位相ロッキング値(PLV)やコヒーレンスなどの測定値によって検出できますが、振幅同期もコヒーレンスに寄与します。位相-振幅同期(図1.23-7 右)は、ガンマのような速い信号の振幅が、シータのような遅い信号の位相によって変調されるときに最大になります。その協調は**位相-振幅カップリング(PAC)**と呼ばれますが、このような相互作用は異なる周波数帯域間でも発生するため、CFCとも呼ばれます。「ネスト」という用語もPACを記述するために使用されており、遅い振動の位相が、遅い振動の周期内で速い振動の振幅を変調するという事実を強調しています。あらゆる形態の神経同期が神経回路および脳機能において役割を果たす一方で、現在の目標は包括的であるよりも説明的であることなので、神経振動が神経回路計算にどのように関与するかの主要な原則を説明するために、PACの議論を拡張します。

図1.23-7. 同期の種類
振幅同期(左)では、2つの信号(青と黒で示されている)の振幅が類似した時間パターンをたどります。位相同期(中央)では、2つの信号の位相が時間を通じて一定の位相オフセットを維持します。位相-振幅同期(右)では、速い振動の振幅が遅い振動の特定の位相で現れます。
位相-振幅カップリング(PAC)
PACは、様々な脳領域および異なる動物種間で観察されています。ここではPACの計算方法については検討しませんが、その方法と限界に関するレビューを参照してください。ヒトの新皮質では、速いガンマ振動(80〜150 Hz)のパワーが約8 Hzのシータ振動に位相ロックされており、異なる行動課題は皮質全体で独特のシータ-ガンマ結合パターンを誘発します。ヒトの新皮質におけるシータ-遅いガンマ(25〜50 Hz)結合の特性は、ワーキングメモリに保存された項目の数を反映しています。記憶負荷の増加は、遅い振動の周波数の減少と関連しており、それぞれの情報表現がガンマ周期によって刻まれるため、より多くの情報表現に対応するためにはより長い振動周期が必要であるという考えと一致しています。
PACは、神経回路の計算的に異なるコンパートメントへの情報流を調整し、経路決定すると考えられています。ラットの海馬CA1領域では、局所振動のシータ位相が、遅いガンマと速いガンマという、やや重複する2つのガンマ周波数帯の振幅を変調することが示されています。遅いデルタ(1〜4 Hz)リズムの、課題関連入力ストリームの感覚選択における役割も実証されています。PACの生理学的メカニズムはよく理解されていませんが、海馬の周体抑制性バスケット細胞が、ガンマ周波数でシータリズムの活動電位列を発火させることで、細胞集合の時空間的組織化に役割を果たし、したがって、この活動が両方のリズムとその位相-振幅関係および位相-位相関係に寄与すると仮説化されています(図1.23-5)。
PACの計算上の役割については、いくつかの概念的枠組みも提案されています。神経活動のクロススケール組織という概念は、知覚結合、選択的注意、認知制御、および特定の計算細胞集合の動員を達成するために、いくつかの機能的に異なるネットワーク間で情報を統合する可能性のある神経メカニズムを提供します。巨視的(遅い振動)、中規模(高周波振動)、微視的(単一ニューロン活動)スケールの神経活動は、絡み合っており、遅い活動の短い時間窓内で徐々に速い活動が発生するようになっています。特に明確な例は、自由に振る舞うラットの海馬LFPに見られます。海馬シータリズムの位相は、海馬ガンマ振動の振幅を変調します(図1.23-4を参照)。次に、ガンマ振動は、海馬錐体細胞の放電確率が最大になるミリ秒スケールの「機会の窓」 を提供します。伝導遅延のため、シータのような遅い振動は、より長い距離にわたる機能的ネットワークの同期に特に適していると示唆されています。これに対し、ガンマのような速い振動は、比較的短い空間スケール(数百マイクロメートルにも及ぶ)で、同じ機能を持つ集合体へと一時的にニューロンの活動電位放電を同期させる可能性があります。2つの振動間の相互作用は、局所からグローバルなスケールへの空間統合のメカニズムを提供する可能性があります。このスキームでは、遅いシータ振動の特定の位相で現れるより速いガンマ振動が、同じ情報をシグナルする細胞のサブセットを、ニューロン情報処理のための共活動細胞の細胞集合へと動員する可能性があります。シータは、その後、より長い期間にわたって特定のガンマエピソードと関連付けられたいくつかの機能的ネットワーク間の統合メカニズムとして機能するかもしれません。
PACの機能的意義に関するもう一つの概念的枠組みは、位相符号化のアイデアに基づいています。ここでは、PACがシータサイクルの異なる位相で異なる情報を符号化するメカニズムであるとされます。このシナリオでは、遅いシータ振動の特定の位相で現れるより速いガンマ振動が、図1.23-4に示されているように、細胞間の放電パターンによって異なる表現を符号化する、異なる神経集合を活性化すると仮説化されています。
神経発火と振動の非協調性
神経同期の障害は、統合失調症、自閉症、アルツハイマー病、パーキンソン病、てんかんなど、多様な脳疾患に関連する認知機能障害の根底にあると提案されています。機能不全が同期の不足から単純に生じるというわけではありません。むしろ、神経同期が認知機能に最適化されており、多すぎても少なすぎても異常な認知として現れるという考え方です。ムーニー顔(人間の顔の白黒の輪郭写真)のゲシュタルト知覚は、統合失調症患者で障害され、その障害はガンマ帯域における位相同期の低下と関連しています。また、シータ周波数振動の選択的な変化が報告されており、ガンマ帯域における局所的な同期がほぼ無傷である一方で、大規模な同期の欠損を示唆しています。いくつかの研究では、陽性症状、特に視覚および聴覚の幻覚と妄想が、誘発および誘導されたベータ帯域およびガンマ帯域活動の振幅および位相同期の増強と相関していることが示されています。一方、陰性症状は、高周波振動の増強と減少の両方と関連付けられています。実際、統合失調症では、安静時、ベースライン(すなわち、誘発されていない)のガンマパワーが上昇しているという実質的な証拠があります。これは、刺激誘発性ガンマ上昇が統合失調症患者で減弱しているように見える理由の一部を説明するかもしれません。統合失調症における神経非協調性のこれらの多様な所見を説明する正確なメカニズムは不明ですが、皮質GABA作動性介在ニューロン集団におけるパルブアルブミン発現の減少がGABA作動性機能不全を示しており、これがガンマ帯域の同期障害を引き起こし、これは多数の錐体ニューロンの局所同期発火に不可欠であり、分散した神経活動の時間的協調に欠陥をもたらす可能性があると仮説化されています。
精神障害の神経発達モデルにおける神経非協調性
一般に精神疾患、特に統合失調症を理解する上で重要な進展は、これらが神経発達障害であるという認識です。神経発達を妨害する効果は動物モデルを用いて研究されており、統合失調症のような障害が神経発達起源を持つという主張に対する最も説得力のある支持の一部を提供しています。MAM-E17ラットモデルでは、妊娠中のメスラットに胚発生17日目にマイトトキシンであるメチルアゾキシメタノールアセテート(MAM)が投与され、海馬と前頭前野の進行中の胚発生を優先的に破壊します。成人MAMラットは、認知の柔軟性の欠損とドーパミン作動性アゴニストへの過応答性、海馬グルタミン酸作動性機能不全、およびパルブアルブミン陽性介在ニューロン発現の減少を示します。これらの異常には、状態選択的な神経応答と睡眠中の遅い振動の根底にある皮質アップ状態とダウン状態の遷移の減少が伴います。前頭前野における海馬(150〜250 Hz)のリップル振動と睡眠中の視床皮質紡錘波の結合も、成人MAMラットで障害されます。したがって、MAM神経発達障害は、統合失調症に一般的に関連する多種多様な異常と、神経ネットワーク機能の非協調性の明確な証拠を引き起こします。
新生児腹側海馬病変(NVHL)ラットは、統合失調症研究で最も研究されている神経発達モデルの1つです。これは、幼少期の脳損傷が神経回路の異常な発達を引き起こすという仮説に基づいて開発されました。腹側海馬の興奮毒性病変は生後7日目に発生し、これはヒトの脳発達における妊娠第3期に相当します。NVHL研究は、早期の脳損傷が統合失調症に関連する神経回路と認知機能を障害する可能性があるという最も強力な証拠の一部を提供します。成人NVHLラットは、精神疾患、特に統合失調症に関連する異常を示します。これらには、皮質樹状突起形態の異常、GABA作動性代謝の減少、過剰なドーパミン作動性シグナル伝達、ドーパミン作動性アゴニストへの過応答性行動、および成人期に現れる様々な行動異常が含まれます。統合失調症では発作の有病率が増加しており、成人NVHLラットではてんかん様活動の発生率が増加しています。成人期に病変を作成しても同じNVHL異常は生じず、結果に発達的要素があることと一致しています。
成人NVHLラットでは、前頭前野および側坐核の単一ニューロン応答が異常です。通常、前頭前野の発火は腹側被蓋野の刺激からのドーパミンに応答して減少しますが、NVHL成人では前頭前野活動が増加します。このような興奮-抑制協調の障害は、部分的にドーパミンによる介在ニューロンの活性化の障害によって生じます。成人NVHL新皮質の脱抑制は、意思決定課題のような認知機能障害と関連しています。対照ラットでは、思春期の前頭前野ネットワークも脱抑制されており、成人よりも協調性が低く、NVHL情報処理ネットワークが機能的に未熟であることを示唆しています。
認知的に困難な行動中、NVHLラットの皮質ネットワーク活動パターンは、海馬と前頭前野内およびそれらの間で非協調的です。匂い識別課題中、ラットは行動サンプリングイベント関連で低周波(1〜30 Hz)前頭前野振動の増加を生成します。これらの増加はNVHLラットでは弱いです。振動の減少が興奮-抑制組織の減少の指標であることと一致して、NVHLラットの前頭前野ニューロンは、動物が匂いをサンプリングするときに過応答性であり、これはドーパミンレベルが上昇すると予想される高報酬試行で悪化しました。これらの異常は、振動パワーの差が検出されにくいベースライン行動中には明らかではなく、ネットワーク活動パターンが被験者が何をしているか、そしておそらく何を考えているかに敏感であることを示しています。したがって、グループおよび治療の差は認知努力中に現れる傾向がありますが、生理学的差が認知パフォーマンスとは無関係である可能性もあり、行動と生理学が同時に評価されない限りこれを判断することは困難です。
認知行動とネットワーク活動の相互依存性は、ゆっくりと回転するアリーナでの能動的場所回避課題を実行するNVHL成人の研究で明らかです。この課題は、固定された空間手掛かりを使用し、無関係な回転する嗅覚手掛かりを無視するために、健全な海馬機能と維持された海馬長期増強(LTP)、および認知制御を必要とします。NVHL成人は場所回避が障害されますが、長期間の訓練によって対照群のパフォーマンスに近づくことができます。NVHLラットは思春期には障害されず、認知制御の要求が減少した場合も障害されません。これは、てんかん様活動の増加が基本的なパフォーマンス学習と記憶の欠損を引き起こすには不十分であることを示しています。海馬および前頭前野のLFPは、歩行中に広範な周波数帯で減少しますが、これは経験と手掛かりの利用可能性に依存する認知機能障害を説明するには不十分です。課題中と比較して、安静時、グルーミング、摂食などのホームケージ行動中には、海馬間および前頭前野間の振動の位相および振幅同期は減少しますが、ガンマ帯域では、すべての条件下でNVHLと対照群で類似しています。場所回避中には、半球間位相同期がホームケージ行動中と比較して増加しますが、前頭前野同期は場所回避中にNVHL群と対照群の間で差はありません。海馬間のシータ位相同期は、NVHLラットが対照群と同じくらい良好にパフォーマンスしている場合でも、NVHL成人で弱いです。成人期におけるこれらの差は、思春期における認知訓練によって予防されました。これはおそらく、神経ネットワーク機能における持続的な変化によるものです。神経非協調性と認知異常は、抗てんかん薬のエトスクシミドによる興奮性低下によって部分的に減弱することも、興奮-抑制の不均衡がNVHL成人における非協調性を引き起こし、この非協調性が認知異常を説明するのに十分である可能性と一致しています。
統合失調症のリスクを付与する遺伝子欠損および症候群の特定における実質的な進歩により、これらの遺伝的変化をマウスでモデル化することが可能になりました。1つの基本的な観察は、そのような遺伝子欠損が、統合失調症に加えて、大うつ病、双極性障害、ADHD、自閉症を含む複数の障害のリスクを付与する傾向があるということです。この明らかな多面発現性は、遺伝的変化のメカニズム的結果を理解することの価値と、シナプスタンパク質や受容体のような細胞生物学的な根本的な変化が、それらが発現する時期や特異的な細胞型に応じて多様な結果をもたらす可能性があるという事実を浮き彫りにしています。Df(16)A(+/-)変異マウスは、統合失調症を含む広範な神経精神疾患のリスク増加を伴う22q11.2微小欠失症候群をモデル化するため、重要な遺伝子モデルとして浮上しています。これらの変異マウスは、認知機能障害を予測する新皮質と海馬の両方における神経活動の非協調性を含む、シナプス、細胞、神経回路、および行動の異常を発現します。おそらく最も一般的な遺伝子モデルは、RNA結合タンパク質である脆弱X精神遅滞タンパク質(FMRP) を生成する遺伝子を欠損したFmr1ノックアウトマウスです。Fmr1ノックアウトマウスは、過剰な(>200)CGGヌクレオチドリピート伸長によるFMR1遺伝子のサイレンシングに起因する脆弱X症候群の遺伝的欠陥をモデル化します。FMRPを欠くFmr1ノックアウトマウスは、様々なシナプス、細胞、および神経生理学的異常を発現し、その多くはFMRPの回復、またはmRNAからタンパク質への翻訳のための分子シグナル伝達の回復、あるいはFMRP喪失に起因する調節不全なcAMP代謝およびタンパク質発現のレベルに対抗することによって回復できます。認知機能障害の減弱の可能性と非協調性仮説と一致して、多様な細胞異常にもかかわらず、Fmr1ノックアウトマウスは正常な海馬場所細胞と単一細胞の電気生理学的特性を発現できますが、これらの細胞間の活動電位タイミングの非協調性と、LFPにおける進行中の振動との関係は異常です。これらの所見は、自閉スペクトラム症で観察される欠陥のFmr1ノックアウトモデル、ならびにCntnap2(-/-), 16p11.2(del/+), Tsc2(+/-)遺伝子モデルにおける根本的な興奮-抑制非協調性を示唆しています。単一遺伝子欠陥でさえも複雑な多レベルの結果をこのように解剖し解明することは、新規治療選択肢を特定するための動物モデルの力と可能性を示しています。これらの所見やDf(16)A(+/-)、Fmr1ノックアウト、その他の神経精神疾患に関連する変異マウスにおける他の所見は非協調性仮説と一致していますが、これらの神経機能不全の欠陥がどのように生じ、どのように正常化できるかを理解することは依然として困難な課題です。したがって、この分野は、とらえどころのないメカニズムを特定するために動物モデルを利用する強力な新しい神経生物学的技術に焦点を当てています。
まとめ
システム神経科学の視点は、生物学的組織の多様なレベルを包含し、これを統合的な枠組みで実践する際には、同じ被験者から異なる生物学的レベルで測定を行い、クロススケールな関係や原則を探すことを目指します。このシステムアプローチは、統合失調症に関連するモデルのような精神疾患に関連する動物モデルを用いて仮説を検証する際に特に強力になり得ます。なぜなら、臨床集団において必要なマルチスケールのシステムレベル分析を行うことは、不可能ではないにしても極めて困難だからです。
締めくくりの例として、統合失調症に関連し、図1.23-5に示されるようなGABA作動性介在ニューロンに関連するパルブアルブミン免疫反応性の減少として現れるGABA作動性トーンの喪失を考えてみましょう。このようなGABA作動性機能の損なわれは、認知機能障害が生物学的組織の異なるレベルに影響を与えるマルチスケールの障害の結果であると主張するシステムレベルの非協調性仮説と一致しています(図1.23-1)。この見解によれば、遺伝的異常や変化した発達プログラムは、シナプスと細胞のレベルで、効率的なカルシウム結合(パルブアルブミンの正常な機能)による分子相互作用の障害を引き起こします。これは、異常なシナプスシグナル伝達やシナプスタンパク質合成の調節不全など、多様な結果をもたらす可能性があり、これらすべてが神経回路レベルでの興奮と抑制の不均衡に寄与します。これらの回路は動的で非線形であるため(少なくとも部分的には図1.23-6に示されるネットワークメカニズムのため)、GABA作動性ニューロンにおけるパルブアルブミン発現の減少の結果は、時間的に変動する興奮-抑制の非協調性となります。
興奮-抑制の非協調性は、図1.23-3に示されるような神経アンサンブルにおける異常な放電の時間パターン、図1.23-4に示されるようなスパイク-電場同期の種類の障害、および集団シナプス活動を反映する電場電位における振動間の様々な形態の同期の非協調性として現れる非協調的な神経活動をもたらします。この仮説によれば、これらの多様な非協調性の形態は、認知制御の失敗や目的志向行動の組織化不全に代表される認知機能障害を引き起こします。
システム視点からは、標準的な薬理学的介入が認知機能障害の改善に効果的であるとは自明ではありません。少なくとも、システム視点では、特定の進行中の認知努力に応じて、特定の脳部位で特定の時点での介入が必要であるとされることが多いからです。より楽観的には、NVHLラット神経発達モデルの研究に例示されるように、システム神経科学の視点は、経験自体を活用して、機能不全の神経回路機能の位置および時間特異的な修正と調整を助ける機会があることを示唆しています。
希望と可能性としては、神経回路操作の詳細な動員と入力特異的な活性化と抑制に関する知識を開発し、精緻化するにつれて、シナプス可塑性のメカニズムを活用して機能不全の神経回路を調整し、修正する、認知行動療法やコンピュータベースの認知トレーニングプログラムのような特定の経験に基づく療法を設計し、実施することが可能になるでしょう。そうすることで、障害された認知行動を補償し、おそらく修正さえできるかもしれません。
まだ仮説の段階ではありますが、神経可塑性を調節するための製薬的介入または脳シミュレーションに基づく介入を、特定の神経回路の認知主導の運動と組み合わせることができれば、この組み合わせは、経験の自己組織化神経学的結果を利用して異常な脳機能を改善または正常化するための強力な戦略となる可能性があるという、実質的な楽観論があります。やるべきことはたくさんありますが、基礎システム神経科学がこれほど強力で広大なツールボックスを持ったことはかつてないため、かなりの楽観論を抱く理由もあります。
参考文献
- Antoine, M. W., Langberg, T., Schnepel, P., & Feldman, D. E. (2019). Increased excitation-inhibition ratio stabilizes synapse and circuit excitability in four autism mouse models. Neuron, 101, 648-661.e4.
- Berry-Kravis, E. M., Harnett, M. D., Reines, S. A., et al. (2021). Inhibition of phosphodiesterase-4D in adults with fragile X syndrome: a randomized, placebo-controlled, phase 2 clinical trial. Nature Medicine, 27, 862-870.
- Buzsáki, G. (2010). Neural syntax: cell assemblies, synapsembles, and readers. Neuron, 68, 362-385.
- Buzsaki, G., Anastassiou, C. A., & Koch, C. (2012). The origin of extracellular fields and currents—EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience, 13, 407-420.
- Cuthbert, B. N., & Insel, T. R. (2010). Toward new approaches to psychotic disorders: the NIMH Research Domain Criteria project. Schizophrenia Bulletin, 36, 1061-1062.
- Dvorak, D., & Fenton, A. A. (2014). Toward a proper estimation of phase-amplitude coupling in neural oscillations. Journal of Neuroscience Methods, 225, 42-56.
- Fenton, A. A. (2015). Excitation-inhibition discoordination in rodent models of mental disorders. Biological Psychiatry, 77, 1079-1088.
- Fernández-Ruiz, A., & Herreras, O. (2013). Identifying the synaptic origin of ongoing neuronal oscillations through spatial discrimination of electric fields. Frontiers in Computational Neuroscience, 7, 5.
- Gandal, M. J., Edgar, J. C., Klook, K., & Siegel, S. J. (2012). Gamma synchrony: towards a translational biomarker for the treatment-resistant symptoms of schizophrenia. Neuropharmacology, 62, 1504-1518.
- Gurney, M. E., Cogram, P., Deacon, R. M., Rex, C., & Tranfaglia, M. (2017). Multiple behavior phenotypes of the fragile-X syndrome mouse model respond to chronic inhibition of phosphodiesterase-4D (PDE4D). Scientific Reports, 7, 14653.
- Hamm, J. P., Peterka, D. S., Gogos, J. A., & Yuste, R. (2017). Altered cortical ensembles in mouse models of schizophrenia. Neuron, 94, 153-167.e8.
- Insel, T. R. (2010). Rethinking schizophrenia. Nature, 468, 187-193.
- Kao, H. Y., Dvorák, D., Park, E., Kenney, J., Kelemen, E., & Fenton, A. A. (2017). Phencyclidine discoordinates hippocampal network activity but not place fields. Journal of Neuroscience, 37, 12031-12049.
- Karayiorgou, M., Morris, M. A., Morrow, B., et al. (1995). Schizophrenia susceptibility associated with interstitial deletions of chromosome 22q11. Proceedings of the National Academy of Sciences of the United States of America, 92, 7612-7616.1
- Kelemen, E., & Fenton, A. A. (2010). Dynamic grouping of hippocampal neural activity during cognitive control of two spatial frames. PLoS Biology, 8, e1000403.
- Laughlin, R. B., Pines, D., Schmalian, J., Stojkovic, B. P., & Wolynes, P. (2000). The middle way. Proceedings of the National Academy of Sciences of the United States of America, 97, 32-37.
- Le2 Van Quyen, M., & Bragin, A. (2007). Analysis of dynamic brain oscillations: methodological advances. Trends in Neurosciences, 30, 365-373.
- Lee, H., Dvorak, D., Kao, H. Y., Duffy, A. M., Scharfman, H. E., & Fenton, A. A. (2012). Early cognitive experience prevents adult deficits in a neurodevelopmental schizophrenia model. Neuron, 75, 714-724.
- Lee, S. H., Ripke, S., Neale, B. M., et al.; Cross-Disorder Group of the Psychiatric Genomics Consortium. (2013). Genetic relationship between five psychiatric disorders estimated from genome-wide SNPs. Nature Genetics, 45, 984-994.
- Lieberman, J. A., Stroup, T. S., McEvoy, J. P., et al.; Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) Investigators. (2005). Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. New England Journal of Medicine, 353, 1209-1223.
- Liu, Q., Ganzetti, M., Wenderoth, N., & Mantini, D. (2018). Detecting large-scale brain networks using EEG: impact of electrode density, head modeling and source localization. Frontiers in Neuroinformatics, 12, 4.
- Mitchell, K. J., O’Donnell, P., Durstewitz, D., et al. (2013). A framework for the use of models in schizophrenia. In S. M. Silverstein, B. Moghaddam, & T. Wykes (Eds.), Schizophrenia: Evolution and Synthesis (pp. 212-226). MIT Press.
- Nunez, P. L., & Srinivasan, R. (2006). Electric Fields of the Brain: the Neurophysics of EEG. Oxford University Press.
- Park, E., Dvorak, D., & Fenton, A. A. (2011). Ensemble place codes in hippocampus: CA1, CA3, and dentate gyrus place cells have multiple place fields in large environments. PLoS One, 6, e22349.
- Phillips, W. A., & Silverstein, S. M. (2003). Convergence of biological and psychological perspectives on cognitive coordination in schizophrenia. Behavioral and Brain Sciences, 26, 65-82; discussion 82-137.
- Piatkevich, K. D., Bensussen, S., Tseng, H.-A., et al. (2019). Population imaging of neural activity in awake behaving mice. Nature, 574, 413-417.
- Sigurdsson, T., Stark, K. L., Karayiorgou, M., Gogos, J. A., & Gordon, J. A. (2010). Impaired hippocampal-prefrontal synchrony in a genetic mouse model of schizophrenia. Nature, 464, 763-767.
- Steinmetz, N. A., Aydin, C., Lebedeva, A., et al. (2021). Neuropixels 2.0: a miniaturized high-density probe for stable, long-term brain recordings. Science, 372, eabf4588.
- Subramaniam, K., Luks, T. L., Fisher, M., Simpson, G. V., Nagarajan, S., & Vinogradov, S. (2012). Computerized cognitive training restores neural activity within the reality monitoring network in schizophrenia. Neuron, 73, 842-853.
- Talbot, Z. N., Sparks, F. T., Dvorak, D., Curran, B. M., Alarcon, J. M., & Fenton, A. A. (2018). Normal CA1 place fields but discoordinated network discharge in a Fmr1-null mouse model of fragile X syndrome. Neuron, 97, 684-697.e4.
- Thomazeau, A., Bosch, M., Essayan-Perez, S., Barnes, S. A., De Jesus-Cortes, H., & Bear, M. F. (2021). Dissociation of functional and structural plasticity of dendritic spines during NMDAR and mGluR-dependent long-term synaptic depression in wild-type and fragile X model mice. Molecular Psychiatry, 26, 4652-4669.
- Thomson, S. R., Seo, S. S., Barnes, S. A., et al. (2017). Cell-type-specific translation profiling reveals a novel strategy for treating fragile X syndrome. Neuron, 95, 550-563.e5.
- Weinberger, D. R. (1996). On the plausibility of “the neurodevelopmental hypothesis” of schizophrenia. Neuropsychopharmacology, 14, 1S-11S.
- Ylinen, A., Soltész, I., Bragin, A., Penttonen, M., Sik, A., & Buzsáki, G. (1995). Intracellular correlates of hippocampal theta rhythm in identified pyramidal cells, granule cells, and basket cells. Hippocampus, 5, 78-90.
- Zaremba, J. D., Diamantopoulou, A., Danielson, N. B., et al. (2017). Impaired hippocampal place cell dynamics in a mouse model of the 22q11.2 deletion. Nature Neuroscience, 20, 1612-1623.

