1.24 計算論的モデリングを用いた精神医学へのアプローチ
ジョン・D・マレー博士、アラン・アンティチェヴィック博士
精神医学の主要な目標は、精神疾患の根底にある神経基盤とメカニズムを理解することです。メカニズムの理解は、新しい診断法と治療法を開発するために不可欠です。精神医学分野が直面する大きな課題は、分析レベル間の広大な説明ギャップを埋めることです。すなわち、ニューロンから回路、そして複雑な人間の行動へと至るギャップです。現在、いかなる精神症状に対しても、この計算階層全体にわたる統一的な理解が欠如しています。このことは、十分に確立された神経メカニズムに基づいた、新規で合理的に導かれる治療法を開発するこの分野の能力を大きく制限しています。
重度の精神疾患を脳に基づく疾患と概念化することは、もはや論争の的ではありません。神経科学の研究の爆発的な進展により、脳は本質的に、生物の行動の発現を司る、非常に複雑で非線形な計算装置であることが確立されています。この見方は、精神医学分野における進行中のパラダイムシフトによっても捉えられています。これは、行動に基づくカテゴリー的な精神医学的診断から、明確に定義された神経基質に対応する複雑な行動における次元的障害の理解へと移行するものです。この見方は、複雑な精神疾患の還元主義的なモデルを主張するものではありません。決定的に重要なのは、この見方が、精神疾患が外部の因果的要因や攪乱(例:長期ストレスや極端なトラウマ)が脳に影響を与える結果として生じないとは主張していないことです。それにもかかわらず、そのような攪乱は最終的に、行動反応(例:恐怖の表現)を司る一連の神経プロセスと計算に影響を与えます。簡単に言えば、精神科医が治療しようとしている臓器、つまり中枢神経系が存在するのです。
脳の複雑さと、異なる分析レベルにわたる膨大な数の起こりうる障害を考えると、精神医学分野は、上流の原因が遺伝子にあるか外部ストレス因子にあるかに関わらず、異常行動をメカニズム的に理解するために利用可能なすべてのツールを活用するよう努めるべきです。これらのレベルを結びつける有望な方法の1つは、「計算論的精神医学」と呼ばれる新たな分野において、臨床神経科学からの経験的知見を計算論的および理論的神経科学からのアプローチと組み合わせることです。ここでの主要な論理は、数学的原理と形式主義を用いて、分析レベルを超えたメカニズムのより良い理解につながる、一貫性があり、厳密で、テスト可能な仮説を生成することです。その意味で、計算論的精神医学は、ニューロン、神経系、そして最終的には異常行動のレベルで、実験的および治療的研究とのインターフェースの機会を提供します(図1.24-1)。別の言い方をすれば、特定の精神疾患に寄与する障害されたメカニズムは、ニューロンとシナプスのレベルで起こりえますが、精神症状は行動のレベルで発現し、それは大規模な脳ネットワークを含みます。これらの異なるレベルを結びつけることは、精神疾患のメカニズム的洞察を得るため、そしてシナプスレベルで作用する薬理学的治療法の合理的な開発のために不可欠です。計算論的精神医学の主要な目的は、この既存のギャップを埋め、注目された分析レベルにわたる計算を数学的に形式化するのを助けることです。
これまでに、神経システムの数学モデルは、根底にあるメカニズムから神経ダイナミクスと行動がどのように生じるかについての私たちの理解に大きく貢献してきました。このメカニズム的理解に基づいて、モデルの根底にある要素の障害を神経および行動の機能不全と関連付けることができます。特に、研究者は、どのモデルまたはモデルパラメータが、対照と比較して、疾患状態における経験的知見をより良く記述するかを評価できます。モデル内のこれらの障害を検討することにより、根底にあるプロセスの主要な違いを数学的に正確な方法で記述できます。このアプローチはまた、人間における高レベルの実験的にアクセス可能な非侵襲的測定(例:機能的磁気共鳴画像法 [fMRI] または精神物理学的行動)を用いて、低レベルの現象(例:特定のシナプス障害)に関する仮説をテストすることもできます。
実際、過去数十年で、精神医学分野は、非侵襲的神経画像技術、より洗練された人間の認知神経科学、および基礎神経科学の進歩の継続的な発展から非常に恩恵を受けてきました。これらのアプローチの組み合わせは、精神医学における広範なエビデンス基盤に直接影響を与え、精神疾患全体における神経変化の支持を提供しています。精神疾患における神経変化のこのような証拠は、幅広い実験様式から現れています。死後脳組織の分析は、精神疾患全体におけるニューロンおよびシナプス構造の違いを明らかにしています。遺伝子分析は、特定のニューロンおよびシナプス変化を示唆しています。神経化学的変化は、陽電子放出断層撮影(PET)や磁気共鳴分光法(MRS)などの非侵襲的方法を用いて生体内で評価できます。様々なタスク中および安静時の脳活動の時空間特性は、fMRI、脳波検査(EEG)、脳磁図(MEG)などの非侵襲的神経画像法を用いて測定できます。神経画像法はまた、灰白質分布と長距離白質経路における構造的違いも明らかにできます。前述のように、これらの神経測定は、行動レベルで患者の認知、情動、および知覚の障害を定量的に特徴づけることを可能にする、認知神経科学における急速かつ並行する進歩によって補完されています。
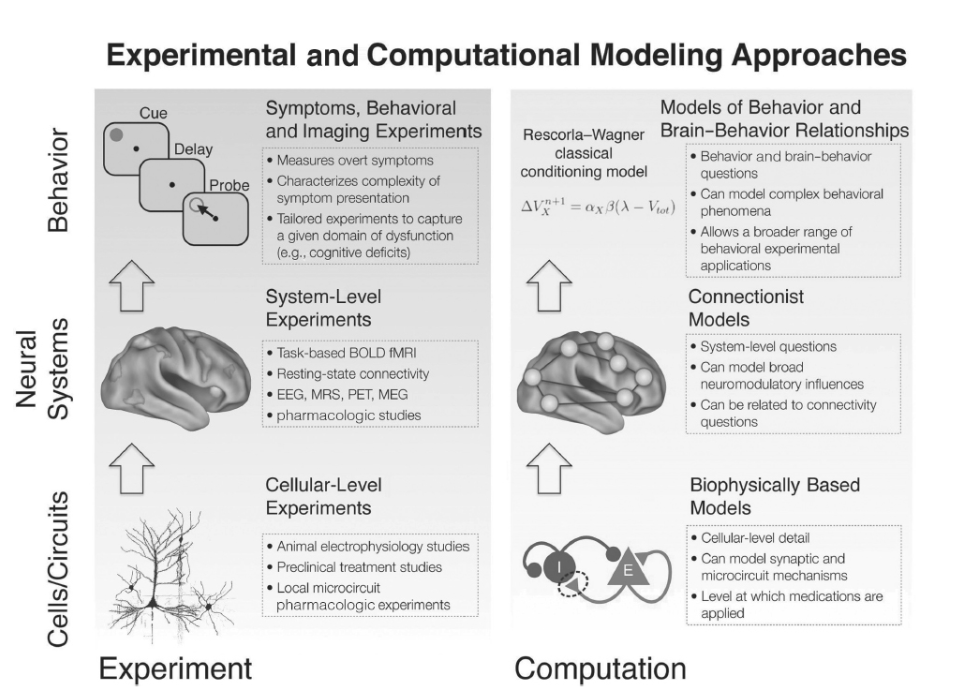
図1.24-1. 計算論的モデリングと分析レベルを超えた実験的相互作用の概念図
計算論的モデリング、特に統合失調症の研究における有用性は、実験研究の特定のレベルに情報を提供できる能力にあります。統合失調症における異常を細胞レベル、神経系レベル、そして最終的には行動レベルで研究するため、我々は実験的枠組みに最も適合するようにモデリングアプローチを利用する必要があります。例えば、細胞レベルの実験では、必要なレベルの生物物理学的リアリズムを含むモデル(下段パネル)を用いることで、最もよく捉えられる技術と測定値が生成されます。このようなモデルは、例えば、研究対象となっている神経振動のようなマイクロ回路現象を司る可能性のあるシナプスプロセスに情報を提供することができます。
次に、多くの神経画像研究は、課題ベースのパラダイムと安静時機能的結合性アプローチの両方を用いて、統合失調症におけるシステムレベルの障害を特徴づけることに焦点を当ててきました。このようなシステムレベルの認知神経科学実験に最もよく情報を提供するために、モデルはより大規模な神経システムの関連する詳細と複雑さを捉えるべきです(中段パネル)。このようなモデルは、全身的な薬理学的操作がBOLD fMRIに与える役割をよりよく示唆したり、統合失調症における機能的結合性研究の結果を予測するために使用されたりする可能性があります。
最後に、統合失調症は複雑で壊滅的な行動症状を引き起こし、これはますます洗練された行動パラダイムを通じて測定できます。ここで、複雑な行動を形式化するモデルの使用は、患者における特定の行動プロセス(例:強化学習)を定量的に調査するための強力なツールを提供できます。
このような爆発的な技術的および実験的進歩にもかかわらず、精神医学分野は、治療法の合理的な開発に適した体系的かつメカニズム的な疾患モデルをまだ生み出せていません。前述のように、精神疾患のこのような多レベルの理解を達成するためには、精神医学分野は最終的に、シナプスから細胞へ、神経回路へ、大規模システムへ、そして行動障害へと、これらの分析レベルをリンクさせる必要があります。新たな分野である計算論的精神医学は、これらのギャップを埋めるために必要な理論的基盤を提供する上で独自の立場にあります。計算論的精神医学は、計算神経科学というより広い分野における多様な補完的なモデリングアプローチから恩恵を受けています。異なる種類のモデルは、異なる疑問や異なる種類の実験データに対処するのに最も適しています。その意味で、計算論的モデリングのレベルは、実験的探求の適切なレベルと一致しており、実験と理論の相互作用を可能にしています。行動における複雑な異常(すなわち、精神症状)の多レベルの理解は、これらの補完的なモデリングアプローチから直接恩恵を受けています(図1.24-2)。
この章では、広義に定義された3つのレベルの計算論的モデリングについて説明します。(1)生物物理学的モデル:シナプス、ニューロン、回路の現実的な生理学的特性によって制約されます。これらのモデルは、シナプスレベルの仮説を検証し、精神医学における生理学的および薬理学的研究と比較するのに適しています。このタイプのモデリングは、疾患状態の神経生理学的バイオマーカーを研究するのにも適しています。(2)コネクショニストモデル:より抽象的な神経要素を使用しますが、システムレベルの神経アーキテクチャを組み込みます。これらのモデルは、より複雑な行動に適用でき、課題ベースの神経画像や行動、すなわち認知神経科学のアプローチとのインターフェースにも適しています。(3)行動の数学モデル:認知計算の根底にあるアルゴリズムを形式化し、それが行動症状や認知欠損を形式化することができます。これらのモデルは、行動や症状を定量的に当てはめるのに適しています。
全体として、この章は、局所的なニューロン回路から強化学習(RL)のような複雑な行動に至るまで、計算論的精神医学の現在の最先端技術の概念的概要を提供します。最後に、計算論的精神医学における進行中の課題と将来の方向性について議論します。
生物物理学的回路モデル
生物物理学的回路モデリングとは、神経生物学的メカニズムに基づいた神経システムをモデリングするための計算論的枠組みを指します。これらのモデルは、ニューロンおよびシナプスの詳細な生理学的特性によって制約され、ニューロンとシナプスのレベルで神経回路活動と計算をシミュレートすることができます。これらのモデルは、さらに、回路アーキテクチャ、神経活動、およびタスクにおける行動のシステムレベルの実験的測定によって制約されることも可能です。これらのモデルでは、動的な活動は通常、ニューロン、シナプス、およびイオンチャネルの生物物理学的特性を司る微分方程式系を通じてシミュレートされます。ニューロン間の活動パターンは、回路内の結合と、基本的な解剖学的原理に基づいた外部入力によって形成されます。これにより、そのようなモデルは、神経活動の経験的測定値を用いて検証することができます。特定のモデルでは、活動パターンから行動反応を読み出すことができ、様々なタスクパラダイムからの行動データとの比較が可能になります。
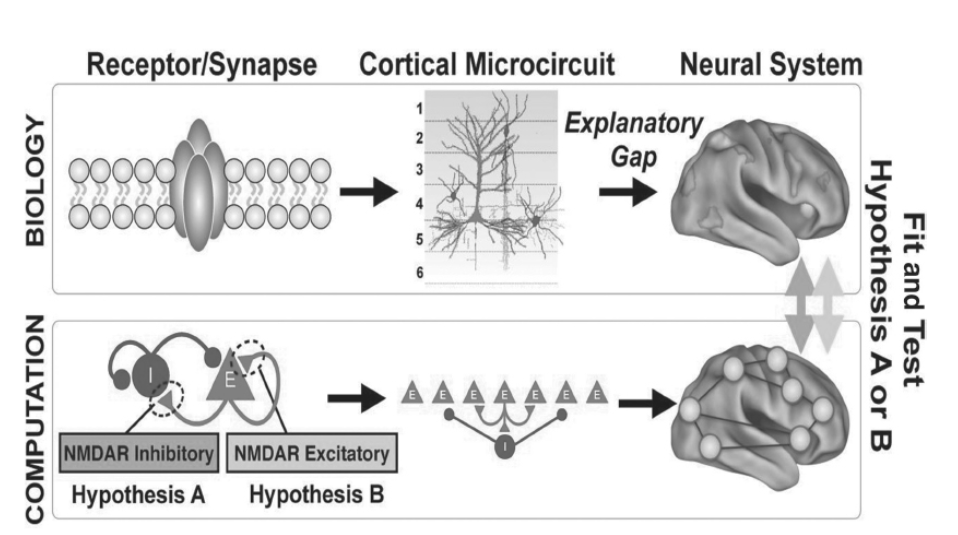
図1.24-2. 計算論的精神医学によって示唆される仮説的機能不全の多レベル分析
現在の非侵襲的神経画像法は、神経精神疾患における神経系の機能不全に関して重要な洞察を提供しますが、シナプスレベルやニューロンレベルのメカニズムを明らかにすることはできません。これにより、神経画像によるシステムレベルの観察と、特定の受容体サブタイプにおける細胞変化を提案するような細胞レベルの仮説との間に重要な説明ギャップが生じます。計算論的精神医学は、異なる探求レベルにわたって検証可能で翻訳可能な仮説を生成することによって、これらのギャップを埋めることを目指します。
計算論的精神医学において、回路モデルの生物物理学的基盤は、シナプスレベルの障害が異常な神経活動と認知・行動の欠陥をどのように生み出すかを探る機会を提供します。例えば、生理学的に解釈可能で仮説的な疾患メカニズムに関与するとされる、モデル内の特定のシナプスパラメータを摂動させることができます。これにより、疾患メカニズムおよび薬理学的操作に関連する仮説的な摂動を直接的に実装することが可能になります。そして、これらの摂動が創発的な神経活動と行動に与える影響を特徴づけることができます。したがって、モデルの結果は、健康な集団および臨床集団、ならびに疾患状態の動物モデルにおけるヒトの神経画像および精神物理学に関連付けることができます。生物物理学的回路モデルは、精神医学的薬剤によって変化するシナプスおよびニューロンの特性の詳細を組み込んでいるため、薬理学的治療の理解と設計に情報を提供する特定の可能性を秘めています。
これらの固有の利点にもかかわらず、生物物理学的モデルの詳細なレベルのため、回路モデルを特定の複雑な認知機能に関連付けることは依然として課題です。いくつかの主要な認知計算については、これらのプロセスの根底にある神経回路基盤の知識がありますが、これは通常、前臨床動物研究からの貢献を含みます。これらの場合、詳細な回路モデルは、シナプス障害から行動(例えば、以下で議論される認知欠損)へのリンクを提供するために厳密に開発することができます。しかし、生理学的パラメータの数が多いため、これらのモデルを行動パフォーマンスに定量的に当てはめることはより困難です。他のケースでは、精神症状は、根底にある神経回路プロセスの理解を欠く複雑な機能に関連しています。現在、これらの回路モデルは限定的であり、神経回路相関の理解を欠く複雑な行動課題には適用できません。
生物物理学的回路モデルはまた、疾患状態の神経生理学的バイオマーカーの根底にあるメカニズムに関する洞察を提供することもできます(以下のセクションを参照)。これらのバイオマーカーには、異常な神経振動ダイナミクスの電気生理学的測定、および安静時活動における大規模な接続不全の神経画像特徴づけが含まれます。別の言い方をすれば、一部の神経測定は、細胞から神経系へ、そして動物からヒトへ直接的に翻訳可能です(例えば、単一電極、電極アレイ、またはヒトにおける脳波検査を介して測定される電気生理学的シグネチャ)。このような場合、生物物理学的モデルは、動物からヒトの実験へ容易に翻訳できる検証可能な予測を提供することができます。
シナプスから認知へ:ワーキングメモリ
生物物理学に基づく神経回路モデルの認知処理への重要な応用は、ワーキングメモリというテーマで行われています。ワーキングメモリとは、感覚刺激がない状態で、情報を符号化し、一時的に保持または操作する能力を指します(例えば、数秒間電話番号を覚えていること)。この神経計算は、行動の正常な発現にとって不可欠であり、局所マイクロ回路ニューロンの微妙なバランスに依存しています。ワーキングメモリの障害は、統合失調症や注意欠陥多動性障害を含む多くの精神疾患および神経疾患における顕著な認知欠損です。ワーキングメモリ機能はまた、臨床神経科学において、遺伝的リスク要因と精神疾患の中間にある定量的に測定可能な中心的特性であるエンドフェノタイプとしても有望な候補です。このようなトランス診断的エンドフェノタイプは、症状次元のメカニズム的根底にある研究にとって、より扱いやすいかもしれません。その意味で、ワーキングメモリは、生物物理学に基づくモデリングを認知機能に応用するための有用なテストベッドとなります。なぜなら、モデルを制約し、テストできる多レベルのデータを提供する実験パラダイムが存在するからです。
ワーキングメモリの神経回路基盤
動物とヒトにおける神経科学的研究は、ワーキングメモリに関与する重要な神経回路とシステムを明らかにしています。ワーキングメモリは、皮質と皮質下領域の分散ネットワークを活動させ、前頭前野がこのネットワークの主要な結節点となります。サルにおける単一ニューロン記録実験では、前頭前野におけるワーキングメモリの神経相関は刺激選択的な持続性活動であることが発見されており、そこではニューロンが記憶遅延中に発火率の上昇を示します。例えば、あるよく研究された実験パラダイムである眼球運動遅延反応課題では、被験者は、眼球のサッカード運動をその位置に導くために、遅延期間を通じて視覚的キューの空間的位置をワーキングメモリに保持しなければなりません。記憶遅延中、前頭前野ニューロンのサブセットは、チューニングされた持続性活動パターンを示し、単一ニューロンは好ましい空間位置に対して高い発火率で発火します。このパラダイムはヒトの研究に成功裏に拡張され、機能的神経画像法によって広範にテストされ、ヒトにおけるワーキングメモリの神経相関を確認しています。その意味で、この複雑な認知行動は、シナプス、ニューロン、システムレベル、および行動のメカニズムが動物とヒトの両方の研究でよくリンクされている理想的な例です。ここでは、この複雑な行動における障害を引き起こす回路メカニズムに特定の洞察を提供できる、ワーキングメモリの生物物理学的モデルに焦点を当てます。
アトラクターネットワークモデル
アトラクターネットワークと呼ばれる回路モデルのクラスは、ワーキングメモリをサポートする持続性活動の神経回路基盤を理解するための主要な枠組みを提供します。「アトラクター」という用語は、動的システムの数学的形式主義に由来します。アトラクター状態とは、時間的に安定した活動パターンであり、システムのわずかな摂動の後、システムがアトラクター状態に収束し直すものです。アトラクターネットワークモデルでは、これらのダイナミクスは通常、時間の経過に伴うニューロンのダイナミクスを捉える一連の微分方程式によって形式化されます。ワーキングメモリのアトラクターネットワークモデルは、通常、複数のアトラクター状態を持ちます。低活動ベースライン状態と、ニューロンのサブセットが持続的に活動している複数の刺激選択的記憶状態です。記憶状態は安定したアトラクター状態であるため、自己強化的でノイズや摂動に強く、記憶が時間を通じて維持されることを可能にします。このようなモデルのこの重要な特性は、興奮性錐体細胞上のN-メチル-D-アスパラギン酸受容体(NMDAR)によって媒介される遅い電流に依存することが示されています。ここで強調すべき重要な点は、生物物理学的モデルにおけるまさにこの詳細なレベル(すなわち、NMDARコンダクタンス)が、神経回路、あるいは最終的には行動(すなわち、ワーキングメモリパフォーマンス)への特定のシナプス寄与の摂動とテストを可能にするということです。
典型的なアトラクターネットワークでは、ニューロンのサブポピュレーションが異なる刺激に選択的です。類似の選択性を持つニューロンは、それらの間に強い再帰性興奮性結合のヘブ型パターンを示します。再帰性興奮性結合の強度が十分に強い場合、それらは持続性活動記憶状態をサポートできます。強力で構造化された再帰性興奮が持続性活動を維持します。抑制性GABA作動性介在ニューロンは、2つの役割を果たす強いフィードバック抑制を媒介します。第一に、それは低活動ベースライン状態を安定させます。第二に、持続性活動中、それはワーキングメモリ表現の選択性を強制する側方抑制を提供し、ネットワーク内のニューロン全体の集団への興奮の広がりを防ぎます。興奮と抑制に依存するアトラクターダイナミクスの安定性は、ネットワークにノイズや遅延中に介入する妨害因子に対する自然な抵抗性(すなわち、安定したアトラクター状態)を与えます。ワーキングメモリのこの妨害に対する堅牢性は、認知処理をサポートする重要な認知特性です。
詳細な生物物理学に基づいたモデルは、回路機能における重要な制約を明らかにし、実験的に検証可能な具体的な予測を行ってきました。強く再帰的なネットワークは振動に傾きやすく、これが持続性活動パターンを不安定化し、ワーキングメモリ機能を破壊する可能性があります。前述の通り、10年間の計算モデリング研究は、再帰的興奮が速いα-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸(AMPA)受容体ではなく、主に遅いN-メチル-D-アスパラギン酸受容体(NMDAR)によって媒介されることで、遅延活動の時間的安定性を提供し、持続性活動が安定化されると予測してきました。
多くのモデル予測は、単一ニューロンの活動を記録し、そのニューロンを取り囲む皮質組織に局所的に薬理学的薬剤を適用する研究によって検証されてきました。モデル予測と一致して、NMDARを局所的に遮断すると遅延期間の持続性活動が消失すること、そしてガンマアミノ酪酸受容体(GABAR)を局所的に遮断すると、発火の上昇を通じて遅延中の刺激選択性が低下することが実験的に確立されました。これらの実験的検証は、ワーキングメモリ機能を支持する前頭前野における均衡の取れた興奮と抑制の重要な役割を支持しており、これは重度の精神疾患(例:統合失調症)によって影響を受けると仮説化されている神経特性です。
アトラクターモデルにおける機能不全
多くの計算モデリング研究が、シナプスおよびニューロンの特性の変化によってアトラクターネットワーク機能がどのように影響されるかを分析してきました。最適な皮質機能は、興奮と抑制の適切なバランス(E/Iバランス) に依存しています。皮質におけるE/Iバランスの障害は、統合失調症、自閉症、注意欠陥多動性障害を含む多くの精神疾患の神経病理学に関与しているとされています。
前述の通り、アトラクターモデルは、錐体ニューロンと介在ニューロン間の強い再帰的相互作用を必要とし、したがって、E/Iバランスの摂動に敏感です。これらのモデルはまた、精神疾患で障害されることが知られているワーキングメモリという中心的認知プロセスを実装しているため、アトラクターモデルは、障害されたE/Iバランスを認知欠損と関連付け、分析レベルを超えた重要な実験予測を生成するための有用なテストベッドとなります(図1.24-2を参照)。
これらのモデルは、統合失調症に関連する皮質変化に最も頻繁に適用されてきました。統合失調症におけるニューロン微小回路の変化は複雑ですが、多くの研究が、その病態生理学の主要な要素として介在ニューロンの機能不全に収束しています。介在ニューロン機能の障害は、フィードバック抑制の動員を弱め、錐体ニューロンの脱抑制と回路内のE/Iバランスの上昇を引き起こす可能性があります。計算モデルは、ワーキングメモリ回路における脱抑制の神経学的および認知的影響を探索してきました。軽度の脱抑制は、ワーキングメモリ表現の広がりを引き起こす可能性があり、これは持続性活動パターンの選択性を維持する上での抑制の役割から理解できます。強い脱抑制は、ベースライン状態を不安定化させ、ワーキングメモリパターンが自発的に現れる(例:偽記憶表現)原因となる可能性があります。重要なことに、これらの異なるレジームは、ワーキングメモリ課題におけるパフォーマンスについて区別可能な予測を行い、これにより行動によってこれらの仮説を検証することが可能になります。抑制性欠損に加えて、統合失調症の前頭前野では再帰的興奮が損なわれているという強力な証拠もあります。アトラクターモデルでは、再帰的興奮の減少は持続性活動を消失させ、回路がワーキングメモリを実装するのを妨げます。このレジームもまた、ワーキングメモリ課題の文脈における行動と神経活動のパターンについて具体的な検証可能な予測を行います。
アトラクターモデルは、ニューロモデュレーションがワーキングメモリに与える影響を研究するためにも応用されてきました。ニューロモデュレーターは、多くのシナプス受容体およびニューロンチャネルの有効コンダクタンスを変化させることが知られています。ドーパミン(DA) は、前頭前野回路に多様な影響を与え、錐体細胞と介在ニューロンの両方で複数の細胞およびシナプス部位を変調します。DAはワーキングメモリ機能も変調し、DAシグナル伝達は多くの精神疾患で調節不全であることが判明しています。多くの証拠が、統合失調症では、前頭前野におけるD1受容体を介したDAシグナル伝達の障害があるという仮説を支持しています。ある回路モデリング研究では、D1刺激がネットワークにおけるベースライン状態と記憶状態の両方の安定性を高めることを発見しました。これは、ワーキングメモリ維持中に機能的に有益であると考えられます。これは、前頭前野における低ドーパミン作動性状態が、持続性活動を弱めることによってワーキングメモリを障害し、それによってノイズや妨害による破壊に対して脆弱にするという予測につながります。対照的に、異常な高ドーパミン作動性状態は、アトラクター状態を強固にしすぎ、ネットワークが通常内部状態間の遷移を誘発するはずの信号に対して柔軟性を失う原因となる可能性があります。
次に、生物物理学に基づいたモデルは、神経システムレベルにスケールアップすることも可能です。このように生物物理学に基づいたモデルを拡張することで、ヒトにおける因果的な薬理学的操作や精神科集団における認知課題中に検証できる神経画像実験の実験予測を生成できます。より具体的には、ヒトの神経画像実験から得られた最も確立された知見の1つは、「反相関」する神経アーキテクチャを示唆しています。これには、外部からの要求の厳しい認知課題への方向付けに特異的に関与する脳領域(すなわち、タスク陽性領域)と、内部精神状態に関与しているときに活動的であるが、認知要求中に抑制される領域(すなわち、タスク陰性領域またはデフォルトモードネットワーク、DMNと呼ばれることもある)があります。研究では、要求の厳しい認知課題中、統合失調症患者は通常、タスク陰性領域を抑制できず、同時にタスク陽性領域を活性化できないことが判明しています。このプロセスは、健康な被験者がワーキングメモリ中にNMDAR拮抗薬を投与された後にも発生することが示されています。
生物物理学に基づいたマイクロ回路計算モデルは、相互シナプス抑制を組み込むことにより、タスク陽性およびタスク陰性神経システム間の推定される相互拮抗作用を生物学的に妥当な方法で捉えるように拡張されてきました。このようにして、そのようなモデルは、関連するシナプスの詳細を捉えながら、ヒトの課題ベースの神経画像実験に対するシステムレベルの予測を生成できます。それにもかかわらず、前述の通り、これらのモデルは、その生物学的リアリズムに内在する制約のために、捕捉できる複雑な行動のレパートリーにおいて依然として限定的です。したがって、この計算論的精神医学の分野は、現在、ヒトで表現できる複雑な認知および情動の計算の範囲に対処する位置にはまだありません。これは、現時点では、コネクショニストモデルという別の種類のモデリングによって、はるかにうまく達成されています。次にこれに焦点を当てます。
認知精神神経科学とコネクショニストモデル
上記のセクションでは、生物物理学に基づく計算モデリングと臨床神経科学のインターフェースについて紹介しました。前述の通り、このモデリング分野は、実際のニューロンとシナプスの物理的特性に基づいて構築され、現実的な細胞レベルのダイナミクスを生成することで区別されます。この詳細なレベルは、最終的に治療レベルでメカニズム的予測を生成したり、精神疾患患者における複雑な行動を司るシナプスメカニズムを解明したりするために不可欠です。それにもかかわらず、非侵襲的神経画像技術の急速で生産的な進歩に基づいて、認知神経科学革命と同時に進行する並行した計算精神医学研究の潮流が出現しました。具体的には、このモデリング分野は、大規模な神経ネットワークの機能を捉え、人間の認知神経科学実験と連携して行動予測を生成するように設計されたコネクショニストモデルとして広く言及できます。
精神医学における認知神経科学の出現
コネクショニストモデリングが精神医学にもたらした貢献を詳しく説明する前に、これらのモデルが最も適している研究課題の種類、すなわち認知神経精神医学のために舞台を設定することが重要です。過去20年間は、健常者の様々な認知および情動プロセスの神経相関に関する知識が爆発的に増加しました。この急成長している認知神経科学の分野は、臨床神経精神医学現象を解釈するためのますます堅固なプラットフォームを生成してきました。これは主に、健常者における様々な認知操作に関与することが知られている神経システムの理解を深めることによって達成されます。この理解は、次に、これらの同じ認知操作に欠損を示す臨床集団において、脳回路のどの側面が異常であるかの我々の探索空間を制約します。したがって、計算メカニズムを理解することに特化した認知神経科学の枠組みを使用することは、健常集団における機能がますます理解されている神経回路の異常を明確にすることで、精神症状を解明し、最終的に治療するための有望なツールを提供します。
この認知神経科学の枠組みは、精神医学における計算モデリングの発展と並行して出現しました。歴史的に、最初に現れた計算精神医学モデルの種類は、神経システムおよび行動分析のレベルと最も直接的に一致していました。したがって、精神医学における認知神経科学とコネクショニストモデリングアプローチの間には、生産的で継続的な相互作用が存在します。
コネクショニストモデルと並列分散処理モデル
中枢神経系機能を理解するためにモデルを使用する長い歴史があります。そのようなレビューはこの章の範囲外であるため、読者には章末の参考文献の1つを参照することを勧めます。しかし、簡単に言えば、脳を「コンピューター」とする長年の類推を検討する価値があります。基礎計算科学におけるアルゴリズムと原理の洗練が進むにつれて、神経科学におけるそのようなアプローチの新たな応用が相互に受粉し合っています。この努力から生まれた特定の枠組みの1つが、ニューラルネットワークのモデリングです。より正式には、このクラスのモデルは並列分散処理(PDP) またはコネクショニストモデルと呼ばれます。この広範なモデルのクラスは、認知制御、言語、恐怖処理などの複雑な心理機能の神経相関を解明する努力の中で出現しました。
重要なことに、これらのモデルは、この章でレビューされた生物物理学に基づく(または行動)モデルとは、その風味、アーキテクチャ、およびアルゴリズムの実装において異なります。主要な区別は、厳密な生物学的リアリズムを超えた抽象化のレベルを組み込む能力に表れています。PDPモデルの主要な目的は、心理学的観点から認知を駆動するメカニズムのより深い理解を発展させることですが、脳内でどのように実行されるかという計算の側面を捉えると考えられている原理を使用します。別の言い方をすれば、そのようなモデルは、必ずしも明示的な神経生物学的制約や仮定を組み込んでいるわけではありません。
典型的なPDPモデルのアーキテクチャは、ある方法で相互接続され、何らかの計算プロセスを表す一連の「ユニット」として概念化されます。各ユニットは、他のモデルユニットからの入力を合計し、それを出力活動レベルに変換する単純な伝達関数を実装します。ネットワークの状態は、これらの単純なユニットの集団にわたる段階的な活動パターンによって記述され、情報処理は、あるユニットのセットまたは層から別の層への活動パターンの変換を通じて行われます。望ましい情報処理を達成するために、ユニット間の結合強度は、バックプロパゲーションなどの学習アルゴリズムを通じて変更されます。この結合重みの訓練は、ニューロン間の結合強度の変化を司ることが知られているヘブ型学習の種類のいくつかの要素を捉えることを意図しています。
バックプロパゲーション学習アルゴリズムでは、ネットワークに入力パターンが提示され、出力層がその応答を生成することを許可されます。ネットワークの各層で、生成されたネットワークの応答と望ましい目標応答との差として誤差信号が計算されます。これらの誤差信号は、ネットワークを通じて入力層に向かって逆伝播され、ユニット間の結合重みを変更するために使用されます。バックプロパゲーション学習の実装は、複雑な神経現象を捉えながらも、コネクショニストモデルが特定の神経生物学的メカニズムにマッピングされない可能性がある方法の例を提供します(上記の生物物理学に基づくモデルとは対照的に)。それにもかかわらず、このアプローチは、学習がユニット間の結合の小さな変化による誤差の漸進的な最小化を通じて起こるという考えを捉えています(勾配降下法と呼ばれる現象)。
典型的なPDPモデルでは、ユニットは抽象化されており、個々のニューロンとの直接的な対応や明示的な神経生物学的仮定はありません。ユニットは代わりに、ニューロン集合体によって達成される処理を表し、神経情報処理の一般原則を捉えます。しかし、一部のモデリング研究では、様々な解像度レベルで神経解剖学的制約と特定の神経伝達物質の変更が組み込まれています。
コネクショニストモデルは、神経システムの低レベルの特性の理解と、高レベル(システム)行動へのそれらの参加との間の橋渡しを構築するのに役立ちます。これらは、現在、生物物理学に基づくモデルによって効果的にモデル化できない幅広い複雑な行動と神経システム相互作用を捉えることができます。したがって、PDPモデルは、強固な生物学的仮定を裏付ける確固たる経験的証拠が不足している分野の質問やシナリオに対処するために、計算論的精神医学において引き続き成功裏に適用されています。
精神医学におけるコネクショニストモデルの応用
このセクションでは、PDPモデルが新規の洞察を提供し、基礎神経科学と精神医学的疑問の間の重要な相互作用を確立した3つの研究領域の例を提示します。第一に、PDPモデルが統合失調症における幻覚と妄想の形成を理解するためにどのように使用されてきたかに焦点を当てます。次に、多くの精神疾患に共通する認知制御欠損を理解する上でのPDPモデルの役割をレビューします。第三に、恐怖条件付けの文脈におけるコネクショニストモデルの使用、特にシステム神経科学の観点から、心的外傷後ストレス障害(PTSD) を理解するための可能な含意について議論します。
統合失調症における幻覚のコネクショニストモデリング
PDPフレームワークを用いた初期の主要なモデルのいくつかは、皮質における異常なシナプスプルーニングの影響と、それが統合失調症で観察される症状、特に外部からの感覚入力がないにもかかわらず異常な内部感覚経験である幻覚の形成に与える可能性のある結果を検証するために開発されました。このメカニズムは、統合失調症を、発達過程におけるシナプスプルーニングの異常に関連し、それが大規模な神経システムの機能に影響を与える神経発達性疾患とする神経生物学的概念化に基づいています。
PDPモデルは、シナプス結合を表すと考えられるユニット間の接続を排除することによってこのメカニズムを実装しました。この研究分野は、十分な数の接続が除去された場合、モデルが**「寄生焦点」** と呼ばれる異常な状態に繰り返し戻ることを示しました。つまり、研究者たちは、モデル内のユニット全体の活動パターンが、学習された記憶のいずれにも対応せず、むしろモデルが戻り続ける「状態」に対応していることを観察しました。これは、おそらく幻覚中に起こりうる異常な内部で生成された状態を捉えているのかもしれません。この分野の研究者は、これらの寄生焦点が行動的に妄想と幻覚に対応する可能性があると仮説化しました。
PDPモデルが幻覚を説明するのに役立つ具体的な例は、言語処理の理解への応用から生まれました。PDPスタイルのアーキテクチャを使用して、研究は言語が「エルマンネットワーク」内で表現できることを発見しました。これは、内部処理を計算する「隠れ層」によって接続された入力層と出力層からなる逐次的再帰ネットワークです。このアーキテクチャには、隠れ層に接続された追加の層が含まれており、発話知覚中にワーキングメモリ機能(情報の一時的な保存)をサポートすると考えられている情報を一時的に保存できました。このアーキテクチャでは、モデルのワーキングメモリサブネットワーク内のユニット(すなわち「シナプス」)間の接続の排除が、当初は発話知覚を改善することが示されました。しかし、排除の程度が増すにつれて、モデルは単語を正確に検出できなくなり、「幻覚」を生成し始めました。このPDPモデルでは、これは、モデルに構造化された入力がない場合でも、単語に対応する出力層全体の活動パターンとして計算論的に捉えられました。シナプス排除とは対照的に、少量の「細胞」除去(例:ユニットの排除)も当初は発話知覚を改善しましたが、より大きな細胞損失は幻覚を生成しませんでした。決定的に重要なのは、これらの初期のPDPモデルが、様々な神経生物学的変化がコネクショニストネットワークにどのように影響するかについての重要な**「概念実証」** を提供したことです。
次に、そのようなPDPモデルは、広範な神経調節のいくつかの側面も組み込むことができます。例えば、統合失調症における幻覚のPDPモデルを拡張した研究者は、モデルにおけるDA(ドーパミン)増加の潜在的影響も捉えました。これは、神経生物学的に妥当な広範な「神経調節的」影響をPDPネットワーク全体に抽象化することによって、モデル内のゲイン関数として具体的に達成されます。統合失調症では、DAの役割が皮質の「チューニング」において重要な役割を果たすと仮説化されています。この仮説に基づいて、PDPモデルは、ワーキングメモリモジュールのユニットへのバイアスを変更することによってDAの増加を組み込みました。これにより、ユニットは情報を維持するためにより多くの情報を蓄積する必要があるように効果的に設定されました。この操作は、DAがニューロンの情報処理に与える影響の一側面にのみ関連しており、それ自体では臨床観察を完全に捉えることはできませんでした。しかし、DAの増加とシナプスプルーニングの組み合わせは、幻覚を経験した患者のパフォーマンスをより成功裏に捉えました。
これらのタイプのモデルは、脳スタイルの計算原理の側面を組み込んでいますが、モデル開発中に神経生物学の主要な側面に対して強いコミットメントをしていません。それにもかかわらず、これらは、神経生物学的またはニューラルネットワークの欠損が、幻覚などの精神病の核心症状の形成にどのように寄与しうるかを理解するための重要なステップと数学的形式主義を提供しました。モデル自体は、人間の患者が示すような同じ形式と内容の行動を生成しませんでしたが、「原則として」の例は、生物学と行動の間のギャップを埋め、さらには治療推奨(例:これらのモデルからの洞察を明示的に活用した経頭蓋磁気刺激の分野の研究)にまで拡大する概念的なてこ入れを提供しました。したがって、生物学的リアリズムに明示的にコミットしていないにもかかわらず、PDPモデルは治療開発に有用な予測を提供することができます。
認知制御欠損のコネクショニストモデリング
並行する研究分野は、精神疾患全体で現れるが、特に統合失調症で顕著な認知制御欠損を理解するためにPDPモデルを活用しました。これらのモデルは、中枢神経系における「認知制御」がDA神経伝達物質システムとPFC(前頭前野)間の相互作用から生じると仮定することにより、より神経生物学的に妥当なアーキテクチャを開発しました。これらのモデルは、目標関連情報、またはコンテキスト情報がPFCで維持され、後部皮質で表現される刺激-反応マッピングをバイアスするために使用され、行動を制御するためのトップダウンサポートの源として機能することを示唆しました。これらのモデルでは、「コンテキスト」モジュールは背外側前頭前野(DLPFC) の機能に関連付けられました。外部入力がない場合の活動的維持は、上記のセクションでレビューされた神経生物学的データによって示唆されるように、再帰的興奮を介して発生すると仮定されました。このモデルの分野は、コンテキスト/DLPFCモジュールからのフィードバック投射が直接的な興奮を介して後部システムにおける処理をバイアスするが、処理ストリーム内の表象間の競合は側方抑制を介して発生すると仮定しました。さらに、DAの効果は純粋に抑制的であるというよりも調節的であると仮定され、DA活動の変化は、DAが調節している入力の性質に応じて活動を増加または減少させることができるとされました。別の言い方をすれば、DAの増加は、ユニットの活性化値とその入力との関係における信号対雑音比を増加させると仮定されました。
具体的には、これらのモデルは、統合失調症におけるコンテキスト処理欠損を評価する認知パラダイム中に観察される、複雑な行動エラーの特定のパターンに関する予測を生成するために成功裏に利用されてきました。具体的には、このモデルは、外側PFCへのDA入力の減少が、外側PFCにおけるコンテキスト情報を表現し維持する能力の障害につながり、このコンテキスト表現の障害が統合失調症患者の幅広い認知課題における欠損につながるという仮説を検証するために使用されました。行動的に、このモデルは、コンテキスト情報を維持する必要がある場合に、認知欠損のある個人が特定の行動エラーパターンを示すと予測しました。このエラーパターンは、統合失調症患者における一連の研究で大いに確認されました。次に、このタイプのPDPモデルは、課題ベースの認知活性化神経画像パラダイム中に見られる外側PFC信号のパターンに関する予測を生成するためにも成功裏に活用されました。これらのモデルからの具体的な予測は、統合失調症患者が、コンテキスト維持に対する強い要求がある条件下で、外側PFC活動の減少を示すべきであると示唆しました。繰り返しになりますが、多くの経験的報告がこの予測を裏付け、統合失調症患者が、モデル予測と特に一致して、外側PFCの動員に欠損を示したことを示しました。この分野でのその後の研究は、DAシグナル伝達の欠損が、外側PFCにおける異常なコンテキスト維持と情報ゲーティングに寄与し、それがこの患者集団に見られる認知処理欠損の一部に寄与する可能性があることを示唆しました。
総じて、この研究分野は、PDPモデルが与えられた行動症状(すなわち、認知欠損)の行動的および神経的予測をどのように行うことができ、それが患者における認知神経科学パラダイムを通じて明示的に検証できるかを例示しています。この研究分野はまた、精神科集団における特定の情動欠損、すなわち恐怖条件付けの神経学的根底を理解するためにも成功裏に活用されてきました。
恐怖条件付けのコネクショニストモデリング
感情処理における重度の欠陥が、統合失調症、双極性障害、不安障害など、様々な診断カテゴリを横断して存在することはよく確立されています。ここでは、感情処理の特定の分野、すなわち恐怖表現における計算モデリング研究に焦点を当てます。異常な恐怖表現は、基本的な恐怖表現の根底にある神経生物学的メカニズムが哺乳類種間でよく保存されていることを考慮すると、計算論的に理解できる強力な翻訳的標的となります。基本的な前臨床レベルでは、恐怖生成における扁桃体の役割は、おそらく最もよく研究された神経計算メカニズムの1つであり、ヒトの研究を含む様々な分析レベルで翻訳されてきました。臨床的には、異常な恐怖表現は、全般性不安障害、社交不安障害、特定の恐怖症、心的外傷後ストレス障害(PTSD)など、多くの不安障害で見られます。したがって、異常な恐怖回路を計算論的に形式化することは、計算論的精神医学にとって特に広範で重要な課題を表します。
この分野の計算研究は、扁桃体を中心的な出発点として使用してきました。扁桃体は、海馬構造の前方に位置するいくつかの核からなる小さな構造であり、恐怖の正常な表現と恐怖関連連合の学習(すなわち、古典的恐怖条件付け)にとって重要です。その意味で、この分野のPDPモデルは、この神経構造のよく理解された生物物理学的原理と、そのよく確立された大規模な解剖学的結合性の両方に基づいています。これは、PDPスタイルのモデルが、有用な行動予測(例:恐怖学習)を伴うシステムレベルのアーキテクチャを維持しながら、生物学的に妥当な回路へのより明示的なコミットメントを組み込み、生物物理学的リアリズムを具現化できる方法の良い例です。具体的には、このような解剖学的に制約された恐怖回路のPDPモデルは、複数の相互作用する神経構造がどのように共同して無条件刺激(US、侵害受容刺激)と条件刺激(CS、聴覚入力)の間の対を形成するかを予測するために使用されてきました(図1.24-3を参照)。このモデルアーキテクチャを使用することで、恐怖学習がCSとUSをマッピングする特定のユニットペアにわたる結合パターンを介して確立できることがわかりました。さらに、このモデルは、局所的な病変が恐怖学習にどのように影響するかを予測する強力な方法を提供しました。これは、神経解剖学的に妥当な原理に基づいて開発され、制約されたPDPモデルの特定の利点です。この研究分野は特に、恐怖回路の1つまたは複数の主要な構成要素への神経病理学から生じる可能性のある恐怖表現の異常に関する有用な予測を生成するのに役立ちます。
総じて、この研究は、コネクショニストモデルが、幅広い神経システムと行動にわたる行動的および神経画像的予測を創造的かつ柔軟に生成するためにどのように使用できるかを示しています。前述の通り、PDPスタイルのモデルのこの柔軟なレパートリーは、そのアーキテクチャが常に神経生理学または神経解剖学に基づいて明示的に開発または制約されているわけではないために可能です。そうは言っても、これらのモデルは、神経計算を表現するために多くの強いコミットメントをしています。このため、PDPモデルは、精神疾患患者に現れる可能性のあるさらに複雑な行動(例:妄想のような複雑で異常な信念パターンの形成、または動機付けや報酬学習の欠損)を常に形式化できるわけではありません。PDPモデルも生物物理学に基づいたモデルも行動への最終的なリンクを提供できないような場合、我々は、複雑な精神症状のパターンを形式化するために明示的に開発された行動の数学モデルに目を向けます。
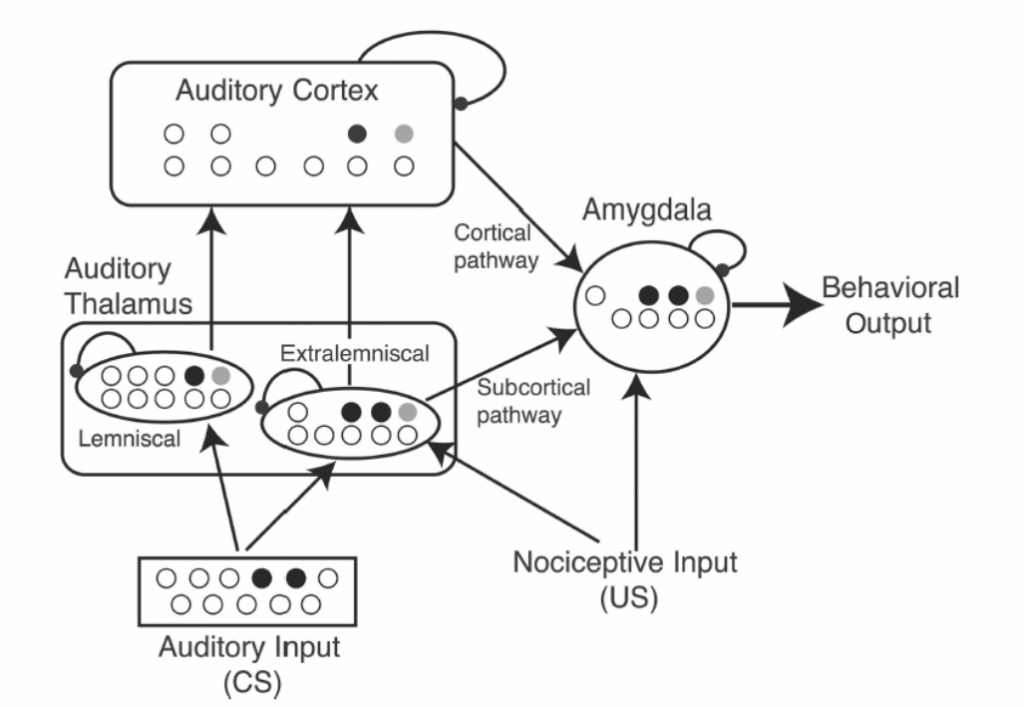
図1.24-3. 恐怖条件付けの文脈におけるコネクショニストPDP型モデルの例示
恐怖学習の場合、PDPモデルは、特定の神経解剖学的構造を表す異なる「モジュール」にわたるコネクショニストレベルのアーキテクチャと、一定レベルの生物物理学的リアリズム(すなわち、動物の生理学的実験に基づいて扁桃体をモデリングすることによって)の両方を成功裏に融合させてきました。ここに、Xからの改変図を示します。この例では、各大きなモジュールは、PDPモデルで典型的になされるように、個々の非線形ユニット(黒いユニット:最大活性化;白いユニット:ゼロ活性化;灰色のユニット:中間レベルの活性化)で構成されています。大きな矢印はモジュール間の接続を示しており、これはフィードフォワードかつ興奮性としてモデル化されており、実際のラットの脳内の経路に対応しています(ただし、ここでは簡略化されています)。モジュール間の接続強度は、拡張ヘブ型規則を組み込むことによって、学習の関数として変調されます。(Armony JL, Servan-Schreiber D, Romanski LM, Cohen JD, LeDoux JE. Stimulus generalization of fear responses: effects of auditory cortex lesions in a computational model and in rats. Cereb Cortex. 1997;7(2):157-165. doi:10.1093/cercor/7.2.157 より転載)
行動の数学モデル
上記で議論された計算論的精神医学のアプローチ、すなわち生物物理学に基づく回路モデリングとコネクショニストモデリングは、神経システムがその入力を出力に変換する方法を具現化する要素コンポーネントを持つモデルを開発することを目指しています。これらのアプローチは、関連する神経生理学的メカニズムに関する我々の限られた知識のために、適用できる認知行動の範囲がしばしば制限されます。認知をモデリングするもう一つのアプローチは、与えられた認知機能の根底にある心理学的計算を説明する数学モデルを開発することです。これらのモデルはしばしば、タスクにおけるパフォーマンスを最適化するアルゴリズムを定義し、そのようなタスクパフォーマンスを制限する制約を特徴づけることを目的とする、いわゆる規範的説明に基づいています。
行動を説明するために開発されましたが、これらのモデルは神経回路に重要なリンクを作る可能性があります。例えば、実験は、特定の脳領域における活動がモデルの内部変数を表すことを明らかにし、この計算論的説明を支持し、脳システム間の分業に関する洞察を提供します。次に、そのような神経科学的知見は、モデルの計算アーキテクチャを構成するアルゴリズムとモジュールに情報を提供することができます。
意思決定における障害は、精神疾患および神経疾患に共通する認知症状です。行動の数学モデルは、これらの症状を厳密かつ定量的な用語で形式化し、与えられた精神状態において変化している意思決定計算の特定のコンポーネントを潜在的に分離することができます。これらのモデルは、上記の神経システムモデルよりもパラメータが少ないため、行動データに適合させたり、与えられたパラメータの全範囲を探求したりするのがより容易です。その意味で、行動モデルは、可能な行動レパートリーの全範囲についてより深い直感を提供し、異常または不適応である可能性のある行動状態を厳密に定義するのに役立ちます。
強化学習
意思決定における機能不全の1つの形態は、利用可能な行動の価値を学習するプロセスにおける障害です。数学的モデリングと実験は、強化学習(RL) の文脈でこのプロセスを研究する上で大きな進歩を遂げました。RLでは、エージェントはフィードバック(報酬と罰)の連続した試行を通じて刺激と行動の価値を学習し、これらの価値に基づいて行動を選択し、全体の成果を最大化します。
時間差分RL(TDRL)モデルのクラスは、刺激と状態から行動へのマッピングを学習するプロセスを説明するために広く適用されてきました。これらのモデルでは、行動はその行動の合計期待値に基づいて選択されます。各行動の価値は、報酬予測誤差(RPE) に基づく逐次更新を通じて学習されます。最も単純な形式では、RPEはその行動の後に受け取った報酬と行動の期待値との差です。したがって、報酬が期待よりも大きい場合、正のRPEは価値を増やすべきであることを示します。報酬が期待と同じ場合、RPEはゼロであるべきです。RPEの定式化は、将来の成果の時間割引など、追加の要因を組み込むように拡張できます。TDRLモデルは、行動研究だけでなく、行動価値とRPEを示す脳領域を発見した神経科学研究によっても十分に支持されています。特に、皮質下腹側被蓋野(VTA)のDAニューロンは、活動電位のバーストを通じて内部で計算されたRPEを定量的に反映します。
依存症の多くの重要な側面は、TDRLモデルの機能不全としてモデル化できます。乱用薬物は脳の自然なRLシステムにアクセスし、エージェントが薬物探索行動を過度に選択するようになると考えられています。具体的には、乱用薬物は、RPEを信号するDAニューロンを活性化する経路に介入する可能性があります。例えば、コカインはVTAのDAニューロンの一過性発火を誘発する可能性があります。TDRLでは、これはRPEシグナル伝達を妨害し、薬物探索行動の学習価値を強く増加させ、それらが行動を支配するようになる可能性があります。モデリング研究では、TDRLモデルでこの薬物誘発性のRPEシグナル伝達のコンポーネントを実装すると、依存症関連行動の多くの重要な側面を簡潔に説明できることがわかっています。
与えられた状態の行動の価値を学習する上記で説明されたTDRLモデルは、習慣関連学習に適用されます。脳内の複数の学習システムの役割を探求するために、より精巧なRLモデルも開発されています。この習慣関連の学習形式(モデルフリーRLとも呼ばれます)に加えて、モデルベースRLと呼ばれる別のタイプがあります。モデルベースRLは、環境の因果関係構造の内部表現(すなわち、どの状態が行動を通じて到達するかを知ること)を使用して、将来の状態の価値から行動の価値を計算します。モデルベースRLは、エージェントにとってモデルフリーRLよりも計算負荷が高く(ただし、より柔軟でもあります)、PFCにおける認知処理と関連付けられています。
RL課題における行動とモデルパフォーマンスを比較することで、研究者はモデルフリーRLとモデルベースRLの相対的な依存度を調べることができます。認知欠損はモデルベースRLの機能を損ない、モデルフリーRLへの依存度を高める可能性があります。研究者は、意思決定におけるモデルフリーRLとモデルベースRLの相対的寄与を測定するための行動パラダイムを設計してきました。研究では、依存症と強迫性障害の両方において、健常者と比較して習慣的なモデルフリーRLが好まれることが判明しています。これらの知見は、これらの障害が習慣的で反復的な行動を示すという見方を支持しています。
逐次サンプリングによる意思決定
意思決定の数学モデリングのもう一つのトピックは、利用可能な選択肢の中からカテゴリー的に選択するプロセスです。これは、二択強制選択(2AFC)課題の文脈で最も広範に研究されてきました。2AFC課題では、意思決定プロセスは、一方または他方の選択肢を支持する証拠を時間的に逐次的に蓄積するものとして定式化できます。ドリフト拡散モデル(DDM) は、現象論的ではあるがメカニズム的なモデルであり、2AFC課題に広く適用されており、特定の文脈では最適な解である可能性が高いです。
DDMでは、意思決定変数が時間とともに進化し、ノイズの多い証拠を蓄積します。証拠サンプリングは本質的にノイズが多いため、意思決定変数はバイアスのあるランダムウォークを受け、一方の選択肢を他方よりも支持する正味の証拠によって決定される一方向への平均ドリフト率を持ちます。計算論的には、2つの選択肢は下限と上限に対応します。意思決定変数が境界を越えると、対応する選択が行われます。ノイズは意思決定の試行ごとに異なるため、選択と反応時間は試行ごとに変化します。DDMの強みの一つは、選択の割合だけでなく、経験的選択データに適合させるために使用できる反応時間の完全な分布を生成することです。神経レベルでは、DDMは、意思決定中に神経活動のゆっくりとした増加を示す多くの皮質領域からの電気生理学的記録によって支持されています。
DDMは、DDMパラメータの値の観点から行動を記述することによって、意思決定障害の側面も説明できます。これにより、意思決定行動における差異をより正確に分離し、定量化する可能性を秘めています。例えば、一方の選択肢を他方よりも選択する傾向を示す臨床グループを考えてみましょう。DDMの枠組みでは、これは一方の決定境界が他方よりも近いことが原因である可能性があります。あるいは、平均ドリフト率にその選択肢を支持するドリフト率の成分が含まれている可能性もあります。決定的に重要なのは、これら2つの潜在的なメカニズムが、エラーパターンと反応時間に分離可能な影響を与えることです。したがって、被験者の行動データを適合させることで、どの変更が被験者のグループの行動をよりよく説明するかを分離することができます。
推論におけるベイズ的アプローチ
研究のもう一つの実りある分野は、信念形成の数学的定式化です。これは、強いが異常な信念が臨床的に妄想として特徴づけられる内部状態をもたらす場合に最も臨床的に関連性があります。ここでは、ベイズ推論の数学モデルのクラスによって最大のインパクトが達成されています。ベイズ推論は、ベイズの定理に従って、イベントBの観測によってイベントAの推定確率がどのように更新されるべきかを記述します。
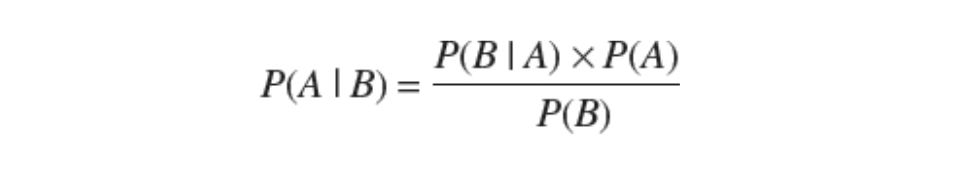
ここで、P(A∣B) はBが真である場合にAが真である確率、P(B∣A) はAが真である場合にBが真である確率、P(A) はAの確率、P(B) はBの確率です。したがって、事後確率 P(A∣B) は、尤度 P(B∣A) に事前確率 P(A) を掛けたものに比例します。イベントAが起こるという期待である事前確率は、イベントBの観測からの事後推定の推論において重要な役割を果たします。
妄想形成の文脈では、ベイズモデルは、精神病が世界に関する異常な事前確率によって特徴づけられる神経的および心理的状態であると仮説化しています。異常な事前確率は、異常な顕著性の状態から生じる可能性があります。つまり、環境中の出来事が通常よりも顕著であると仮説化されており、おそらく線条体におけるドーパミン(DA)シグナル伝達の上昇が原因である可能性があります。ベイズモデルは、次に、期待が形成され、その後確認または違反される様々な行動実験の文脈に適用でき、報告された事後推定は異常な事前確率への窓を提供します。この分野の研究は、異常な事前確率(または事後確率)が異常な推論の形成につながり、それが現在の証拠に裏打ちされていない安定した内部信念(すなわち妄想)につながるという見方を支持しています。簡単に言えば、精神医学に応用された行動のベイズモデルは、妄想が異常な推論の極端な状態であると仮定しています。このフレームワークは、その後に異常な予測誤差コーディングと関連付けられ、神経画像診断の文脈に拡張され、異常な信念形成の推定神経マーカーを提供しています。
神経生理学的バイオマーカーのモデリング
臨床神経科学の主要な目標は、精神疾患に対する堅牢な神経生理学的バイオマーカーの発見です。これらのバイオマーカーの根底にあるメカニズムの理解は、特定の回路摂動を神経生理学的測定にマッピングすることによって、治療法の開発に役立つ可能性があります。生物物理学に基づく回路モデリングは、モデルがシナプスレベルのパラメータをネットワークレベルのダイナミクスにリンクさせるため、これらのレベルを結びつけるのに適しています。モデルは、推定されるシナプス障害によって生理学的バイオマーカーがどのように影響されるかについての予測を行うことができます。次に、モデル予測は、逆方向の推論の基礎を提供し、生理学的バイオマーカーの測定された変化を伴うシナプス摂動の部位に関する仮説を検証します。したがって、生物物理学に基づく回路モデリングは、特定のバイオマーカーを解釈し、シナプスレベルおよび細胞レベルの測定でさらに検証できる仮説を生成する手段を提供します。この理解により、患者で測定された異常な神経ダイナミクスを回路摂動の観点から解釈することができ、動物モデルおよび臨床集団における実験研究のための具体的で検証可能な仮説が生成されます。この方法で研究されている2つのトピックは、皮質振動と大規模な安静時脳ネットワークです。
振動
皮質回路は、強い再帰的ネットワーク相互作用から生じる幅広い振動ダイナミクスを生成します。異常な振動は、多くの精神疾患および神経疾患で観察されており、通常、EEGまたはMEGを通じて測定されます。このような振動欠損は、局所的なダイナミクスと、脳領域間の長距離結合の両方で観察されます。統合失調症では、ガンマ帯域(30~80Hz)の振動異常が特に注目されています。錐体細胞と介在ニューロンからなる皮質回路モデルは、統合失調症などの精神疾患に関与する摂動に応答したガンマ振動の障害を探求するために使用されてきました。
計算論的および実験的研究は、新皮質ガンマ振動が、傍体標的の速い発火性(およびパルブアルブミン発現性)抑制性介在ニューロンと相互に接続された興奮性錐体細胞のフィードバックループから生じるというモデルを支持しています。これらの回路モデルでは、ガンマ振動は錐体細胞と介在ニューロンの活性化のパターン化されたサイクルを通じて生じます。興奮性入力が錐体細胞を発火させます。この活動は、抑制性介在ニューロンを短時間の遅延を伴って発火させます。このフィードバック抑制は回路内の発火を抑制します。このシナプス抑制が減衰した後、サイクルが再び始まります。モデルは、このような振動行動が、フィードバック抑制が興奮に対して遅いか遅延している場合、強い再帰的興奮と抑制を持つシステムで自然に発生することを示しています。上記のワーキングメモリ機能の場合と同様に、ガンマ振動は興奮性細胞と抑制性細胞間の強い再帰的相互作用に依存しており、振動ダイナミクスはE/I障害に敏感です。
多くの計算研究は、ガンマ振動を生成する皮質マイクロ回路のモデルを開発し、疾患状態に関与するシナプス摂動によってガンマ帯域同期がどのように影響されるかを研究してきました。特に統合失調症に焦点を当てています。これらの研究は、統合失調症に関連するパルブアルブミン発現性介在ニューロンの障害がガンマ振動の生成をどのように損なうかを特徴づけてきました。モデリング研究はまた、ガンマ振動がドーパミン作動性調節や特定の細胞タイプにおけるNMDA受容体の拮抗作用によってどのように影響されるかを特徴づけてきました。これらの各ケースにおいて、モデルはシナプス操作の生理学的効果に関する検証可能な仮説を提供します。
これらのモデルは、疾患状態における異常な皮質ダイナミクスの回路基盤を理解する上で有用であることが証明されています。しかし、認知欠損や精神症状における異常な振動の役割は依然として不明確です。新皮質回路が認知中に実行する計算にとって、振動同期が根本的に必要であるかについては依然として議論があります。理論モデルは、振動同期が、神経集団間の効率的な情報伝達などの特定の計算機能を支えることができることを示しています。認知プロセスにおける振動の具体的な役割を仮定し、疾患状態において行動がどのように損なわれるかについて具体的な予測を行う、さらなる計算研究が必要です。
大規模脳ダイナミクス
計算神経科学における新たなトピックは、大規模脳ネットワークのダイナミクスです。この分野の進歩は、fMRIを介した全脳機能神経画像診断によって精神疾患を特徴づける増大する実験文献に洞察を提供する可能性を秘めています。これらのデータは、疾患状態の重要なバイオマーカーを提供する可能性があります。fMRIにおける一般的なアプローチの1つは、安静時に血液酸素化レベル依存(BOLD)信号に存在する低周波変動を分析することです。特に、安静時fMRIは機能的結合性のパターン、すなわち脳の区画にわたるBOLD信号の変動性を提供できます。これらの機能的結合性のパターンは、脳領域間の根底にある構造的結合性に関連付けることができ、これはヒトにおいて拡散テンソルトラクトグラフィーを通じて非侵襲的に測定できます。
最近の計算モデルは、安静時機能的結合性のグローバルパターンが皮質領域間の長距離相互作用を通じてどのように出現するかを捉えるために開発されてきました。これらの大規模ネットワークモデルは、それぞれが皮質区画を表す複数のノードのダイナミクスをシミュレートします。ノードは、通常トラクトグラフィー研究から導出される長距離結合を反映する解剖学的結合行列を通じて相互作用します。ノードにおける継続的な時間ダイナミクスは、ネットワーク全体の活動における相関変動のパターンを生成します。その後、モデルの機能的結合性を計算し、実験で観察された機能的結合性と比較することができます。
これらの安静時モデルの1つのクラスでは、各ノードは相互に接続された興奮性錐体細胞と抑制性介在ニューロンのプールでシミュレートされ、ノード間の興奮性長距離投射の構造的結合パターンを定義するためにヒトにおける拡散テンソルトラクトグラフィーが使用されます。各ノードはダイナミクスを駆動するために変動する背景入力を受け取ります。マイクロ回路モデルと同様に、これらの大規模モデルの生物物理学的基盤により、疾患プロセスまたは薬理学的操作によって誘発される解剖学的および生理学的変化の動的結果に対処するために直接適用できます。局所および長距離結合の強度の変化は、機能的結合性のパターンに異なる影響を与える可能性があります。モデルは、安静時機能的結合性が、根底にある解剖学的結合性の構造と、局所および長距離結合をスケーリングする生理学的パラメータの両方に敏感であることを明らかにしています。これは、fMRIを介して観察される安静時変化の予測によって、疾患状態のシナプスレベルの仮説を検証するために使用できます。例えば、局所皮質回路におけるE/Iバランスの亢進対低下の仮説は、皮質BOLD信号における変動性と共変動性のパターンに対して分離可能な予測を行い、これは統合失調症患者で検証できます。
将来の課題
分析レベル間の統合
この章では、計算論的精神医学が、局所的なニューロン回路から大規模な神経システム、そして最終的には精神症状へと、分析レベル間の橋渡しをする方法を提供してきたかを説明しました。この急速に成長している分野が依然として直面している課題は、ほとんどの精神症状について、これらの探求レベル間の形式的な橋渡しをどのように提供するかです。我々は、そのような進歩が起こった事例、すなわちワーキングメモリと恐怖条件付けの文脈を強調しました。このような場合、計算論的精神医学は、局所回路と大規模なニューロンダイナミクスおよび行動の発現を関連付ける方法の形式主義を確立し始めています。しかし、計算論的精神医学のこの分野における現在のモデルは、その行動のレパートリーにおいて依然として単純であり、非常に限られた実験的文脈を捉えるように設計されています。
より複雑な認知および情動行動を正確に捉えるためには、モデルは、様々な分散型およびモジュール型計算を持つ複数の相互作用する脳領域を組み込む必要があります。この分野では、生物物理学に基づくモデリングは、より抽象的で生物物理学的詳細から離れていながらも、心理学的プロセスおよび分散型神経システム間の相互作用のモデリングに容易に適用できるコネクショニスト型モデルによって情報が提供されるでしょう。同様に、計算論的精神医学が直面している密接に関連する課題は、この分析レベルが疾患関連バイオマーカーの開発の可能性を提供する可能性があるため、生物物理学に基づくモデリングをマイクロ回路レベルを超えた大規模な分散型脳ネットワークに正式に拡張することです。例えば、そのようなモデルの重要な拡張は、多くの精神疾患にわたって重要な役割を果たす可能性のある大規模な視床皮質機能ループを、生物物理学的に現実的な方法で捉えることでしょう。次世代の計算論的精神医学研究は、これらの分析レベル間の橋渡しを形式化するために不可欠となるでしょう。
計算論的表現型分類(コンピュテーショナル・フェノタイピング)
精神疾患の診断は、症状の併発セットに完全に基づく包含基準と除外基準を用いて行われます。精神疾患の診断と統計マニュアル(DSM)は、診断の信頼性を向上させ、臨床意思決定のための明確な指針を提供するために、繰り返し改訂されてきました。しかし、その結果として、精神医学研究の主要な目的は、DSMカテゴリの下で疾患のバイオマーカーを特定することとなり、多くの場合、無症状の対照群と単一の疾患の診断基準を満たす患者群との間の平均差を探索するケースコントロール研究を通じて行われます。このようなシステムを使用する際の課題は、同じ診断を持つ患者が非常に異なる行動および神経表現型を示す可能性があり、診断カテゴリ内にかなりの異質性が存在することを示唆していることです。研究者と臨床家の両方が、個々の精神症状が実質的な異質性を伴って現れることを認識しており、これは診断カテゴリ内およびカテゴリ間を横断しています。この概念的な問題は、カテゴリベースのDSM型診断基準と次元的リサーチドメイン基準(RDoC)フレームワークの間に存在する緊張関係の事例に捉えられています。特定の精神症状や症候群にとってどちらのフレームワークが優れているかについて先験的な決定を下すのではなく、おそらく「精密精神医学」に向けた並行した動きがあるべきだと我々は提唱します。簡単に言えば、計算論的精神医学の進歩を活用して、観察される神経画像効果や行動症状のパターンを支配する根底にある計算メカニズムの種類に関して、個人レベルの推論を生成することが可能であるかもしれません。
この研究分野における現在の最先端技術は、グループ効果に焦点を当てています。つまり、計算論的精神医学で出現した作業の大部分は、特定の診断におけるグループレベルの効果を説明することに焦点を当ててきました。我々は、計算論的精神医学の非常に有望な将来の応用の一つは、メカニズムモデルに基づいた個人レベルの計算論的表現型分類を提供することであると主張します。このような精度レベルは、精神医学における現在の臨床基準の内外に存在する大規模な臨床的異質性を管理する方法を提供する可能性があります。最終的に、このような臨床的異質性を根底にある計算メカニズムにマッピングすることは、より良いメカニズムに基づいた治療法を開発するために不可欠となるでしょう。
精神症状に対するより効果的で標的を絞った治療法を開発するための必要かつ重要なステップは、根底にある神経特性への信頼性と特異性の高いマッピングです。カテゴリカルなフレームワークの限界は、機能的領域を神経回路にマッピングするための次元的フレームワークを提唱したRDoCのようなイニシアチブに反映されています。このような努力は、精神疾患にわたる症状と神経のバリエーションをマッピングするための大規模な、複数施設、トランス診断的研究を動機付けてきました。これらのより大きなデータセットにより、精神医学的スペクトルにわたる多変量脳-行動関係を探求することが可能になり、定量的に根拠のある個別化された治療法への道を開き、神経行動学的異質性を最適に解析できない可能性のある従来の臨床スケールを超えて進んでいます。例えば、精神症状空間の多くのデータ駆動型因子分析研究があるにもかかわらず、精神医学神経画像研究における一般的なアプローチは、複合スコア(「陽性」または「陰性」の精神病症状の合計など)を神経測定値に「関連付ける」ことに留まっています。決定的に重要なのは、これらの分析が、精神疾患における神経の変化が、合計複合スコアには反映されない症状の重み付けされた組み合わせによってよりよく捉えられる可能性を検証していないことです。
このような重み付けされた組み合わせは、正準相関分析(CCA)などの多変量アプローチを使用して検証できますが、これらの研究自体は過学習に陥りやすく、結果の再現性の失敗につながります。これはしばしば、比較的少ない被験者数に対して評価される神経学的および行動学的データの本質的に高い次元性によるものです。実際、最近の研究では、CCAのほとんどの場合、真の効果を検出するために使用される神経/行動学的特徴の数よりも、サンプルサイズが少なくとも一桁大きい必要があることが示されています(例:正準相関r = 0.3を仮定)。神経行動学的特徴空間の事前の次元削減(数百から数十万の特徴を通常数百に削減する一般的な手法)を行ったとしても、これは数千人の被験者のサンプルサイズを必要とします。注目すべきは、現在の最先端の臨床神経画像研究のほとんどは、目標登録総数が200〜600人であるのに対し、いくつかの人口ベースおよび前駆期研究では数千人の登録者数を達成していることです。したがって、多変量手法は、神経学的特徴と行動学的特徴間の最大の共変動を同時に計算するための有望で強力なアプローチであるものの、結果の再現性と信頼性を評価する必要があります。
計算論的表現型分類では、モデルのパラメータが単一の被験者の経験的データを最もよく捉えるように適合されます。計算論的表現型分類は、幅広い経験的データとモデリングアプローチを活用できます。例えば、RLモデルは被験者の意思決定行動データに適合させることができます。同様に、生物物理学に基づくネットワークモデルは、被験者の安静時神経画像データに適合させることができます。このアプローチの可能性は、これらのモデルパラメータが診断的価値を持つ可能性があり、より予測的なバイオマーカーにつながる可能性があることです。これらのモデルパラメータは、診断基準に応じた効果的な分類を可能にし、診断カテゴリ内の臨床的に関連するクラスターまたは次元を明らかにしたり、患者の治療への反応を予測したりする可能性があります。計算論的表現型分類の診断可能性を検証するためには、縦断的研究が必要となるでしょう。
治療のモデリング
最後に、精神医学にとって最も重要性の高いことですが、計算論的モデリングは、上記で説明した分析レベルを横断して発生する可能性のある治療(または代償)の効果をシミュレートする方法を提供する可能性があります。例えば、一部のモデリングの取り組みは、局所回路におけるNMDARやGABARシナプスへの代償が、ワーキングメモリ計算に悪影響を与える皮質脱抑制にどのように影響するかについて予測を生成し始めています。しかし、この研究分野は現状では未発達であり、複雑な神経ダイナミクスが関与するケースで直感を導く将来の可能性を秘めています。
治療設計を導くために、いかなる計算論的特徴も臨床的に実用可能であるためには、その特徴を標的化可能な神経メカニズムに関連付ける必要があります。BOLD神経画像測定は、根底にあるメカニズムや、これらのメカニズムがどのように障害されて精神症状を引き起こすかについての情報を本質的に提供しません。したがって、神経画像測定を、「分子ベンチマーク」として機能しうるメカニズムに基づいた神経生物学的特徴(遺伝的、細胞的、または回路レベルの測定) を用いて検証することが重要です。そのような例の1つが薬理学的神経画像マップであり、これは特徴付けられた作用機序に関する情報を含み、症状-神経マップのメカニズム的参照として使用できます。例えば、患者の類似性をある分子標的マップと別のマップ(例:ケタミンによるNMDA拮抗作用とセロトニンによるセロトニン受容体作動作用)で定量化することにより、単一の患者の、ある潜在的治療メカニズムと別のメカニズムに対する差次的類似性を評価することが可能です。
別の方法は、精神病理学に関与する遺伝子の遺伝子発現データ、例えばアレンヒト脳アトラスから得られたトランスクリプトミクス(転写産物全体)マップを使用することです。特定の遺伝子(例:神経伝達物質受容体サブユニットや介在ニューロンマーカーをコードする遺伝子)のトランスクリプトミクスパターンと神経画像表現型マップとの関係を定量化することは、特定のメカニズムや神経システムが観察された脳-行動特性にどのように関与しているかを知らせることができます。したがって、これらのトランスクリプトミクスマップは、特定の受容体に関連する可能性のある治療標的の独立したベンチマークを提供する可能性があります。
ここで、生物物理学に基づくモデルのさらなる開発と洗練は、特に有利です。関連する細胞の詳細を考慮すると、そのようなモデルは、特定のシナプス部位における障害のバイオマーカーと行動の両方の予測を実際に生成できます。このような詳細レベルは、動物モデルによって情報が提供されない場合には手の届かないものであるかもしれません。それにもかかわらず、これこそが、計算論的精神医学と臨床神経科学における将来の研究間の最先端の相互作用の要点です。我々は、この分野の将来の研究が、基礎神経科学に基づいた精神医学における治療開発を合理的に導くという刺激的な可能性を秘めていると仮定します。
参考文献 (Further Readings)
- Abbott LF, Dayan P. Theoretical Neuroscience: Computational and Mathematical Modeling of Neural Systems. MIT Press; 2001.
- Adams RA, Brown HR, Friston KJ. Bayesian inference, predictive coding and delusions. AVANT. J. Philos. Int. Vanguard. 2014;5:51-88.
- Anticevic A, Cole MW, Repovs G, et al. Connectivity, pharmacology, and computation: toward a mechanistic understanding of neural system dysfunction in schizophrenia. Front Psychiatry. 2013;4:169.
- Anticevic A, Murray JD, Barch DM. Bridging levels of understanding in schizophrenia through computational modeling. Clin Psychol Sci. 2015;3(3):433-459.
- Armony JL, Servan-Schreiber D, Cohen JD, Ledoux JE. Computational modeling of emotion: explorations through the anatomy and physiology of fear conditioning. Trends Cogn Sci. 1997;1(1):28-34.
- Cohen JD, Braver TS, O’Reilly RC. A computational approach to prefrontal cortex, cognitive control and schizophrenia: recent developments and current challenges. Philos Trans R Soc Lond B Biol Sci. 1996;351(1346):1515-1527.
- Corlett PR, Taylor JR, Wang XJ, Fletcher PC, Krystal JH. Toward a neurobiology of delusions. Prog Neurobiol. 2010;92(3):345-369.
- Deco G, Kringelbach Morten L. Great expectations: using whole-brain computational connectomics for understanding neuropsychiatric disorders. Neuron. 2014;84(5):892-905.
- Huys QJ, Guitart-Masip M, Dolan RJ, Dayan P. Decision-theoretic psychiatry. Clinical Psychological Science. 2015;3(3):400-421.
- Insel TR. The NIMH research domain criteria (RDOC) project: precision medicine for psychiatry. Am J Psychiatry. 2014;171(4):395-397.
- Kishida KT, King-Casas B, Montague PR. Neuroeconomic approaches to mental disorders. Neuron. 2010;67(4):543-554.
- Lee D. Decision making: from neuroscience to psychiatry. Neuron. 2013;78(2):233-248.
- Lisman J. Excitation, inhibition, local oscillations, or large-scale loops: what causes the symptoms of schizophrenia? Curr Opin Neurobiol. 2012;22(3):537-544.
- Maia TV, Frank MJ. From reinforcement learning models to psychiatric and neurological disorders. Nat Neurosci. 2011;14(2):154-162.
- Montague PR, Dolan RJ, Friston KJ, Dayan P. Computational psychiatry. Trends Cogn Sci. 2012;16(1):72-80.
- Redish AD, Jensen S, Johnson A. A unified framework for addiction: vulnerabilities in the decision process. Behav Brain Sci. 2008;31(4):415-437; discussion 437.
- Stein DJ, Ludik J. Neural Networks and Psychopathology: Connectionist Models in Practice and Research. Cambridge University Press; 2007.
- Stephan KE, Mathys C. Computational approaches to psychiatry. Curr Opin Neurobiol. 2014;25:85-92.
- Thomas MS, McClelland JL. Connectionist models of cognition. In: Sun R, ed. The Cambridge Handbook of Computational Psychology. Cambridge University Press; 2008.
- Uhlhaas Peter J, Singer W. Neuronal dynamics and neuropsychiatric disorders: toward a translational paradigm for dysfunctional large-scale networks. Neuron. 2012;75(6):963-980.
- Wang XJ. Neurophysiological and computational principles of cortical rhythms in cognition. Physiol Rev. 2010;90(3):1195-1268.
- Wang XJ, Krystal John H. Computational psychiatry. Neuron. 2014;84(3):638-654.

