- 1.25 核磁気共鳴画像法と分光法:基本原理と神経精神疾患における最近の知見
- MRS測定における周波数と分子識別の影響
- 図1.25-3. ニューロケミカルは、その化学的同一性と分子内の位置に応じて、原子のラーモア周波数がわずかに異なります。
- システムハードウェア
- 図1.25-4. 化学シフトとJカップリングの効果
- システムハードウェア: 磁石
- 磁気共鳴(MR)スキャナーの構成要素とその機能
- 磁気共鳴(MR)スキャナーのさらなる構成要素:傾斜磁場コイルとフーリエ変換
- フーリエ変換:信号の解読
- フーリエ変換:複雑な信号を単純な波の組み合わせで表現する
- 図1.25-8. フーリエ変換は時間依存信号を周波数で表現することを可能にし、この点でMRIは音と区別がつきません。
- 図1.25-9. K空間データ(上)と関連する画像(下)。
- MRIの方法論
- 図1.25-10. 脳画像におけるk空間のカバレッジ。
- T1強調画像、注入造影剤、およびT2強調画像
- 拡散MRI
- 図1.25-11. 左小脳橋角部の聴神経鞘腫。
- 図1.25-12. 脳室周囲領域の多発性硬化症(MS)。
- 図1.25-13. 外傷後ストレス障害患者群における体積解析のために脳領域別にセグメント化された構造T1強調画像。
- 構造画像が精神医学に応用される可能性
- 図1.25-14. DTIから決定された線維トラクトを軸位視点で示しています。
- MRIの認知症への応用
- 図1.25-15. タイムオブフライト(TOF)アンギオグラフィーによる血管系の画像化。
- MRIの統合失調症への応用
- MRIの気分障害への応用
- MRIのアルコール依存症への応用
- 機能的MRI(fMRI)の方法論
- 図1.25-16. 右手運動中の3T機能的MRI画像(矢状面(左)、冠状面(中央)、軸位面(右))。
- 図1.25-17. 機能状態の変化が脳のエネルギー利用に及ぼす相対的変化とfMRIへの影響。
- 精神医学におけるfMRIの応用
- 統合失調症のfMRI
- 気分障害のfMRI
- アルコール依存症のfMRI
- 1H MRS(水素原子核磁気共鳴分光法)
- 図1.25-18. 4テスラ磁石を用いた健康な被験者の31P MRS。
- 31P MRS(リン原子核磁気共鳴分光法)
- 13C MRS(炭素原子核磁気共鳴分光法)
- 図1.25-19. ヒトの脳における[1-13C]グルコース2時間注入前(下)および注入中(上)の13C MRスペクトル。
- 精神医学におけるMRSの応用
- 統合失調症におけるMRS
- 気分障害におけるMRS
- アルコール依存症におけるMRS
- 7Liおよび19F MRS
- 図1.25-20. デューテリウム代謝イメージング(DMI)が示す、悪性脳腫瘍患者におけるワールブルグ効果として知られる異常なグルコース代謝。
- デューテリウム代謝イメージング(DMI)
- 実用上の考慮事項
- スキャン前に患者に伝えるべきこと
- 将来の方向性
- 参考文献
1.25 核磁気共鳴画像法と分光法:基本原理と神経精神疾患における最近の知見
GRAEME F. MASON, PH.D., JOHN H. KRYSTAL, M.D., AND GERARD SANACORA, M.D., PH.D.
歴史的に、精神医学におけるMRIの役割は、感情的、認知的、および行動的症状の既知の有機的原因を除外するための構造MRIの使用に限定されていました。現在、MR技術の精神医学における利用への関心が高まっています。これは主に、その非侵襲性と、脳の構造、機能、生理学に関する情報を提供する能力が増していることによります。精神疾患の診断におけるMRの潜在的有用性は計り知れませんが、現在の臨床応用は極めて限られています。しかし、過去10年間で、精神疾患の病態生理学および様々な治療法の作用機序の研究に関連するMR研究応用が爆発的に増加しました。画像測定は現在、国立衛生研究所のリサーチドメイン基準(RDoC) に明示的に含まれています。RDoCの文脈では、画像結果は特に研究目的であり、画像をその標準的な診断目的に限定するのではなく、様々な測定形式で疾患のスペクトルにわたる病態生理学的プロセスを特徴付けようとしています。
歴史
MRIおよびその他のMR技術は、元々核磁気共鳴(NMR) と呼ばれていました。この名前の「核」の部分は、原子の原子核へのエネルギー伝達とそこからのエネルギー伝達にこの技術の基礎があることに由来します。「磁気」は、実験環境における磁場の使用を指します。「共鳴」は、測定に使用される特定の周波数のエネルギーの使用に由来します。導入以来、NMRは化学および物理学の基礎研究に使用されてきましたが、医療応用への導入に伴い、患者が電離放射線、原子力、核兵器と誤って関連付ける可能性があるため、「核」という言葉は一般的に省略されてきました。データ取得だけでなく、人工知能を含む分析においても、技術的進歩は継続しています。多くのMR技術の歴史と調査は最近出版されています(Kose, 2021)。
1946年、エドワード・パーセル(Edward Purcell, 1912-1997)とフェリックス・ブロッホ(Felix Bloch, 1905-1983)は、ハーバード大学とスタンフォード大学でそれぞれ独立してNMRを実証し、この発見に対して1952年のノーベル物理学賞を共有しました。初期のNMR測定は掃引磁場で行われ、サンプルが時間変化する磁場に曝される間、狭帯域の無線周波数適用が実行されました。測定の効率を高めるため、パルスおよびフーリエ変換NMRが開発され、1964年にカリフォルニア州パロアルトのバリアン・インスツルメンツでリチャード・エルンスト(Richard Ernst, 1933年生まれ) によって成功裏に実証されました。彼はこの概念をMRIに拡張し、1991年のノーベル化学賞を受賞しました。ニューヨークの医師レイモンド・ダマディアンは、1969年に腫瘍が異なるMR関連特性を持つことを観察し、癌組織と健康な組織を区別する可能性を提供することで、NMRの潜在的な臨床応用を実証しました。ダマディアン博士は、1972年にMRI装置の最初の特許を申請し、その装置の目的を記述しました。1973年、安倍善右衛門らは、対象物の位置を一連の位置を通じてずらしながら信号を逐次取得する遅いプロセスによって画像を生成する方法を発表し、1976年にはダマディアン博士がマウスに適用した同様の方法を発表しました。MRIの劇的なブレークスルーは、SUNYストーニーブルックのポール・ローターバー(Paul Lauterbur, 1929-2007) と、イギリスのノッティンガムのピーター・マンスフィールド卿(Sir Peter Mansfield, 1933年生まれ) が独立して、本章で議論する磁場勾配によるMRIの取得を開発したときに起こり、その業績により彼らは2003年のノーベル生理学・医学賞を共有しました。
NMR、MRS、MRIの基礎物理学
ヒトでの使用の場合、これらの技術は一般的にMRIおよびMRSと呼ばれます。MR法は、スピンと呼ばれる量子力学的特性に基づいていますが、ほとんどの目的で、古典力学を使用して最も適切に記述される現象を利用しています。
スピン、ラーモア周波数、および正味の磁化
このセクションの主要なポイントは、(1) 特定の種類の原子核のみを検出できること、(2) 検出周波数が観測される原子核の種類とスキャナーの磁場の強さに依存すること、そして (3) 実際に検出できる原子核はごくわずかであることです。
MRIとMRSの基本的な基礎は量子力学にあります。なぜなら、信号を生成する原子核は量子粒子だからです。原子核は正の電荷を帯びており、観測可能な原子核はスピンと呼ばれる量子力学的特性を持っています。スピン1/2は、陽子と中性子の基本的な特性の1つです。つまり、陽子または中性子は+1/2または-1/2のいずれかのスピンを持つことができ、中性子と陽子が結合して原子核を形成すると、それらのスピン値が結合して、それらのスピンの正味のスピンを持つ原子核を生成します。最も豊富な形態の水素は単一の陽子からなる原子核を持つため、1Hの原子核のスピンは+1/2です。最も一般的な形態の炭素は、6つの陽子と6つの中性子からなる原子核を持っており、半分がスピン+1/2、半分がスピン-1/2であるため、結合するとスピンを持たない12Cの原子核を生成します。したがって、12CはMR技術では観測できません。しかし、天然に存在する炭素の1.1%は13Cであり、その原子核内に存在する追加の中性子が13Cに正味のスピン1/2を与えます。したがって、13CはMR技術で観測できます。表1.25-1は、ヒトの脳を研究するために応用されてきたいくつかのMR観測可能な原子核をリストしています。
非ゼロのスピンを持つ原子核は、エネルギーを印加し、その応答を観察することによってNMRで検出できます。そのため、MR技術を開発する研究者は、磁場中のスピンの挙動と測定中のスピンの操作についてしばしば議論します。原子核のような荷電粒子がスピンを持つとき、それは磁気双極子を生成します。これは、N極とS極を持つ小さな棒磁石として想像できます。
表1.25-1. MR検出可能な原子核とその脳研究への応用例
| 原子核 | ν (MHz/Tesla) | 原子あたりの感度 (% of 1H) | 応用 |
| 1H | 42.58 | 100.0 | アミノ酸神経伝達物質およびニューロンとグリアの化合物;水と脂質の画像化 |
| 2H | 6.54 | 1.89 x 10^-8 | 脂肪、グルコース、酢酸の代謝:重水素代謝イメージング (DMI) |
| 31P | 17.25 | .0666 | 高エネルギーリン酸レベル、細胞内pH、リン脂質ヘッドグループ |
| 13C | 10.71 | .0174 | アミノ酸神経伝達物質、グルコース、脂質、酢酸の代謝 |
| 15N | -4.32 | -3.83 x 10^-4 | アンモニア、アミノ酸の代謝 |
| 17O | -5.77 | 1.89 x 10^-7 | 脳酸素消費、H2O生成 |
| 19F | 40.08 | 83.5 | フルオキセチンやフルボキサミンなどのフッ素化薬物の脳薬物動態 |
| 23Na | 11.26 | 1.60 x 10^-3 | 低酸素症の影響、ナトリウムポンプへの薬理学的チャレンジ |
| 7Li | 16.55 | 4.62 x 10^-3 | リチウムの脳薬物動態 |
スピンを持つ原子核が大きさB0の強い磁場中に置かれると、ラーモア周波数または共鳴周波数と呼ばれる周波数でその磁場の軸を中心に歳差運動します(図1.25-1)。γとB0は次の段落で定義されます。
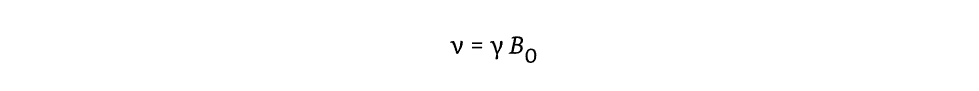
Larmor周波数は、サンプルに影響を与えるために送信する必要がある周波数であり、MRスキャナーによって受信される周波数でもあります。式1は、Larmor周波数が静磁場の強さとγに依存することを示しています。磁場強度B0が3テスラ(略して3T)で動作する臨床磁石で原子核が検出される周波数は、1.5Tで同じ原子核が検出される周波数の2倍です。最も豊富な水素同位体である1HのLarmor周波数は、1.5Tで63MHz、3Tで126MHzであり、これらが最も一般的な臨床磁場強度です。これらの周波数はラジオのFM帯域にあり、そのためMRスキャナーは通常、周囲の信号がデータにノイズのように混入するのを防ぐために、電気的に密閉された部屋に設置されています。周波数に影響を与えるもう一つの変数は、各原子核種で異なる磁気回転比であるγです。そのため、一般的な水素原子核のγの値は13Cの約4倍であるため、水素のLarmor周波数は13Cの約4倍になります。
正味の磁化
大きな静磁場が必要なのは、正味の磁化と呼ばれる状態を作り出すためです。外部磁場がない場合、磁場中の原子核のスピンは空間内でランダムに配向しており、各原子核のスピン配向に矢印を描き、それらの矢印をすべて共通の始点に集めたとすると、球体になり、すべての矢印が球体の反対側で等しく反対向きの矢印と対になって平均方向がゼロになります(図1.25-2A.1)。つまり、外部磁場がない状態では正味の磁化はゼロです(図1.25-2B.1)。信号の可能性を生み出すには、何らかの非ランダム性を導入する必要があります。強い磁場が存在すると、スピンはわずかに一方向に偏向し(図1.25-2A.2)、まるでそよ風に吹かれたタンポポの綿毛のように、正味の磁化を生成します(図1.25-2B.2)。MRスキャナーが検出できるのは、原子核のこのわずかな配向の偏りであり、正味の配向が大きいほど、サンプルから検出できる信号は大きくなります。総スピンに対する正味の磁化の割合は、ボルツマン分布によって与えられます。
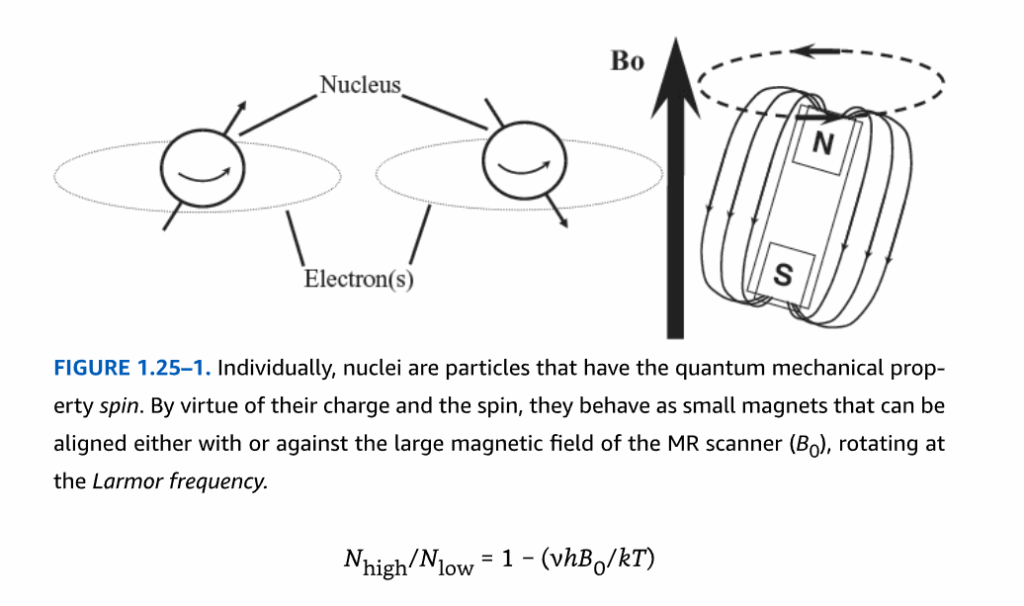
図1.25-1. 個々の原子核は、量子力学的特性であるスピンを持つ粒子です。それらは電荷とスピンの性質により、MRスキャナーの大きな磁場(Bo)と同じ向きか反対の向きに整列することができ、ラーモア周波数で回転します。
ここで、k はボルツマン定数、h はプランク定数、T は絶対温度です。ほとんどの人は式2を使用する機会はほとんどありませんが、これはNMR測定のいくつかの重要な特徴を示しています。第一に、大きな磁気回転比を持つ原子核を使用すると、より大きな正味の磁化が得られます。水素は最大の比率を持ち、日常の解剖学的およびその他の画像化に使用できる感度を持っています。ナトリウムは低い比率で感度が低く、画像化にはより困難です。第二に、より大きなB0はより多くの正味の磁化を生み出すため、より強い磁石はより多くの信号を生み出すことができます。これが地球磁場MRが脳の研究に使用されてこなかった理由です。3テスラの磁石は地球の平均磁場よりも67,000倍強く、そのため地球磁場では利用可能な信号が数千倍低くなります。実用的な観点から言えば、3テスラの装置での測定は1.5テスラの装置から得られる信号の2倍であり、7テスラの装置は4.5倍以上の信号が得られます。第三に、低い温度は信号を増やしますが、ヒトでの測定では、Tは通常約37℃(310K)に固定されています。最後に、ヒト臨床スキャンで使用される典型的な温度と磁場強度を代入すると、この式は水素の場合、正味の磁化はサンプル中の原子核のわずか0.0004%から0.0008%に過ぎないことを示しています。
正味の磁化の検出
生体内のMRSおよびMRIの技術は、様々な位置での正味の磁化の量を検出し、細胞環境の特性を解明します。MRSの場合、磁化がどの化学物質に存在するのかを発見するという特定の目的があり、MRIの場合、磁化の空間分布を測定するという特定の目的があります。原子核をラーモア周波数で歳差運動させ、スキャナーの磁場に沿って配向した正味の分布に従わせることでMR検出の準備が整いますが、信号を得るためにはもう1つの要素が必要です。
被験者をスキャナーに配置してから数秒以内に、脳内の原子核は完全に緩和された状態になります(図1.25-2A.2およびB.2)。MRの専門用語では、完全に緩和された状態とは、原子核がボルツマン分布に従って磁場に対して非常にわずかな正味の配向を持つ状態を指します。各スピンは磁石の軸を中心に歳差運動し、各スピンが歳差運動するにつれて、わずかな磁場がラーモア周波数で振動します。これらの振動する磁場が信号を検出する方法ですが、どの瞬間においても、軸を中心に一方向に配向するすべてのスピンに対して、反対方向に配向する別のスピンがあり、それらの振動する磁場は互いに打ち消し合います。この状態では、サンプルで信号を検出することはできません。この問題を解決し、歳差運動を検出するためには、スピンを協調的なグループ歳差運動の状態にする必要があります。ラーモア周波数で振動する磁場(高周波、またはRFと呼ばれる)が印加され、一般的に数百マイクロ秒から数ミリ秒持続し、原子核は伝送からエネルギーを吸収します。これにより、正味の磁化を含むスピンの集合全体が、スキャナーの大きくて静的な磁場との整列から回転してずれます(図1.25-2A.3およびB.3)。エネルギーが正味の磁化をスキャナーの磁場に対して垂直な方向に回転させるにつれて、スピンは位相コヒーレンスを獲得します。つまり、正味の磁化は、Z軸周りにランダムに分布するのではなく、正味のスピンが一緒に歳差運動する位置に置かれます。その位置では、それらの微小な振動する磁場がコヒーレントに発生し、検出器はそれを信号として拾うことができ、その信号もラーモア周波数を持っています。エネルギーは、研究対象の身体部分の周りまたは接触して配置されるプローブ(コイルとも呼ばれる)で検出されます。多くの場合、同じコイルが送受信に使用されます。エネルギーが印加された後、正味の磁化を構成するスピンがその配向を分散させ、Z軸との整列に戻るにつれて、信号は徐々に消失します。
用語に関して、正味の磁化が磁場配向から回転してずれるとき、スキャナーの磁場に垂直な磁化は横磁化と呼ばれます(図1.25-2A.3)。古典力学の用語では、MRは横平面にある磁化ベクトルの成分のみを検出できます(図1.25-2B.3)。使用されるエネルギーが少ない場合、より低いフリップ角が達成され、検出できる信号も少なくなります。磁化を任意の角度、180度を含む角度で回転させることは可能であり、これは反転と呼ばれる特別な回転であり、MRIおよびMRSで頻繁に使用されます。
量子力学と古典力学
MRIとMRSの多くの説明は、主に量子力学に基づいています。これらの説明はしばしば難解であり、一般的には不必要です。古典力学では観測される挙動を説明できない場合、「量子力学的現象」と呼ばれます。例えば、回転する自転車の車輪は量子力学的計算を用いて多大な労力を払って記述できますが、その挙動は古典力学によって極めて正確かつはるかに簡単に説明できます。したがって、回転する自転車の車輪は、量子力学的現象ではなく、古典的現象とみなされます。MRの場合、単一のスピンの観測は量子力学によってのみ説明できますが、脳のMRI研究のように多数のスピンが観測される場合、原子核は磁場にわずかに偏った連続的な配向を持つスピンの集合として挙動します。その挙動は古典力学の領域で完全に説明されます。この点については、Hanson (2008) によって詳細に記述されています。
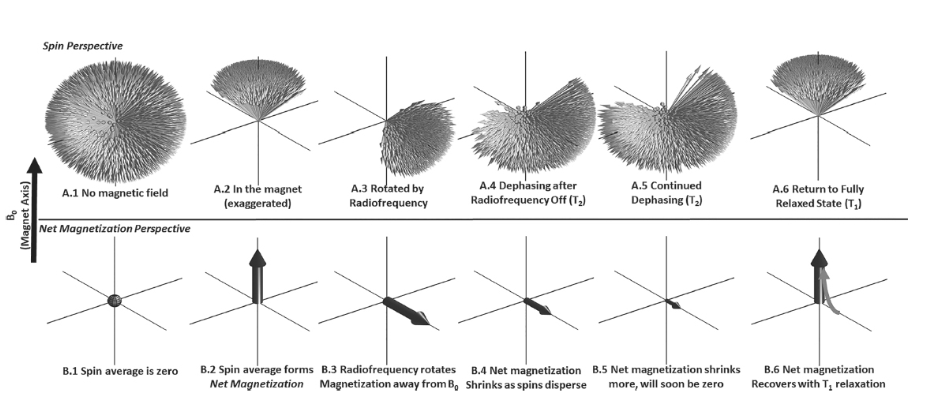
図1.25-2. MR実験における磁化を量子力学と古典力学の視点から示しています。
A: 量子力学的視点
- A.1 および A.2: 外部磁場が存在する場合、個々のスピンは磁場と同じ方向または反対の方向に整列します。そして、わずか0.0004パーセントというオーダーのわずかな多数のスピンが磁場と同じ方向に整列します。この比率が非常に小さいことが、MRが他の種類の画像診断と比較して感度が低いと見なされる理由です。
- A.3: スピンのラーモア周波数で高周波バーストを印加して、いわゆる90度パルスを印加すると、正味の分布はランダム化され、スピンは磁場と同じ方向と反対の方向に均等に分布します。スピンがランダム化されると同時に、XY平面に関して一つの配向にまとまり、位相コヒーレンスを獲得します。
- A.4 および A.5: 時間が経過すると、個々のスピンと環境との相互作用により、T2緩和に従ってXY平面内での配向が変化し、徐々に分散して位相コヒーレンスが失われます。
- A.6: 最終的に、スピンはXY平面内での正味の配向をすべて失い、Z軸に沿った元の状態に戻り、正味の磁化のわずかな部分がA.2のようになります。
B: 古典力学的視点
- B.1: 磁場がない場合、A.1のスピンは平均してゼロとなり、単なる点、つまり正味の磁化がなく、したがって利用可能な信号はありません。
- B.2: 外部磁場が存在する場合、磁場と正味の整列を持つスピンのわずかな多数の合計に比例する大きさの磁化ベクトルが存在します。
- B.3: 90度パルスが印加されると、磁化ベクトルはXY平面に回転します。これはA.3で示されているベクトルの平均的な配向です。
- B.4 および B.5: 励起後、A.4およびA.5の個々のスピンがXY平面内で徐々に様々な方向を向くにつれて、磁化ベクトルは時間とともに縮小します。
- B.6: 正味の磁化は最終的にすべてのXY配向を失い、T1緩和に従ってZ軸に戻ります。
T1、T2、およびT2*緩和
磁化ベクトルが横平面に回転された後、信号を消去し、T1およびT2緩和、またはそれぞれ縦緩和および横緩和と呼ばれる指数過程を通じてベクトルをZ軸に戻す緩和と呼ばれる現象が発生します(図1.25-2A.5,6およびB.5,6)。縦緩和は、指数時間定数T1によって制御される速度で、磁化をスキャナー磁場との整列に戻します。後に説明するように、この関係は、灰白質や白質など、異なるT1値を持つ物質間のコントラストを作成するために使用できます。
大きすぎる励起角度でスキャンを速く繰り返しすぎると、飽和と呼ばれるプロセスを通じて信号振幅が減少します。横磁化は、T1緩和プロセス中に生成されるZ磁化からのみ生成されます。したがって、Z磁化の回復に許容される時間が短すぎると、繰り返しのスキャンで信号が減少します。90度パルス後の完全な緩和には、通常、数秒の遅延が必要です。励起角度が小さいほど飽和は少なくなりますが、これにより生成される横磁化も少なくなります。実際には、最も効率的な取得は妥協点を取り入れており、90度未満の励起角度が使用され、スキャン間に3つのT1未満のインタースキャン遅延が許容されます。
生体内では、T1緩和は、静磁場の強さ、スピンが存在する分子のタンブリング速度、および緩和している原子核とサンプル中の他の荷電スピンとの距離に依存します。その結果、磁場強度が増加するにつれて、T1の値は増加します。後に示されるように、T1の磁場強度依存性は、より効果的な実験を行うために利用できますが、異なる磁場強度での測定にいくつかの制限を課すこともあります。
生体内での測定では、磁化ベクトルがZ軸に戻るずっと前に、T2緩和のために信号は消滅します。T2緩和は、XY平面における磁化の成分の位相コヒーレンスを破壊し、MR信号が指数関数的に減衰します(図1.25-2A.4,5およびB.4,5)。信号は徐々に消失し、自由誘導減衰(FID) を生じます。T2緩和は主に、原子核とサンプル中の他のスピンとの相互作用によるものであり、生体内の脳では、その値は磁場強度にほとんど依存しません。位相コヒーレンスが失われると、サンプル中の各スピンからの信号は、サンプル中の別のスピンによってますます打ち消され、最終的にサンプルから得られる平均信号はゼロに近づきます。T2の値は、原子核が存在する分子の可動性に大きく依存します。動きの制限が大きいほど、T2は短くなります。例えば、白質は豊富な硬い構造を持っており、水が急速に拡散したり自由に回転したりするのを妨げます。そのため、白質は脳脊髄液(CSF)よりもT1が短く、CSFでは水は自由に回転できます。白質と灰白質の差は、MRIで液体を強調する必要がある疾患に対する高コントラストの有効な基礎を提供します。骨のT2は非常に短いため、通常、MRIやMRSでは検出されません。
T2に関連するパラメータにT2*(ティーツースター) があります。これは磁場の不均一性から生じます。このような不均一性は、組織と骨または空気の間の界面のような巨視的な原因に由来する可能性があります。副鼻腔、耳道、および側頭骨は、MRIおよびMRS研究にとってしばしば厄介な大きな不均一性を引き起こします。不均一性はまた、デオキシヘモグロビンの存在などの微視的な影響からも生じます。T2*は位相コヒーレンスの指数関数的損失の時間定数ですが、このプロセスは、組織の不均一性や形状によるサンプル内の異なる部分での磁化の位相ずれによっても発生します。サンプル体積は画像ピクセルまたはMRS測定用に選択された領域である可能性があります。画像ピクセルのある角がわずかに高い磁場強度を経験する場合、その角のラーモア周波数はわずかに高くなります。画像ピクセルの中心は周波数が低い可能性があり、その場合、ピクセルの中心のラーモア周波数は低くなります。時間が経過すると、サンプル内の異なる部分の磁化は最終的にその位相をランダム化し、サンプルのある部分から来る信号は、サンプルの別の部分から来る反対位相の信号によって打ち消されます。特定の種類のMRIおよびMRS研究では、このような効果は信号を劇的に減少させ、MRIでは画像の局所的な暗化を引き起こし、MRSではぼやけと信号の損失を引き起こします。
MRS測定における周波数と分子識別の影響
このセクションの主要なポイントは、共鳴周波数に影響を与える主な要因が、(1) 磁場強度と (2) 磁気回転比であり、これらが主に送信周波数に影響を与えるということです。より小さな影響として、電子雲の構造と、分子内の他の原子核との相互作用があり、これらがMRSにニューロケミカルを互いに区別する能力を与えています。
化学物質の識別における主要な要因は遮蔽(シーディング) です。これは、分子内の電子雲が原子核に浸透する静磁場を部分的に遮断する現象です。グルタミン酸とグルタミン(図1.25-3)の例を考えてみましょう。グルタミン酸の鎖の4番目の炭素(C4)は、高度に電子求引性の酸素原子を持つカルボキシル基の隣に位置しています。カルボキシル基の近くの酸素原子は、分子のその端にある電子を自身に引き寄せるため、グルタミン酸のC4炭素原子核はより大きな磁場に曝され、したがってより大きなラーモア周波数を持っています。言い換えれば、カルボキシル基は炭素原子核の遮蔽を減少させ、わずかにB0の値を変化させ、その結果、炭素がわずかに高い周波数で共鳴することになります。
次にグルタミンを考えてみましょう。グルタミンは、C4炭素位置の近くに非電子求引性のアミド基に加えて1つの酸素しか持っていません。そのため、電子はグルタミンC4炭素原子核をより完全に遮蔽します。結果として、グルタミンのC4は、グルタミン酸のC4炭素よりも低い周波数で共鳴します。
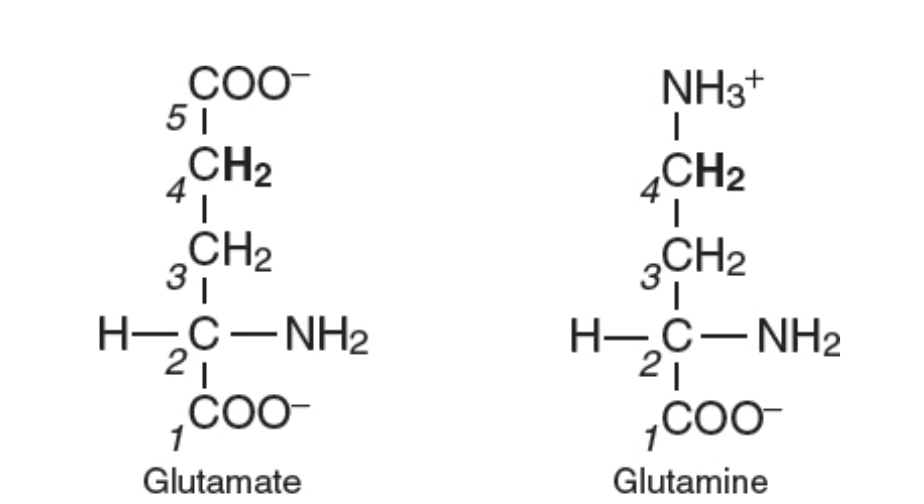
図1.25-3. ニューロケミカルは、その化学的同一性と分子内の位置に応じて、原子のラーモア周波数がわずかに異なります。
周波数はその磁気環境に応じて異なり、電子雲は原子核を遮蔽します。カルボキシル基に隣接する、炭素番号4のグルタミン酸の-CH2-の場合、カルボキシル基上の電子求引性の酸素原子が電子雲を自身に引き寄せるため、水素原子核は大きな静磁場に曝されます。グルタミンの対応する水素原子核は、それらを脱遮蔽する隣接する電子求引性の酸素原子を持たないため、わずかに低い磁場強度を経験します。したがって、1.5Tでのグルタミン酸の共鳴周波数は、グルタミンよりも約7Hz高くなります。
グルタミン酸とグルタミンは、1Hスペクトルでも分離されます。1.5Tの磁場強度では、グルタミン酸とグルタミンのC4に結合した2つの水素原子核の共鳴は、グルタミンに対してグルタミン酸が7.7Hz離れて中心に位置します。3Tでは、同じ水素原子核が15.4Hz離れて共鳴します。7Tでは36Hz離れて共鳴し、磁場強度が高いほど信号がより効果的に分離されます。MRS研究は幅広い磁場強度で行われるため、共鳴周波数に基づいて化学物質を識別しやすくするために、いくつかの共通の単位が使用されます。特定の分子の特定の位置にある原子核の共鳴周波数は化学シフトと呼ばれ、単位はppm(パーツパーミリオン) です。ppmの表記は、周波数差をヘルツで、ラーモア周波数をメガヘルツ(すなわち10$^6$ Hz)で割ることによって得られます。結果の単位はヘルツ/百万ヘルツ、またはppmです。これらの単位では、グルタミン酸とグルタミンのこれらのプロトンは、静磁場強度に関係なく0.11ppm離れて中心に位置すると言われています。
化学シフトは、周波数位置の相対的な差として理解する必要があります。慣例として、1Hおよび13C MRSの場合、分野ではトリメチルシリルプロピオネート(TSP)からの信号を0ppmのシフトを持つ参照化合物として指定することに合意されています。他のすべての化合物は、慣例により、TSPに対する周波数で記述されます。例えば、乳酸のプロトンは、TSPからそれぞれ1.33ppmと4.15ppm離れて共鳴します(図1.25-4)。MRS測定を得るために使用された元の技術(掃引磁場NMRと呼ばれる)に基づいた理由により、低い化学シフトは高磁場側(upfield)、高い化学シフトは低磁場側(downfield) と呼ばれます。
原子核の周波数に影響を与える最後の要因は、Jカップリングです。これは、隣接するスピンを持つ原子核がお互いに与える影響です。ある原子核のスピンの状態が、隣接するスピンの遷移エネルギーに非常にわずかな影響を与えます。Jカップリングを記述するには、量子力学的な説明が必要です。遷移エネルギーとは、スピンが吸収してそのエネルギー状態を変化させることができるエネルギーの量であり、それは定義された固定量であり、正確にラーモア周波数で供給されなければなりません。もしあるスピンが別のスピンと、通常は共有結合を通じて結合している場合、一方のスピンは他方の遷移エネルギーをわずかに高くまたはわずかに低い値に変化させます。遷移エネルギーが最終的に原子核の共鳴周波数を定義するため、スピンの半分はわずかに高い周波数を持ち、半分は低い周波数を持つことになります。
乳酸の1.33ppmの-CH$_3$基のように、1つの近くのスピンによって影響を受ける原子核は、1つの共鳴ではなく二重線(ダブレット) または2つの共鳴を持ちます。それぞれが-CH$_3$の全共鳴の半分を表します。これは乳酸のメチル基の場合であり、3つの同じ水素原子核が単一の隣接する水素によって同じように影響を受けます(図1.25-4A)。原子核が2つのスピンに隣接している場合、その共鳴は三重線(トリプレット) に分かれます。エタノールのスペクトルに示されている通りです(図1.25-4B)。乳酸のメチル基に隣接する水素に見られるように、3つのスピンに隣接する原子核は四重線(カルテット) を生じます。これは乳酸の3つのメチルプロトンが4.11ppmの単一の1Hに与える影響(図1.25-4A)またはエタノールの-CH$_2$プロトンに与える影響(図1.25-4B)から生じます。多重ピーク構造における各共鳴間のスペクトル距離はJ Hzであり、Jカップリングによる分裂は磁場強度に依存しないため、通常はppmではなくヘルツで報告されます。図1.25-4の1H-1H分裂の場合、Jの値は通常3〜15Hzの間にあります。
システムハードウェア
MRの基礎物理学からMRIとMRSの方法に移行する前に、MR装置自体を調べることは有用です。MR装置は、磁石、送信経路、受信経路の3つまたは4つの主要なコンポーネントで構成されており、ほとんどすべてのMRスキャナーには傾斜磁場コイルも備わっています。磁石はB0の源であり、これが正味の磁化を生成します。送信経路は横磁化を生成します。受信経路はサンプルからの信号を検出し、保存のためにコンピューターに送り返します。
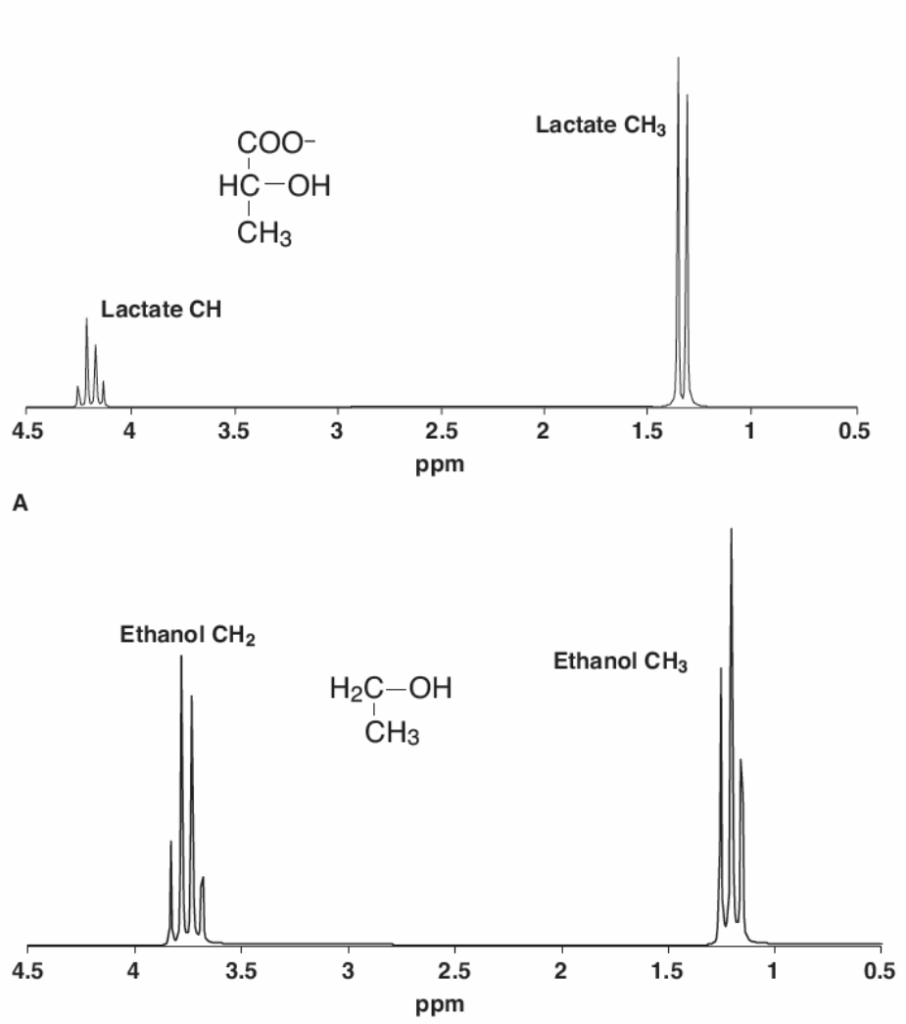
図1.25-4. 化学シフトとJカップリングの効果
MRS研究における化学物質は、主に化学シフトに基づいて同定されますが、スピンのJカップリング相互作用からも重要な情報が得られます。
- A: 乳酸は、TSPから4.15 ppmと1.33 ppmに共鳴を持ちます。メチルプロトンは等価であり、すべて1.33 ppmを中心に位置します。しかし、これらは4.15 ppmにある隣接する単一プロトンと相互作用し、その共鳴を1.33 ppmを中心とする二重線に分裂させます。4.15 ppmにある単一プロトンは、3つのメチルプロトンすべてと相互作用し、四重線に分裂します。
- B: エタノールは、1.2 ppmを中心とするメチル基の共鳴と、3.7 ppmを中心とするエチレン基の共鳴を持ちます。2つのプロトンはメチル共鳴を三重線に分裂させ、一方、メチル基の3つのプロトンはエチレン共鳴を四重線に分裂させます。
システムハードウェア: 磁石
磁石(図1.25-5)は、数百マイルにわたる超伝導ワイヤーが精密な形状に巻かれて構成されています。磁石が設置される際、ワイヤーの周囲からすべての外気と水を除去するために強力な真空が適用されます。その後、真空状態になった容器は、4K(-453°F) の温度で超伝導状態を維持するために液体ヘリウムで満たされます。ヘリウム浴は、沸騰を防ぐために真空チャンバーによって絶縁されています。液体ヘリウムは高価であり、最近の世界的な供給不足が数年間続くと予想されているため、多くの磁石ではヘリウム構造が液体窒素の浴または冷却ユニット内に配置されています。磁石内のヘリウムは、高純度に保たなければなりません。なぜなら、ヘリウムチャンバー(デュワーと呼ばれる)に湿気や空気が入ると固化し、閉塞を引き起こして爆発につながる可能性があるからです。
もう一つの故障の種類はクエンチです。これは、磁石の電気巻線における電荷の急激な喪失であり、同時に磁石からヘリウムがほぼ瞬時に排出される現象です。このような事象は、ヘリウム容器の周囲の真空の喪失、ヘリウムを適切なレベルに維持できなかったこと、または磁石の近くに強磁性体が導入されたことによって引き起こされる可能性があります。
磁気共鳴(MR)スキャナーの構成要素とその機能
磁気共鳴画像法(MRI)と磁気共鳴分光法(MRS)は、精神医学における脳の構造、機能、生理学に関する詳細な情報を提供する、非侵襲的な強力なツールです。これらの技術を可能にする複雑なハードウェアについて見ていきましょう。
磁石:強力な静磁場の源
MRスキャナーの中心には、数百マイルにわたる超伝導ワイヤーが精密に巻かれた磁石があります(図1.25-5)。この磁石は、検査対象の体(通常は頭部または胴体)を収容するための円筒形の穴を持っています。この穴には、シミングや画像化のような空間情報を必要とする実験に使用される傾斜磁場コイルが内蔵されています。
磁石の重要な特性:
- 超伝導性: ワイヤーは液体ヘリウム(約4K、-453°F)で冷却され、超伝導状態を維持します。これは、磁場を生成する電荷の損失を防ぐために不可欠です。液体ヘリウムの供給不足に対応するため、多くの磁石には液体窒素浴や冷却ユニットが組み込まれています。
- クエンチ: 磁石の巻線で電荷が急激に失われる現象で、ヘリウムが磁石から排出されることを伴います。これは、真空の喪失、ヘリウムレベルの低下、または強磁性体の侵入によって引き起こされる可能性があります。
- シム回路: 磁場の均一性を微調整するために使用される追加の回路です。磁石は中心で均一な磁場を達成するように設計されていますが、設置場所や被験者の存在によって均一性が乱れることがあります。この均一性はMRIやMRSの画質を劇的に向上させるため、エンジニアやMR装置は、磁場を補償するために手作業で調整する小さな金属片(シム)や自動化されたシム回路を使用します。
送信経路:信号の生成
送信経路は、スピンを励起し、信号を生成するために必要な高周波(RF)パルスを生成します。
- 周波数源: 所望の振幅、位相、形状を持つ信号を生成します。
- RF増幅器: 変調された信号をキロボルトの範囲に増幅し、コイルに送信します。
- RFコイル: 脳を囲むように配置され(図1.25-6)、励起のためにB1と呼ばれる振動磁場を発生させます。このコイルはラーモア周波数に調整され、調整可能なコンデンサを介してその一部を形成します。
受信経路:信号の検出と処理
RFコイルは、脳からの信号を受信する役割も果たし、受信経路の始点となります。
- プリアンプ: 受信コイル内の信号はマイクロボルトという微弱な振幅しかありません。この信号が長距離のワイヤーを介してコンピューターに送られると、ノイズに埋もれてしまいます。これを防ぐため、コイルのできるだけ近くに、磁石と互換性のあるプリアンプが配置され、信号をミリボルトレベルまで増幅します。
- 信号処理: 増幅された信号は周波数変換され、キロヘルツの可聴範囲にシフトされ、コンピューターに保存されます。
- 故障: コイルの故障の一般的な原因としては、RF送信が受信経路に漏れてプリアンプが損傷したり、電力による亀裂や火花によってコンデンサが損傷したりすることが挙げられます。これは特に、ヒトの頭部とはサイズや導電性が大きく異なるサンプルに高出力レベルを送信する場合に、ヘッドコイルで発生しやすくなります。
MRスキャナーは、これらの高度な構成要素が連携して機能することで、非侵襲的に脳内の微細な変化を捉え、精神神経疾患の病態生理学の理解と診断に貢献しています。
磁気共鳴(MR)スキャナーのさらなる構成要素:傾斜磁場コイルとフーリエ変換
前述の磁石とRFコイルに加えて、MRスキャナーには傾斜磁場コイルという不可欠な第4の構成要素があります。これは、得られる信号に空間情報を持たせ、MRIで画像を作成し、MRSで特定の領域の化学物質を特定するために重要です。
傾斜磁場コイル:空間情報の鍵
傾斜磁場コイルがない場合、MR信号はどのサンプル部分からのものかという情報がほとんど、あるいはまったく得られません。例えば、傾斜磁場コイルなしで標準的な脳画像プロトコルを実行すると、結果は大量の水信号と少量の脂肪信号からなるMRスペクトルになるでしょう。X、Y、Z傾斜磁場コイルが位置情報を提供します。
- 機能原理: 電流がX傾斜磁場コイルに流されると、静磁場(B0)に空間的に線形な勾配が追加され、B0effective=B0+Gxx となります。ここで、Gx は勾配強度(ミリテスラ/センチメートル単位)、x は磁石の中心からの距離です。YおよびZ勾配についても同様の関係が存在します。
- 画像化: 傾斜磁場に電力が印加されると、ラーモア周波数は磁石内の位置に線形に依存するようになり、このエンコーディングによって画像が得られます。
- 騒音と振動: 患者がMRスキャナーの大きな音の原因を尋ねることがよくありますが、その答えは傾斜磁場コイルです。電流が急速にオンオフされると、主磁場に反発する磁場を生成し、大きな力を発生させます。この力が大きな騒音として現れるのです。患者は同じ原因でスキャナー内部の振動を感じることもあります。
フーリエ変換:信号の解読
MR研究で用いられる最も基本的な解析ツールの1つがフーリエ変換です。この数学的操作は、時間と時間周波数(例:秒とヘルツ)の間、または空間とk空間(センチメートルと逆センチメートル)の間を変換するために多くの分野で利用されます。
- 原理: すべての時間依存信号は、ヘルツで測定される一連の周波数として表現でき、すべてのオブジェクトはk空間における一連の信号として表現できます。フーリエ変換の背後にある考え方は、任意の形状を適切な周波数と振幅の正弦波信号を合成することによって作成できるということです。
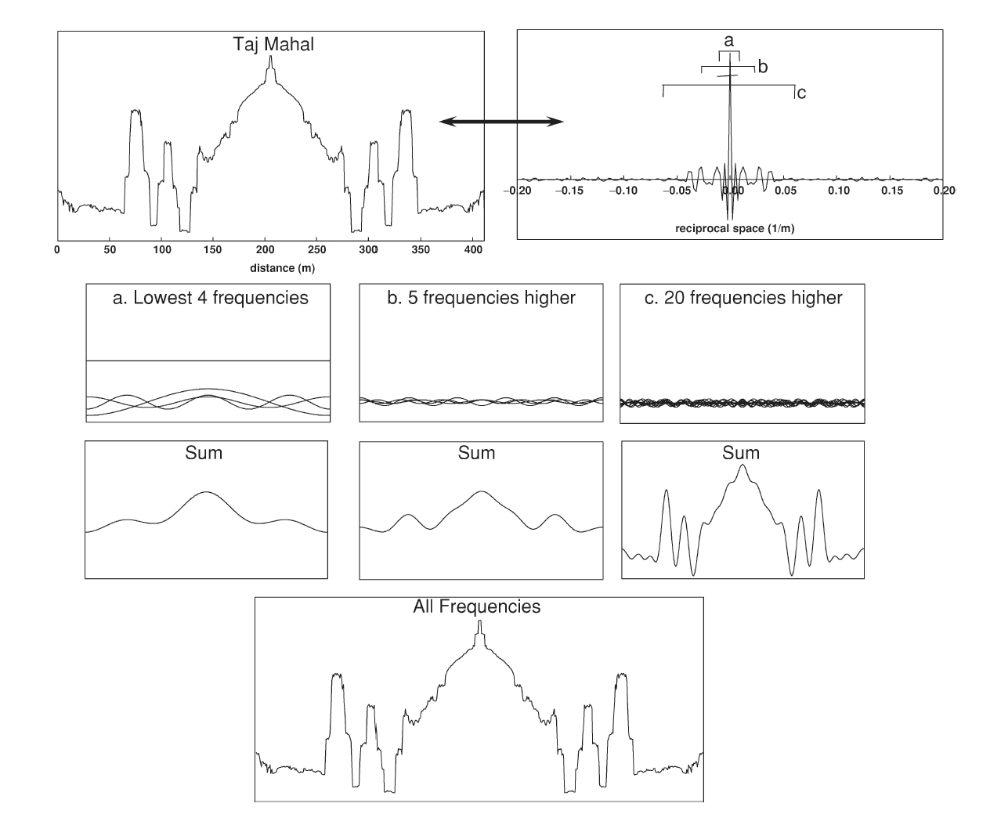
- タジ・マハルの例(図1.25-7): 図1.25-7は、インドのタージ・マハルのプロファイルの分解と再構成を示しています。
- 右上にあるフーリエ変換は、プロファイルを構成する周波数範囲に関連付けられた重みのヒストグラムとしてプロットされており、グラフの中心に低周波数、両側に高周波数が配置されています。
- 中央左のパネルは、プロファイルに対する低周波数の寄与が、大きな特徴に関係していることを示しています。低周波数からは、プロファイルが中央に大きなオブジェクトを持ち、両側に何か大きなものがあることがわかりますが、詳細はほとんどありません。
- 右隣のパネルは、徐々に高周波数を追加する効果を示しており、これによりより細かい特徴が徐々に生成されます。これは、フーリエ変換の高周波数成分が信号の詳細を含んでいるためです。
- すべての周波数が含まれると、元の画像が得られます。タージ・マハルは正弦波から構築されているのです。
以下に、ご提供いただいた文章を整形して要約します。
フーリエ変換:複雑な信号を単純な波の組み合わせで表現する
フーリエ変換の基本原理
フーリエ変換は、あらゆる形状や信号を、異なる周波数と振幅を持つ正弦波の組み合わせとして表現できるという前提に基づいています。この強力な数学的手法は、時間依存の信号(例:音)をその構成周波数に変換したり、空間データ(例:画像)を「k空間」と呼ばれる周波数領域に変換したりするために、様々な分野で用いられています。
タジ・マハルの例から学ぶフーリエ変換
図1.25-7は、インドのタージ・マハルのプロファイルがどのように正弦波の組み合わせで再構築されるかを示しています。
- 低い周波数(a): 中央の低い周波数帯を組み合わせると、タージ・マハルのプロファイルの大まかな形状が得られます。この段階では、中央に大きな建物があり、その両側に何か大きなものがあることはわかりますが、詳細はありません。これは、信号の主要な特徴や全体像が低い周波数成分に存在する(k空間の中心に近いデータに存在する)ことを示しています。
- 中程度の周波数(b): 次の周波数帯を加えると、中央のドームの形が具体化し始めます。
- 高い周波数(c): さらに高い周波数帯を取り込むことで、中央のドームの両側にある一対の塔の存在が明らかになります。
- すべての周波数: すべての周波数成分が統合されると、元のタジ・マハルの画像が完全に再現されます。
この例から示される2つの重要な原則は、オブジェクトは一連の正弦波として表現できること、そしてオブジェクトの詳細情報は主にゼロから最も遠い周波数、つまり高周波数成分に存在するということです。
脳画像におけるフーリエ変換の応用
タジ・マハルは精神医学的な脳画像とは直接関係がないかもしれませんが、フーリエ変換の基本的な考え方を効果的に示しています。
- MRS(磁気共鳴分光法): MRSでは、信号は時間関数として取得されます。これは、音が時間依存の振動として記録されるのと似ています(図1.25-8A)。音のフーリエ変換が音を構成する周波数と音量を明らかにするように、MRS信号のフーリエ変換は、神経化学物質を一意に識別する信号の周波数と振幅を明らかにします(図1.25-8B)。
- MRI(核磁気共鳴画像法): 脳画像におけるMR信号は、k空間領域で取得され、標準的な解剖学的画像を作成するためにフーリエ変換が行われます。
- k空間の中心に近い低周波数データは、脳の画像で頭部の大きさや大まかな円形を示すなど、詳細を欠くものの、全体の形状を反映します。
- 脳溝やその他の微細な詳細に関する情報は、k空間の中心から遠い、つまり高周波数データに存在します(図1.25-9)。
画像全体の情報を必要としない場合に時間を節約するために、k空間の中心または外縁のみを取得するスキームも存在しますが、脳画像の大部分はk空間の標準的なカバレッジで行われます。
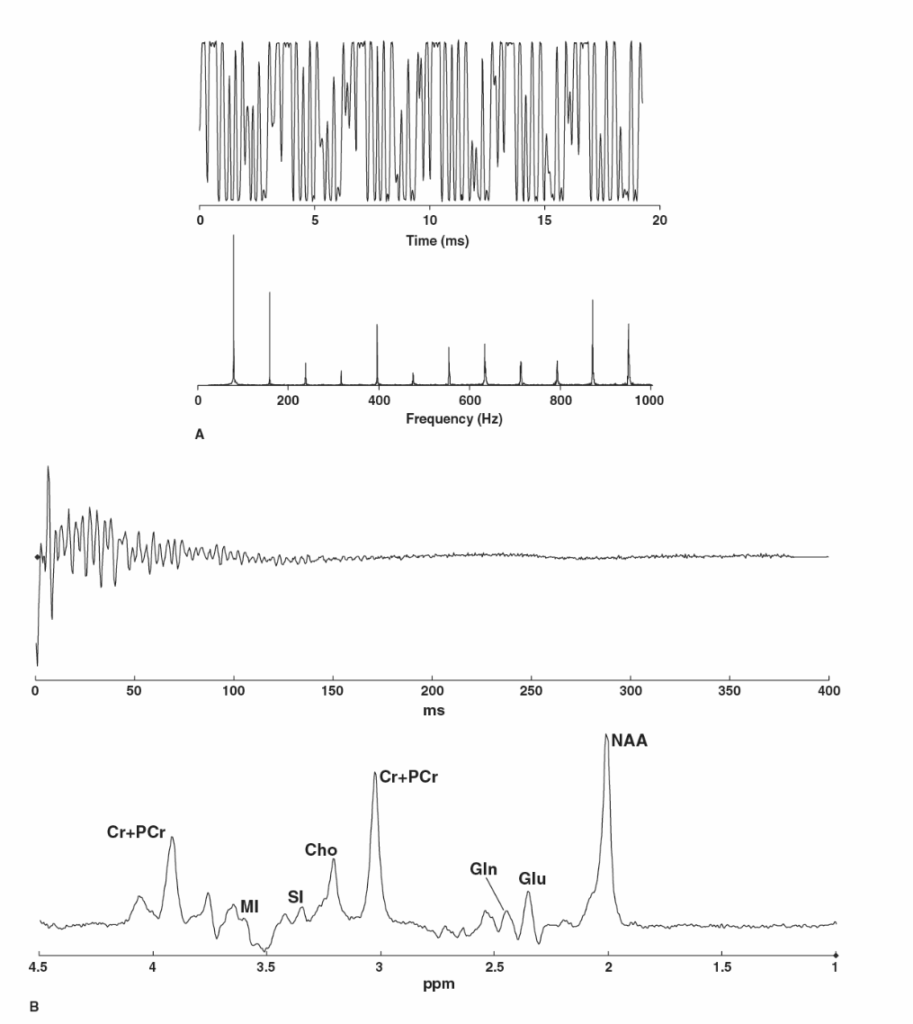
図1.25-8. フーリエ変換は時間依存信号を周波数で表現することを可能にし、この点でMRIは音と区別がつきません。
A: 上のグラフは、著者の娘と息子が演奏したサックスとシンバルの音を示しています。フーリエ変換により、楽器から生成されるいくつかの周波数が明らかになります。サックスの音の豊かさは、主にそれが発する周波数と様々な音色の組み合わせに由来し、シンバルの特徴的な音は、主音である540Hzに加えて、多数の周波数に由来します。
B: MRS信号は、ラーモア周波数と比較して見ると、音と区別がつきません。MRS信号もまた、時間依存の振動として現れます。初期のMRスキャナーの中には、オペレーターが信号品質を素早く評価できるように、オーディオスピーカーに接続されていたものもありました。この場合、フーリエ変換は複雑な時間領域の測定値を、健康な脳組織のサンプルに典型的な、簡単に識別できる特徴を持つスペクトルに変換します。この容積には、N-アセチルアスパラギン酸(NAA)、クレアチン+ホスホクレアチン(Cr + PCr)、ミオイノシトール(MI)、コリン、スカイロ-イノシトール(SI)、グルタミン酸(Glu)、グルタミン(Gln)が含まれています。
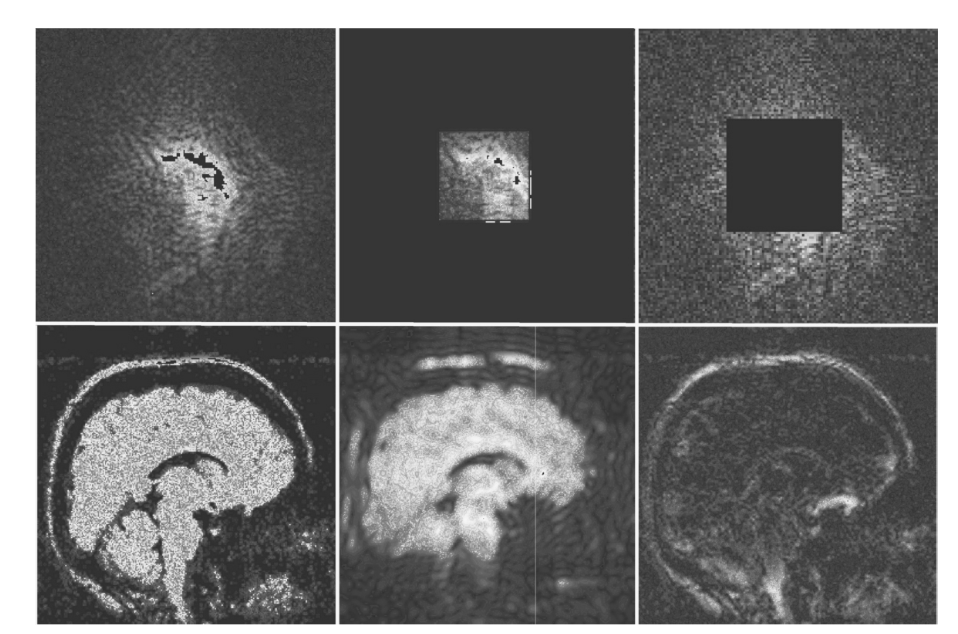
図1.25-9. K空間データ(上)と関連する画像(下)。
一般的なk空間のカバレッジは均一であり、標準的な脳画像をもたらします(左のペア)。もしk空間の中心のみが取得された場合(中央のペア)、画像はその詳細の多くを失います。これは、先の例におけるタージ・マハルのプロファイルの再構築の例に類似しています。もしk空間の外側の領域のみが取得された場合(右のペア)、微細な詳細のみが残ります。
MRIの方法論
MRIの方法論は、境界線と組織組成の差異を見ることに関わり、これは画像コントラストの生成を必要とします。「コントラスト」という言葉は、臨床的には注射可能な造影剤を意味することが多いですが、MRIにおけるコントラストの一般的な意味は、ある物質と別の物質の外観を区別するあらゆるものです。そのため、脳画像におけるコントラストは、T1、T2、血液酸素化、拡散係数、および水または脂肪の濃度の差異を利用することによって得られます。MRIの最も基本的な神経精神医学的応用は、脳の解剖学的マッピングであり、これは一般に脳水のT1、T2、およびT2*からの自然なコントラストに基づいて行われます。臨床応用の側面では、その目的は、腫瘍や多発性硬化症などの特定の症状の原因をチェックすることであることが多いです。すべての画像シーケンスは、1つ以上の領域特異的な高周波励起と、それに続くk空間をスキャンするための勾配の適用から構成されます。結果として得られるk空間の分布は、画像を生成するためにフーリエ変換を受けます。慣例により、MRIの結果は、矢状面または冠状面の画像の下部が足元を指し、軸位または冠状面の画像の右側が患者の左側を指すように表示されます。
最も基本的なMRIシーケンスは、グラディエントエコーとスピンエコーと呼ばれます。グラディエントエコーシーケンスは、信号源を局所化するための勾配と組み合わせた励起パルスです(図1.25-10)。各スライスについて、測定は、スライス選択勾配が印加されている間に適用されるスライス選択励起パルスから構成されます。パルスが長く、勾配が強いほど、スライスは薄くなります。より強力な勾配を備えたスキャナーは、一般により薄いスライスを提供できます。次に、位相エンコーディング勾配が、k空間における固定距離に取得をシフトするために、スライス選択に垂直な面内次元の1つに適用されます。より大きな位相エンコーディング勾配は、取得をk空間でより遠くにシフトさせます。位相エンコーディング勾配の後、準備勾配が2番目の面内次元に適用され、k空間の2番目の次元に取得をシフトさせます。最後に、そのk空間の2番目の次元に読み出し勾配が適用されます。このプロセスは、k空間の2次元の適切なカバレッジを提供するために、毎回わずかに異なる位相エンコーディング勾配強度を使用して繰り返され、2次元画像を生成できます。
グラディエントエコー画像では、副鼻腔や他の組織/空気/骨の界面の近くで見られるような磁場の歪みにより信号損失が発生しますが、これはスピンエコーシーケンスで回避できます。スピンエコーシーケンスには、グラディエントエコーシーケンスに含まれるすべての要素が含まれていますが、励起パルスと取得の間の半分の時点で適用される180度パルス(リフォーカスパルスと呼ばれる)が追加されています。その効果の1つは、磁場不均一性によって失われた磁化を再収束させ、副鼻腔の近くなどでの信号を回復することです。スピンエコーシーケンスは、後で説明するように、組織コントラストを取得し、特定の病態を可視化する方法も提供します。
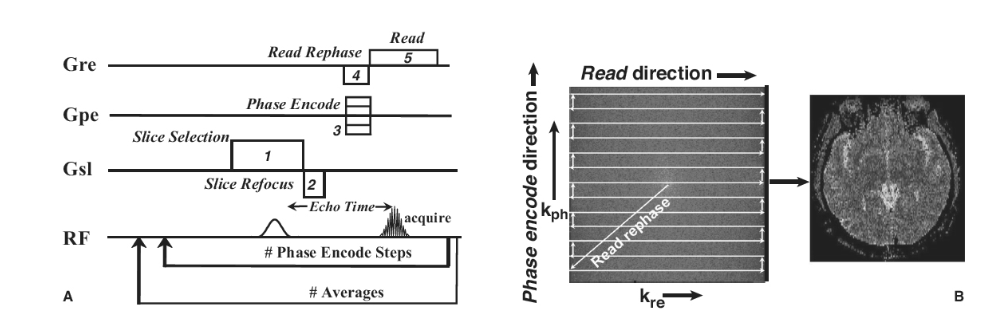
図1.25-10. 脳画像におけるk空間のカバレッジ。
A: グラディエントエコーシーケンスは、信号を局所化するための勾配を含むパルス取得測定です。(1) スライス選択勾配は、スライス内の磁化を励起するために、周波数選択パルスと共に適用されます。(2) スライス選択勾配は磁化を分散させるため、取得前にそれを再収束させるためのスライス再収束勾配が適用されます。(3) 位相エンコード勾配は、磁化を位相エンコード方向に移動させます。(4) 読み出し勾配とは反対の読み出し再位相勾配が、k空間の一方の端に移動するために適用されます。(5) 読み出し勾配は、読み出し方向のk空間を介して信号を移動させます。
B: k空間データは左に示されており、読み出し勾配と位相エンコーディング勾配によってカバーされた経路が示されています。k空間データの変換により、右に示す画像が生成されます。
T1強調画像、注入造影剤、およびT2強調画像
T1ベースのコントラストは、スピンが静磁場に再整列する速度の差を利用します。T1強調は、外因性薬剤の注入を含む様々な方法で利用されますが、一般的な非侵襲的アプローチは反転回復(IR) であり、CSFの長いT1を持つ画像の領域をヌル化(黒くする)ようにタイミングが設定されます。IR画像化は、検出可能なXY磁化がZ磁化からしか作成できないという原則に基づいて機能します。これは、CSFにおけるZ磁化の除去が、CSFを含む領域の信号源を排除することを意味します。180度パルスが磁化に適用されると、正味の磁化は反転し、直ちに磁場との整列に戻り始めます。白質のT1が最も小さいため、白質の磁化が最初に回復します。CSFのT1が最も長いため、その磁化の回復が最も遅く、Z磁化が0に達する点付近で画像が取得されると、CSFは画像で黒く見えます。灰白質は中間的なT1を持つため、その値は検出できるほど回復しますが、白質ほどではありません。灰白質は白質よりもかなり暗く見えます。図1.25-9にそのような画像を示します。T1強調画像は、体積研究を含む構造解析に一般的に使用されます。
T1ベースのコントラストを得るもう一つの方法は、注射可能な薬剤を使用することであり、そのほとんどはガドリニウムを含んでいます。造影剤は血液を通過しますが、健康な血液脳関門(BBB)は通過しません。分子内に閉じ込められたガドリニウムは、その周囲の水中の水素原子核のT1を減少させ、出現する場所の画像強度を明るくします。一部の腫瘍のようにBBBが破壊されている場合、ガドリニウム薬剤は異常組織に容易に浸透し、その領域は画像で明るく見えます(図1.25-11)。
水信号のT2減衰による信号損失は、白質や灰白質と比較してCSFを強調するために使用できます。これらはエコー遅延中に信号が著しく速く失われます。T2強調画像は通常、スピンエコータイプの画像を使用します。これは、XY磁化を作成するための励起パルスと、励起パルス後の時間とともに進行するT2減衰を追跡するための1つ以上の180度パルスを組み合わせたものです。多発性硬化症の場合(図1.25-12)、脳室、脳溝、および病変内の液体のポケットは、他の組織よりも長いT2値を持っています。長いエコー遅延を使用すると、灰白質と白質からの信号は最大値の50%以下に減衰しますが、液体からの信号は強く残ります。
T2強調画像の欠点の1つは、灰白質と白質間のコントラストが低いことです。しかし、利点としては、T2強調に用いられる画像シーケンスの種類が、通常、耳道や副鼻腔の近くの画像を暗くするT2*損失と呼ばれる不均一性関連の信号損失を排除することです。T2強調に用いられるシーケンスはこの挙動を回避します。
ほとんどのMR画像は構造を評価するために取得されます。担当医は、図1.25-11と図1.25-12ですでに示されているように、腫瘍や多発性硬化症の確認に関心があるかもしれません。その他の一般的な臨床目的は、萎縮や脳奇形の検出です。構造MRIの分野で、現在の研究ツールの地位を超えて発展する可能性があるのは、体積分析です(図1.25-13)。手動と自動の両方で様々なアプローチが存在しますが、その目的は脳領域の体積を測定することであり、多くの場合、白質と皮質組織を個別に定量化します。研究の具体的な目標は、通常、前頭葉、海馬、または脳梁など、様々な脳構造の体積に関して特定の患者集団を特徴付けることです。
拡散MRI
水の拡散性は、MRIのコントラストメカニズムを提供することができます。最も一般的な形式である拡散強調画像(DWI) は、水の拡散性に基づいて各画像ピクセルの信号を減少させます。信号が減少するプロセスはT2*減衰のそれと類似しています。勾配は、強い空間依存性を持つT2*の人工的な源として使用されます。スピンエコー型のシーケンスが、再収束パルスの両側に拡散勾配をオンにして適用されます。勾配間でほとんど拡散しない原子核は同じ磁場強度を経験し、スピンエコーによって再収束されますが、勾配の方向に著しく拡散する原子核は2つの異なる磁場を経験し、不完全に再収束され、静止した原子核に見られるよりも少ない信号を生成します。DWIは、脳梗塞を囲む浮腫領域のように、一見正常に見える組織の異常を明らかにすることができます。浮腫のある領域は、組織構造が破壊され、より多くの液体で満たされている場合、水がより容易に拡散できるため、より大きな信号減少を示します。
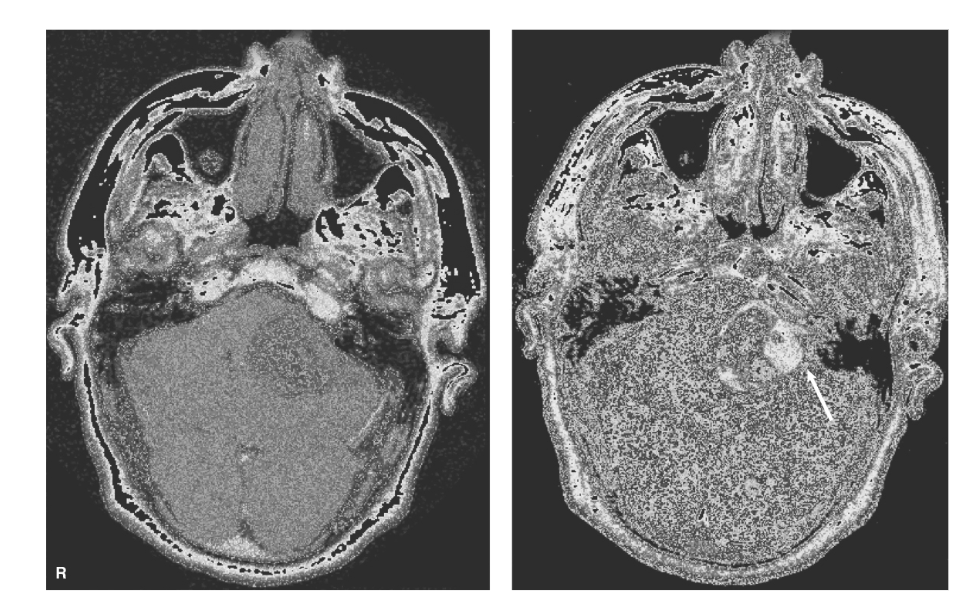
図1.25-11. 左小脳橋角部の聴神経鞘腫。
造影剤注入前のT1強調画像(左)は、左小脳橋角部に腫瘤を示しています。ガドリニウム造影剤投与後(右)は、血管が強調され、腫瘍は血液脳関門によって保護されていないため、部分的に嚢胞性であるとより明確に特徴付けられます。内耳道に造影効果が認められ(矢印)、聴神経鞘腫と一致しています。
水は脳内で全ての方向に均等に拡散するわけではありません。これは、微小環境が水の移動性を制限するためです。例えば、白質では、水は線維路の長軸方向に沿って横断方向よりもはるかに容易に拡散します。これは、拡散勾配と同じ方向に走る線維路は、拡散勾配の向きに垂直な線維よりも大きな信号減少を示すことを意味します。6つ以上の異なる方向に拡散勾配を適用することで、水の拡散の方向性、つまり拡散テンソルを各画像ピクセルで測定でき、拡散テンソル画像(DTI) が生成されます。
水の拡散方向の測定により、異方性度(fractional anisotropy) の測定が可能になり、これは組織構造の無秩序性の尺度を提供します。例えば、組織が高度に秩序化されている場合、水の拡散は制限され、無秩序な組織の場合よりも方向性が強くなります。DTIのより計算集約的な使用法は、ピクセルの連鎖を通じて拡散テンソルを追跡し、線維を追跡することから来ます。線維トラッキングは、解剖学的接続性の詳細な分析を可能にし(図1.25-14)、臨床的に大きな可能性を秘めていますが、今のところ研究ツールに留まっています。
血流の画像化
MRIは、臨床的に頭部の血流を画像化するために使用されます。医師は、脳の特定の領域における変性疾患と血流障害を区別する必要があるかもしれません。この目的のために、MRアンギオグラフィー(MRA) と灌流MRIが有用な情報を提供できます。図1.25-15の例は、タイムオブフライトアンギオグラフィーを示しています。これは、グラディエントエコー測定を使用して、流入する水が静止スピンよりも多くの磁化を持ち、周囲の組織よりも明るく見える画像を生成します。灌流を画像化する別の方法は、T1緩和を増強し、T1強調MRIの信号を増加させる血管内造影剤の注入を使用することです。造影剤なしでT1強調MRIを取得し、その後造影剤を投与して取得し、血流経路にある画像ピクセルは造影剤により明るく表示されます。
もう一つのアプローチは、動脈スピンラベリング(ASL) です。これは、画像スライスの外側の水中の原子核の操作と、それらの原子核が関心のあるスライスに到着した際の画像強度の変化の検出に基づいています。一つのアプローチは、ベースライン画像と、それに加えて、首の組織中の水(インバージョンパルスが適用されたときに動脈を上昇している水を含む)に負の磁化を生成するために反転パルス(スピンタグ付け)を適用する画像、の2つの画像を取得することです。脳のスライスを通して画像が取得されると、首から血液とともに流れてくる水は負の信号を持つことになります。2つの画像を互いに減算すると、静止した脳水を表すピクセルはゼロに近づきますが、血流経路にあるピクセルはベースライン画像のピクセルの最大2倍明るく表示されます。この方法により、造影剤を注入することなく血流をマッピングすることができます。
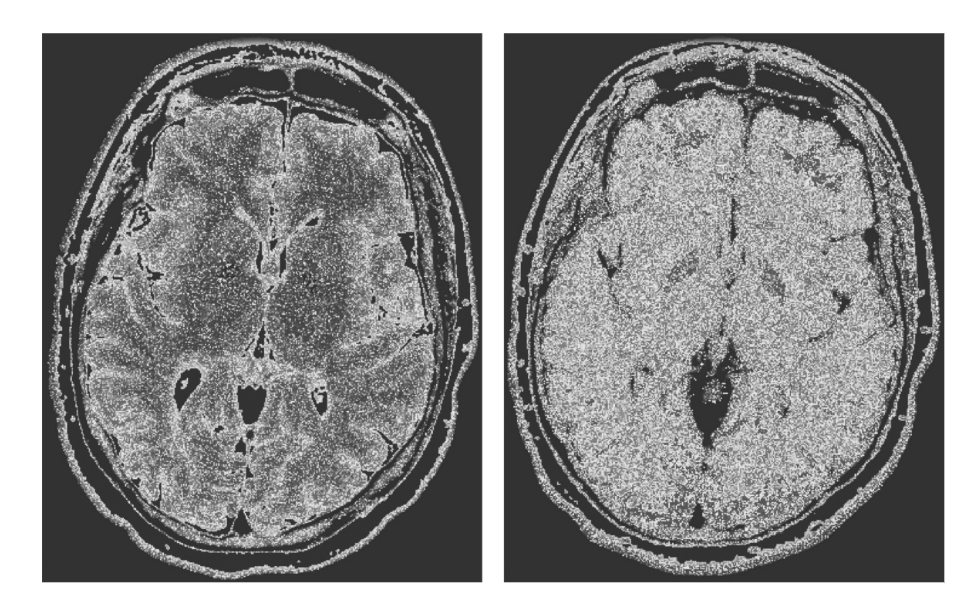
図1.25-12. 脳室周囲領域の多発性硬化症(MS)。
左: 高速スピンエコー画像は、脳溝や脳室内の脳脊髄液(CSF)を含む、大きなT2値を持つ物質を強調します。MS病変は強調されていますが、正常なCSFとの区別は困難です。脳室周囲のMS病変は、CSFの値よりも有意に低いT1値を持つため、T1強調を用いることで病変と液体を区別できます。
右: 高速スピンエコー、液体減衰反転回復画像(FLAIR)では、病変がより顕著に描出されます。FLAIRシーケンスは、T1緩和を利用してCSFからの信号を抑制する反転回復パルスを組み込んでおり、CSF空間に隣接する病変の検出を容易にします。
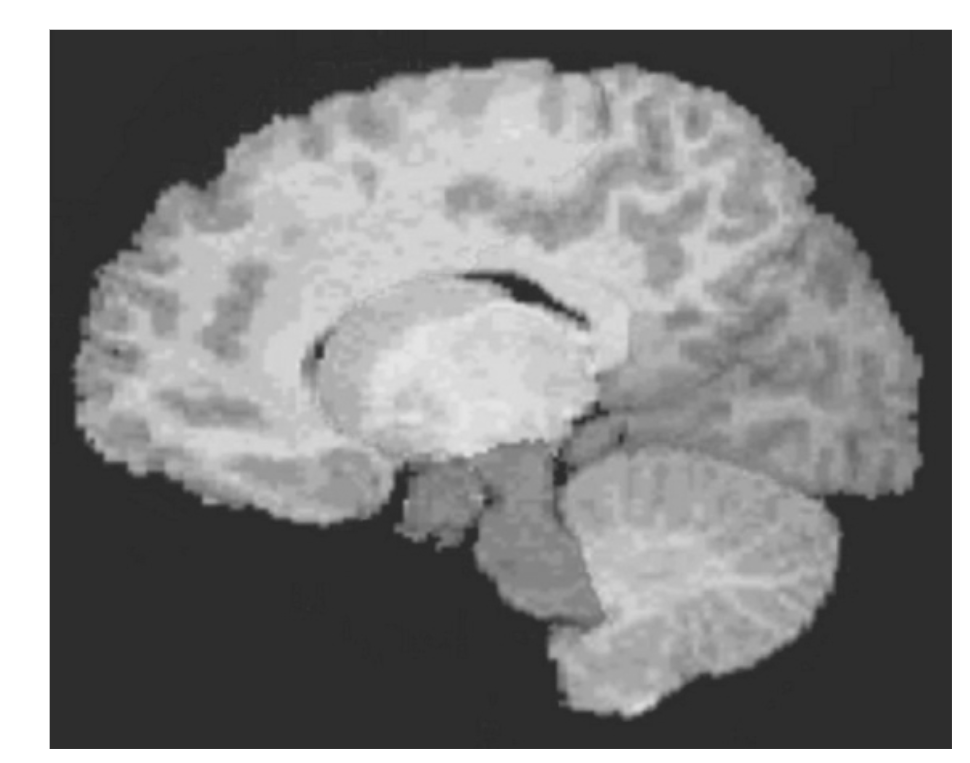
図1.25-13. 外傷後ストレス障害患者群における体積解析のために脳領域別にセグメント化された構造T1強調画像。
この研究では、全脳をカバーするために連続したスライス群が取得され、その後、解剖学的ランドマークが脳領域を区画するために使用されました。(アンドレア・ジャコウスキー博士、ブラジル連邦サンパウロ大学、およびジョーン・カウフマン博士、ジョンズ・ホプキンス大学医学部提供)
構造画像が精神医学に応用される可能性
これまで、精神医学における構造画像の臨床的有用性は、器質性脳疾患を除外することに限定されていました。しかし、この方法論は、いくつかの精神疾患に関連する病態生理学的メカニズムに関する現在の多くの理論を形成するのに役立つ情報を提供し、神経発達異常と神経変性異常の両方が様々な疾患に関連していることを示唆しています。疾患の理解に貢献するための画像診断の利用は、NIH(アメリカ国立衛生研究所)のRDoC(研究領域基準)の主要な部分を形成しています。
この方法論における最近の進歩は、この技術が間もなく一部の精神疾患の診断と予後において臨床的有用性を見出すかもしれないという期待をもたらしています。

図1.25-14. DTIから決定された線維トラクトを軸位視点で示しています。
拡散テンソルは、複数の方向への拡散強調画像を撮像することによりマッピングされました。数値積分技術により、ピクセルからピクセル、スライスからスライスへと拡散率の主方向を追跡し、脳内の線維を追跡しました。(マルセル・ジャコフスキー博士、ブラジル・サンパウロ大学、およびトッド・コンスタブル博士、イェール大学提供)
MRIの認知症への応用
認知症の診断は、記憶喪失やその他の認知障害を特徴とするいくつかの疾患を含みます。認知症に関連する最も一般的な疾患はアルツハイマー病であり、これはいくつかの皮質および皮質下辺縁領域におけるアミロイド斑と神経原線維変化の存在によって特徴付けられます。この疾患は、神経細胞およびグリア細胞の病理、ならびに全般的および局所的な脳萎縮と灰白質の喪失に関連しています。構造画像は現在、アルツハイマー病診断の臨床的に関連する要素として浮上し始めています。
米国国立神経疾患・脳卒中研究所-アルツハイマー病および関連疾患および精神疾患の診断・統計マニュアル第4版テキスト改訂版(DSM IV-TR)が用いる現在のアルツハイマー病診断基準は、診断プロセスにMRIデータを考慮していませんが、国立神経疾患・脳卒中研究所-アルツハイマー病および関連疾患診断基準を再評価するために開催された国際会議に基づいて発表された最近のポジションペーパーは、MRIをアルツハイマー病診断における補助的な特徴として診断的に使用することを提案しました。
サブコルティカル高信号域の増加、全身性萎縮、脳室拡大など、いくつかのMRI変化は正常な老化に関連しています。しかし、一部の変化はアルツハイマー病の診断により特異的であるように見え、疾患の診断と予後の策定に臨床的に有用である可能性があることがよく確立されています。内側側頭葉(MTL)萎縮のMRI所見は、この疾患と最も密接に関連しているようです。MTL萎縮はアルツハイマー病患者に極めて一般的であり、疾患の重症度に応じて**71〜96%**の割合で報告されています。MTL萎縮は、軽度認知障害(MCI)の早期段階でしばしば観察され、予後予測ツールとして有用である可能性があります。しかし、現在のMRI方法論に関連する感度と特異度は、予後画像化におけるその臨床的有用性を制限しています。アルツハイマー病および他の形態の認知症の診断と予後におけるMRIの臨床的有用性を改善するのに役立つ可能性のある1つのアプローチは、脳構造の経時的な変化率を追跡することです。
縦断的追跡調査では、前駆期アルツハイマー病の被験者における脳容量損失率が、正常な加齢に伴う減少(脳容量の年0.1%)と比較して有意に大きい(脳容量の年最大5%) ことが示されています。アルツハイマー病の診断におけるMRIの臨床的有用性を改善するのに役立つ可能性のある他の方法論的進歩も開発中です。海馬や内嗅皮質など、MTLの特定のサブ領域の容量を迅速かつ確実に評価する能力を向上させる方法は、いくつかの有望性を提供しています。最近のいくつかの研究は、MCI患者におけるMRI体積分析によって決定された海馬の容量損失が、その後の数年間におけるアルツハイマー病への転換を予測できることを示唆しています。これらの領域の特定のサブフィールドを評価する能力がさらに進歩すれば、研究の特異度と感度が劇的に向上する可能性があります。
これらの方法の例としては、皮質および皮質下の変性の複数の領域を同時に特定できる画像解析技術であるボクセルベース形態計測や、特定の皮質特徴を制約として使用し、被験者間の解剖学のマッチングをガイドして特定の脳領域の皮質灰白質厚に関する情報を提供する表面マッピング技術などがあります。これらの技術はすべて、今日では高磁場(3〜4T)および超高磁場磁石(7T以上)として考えられているものの開発によって部分的に支援されています。フルオロデオキシグルコース陽電子放出断層撮影(FDG-PET) のような他の測定を追加することによる精度の向上の可能性は有望性を示しています。これらの技術は元々神経科学研究のために開発されましたが、構造分解能の向上、さらにはイメージング顕微鏡の潜在的な応用を提供することにおけるその臨床的関連性が認識され始めています。
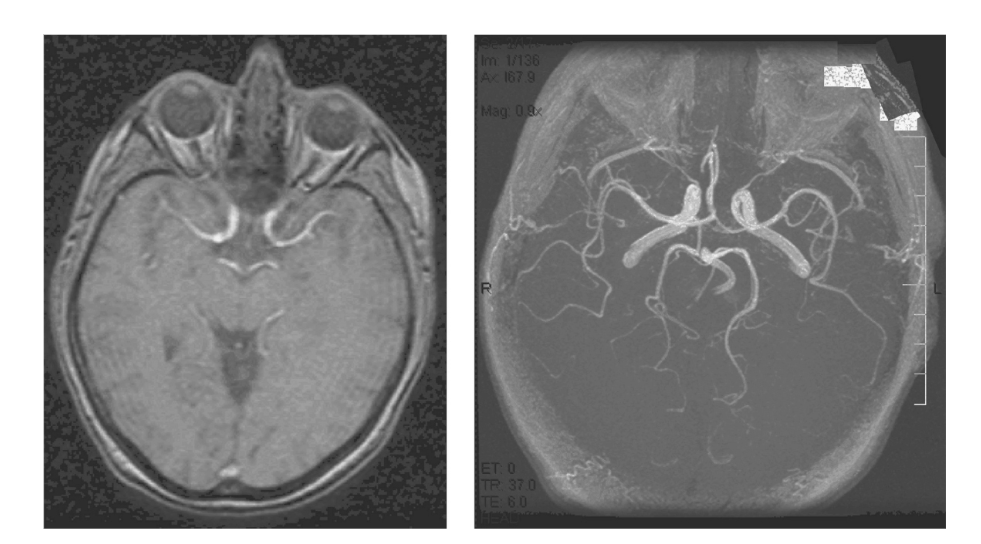
図1.25-15. タイムオブフライト(TOF)アンギオグラフィーによる血管系の画像化。
左: 血管以外の原子核からの信号を飽和させる高速繰り返しで画像が取得され、それにより流れる血液以外の組織からの信号が減少します。
右: 信号強度が増強された画像領域を選択するように処理された後、流れる血液が特定されます。
DTI研究では、MCI(軽度認知障害)およびアルツハイマー病患者において、前頭葉、側頭葉、頭頂葉の白質における拡散テンソル変化が認知機能と相関していることが特定されています。他の最近の研究では、アルツハイマー病およびMCI患者の正常に見える白質においても関連する微細構造変化が発見されていますが、異方性度(fractional anisotropy)は疾患に対して特に感度が高くないかもしれません。これらの変化は、アルツハイマー病における前頭葉および側頭葉領域の軸索プロセスの仮説上の喪失と一致しています。
MRIの統合失調症への応用
構造的神経画像研究は、統合失調症患者における皮質発達異常の最も重要な証拠のいくつかを明らかにしました。初期の研究では、一貫した脳室拡大、総皮質容量の減少、特に前頭葉および側頭葉皮質領域における局所的な容量欠損が報告されました。この規則に対する一貫した例外は線条体であり、そこでは定型抗精神病薬による治療が、健常被験者または未服薬患者と比較して、患者の容量増加を引き起こします。MR画像内で皮質灰白質と白質を分離するセグメンテーション技術の適用により、両方の組織コンパートメントが患者において局所的な欠損を示すことが明らかになりました。より新しい技術の適用により、研究者たちは患者における異常な皮質回旋、湾曲、および皮質厚の減少を記述することが可能になりましたが、現在までのところ、異常は個々の患者を健常対照被験者から識別するには不十分です。
構造MRIはまた、統合失調症の遺伝的リスクの特徴付けにも有用です。統合失調症は、遺伝率が70%から90%と関連しています。この見解と一致して、統合失調症患者の家族は、統合失調症に関連するものと類似しているがより軽度な皮質灰白質および白質の容量減少のパターンを示します。個々には非常に小さな効果を持つ一般的な遺伝子変異に基づく統合失調症のポリジェニックリスクの程度と、統合失調症リスクに大きな影響を与える稀な変異の両方が、MRIで測定される脳構造変化と関連しています。
構造MRIはまた、この疾患の進行性経過と抗精神病薬治療の影響に関するいくつかの洞察を提供しています。最も顕著な発見は小児期発症統合失調症に見られ、様々なMRIアプローチ(特定の関心領域、自動ボクセルベース形態解析、変形解析(被験者内の変化を測定する非常に感度の高いアプローチ)を含む)を用いた一連の神経画像研究により、統合失調症の発症と進化が、健常対照集団と比較して局所的な皮質容量の進行性の逸脱と関連していることが明確に示されています。統合失調症の前駆期症状、「超高リスク」状態、または初回エピソードの思春期および若年成人では、慢性統合失調症に関連する変化の多くがすでに存在しています。CT画像からの以前のデータとは対照的に、慢性統合失調症の成人における研究の数が増加しており、この疾患の段階でさえ、年齢をマッチさせた健常被験者の時間依存的容量減少と比較して、多くの皮質領域で微妙だが進行性の皮質灰白質および白質の容量損失があることを示しています。ほぼすべての統合失調症患者が何らかの薬物療法を受けている時代において、研究は、疾患に関連する皮質容量変化の長期的な軌跡と、数十年間の治療を通じて現れる可能性のある抗精神病薬の長期的な効果を区別するという課題に直面しています。この点において、一部のデータが、一部の「第二世代」または「非定型」抗精神病薬による治療が、短期(つまり1〜2年)の皮質容量減少の進行、または統合失調症患者における定型抗精神病薬治療関連の基底核容量増加を減少させる可能性を示唆していることは興味深いことです。これらの種類の研究が、将来の統合失調症薬物療法の神経保護効果を明らかにする可能性に期待が寄せられています。
DTIは、統合失調症に関連する多くの主要な白質経路の組織化と完全性の障害を特徴付けようとする研究の数が増加しています。DTIは水分子の動きを測定するため、神経突起とその関連するグリア鞘が水の正常なランダム拡散に与える制約効果、および神経およびグリアの完全性の障害の影響に特に敏感です。統合失調症におけるDTI所見には、(1) 異方性の程度の異常(特定のボクセル内での水分子の移動方向の組織化の欠如)が含まれ、これはおそらく皮質白質経路の完全性または分岐度の変化を反映しています。(2) 総拡散率の減少(特定のボクセル内の総水移動量)は、異方性に関連し、白質経路の完全性に関連する従属尺度です。(3) DTIトラクトグラフィーを用いて特定された特定の白質経路のサイズ、完全性、または分岐度の減少。標準的な技術では、局所の樹状突起野、局所の軸索経路、および遠隔ニューロンからの収束入力の寄与を区別することはできません。
MRベースの灌流研究は、統合失調症に関連する皮質灌流欠損を記述する上で、主にPET(陽電子放出断層撮影)およびSPECT(単一光子放出コンピュータ断層撮影)などの他の技術を補完し始めています。統合失調症に関連する灌流および代謝欠損のPET研究の初期の世代は、統合失調症が安静時の**「前頭葉機能低下(hypofrontality)」、すなわち前頭皮質構造の代謝または灌流の相対的な欠損に関連しているという印象を与えました。しかし、この第一世代の研究の注意深いレビューは、統合失調症に関連する安静時の前頭葉機能低下の性質や妥当性に関する確固たる結論をもたらしませんでした。より最近では、PET、SPECT、およびMRベースの灌流研究が、統合失調症に関連する課題関連の局所的な皮質灌流の変化**を特徴付けるために使用されています。MRベースの灌流研究が提供する新しい機会は、絶対的な灌流定量化の可能性を活用することであり、これは、ベースラインの差がある可能性があり、Echo-Planar Imaging(EPI)と血液酸素レベル依存性(BOLD)コントラストのような半定量的な画像技術では評価できない場合に、被験者間またはテスト日間で比較する際の解釈エラーを減少させることです。統合失調症における皮質灌流の研究は、ニコチンの場合のように、神経およびグリア機能の変調に関しても興味深い可能性のある物質の潜在的な直接的な血管効果を評価するのに役立っています。
MRIの気分障害への応用
より大きな脳領域を評価した古いMRI研究では、側脳室拡大という漠然とした報告を除いて、気分障害に関連する再現可能な所見はほとんどありませんでした。しかし、脳の特定のサブ領域を調べたより最近の所見は、基底核、視床、海馬、前頭葉、眼窩前頭皮質、直回を含むいくつかの脳領域で、より小さな容積という興味深く再現可能な所見をもたらしました。おそらく、気分障害研究分野へのMRIの最大の貢献は、大うつ病性障害(MDD)を患う個人の海馬容量の減少を示した研究です。海馬の容量測定は、いくつかの神経精神疾患で研究されてきました。海馬容量の減少は、てんかん、パーキンソン病、ハンチントン病、クッシング病、アルツハイマー病、外傷性脳障害、アルコール依存症、強迫性障害(OCD)、および統合失調症で報告されています。MDDの研究を特徴づける研究の異質性(年齢、性別、病気の期間、治療への反応性)によって導入された交絡因子にもかかわらず、2004年の12のMRI研究のメタ分析は、MDD患者の両半球で海馬容量の有意な減少を明らかにしました。左で平均8%、右で10%の減少が報告されています。他の証拠は、エピソードの総数、病気の期間、および小児期の虐待への曝露が、MDDに関連する容量減少の程度にさらに貢献する可能性があることを示唆しています。このデータは、グルココルチコイド受容体活性化、低酸素症、およびグルタミン酸神経伝達のレベル上昇を伴うストレス誘発性海馬毒性のモデルの強力な支持として解釈されてきました。しかし、最近の研究では、家族性うつ病の小児患者も海馬容量が減少していることが示されており、海馬容量の減少がMDD発症のリスク因子を示唆している可能性が示唆されています。
前帯状回は、気分障害に関連する有意な異常の所見により、大きな注目を集めているもう一つの領域です。構造MRIは、ある研究で、家族性双極性うつ病患者と家族性単極性うつ病患者の両方において、脳梁膝腹側の前頭前野の平均灰白質容量が39%および48%減少していることを示しました。この所見は後の構造画像研究で一貫して再現されていませんが、機能画像研究ではこの脳領域に一貫して異常が発見されており、組織学的研究ではこの領域で有意なグリア細胞の減少がさらに特定されています。
海馬や前帯状回を含む、感情処理をサポートする神経領域の構造的異常のパターンは、最近、MDDと双極性障害(BPD)を区別することが判明し、多変量パターン分類技術が将来の診断補助として有望である可能性を示唆しています。認知症の場合と同様に、より高い磁場強度と海馬サブフィールドの改善された測定を可能にする他の方法を用いた将来の研究は、現在使用されている方法よりも著しい利点を提供する可能性が高いです。
扁桃体に関しては所見が依然として決定的ではありません。いくつかの研究は扁桃体容量と気分障害の間に関係がないと報告している一方で、他の研究は健常対照被験者と比較して気分障害被験者において扁桃体容量の増加または減少のいずれかを発見しています。他の研究では、気分障害に関連する基底核の形態計測的異常を定義しようと試みています。MDDに関連する基底核容量の潜在的な減少とBPDに関連する潜在的な増加を示唆するいくつかの証拠がありますが、一般的にデータは決定的ではありません。7Tのような高磁場磁石による最近の進歩は、相異なる結果を明確にする可能性があり、場合によっては双極性精神病を統合失調症から区別する方法を提供する可能性さえあります。
晩期うつ病の分野では、構造MRIの所見は研究の方向性を導く上で大きな影響を与えてきました。白質高信号病変(WMHs) は、T2強調画像で特に顕著な信号強度の増加した領域です。上記で述べたように、これらは一般的に老化と関連しており、虚血、高血圧、髄鞘蒼白化、炎症性疾患、アミロイドーシス、およびその他の原因に関連する多様な神経病理学的根拠を反映していると考えられています。WMHsは、脳に対する血管リスク因子の影響の研究における重要なマーカーと見なされ、慢性脳虚血の主要な特徴として一般的に解釈されています。晩期うつ病、特に遅発性うつ病の個人におけるWMHsの有意な増加の一貫した所見は、MDDの病因的に異なるサブタイプを示唆しています。これらの所見は、脳血管疾患に起因する白質病変が前頭線条体回路内の線維路を破壊するという晩期うつ病の脳血管仮説を裏付けてきました。
最近の研究では、白質変化が遅発性うつ病の発症に先行すること、そして年齢、ベースライン認知機能、およびうつ病症状を調整した後でも、変化の重症度が翌年のその後のうつ病症状を予測することが示唆されています。これは因果関係の主張を支持するものですが、実際のWMHsの位置と側性化が晩期うつ病の病因にどれほど重要であるか、またはそれらが単に進行中の血管疾患のマーカーであるのかどうかは、まだ決定されていません。現在開発中のWMHの将来の標準化された自動評価システムは、臨床診療におけるこのモダリティの使用を大いに促進するはずです。
MRIのアルコール依存症への応用
MRI研究は、アルコール依存症に関連する多くの神経毒性の原因を生体内で記述する主要なツールとなってきました。これには、(1) エタノールの直接的な神経毒性およびグリア毒性効果、(2) アルコール乱用にしばしば伴う栄養不良の神経毒性効果、(3) エタノール離脱状態に関連する興奮毒性、および (4) 成人の神経新生関連のエタノール中毒および離脱における潜在的な障害が含まれます。これらの研究は、アルコール依存症に関連する全体的な神経毒性における顕著な年齢依存性を記録しています。思春期のアルコール依存症は、皮質容量の顕著かつ持続的な減少と関連しており、これはアルコール依存症の家族歴またはアルコールへの曝露に関連する神経発達プロセスの障害を示唆しています。健常な若年成人では、注意深い研究は、ほとんどの大量飲酒者には存在しないかもしれないエタノールの比較的微妙な神経毒性効果があることを示唆しています。しかし、「中年」の開始とともに、そしてその後も進行的に、アルコールへの累積的な曝露とアルコール離脱の繰り返しが進行するにつれて、アルコール関連神経毒性への進行性の感受性が現れるようです。この毒性は灰白質と白質の両方の損失として反映され、これらの損失は認知障害と関連しているようです。灰白質の微細構造は最初に変化すると報告されており、損傷は早期に飲酒する人の方が重度である可能性があり、これは早期の大量飲酒者が後に飲酒を開始する人よりも大量に飲酒する傾向があるためかもしれません。DTI研究は、アルコール依存症に関連する白質経路の完全性の障害の証拠を提供しています。容量変化は、栄養欠乏に起因するウェルニッケ・コルサコフ症候群の患者で特に重度です。一般に、長期的な禁酒により、容量損失の段階的かつ部分的な回復が見られます。つまり、数ヶ月でより急速な容量回復フェーズがあり、数年にわたって回復が継続します。白質は灰白質よりも早期の回復の証拠を示しますが、再発は白質損傷を加速させます。構造MRI研究は、アルコール依存症と禁酒の開始に関連する脳の容量変化がそれぞれ脳の脱水と再水和を反映するという初期の仮説を反証しました。
機能的MRI(fMRI)の方法論
脳機能はエネルギーを消費し、それは酸素と栄養素を組織に運ぶ血流によって供給されます。脳機能の変化は、血行動態と血液酸素化の変化につながり、そのような変化はMRIによって検出される磁化に影響を与えます。これらの効果は、酸素化ヘモグロビンと脱酸素化ヘモグロビンの磁化率を介して、局所的なT2*効果を介して媒介されます。脱酸素化ヘモグロビンは、その付近の磁場均一性を乱しますが、酸素化ヘモグロビンはそうではありません。脱酸素化ヘモグロビンレベルが増加すると、血液付近の信号は減少し、脱酸素化ヘモグロビンが低いと、血管周辺でより大きな信号が得られます。これにより、BOLD(血液酸素レベル依存性)コントラストの現象が生まれます。
2つ以上の条件下で一連の画像が取得され、異なる機能的または薬理学的課題が使用される場合、この技術はphMRIと呼ばれることもあり、脳機能の変化は画像強度の増減として検出されます(図1.25-16)。
脳機能は血行動態および血液からの酸素抽出と関連しているため、酸素化ヘモグロビンのレベルは脳機能に依存します。逆説的ですが、脳活動が増加すると、脱酸素化ヘモグロビンの割合は減少します。これは、血流が非常に劇的に増加し、酸素抽出を上回るためです。そして、血管付近のMR信号は上昇します。したがって、例えば、ある条件下でMRIデータが取得され、その後、患者が9番領域で酸素抽出を増加させる認知課題を行っている間に、9番領域の信号は高くなり、通常1%以下の増加が見られます。もし9番領域の利用を減少させる認知課題が選択された場合、2番目の画像は9番領域で数パーセント暗くなります。
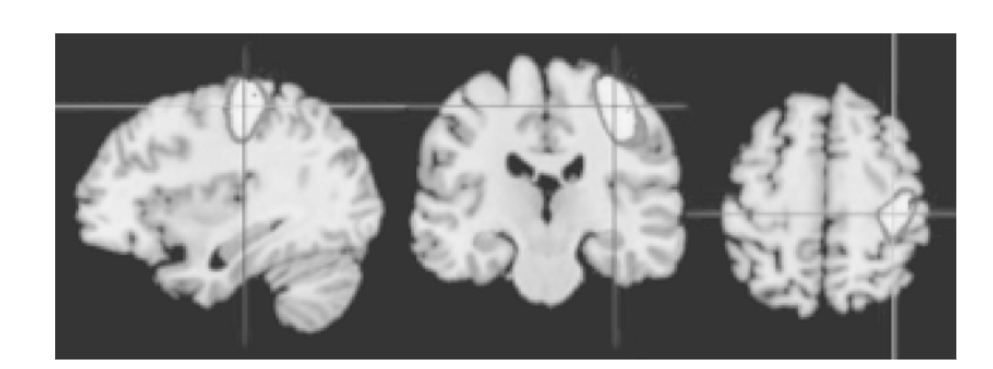
図1.25-16. 右手運動中の3T機能的MRI画像(矢状面(左)、冠状面(中央)、軸位面(右))。
T1強調画像は解剖学的同定のための表示の基盤を形成しています。手が静止状態と運動状態を交互に行う一連の画像が取得され、その後、画像群が比較され、手運動中に統計的に有意な信号変化を示した領域が特定されました。左運動野が活性化を示し、最も強度の変化があった領域が強調表示されています。
機能的磁気共鳴画像法(fMRI)は、しばしば単に血液酸素化や血流を反映すると言われますが、fMRIのコントラストは、その特異性の程度が異なる様々な要因に依存します。そのメカニズムは、血管の直径、血液量、血流速度、血液中の脱酸素化ヘモグロビン量、スキャンに使用される磁石の強度、およびMRI取得方法に依存します。
20 µmよりも大きな血管の場合、脱酸素化ヘモグロビンからの信号減少を支配するのは静的脱位相です。静的脱位相は、血管周囲の組織中の水における脱酸素化ヘモグロビンの近接性に起因し、スピンエコー型のMRIシーケンスにおける再収束パルスによって除去することができます。毛細血管床やその他の小さな血管の場合、支配的なメカニズムは血管内動的脱位相と血管外動的脱位相です。これらは、水分子が脱酸素化ヘモグロビンを囲む歪んだ磁場の領域をランダムに移動するときに発生します。血管内動的脱位相は活性化に関する情報を提供しますが、その信号は必ずしも活性化部位に位置するとは限りません。血管内動的脱位相は1.5TでBOLD応答を支配しますが、磁場強度が増加するにつれてその影響は徐々に小さくなります。7Tのような高磁場では、血管内動的脱位相からの寄与はごくわずかです。これらのメカニズムからの信号変化の程度は、各血管の静磁場B0に対する向きにも影響されます。毛細血管床におけるランダムな向きは、B0のランダムなシフトを生じさせ、それが平均化されると特定の画像ピクセルの信号を減少させます。より大きな血管は、信号を減少させる正味の位相変化をもたらしますが、それは向き依存的な方法でそうします。スライスの厚さをまっすぐに横切って流れる大きな血管における酸素化の変化は、スライスの平面に沿って流れる同じサイズの血管のそれとは異なるfMRI変化をもたらします。異なるスライス向きは、同じ機能的課題でも異なる程度のfMRI信号変化をもたらす可能性があります。
fMRIにおけるもう一つのコントラストメカニズムは流入(inflow) です。fMRI研究中、各画像スライス内の原子核は繰り返し励起され、繰り返しの励起は飽和につながります。つまり、一連の高速スキャンから観測される信号は、最大Z磁化への完全なT1緩和に十分な時間が確保されていないため、小さくなります。この飽和は、励起された原子核、すなわちスライス内にあり、スライス内に留まる原子核のみで発生します。スキャン間に血流によってスライス内に運ばれる原子核は飽和を経験していないため、より大きなZ磁化を持っています。これらは、その常駐する原子核よりも単位体積あたりにより多くのZ磁化を寄与します。スライス内の磁化が飽和しているほど、流入コントラストの影響は大きくなります。流入コントラストは、より速いスキャン繰り返しとより大きなスライス励起角度が使用される場合に大きくなります。血流が増加すると、到着するスピンはスライス励起の影響をあまり受けなくなるため、血流の増加はfMRIスキャンにより大きな信号を寄与します。血流を増加させるあらゆる影響は、血管からの信号強度を増加させますが、これは活性化された組織の領域にある場合とない場合があります。したがって、流入コントラストはfMRIマップに非特異的な変化を寄与します。
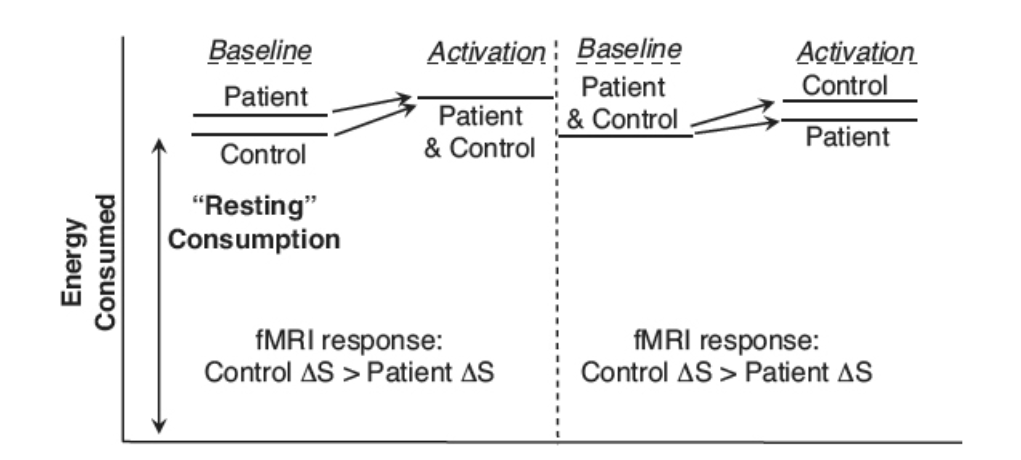
図1.25-17. 機能状態の変化が脳のエネルギー利用に及ぼす相対的変化とfMRIへの影響。
覚醒したヒトのベースライン状態は、高レベルの神経活動、血流、および代謝に対応します。脳機能の変化は、典型的には脳のエネルギー利用のわずかな変化、結果としてfMRI画像振幅のわずかな変化として現れます。fMRIは大きなベースラインに対する相対的な状態を反映するため、fMRI応答の解釈にはベースラインの状態を考慮する必要があります。
左: 患者は対照被験者よりも高いベースライン活動を持ち、機能的課題が両方を同じエネルギー状態にシフトさせると、患者は対照被験者よりも小さなfMRI応答を示します。
右: 患者と対照被験者は同じベースラインエネルギー利用を持っていますが、対照被験者は患者よりもエネルギー消費を多く増加させるため、この場合も患者は対照被験者よりも小さなfMRI応答を示します。
あいまいさにつながる可能性のある他の要因は、疾患または薬理学的介入によるエネルギー需要に対する脳血管結合の差異です。
fMRI信号の変化が評価された後、追加の要因を考慮する必要があります。それはベースライン画像の意味です。健常な成人では、記憶課題を行っている間、背外側前頭前野(DLPFC)の信号振幅が1%増加するかもしれませんが、患者では同じ課題に対して同じ領域で2%の増加を示すかもしれません。どちらの場合も、神経細胞のベースライン活動は、脳波(EEG)、灌流、代謝測定など、様々な関連するパラメータに関して有意です(図1.25-17)。
一つの解釈は、患者の神経回路は効率が悪く、同じ作業を行うためにより多くのエネルギーを必要とするということです。同様に妥当な説明は、患者が健常者よりもベースライン活動が少なかったが、課題が開始されたときに、患者のDLPFCの同じ領域が正常に機能し、同様の量のエネルギーを使用したというものです。どちらの場合も、異常が特定されていますが、根底にある病理の理解は解釈によって異なります。課題が薬理学的なものである場合、薬物(急性または慢性の喫煙、多量飲酒など)が脳血管系に与える潜在的な影響が、組織の機能的需要とは独立して存在するという、さらにもう一層の複雑さを考慮する必要があります。
まとめると、多数のコントラストメカニズムは、fMRIマップをその取得方法、スライス方向、磁場強度、および脳血管系に対する薬理学的影響に関して考慮する必要があることを示しています。観察される変化の意味と量を評価する際には、様々なコントラスト源を考慮しなければなりません。
精神医学におけるfMRIの応用
fMRIは、複雑な認知、感情、および知覚プロセスの神経相関を研究するために使用できる非侵襲的な神経画像技術です。fMRI研究は、肉眼的な脳構造が保たれているが脳機能の障害が存在する精神疾患に関連する病態生理学の現在の理解を進める上で、計り知れない可能性を秘めています。症状、認知バイアス、および感情応答の神経相関を明らかにすることにより、fMRI研究はすでに、認知症、気分障害、不安障害、精神病性障害、および嗜癖性障害の病態生理学、ならびにこれらの状態に対する精神薬理学的治療のメカニズムを解明するために使用されてきました。現在までのところ、診断または治療の決定に情報を提供するためのfMRIの臨床能力は確立されていません。fMRIによって特定された異常は、これまでのところ、個々の患者を健常被験者または他の疾患の被験者から識別するのに十分な感度と特異度を欠いています。しかし、定量的fMRIのような分野における将来の進歩により、この技術が最終的に、研究と臨床診療の両方を改善するために使用できる、病態生理学に基づいた精神医学的表現型の分類へと道を拓くことが期待されています。そのような研究の例を以下に示します。
認知症のfMRI
fMRI方法は、アルツハイマー病および他の形態の認知症の研究、診断、および予後に潜在的に使用できる情報を提供するとともに、正常な加齢に伴う認知処理の変化に関する洞察も提供します。加齢が、より弱く、より拡散した活性化、ならびに半球間偏りの減少と関連しているという証拠は、失われた局所的強度の補償または処理の脱分化のいずれかを示唆しています。より弱い活性化、特に前頭前野の活性化は、加齢に関連する潜在的な符号化段階の機能不全を示唆しています。神経変性疾患で発生するこれらのプロセスの変化は、正常な老化の経過に重ね合わされるように見えます。fMRI研究は、アルツハイマー病患者が、認知機能が損なわれていない高齢者と比較して、新しい記憶の符号化中に海馬およびMTL内の関連構造においてfMRI活性化の減少を示すことを一貫して示しており、これにはデフォルトモードネットワークと呼ばれるものの変化も含まれます。より最近では、結合PET/構造およびfMRI研究により、連結性の低下がより多くの白質病変とより大きなアミロイド負荷に関連していることが明らかになりました。これらの集団におけるfMRI研究の利用を検証するためには、特に縦断研究が必要であり、前駆期アルツハイマー病の経過における機能的活動の変化のパターンと、アルツハイマー病の病理との関係を調査する必要があります。考慮すべき主要な要因は、加齢および疾患に関連する血管系の変化が、fMRIによる神経機能の表現にどのように影響するかです。
統合失調症のfMRI
fMRIは、統合失調症の発症リスク、統合失調症に関連する症状と認知障害、および抗精神病薬治療の影響に関連する、特定の脳領域と特定の回路における障害を調査するための主要なアプローチとして浮上しています。PubMedによると1987年以来8,700以上の関連論文が発表されており、fMRIの範疇に含まれるMRベースのアプローチの範囲、および皮質活動を刺激するために使用されてきた膨大な範囲の認知テストを考慮すると、統合失調症のfMRI研究の包括的なレビューは、このレビューの範囲を超えています。
低周波皮質連結性の研究
fMRIによって評価される脳領域の機能的連結性の研究は、統合失調症患者において白質路の組織と完全性が損なわれているというDTI研究から明らかになっている構造的証拠を補完します。これらの研究では、機能的連結性は、長期間にわたる安静時の脳領域間の皮質活動の共分散を定量化することによって評価されます。
統合失調症に関連する知覚および認知の変化のfMRI研究は、MRI、DTI、および機能的連結性研究から浮かび上がっている中心的な仮説を支持しています。すなわち、広範な局所的な脳機能活性化の変化が存在し、それが知覚および注意、学習と記憶、判断を含む高次認知機能に関連する回路活性化の正常なパターンを乱すというものです。ここでは、この研究に関連する神経画像の問題が議論されます。この研究の一般的な仮定は、これらの局所的な脳活性化の変化が、統合失調症に関連する知覚および認知プロセスの障害の根拠を構成するというものです。この仮定はおそらくこれらの研究に一般的に当てはまりますが、EPI-BOLD画像化は実際には神経活動を直接測定するのではなく血流と容量の変化を測定しており、前述のように、現在の臨床研究画像化(通常3T)は、それが測定しようとするプロセスに対して控えめな時間的および空間的分解能しか持っていません。したがって、これらの研究が、fMRIの分解能を超える空間的および時間的特性で主に発生する神経およびグリアプロセスの間接的な測定値、すなわちバイオマーカーを提供するものと仮定する方がより正確です。追加の複雑さは、課題の要求と回路活性化を刺激するその能力との関係がしばしば非線形であるということです。つまり、逆U字型パターンに従います。この問題は、統合失調症におけるワーキングメモリー欠損の研究で浮上しました。そこで最初に、ワーキングメモリーに要求を課す課題を実行する際に、患者が前頭前野の活性化の減少を示すことが示されました。後に、段階的な難易度の課題を使用すると、患者は実際には簡単な課題に対して健常被験者と比較して前頭前野の過剰活性化を示しましたが、健常者が前頭前野の活性化のさらなる増加を示しているときに、中程度の難易度の課題に対して機能的活性化欠損を示し始めました。
統合失調症のfMRI研究の解釈に関連するいくつかの追加の課題があります。第一に、脳構造の広範な障害のため、根底にある異常を、異常に機能する構造に帰属させるのは困難であり、その入力に帰属させるのは困難です。この制限は、階層的または「ボトムアップ」方式で組織化された認知機能に深刻な影響を及ぼします。つまり、判断は記憶に依存し、記憶は注意と知覚に依存します。しかし、これらのプロセスには実行機能または「トップダウン」制御も存在します。つまり、期待したり探したりする刺激を知覚し記憶するのに私たちはより効果的です。この観点から、統合失調症の「中心的な」認知障害を特定し、特定の認知障害を特定の脳領域に帰属させようとする試みは、困難な課題です。第二に、回路機能不全のため、統合失調症の個人は課題の成績が悪いかもしれませんし、聴覚障害を持つ個人が読唇術を学ぶのと同様に、統合失調症ではない個人とは異なる方法で特定の課題を成功裏に実行するかもしれません。成績不全に関して、研究は通常、統合失調症の有無にかかわらず個人が成功裏に実行できる課題を選択します。しかし、成績欠損自体に関連する多くの疑問があります。この場合、研究はしばしば段階的な難易度の課題を使用して、課題の難易度、皮質活性化、および成績の関係が決定できるようにします。第二の問題に関して、統合失調症の有無にかかわらずの人々の間の乖離が、主要な回路機能不全から生じるのか、それともこれらのグループが同じ種類の問題を解決するために傾向的に使用する異なる戦略から生じるのかを知ることは非常に困難です。これは機能的神経画像化にとって重要な問題であり、それは人々が何をするのか、そしてどのようにそれを行うのかという構造を定義する必要性を浮き彫りにします。これらの問題を完全に制御することはできないため、パフォーマンスを評価し、可能であれば戦略を評価することは有用かつ重要です。上記で概説した理由により、統合失調症に関連する回路機能不全をマッピングする試みはすでに困難ですが、認知プロセスにおける脳回路の関与は高度に状態依存的であり、したがって感情的覚醒のレベル、他の状態依存的プロセス(統合失調症の症状など)の影響、他の神経生物学的調節因子(治療薬の影響、乱用物質への曝露、および他の精神医学的および医学的併存疾患など)の存在によって異なるため、さらに困難になります。
気分障害のfMRI
気分や気分障害に関連する回路の様々な側面を調査した1,200以上のfMRI研究が報告されています。適応的な感情調節と認知を媒介する神経回路を調査する研究は、気分障害および不安障害の病態生理学の現在の理解を進める上で重要な役割を果たしてきました。過去10年間にPET、SPECT、およびfMRI分光法を用いて行われた機能画像研究は、感情的および認知的処理、ならびに気分調節の構造および機能相関に関するはるかに大きな理解を私たちにもたらしました。うつ病、躁病、および不安のエピソードに脆弱性を示す、または苦しんでいる個人は、認知処理の障害と、気分および情動を効果的に調節する能力の低下を示すようです。これらの所見は、疾患の神経生物学にとって特定の関心領域を特定する上で非常に有益であると考えられています。機能的脳画像研究は、感情的行動を調節する重要な神経回路を特定しました。以下のようないくつかの前頭辺縁系ネットワークが浮上しています。(1) 扁桃体、内側背側視床、および眼窩前頭前野および内側前頭前野からなる辺縁系-視床-皮質(LTC)回路、および (2) LTC回路の構成要素ならびに線条体および淡蒼球の領域を含む辺縁系-皮質-線条体-淡蒼球-視床(LCSPT)回路。回路内の様々な領域間の相互接続は、感情的応答を調節すると考えられています。
気分障害および不安障害の病態生理学に対するこれらのネットワークの寄与を研究するためにfMRIを使用することには、いくつかのユニークな利点があります。このモダリティは、他の方法論と比較して優れた空間的および時間的分解能を提供し、特定のネットワークを活性化し、個々の構造の相互接続をさらに解明するためのプローブとして機能する認知および感情的課題の統合を可能にします。しかし、測定値は常に脳活性化の他の測定値に対する相対的なものであり、脳活動の絶対的な測定値とは見なせないことを理解することが重要です。
病気の異質性と、探索に用いられた研究デザインの多様性に基づいて予想されるように、この方法は気分障害および不安障害を持つ個人のこれらのネットワークの機能に関して多くの矛盾した所見をもたらしていますが、これらの回路の機能障害がこれらの疾患の病態生理に貢献しているという合意が広まりつつあります。例えば、いくつかのグループは、感情的に重要な刺激の識別と信号伝達に関与する領域である扁桃体の活性化が、気分障害および不安障害と診断された被験者の感情課題遂行中に増加し、異常に持続することを発見しました。興味深いことに、異常な扁桃体活性化は、セロトニントランスポーター遺伝子の機能的プロモーター多型における短アレルを持つ健常者でも観察されており、これは、この遺伝子型に関連するストレス関連うつ病感受性の増加との潜在的な関連を示唆しています。
帯状皮質は、気分障害および不安障害患者において脳血流(CBF)および代謝の異常パターンを示すことが一般的に見られるもう一つの領域であり、視床およびいくつかの皮質領域から入力を受け、帯状束を介して扁桃体および内嗅皮質に投射しています。それは辺縁系の不可欠な構成要素として機能し、特に感情処理、学習、記憶、不適切な無意識下のプライミングの抑制に関与しています。帯状皮質下部(ACC)の活性化は、単極性および双極性うつ病において、対照サンプルと比較して繰り返し減少していることが測定されています。しかし、MRI研究によって特定されたこの領域の容量減少を考慮に入れると、この領域の残存組織は実際に相対的な代謝亢進を示す可能性があります。うつ病患者は、悲しい刺激の処理中にこの領域のより大きな活性化を示すことが発見されています。
他の2つの前頭前野皮質領域の異常な活性化パターンもまた、気分障害および不安障害と一貫して関連していることが発見されています。いくつかの研究は、気分障害および不安障害を持つ個人において、眼窩皮質および腹外側前頭前野(VLPFC)(新しい感情刺激の関連付けの学習と以前に学習された関連付けの逆転において役割を果たすと考えられている領域)において、CBFと代謝の異常な上昇レベルを報告しています。これらの領域の機能不全は、うつ病に特徴的な持続的な認知および感情的反応を個人に素因として与えるものと仮説されています。fMRI研究は、健常者が否定的な画像の感情的意味を再評価する際に、扁桃体と腹内側前頭前野(VMPFC)の活性化の間に逆の関係があることを示しています。再評価中にVMPFCの活性化が増加し、扁桃体の活性化が減少する個人は、日中のコルチゾールのより急峻で適応的な日内パターンを示しており、これは辺縁系回路を成功裏に調節する能力が日常生活の幸福に影響を与えることを示唆しています。努力的な感情再評価課題中の対照群と抑うつ患者の間でVMPFCと扁桃体の活性化の間に有意に異なる相関があることを示した最近の研究は、この考えをさらに支持しています。
DLPFCは、ワーキングメモリーと注意に関連する認知課題によって特異的に活性化される領域であり、うつ病に関連するCBFと代謝の異常な減少を一貫して示すことが示されています。認知課題遂行時のこの領域の活動低下は、気分障害に特徴的に見られる認知機能の欠損と関連付けられています。いくつかのfMRI研究は、認知課題に対するDLPFC活動の減少を示しています。VLPFCと同様に、最近の研究では、うつ病患者が扁桃体とDLPFC活動の間の関係の減少を示し、これらの構造間の機能的関係の減少を潜在的に示唆していることも発見されています。
視床と基底核は、扁桃体、眼窩皮質、VLPFC、および帯状皮質と広範な接続を持っています。さらに、腹側線条体は、脳の重要な報酬経路の一部を構成する腹側被蓋野(VTA) から重要な投射を受けます。単極性うつ病患者と双極性うつ病患者は両方とも、視床の左内側背側核における代謝およびCBFの異常な増加を示します。気分障害患者におけるこれらの領域の機能画像研究は、うつ病エピソード中に幸福な刺激に対する線条体反応の減少と、躁病状態における線条体活動の増加を示しています。
要約すると、機能画像研究は、感情的および認知的処理の神経回路への新しい窓を提供し、新しい仮説の生成と検証に使用できる新しい情報を提供します。認知神経科学の他の分野から得られた研究と合わせて、これらの研究は、気分障害および不安障害が、感情的および認知的処理の調節を担当するLCSPT回路の機能障害に起因するという一般的な仮説につながっています。具体的には、「ボトムアップ」モデルが提示されており、扁桃体などの辺縁系構造の過剰活性化が刺激に対する感情的反応を高め、DLPFCの相互抑制のために、流入する刺激を効果的に認知的に処理する能力をさらに低下させるとされています。第2の**「トップダウン」モデル**は、高次皮質構造が辺縁系活性化を調節する能力が気分障害および不安障害を持つ個人で損なわれていると仮説を立てています。いくつかの研究は、治療反応に関連するように見えるトップダウンまたはボトムアップモデルを反映する特定の活性化パターンを特定するためにfMRIプロトコルを使用しています。これらのモデルの潜在的な臨床的関連性をさらに探求し、活性化パターンが利用可能な様々な治療介入に対する異なる治療反応を予測するために使用できるかどうかを決定するための追加の研究が現在進行中です。
アルコール依存症のfMRI
fMRI研究は、アルコール依存症関連の神経毒性の機能的結果に関する洞察を提供しています。研究は、回復期のアルコール依存症患者が、注意、学習と記憶、運動協調、行動の抑制制御における障害に関連して、前頭皮質、視床、線条体、小脳、および海馬において異常な活性化パターンを示すことを示唆しています。研究は、ベンゾジアゼピンに対する鈍化した反応によって示されるように、アルコール依存症における回路機能不全の根底にあるメカニズムを探るために、安静時回路活動の薬理学的調節を探求し始めています。
研究はまた、アルコール依存症への脆弱性に関する洞察も提供しています。アルコールを乱用する、または乱用するリスクのある思春期および成人は、報酬予測、反応抑制、注意制御、および認知の他の側面に関連する回路関連の機能不全を示します。さらに、これらの個人は、脳の構造的異常に関連して、アルコール渇望を引き起こすアルコール関連の刺激に曝露されたときに、辺縁系および眼窩前頭前野の活性化の増加を示します。研究は現在、アルコール依存症の推定される薬物療法をテストするために、これらの渇望関連のfMRI変化を利用しようとしています。
1H MRS(水素原子核磁気共鳴分光法)
1983年、イェール大学ロバート・シュルマンの研究室のケビン・ビーハーによって、生きたラットの脳内でグルタミン酸やGABAを含む微量代謝物のスペクトルが観察されました。それ以来、脳のMRS研究は、その種類とヒトの脳研究への応用において大きく拡大してきました。今日、MRSは健康な脳と病気の脳の診断と基礎研究のために、世界の多くの地域で応用されています。
MRSは、主にその周波数に基づいて分子を区別することを利用しています。最も一般的に使用される原子核は、1H、31P、および13Cです。図1.25-9Bは、ヒトの脳で得られた1H MRスペクトルの例を示しています。MRスペクトルの主要な構成要素は、クレアチンとホスホクレアチンのメチル基、コリン、N-アセチルアスパラギン酸(NAA) です。2つのクレアチン化合物は生体内では共鳴が重なるため、単一のピークとして現れます。クレアチンとホスホクレアチンは細胞のエネルギー代謝において重要な役割を果たしていますが、その複合レベルは虚血のような重度の急性負荷に直面しても一定に保たれます。老化のような一部の慢性的な影響は、組織クレアチンレベルを増加させたり、減少させたり、影響を与えなかったりすると報告されており、これは現在MRSコミュニティで活発に調査されている分野の1つです。リン脂質コリンとグリセロリン脂質コリンが主成分であるコリンの共鳴は、膜の分解と合成を反映していると考えられており、アセチルコリンからの寄与は無視できるほどです。NAAは主に、神経突起を含むグルタミン酸作動性ニューロンに見られ、ミトコンドリア酵素であるN-アセチルトランスフェラーゼによって合成されます。グリア細胞はNAAを輸入するためのトランスポーターを持ち、NAAを分解する酵素も含有しており、ニューロンからグリアへのNAAのシャトル輸送の可能性を示唆しています。実際、NAAのアセチル基がミエリンに取り込まれるという証拠もあります。1990年代初頭までは、NAAの減少は神経細胞死を示すと考えられていましたが、それ以来、NAAが減少した後回復する状態が見つかっています。NAAは現在、神経細胞の健康、生存能力、またはミトコンドリアの完全性を表すと考えられています。
MRS研究の多くは、1H MRスペクトルを支配するこれら3つの代謝物に基づいて行われてきました。アルツハイマー病(AD)、肝性脳症、その他の疾患の診断と評価を含む臨床応用が提案されています。1H MRSを用いて検出できる神経化学的に関心のある他の代謝物には、ミオイノシトール、グルタミン酸、グルタミン、GABA、およびグルタチオン(GSH) があり、これらはすべて様々な神経精神疾患において研究的な観点から詳細に検討されてきました。グルタミン酸、グルタミン、特にGABAは、互いに重なり合い、Jカップリングの影響下で複雑なパターンに変調されるため、ヒトの脳での検出には高度なMRS法が必要とされてきました。スペクトル編集に分類される方法は、GABA、グルタミン酸、GSH、および他の化合物の信号を、より大きな重なる共鳴から分離するために使用されます。神経伝達物質活性に関して、グルタミン酸とグルタミンの総組織レベルが神経炎症を示すかどうか、およびMRSで検出された化学物質のいずれかが神経炎症を示すかどうかを評価するための研究が現在進行中です。
磁気共鳴スペクトルイメージング(MRSI) は、ケミカルシフトイメージング(CSI) とも呼ばれ、化学的識別能力と空間分布をマッピングする能力を組み合わせたもので、最も一般的には1H MRSに実装されています。検出されるほとんどの神経化学物質からの信号は通常、水の信号よりも5〜6桁低いため、MRSI測定の信号対雑音比ははるかに低く、適切な感度を得るには著しく長い取得時間が必要であり、解像度は通常MRIで使用されるものよりも低くなります。しかし、脳の広い領域を同時に視覚化できる能力により、てんかんのように異常を局所化する必要がある病態や、多発性硬化症やアルコール依存症のような脳内の分散した変化がある病態に対するこのアプローチの臨床応用が始まりました。
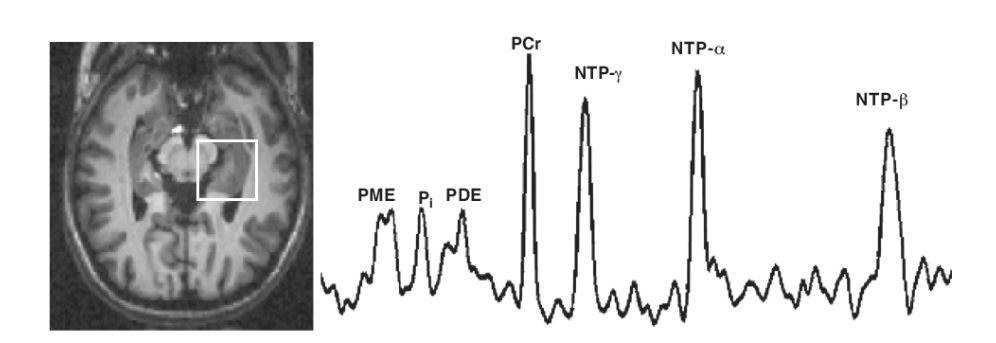
図1.25-18. 4テスラ磁石を用いた健康な被験者の31P MRS。
左: CSFをヌル化し、灰白質と白質のコントラストを作成するために、反転回復法で得られたT1強調画像。
右: 左から右に、リン酸モノエステル(PME)、無機リン酸(Pi)、リン酸ジエステル(PDE)、ホスホクレアチン(PCr)、およびヌクレオチドリン酸のγ, α, βリン酸残基を示すスペクトル。(ミズーリ大学コロンビア校、ジュリー・パン医師・博士提供)
31P MRS(リン原子核磁気共鳴分光法)
1978年、ブリットン・チャンスらは、生きたマウスの脳内のリン酸化代謝物のMRスペクトルを発表しました。31P MRSは、ホスホクレアチンやアデノシン三リン酸(ATP) などの高エネルギー化合物の測定値を提供し、リン酸モノエステル(PME) やリン酸ジエステル(PDE) の測定も可能です(図1.25-18)。これは統合失調症、うつ病、その他の疾患の研究に応用されています。31P同位体原子核は、原子あたりで見ると1Hよりもはるかに感度が低く、さらに1Hの多くの共鳴がメチル基またはエチレン基を表し、1つではなく3つまたは2つの原子核を共鳴あたり提供することを考慮すると、さらに感度が失われます。感度を有利にする事実は、自然界に存在するリンの100%が31P同位体であることです。組織を破壊することなく、高エネルギーリン酸塩やその他の代謝物に関する独自の情報を提供するという点で、脳研究にとって強力なツールとなっています。一部の研究室では、脳全体にわたってこれらの神経化学物質をマッピングするために、31PのMRSIを応用しています。
脳の31Pスペクトルにおける主要な共鳴はホスホクレアチンであり、慣例により0 ppmの化学シフトが割り当てられています。右側には、ヌクレオチド三リン酸(NTPs)のγ, α, β共鳴を表す3つの共鳴があります。左側には、PME、PDE、および無機リン酸があります。PMEとPDEの共鳴は、脂質と膜代謝物の可動成分を反映していると考えられています。無機リン酸は、エネルギー消費中にホスホクレアチンとATPから放出された遊離リン酸です。虚血のような極端な状態では、高エネルギーリン酸プールが枯渇し、リン酸基が放出されるにつれて、ホスホクレアチン共鳴が低下し、NTP共鳴が減少し、無機リン酸ピークが上昇します。精神疾患では、変化は一般により微妙であり、PMEまたはPDEの変化の報告もありますが、現時点では変化の方向性と程度は不確実です。最近の進歩により、31P代謝の速度論的研究は、長年使用されてきた筋肉から脳への応用へと移行しました。飽和移動(saturation transfer) と呼ばれる技術は、ホスホクレアチンのようなある化学物質中の31Pの信号を減少させ、その後、リンがホスホクレアチンからATPに移動する際のATPの信号減少を追跡します。このアプローチにより、脳内のホスホクレアチンおよびATP合成の測定が可能になりました。
13C MRS(炭素原子核磁気共鳴分光法)
あまり一般的ではありませんが、13C MRSは、世界の炭素の1.1%を自然に占める非放射性同位体である炭素-13を検出するために使用されます。ほとんどの1H MRSおよびすべての31P MRSと同様に、13C MRSは依然として研究ツールであり、その役割において、神経エネルギープロセスおよび神経伝達の速度論の測定に有用であることが証明されています。脳におけるその主な応用は、炭素酸化およびグルタミン酸-グルタミン神経伝達サイクルの測定です。
13Cは、1H MRスペクトルで解決できない多くの代謝物の解像を可能にする広い化学シフト分散という強力な利点を持っています。例えば、グルタミン酸とグルタミンのC4およびC3共鳴は、1.5Tの磁場強度でも完全に解決され、高磁場強度ではさらに解像度が向上します。13Cの大きな欠点は、原子あたりで見ると31Pよりもさらに感度が低く、その低い天然存在量によってさらに感度が低下することです。しかし、この低い天然存在量は、それがバックグラウンド信号をほとんど寄与しないという観点から見ると利点に変えることができます(図1.25-19)。この低いバックグラウンドレベルは、13Cが代謝経路に導入され、神経化学物質に組み込まれる場合、検出されるほとんどすべてが追加された炭素に由来することが既知であることを意味します。これは最初に細胞懸濁液で、次にウサギとラットで、そして現在はいくつかの研究室でヒトの脳の代謝研究に応用されています。今日最も一般的に使用されている方法は、13C-グルコースまたは13C-酢酸の投与であり、これにより、解糖、酸化、およびニューロンとアストロサイト間の神経伝達物質の放出と輸送を介して、グルタミン酸、グルタミン、およびGABAの標識が行われます。13Cの取り込みは、複数の代謝物で同時に経時的に追跡され、関連する経路における代謝プロセスが速いほど、MRスペクトルへの13Cの出現は速くなります。グルコースは一般にニューロンに関するより多くの情報を提供し、酢酸はグリア代謝に対するより大きな感度をもたらします。
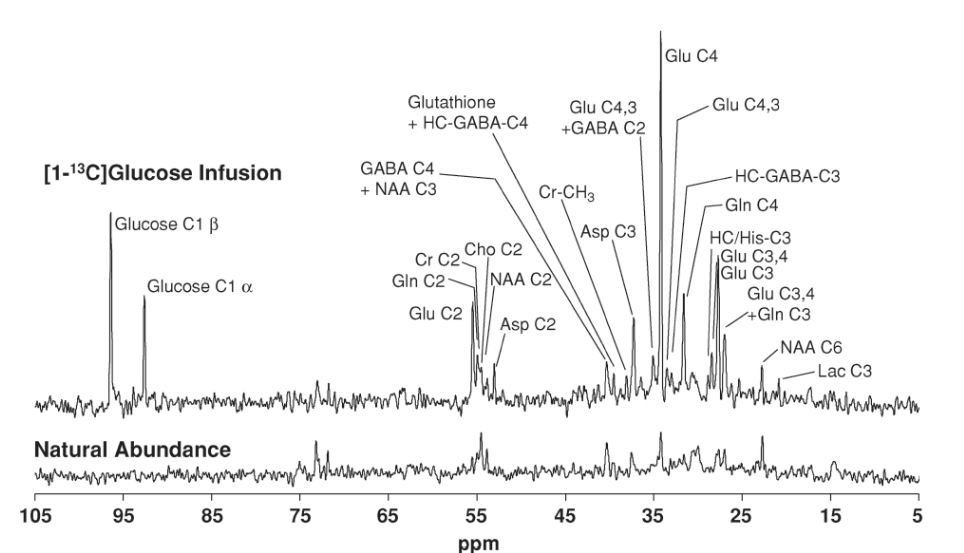
図1.25-19. ヒトの脳における[1-13C]グルコース2時間注入前(下)および注入中(上)の13C MRスペクトル。
注入前は、1.1%の天然存在量信号のみがスペクトルに見られます。グルコースとして外因性の13Cが供給されると、代謝を通じて、この同位体は脳内の多数の生成物として現れ、13C MRSで検出できます。左側にはグルコース自体が見られます。最大の単一共鳴はグルタミン酸のC4(Glu C4)です。グルタミン酸のC3とC2も存在し、グルタミンのC4、C3、C2も同様です。GABAはC2、C3、C4の位置で標識され、アスパラギン酸(Asp)はC2で標識されます。乳酸(Lac)はC3の位置で標識されます。NAAとクレアチン(Cr)は、その合成が遅すぎて2時間では有意な標識が起こらないため、天然存在量スペクトルと標識スペクトルで類似して現れます。
13Cを検出するために様々な方法が開発されており、適切な選択はアプリケーションに基づいています。最も単純なアプローチは直接検出であり、13C原子核のみの励起と検出を必要とします。感度は、核オーバーハウザー効果(NOE) と呼ばれる方法で1H周波数で無線周波数を事前に印加することにより、最大3倍に増加させることができます。より複雑なアプローチである偏極移動は、共有結合を介して結合した1H原子核のより大きな偏極の一部を13C原子核に移動させることにより、感度を最大4倍増加させることができ、取得時には13C原子核が観測されます。プロトン観測/カーボン編集(POCE)分光法は、感度をさらに大きく改善します。POCEは13Cに結合した1Hを検出し、1H原子核が観測されるため、検出は1H MRSのはるかに高い感度を持ちます。感度が高いということは、13C領域でデータを取得する方法の75 mL以上ではなく、数ミリリットルの体積を研究できることを意味します。主な欠点は、1H領域での検出が、13C化学シフト分散から得られる高分解能の利点を排除することです。異核単量子コヒーレンス分光法(HSQC) は、両方の原子核を取得することによって得られる情報が同時に含まれるデータを提供することにより、13Cスペクトルで利用可能な分解能を1H取得の感度で達成する方法を提供し、より高い空間分解能の達成に期待が持たれています。
精神医学におけるMRSの応用
MRIが脳構造に関する情報を提供するように、fMRIが局所的な脳機能に関する情報を提供するように、MRSは脳の化学と代謝に関する情報を提供します。多くの点で、それはMR方法論の中で最も新しく、最も未開発なものであり、最近まで、精神医学への応用もその比較的低い空間的および時間的分解能と技術的専門知識の必要性によって制限されていました。しかし、過去10年間にin vivoでのMRS研究によって提供された情報は、いくつかの精神疾患に関連する神経化学的および代謝的異常を特定する上で貴重であることが証明されており、これらの疾患の病態生理学的モデルに関する現在の考え方を再形成するのに役立っています。MRS画像化技術の改善と専門知識の普及に伴い、このモダリティは精神医学研究により広く応用されるようになり、精神疾患の病態生理学と病因に関連する斬新な仮説を検討することが可能になっています。
認知症のMRS
1H MRSは、神経伝達、エネルギー代謝、および細胞機能に関連するいくつかの神経化学物質の非侵襲的な測定値を得る機会を提供します。1H MRSを使用した研究は、内側側頭葉および前頭葉皮質脳領域において、加齢とともにNAA測定値の一般的な減少傾向を示していますが、認知症ではより大きな減少が見られ、NAAレベルはプラーク密度に関連しています。NAAは、脳内で最も確実に測定される代謝物かもしれません。これは、7〜13 mmol/kgの範囲で存在し、分子の物理的特性(メチル基に同一の3つの水素原子が存在し、単一のプロトンから得られる感度の3倍を提供すること)によるものです。前述のとおり、脳のNAA含有量の重要性は完全には理解されていません。一般的には神経細胞の健康のマーカーとして機能すると考えられていますが、ミトコンドリアエネルギー代謝およびミエリン維持の側面を反映することも知られています。MCIおよびADに関する研究は概ね一致しており、これらの疾患の患者が、年齢をマッチさせた対照被験者と比較して、NAAレベルの低下とミオイノシトール(脳内に正常に存在するイノシトールの一種で、浸透圧調節に寄与する)レベルの増加を示すと報告しています。一つの解釈は、NAAの減少とミオイノシトールの増加が、神経細胞の喪失とグリア細胞増生(gliosis)の増加に関連しているというものです。しかし、NAAの喪失は神経機能の低下を反映している可能性もあります。この仮説は、NAAの変化が一部の条件下で回復できるという事実によって裏付けられています。いくつかのグループはまた、NAA含有量の減少と臨床神経心理学的スコアの間に相関関係を報告しています。興味深いことに、この相関関係は最近、健康なボランティア被験者でも報告されています。
全体的に、他の代謝物の研究はADおよび他の認知症との関係において説得力が低いですが、いくつかの研究は、MCI障害およびADの被験者においてグルタミン酸レベルの減少とグルタミンレベルの上昇が見られることを示唆しています。これらの所見は全体として、進行中の代謝機能不全とグリア細胞増生の増加の組み合わせを反映していると考えられています。現在のところ、認知症の診断または治療においてMRSの臨床的利用はありません。
統合失調症におけるMRS
1H MRSは、統合失調症における皮質化学の研究に広く応用されてきました。これらの研究は、統合失調症患者の多くの皮質および辺縁系脳領域におけるNAAレベルの減少、および統合失調症と診断された人々の家族におけるより小さな減少を記録しています。1NAAレベルの減少は、未服薬患者の一部の脳領域で記述されていますが、病気の進行と抗精神病薬治療の継続に伴って進行性の減少も現れるようです。NAAはニューロンに局在するため、NAAレベルの減少は、死後の研究で報告された神経細胞のサイズの減少と樹状突起の樹状構造の減少、およびDTI研究からの長線維経路の完全性の障害に関する生体内証拠を反映している可能性があります。しかし、NAAはミトコンドリア酵素によって合成されます。その結果、NAAレベルの減少は、死後の研究で示唆されたミトコンドリア機能不全、または統合失調症の病態生理に関連する局所的な代謝変化、あるいは治療の影響に関連する代謝障害を反映している可能性があります。この可能性は、定型抗精神病薬と非定型抗精神病薬の治療が患者のNAAレベルに与える影響の間の新たな違いと一致しています。
統合失調症患者の1H MRS研究では、他の代謝物も測定されています。これまでの最も興味深い発見は、薬物を使用していない統合失調症患者におけるグルタミン酸とGABAのレベルが正常または低く、グルタミンレベルが増加しているという記述かもしれません。薬物が統合失調症で報告されている異常な代謝物レベルの一部に責任があるという証拠が蓄積されています。それにもかかわらず、病気の発症前および統合失調症の初期段階のハイリスク患者でも代謝物変化が観察されています。脳のグルタミンは、主にグリア細胞によって、エネルギー代謝の副産物として生じるグルタミン酸から、および興奮性神経伝達の文脈でニューロンとグリア細胞によって放出された後にグリア細胞に取り込まれるグルタミン酸からも合成されます。したがって、統合失調症と診断された個人のグルタミンとグルタミン酸の変化は、グルタミン酸作動性神経伝達の変化を反映している可能性があります。
統合失調症患者では、グルタチオン、コリン、PME、PDEなど、多くの他の代謝物が1H MRSおよび31P MRSを用いて検査されています。これらの代謝物は、それらの研究が統合失調症が炎症および膜完全性の異常と関連しており、死後および臨床分子遺伝学的研究によって示唆されたミエリン処理の障害を反映している可能性があることを示唆しているため、潜在的に関心があります。しかし、これらの代謝物と統合失調症に関連する特定の膜障害との関係は不明確なままです。また、31P MRS研究では、様々なグループによって行われた発見の矛盾が、これらの発見に疑問を投げかけています。しかし、酸化リン酸化が統合失調症で遅いという最近の磁化移動を用いた発見と一致する可能性があり、かなりの割合の白質を含む組織の容積を用いることで、統合失調症患者のミエリンが損なわれている可能性が間接的に示唆されています。
気分障害におけるMRS
過去10年間で、気分障害および不安障害の研究におけるMRSの使用が急速に増加しています。この方法論はまだ気分障害の診断と治療に関連する臨床実践には組み込まれていませんが、部分的には、これらの障害の病態生理学の概念の進化につながっています。研究の大部分は、1H MRSまたは31P MRSを使用して、病気に関連する神経化学的およびエネルギー代謝の異常に関する情報を提供しています。他のいくつかの研究は、気分障害および不安障害の治療に使用される薬物の薬物動態学と脳内濃度を研究するために、7Liおよび19F MRSを使用しています。最近の新しい研究は、13C MRSおよび31P MRSの使用がこれらの障害の病態生理学をさらに定義するのに役立つことを示唆しています。
現在まで、1H MRSは気分障害の研究で最も広く使用されているMRS方法論です。技術は進化し続けていますが、いくつかの測定はより日常的かつ信頼性が高くなっており、これにより研究者は異なるプロトコルと分光計を使用して異なるサイトで得られたデータからより自信を持って結論を導き出すことができます。
気分障害および不安障害に関連するNAAレベルを調査した200以上の論文が発表されています。しかし、研究された病気の異質性と検査された領域の多様性のため、NAAが気分障害の神経生物学に寄与していることに関して確固たる結論を導き出すことは依然として困難です。一般に、大うつ病に伴うNAA変化を示す一貫した所見はありません。しかし、うつ病患者および不安患者の海馬でNAAが減少している可能性を示唆する特定の研究があります。また、双極性患者の前頭葉でNAAレベルが減少している可能性を示唆するいくつかの証拠もあり、診断マーカーとして機能する可能性があります。クレアチンピークはほとんどの疾患で比較的安定していると考えられており、多くの研究でクレアチンを内部標準として使用する理由となっています。気分障害に関連するクレアチンを調べる研究は、この見解と概ね一致しているようですが、例外も存在します。コリンは膜脂質と神経伝達物質アセチルコリンの必須前駆体です。一連の研究は、健常対照者と比較して気分障害患者の基底核でコリンレベルが上昇していることを示しているようです。これらの研究は、患者の基底核における膜ターンオーバーの変化と信号伝達メカニズムの障害の証拠として示唆されています。
脳の主要な抑制性および興奮性神経伝達物質として、アミノ酸神経伝達物質GABAおよびグルタミン酸がいくつかの神経精神疾患の病態生理に関連付けられていることは驚くべきことではありません。そのため、MRS研究にとって非常に興味深いターゲットとなっています。共鳴の重なりのため、これらの化合物は標準的な1H MRS法では測定がより困難です。これにより、アミノ酸神経伝達物質を研究するためのMRSの使用が遅れ、多くの研究者がGABA、グルタミン酸、およびグルタミンを合わせた測定値を指すためにGlxという用語を使用するようになりました。いくつかの新しい編集技術の開発により、いくつかのグループは現在、個々のピークを分離できるようになっています。アミノ酸神経伝達物質システムを調査するためのMRSの比較的最近の応用は、気分障害研究の分野で非常に生産的であることが証明されており、気分障害および不安障害患者のいくつかの脳領域におけるGABAおよびグルタミン酸の著しく異常な濃度を示唆する証拠が増加しています。さらに、最近の研究は、抗うつ薬治療がこれらの異常の一部を逆転させる可能性があることを示唆しています。これらのデータは、アミノ酸神経伝達物質が気分障害の神経生物学と抗うつ薬作用のメカニズムにおいて果たす潜在的な役割に対する認識を高めるのに役立ちました。グリア細胞機能がアミノ酸神経伝達物質代謝に不可欠であることが現在認識されているため、これらのデータは、いくつかの死後の所見と合わせて、MDDに関連するグリア細胞障害の病態生理学的モデルの支持も提供しています。気分障害における脳のグルタチオンレベルの変化に関する最近の観察も、グリア/ニューロン相互作用の変化に関連している可能性があります。
31P MRSは、脳の膜リン脂質代謝、高エネルギーリン酸代謝、および細胞内pHの生体内測定を提供します。双極性障害における初期の31P MRS研究は、ホスホイノシチド経路が双極性障害で増強されているという仮説を検証し、PMEとPDEのレベルを測定することによって、双極性障害における膜リン脂質と膜欠陥の寄与を探ることを目的としていました。これらの研究のメタ分析は、双極性障害患者におけるPME含有量の診断および気分状態依存性の有意な異常を発見し、脳信号伝達システムと膜代謝の調節不全が双極性障害に関連している可能性があることを示唆しています。さらに、リチウム治療がPMEレベルを増加させることを示唆しており、作用機序への手がかりを提供する可能性があります。濃度レベルを超えて、初回エピソードの双極性障害患者では、速度論的31P MRSもまた、ATPとホスホクレアチンの間のリン酸転送の遅延を示しており、ホスホクレアチンがATPレベルを維持するための高エネルギー貯蔵庫として機能することを考えると、これは重大な結果をもたらす可能性があります。
他の研究では、ヌクレオチドリン酸(NTPからの3つのリン酸残基)およびホスホクレアチンの濃度を測定することによって、神経エネルギー欠陥が気分障害に関連しているかどうかを評価しようと試みてきました。一般に、これらの研究は、うつ病エピソード中の被験者の基底核でヌクレオシドリン酸のレベルが低いことを発見しており、高エネルギーリン酸代謝がうつ病の被験者の基底核で変化していることを示唆し、ミトコンドリアが気分障害で果たす可能性のある役割に注意を向けています。
脳への虚血性損傷に起因する病理学的状態では、pHの低下が観察されています。双極性患者でも細胞内pH(pHi)濃度の異常が報告されています。いくつかの研究は、気分安定期の双極性患者の基底核と全脳の両方で有意なpHの低下を発見している一方で、他の研究はpHレベルの増加が双極性および抑うつ状態に関連していることを発見しています。これらの効果の根底にある特定の病態生理は不明のままですが、これらの発見は、神経エネルギーが気分障害に貢献する可能性に注意を向けるのに役立っています。
この章の冒頭で述べたように、13Cの独自の物理的特性により、グルコース代謝の速度だけでなく、アミノ酸神経伝達物質のサイクルも測定するのに優れたツールとなり、安定同位体であるため、放射性化学研究に関連するリスクと課題を提示しません。13Cで標識されたグルコースを用いた研究は、グルコース酸化、グルタミン酸/グルタミンサイクル、およびGABA合成の速度を測定するために使用されてきました。13C標識酢酸を用いた研究は最近、グリア細胞代謝の測定値をもたらしており、グリア細胞病理が気分障害の神経生物学において重要な役割を果たす可能性を示唆する最近の発見を考慮すると、潜在的に貴重なツールとなります。in vivoでの13C MRSの精神医学への応用は比較的新しいですが、最近のデータは、未服薬の大うつ病患者における酸化代謝の有意に低い速度を示しています。概念的に新しい方向性は、Vtca/Vcycleを用いて長期増強/長期抑制のテストとしてシナプス強度を測定するための13C MRS速度論的測定の使用です。このモダリティを用いた将来の研究は、気分障害、神経エネルギー、アミノ酸神経伝達物質機能、およびグリア細胞機能間の関連性に関する新しい洞察を提供する可能性が高いです。
アルコール依存症におけるMRS
NAAとコリンを評価した1H MRS研究は、アルコール関連の神経毒性の出現と回復に関連するMRIの発見を補完する神経化学的証拠を提供しています。GABAの1H MRS研究は、アルコール依存症からの回復に関連する皮質抑制性神経伝達の変化に関する洞察を提供しています。急性離脱期には、皮質GABAレベルは正常であるように見え、動物研究と一致しています。アルコール依存症からの回復に伴い、皮質GABAレベルは低下し、長期的な禁酒をしている健常者で見られるレベルを著しく下回る可能性があります。禁酒中の皮質GABAレベルのこれらの時間依存性の変化は、慢性エタノール曝露によって生じるGABAA受容体集団における適応からの回復を反映していると仮説立てられています。
13C測定は、脳のアルコールとその代謝産物である酢酸を酸化する能力の向上など、大量飲酒と再発を促進するエネルギー因子を明らかにする可能性があります。脳が燃料として酢酸に依存するようになる程度に、患者が飲酒を停止すると、アルコール離脱は循環酢酸のほぼ不在によって悪化する可能性があります。さらに、アルコールが酸化されると、アセトアルデヒドが生成されます。これは全身的には嫌悪感を引き起こすことが示されているにもかかわらず、脳内では報酬特性を持つことが示されています。
7Liおよび19F MRS
いくつかの研究が、気分障害の治療に関連するリチウムの薬物動態を研究するために7Li MRSを使用しようと試みてきました。これらの研究は、リチウムが比較的迅速にBBB(血液脳関門)を通過し、脳内で約28時間の半減期を持つことを示しています。この方法論の潜在的に強力な臨床応用は、血清レベルに対する脳内Li濃度を測定し、細胞内と細胞外のリチウムを評価する能力です。数は限られていますが、これらの研究は、治療用量を滴定するために一般的に使用される血清リチウムレベルと脳リチウム濃度の間にわずかな相関関係しかないことを示唆しているようです。
同様に、研究では19F MRSを使用して、フルオキセチンやフルボキサミンなどのフッ素含有薬物の薬物動態と血清レベルと脳内レベルの関係を決定してきました。このような研究は現在、臨床的有用性は限られていますが、将来的に他の化合物に対する用量反応関係を決定するのに役立つ可能性があります。
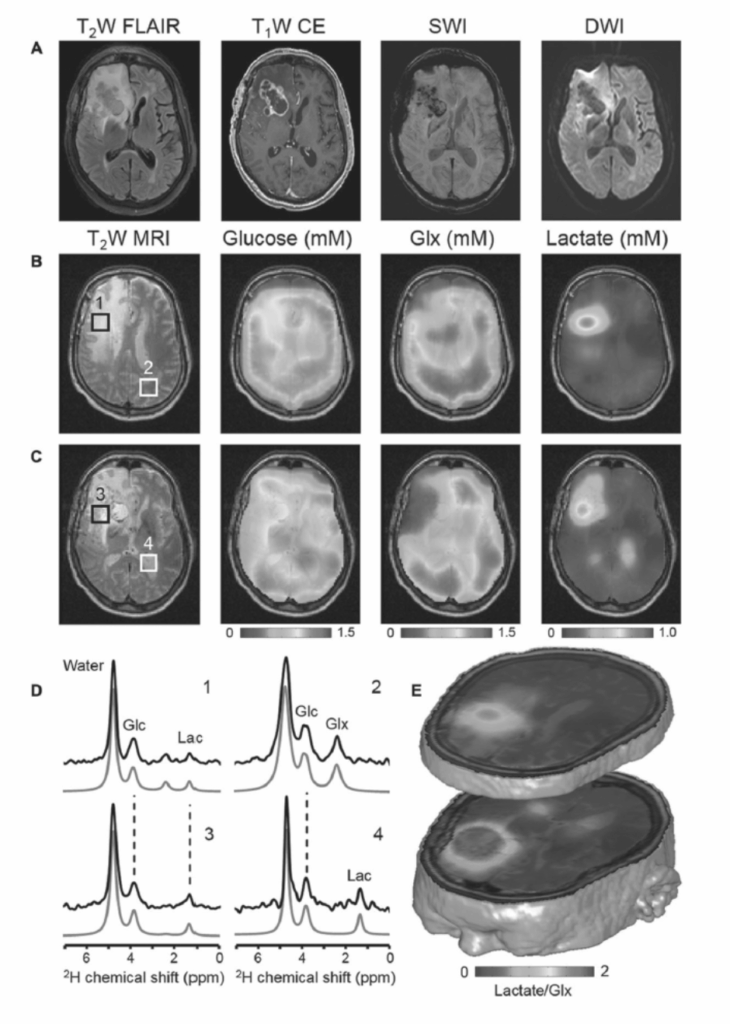
図1.25-20. デューテリウム代謝イメージング(DMI)が示す、悪性脳腫瘍患者におけるワールブルグ効果として知られる異常なグルコース代謝。
DMIは、標準的なMRIスキャナーを使用して、生体内の重水素標識基質とその下流代謝物を検出します。グルコースの場合、投与は水に溶かした2H-グルコースを飲むのと同じくらい簡単です。この方法は、脳や肝臓などの異なる臓器に適用でき、異なる重水素標識基質を使用して異なる代謝特性を測定できます。このシンプルでロバストなMRI法は、既存のスキャンプロトコルに簡単に統合でき、臨床で広く利用される代謝イメージングモダリティとなる可能性があります。(De Feyter HM, Behar KL, Corbin ZA, et al. Deuterium metabolic imaging (DMI) for MRI-based 3D mapping of metabolism in vivo. Sci Adv 2018;4(8). doi: 10.1126/sciadv.aat7314. C The Authors, some rights reserved; exclusive licensee AAAS. Distributed under a CC BY-NC 4.0 License (http://creativecommons.org/licenses/by-nc/4.0/).よりAAASの許可を得て転載.よりAAASの許可を得て転載))
デューテリウム代謝イメージング(DMI)
実用的で広範な利用が見込まれる最近の進歩として、水素の同位体である2H(一般に重水素として知られる)のMRSによる代謝測定があります。この同位体は1Hよりもはるかに感度が低いですが、いくつかの有利な特性を持っています。2HはT1緩和時間が短く、迅速な繰り返しが可能で、現在PETで見られるのと同程度の解像度を持つ3D画像を生成するのに十分な信号を蓄積できます。また、2Hは天然存在量が非常に少なく、1%のわずかな割合であるため、代謝トレーサーとして2Hを投与する場合、実質的にバックグラウンド信号はありません。2HはT2緩和時間が非常に短いため、精神医学的に重要な領域(例:眼窩前頭皮質)における磁場均一性の歪みが比較的に無視できるほど小さく、低い共鳴周波数によるロバスト性もあります。そのため、1H、13C、31P、およびその他の主要な同位体のMRSに影響する局所的な制限なしに、脳全体で代謝をアクセスできます(図1.25-20)。
大量の重水素は吐き気を引き起こす可能性がありますが、DMIははるかに低い線量を使用するため、被験者は悪影響を経験しません。重水素は最終的に水として体から排出され、測定は安全に繰り返すことができます。一部のアプリケーションでは、重水素は重水素化水またはグルコース溶液の形で経口投与できます。この方法の非常に重要な側面はそのシンプルさです。データを取得するための電子機器とソフトウェアは、NMRにとって可能な限り最も単純なものの一つです。
実用上の考慮事項
技術はいくつかの複雑さを伴うものの、患者に対するMRIまたはMRSスキャンを検討する際には、安全性と快適性という実用的な考慮事項が非常に重要です。
安全性
最も重要な考慮事項は患者の安全性です。MRIとMRSは、人体を検査する最も安全な方法の一つと考えられています。MRIとMRSはX線ではなく磁気と電波を使用するため、変異原性があるとは知られておらず、電離放射線を使用する方法のように癌リスクとは関連していません。電波は脳を含む組織の加熱を引き起こす可能性があるため、米国FDAは磁石の強度と電波への曝露に関するガイドラインを定めており、MR装置の製造業者と操作者はそれらのガイドラインを慎重に遵守しています。ヒトのMRスキャンで使用される無線周波数、電力、および持続時間への曝露に関しては、有害な影響は観察されていません。
MRIとMRSは、特定の人々にとっていくつかのリスクをもたらします。ペースメーカーや体内に特定の金属物体がある人々は、MRスキャナーの強力な磁石がインプラントの誤動作や移動を引き起こす可能性があるため、一般的にMRスキャンの候補ではありません。動脈瘤クリップは特に大きなリスクをもたらします。現在の技術が磁場強度を増加させるにつれて、MR対応と指定された金属製品には注意を払う必要があります。可能な限り、企業は製品の必要な品質を維持しつつ、材料から強磁性体をできるだけ除去しようと努めています。しかし、微量の強磁性体が残る可能性があり、磁場強度が増加するにつれてより大きなリスクをもたらします。MR互換性の主張は、一般的に1.5 T以下の磁場強度では真実であり、場合によっては3 Tでも安全なデバイスもあります。しかし、多くのデバイスは1.5 T以上でテストされておらず、3 T以上でテストされたものはさらに少ないため、現時点では、多くの金属インプラントは3 T以上では未知の許容できないリスクをもたらし、与えられた磁場強度での互換性を個別に確認する必要があります。
もう一つのリスクは、金属物体が空中を磁石に向かって飛び、患者に衝突することです。このリスクを軽減するために、MR施設では通常、患者を含むすべての職員に、衣服からすべての金属を取り除き、ポケットからすべての金属物体を取り除くよう求めています。多くの場合、患者は病院着を着用する必要があります。磁石室には、MR操作者によって特別に検査された機器や備品を除き、金属製のものは持ち込むことができません。磁石室のドアは、操作者と患者または操作者が直接承認した職員による短い出入りを除いて、閉じておくべきです。このリスクに対する保護を怠った結果、時速50マイルを超える速度で磁気酸素ボンベが子供の頭蓋骨を押しつぶし、子供が死亡するといった大惨事が発生しています。それほど劇的ではありませんが、より一般的なリスクは、飛んでいるボールペンやペーパークリップによる患者の目の損傷です。
一般的な質問は、妊娠の安全性についてです。1980年代初頭から使用されている1.5 T、および1990年代初頭から使用されている3 Tの磁場強度では、磁場による妊娠または生殖健康への有害な影響は関連付けられていません。3 Tを超える磁場強度ではデータははるかに少ないですが、現時点では悪影響は報告されていません。7 T以上では、一部の個人は、磁石のボア付近で磁場が変化する領域を移動する際に、内耳に対する磁場効果により、磁場に入ったり出たりするときに吐き気やめまいを経験します。
注射可能な造影剤の使用は、追加ではあるものの小さなリスク源となります。静脈ラインの留置には、打撲や感染などのリスクが伴いますが、これらのリスクを最小限に抑えるために、滅菌条件下で慎重にラインを留置する必要があります。FDAは、ヒトへの使用について金属ガドリニウムを含む造影剤を承認しており、その使用に伴う大きなリスクは認識していません。患者の3%未満が注射後に軽度の吐き気、頭痛、またはめまいを経験する可能性があり、これらの副作用は通常、治療なしで自然に解決します。患者の1%未満が、蕁麻疹、かゆみ、または呼吸困難を含むアナフィラキシー反応を経験します。被験者には、MRまたは他の注射された造影剤に対するアレルギー反応の既往歴があるか、腎臓病、喘息、アレルギー性呼吸器疾患、貧血、または赤血球に影響する他の疾患の既往歴があるか尋ねるべきです。米国では妊娠中の女性にガドリニウム造影剤は一般的に投与されませんが、ヨーロッパでは安全と判断されており、許可されています。授乳中の女性は、スキャン後48時間は搾乳してから授乳に戻るように指示されます。
マグネットのクエンチは、この章の冒頭で、液体ヘリウムの急速な蒸発と、場合によっては窒素を伴う磁石の突然の消磁として説明されました。窒素とヘリウムは不活性で無毒ですが、密閉された空間では酸素を置換し、窒息を引き起こす可能性があります。したがって、MRスキャナーには、クエンチが発生した場合にこれらのガスを除去するための換気システムが装備されています。さらに、非常にまれにクエンチが発生した場合、操作者は患者を磁石室からすぐに避難させる訓練を受けています。患者がクエンチが最も発生しやすいときに(設置時や主要な機器のアップグレード後の磁石通電中、またはシステムからゆっくりと失われた物質を補うためにヘリウムが磁石に追加されているときなど)存在することはほとんどありません。大きな金属物体が磁石に衝突した場合にもクエンチが発生する可能性があります。現在までに、クエンチによる患者の負傷または死亡は報告されていません。
スキャン前に患者に伝えるべきこと
患者には、検査のためにベッドに横になる必要があること、通常は頭の周りにいくつかの棒状の検出器が配置されることを伝えるべきです。ベッドはスキャナーの中に滑り込まされ、スキャナーは通常チューブ状に見え、頭はチューブの長さの中央付近に位置し、足、脚、時には腰までがチューブの外に出ます。患者には、スキャナーがデータを取得している間、機械は動かないが、ノッキングなどの音や、おそらく振動を感じる可能性があることを伝えるべきです。じっとしていることの重要性を強調することが重要です。動きは、画像がぼやけたり、その他の理由で解釈不能になったりする可能性があります。造影剤の注射がある場合、点滴ラインに関連する不快感を少し感じるかもしれません。これは、どんな点滴カテーテルでも打撲やその他の不快感を引き起こす可能性があるのと同じです。それ以外に、MRには痛みのある部分はありません。
一部の人々は、直径が一般的に3フィート未満で長さが数フィートのチューブの中にじっと横になることに不快感や不安を感じます。被験者が不安を感じる場合、測定に悪影響を与えない限り、ベンゾジアゼピンなどの抗不安薬を少量投与することがあります。被験者には、操作者が視覚と聴覚で常に監視していることを伝えるべきです。そのため、患者は操作者にスキャナーから出してもらうように頼むことができます。患者には、めまい、胃の不調、金属味、チクチク感、または筋肉のぴくつきを感じる人がいることを警告することが重要です。これらの感覚は通常すぐに消えますが、発生した場合は研究スタッフに伝えることが重要です。
患者には、MR安全質問票を非常に注意深く回答してもらい、各患者と口頭で回答を確認することが重要です。両親が子供と一緒にMRI室に入る場合、両親も同様にスクリーニングされるべきです。質問票は、ペースメーカー、子宮内避妊具、動脈瘤クリップ、榴弾や金属加工による損傷(特に目)など、潜在的にMR非互換性の様々な項目について、手術歴と存在を尋ねます。患者はしばしば、歯科治療や骨折の修復に使用されたネジなどの埋め込まれた金属について質問します。詰め物は安全です。ほとんどの恒久的に設置された歯科治療は安全です。取り外し可能な部分入れ歯は、安全性のためだけでなく、主に一部の強磁性材料がMRIまたはMRSの品質を損なうT2*効果を引き起こす可能性があるため、スキャン前に取り外すべきです。骨ネジやその他の外科的に埋め込まれた材料は、MR施設の安全責任者と協力して検査されるべきです。患者がデバイスがMRI安全であると主張しても、埋め込まれたデバイスの製造元とモデルを知ることも重要です。一部のデバイスは1.5 Tでは安全でも3 Tでは安全ではなく、3 Tで安全なデバイスでも3 Tを超える磁場ではリスクをもたらす可能性があります。内部材料の存在とMRI互換性を評価するために、X線または患者の手術記録のレビューが必要になる場合があります。患者には、安全フォームを注意深く読み、不明な点があれば、安全だと思っていても質問するように、何度も促すべきです。患者が恥ずかしさから黙って死ぬよりも、リスクのないことについて尋ねる方がはるかに良いことです。
ジュエリーは、質問の主な原因であり、時には抵抗の原因となります。患者が拒否することが多いにもかかわらず、舌ピアス、鼻ピアス、へそピアス、イヤリングなどのピアスジュエリーを外さずに磁石室に入るべきではありません。彼らは、お気に入りのネックレスが非磁性の純金であると主張するかもしれませんが、MR装置は反対の結果を示すだけです。場合によっては、イヤリングの裏側のように、不適切に固定された部品が緩んで飛行の危険をもたらしたり、磁石のケーシングや勾配コイルアセンブリ内のどこかのジョイントに引っかかったりする可能性があります。より一般的な問題は、少量の強磁性材料がMRIを歪ませたり、場合によっては、患者の頭が明らかに無傷であるにもかかわらず、巨大な穴を出現させたりすることです。ジュエリーの全面的な禁止に従うことで安全性が向上します。
一般集団の相当数の被験者は異常を示す可能性があります。これらが予期しないものである場合、インシデンタローマと呼ばれ、インシデンタローマを発見した場合の適切な対処法は、これまでも、そしてこれからも議論の対象となっています。潜在的に臨床的に重要性のある所見は、評価とさらなる行動方針の決定のために放射線科医に照会されるべきです。例えば、動脈瘤はさらなる評価の原因となります。85歳の女性の無症状の髄膜腫のような一部の状態は、症状が後から出現しない限り、監視するだけで治療しない方が最善かもしれません。各症例は、その状況と各施設のポリシーに従って個別に評価されなければなりません。
将来の方向性
今日、確立されたMR技術は、粗大な構造的異常を除外する能力を通じて、精神医学に限定的ではあるものの貴重な臨床サービスを提供しています。現在、この章で記述されているほとんどの方法論は、精神科医が精神疾患の病態生理学、病因、および治療を理解するのに役立つ学術研究設定でデータを取得するために使用されています。
今日MRが直面している主な限界は、空間分解能、感度、およびコストです。空間分解能に関しては、ヒトのMRIデータは0.5〜0.75 µLよりも細かいグリッドサイズで取得されることはめったになく、より一般的には1.5〜2 µLです。MRSの感度は、代謝物の濃度がMRIで通常検出される水や脂肪の濃度よりもはるかに低いため、MRIよりもはるかに低く、ヒトの脳生体内での検出限界は一般的に0.5〜1 mmol/kgであり、一部のケースでは0.25 mLという小さい体積でも可能ですが、1H MRSではより一般的に8 mL、31Pおよび13Cではより大きな体積が必要です。より低い濃度を検出する必要があるため、MRSIは解像度や感度に関してMRIよりも劣りますが、脳内の化学物質をマッピングする能力は精神疾患を調査する独自の力となります。全脳1H MRSは実装可能ですが、脳の大部分はシミングが不十分で、有用なデータが得られません。問題のあるシミングを大幅に改善する方法も開発中であり、今後数年間でこの問題を解決する可能性があります。この章で議論されているDMI法は、そのような問題の影響をはるかに受けにくく、FDG-PET放射線断層撮影と同様に、放射能なしで脳全体にわたる代謝をマッピングする大きな可能性を秘めています。fMRIは今日、精神医学研究コミュニティで大きな注目を集めていますが、画像結果を解釈する際に心に留めておくべき主要な制限は、測定が相対的であること、および機能関連の変化は可能なベースライン条件の文脈で評価されなければならないことです。コストは、新しいMR方法論による診断アプローチの増加の障害となります。現在、スキャン費用は、オーダーされた手順とスキャンが行われる施設に応じて500ドルから4,000ドルかかるため、追加の方法は、臨床的に重要な情報を追加することが明確に示された場合にのみ広く受け入れられるでしょう。
MRの将来はいくつかの視点から見ることができます。MRの非侵襲性、非放射線性は、患者の診断評価と基礎科学研究における継続的な開発に強い推進力をもたらします。その安全プロファイルにより、MRは精神疾患の小児期症状の研究をサポートする可能性が高いです。研究用スキャナーの磁場強度は増加しており、ヒト用で11.7 Tに達しています。ほとんどの脳研究における高磁場強度は、より高い感度を表します。製造業者が高磁場研究機で経験を積むにつれて、技術は過去に中磁場磁石のコストを下げ、信頼性と安定性の向上につながりました。第2の潜在的な進歩は、磁石の超電導線材の冷却剤としてのヘリウムの排除にあります。ヘリウムは現在、MRスキャナーの設置と運用にかなりのコストをかけています。世界のヘリウム供給の制限が厳しくなるにつれてコストは上昇しており、一部の業界関係者は2030年までに世界の供給が枯渇すると予測しています。世界中の研究者が、液体窒素温度で必要な物理的柔軟性と大電流を流す能力を持つ超電導体、およびより強力な永久磁石(電流によって生成されない)の開発に取り組んでいます。そのような画期的な進歩は、MRの運用コストを下げ、限られたヘリウム供給の必要性を排除するはずです。もう一つの集中的な研究分野は、13Cのハイパー偏極化であり、その感度を数桁増加させます。研究者は、血管造影と代謝のための非毒性造影剤としてハイパー偏極化13Cを使用することを積極的に追求しています。非常に異なるアプローチである分子MRIは、神経細胞の移動、遺伝子発現、特定の細胞型の標的化などのプロセスを監視する能力を高めます。そのような分子イメージング能力は動物研究の領域に留まっていますが、方法が発展し続けるにつれて、ヒト疾患への応用が見出される可能性が高いです。もう一つの主要な増加分野はマルチモーダルイメージングです。MRI、fMRI、MRS、または他の測定値をリンクさせ、それらの測定値をPETと結合させます。例えば、現在、PETトレーサーSV2Aを使用して、代謝物レベルの変化とシナプス密度の変化をリンクさせる試みが行われています。
将来、MRは、神経解剖学、機能、および神経化学に関する定量的窓を提供するため、研究ツールとしての有用性が増加する可能性が高いです。開発者はまた、研究方法論を、治療効果を監視するためのバイオマーカーのテストと使用のためのロバストな臨床技術に変えることに取り組んでいます。MR研究はますますマルチモーダルになっており、単一のスキャンセッションで、また個々の被験者で、様々なタイプのMRIとMRSが取得されており、PETやEEG記録などの方法との補完的な測定も行われています。上記で概説したように、MRはすでに、精神疾患の病態生理学、神経エネルギー学、アミノ酸神経伝達、および可塑性に関して現在の考え方を変え始めています。ほとんどの観点から、MRは将来もそうし続ける可能性が高いと思われます。
参考文献
- Alloza, C., Blesa-Cábez, M., Bastin, M. E., et al. (2020). Psychotic-like experiences, polygenic risk scores for schizophrenia, and structural properties of the salience, default mode, and central-executive networks in healthy participants from UK Biobank. Translational Psychiatry, 10, 122.
- Attwell, D., & Laughlin, S. B. (2001). An energy budget for signaling in the grey matter of the brain. Journal of Cerebral Blood Flow and Metabolism, 21, 1133-1145.
- Averill, L. A., Jiang, L., Purohit, P., Coppoli, A., Averill, C. L., Roscoe, J., Kelmendi, B., De Feyter, H. M., de Graaf, R. A., Gueorguieva, R., Sanacora, G., Krystal, J. H., Rothman, D. L., Mason, G. F., & Abdallah, C. G. (2022, April 11). Prefrontal Glutamate Neurotransmission in PTSD: A Novel Approach to Estimate Synaptic Strength in Vivo in Humans. Chronic Stress (Thousand Oaks), 6, 24705470221092734. doi:10.1177/24705470221092734. PMID: 35434443; PMCID: PMC9008809.
- Carlson, P. J., Singh, J. B., Zarate, C. A. Jr., Drevets, W. C., & Manji, H. K. (2006). Neural circuitry and neuroplasticity in mood disorders: insights for novel therapeutic targets. NeuroRx, 3, 22.
- De Feyter, H. M., Behar, K. L., Corbin, Z. A., et al. (2018). Deuterium metabolic imaging (DMI) for MRI-based 3D mapping of metabolism in vivo. Science Advances, 4, eaat7314.
- Drevets, W. C., Price, J. L., Simpson, J. R., et al. (1997). Subgenual prefrontal cortex abnormalities in mood disorder. Nature, 386, 824-827.
- Du, F., Cooper, A. J., Thida, T., et al. (2014). In vivo evidence for cerebral bioenergetic abnormalities in schizophrenia measured using 31P magnetization transfer spectroscopy. JAMA Psychiatry, 71, 19-27.
- Du, F., Yuksel, C., Chouinard, V. A., et al. (2018). Abnormalities in high-energy phosphate metabolism in first-episode bipolar disorder measured using 31P-magnetic resonance spectroscopy. Biological Psychiatry, 84, 797-802.
- Dukart, J., Mueller, K., Barthel, H., et al. (2013). Meta-analysis based SVM classification enables accurate detection of Alzheimer’s disease across different clinical centers using FDG-PET and MRI. Psychiatry Research, 212, 230-236.
- Feldstein Ewing, S. W., Sakhardande, A., & Blakemore, S-J. (2014). The effect of alcohol consumption on the adolescent brain: a systematic review of MRI and fMRI studies of alcohol-using youth. NeuroImage: Clinical, 5, 420-437.
- Goghari, V. M., Rehm, K., Carter, C. S., & MacDonald, A. W. III. (2007). Regionally specific cortical thinning and gray matter abnormalities in the healthy relatives of schizophrenia patients. Cerebral Cortex, 17, 415-424.
- Gore, J. C. (2020). Artificial intelligence in medical imaging. Magnetic Resonance Imaging, 68, A1-A4.
- Hanson, L. G. (2008). Is Quantum Mechanics Necessary for Understanding Magnetic Resonance? Concepts in Magnetic Resonance Part A, 32A, 329-340.
- Kempton, M. J., Salvador, Z., Munafò, M. R., et al. (2011). Structural neuroimaging studies in major depressive disorder. Meta-analysis and comparison with bipolar disorder. Archives of General Psychiatry, 68, 675-690.
- Kose, K. (2021). Physical and technical aspects of human magnetic resonance imaging: present status and 50 years historical review. ADVANCED PHYSICS-X, 6, 1885310.
- Kroenke, C. D., Rohlfing, T., Park, B., Sullivan, E. V., Pfefferbaum, A., & Grant, K. A. (2014). Monkeys that voluntarily and chronically drink alcohol damage their brains: a longitudinal MRI study. Neuropsychopharmacology, 39, 823-830.
- Kumar, V., Vajawat, B., & Rao, N. P. (2021). Frontal GABA in schizophrenia: a meta-analysis of 1H-MRS studies. World Journal of Biological Psychiatry, 22, 1-13.
- Lv, J., Di Biase, M., Cash, R. F., et al. (2021). Individual deviations from normative models of brain structure in a large cross-sectional schizophrenia cohort. Molecular Psychiatry, 26, 3512-3523.
- Mahon, P. B., Lee, D. S., Trinh, H., et al. (2015). Morphometry of the amygdala in schizophrenia and psychotic bipolar disorder. Schizophrenia Research, 164(1-3), 199-202.
- Merritt, K., McGuire, P. K., Egerton, A., et al. (2021). Association of age, antipsychotic medication, and symptom severity in schizophrenia with proton magnetic resonance spectroscopy brain glutamate level: a Mega-analysis of individual participant-Level data. JAMA Psychiatry, 78, 667-681.
- Minati, L., Grisoli, M., & Bruzzone, M. G. (2021). MR spectroscopy, functional MRI, and diffusion-tensor imaging in the aging brain: a conceptual review. Journal of Geriatric Psychiatry and Neurology, 20, 3-21.
- Modenato, C., Kumar, K., Moreau, C., et al. (2021). Effects of eight neuropsychiatric copy number variants on human brain structure. Translational Psychiatry, 11, 399-408.
- Ogawa, S., Menon, R. S., Tank, D. W., et al. (1993). Functional brain mapping by blood oxygenation level-dependent contrast magnetic-resonance imaging-A comparison of signal characteristics with a biophysical model. Biophysical Journal, 64, 803-812.
- Onwordi, E. C., Whitehurst, T., Mansur, A., et al. (2021). The relationship between synaptic density marker SV2A, glutamate and N-acetyl aspartate levels in healthy volunteers and schizophrenia: a multimodal PET and magnetic resonance spectroscopy brain imaging study. Translational Psychiatry, 11, 393.
- Redlich, R., Almeida, J. J. R., Grotegerd, D., et al. (2014). Brain morphometric biomarkers distinguishing unipolar and bipolar depression. A voxel-based morphometry-pattern classification approach. JAMA Psychiatry, 71, 1222-1230.
- Smucny, J., Carter, C. S., & Maddock, R. J. (2021). Medial prefrontal cortex glutamate is reduced in schizophrenia and moderated by measurement quality: a meta-analysis of 1H-MRS studies. Biological Psychiatry, 90(9), 643-651.
- Wang, L., Hermens, D. F., Hickie, I. B., & Lagopoulos, J. (2012). A systematic review of resting-state functional-MRI studies in major depression. Journal of Affective Disorders, 142, 6-12.
- Whitehurst, T. S., Osugo, M., Townsend, L., et al. (2020). Proton magnetic resonance spectroscopy of N-acetyl aspartate in chronic schizophrenia, first episode of psychosis and high-risk of psychosis: a systematic review and meta-analysis. Neuroscience & Biobehavioral Reviews, 119, 255-267.
- Zahr, N. M. (2014). Structural and microstructural imaging of the brain in alcohol use disorders. In E. V. Sullivan & A. Pfefferbaum (Eds.), Handbook of Clinical Neurology: Alcohol and the Nervous System (Vol. 125, pp. 257-290).
- Zhang, B., Ferman, T. J., Boeve, B. F., et al. (2015). MRS in mild cognitive impairment: early differentiation of dementia with Lewy bodies and Alzheimer’s disease. Journal of Neuroimaging, 25, 269-274.

