1.26 精神医学における脳波検査
ジェイソン・K・ヨハネセン博士、およびパトリック・D・スコスニック博士
脳波(EEG)は、最初の機能的脳画像化技術と考えられており、精神医学分野全体における病態生理学の研究に大きく貢献してきました。EEGは、脳活動の非侵襲的測定を提供し、低コスト、検査環境と機器の柔軟性、ミリ秒レベルの時間分解能(いくつかの主要な利点と考えられています)といった特徴から、様々な臨床および科学的応用に適しています。「リアルタイム」測定に近いEEGは、覚醒から睡眠への覚醒状態の移行、基本的な感覚刺激(初期の感覚登録段階と知覚処理を含む)、より複雑な精神操作(注意、記憶、学習プロセスを伴うもの)など、様々な条件に対する脳活動の変化に関する疑問に取り組むのに非常に適しています。高密度デジタルEEG記録と、根底にある神経活動の発生源を補間する関連方法の継続的な開発にもかかわらず、EEGの強みは、活性化の正確な脳構造における位置ではなく、時間的にイベントを特定することに依然としてあります。この区別は、脳画像化のすべての方法に適用される「時間」と「空間」分解能のトレードオフという観点から一般的に議論されており、したがって、進化する神経プロセスのタイミングと順序に関する疑問を調査するのに最も適切な方法を選択する際の指針となるべきです。
EEG方法論の復活は、脳機能の測定を新しい実験的、診断的、および計算上の疑問に適用する費用対効果が高く、非侵襲的な手段を求める認知科学者や臨床科学者がこれらの機器にアクセスできるようになったことで促進されました。EEG方法論は、精神疾患の病因に関する仮説を検討するのに精緻に適用できます。これはもはや、特定の脳領域の機能不全の結果ではなく、複数の脳領域にわたるネットワークを介した神経活動の統合の失敗の結果として概念化されています。脳機能のEEG測定における進歩は、バイオ増幅、電極センサー、信号処理および定量化のための計算アルゴリズムのレベルでの技術的進歩によって支えられてきました。EEG方法論とその実験神経科学とのインターフェースは、精神医学研究の最前線において重要な位置を占め続けており、疾患の特性評価と治療開発の両方の領域に貢献しています。時が経ち、必要な大規模な再現が行われれば、究極の目標は、疾患の早期予測、鑑別診断、サンプル濃縮、および一般的な精神疾患のために開発された治療法に情報を提供するために使用できる研究結果を臨床プロトコルに翻訳することです。
脳波記録と解釈の実践である脳波検査(Electroencephalography) は、てんかん発作、睡眠障害、頭部外傷、腫瘍、感染症、脳症、無酸素症、および急性毒性が疑われる症例の診断に使用される一連の神経評価応用を含む、医学分野全体で成長している分野です。爆風圧波に続発する外傷性脳損傷の症例のように、EEGが病態生理学に対して構造的脳スキャンよりも優れた感度を示した臨床研究の例がいくつかあります。EEG測定に依存する診断技術には、感覚刺激に応答して記録される誘発電位(EP) が含まれます。EPは、刺激に時間的に同期した継続的なEEGの位相同期から生じ、振幅(電圧変化)と潜時で測定される特徴的な波形を生成し、外部感覚イベントによって「誘発」された脳活動の変化の表現として解釈されます。EPは感覚処理の最も初期の段階を反映し、既知の経路に沿った感覚情報の伝達が連続的か中断されているかを判断するのに役立ちます。神経学的評価に共通する検査には、視力に影響する視神経の問題を検出する視覚誘発反応(VER)検査、聴力(乳幼児に使用されるように)を検査するために使用される脳幹聴覚誘発反応(BAER)検査、脳幹腫瘍の検出、および体性感覚誘発反応(SSER)検査があります。SSER検査はEEGの時間特性を精緻に利用し、影響を受けた四肢に適用された刺激(通常は電流)が脳に到達するまでにかかる時間を測定することにより、脊髄に沿った神経伝達の検査に役立ちます。
臨床精神医学の実践において、EEGは主に、知覚体験の変化(例:幻覚)、人格、行動など、精神症状の提示に寄与する可能性のある器質的要因を除外するためのスクリーニングツールとして使用され続けています。器質的病理からの精神疾患の鑑別診断は、病歴と臨床面接によってさらに情報が得られます。現時点では、単独で精神科診断の確定と見なされる特定のEEG活動プロファイルや関連診断手順はありません。そうは言っても、精神医学文献では様々なEEG異常が記述されており、脳機能を障害する根底にある病因のバイオマーカーとしてそのような特徴を使用することにかなりの関心が寄せられています。脳機能の客観的で具現化された測定値として、EEGは、疾患のサブタイプの分類、疾患の進行の測定、および効果的な薬物療法に反応する信号としてなど、精神症状が使用されるのと同じ多くの方法で有用性を持つ可能性があります。
歴史
脳由来の電位に関する実験的証拠は、リチャード・ケイトン(1842-1926)が1874年に、露出したネコ、ウサギ、およびサルの皮質から自発的な電気活動を記録した発見によって初めて確立されました。しかし、実験室での実験からEEGの最終的な受容への長い移行は、激しい論争に悩まされました。証拠の継続的な蓄積にもかかわらず、脳から電位が放出されるという考えは、主要な権威によってほぼ50年間拒絶されました。ケイトンの研究は、ヴァシリー・ダニレフスキーの1877年の報告によって再現されました。その報告では、動物の脳から記録された電気振動が強い感覚刺激によって変化しうることが述べられていました。さらに注目すべき3つの歴史的ハイライトには、(1) 1891年にアドルフ・ベックによって示された、イヌの視覚野が眼をリズミカルに照らされたときに大きな電位を生成すること(これによりEEG光駆動の実験的基礎が築かれました)、(2) ベックとナポレオン・ツィブルスキーの1892年の報告で、皮質への局所的な損傷が記録された自発的な電気活動の特性を変化させうること、および(3) ツィブルスキーの1914年の報告で、皮質に電気刺激を適用することによって脳波のてんかん発作放電を誘発できること(これによりてんかんにおけるEEGの使用が予見されました)が含まれます。この一連の成功した実験的研究にもかかわらず、EEG現象は科学界によって引き続き精査されました。
ケイトンの画期的な研究は、1929年にハンス・ベルガー(1873-1941)によって引用され、脳波学の分野の出現においてアルファ波(約8〜12 Hz)の発見を報告したときに、ついに日の目を見ました。生物学志向のイエナ(ドイツ)の精神医学教授であり、精神科クリニックの所長であったハンス・ベルガーの集中的な忍耐力が、最終的にEEGを受容と臨床的有用性の地位にもたらしました。何年にもわたるヒトからの脳波記録の試みの失敗(彼は動物から記録を得ることができました)の後、彼はついに1924年にヒトのEEGの記録に成功し、1929年にヒトのEEGの多くの側面を記述した彼の古典的な23報の論文シリーズの最初のものを発表しました。彼の膨大な業績の中で、ベルガーは、脳の電気活動が血管や結合組織ではなくニューロンから来ていること、脳腫瘍患者からの記録には高電圧の徐波が含まれていること(彼の記録技術では局所化はできませんでした)、覚醒時のアルファ波は開眼によってブロックされること、およびEEG活動の特性が年齢、感覚刺激、意識状態、および身体の物理化学的状態によって変化することを示しました。しかし、ノーベル賞受賞者の神経生理学者であるロード・エイドリアンがベルガーの発見は「不可能だ」と主張したため、受容は一時的に遅れました。その後、1934年にロード・エイドリアンはベルガーの研究の受容を公に確認し、脳波学の分野が誕生しました。
脳波検査の基本原則
ハンス・ベルガーによって造語された脳波(electroencephalogram) という用語は、脳の電気活動、すなわち脳波のグラフィック記録を指します。関連する用語である脳波計(electroencephalograph) は、頭皮表面で電位を記録するために使用される特殊な機器を指します。略語のEEGは、記録または記録機器のいずれかを指すために互換的に使用されることがあります。EEGによって描出される脳波は、頭皮上の任意の2点間、または頭皮に置かれた電極と頭皮外の中立位置(例:耳たぶ、乳様突起、鼻)に置かれた参照電極との間の電位の一時的な差(大きく増幅されたもの)を反映しています。簡単に言えば、EEGは極めて敏感な電圧計であり、測定単位はマイクロボルト(μV) であり、百万分の1ボルトのスケールで発生するダイナミクスを表します。典型的なEEG信号は約30〜80μVの範囲ですが、早期のEPでは1μVと低いこともあれば、一部の高電圧の「スパイク」放電では150または200μVと高いこともあります。任意の2つのEEG電極間で測定される電位差は、急速に、通常は毎秒何回も変動または「振動」します。この振動こそが、多くの素人でも今や「脳波」として認識する特徴的な波形を生み出すのです。
初期のEEG記録は、電極の1対または記録の1チャンネルのみを伴っていましたが、これによって特定の正常および異常な特徴を検出することはできましたが、効果的な臨床応用は将来を待つことになりました。まもなく、EEGの2チャンネルを記録する能力が達成され、各半球の同種の位置から同時に活動を記録することが可能になりました。間もなく、記録技術の急速な進歩により、4チャンネルおよび8チャンネルの記録が可能になり、EEGは実用的な臨床ツールとなりました。最終的に、10、12、および16チャンネルの記録装置が、世界中の臨床および研究EEG研究所の標準的な主力となりました。現在では、32〜64チャンネルの同時記録が可能なEEG機器はほとんどのEEG研究所で一般的であり、128および256チャンネルのシステムも、「高密度」記録が電流源の推定にさらなる精度をもたらす可能性がある研究で使用されています。多くの頭皮位置から同時に脳波を記録できる能力は重要です。なぜなら、これにより皮質領域間および皮質領域内の非対称性を検出し、記録アレイが局所的または領域的な異常な特徴をより明確に特定し、様々なアーチファクト(すなわち、EEGを汚染する非脳起源の信号源)を検出する能力を高めることができるからです。
EEGによって頭皮で捉えられる脳波活動は、多数のニューロンによって生成される細胞外電位場の総和の結果です。EEGは、単一のニューロン、あるいは頭皮に近い数個のニューロンによって生成される電気活動を検出することはできません。むしろ、頭皮で記録されるEEG信号は、皮質の垂直方向に配向した錐体細胞における興奮性および抑制性シナプス後電位(すなわち、EPSPおよびIPSP)によって生成される電位場の総和の結果です。樹状突起におけるEPSPは、直近の周囲領域に電気的陰性を生じさせますが、その電気場は発生源から離れるほど正になります。IPSPでは逆のことが起こり、近くに電気的陽性を、遠くに負の電場を生成します。ニューロンが密に密集し、垂直方向に平行に配向しているため、EPSPとIPSPの総和は増強されます。表面EEG電極によって検出可能であるためには、神経活動は他の組織と体液(すなわち、CSF、硬膜、頭蓋骨、頭皮)を通過するのに十分な強度である必要があります。電流が異なる密度と異なる電気抵抗を持つ組織と体液を横切って変換されることが、頭皮で記録される際の電流の広範な拡散に寄与します。これは、根底にある発生源と電流投影の方向について仮定を立てる際に考慮すべきEEG記録の重要な側面の一つです。皮質から頭皮への電気活動の変換は、脳が多数の細胞集団を同期させる能力に依存しており、これは自発的に、または刺激イベントに応答して発生する可能性があります。同期していない神経活動は、破壊的な干渉によって打ち消し合うため、頭皮EEGとして記録される電位場には実質的に寄与しません。優勢な内因性脳波が生成される方法のため、EEGは皮質神経活動に最大限の感度を持ち、皮質下構造で生成される電位には比較的感度が低いです。しかし、皮質下神経イベントが皮質下-皮質路に沿った求心性伝達を介して皮質神経発火に影響を及ぼす可能性があるため、例外も存在します。
おそらく脳波に関する最初の観察は、ケイトンの時代にまでさかのぼり、記録された多くの電位が律動的に振動し繰り返すということでした。実際、「固有リズム」という用語は、正常な背景活動を指すために頻繁に使用され、「不整リズム」という用語は、病理を示唆する可能性のある振動パターンの不規則性を持つ活動を指すために使用されます。合理的な範囲内で、EEGの反復的な律動性は、病態生理学的イベントの導入がない限り、個人間で安定しており、時間的に個人内でも安定しています。実際、定量化されたEEG信号は、多くの記録状況で高い再テスト信頼性を示すことが示されており、健常成人および精神科サンプルでr = 0.90の係数が報告されています。精神的課題の条件下で記録された、課題関連EEGの再テスト信頼性の検査も、高い信頼性係数を生み出す傾向があります。しかし、これらの測定の信頼性は、刺激、課題条件、および試行回数によっても影響を受けることが知られています。EEGスペクトル特性の安定性は、遺伝的基盤を持つ可能性もあり、思春期の双生児とその両親の大規模な地域サンプル(N = 4,026)で平均生物学的遺伝率推定値0.78が報告されています。EEGは状態依存性の変化を反映し、例えば覚醒状態やリラックス状態に敏感ですが、時間的に個人内のその信頼性は、一部の著者によって、EEGセットポイント、すなわち個人的に特徴的で時間的に安定した自然な自発的リズムの証拠として解釈されています。セットポイントの概念は、テストセッション全体で平均化を伴う繰り返しテストが測定誤差を排除するのに役立ち、したがって神経変性プロセスの発症または進行を検出する可能性を最大化することを示唆しています。EEG特性がある程度遺伝性であるというさらなる証拠を考慮すると、EEG測定は、家族歴のために精神疾患を発症するリスクが高いと見なされる個人の神経病理の進化を監視するのにも役立つ可能性があります。
リチャード・ケイトンによるEEGの最初の記録から130年以上が経過し、その間に多くの精神科疾患で様々な異常所見が報告されてきましたが、EEG法は依然として精神医学の訓練と臨床実践において主要な役割を見出すには至っていません。これは、EEGがアメリカ医学専門委員会(ABMS)およびアメリカ精神医学神経学会(ABPN)によって承認されたサブスペシャリティとして、臨床神経学において確立された地位にあることとは対照的です。精神医学におけるEEG訓練の軽視は、精神科診断自体に固有の要因の結果である可能性が高いです。これらの要因の中で際立っているのは、一般的に精神疾患の複雑で異質な性質であり、現時点では臨床面接以外に正式に認められた診断技術がありません。精神科医のEEG技術への不慣れさ、およびエビデンスに基づいた実践の基準の厳格化は、日常の精神医学診療におけるEEGの実行可能な応用を検討する際に考慮すべき追加の要因です。
EEG解釈の基本
EEG記録の解釈は、本質的に、無数の固有波形、皮質領域におけるそれらの期待される分布、および振幅と対称性の程度の変動範囲を認識することを学ぶ問題です。64、32、あるいは16チャンネルの振動波が初心者には非常に混乱して見えることは疑いありませんが、経験豊富な脳波医が認識するようになる脳の電気出力には固有の規則性があります。この固有の規則性により、覚醒、傾眠、および様々な睡眠状態を特徴付ける固有のEEGリズムとその変動範囲は、練習と経験を通じて容易に識別されます。EEG信号と区別する必要がある非脳起源の様々な電気生理学的現象も、定型的な外観の局所的または領域的な波形を生成し、識別できるようになります。解釈者の主な仕事は、固有の背景活動の正常な変動範囲と呼ばれるものから逸脱しているように見えるEEG波形を特定し、したがって(1) 既知の病態生理学的相関を持つ明確に異常なもの、または(2) さらなる臨床的調査の結果を待つ潜在的に臨床的関連性のある論争のある異常な波形を特定することです。
解釈者の信頼性
EEG記録は、頭皮上の電位のマイクロボルト変動を正確に測定することによって得られるため、EEG解釈は、温度、重量、長さ、体積の測定が客観的であるのと同様に、純粋に客観的であるという誤解がしばしば生じます。しかし実際には、EEG解釈には判断という大きな主観的要素があり、この分野での技能の習得は、徹底的な訓練と臨床経験の指導的な手があって初めて可能となります。認められたEEG異常は、常に教科書的な明確な形でEEGのトレーシングに現れるわけではなく、明確に正常なEEG活動が曖昧になり、明確に異常な波形に移行する領域には常に曖昧さがあります。
臨床EEG解釈の信頼性という重要なトピックは、広範な研究を受けていませんが、一般的には、訓練と臨床経験を通じて高レベルの解釈信頼性が得られると仮定されてきました。信頼性を評価する2つの正式な方法には、2人以上のEEG解釈者による独立した判読を比較する方法(評価者間信頼性)と、1人の脳波医が一定時間経過後にEEGのサンプルを盲目的に再解釈するように求める方法(評価者内信頼性)があります。これらの方法が、認定臨床神経生理学者がEEGを1つ以上の診断カテゴリーに分類するように求められた研究でテストされたところ、EEGの臨床解釈は、訓練と実践の観点からはるかに大きな注目を集めるべきであることが示唆されました(Grant et al., 2014)。訓練された判読者は、彼らの解釈に対して高い信頼度評価(中央値で99%以上の正確性)を提供する傾向があったと報告されていますが、評価者内信頼性係数は0.33から0.73の範囲で、集計値は0.59であり、評価者間信頼性係数は0.29から0.62の範囲で、集計値は0.44でした。この研究の重要な点は、経験豊富なてんかん専門医はEEG解釈に非常に高い自信を持っているにもかかわらず、この自信が実際のパフォーマンスに基づいているとは限らず、EEGの正確性と信頼性を向上させるためのさらなる訓練が必要であるということです。この目標を達成するための1つの提案は、個々のユーザーにEEG信頼性スコアを測定し報告する継続的な医学教育モジュールを通じて行うことです。
EEG記録と関連方法論
EEGの記録、解釈、および適切なEEGを得るために必要な対応するスキルレベルの複雑さについては、多くのことが書かれています。十分に認識されていないかもしれないのは、適切に訓練された登録看護師または研修医によって得られた大幅に簡素化されたEEGが、実質的な診断的有用性を持つ臨床状況も存在するという事実です。救急治療室の環境、そしておそらく一部の急性期精神科入院またはトリアージユニットに特に関連する重要なEEG所見がいくつかあり、これらは最低限の技術スキルを持つ臨床医によってわずか10分で得ることができます。中程度から顕著な錯乱と興奮、せん妄、または非痙攣性てんかん重積状態(NCSE)の可能性を呈する臨床症例では、トレーシングに多かれ少なかれ連続的なびまん性EEG異常がある場合があり、記録が開始されるとほぼすぐに検出可能です。そのような所見は高度な局所化研究を必要とせず、その存在、または非存在は診断的に関連性があります。迅速なEEG検査室へのアクセスは、特に週末や夜間には常に可能とは限りません。したがって、オンサイトスクリーニングが最も役立つ可能性があります。
上記で記述したルーチンなスクリーニングEEGを超えて、EEGの記録は、実際にはかなりの量のスキルと経験を必要とします。それは単に技術者が行う技術的な行為ではありません。展開される臨床EEG記録は、多数の頭皮位置から同時に記録される複雑な波形の絶えず動く変化する表示であり、EEGパターンは覚醒時、傾眠時、および様々な睡眠レベルで劇的に異なります。EEGの外観は、選択された基準の違いとともに、記録モンタージュによっても変化し、その一方で、多くの正常および異常なEEG波形と汚染アーチファクトが、その明白な形と微妙な形で識別されなければなりません。アーチファクトの発生源を特定し、それらがEEGに侵入するのを最小限に抑えることは、記録手順中に最も重要です。なぜなら、オフラインでの除去および修正手順の適用には、高度なスキルセットと、そのような変換がEEGに残された特徴の外観を不注意に変更する可能性のある複雑さの理解が必要だからです。電極を正しく適用し、増幅器と記録機器を操作するスキルに加えて、より優れた技術者は、高度なEEG解釈も可能です。これがどれほど重要であるかは明白ではないかもしれません。EEG異常は常に明確な教科書的な形で現れるわけではなく、むしろ歪んだり、したがって曖昧であったりする可能性があります。解釈能力は、可能性のある異常を認識し、次に記録モンタージュを配置し、患者の覚醒状態(覚醒または睡眠)を、パターンを強調し、脳波医によるより明確な解釈を可能にする方法で監視するために必要です。EEG技術者が能力を達成するためには、講義による指導と監督下の実践的な記録および解釈経験を含む、最低1年間の常勤訓練が必要です。EEG技術者のための正式な訓練学校は多くの場所に存在し、卒業生は筆記試験と実技試験の2部構成の試験に合格することで、登録EEG技術者になることができます。
精神医学の現場で働くことは、技師が快適に扱えるようにならなければならない特有の課題を伴います。何よりもまず、精神的に不安定な個人のニーズを適切に管理できることです。臨床EEGは通常、精神状態の急性変化に近い条件下で実施されるため、精神症状が悪化する可能性があることを認識しておくべきです。精神科の現場で働くEEG技師は、いつ処置を中止し、助けを求め、状況を鎮静化させようとするべきかを知っていなければなりません。最も協力的な精神科患者でさえ、遅発性ジスキネジアやアカシジアに伴う眼や不随意の身体運動の増加により、EEG記録に課題を呈することがあります。筋肉活動、特に眼、口、顎の活動は、脳活動よりもはるかに大きなスケールで電気活動の変化を生み出し、信頼できる解釈ができないほどEEG記録を汚染する可能性があります。良好な覚醒時の記録が必要であることを考えると、鎮静は許容される処置ではありません。一方で、発作に伴うスパイク波放電などの突発性活動をより完全に評価するために睡眠が必要な場合があり、そのために患者が眠りにつくのを助けるための他の措置が必要となることがあります。これには、照明を落とし、患者をリラックスさせることが必要となる場合があります。EEG記録環境の室温は、理想的には21℃から24℃(70°Fから75°F)に保つべきであり、これは個人が発汗しない快適な温度です(発汗は皮膚電位アーチファクトを引き起こす可能性があります)。発汗に寄与する体温の変化を最小限に抑えることも重要です。汗は導電性を維持し、電極インピーダンスを低減するために塗布された電解ゲルと相互作用し、遅いドリフトやその他のEEG信号に影響するアーチファクトを生成し、隣接する電極の「塩橋」(本質的に電極を接続して橋渡しされた部位で記録された信号間の区別ができなくなること)に寄与する可能性があるためです。発汗と関連する皮膚伝導の変化は、交感神経の興奮亢進とも関連しており、興奮しているまたは高度に不安な患者ではこれを認識すべきです。これらの理由から、患者が普段着で検査を受ける場合は、厚手の衣類や余分な層の衣服を脱ぐように促すべきであり、前述のように、患者を快適でリラックスさせるためにあらゆる努力を払うべきです。電極装着中に、手順の目的、EEG装置、およびEEG記録によって得られる信号(例えば、心臓活動の心電図に似ているが、脳活動を記録するために電極が頭に置かれるという類推)を説明することは、患者が情報を得て安心感を持ち、プロセスに慣れる上で非常に役立ちます。慎重な手順は、精神科患者の記録時間を延長するでしょう。しかし、精神科患者が日常的に評価されない検査室では、技師は、手順を遅らせるべきであるにもかかわらず、急いで処置を終えようとする傾向があるかもしれません。
EEG装置
EEG記録装置の基本的な構成要素は、(1) 電極、(2) 増幅器、および (3) EEG記録を視覚化、取得、および保存する手段を含む記録装置です。それぞれについて以下のセクションで議論します。
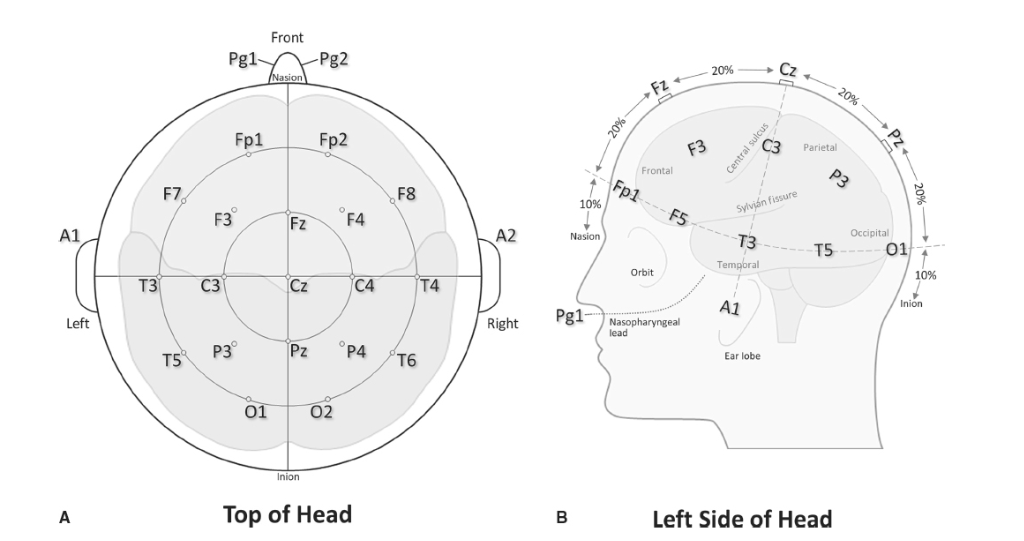
電極。EEGが臨床分野に登場した当初、電極は頭の顕著なランドマークを参照点として、目測で対称的に頭皮に配置されており、すべての検査室が同じ配置システムを使用していたわけではありません。最終的に、1947年にロンドンで開催された国際EEG会議で、臨床および研究の所見が異なる検査室間でより直接的に比較可能になるように、電極配置のシステムを標準化する努力を行うべきであると決定されました。この課題はハーバート・ジャスパーが引き受け、10-20国際電極配置システムを開発しました。これは1958年以来世界中で標準となっています。このシステムは、配置のための2つの解剖学的ランドマークに基づいています。1つは鼻根で、鼻梁の上の目の間の窪んだ領域として識別されます。もう1つは外後頭隆起で、頭蓋骨の最も低い点の近くの後頭部の目立つ隆起として位置します。簡単に言えば、鼻根から外後頭隆起までの総距離から測定が行われ、その中点がこれらの点の間の距離の50%の位置にマークされます(そして耳の前耳介点間の横方向距離の50%)。10-20の命名法は、電極間の距離を指し、頭蓋骨の実際の前後方向または横方向の距離の10%または20%の位置に配置されます(図1.26-1A,B)。各電極の位置は、大脳皮質の根底にある領域と関連付けられており、F、T、C、P、Oの文字はそれぞれ前頭葉、側頭葉、中心部、頭頂葉、後頭葉を示し、その後に正中線電極の場合は小文字の「z」、または同種の左側(奇数)または右側(偶数)の位置を示す数字が続きます。したがって、例えば電極O1とO2は、それぞれ後頭部の左側と右側に配置されます。電極Czは頂点とも呼ばれ、最も中心に位置する電極であり、鼻根から外後頭隆起、および横方向の距離測定の交点に対する位置合わせの中点として使用されます。標準的な10-20システムは合計21個の電極に基づいており、19個の頭皮サイトと、伝統的に頭皮電極の共通参照として機能してきた前頭極サイト(Fp1、Fp2)の2個の電極、および耳たぶ(A1、A2)に固定された2個の電極が含まれます。
- 図1.26-1. A: 頭頂部から見た国際10-20電極配置システム。B: 定期的な10-20電極の位置を示す頭部の左側面図。頭皮に配置された電極と下層の脳構造との関係に注目してください。
- 図1.26-2. 拡張された64電極アレイ。このような広範囲の配置システムは、主に特殊な研究のために使用され、臨床記録にはめったに使用されません。
- モンタージュ選択
- 図1.26-3. 前後方向の連結を持つ18チャンネルバイポーラモンタージュの例。電極位置間の数字は記録チャンネルを示します。したがって、数字の6はチャンネル6を意味し、F3とC3電極間の電位差を測定します。
- 図1.26-5. クイーンスクエアモンタージュの図。これは、側頭葉の活動を強調するために2つのリファレンシャルリードを含むように変更された18チャンネルモンタージュです。
- 図1.26-6. 正常なEEGで観察される典型的な固有脳リズムの例。中央のパネルは、各リズムの生のEEGにおける原型的な例を示しています。一番右のパネルは、時間x周波数変換後の各リズムがどのように見えるかを示しています。
- EEGアーチファクト
- 図1.26-7. 眼電図(EOG)アーチファクト。パネルA:眼の瞬きによって引き起こされる垂直EOG(VEOG)活動。VEOGは右眼窩の上下に固定された電極から記録されており、前頭極(Fp1、Fp2)および隣接する前頭部位でも明らかで、信号は後方に向かって減衰している。パネルB:視線の横方向シフトによって引き起こされる水平EOG(HEOG)。眼の外側隅角に両側から固定された電極で記録されている。
- 図1.26-8. 眼球アーチファクト補正
- 図1.26-9. 筋電図アーチファクト。パネルA:顎(側頭筋)の緊張。パネルB:額(前頭筋)の緊張。これらのアーチファクトは、観察されたときに被験者に顔の筋肉をリラックスさせるよう求めることで、通常軽減できます。
- 図1.26-10. 乳様突起を参照したEEG記録における発汗ドリフトアーチファクト。前頭極(電極Fp1、Fp2)のドリフトは額の発汗を示唆している。残りの頭皮電極全体に共通するドリフトは、乳様突起参照電極の発汗を示唆している。
- 図1.26-11. パネルA: 100 µVの範囲で表示された、参照なしEEGにおける60 Hzの周囲ノイズ。パネルB: パネルAのセグメントにおける顕著な60 Hzの活動を描写する高速フーリエ変換 (FFT) によるパワースペクトル解析。パネルC: 100 µVのバイポーラ参照モンタージュで表示されたパネルAのEEGセグメント。EEGには60 Hzの活動が残っているが、参照されると共通信号として相殺されることに注意。
- 図1.26-12. リファレンシャルモンタージュにおける物理的な電極の動き。パネルAは単一電極(C4)での影響を示しており、電極が物理的に位置を移動し、頭皮との接触点から外れていることを示唆している。パネルBは、すべての電極にわたる一貫したシフトパターンを示しており、参照電極サイトでの動きを示している。
- 図1.26-13. 過渡的および定常状態誘発活動は、離散的または定常状態の感覚刺激によって誘発される位相および時間ロックされた振動(AおよびB)です。これら両方のタイプの活動において、試行間の平均化は非位相ロック振動を相殺する効果があり(破壊的干渉のため)、誘発応答をそのままに拡大します。したがって、時間-周波数分析は平均化されたEEGに対して実行できます(すなわち、個々のすべての試行を平均化した後)。対照的に、誘発活動は通常、より高次の知覚処理中、例えば、コヒーレントな運動の知覚または幻想的な形状の知覚中に誘発されます(パネルCを参照)。これらの応答は、多くの場合、非時間ロックされています(試行ごとに時間的にジッターがあります)。したがって、試行を平均化すると、破壊的干渉のために目的の応答が相殺され、時間-周波数変換では見えません(パネルCの下部、左)。しかし、これらの応答は、時間-周波数分析が単一の試行に対して実行され、個々の試行の時間-周波数変換がその後平均化された場合に検出できます(パネルC、右)。(Skosnik PD, Cortes-Briones JA. Electroencephalography and cannabis: from event-related potentials to oscillations. In: Preedy VR, ed. The Neuropathology of Drug Addictions and Substance Misuse. Academic Press; 2016:851-862, with permission from Elsevier.)(カラーパネル参照)
- Q-EEG地形図分析とソース分析
- 図1.26-14. sLORETAを用いたEEGソース解析の例。左の時間-周波数変換は、聴覚クリック刺激に対する一過性のガンマ活動のバーストを示しており、それが一次聴覚皮質(右)に局在化されている。
- 応用臨床実践におけるQ-EEGの現状
- 応用臨床実践におけるEEG
- 正常か異常か:一般的な考察
- 正常EEGのバリエーション
- 議論のある鋭波または棘波パターン
- 病態生理学的特徴を誘発するためのパラダイム
- 図1.26-15. 9Hzのフリッカーレートで提示されたチェッカーボードパターンを用いた光駆動。パネルA:光刺激開始時のEEGの10秒表示。「s」は視覚的なチェッカーボード表示の開始を示す。パネルB:刺激前の10秒間を平均したEEGに基づくOz電極での1秒間セグメント。パネルC:Oz電極で刺激中に記録された10秒間の平均に基づく視覚誘発電位(VEP)。VEPは1秒間セグメントで9サイクルの振動パターンを表す。パネルD:Oz電極での1〜50Hzの周波数のウェーブレット変換による時間-周波数分解として表されたVEPで、約9Hzでピーク活動を示す。頭皮プロット(右下)は、活動が主に後頭部の電極サイトで生成されていることを示している。
- 過呼吸(ハイパーベンチレーション)
- 器質的病態生理におけるEEG所見の簡単な概要
- 精神医学の概要
- 結果の非特異性
- 精神医学における応用EEG
- 精神疾患におけるEEG所見
- 気分障害
- 認知症とせん妄
- 薬剤によるEEGの変化
- 薬理EEG
- 向精神薬 – 一般的な考察
- 伝統的神経弛緩薬(定型抗精神病薬)
- 非定型抗精神病薬
- 三環系抗うつ薬(TCAs)
- 選択的セロトニン再取り込み阻害薬(SSRIs)
- リチウム
- ベンゾジアゼピン
- その他の治療薬
- 乱用薬物
- 精神刺激薬
- 吸入剤
- 幻覚剤
- タバコ
- カフェイン
- その他の乱用薬物
- EEGと実験的研究パラダイム
- 誘発電位と事象関連電位
- 中期潜時成分(P50とN100)
- 中期潜時成分(P50とN100)
- P300
- ミスマッチ陰性電位(MMN)
- エラー関連陰性電位(ERN)
- まとめと今後の方向性:精神病理の体系的研究におけるEEG
- 研究成果の臨床応用への翻訳
- ステップ1
- ステップ2
- ステップ3
- ステップ4
- 参考文献
図1.26-1. A: 頭頂部から見た国際10-20電極配置システム。B: 定期的な10-20電極の位置を示す頭部の左側面図。頭皮に配置された電極と下層の脳構造との関係に注目してください。
下層の機能的解剖学との正確な局在化は想定すべきではありませんが、電極の位置と、その領域で検出される脳活動の性質については、いくつかの基本的な一般化がなされています。たとえば、前頭中心電極Fzは、意図や動機付けのプロセスに重要な前頭葉構造の近傍に位置します。一方、頂点付近の中心部位(C3, Cz, C4) は、感覚(特に聴覚登録)および運動プロセスに、後頭部の位置O1とO2は初期段階の視覚プロセスに敏感です。加えて、側頭部の位置(T3, T4, T5, T6) は記憶と情動プロセスに感度を示しており、側頭頭頂部の電極サイト(P7, P8) は、顔の構造的符号化に関わる神経活動に関する実験的研究で一般的に選択されます。繰り返しますが、これらの所見の言及は、EEGが既知の発生源への機能の局在化に効果的なツールであることを示唆するものではなく、むしろ、ユニークで空間的に分布した脳信号を特徴づけるための多チャンネル記録と標準化された電極配置の重要性を示す例を提供することを意図しています。なお、上記で説明した機能的関連性は、日常の臨床EEGから推測されるものではなく、この章の後半で議論される実験的な刺激誘発電位および課題関連手順から得られるものです。
10-20システムは、電極の拡張を可能にし、より広い範囲をカバーできます。追加の電極は、通常、元の10-20の位置間の距離の10%の位置に配置されます。アメリカEEG学会(現在はアメリカ臨床神経生理学会[ACNS])は、最大75の定義された電極位置の命名法を開発しました。しかし、現在確立されている臨床EEGの応用には、極めて多数の頭皮電極は不要であることを強調する必要があります。現在受け入れられている臨床適応症では、最小で16個(推奨される最小標準)、または最大でも32個の頭皮電極で最適なEEG記録を達成できます。与えられた記録状況で適用できる電極の数に対する制約として、準備と設定時間を常に考慮する必要がありますが、電流源解析と3次元モデリング(頭皮下の追加電極配置から恩恵を受ける)がデータ収集の目的である特殊な研究応用では、128または256の頭皮電極のアレイも珍しくありません。拡張された64チャンネル電極アレイの例は、図1.26-2で確認できます。
10-20電極配置システムにはいくつかの利点があります。配置システムが厳密な測定に基づいているため、電極配置誤差、特に同種の電極ペアの非対称な電極配置は大幅に最小化されます。このシステムはまた、検査室間だけでなく、単一の被験者から得られた連続的な記録間でも、記録を完全に比較可能にします。頭部のランドマーク間の距離のパーセンテージが配置位置に使用されるため、頭のサイズの違いにもかかわらず、頭皮電極は同じ皮質領域を覆います。さらに、頭皮に配置された電極と下層の脳構造との関係は、死体を用いた配置(電極部位に穴を開けて、後に電極下の皮質領域を特定する)や、CTスキャンを用いた研究によって確立されています(図1.26-1)。
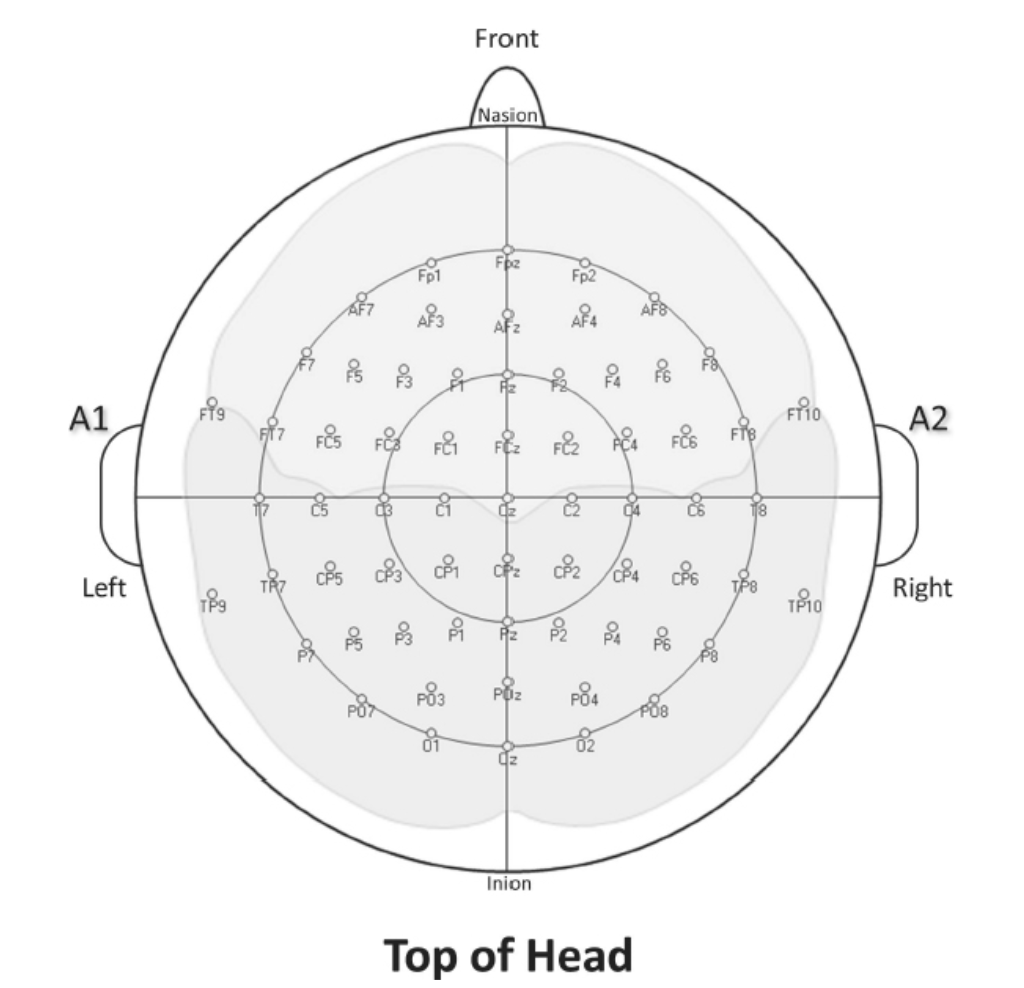
図1.26-2. 拡張された64電極アレイ。このような広範囲の配置システムは、主に特殊な研究のために使用され、臨床記録にはめったに使用されません。
頭皮電極は慎重に装着されなければなりません。電極下の皮膚は清潔で、油分や脂分が完全にない状態である必要があります。一般的な慣習は、表面の表皮の一部も除去するわずかに研磨性の洗浄電解質材料でその領域を擦ることです。これが行われた後、導電性電極ゲルを使用して金属ディスク電極を頭皮に装着できます。電極インピーダンスは10,000オーム(10 KΩ)以下に維持し、電極間で密接に一致させる必要があり、理想的には互いに1 KΩ以内であるべきです。電極装着手順は被験者にとって不快であってはなりません。しかし、頭皮のインピーダンスを低減する方法として、頭皮の擦り傷が皮膚の最も表層を穿孔するために通常使用されてきました。研究用に設計された現代のEEGシステムは、能動電極の使用を通じて高インピーダンス記録を可能にします(注:能動システムはまだ臨床使用が承認されていません)。能動電極システムは皮膚の擦り傷を必要とせず、むしろ、電極段階での前増幅を通じて許容可能な信号対ノイズ品質が達成されます。増幅の最初の段階を頭皮に近づけることで、遮蔽された電極ケーブルを介して増幅器への電気的干渉の伝播が減少します。その時点では、ラインノイズはEEG信号と同じスケールで増幅されます。能動電極は、電解質ゲルの慎重な設定と適用を通じて頭皮部位での良好な導電性を保証する必要性をなくすものではありませんが、受動電極システムに一般的な頭皮の擦り傷の必要性をなくすことで、全体的な準備時間を短縮する可能性があります。
標準的な頭皮電極のモンタージュを超えて、特定の応用では、深部脳構造から記録するために特別に設計された追加の電極が必要となる場合があります。鼻咽頭(NP)電極は、頭皮電極では得られない基底側頭葉により近いEEG記録を達成するために鼻孔に挿入されます(図1.26-1B)。これらのリードは10-20配置システムではPg1とPg2と指定されます。実際の組織の貫通は起こりません。NPリードは、長い(成人で最大15 cm)、湾曲したS字またはZ字形の絶縁線で、先端に銀球(電極)が付いており、挿入後に横方向に回転させて、球が鼻咽頭の天井に接触するように配置します。協力的な患者と熟練した技術者であれば、この手順は十分に許容されます。このリードは眼窩前頭皮質、側頭極、および海馬からの活動を検出するのに良い位置にあると推定されていますが、多くの欠点があります。主なものとしては、脈拍と呼吸によるアーチファクトを生成する傾向が高いこと、および中隔弯曲や鼻の炎症プロセスが存在する場合にはNPリードを使用できないことが挙げられます。また、錯乱、興奮、または好戦的な行動を示す多くの精神科患者では禁忌であり、リードを引き抜く可能性があり、鼻腔を裂傷させる可能性があります。その使用は、睡眠賦活EEGの取得を妨げる可能性もあり、協力的な患者でさえ、この手順を単純に拒否することも少なくありません。
モンタージュ選択
よくある誤解は、EEGが各電極サイトで検出された電圧を記録するというものです。そうではなく、EEGチャートの各チャンネルは、2つの電極間の電位の変動または振動する差を表します。したがって、多チャンネル記録では、各チャンネルからの活動は、選択された2つの電極間の電圧の変動する差を表します。頭に16、21、またはそれ以上の電極が配置されると、可能な電極ペアの数は多くなり、これらのペアを記録チャンネル間でどのように配置するかは複雑になる可能性があります。EEGの専門用語では、記録のために電極ペアが配置される方法をモンタージュと呼び、多くのモンタージュが可能であるにもかかわらず、限られた数のものだけが普及し、有用となっています。デジタルEEG機器の進歩以前は、モンタージュの選択は記録前に行われ、紙の記録でEEGがどのように視覚化されるかを決定していました。デジタルEEG機器が使用される場合、モンタージュは事前にプログラムされています。記録は1つのモンタージュを使用して行われますが、記録された(デジタル化された)信号は、オフラインで任意の構成で表示できます。

図1.26-3. 前後方向の連結を持つ18チャンネルバイポーラモンタージュの例。電極位置間の数字は記録チャンネルを示します。したがって、数字の6はチャンネル6を意味し、F3とC3電極間の電位差を測定します。
モンタージュは、異なる脳領域におけるEEG異常の検出を容易にし、左半球と右半球の活動の比較を容易にするように設計されています。モンタージュのセットアップには一般的なガイドラインがあります。最も重要なルールは、解釈を容易にするための単純さです。追加のルールには、奇数が左側、偶数が右側の電極を指すという規定が含まれます(図1.26-1A)。さらに、左側の電極は通常、記録の右側の電極の上または前に表示されます。同様に、前部の電極は、より後部に配置された電極の上または前に表示されます。
モンタージュには2つの主要なタイプがあります。それは、リファレンシャル(単極)モンタージュとバイポーラ(双極)モンタージュです。
リファレンシャルモンタージュでは、すべての電極は単一の共通の参照点に参照されます。これは伝統的に連結された耳(乳様突起を耳たぶの代わりに使用できます)で構成されていましたが、バリエーションとして、左右どちらかの耳のみを参照とするもの、片側の半球のすべての電極をその側の耳を参照とする同側耳参照、または片側の半球のすべての電極を反対側の耳を参照とする対側耳参照があります。両側部位に基づく参照を使用する場合に発生する可能性のある意図しないEEGの歪み(半球間に人為的な非対称性を引き起こす)のリスクを考慮すると、特にインピーダンスが2つの電極間で慎重にバランスが取れていない場合、鼻や頂点(Cz)を含む単一の正中線部位が推奨される場合があります。様々な参照オプションの利点と欠点に関する詳細な議論は本章の範囲を超えますが、すべてのEEG記録応用にとって理想的な(または集合的に受け入れられる)オプションは一つもないと述べておけば十分でしょう。「参照なし」の記録アプローチも、デジタルEEG記録で参照の選択を完全に回避するために採用されています。参照なしモンタージュは、共通平均または電流源密度(CSD)など、すべての電極からの信号の他の数学的導出に基づいており、CSDは局所電場電位(LFP)の2次空間導関数によって定義されます(EEGにおける電場電位の詳細な議論については、Nunez and Srinivasan, 2006のテキストを参照してください)。いくつかの提案されたガイドラインによると、参照電極の選択は、電気的に中性であり、明らかな生理学的(例:乳様突起参照は、適切に配置されていない場合、心臓信号に敏感になることがある)または運動(例:鼻参照は、適切に固定されていない場合、頭の動きに敏感になることがある)アーチファクトによって汚染されておらず、関心領域の電極から比較的遠い(例:参照に最も近いEEG活動が最も広範に差し引かれる)場所であるべきです。リファレンシャルモンタージュは、ある領域の鋭波または徐波が、別の領域と比較してマイクロボルトでどれくらいの大きさであるかという点で異常の大きさを確認することが重要な応用で最も選択されるでしょう。
一方、バイポーラモンタージュは、最大異常領域または異常活動の正確な発生源を特定するのに有用であり(そして実際、神経学の実践でははるかに広く使用されています)。バイポーラモンタージュでは、電極は頭を前後方向(図1.26-3)または左右方向(図1.26-4)に横断する電極の連鎖で、ある頭皮位置から隣接する頭皮位置に参照されます。したがって、与えられたEEG活動のチャンネルは、2つの入力から導き出されると考えることができます。異常な脳活動の大部分は、表面に負の電位として現れる傾向があります。
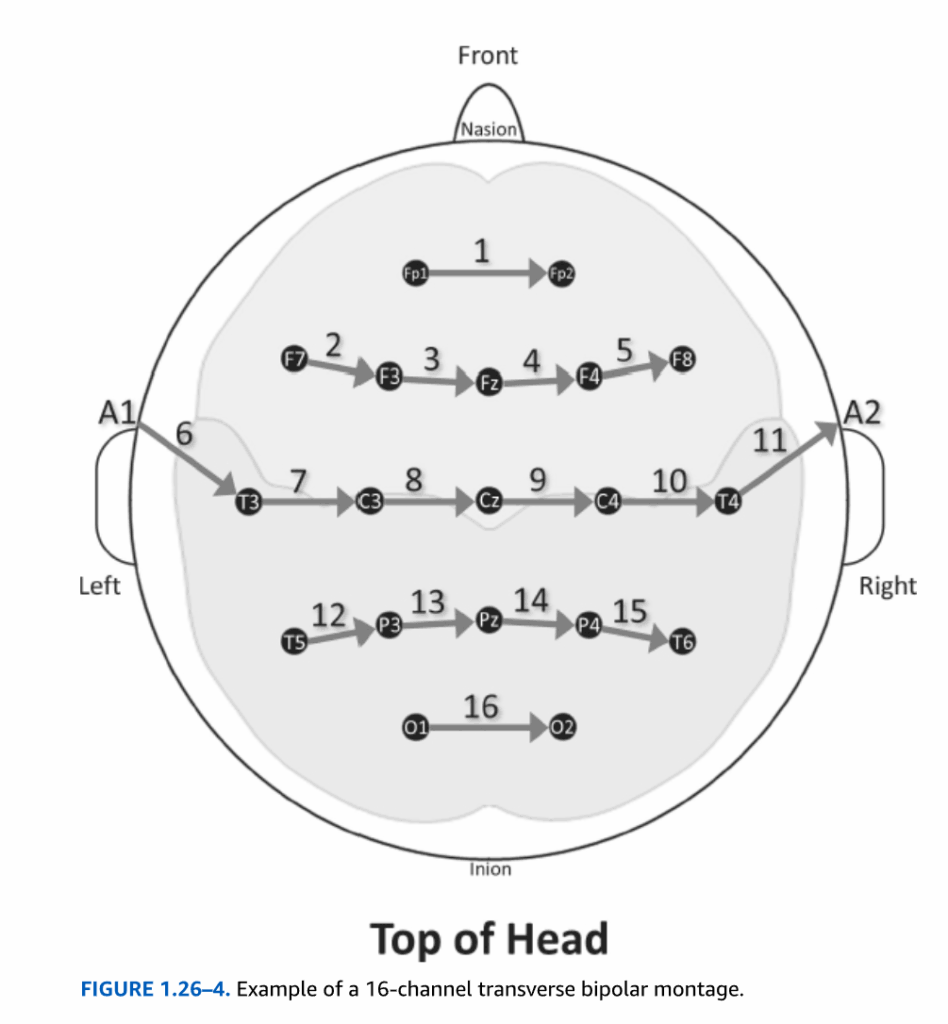
慣例により、ペアの最初の電極が入力1を構成し、2番目の電極が入力2を提供します。したがって、例えば電極ペアC3-P3では、最初の電極C3が入力1を構成します。EEG波形の偏向の方向は、入力1が、相対的に言って、入力2よりも「より陰性」であるか「より陰性でない」(すなわち、相対的に「より陽性」である)かに基づいています。入力1として指定された電極が負の電場の発生源に近く、したがって入力2よりも「より陰性」である場合、上向きの偏向(すなわち、負から陽性/上) が、入力1がイベントの発生源により近いことの指標として観察されます。逆に、入力1が電場の発生源から入力2よりも遠く、したがってより陰性でない場合、バイポーラペアの偏向は下向き(すなわち、陽性から負/下) になります。バイポーラ電極ペアが、強く高度に局所化された負の電場の片側からもう片側に縦方向または横方向に移動すると、入力1が相対的に陰性から相対的に陽性に変化するにつれて、バイポーラペアを横切って偏向の方向が変化します。この偏向の変化は位相逆転と呼ばれ、鋭く局所的な異常の局在化のための強力な方法です。
もう一つ、特別な言及に値するモンタージュ構成があります。これは精神医学EEGで特に有用な場合があります。それは、リファレンシャル電極配置とバイポーラ電極配置を組み合わせたモンタージュです。前頭領域から側頭領域を通り、後頭領域で終わる4つのバイポーラ接続に続いて、リファレンシャル配置が各後側頭領域(T5およびT6)を反対側の耳に接続します。この配置により、低振幅の活動がリファレンシャル電極によって強調され、バイポーラ電極ペアを介してさらに詳細な検査が可能になります。このモンタージュは一般的にクイーンスクエアモンタージュと呼ばれます(図1.26-5)。
EEG活動の外観は、記録モンタージュによって大きく異なります。大きな電極間距離はしばしばより高い電圧を生み出しますが、バイポーラペアにおける電極間の密な間隔は電圧を減少させる傾向があります。これは、両方の電極が電気的電場のほぼ同じ部分を覆い、両方に共通する信号が相殺されるためです。さらに、あるモンタージュでは視認できる特定のEEGパターンが、別のモンタージュでは歪んだり、完全にキャンセルされたりすることがあります。一部のモンタージュでは2つ以上の脳領域間の活動の区別が可能かもしれませんが、他のモンタージュ選択ではそうできない場合があります。例えば、共通(単極)参照記録が行われる場合、EEG睡眠パターンは中心および後頭領域でよく視覚化され、区別されます。しかし、バイポーラ前後方向連結(C3-O1およびC4-O2)が使用される場合、中心と後頭の睡眠活動の区別はもはや不可能であり、同種電極間の横方向バイポーラ連結では、睡眠パターンがまったく見えなくなることがあります。この問題は単なる学術的なものではありません。脳波医にとって関心のある放電は、神経生理学的に存在しているにもかかわらず、ある記録モンタージュでは検出可能であっても、異なるモンタージュが使用されている場合には完全にまたはほとんど検出できない場合があります。前述のように、従来のアナログEEGはモンタージュの変更を記録前に行う必要がありましたが、現代のデジタルEEGは、参照の変更(すなわち、再参照)やモンタージュをオフラインの手順(すなわち、データが記録された後)として行うことを可能にする点で、はるかに柔軟です。デジタルEEGの場合、参照の変更はEEG記録自体を変化させるものではなく、単に可視化の目的のためのデータの外観を変化させるだけです。
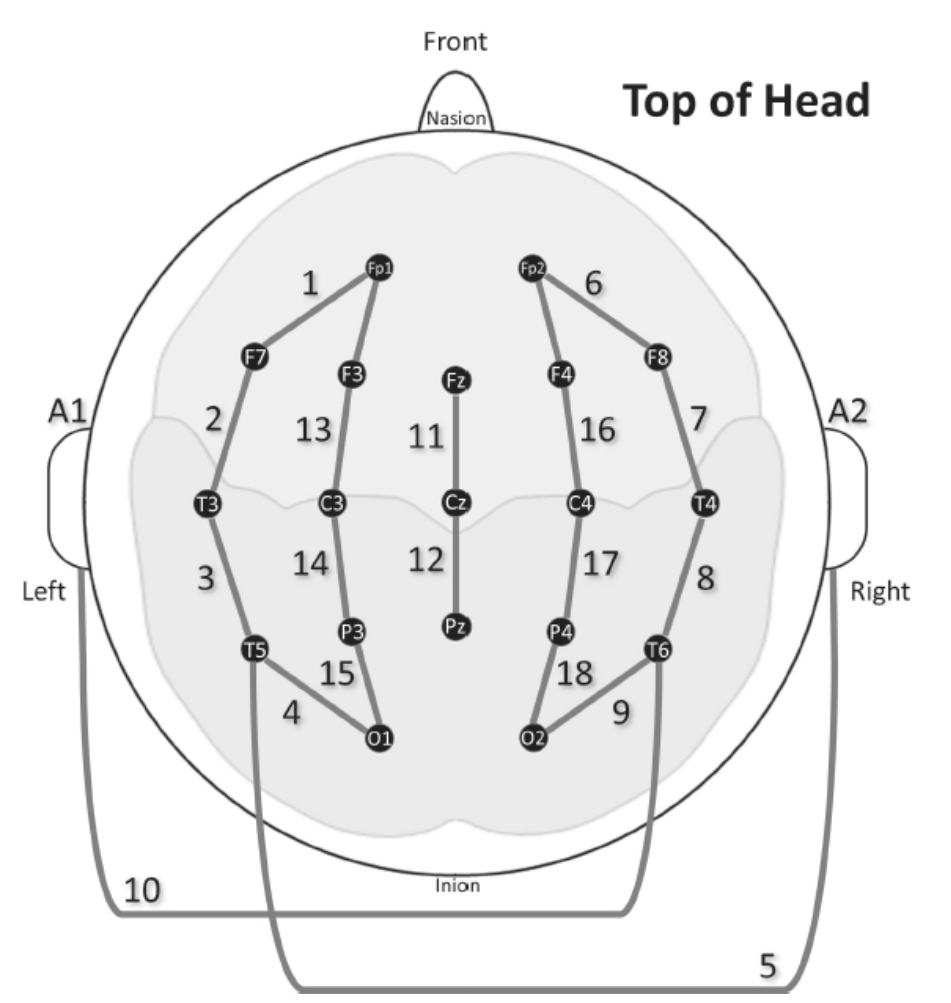
図1.26-5. クイーンスクエアモンタージュの図。これは、側頭葉の活動を強調するために2つのリファレンシャルリードを含むように変更された18チャンネルモンタージュです。
EEG増幅器
頭皮で記録された生体電位は非常に小さいため、視覚化し、その後に分析するためには増幅(通常は電圧利得1,000〜100,000倍または60〜100 dB)が必要です。実際、頭皮電位は通常、非脳波性生体電位(例:筋電、眼電、心電)、電線ノイズ、記録表面での電極導電不良による電圧シフトなど、多くの干渉源よりもスケールが小さいです。したがって、EEG増幅器にとって重要な要件は、脳信号を増幅しながら、これらの汚染信号の増幅を最小限に抑える能力です。これは、差動増幅器を使用することで達成されます。差動増幅器は2つの入力源を使用し、1つは電極から、もう1つは共通システム参照からです。「差動」という用語は、信号が増幅される方法を指し、2つの入力電圧間の差が増幅段階に通過し、入力間で共有される共通電圧(ノイズと見なされる)は除去されます。増幅された差動信号に対する共通電圧除去の比率は、同相除去比(CMRR) として定量化でき、相対利得の単位としてデシベル(dB)で表されます。前述のように、EEG記録の品質は、頭皮および参照部位で低いインピーダンスを達成し維持する能力に大きく依存します。CMRRに関して、インピーダンスが電極間でバランスが取れていることを確認することが特に重要です。なぜなら、不均等なインピーダンスは、差動増幅器が同相信号を検出および除去する能力を低下させるからです。初期のアナログEEG増幅器は、低電圧信号を視覚化できるほど高く増幅し、かつ高電圧信号が記録ペンの偏向限界を超えて「方形化」することを防ぐ増幅範囲を見つけるために、感度(すなわち、入力電圧に対するペンの偏向の比率)を調整する必要がありました。この方法で感度またはゲインを調整する必要性は、アナログ-デジタル(A/D)変換を採用した現代のEEG増幅器では不要になりました。これらの増幅器は、ペンと紙をEEG取得、視覚化、およびデータ保存を制御するためのソフトウェアに置き換えています。ほとんどのソフトウェアでは、入力ゲインをEEG取得中のどの時点でも視覚化のために必要に応じて調整でき、信号の実際の記録には影響しません。
従来のアナログEEG増幅器と現代のデジタルEEG増幅器の両方に見られる機能は、サンプリング段階の前に配置されたオンラインフィルターであり、サンプリング定理に従って入力信号の帯域幅を制限する役割を果たします。このフィルターは増幅器のナイキスト周波数に設定され、特定のサンプリングレートで正確に特徴づけることができる離散信号の最高周波数を定義します。サンプリングレートに対する高い信号周波数は、記録においてエイリアシングを生成する可能性があります。これは、アンダーサンプリングの結果として生じる正弦波の歪んだ表現です。ナイキストの定理は、サンプリング周波数(Fs)が信号に含まれる最高周波数(Fc)の少なくとも2倍でなければならないと規定しています。したがって、ナイキスト周波数は、FNyquist = Fc < Fs/2という式で数学的に表現されるように、増幅器のサンプリングレートによって制約されます。信号周波数とサンプリングレートは両方とも、共通の単位であるヘルツ(Hz)を使用して、1秒あたりのサイクル数/サンプルで測定されます。したがって、フィルタリングの最初の段階は、正確にサンプリングできる限界以上およびそれ以上のEEG周波数を減衰させるために使用される「アンチエイリアシングフィルター」と見なすことができます。臨床応用で使用される増幅器が最小でも256〜512 Hzのレートでサンプリングするため、エイリアシングは時間とともに懸念されなくなりました。これは、ほとんどのヒトの脳機能の範囲内(例:約1〜100 Hz)のEEGを特徴づけるのに十分すぎるほどです。実際、現代のデジタル増幅器は1,000 Hzをはるかに超えて、通常は最大20 kHzまでサンプリングできますが、そうするとデータファイルがはるかに大きくなり、より高いコンピュータ処理速度とストレージ容量が必要になります。さらに、有用な情報はほとんど得られません。この一般化の注目すべき例外は、特殊な増幅器を使用して7 kHzから50 kHzのレートでサンプリングされるイベントを含む可能性のある聴覚脳幹反応(ABR)のテストです。
デジタル記録
過去30年間で、古いEEG装置のアナログEEGトレースは、記録されたEEG信号のA/D変換、増幅、デジタルフィルタリング、保存、および多チャンネルEEGの定量的分析を提供するコンピュータシステムに大部分が置き換えられました。デジタルシステムは現在、研究室や臨床現場で普及しており、比較的安価で、いくつかの実用的な利点を提供します。これらは、長年にわたる紙記録の保管スペースの問題を減らすのに役立ち、また、元の記録後に選択された複数のモンタージュ、フィルター、垂直(ゲインまたは感度)および水平スケーリング(例:紙速度)を使用してEEG記録をレビューすることを可能にします。さらに、デジタル記録システムは、時系列分析だけでなく、スペクトル周波数、時間周波数、コヒーレンスや位相同期の関連方法、空間的時間源局在化およびモデリング(後のセクションで議論します)に依存するEEG信号処理と定量化のための多くの新しくエキサイティングな可能性を可能にします。
周波数フィルター設定
臨床または研究目的で分析されるEEG活動のほぼすべては、0.5〜50.0 Hz(時には最大100 Hz)の周波数範囲に収まります。フィルターは、本質的に、関心のある特徴を含む帯域幅に周波数の範囲を制限するために使用されます。臨床EEGでは、ローパスフィルター設定を70 Hzにすることが慣例となっており、これはこのフィルター設定を超えるEEG周波数が徐々に減衰し、それ以下の周波数が「通過」してさらなる分析のために保持されることを意味します。スペクトルのもう一方の端では、ほとんどの検査室では、このレベル以下の周波数の記録を減らすために、0.5〜1.0 Hzの間にハイパスフィルターも採用しています。EEGは時間に対する振幅の2次元画像として表現され、視覚化された波形はすべての周波数の総和を表すため、ブロードバンド信号から関心のある離散的な周波数帯域(例:アルファ帯域、8〜12 Hz)を分離するためにバンドパスフィルター(ハイパスフィルターとローパスフィルターを組み合わせたもの)が使用されることがあります。
残念ながら、頭皮電極は脳以外の起源の様々な電位を拾い、これらの多くはEEG周波数スペクトル内またはその近くの周波数を持っています。周波数フィルターは、アーチファクトによって生成される周波数の歪み効果をある程度軽減するかもしれません。しかし、フィルターは慎重かつ注意して使用しなければなりません。なぜなら、観察したい実際の脳波もフィルタリングしてしまう可能性があるからです。例えば、発汗中の皮膚伝導の変化によって生成される徐波(皮膚電位反応)は、影響を受ける記録チャンネル(額周辺の両側前頭-前側頭領域は特に影響を受けやすい)の真のEEG活動を完全に消し去るのに十分な大きさになることがあります。ハイパスフィルター設定を5 Hzに上げると、記録におけるこの汚染源を効果的に排除できますが、その代償として、同時に存在する可能性のある実際の全般的または局所的な徐波活動を減衰させてしまいます。また、望ましくない筋電図(EMG)活動を記録から除去または低減するために、ローパスフィルターを70 Hzから35 Hz、さらには15 Hzに下げることも一般的な慣行です。繰り返しますが、これを行う選択は妥協を伴います。なぜなら、高周波活動を減衰させると、特定の速いスパイク放電の正確な検出が不明瞭になる可能性があるからです。なお、このようにフィルターを調整することは、個々のレベルで重要な特徴を特定することを目的とした臨床応用では許容されます。当然のことながら、研究応用におけるフィルター設定の選択は、測定を無効にするような系統的な違いを導入しないように、データサンプル全体で標準化しておく必要があり、主に、評価される実験または神経生理学的プロセスにとって重要な周波数の分解能に基づいて行われます。
EEGの特性的な特徴
生のEEGの外観は個人間で多少異なるかもしれませんが、正常なEEGを特徴付ける周波数、電圧、波形の範囲は、覚醒時と睡眠時に十分に確立されています。正常なEEGトレースは、多くの異なる周波数の複雑な混合物で構成されており、現代のスペクトル分析に基づくと、ほとんどの健康な個人で一貫した認識可能なパターンが観察されます。一部の周波数帯は、他の皮質領域よりも一部の皮質領域でより強く発現します(例:後頭皮質でのアルファ波)。さらに、記録される被験者が注意深い覚醒状態から睡眠に移行するにつれて、周波数プロファイルは大幅に変化します。ベルガーの先導に続き、広範なEEG周波数スペクトル内の離散的な周波数帯はギリシャ文字で指定されています。ただし、ギリシャ文字の順序は完全に論理的ではなく、実際には歴史的な前例に由来していることに注意すべきです。例えば、ベルガーによって発見されたアルファリズムという用語は、それが最初に検出され記述されたリズムであったため、選択されました。対照的に、シータという名称は、この周波数範囲の活動が当初視床に由来すると考えられていたという事実から派生しています。
正常な固有周波数
最も確立され、認識されている固有リズムについて簡単に説明します。これらの各リズムの例は図1.26-6に示されており、生の波形、それらが占めるスペクトル(EEGパワー)帯域、および一般的な機能的関連性の視覚的表現を提供しています。これらの固有リズムの認識により、脳波医は臨床的な文脈でEEG記録を解釈することができます。詳細なレビューは本章の範囲を超えており、関心のある読者は、Greenfield、Geyer、およびCarneyの2020年の包括的なテキストを参照してください。
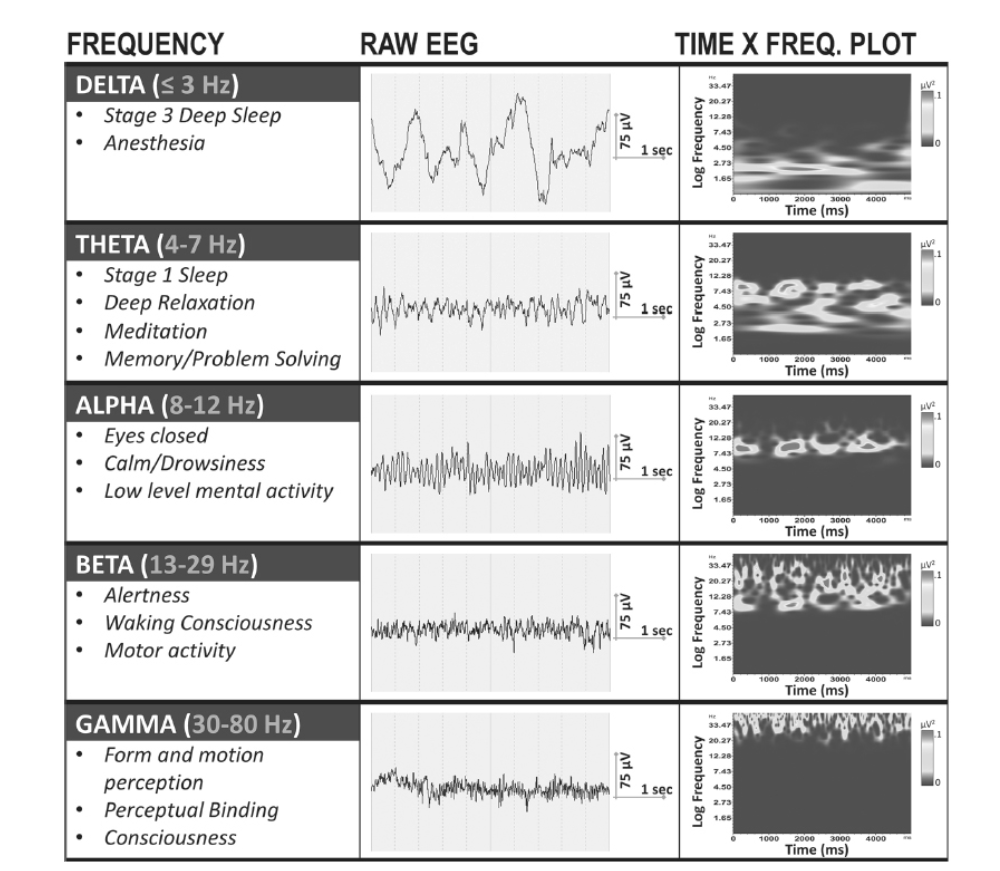
図1.26-6. 正常なEEGで観察される典型的な固有脳リズムの例。中央のパネルは、各リズムの生のEEGにおける原型的な例を示しています。一番右のパネルは、時間x周波数変換後の各リズムがどのように見えるかを示しています。
デルタ波
デルタ活動(≤3 Hz) は、正常な覚醒時のEEGには存在しませんが、より深い睡眠段階、特にステージ3の顕著な特徴です。麻酔下にある個人でも、より遅いデルタリズム(<1 Hz)が観察されます。デルタリズムは主に視床皮質回路によって生成されることが示されています。覚醒時EEGにおける有意な全身性または局所的なデルタ波の存在は、病態生理学的プロセスを強く示唆します。
シータ波
周波数4〜7 HzのEEGはシータ活動と呼ばれます。少量の一過性で不整な孤立したシータ活動は、特に前頭-側頭領域で、多くの正常な覚醒時EEGで見られます。覚醒時EEGでは持続的なシータ活動はやや限定的ですが、睡眠記録中の眠気の兆候となることがあり、ステージ1睡眠では非常に顕著です。短い期間のシータ活動は、問題解決や記憶に関連するプロセスなどの精神活動と関連していることも示されています。シータが海馬で生成されるという事実は、記憶におけるシータの役割を裏付けています。シータリズムは、特にワーキングメモリ課題中に新皮質でも生成されます。覚醒状態における過剰なシータ波は、全身性または局所性の性質を問わず、脳血流減少や代謝性脳症などの局所病理学的プロセスを示唆します。
アルファ波
周波数8〜12 Hzの高度に律動的なEEGはアルファ活動と呼ばれ、1929年にベルガーによって最初に記述された脳リズムです(すなわち、ベルガーリズム)。アルファ波は、正常な閉眼覚醒時EEGの支配的な脳波周波数を構成し、リラックス状態や最小限の精神活動中にも一般的です。したがって、アルファ波は通常、「アイドル状態の脳」のEEG相関として解釈されてきました。中年成人では、大多数の個人が10 Hzまたはそれに近いアルファ周波数を示しますが、正常な高齢者集団では8〜9 Hzの遅いアルファ周波数も珍しくありません。アルファ活動は、後部皮質、特に頭頂葉、後部側頭葉、および後頭葉で最も顕著であり、後頭領域がこの活動を検出するのに最も適しています。実際、アルファ活動の神経発生源は視覚皮質であり、視覚視床からの影響もいくらかあるようです。アルファ活動の検出は、より前方の位置から記録するほど減少し、この周波数は前頭前部電極部位ではまれです。アルファ活動は開眼によって消失するか、少なくとも著しく減衰します。さらに、アルファ活動は睡眠に入ると消失します(実際、ステージ1睡眠の基準の一つは、エポックあたり50%未満のアルファ活動です)。アルファ活動は、集中した注意や集中などの認知活動に非常に反応しやすいです。例えば、閉眼記録条件下では、視覚イメージの想起、数値計算、またはかなりの集中を必要とするほぼあらゆるものによって、アルファ波はブロックされたり減衰したりすることがあります。アルファ周波数は、様々な薬理学的、代謝的、または内分泌的変数によって増加または減少する可能性があります。
ベータ波
13〜29 Hzの周波数範囲はベータ波と呼ばれ、正常な成人覚醒時EEGの支配的な周波数の一つであり、特に前頭中心領域で顕著です。ベータリズムは通常、覚醒状態と関連しており、散発的な孤立した波ではなく、律動的な活動の連続としてベータ波が現れることは珍しくありません。ベータ波を含む混合周波数EEGは、REM睡眠でも観察されます。さらに、研究により、ベータ周波数は末梢EMG活動と相関しており、運動皮質の律動的なベータ波が運動指令の生成において重要な役割を果たしていることが示唆されています。ベータ活動の電圧は、上記の低周波数よりもほとんど常に振幅が小さいです。したがって、ガンマ波(後述)と同様に、ベータリズムはデルタ波、シータ波、アルファ波と比較して、生のEEGでは容易に視覚化されません(図1.26-6)。
ガンマ波
ここ数年間で最も研究されているEEG周波数の一つはガンマリズムであり、通常30〜80 Hzの活動と見なされています(研究者によってはガンマを100 Hzまで拡張することもあります)。ガンマリズムは、EEG研究の歴史のほとんどの間、ほとんど無視されてきました。これは一部には(1) 記録方法論、および(2) そのような高周波数が非神経起源(すなわち、ノイズ)であるという考えによるものでした。しかし、ロドルフォ・リナス、アンドレアス・エンゲル、ヴォルフ・シンガーなどの研究者による1990年代の画期的な研究は、一過性のガンマリズムが、コヒーレントな皮質表現を生成するために神経ネットワークの統合または「結合」において重要な役割を果たすことを示しました。それ以来、ヒトの感覚、知覚、認知におけるガンマリズムの役割は広く支持されています。ガンマリズムの異常は、現在、いくつかの精神疾患、特に統合失調症の核心的な特徴であると考えられています。
EEGアーチファクト
EEGアーチファクトとは、前述したように、脳起源ではない記録された活動のあらゆる発生源を指し、したがって、目的とする信号の正確な特徴付けを汚染するものです。残念ながら、アーチファクトの様々な発生源は豊富ですが、一般的に生理学的アーチファクトと生理学外アーチファクトの2つの発生源に分類できます。生理学的アーチファクトは、患者から記録された実際の生体信号ですが、脳以外の発生源によって生成されます。生理学外アーチファクトは、EEGまたは他の医療機器、および通常は患者の体上または記録環境に配置された電子機器を含む外部発生源によって引き起こされます。各アーチファクトのEEGにおける外観と、それに関連する発生源に習熟することは、EEG技術者にとって極めて重要です。これらの汚染信号のほとんどは記録中に軽減できますが、記録されたデータから除去するのははるかに困難な傾向があるためです。
生理学的アーチファクト
EEG記録と解釈中に注意すべき重要な生理学的特徴は、眼球アーチファクト、筋アーチファクト、発汗、および心臓アーチファクトですが、その他(例:舌の動き)も存在します。眼のまばたきや眼球運動の垂直方向のシフトは、EEG記録で顕著に観察され、特に前頭極(図1.26-7)の前頭電極サイト上で短期間の電圧の急激な変化によって識別されます。まばたきや垂直眼電図(VEOG)反応は、片眼の眼窩の上下に電極をバイポーラチャンネルとして固定することで、EEG記録でさらに捉えることができます。同様に、水平方向の眼球運動、すなわち「サッカード」は、短期間で平坦化する傾向のある電圧の変化として現れる特徴的なアーチファクトを生成し、左右の前頭電極チャンネル間で位相逆転が観察されます(陽性偏向の側は眼球運動の方向を示します)。VEOGと同様に、水平眼電図(HEOG)反応は頭皮EEGチャンネル(特にF7とF8)で検出されますが、最適な特徴付けは、眼の外側隅角近くに配置された電極のバイポーラチャンネルから恩恵を受けます。幸いなことに、いくつかの「瞬目補正」アルゴリズムが開発されており、デジタルEEGデータでVEOG/HEOGアーチファクトをEEG記録から除去するために利用できます(図1.26-8)。
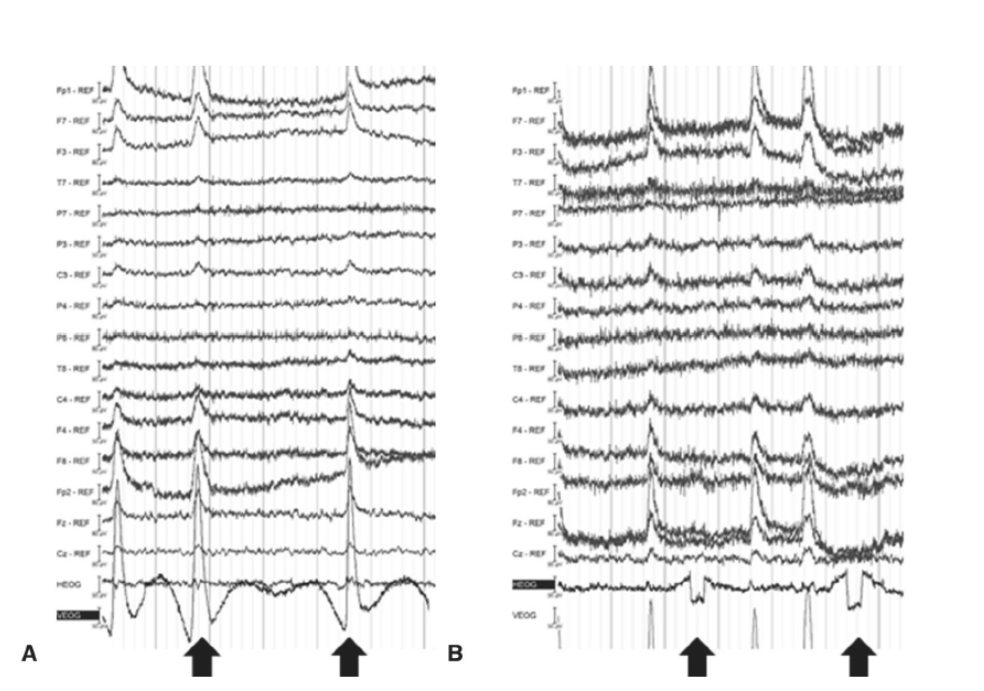
図1.26-7. 眼電図(EOG)アーチファクト。パネルA:眼の瞬きによって引き起こされる垂直EOG(VEOG)活動。VEOGは右眼窩の上下に固定された電極から記録されており、前頭極(Fp1、Fp2)および隣接する前頭部位でも明らかで、信号は後方に向かって減衰している。パネルB:視線の横方向シフトによって引き起こされる水平EOG(HEOG)。眼の外側隅角に両側から固定された電極で記録されている。
側頭筋の筋電図(EMG)活動(顎の食いしばりや咀嚼を示す)や前頭筋のEMG活動(額の緊張や収縮を示す)は、広範囲の頭皮電極に広がる高周波アーチファクトとして現れます(図1.26-9)。この種のEMGアーチファクトのEEG補正をオフラインで行うのはより困難であり、顕著な場合は大量のデータを破棄することにつながる可能性があります。前述したように、ローパスフィルターを使用してEMGアーチファクトを減衰させることは可能ですが、このオプションの使用は、関心のある周波数にも同様に影響を与える可能性があります。したがって、この種のアーチファクトは、EEG記録中に患者に顔の筋肉をリラックスさせるように事前に訓練し、必要に応じて記録を中断して注意を促すことによって軽減するのが最善です。明らかに、暗い部屋で読書するために目を細める、ガムを噛む、話すなど、これらの筋肉の使用に寄与するものは、EEG記録中は避けるべきです。
発汗アーチファクト(ガルバニック皮膚反応)は、長期間(例:2秒)にわたる信号のゆっくりとした波打つようなドリフトによって検出され、脳から生成される活動と容易に区別できます。ただし、これもゆっくりとした眼球の移動に似ています。発汗アーチファクトは、汗(塩化ナトリウム)が電解ゲルや電極金属と相互作用することによって引き起こされ、特に前頭電極サイトで最も顕著になる傾向があります(図1.26-10)。適切に温度調節された記録環境と、必要に応じて脱ぎ着できる重ね着をするよう患者に指示することが、発汗を避けるための最善の解決策です。一度発汗が始まると、それを軽減するのは困難な場合があります。
心電図(ECG)によるアーチファクトは頻繁には見られませんが、首が短い、またはずんぐりした「樽型」の体格など、患者の特定の身体的特徴によってその発生が増加する傾向があります。ECGアーチファクトは心臓の電気的および機械的動作の両方を反映し、脈拍数に密接に一致する周期(したがって、約1 Hz)を持つ一貫した律動パターンによって検出でき、側頭部の電極サイトや耳または乳様突起に配置された参照電極(電極が低すぎたり、頸動脈に近すぎたりする場合)で最も一般的に観察されます。ECGアーチファクトが直接多くの頭皮EEGチャンネルに影響を与える可能性は低いですが、参照チャンネルへのECGの侵入は、参照モンタージュを使用したデータ取得中、またはデータがオフラインで再参照された後に、この外観を示す可能性があります。これらの問題は、可能な限り参照チャンネルをECG信号が拾われない位置に移動することで、最善の方法で回避できます。
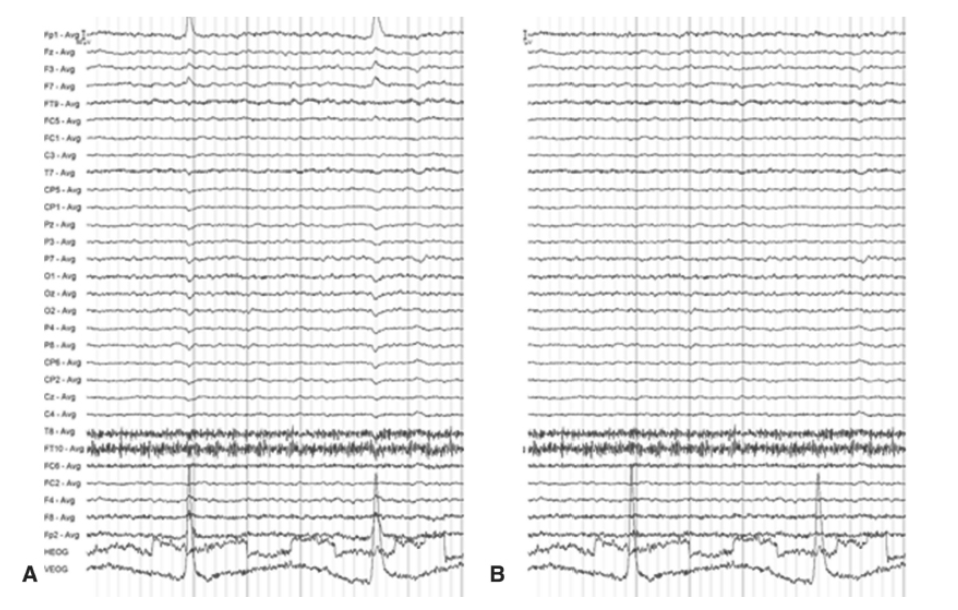
図1.26-8. 眼球アーチファクト補正
パネルA: EEGは、VEOGおよびHEOGチャンネルにおける眼球運動アーチファクトと、それが頭皮電極に伝播している様子を示しています。
パネルB: 同じデータに対して、Gratton & Coles法を用いたオフライン眼球補正を行った後のものです。この場合、補正は頭皮電極にのみ適用され、VEOGおよびHEOGの元のアーチファクトはそのまま残されていることに注目してください。
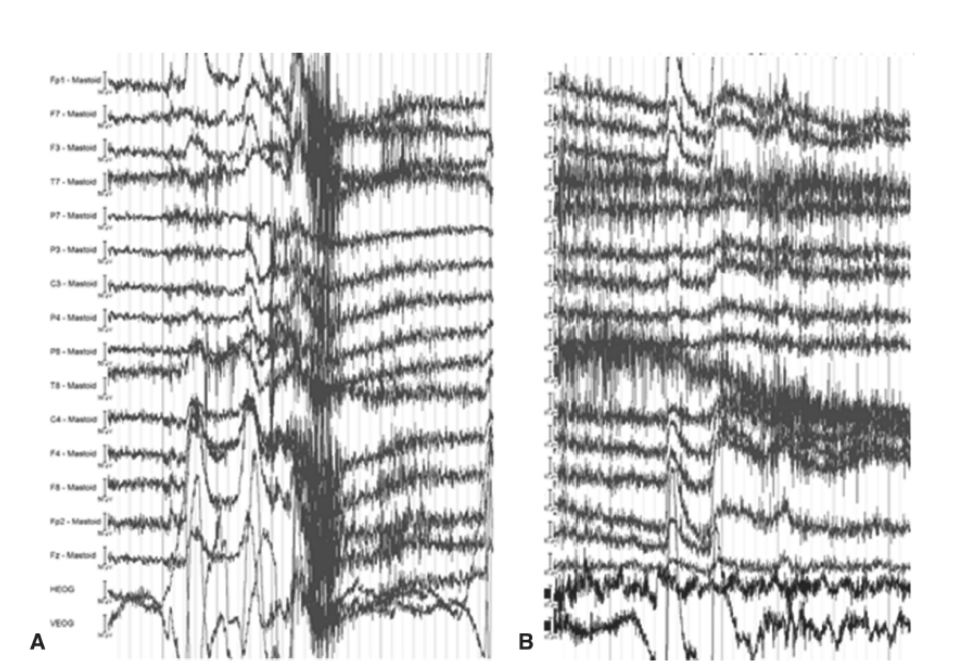
図1.26-9. 筋電図アーチファクト。パネルA:顎(側頭筋)の緊張。パネルB:額(前頭筋)の緊張。これらのアーチファクトは、観察されたときに被験者に顔の筋肉をリラックスさせるよう求めることで、通常軽減できます。
生理学外アーチファクト
生理学外アーチファクトの主な原因は、機器と環境に関する問題であり、適切な電極のセットアップ、使用間の機器の清掃とメンテナンス、および記録室の周囲の電磁ノイズ源の軽減に注意を払うことで最小限に抑えることができます。コンピュータモニター、照明、不適切にシールドされた電源ケーブルなどの電気機器は、米国における交流送電の商用周波数である60 Hzの信号を発します(世界の他のほとんどの地域では50 Hz)。ゲル/頭皮との接触不良やリード線の断線により、インピーダンスが高い、または不安定な電極は、記録環境の周囲ノイズを拾いやすくなります。これは、背景EEGに重なる速い正弦波として現れる持続的な60 Hzの活動によって識別されます(図1.26-11)。一部のEEG取得ソフトウェアパッケージでは、EEGをスペクトル周波数モードで表示することができ、疑問がある場合に60 Hzの特性的なピークを迅速に識別できます。

図1.26-10. 乳様突起を参照したEEG記録における発汗ドリフトアーチファクト。前頭極(電極Fp1、Fp2)のドリフトは額の発汗を示唆している。残りの頭皮電極全体に共通するドリフトは、乳様突起参照電極の発汗を示唆している。
長時間のEEG記録中に適切な電極接触を維持するには、ゲルの再塗布が必要になる場合があります。これは常にノイズの多いチャンネルに対処するための最初のトラブルシューティングステップとなります。電極の動きによっても引き起こされる接続の問題の検出は難しくありません。なぜなら、記録された信号への結果的な影響は真のEEGとはまったく似ていないからです(図1.26-12)。これらの場合、非常に大きな電圧変化が起こる傾向があり、通常のEEGモニタリングに使用されるゲイン設定では範囲外に「振り切れる」可能性があり、信号に規則性はありません。

図1.26-11. パネルA: 100 µVの範囲で表示された、参照なしEEGにおける60 Hzの周囲ノイズ。パネルB: パネルAのセグメントにおける顕著な60 Hzの活動を描写する高速フーリエ変換 (FFT) によるパワースペクトル解析。パネルC: 100 µVのバイポーラ参照モンタージュで表示されたパネルAのEEGセグメント。EEGには60 Hzの活動が残っているが、参照されると共通信号として相殺されることに注意。
電極で防ぐのがより難しい一般的なアーチファクトの1つに、「ポップ」があります。これは、通常、単一の電極(参照またはバイポーラモンタージュに含まれるチャンネルでない限り)に限定され、発生(または散発的に数回再発する)する、電圧の急峻で急速な偏向として現れます。これは、電気電荷が蓄積する頭皮と電極の間(コンデンサーのように)の電位の放電によって引き起こされます。ポップは、ここに挙げられた生理学外アーチファクト(ただしこのリストは網羅的ではありません)の中で、異常なEEG活動に似ている可能性がある唯一のものであり、てんかん波様活動と類似の特性をいくつか持っています。重要なことに、ポップは、一度に1つの電極のみで発生する傾向があるため、電場源からの電圧変化の外観を示さないこと、および比較的急峻な立ち上がりと遅い回復を特徴とする非対称な形態で現れることによって、真の神経生理学的発作性活動と区別できます。これらの特性は、訓練された目にはポップをてんかん性棘波から区別するはずです。
EEG定量化と特徴検出
EEG記録は、刺激誘発パラダイムと精神課題パフォーマンスの実験的測定と組み合わせることで、ヒトの脳機能と病理の神経ダイナミクスを研究するための強力な方法論を提供します。EEGデータは次元的かつ複雑であり、高い時間分解能(すなわち、ミリ秒レベル)でサンプリングされ、複数の頭皮位置(例:32〜256チャンネルのモンタージュ)に空間的に分布したイベントの時系列に基づいています。デジタルEEG記録と典型的な記録セッション(数時間に及ぶこともあります)で可能なものの下限を表す各パラメータを考慮すると、秒間256サンプル、32頭皮チャンネル、10分間の記録の場合、結果として得られるデータマトリックスには4,915,200個の離散データ点が含まれる可能性があります。これまで議論されてきた臨床EEGの例では、電極による各サンプル点の詳細な分析(これはどんな状況でも行われません)を伴うことはありませんが、数秒のタイムスケールでのデータの視覚的検査によって日常的に達成される目的では、このような豊富なデータは、視覚的検査と臨床的判断だけでは確認できない(あるいは見ることすらできない)重要な特徴を間違いなく含んでいます。アナログ紙EEGに対する他の利点の中でも、デジタルEEG記録技術の出現は、コンピュータ化された信号処理を通じて非常に詳細なEEG分析を可能にします。時系列記録を実験イベントに基づいてより短い期間またはエポックに分割するセグメンテーションや、複数のセグメントにわたって平均化する平均化(信号の一貫性は平均化され、ノイズは平均化されて消える)などの基本的なプロセスは、データの重要な特徴を分離する効率的な手段を提供し、その上に多くの追加の信号抽出方法を適用できます。デジタルEEG分析は広く「定量的EEG」と呼ばれ、Q-EEGまたはqEEGと略され、観察された特徴が病態生理学的プロセスを示唆するかどうかという質的な決定ではなく、EEGに含まれる特徴の大きさの測定と分化を強調しています。しかし、重い計算負荷が現在機械に引き継がれているとしても、Q-EEGはデータ品質と解釈に関して依然として同じ人間の判断を必要とします。Q-EEGにおけるアーチファクト汚染の問題が適切に対処されていない場合、それはコンピュータプログラマーが1世代前に述べた状況、すなわち「ゴミを入れればゴミが出る」という状況になり、処理されたデータに関する誤った結論につながります。Q-EEG分析に使用されるソフトウェアには、許容振幅または時間経過による振幅変化の閾値に基づいてアーチファクトを除去する自動または半自動機能が含まれており、これらを使用してEEG汚染のいくつかの発生源をマークして除去できます。しかし、これらのアーチファクト除去手順は、眠気のある患者の低周波活動など、すべての問題のある状態を通常軽減することはできず、視覚的なデータ検査は常に分析の最初のステップとして行われるべきです。

図1.26-12. リファレンシャルモンタージュにおける物理的な電極の動き。パネルAは単一電極(C4)での影響を示しており、電極が物理的に位置を移動し、頭皮との接触点から外れていることを示唆している。パネルBは、すべての電極にわたる一貫したシフトパターンを示しており、参照電極サイトでの動きを示している。
最初のデータクリーニングを超えて、技術者または実験者は、検査中の神経生理学的現象を最適に特徴づけるために使用される時間点と信号抽出方法の選択に関して、さらに多くの技術的な決定に直面します。一部の処理ステップを他のステップより先に行うことは、必須ではないにしても賢明ですが、それぞれには、共通の合意や標準化が存在しない多数のパラメータに関する決定が含まれます。さらに、特定の機能を実装する方法は通常複数あり、ソフトウェアパッケージによって異なる場合があり、ユーザー(通常、コンピュータサイエンスやエンジニアリングにおける広範な訓練を欠いている)は、それぞれの複雑さや前提条件に気づかない可能性があります。EEG分析のために利用可能な無料のオープンソースツールキットも多数あり、意欲のあるユーザーは様々な分析ルーチンをカスタマイズできます。したがって、デジタル記録と分析は、EEGから特徴を探索し抽出する能力を大幅に高めますが、そのような方法の適用は、標準化された実践というよりも、まだ洗練された芸術に近いと言えます。
EEG定量化に最も一般的に使用される方法は、主にフーリエ変換に基づくスペクトル分析です。フーリエ変換は、時間関数として表現された信号を、その構成要素である周波数成分に分解します。音楽で演奏される和音の類推を考えると、和音をアルペジオ(例:イ長調の和音を個々の音A-C#-Eとして演奏する)として演奏すると、聴者は和音全体の調和の取れた品質の構成要素として、各音の周波数と音量を理解できます。同様に、フーリエ変換は、ブロードバンド(例:和音)の総パワーと個々の周波数(例:音符)のバンドパワーに従って、信号をスペクトルパワー(信号振幅の二乗)の測定値として表します。EEG信号処理では、フーリエ変換は最も一般的に高速フーリエ変換(FFT) として実装されます。これは、計算に提出されるサンプル総数を2のべき乗(例:64、128、256、512)で表現できる合計サンプル数を持つ固定長の波形を表すと仮定して、フーリエ変換を計算するための効率的なアルゴリズムを適用します。したがって、FFTを適用するには、データが固定長の波形であり、サンプル総数が2のn乗(例:64、128、256、512)で表現できることを前提とします。FFTの周波数分解能は、サンプリングされたデータの長さに依存し、低周波数を分解するためにはより長いデータセグメントが必要です。例えば、1秒のセグメント長を使用して正確に特徴づけることができる最低周波数は1 Hzであり、0.1 Hzの信号を分解するには10秒のセグメント長が必要です。FFTを使用する場合、分析がセグメント内のすべてのサンプルを時間に無関係に等しく扱うことにも留意することが重要です。したがって、時間変動関数には非感受的であり、定常的であると仮定される信号に最も適しています。
一定期間にわたって発生するスペクトルパワーの変化の定量化は、時間-周波数分解によって可能になります。この目的のために、FFTのバリエーションである短時間フーリエ変換(STFT) が開発されましたが、EEG分析では通常、ウェーブレット変換に基づくより洗練されたアルゴリズムが採用されています。ウェーブレット変換に関わる理論と数学的計算は本章の範囲を超えますが、EEG分析の文脈で書かれた雄弁な記述は、Cong、Ristaniemi、およびLyytinen(2015)の方法ハンドブックに見られます。FFT、つまり時間から周波数への変換と、ウェーブレット、つまり時間-周波数変換を区別する上で心に留めておくべき基本的な点は、FFTによる周波数抽出が分析の全時間窓に適用されるのに対し(信号は時間的に局所化されない)、ウェーブレット分析は周波数抽出を時間窓の各サンプルに局所化するという点です。後者は、信号が時間とともに進化するにつれて周波数成分構造の変化を調べる場合に有利であり、知覚-認知実験により適切な分析となる傾向があります。とはいえ、時間分解能が周波数分解能を犠牲にするという点で、FFTが好まれる場合もまだあります。
臨床および研究文献の両方で、いくつかの種類の時間-周波数アウトカム測定がしばしば議論されており、これらはそれらを引き出すために使用されるパラダイムと利用される信号処理技術によって異なります。最も一般的には、時間-周波数分解によって測定される振動活動は、過渡誘発、定常状態誘発、および誘発の3つのカテゴリに分類されます(図1.26-13)。周波数ベースの分析を使用するQ-EEGは、独自の機能的特性を持つ神経生理学的に生成された振動成分のアンサンブルとしてのEEGの理解に大きく貢献してきました。例えば、覚醒時EEGにおける病理学的所見と伝統的に見なされてきたデルタリズムは、内部集中(すなわち、被験者が外部入力を無視しなければならない条件) と関連していることが示唆されています。さらに、前頭部で生成されるシータ活動が符号化およびワーキングメモリ機能と関連すること、遅いアルファ帯域(7.5〜9.5 Hz) が注意プロセスと関連すること、速いアルファ帯域(9.5〜13.5 Hz) が記憶検索と関連すること、ベータ活動が感覚情報の統合と関連することなどが挙げられます。さらに、30 Hzを超える周波数、いわゆるガンマ帯域に関連する機能がより最近発見され、現在、精神医学研究の主要な焦点となっています。哺乳類の脳における刺激誘発ガンマ振動活動のデモンストレーションは、神経群の同期(感覚入力の異なる側面を個別に符号化)が中枢神経系(CNS)における基本的な「結合」プロセスとして機能し、感覚求心性神経を介して伝達される情報が統合されて統一された知覚を形成することを可能にするという最初の経験的証拠でした。高周波ガンマ同期は短距離局所ネットワークのコミュニケーションをサポートすると考えられていますが、より遅い振動リズムは、長期間(例:記憶符号化)にわたる広い皮質距離(例:異なる感覚モダリティの領域間)にわたる統合を必要とする認知プロセスに関与しています。
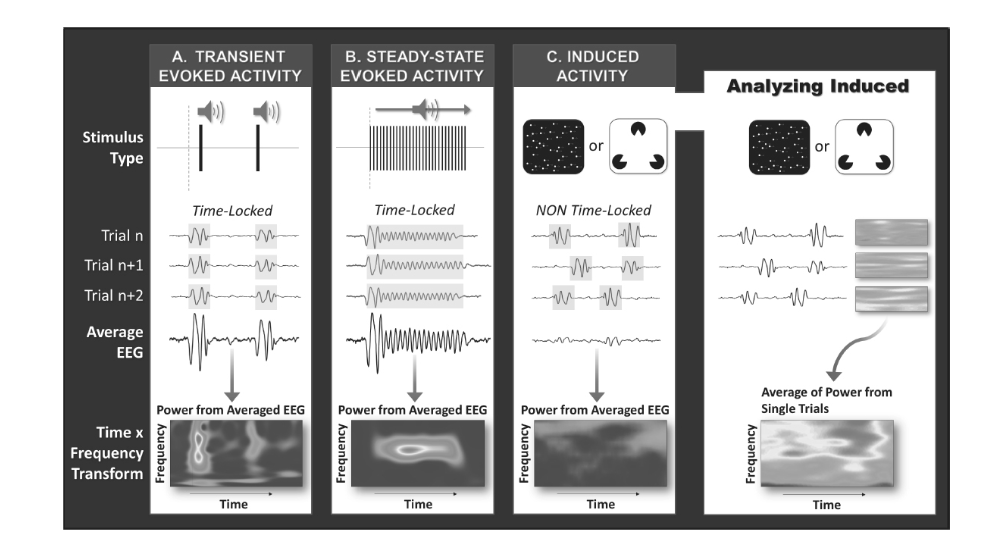
図1.26-13. 過渡的および定常状態誘発活動は、離散的または定常状態の感覚刺激によって誘発される位相および時間ロックされた振動(AおよびB)です。これら両方のタイプの活動において、試行間の平均化は非位相ロック振動を相殺する効果があり(破壊的干渉のため)、誘発応答をそのままに拡大します。したがって、時間-周波数分析は平均化されたEEGに対して実行できます(すなわち、個々のすべての試行を平均化した後)。対照的に、誘発活動は通常、より高次の知覚処理中、例えば、コヒーレントな運動の知覚または幻想的な形状の知覚中に誘発されます(パネルCを参照)。これらの応答は、多くの場合、非時間ロックされています(試行ごとに時間的にジッターがあります)。したがって、試行を平均化すると、破壊的干渉のために目的の応答が相殺され、時間-周波数変換では見えません(パネルCの下部、左)。しかし、これらの応答は、時間-周波数分析が単一の試行に対して実行され、個々の試行の時間-周波数変換がその後平均化された場合に検出できます(パネルC、右)。(Skosnik PD, Cortes-Briones JA. Electroencephalography and cannabis: from event-related potentials to oscillations. In: Preedy VR, ed. The Neuropathology of Drug Addictions and Substance Misuse. Academic Press; 2016:851-862, with permission from Elsevier.)(カラーパネル参照)
これまでに述べた時間ベースおよび周波数ベースの分析(図1.26-6および図1.26-13)は、神経活動と機能のより正確な特徴付けのための道を開いてきました。しかし、これらの方法で抽出される情報が空間的に局所化されたまま(例:1つの電極または電極群に基づいて分析される)であるため、神経伝達の完全に正確な表現を提供するには不十分な場合があります。さらに、これらの方法は神経活動の大きさを時間の平均表現として効果的に定量化しますが、時間セグメント間の活性化の一貫性の程度は失われます。
異なる空間的位置に位置する、または異なる時間点で発生する周波数アンサンブル間の関係は、同期の測定として、コヒーレンス測定を用いて確認できます。コヒーレンス分析は、信号の周波数分解(例:FFT)および時間-周波数分解(例:ウェーブレット)に続き、これらデータの複雑な形式に適用され、2つの信号の線形依存関係における関連性の強さの測定となります。コヒーレンス分析は、定常データおよび時系列データに適用され、2つの領域間のスペクトルパワーの関係(すなわち、空間コヒーレンス)、ある周波数が別の周波数に依存すること(すなわち、クロススペクトルコヒーレンス)、および繰り返される試行における振動活動の位相周期の一貫性(すなわち、試行間コヒーレンス) を測定します。スペクトルパワーとコヒーレンス測定を組み合わせることで、ヒトEEGを構成する神経ダイナミクスの確認が大幅に強化され、脳領域の機能的相互作用を大規模な空間スケールで理解する能力が高まります。
Q-EEG地形図分析とソース分析
コンピュータ化されたEEG地形図(CET) またはQ-EEGマッピングは、多チャンネルQ-EEGデータのために開発されました。この技術は、瞬時振幅やバンドパワーなどのQ-EEGパラメータの地形表現のための2次元または3次元マトリックスの構築を可能にします。記録電極に対応しないマトリックス点は、最も近い3つまたは4つの記録電極の値を補間して計算されます。他のイメージング技術と同様に、異なる被験者集団や実験条件間の比較のために統計的確率マップも実装できます。色分けされたマップは、多チャンネル情報をより即座に理解可能にします。しかし、この技術によって提供される地形情報は、EEG記録に使用される参照電極に決定的に依存します。この問題に対処するために、平均参照(すなわち、各電極の値からすべての電極の平均を差し引く)や、以前に言及した表面ラプラシアンまたはCSDアプローチなど、参照に依存しないデータを提供するいくつかの変換が提案されています。ただし、頭皮上の地形図は、参照に依存しない計算結果であっても、「逆問題」と呼ばれるものにより、基底となる脳発生源に関する生理学的推論を可能にしないことを認識することが不可欠です。本質的に、この問題は、多数の神経活性化パターンが同じ頭皮地形図を生成しうるため、頭皮レベルで記録された電場電位の発生源を局所化することの不正確さを認識しています。
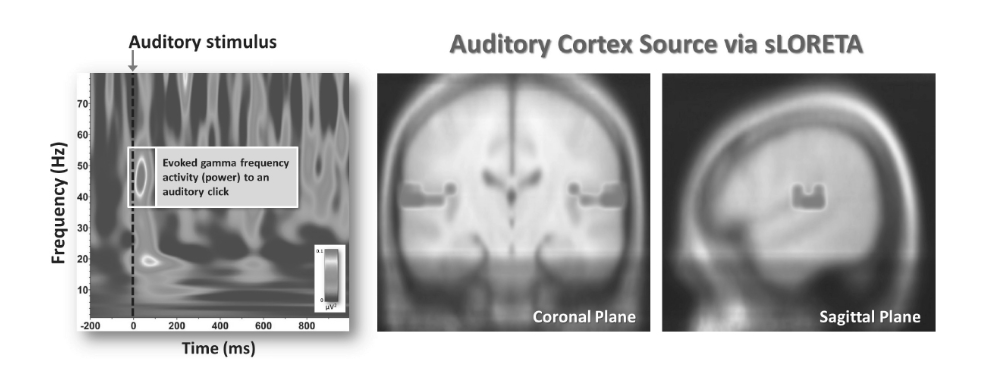
図1.26-14. sLORETAを用いたEEGソース解析の例。左の時間-周波数変換は、聴覚クリック刺激に対する一過性のガンマ活動のバーストを示しており、それが一次聴覚皮質(右)に局在化されている。
このように、1989年にフランク・ダフィー、ディートリッヒ・レーマン、フェルナンド・ロペス・ダ・シルバ、およびその他の著名な科学者たちは、脳の電磁活動、地形図、およびソース分析を調査する技術の応用とさらなる発展を促進するために、国際脳電磁気地形学会(ISBET) を設立しました。近年、逆問題を解決するための様々なアルゴリズムが提案されています。これらは、等価電流双極子モデルと電流分散源モデルに分けられます。最近の比較研究によると、双極子モデルは単一のソースが期待される場合にのみ適しています。分散源モデルの中では、低解像度脳電磁気トモグラフィー(LORETA)、またはより最近では標準化された低解像度脳電磁気トモグラフィー(sLORETA) が、特に複数のソースやノイズが存在する場合に、局在化誤差の点でより大きな有効性を示しています。簡単に言えば、sLORETA法は、適切に標準化された離散的、3次元分散型、線形、最小ノルム逆解法です。sLORETAで使用される特定の標準化形式は、トモグラフィーにテスト点ソースに対する正確な局在化の特性を与え、低い空間分解能(すなわち、隣接する神経源は高い相関を示す)であるものの、正確な局在化を伴う標準化された電流密度画像をもたらします。sLORETAは、測定および生物学的ノイズが存在する場合でも局在化バイアスがないため、現在選択される方法となっています。sLORETAの現在の実装では、MNI152テンプレートを使用した現実的な頭部モデルで計算が行われ、3次元解空間は確率論的Talairachアトラスによって決定された皮質灰白質に限定されます。したがって、sLORETA画像は、神経解剖学的モントリオール神経学研究所(MNI)空間における各ボクセルでの標準化された電気活動を、推定電流密度の正確な大きさとして表します(図1.26-14)。いくつかの研究は、sLORETAとfMRIなどの他の神経画像診断法との間の一貫性を報告しています。LORETA/sLORETAソフトウェアは、ロベルト・パスクアル・マルキと彼のグループの先駆的な研究に基づいており、関連する参考文献は無料でダウンロードできます(http://www.uzh.ch/keyinst/loreta.htm)。ただし、ソース局在化の方法/モデル、分析ステップ、および関連するソフトウェアパッケージは進化し続けていることに注意すべきです。
応用臨床実践におけるQ-EEGの現状
デジタル技術によって可能になったEEG信号抽出の進歩にもかかわらず、Q-EEGが臨床診断ツールとして受け入れられている特定の条件は少なく、これらの場合でも、従来の臨床EEGの解釈を補完するためにのみ使用されます。AETNA Health Insuranceの承認された適応症リスト(最終レビュー:2021年4月15日)によると、Q-EEGは、以下の条件において、伝統的なEEGの補助としてのみ医学的に必要とされています(http://www.aetna.com/cpb/medical/data/200_299/0221.html、2021年11月17日アクセス):
- その後の専門家による視覚的なEEG解釈を容易にするための外来EEG記録。
- 手術室またはICUにおいて、早期の急性頭蓋内合併症を検出するための周波数傾向による連続EEGモニタリング。
- 脳血管疾患の症状を持つ特定の患者の評価で、神経画像およびルーチンEEG検査が結論的でない場合。
- 認知症および脳症の評価で、初期臨床評価後も診断が未解決の場合。
- 高リスクICU患者におけるてんかん発作の可能性のスクリーニング。
- 長期EEGモニタリングにおけるてんかん性棘波または発作の可能性のスクリーニング。
- 難治性てんかんの術前評価における地形的電圧および双極子分析。
記述された適応症のリストは、約20年前にACNS(American Clinical Neurophysiology Society)とAAN(American Academy of Neurology)の役員会が1997年にJournal Neurologyに発表した推奨事項よりも網羅的ではありません。ACNS/AANレポートの結論と一致して、AETNAは、その臨床的有用性を支持する適切な科学的証拠が不足しているため、Q-EEGの他のすべての適応症に対する使用を「実験的および調査的」と見なしています。サポートされていない適応症として明示的にリストされている精神医学的状態には、アルコールおよび薬物使用障害、不安障害、アスペルガー症候群およびその他の自閉症スペクトラム障害、注意欠陥障害、双極性障害および大うつ病、パニック障害、PTSD、統合失調症に加え、軽度または中等度の頭部外傷、スポーツ脳震盪、耳鳴りを含む後天性損傷の症例が含まれます。さらに、研究文献における好意的な報告にもかかわらず、Q-EEGは向精神薬の有効性を予測するための使用について、まだ承認を得ていません。
応用臨床実践におけるEEG
EEGが精神医学に起源を持つという事実にもかかわらず、その使用の強力な最初の推進力は神経学、特にてんかんの研究からもたらされました。1934年から1940年にかけて、構造的脳病変と様々な発作性疾患に焦点を当てたEEG研究が著しく普及しました。1934年、フレッド・ギブス率いるチームは、古典的な毎秒3回の棘徐波複合体を発見しました。これは小発作欠神発作に特異的であることが証明されました。その10年が終わる前に、彼らは大発作およびミオクローヌス発作に関連するEEGパターンと、小発作よりも周波数が遅い(そしてプチマル変異体という混乱しやすい名前が付けられた)びまん性棘徐波パターンを記述し、これが大発作および高頻度の精神遅滞と関連していることを示しました。彼らはまた、精神運動発作(現在は複雑部分発作[CPS]) という用語を導入し、発作中の精神運動発作を特徴づけるEEG所見を記述しました。その後、1947年と1948年には、この疾患の間欠期のEEG相関となる前部側頭棘波焦点を記述しました。神経学的側面では、構造的脳病変の研究は、1930年代から1950年代の画期的なEEGの発見によって進展しました。1935年、オットフリード・フェルスターとヘルムート・アルテンベルガーは、EEG記録における局所的な徐波が脳腫瘍の近くにしばしば現れることを報告し、その1年後、グレイ・ウォルターは脳腫瘍のEEGによる局在化技術を実証することで大きな進歩を遂げました。オックスフォードのデニス・ウィリアムズはその後、第二次世界大戦中に受けた外傷性頭蓋内損傷を研究し局在化するためにEEG記録の使用を開始しました。最後に、脳外科医のワイルダー・ペンフィールドと心理学者(後に神経生理学研究者となった)ハーバート・ジャスパーの協力により、1937年にモントリオール神経学研究所にEEGが導入され、電極皮質脳波(ECoG) と呼ばれる直接頭蓋内EEG記録技術が開発されました。ECoGは、1950年代の画期的なモントリオール手術の一環として、外科的切除のためのてんかん原性領域の検出に応用されました。
正常か異常か:一般的な考察
EEGが精神医学において有用な評価ツールとして認識されてこなかった要因の一つは、EEG所見を正常か異常かという単純な二分法で概念化しようとする試みです。精神科医はしばしば患者のEEGが異常かどうかを尋ね、肯定的な回答か否定的な回答かで満足しているようです。EEGが異常であれば、その患者は神経科に属し、正常であれば、患者の精神科的状態が確認されるという期待がありました。さらに、出版された研究文献の多くは、異常の正確な性質を述べずに、特定の研究集団における異常なEEG所見の割合を報告しています。実際には、単純な正常・異常の二分法は、EEGの動的な性質とは矛盾しています。特に、医学で用いられるより一般的で信頼性高く識別可能な生理学的機能の測定値(例:血圧)にEEGを等しくするような、より客観的な定量化手段を用いずに従来の視覚的検査で解釈する場合に顕著です。
EEG所見の範囲は、二分法としてではなく、一方の端に疑いなく正常なEEGがあり、もう一方の端には可能性のある、そして最終的にはより明確な臨床的意義を持つ特徴へと広がる連続体として存在します。正しく異常と分類される一部のEEGパターンは、臨床的表現性の連続体の低端にあり、診断決定に常に強く寄与するとは限りません。臨床的関連性が限定的な軽微な所見の報告を受けた精神科医は、現在のまたは過去の器質的徴候が検出されない場合、EEGの価値に疑問を抱き始めるのも無理はありません。肝心なことは、EEGが異常であるかどうかを、あたかも二分法の一方であるかのように単純に尋ねるべきではなく、どのような特定の機能が存在し、もしあれば、その機能にどのような既知の臨床的相関が関連している可能性があるかを尋ねるべきだということです。異常な機能の臨床的意義について疑問が残る場合でも、この所見を単に無視すべきではなく、少なくとも、フォローアップのEEG、追加の脳画像診断、神経心理学的評価、使用中の薬剤や違法薬物の見直し、または心臓や代謝機能の他の検査測定の必要性を示す可能性があります。
正常・異常の二分法への依存による混乱に加えて、「正常な人口の10%から20%が異常なEEG所見を示す」と述べる文献報告は、精神科診療におけるEEGの価値に関して不確実性をもたらす可能性があります。このような記述はほとんど適切に明確化されることがないため、非常に誤解を招きやすい傾向があります。もし権威あると思われる情報源で、正常な人口の20%が異常なEEG所見を持つと読んだ場合、診断特異性が低く、論理的に臨床的有用性も低いという印象を受け、異常なEEG報告をフォローアップすることに抵抗を感じるのも理解できます。さらに重要なことに、同じ理由で患者をEEG検査に紹介することに同様の抵抗があるかもしれません。この問題を適切に捉えるために言えば、正常な人口における相当な割合の異常なEEG報告は、臨床的または診断的関連性が低い軽微な所見の包含によって大きく歪められています。Nash Boutrosらが正常対照集団におけるEEG所見に関する文献を包括的にレビューしたところ、ほとんどの対照研究が、EEG結果に影響を与える可能性のある様々な医学的および精神医学的変数について被験者をスクリーニングしなかったために、深刻な問題があったという事実を浮き彫りにしています。このグループは以前、多数の公開されたEEG対照集団研究のデータを再分析しました。境界線上のEEG所見をデータから除外すると、EEG異常の発生率は、健康な成人6,182人の3.2%、健康な子供1,450人の3.5%に減少し、認められた突発性EEG異常の有病率は、混合年齢の健康な被験者11,560人のサンプルでわずか1.14%にまで減少しました。
正常EEGのバリエーション
睡眠パターン
眠気状態と睡眠状態を特徴づけるEEGパターンは、覚醒時に見られるパターンとは異なります。睡眠EEGの微妙なニュアンスを詳細に説明することは本章の範囲を超えています。簡単に言えば、閉眼覚醒状態の律動的な後頭部アルファ活動は、眠気の進行とともに減少し、不規則な低電圧シータ活動と散発的な頂点鋭波に置き換わり、これがステージ1睡眠への移行を示します。ステージ2睡眠への進行は、12〜14Hzの睡眠紡錘波(シグマ波とも呼ばれる)とK複合体の出現によって特徴づけられます。これらのパターンは最終的に高電圧(>75uV)デルタ波に移行し、これがステージ3の深い睡眠を示します。最後に、レム睡眠は、覚醒時EEGに似た低電圧の混合周波数によって特徴づけられます。一部の個人は、レム睡眠中に低振幅の鋸歯状波を示すこともあります。
年齢による変化
EEGの外観は、出生から高齢にかけて劇的に変化します。乳児のトレースに見られる不規則な中〜高電圧デルタ活動の優勢から、EEG活動は年齢とともに徐々に周波数を増し、より律動的になります。思春期半ばに達するまでに、EEGは基本的に成人のトレースの外観を呈します。児童から得られたEEGの解釈には、この期間の年齢に関連する変化についての確固たる基礎が求められ、小児EEGを専門とする者が行うのが最適です。本章の目的のためには、ある特定の機能(例:覚醒中のデルタ波活動の存在)が臨床的に有意であるかどうかについて絶対的な決定を下す際には、発達段階(議論される他の要因の中でも)を考慮する必要があることを認識させるだけで十分です。EEGの年齢に関連する変化と病態の軌跡というこのトピックは、Louis SchmidtとSidney Segalowitzが編集した「Developmental Psychophysiology」というテキストで詳細に扱われています。
議論のある鋭波または棘波パターン
臨床EEGの出現の初期には、EEGトレースで容易に識別できる特定の鋭波または棘波パターンが持つ臨床的意義をめぐって、かなりの白熱した論争が巻き起こりました。これらのいわゆる議論のあるパターンは、数多くの研究で、健常者や一般内科患者集団よりも精神科患者集団でより多く見られることが一貫して観察されているため、ここで特に言及する価値があります。精神科患者における有病率の増加にもかかわらず、これらのパターンの臨床的および神経生物学的相関を定義することは、とらえどころのない目標であることが判明しています。これらのパターンのいずれも診断カテゴリーに特異的ではなく、発作性疾患と予測可能に相関することもないため、この課題は困難です。これらのパターンの生理学的または病理学的相関が、現在利用可能な方法論や評価技術を用いて十分に研究されていないため、それらが神経精神医学的状態と無関係であるという主張は完全に支持できるものではありません。少なくとも、そのようなパターンの出現は、提示された症状の器質的性質の可能性を裏付けるかもしれません。認められているEEG異常と依然として議論のあるEEG異常の数は非常に多く、本章の範囲をはるかに超えています。
病態生理学的特徴を誘発するためのパラダイム
長年にわたり、脳波医たちは、特定の活性化処置が異常な放電、特に棘波または棘徐波発作放電の発生確率を高める傾向があることを認識してきました。いくつかの活性化技術は多くの検査室で標準的であり続けていますが、他の技術は特定の目的のためにごくまれにしか使用されず、過去に導入されたものの、使いにくかったりリスクを伴ったりしたため、ほとんど放棄されたものもあります。発作の症状や、発作を伴う病態生理学的根拠を持つ異常な行動が、特定の刺激によって誘発されうることは、古くから認識されていました。この点に関して、聴原性てんかん、音楽原性てんかん、光原性てんかん、読書てんかんの症例が容易に思い浮かびますが、そのような症例は稀であり、ほとんどの開業医は遭遇したことがありません。他の感覚器系の入力(例:体性感覚や味覚)に関連する発作現象はさらに稀です。時には、検査室の職員が様々なモダリティで感覚刺激を再現または近似し、それらが顕著な症状を伴うEEG発作放電を活性化するかどうかを判断することが可能かもしれません。より一般的な活性化技術のいくつかについては以下に説明します。
光刺激
EEGの初期において、後頭頭皮領域から記録される正常なEEG活動の周波数が、(狭い範囲内で)固有の脳波周波数よりもわずかに速いか遅い点滅光の周波数に追従しうることが知られていました。この現象は光駆動(photic-driving) と呼ばれるようになりました。この現象の例を図1.26-15に示します。これは、9Hzの点滅レートで刺激を行った後、視覚野上に約9Hzの定常状態応答が発生している様子を描写しています。光駆動が時にEEGに発作性放電を引き起こすことが判明すると、間欠性光刺激(IPS) が、刺激条件下で発作性光感受性反応(PRR) と呼ばれるEEG異常を誘発する技術として浮上しました。検査室によって多少のばらつきはありますが、IPSは一般的に、強力なストロボライト(少なくとも0.70 J)を鼻根から約30cmのところに置き、手順の実行方法に応じて1〜50 Hzの範囲で点滅させます。網膜全体に均一な刺激を確保するため、円形の刺激装置を使用することが推奨されています。点滅光に加えて、テレビ視聴やビデオゲームによって発作が誘発される傾向がある患者では、パターン特異的な光感受性反応をさらに評価するために、点滅グリッド刺激が使用されることがあります。一部の検査室では、1〜50 Hzのすべての周波数を必ずしもサンプリングすることなく、独立した点滅周波数を個別にランダムにサンプリングしますが、他の検査室では、1 Hzなどの低い周波数から点滅を開始し、その後徐々に連続して高周波数に増加させるズーム技術を使用します。
一部の個人では、IPSは顔や眼の筋肉のけいれんを引き起こし、これは光ミオクローヌス反応(PMR) と呼ばれます。40年以上前、アンリ・ガストーは、PMRが健常者の0.3%、てんかん患者の3%、精神疾患患者の17%に発生することを観察しました。PMRは、慢性アルコール中毒者のアルコール離脱の初期段階や、バルビツール酸塩および他の鎮静剤からの突然の離脱後にも増強されます。精神科患者におけるPMRの臨床的関連性は、体系的な研究で完全に解明される必要があります。
図1.26-15. 9Hzのフリッカーレートで提示されたチェッカーボードパターンを用いた光駆動。パネルA:光刺激開始時のEEGの10秒表示。「s」は視覚的なチェッカーボード表示の開始を示す。パネルB:刺激前の10秒間を平均したEEGに基づくOz電極での1秒間セグメント。パネルC:Oz電極で刺激中に記録された10秒間の平均に基づく視覚誘発電位(VEP)。VEPは1秒間セグメントで9サイクルの振動パターンを表す。パネルD:Oz電極での1〜50Hzの周波数のウェーブレット変換による時間-周波数分解として表されたVEPで、約9Hzでピーク活動を示す。頭皮プロット(右下)は、活動が主に後頭部の電極サイトで生成されていることを示している。
EEG異常を活性化するという観点から見ると、両側性同期性で通常は広範な、様々な周波数の棘徐波放電または広範な多棘徐波複合体からなるPRR(発作性光感受性反応) を探します。安静時EEGが正常で、発作性疾患や発作性EEG律動異常の兆候が疑われる行動が疑われる場合、IPSは使用する価値のある活性化です。その主な限界は、特に日常的な処置として、発作性疾患の既往歴や現在の症状がない個人におけるPRRの「偽陽性」の発生率の高さ、および検証された発作性疾患の場合における感度の低さです。IPS停止後も棘徐波放電が持続する場合もPRRを示唆している可能性があります。さらに、棘徐波活動が後頭部以外のリードに広がることは、病理学的プロセスを示している可能性があります。
ポリソムノグラフィー – 睡眠検査
フレッドとエルナ・ギブスの先駆的な研究と粘り強い努力のおかげで、現在、自然睡眠下または鎮静下の睡眠中のEEG記録は、覚醒時トレースが正常な場合や、より明確な解釈を可能にするために異常放電の数を増やす場合において、様々な発作性放電を誘発するための不可欠な技術として広く受け入れられています。様々な焦点性および広範な棘波および棘徐波放電、ならびにいくつかの軽微または議論のある発作性パターンは、覚醒時記録よりも眠気時および軽睡眠時に遥かに頻繁に発生し、その中には睡眠記録中にほぼ排他的に見られるものもあります。発作性パターンは、トレースにおける出現が睡眠活性化に依存する程度において、それぞれが大きく異なります。ほとんどの臨床EEGは、完全であるためには眠気時および軽睡眠時のトレースを含むべきですが、広範な高電圧デルタ遅波を伴うステージ3の深い睡眠は、活性化特性がほとんどなく、臨床的には有用ではありません。
睡眠不足
24時間の睡眠不足のみによって生じるストレスが、一部の症例で発作性EEG放電の活性化につながることが示されています。この効果は、自然睡眠または鎮静下の睡眠自体の既知の活性化特性とは独立していると推測されます。睡眠不足は健康な患者にはリスクがありませんが、医学的または身体的に障害のある患者には禁忌となる場合があります。主な欠点は、睡眠不足の個人が記録開始直後に深い睡眠(ステージ3)に入る傾向があり、その結果、棘波活動を検出する機会が減少することです。最適な方法は、被験者が記録開始まで覚醒し、初期の記録期間中も覚醒を維持し、その後徐々に眠気を伴う睡眠に移行することを確認することです。
薬剤活性化および抑制試験
薬物に対する非定型的な行動反応(例:少量のアルコールやその他の乱用薬物に対する異常に重度の反応、またはその他の非常に特異的な反応)を示す患者を評価する精神科医は、薬物摂取が発作や臨床的に有意なその他の発作性異常を活性化するかどうかを判断するために、薬物活性化EEGを検討するかもしれません。過去には、低血糖剤(例:トルブタミド)や痙攣誘発剤(例:ペンチレンテトラゾール)を用いた薬物活性化がてんかん波様放電を活性化するために使用されました。しかし、この種の活性化は、健常被験者においてこれらの薬物によって生成される放電の発生率が高いこと、およびてんかん患者における陽性所見の価値が低いことから、近年、臨床診療から本質的に排除されています。現在、EEGの薬物調節は、薬物開発における機能強化に関連する側面と、薬理学的チャレンジデザインを用いて健常被験者における病態をモデル化する側面の両方で、推定される神経生理学的メカニズムに対する薬物効果を確認するための調査手順として引き続き使用されています。薬物活性化はもはや日常的な臨床診療では使用されていませんが、薬物抑制パラダイムは、焦点性てんかん波様活動の同定に依然として有用であると見なされています。発作焦点は、広範な放電や電極間への活性化の広がりがある場合、EEGで検出することが困難な場合があります。薬物抑制試験では、広範な放電は、ジアゼパムまたはバルビツール酸メトヘキシタール(例:メトヘキシタール抑制試験;MHXT)の静脈内注射によって抑制することができます。このアプローチの根拠は、興奮性神経伝達を遮断したり、抑制性伝達を増強したりする薬物を使用することで、背景EEGの大部分が抑制され、シナプス遮断に耐性のある自律的なてんかん原性病変が発火し続けるというものです。したがって、このアプローチは、シナプス入力に依存する背景EEGおよび広範な活動に対して、てんかん波様病変の局在化を改善することができます。
過呼吸(ハイパーベンチレーション)
過呼吸は、最も古く、今でも臨床検査室で最も頻繁に用いられる活性化処置の一つです。患者は、目を閉じて仰向けのままで、開口したまま1分から5分間(5分を超えても有用ではありません) 過呼吸を行うように求められます。その際、速い呼吸よりも深い呼吸を強調します。目的は、低炭酸ガス血症を生じるまで肺を空にし、脳血管収縮を介して脳への酸素とブドウ糖の供給を減らすことです。
過呼吸に対する正常なEEG応答(EEG用語で「ビルドアップ」と呼ばれる)は、デルタ帯域の全身性の、中〜高電圧の同期した徐波の増加から構成され、過呼吸を停止すると(通常1〜2分以内に)すぐに消失します。誰もが過呼吸にビルドアップ応答を示すわけではなく、子供は成人よりも広範なEEG徐波を示す可能性がはるかに高いです。実際、この処置は高齢者には効果がなく、高齢者は低炭酸ガス血症に対する脳血管の反応性が最小限であり、65歳以上には禁忌です。
EEG異常を活性化するという点では、過呼吸は、標準的な覚醒時EEGに最初に出現しない場合に、小発作(petit mal seizure)の古典的な毎秒3回の広範な棘徐波複合体を誘発するのに特に効果的です。過呼吸は、程度の差こそあれ、他の同期した広範な棘徐波パターンを活性化する可能性があり、焦点性発作活動の活性化はまれに報告されています。興味深い観察として、著しく低い血糖値が、過呼吸停止後2分以上持続する可能性のある、大きな同期したデルタ波の過呼吸ビルドアップと関連していることが挙げられます。したがって、成人における大きなデルタ波のビルドアップは、潜在的な、疑われていない病的な低血糖の存在を示す可能性があります。もし記録中にこの疑いが提示された場合、患者に砂糖入り飲料を与え、後で過呼吸を繰り返すのが良いでしょう。もしブドウ糖の摂取が大きな過呼吸ビルドアップを減少または消失させるなら、低血糖の疑いは確認される可能性が高いです。
一般的に、過呼吸は最も安全なEEG活性化処置の一つであり、大多数の人口にとって身体的なリスクはありません。しかし、心肺疾患や脳血管病態生理のリスク因子を持つ患者にはリスクをもたらす可能性があり、これらの場合にも禁忌となります。
器質的病態生理におけるEEG所見の簡単な概要
EEGは、中枢神経機能に影響を与える多種多様な医学的状態や事象に対して高い感度を持っています。このため、EEGは時に、精神医学的症状の呈示に影響を与えている予期せぬ器質的病態生理の検出に貢献してきました。医学的疾患におけるEEG所見の範囲は膨大であり、本章の範囲をはるかに超えていますが、診断ワークアップの文脈でEEGによって知られる最も一般的な4つの器質的病態に触れていきます。
発作性疾患
発作性疾患の特徴的なEEG所見は、広範性、半球性、または焦点性の棘波または棘徐波放電、あるいはその両方です。しかし、この記述は大幅な単純化に過ぎません。なぜなら、多くの種類のEEG異常が時として発作と関連しており、真性の発作性疾患を持つ一部の患者は、発作間欠期EEGトレースが正常であることも知られているからです。実際、EEGで検出されるてんかん波様活動はてんかんの合理的に特異的な指標ではありますが、感度は25%から56%とかなり低く、てんかんと診断された患者のわずか約50%が初回EEG検査で発作間欠期てんかん波様放電(IED)を示します(ちなみに、この割合は睡眠EEGでは80%に増加する可能性があります)。
さらに、発作性疾患には、遺伝性か、頭部外傷、脳血管病態生理、代謝障害、構造的脳病変、感染性または中毒性脳症、特定の薬物乱用離脱状態、または医原性原因など、多くの可能な病因があります。EEG所見に基づく発作性疾患の診断は、家族歴や個人的な病歴を考慮に入れるべきであり、発作が特発性である可能性も念頭に置く必要があります。
発作の分類も広範であり、特定のてんかん症状の大部分は、開業医である精神科医にとってほとんど関心のないものであるかもしれません。例外の一つは、欠神発作(すなわち、小発作) かもしれません。この発作では、患者は著しい意識障害を伴う顕著な混乱、著しく遅くなった精神プロセス、および昏迷または傾眠状態を呈します。これらの発作は通常短く、15〜30秒しか持続しませんが、欠神発作は1日に100回も再発することがあります。精神科医がこの臨床症状に遭遇する可能性が最も高いのは救急室であり、そこで他の機能性または器質性症候群や酩酊状態と混同されることがよくあります。疑われる場合、連続性で広範な棘徐波活動のEEGによる実証によって、状態を迅速に確認できます。典型的欠神発作は、小児期から思春期初期にかけて発病のピークがあり、場合によっては不注意や他の機能性行動反応と誤認されることがあるため、児童精神科医にも関連する可能性があります。
複雑部分発作(CPS) (精神運動発作または側頭葉てんかんとしても知られる)に関連する前側頭領域の棘波焦点も、精神科医にとって関心があるはずです。これは、「自動的な」運動、感覚障害、精神症状、または自律神経徴候のほとんどあらゆる組み合わせからなる、広範な発作症状の可能性があるためです。症状の集まりは、ほとんど常に発作から発作へと変化せず、発作中の「自動的な」行動は非常に異常である可能性があり、患者は服を脱いだり、服や唇をいじったり、ぐるぐる歩き回って叫んだり、唸りながらテーブルに登ろうとしたり、幻覚症状を経験したり、その他ほとんどあらゆる行動をとる可能性があります。数時間または1日以上続く持続的または密接に間隔を置いたCPS発作(複雑部分状態) が発生すると、ヒステリー性解離状態を模倣する可能性があります。
様々な種類の場所の棘波活動が、明らかな発作症状がない精神科患者のEEGに時折見られます。そのような場合、もし存在すれば、一時的な逸脱行動(特に爆発的な攻撃性)との関係、および抗けいれん剤の試用を検討することができます。時には、てんかんを伴わない精神科患者におけるそのような棘波放電は、神経遮断薬治療後の医原性発作のリスク上昇を示す可能性があります。
構造病変
脳腫瘍は成人における新規発作の主要な原因です。EEGが構造的で空間を占める病変の診断に用いられることは稀で、これらは通常、CTやMRIで評価されます。しかしながら、皮質脳腫瘍の90%は、ルーチンEEGで頭皮上で検出および局在化できることに留意すべきです。
閉鎖性頭部外傷
頭部外傷後のEEGの主な特徴は、外傷部位または対側部(すなわち、衝撃の反対側)に現れる広範性または焦点性の徐波です。後頭部アルファ波の減衰もまた、頭部外傷と関連するもう一つの特徴的な所見です。これらの観察の解釈を導く基本的な前提は、頭皮記録されたEEGの周波数とパワーが、活性化されたニューロンの数とそれらの接続の完全性に依存するということです。したがって、損傷の場合、ニューロンの減少と正常な接続の破壊は、信号パワーの減衰と低周波数へのシフトをもたらします。EEGの変化は、数日または数週間で消失する比較的一過性のものである場合もあれば、長期間持続する場合もあります。焦点性棘波は、外傷後発作性疾患の早期の兆候と見なされることがあります。頭部外傷後の硬膜下血腫は、焦点性デルタ波の徐波またはより広範な徐波を呈し、時には、血腫の部位で電圧が低下した覚醒時EEGの振幅非対称性を示すことがあります。
とはいえ、従来のEEGは、軽度外傷性脳損傷(mTBI)の場合、特に負傷後数時間を過ぎ、意識喪失が2分以内である場合には、臨床的に有用とは一般に考えられていません。頭痛、めまい、疲労、易刺激性、記憶力と集中力の障害、不眠症、音と光に対する過敏性などの脳震盪後症状が存在するにもかかわらず、mTBI後の初期の負傷後期間ではEEG所見が正常に見えることがあります。mTBIに関連する臨床的に有意なEEG変化は、もし存在したとしても、負傷後の後期に採取されたフォローアップEEGと比較されるまで異常と認識されない場合があります。注目すべきは、文献レビューが、非複雑性mTBIの症例の20%もの患者が最初の24時間以内に臨床症状から回復し、負傷後1週間以内に85%もの患者が回復することを示唆していることです。同様に、従来の臨床EEGで検出可能な異常は、負傷後数ヶ月以内に消失する傾向があります。
ルーチン臨床EEGがmTBIのルーチンスクリーニングに有用なツールとは見なされない一方で(少なくとも外傷後発作活動の検出以外では)、Q-EEGにはいくらかの有望性があるという証拠があります。Robert Thatcherとその同僚、および他の研究者による多数の研究は、軽度から中等度の閉鎖性頭部外傷後の脳震盪後症候群に関連するQ-EEG所見を報告しています。報告されたQ-EEGの変化には、安静時EEGにおけるシータパワーの増加、アルファパワーの減少、シータ-アルファ比の増加、および前頭部と側頭部間のコヒーレンスの増加の組み合わせが含まれます。多数の研究が、mTBIと対照サンプルで収集されたQ-EEGに判別分析を適用し、高い分類精度を達成し、機能的障害の予測におけるQ-EEGの有用性を示しています。Q-EEGおよび関連する地形図分析は、ルーチン臨床EEGよりもこれらのケースで優れている可能性があります。なぜなら、定量化プロセスは、統計的に有意な規範的パラメータからの逸脱に基づいて、活動における明確な焦点性または局所的な変化を特定することを目的としており、これは正確な視覚的検出の閾値を下回る可能性があるからです。しかし、mTBIの評価におけるQ-EEGの使用は、研究サンプルの構成やその他の方法論的選択に対する批判があるため、依然として激しく議論されているトピックです。
代謝性および内分泌性障害
EEGは、内分泌系または代謝系障害の評価に用いられるツールではありません。しかし、これらの状態の大部分はEEGを変化させ、ルーチンEEGスクリーニング中の予期せぬ異常所見が、その後の軽度な内分泌系または代謝系障害の特定につながる最初の陽性検査結果となることが時折ありました。代謝性および内分泌性障害、ならびに特定のビタミン欠乏症や毒性物質への曝露は、脳に全体的に影響を与えるため、覚醒周波数の広範な全身性徐波を引き起こす傾向があり、異常の程度は障害の重症度と相関します。予想されるように、焦点性徐波はほとんど見られず、発作性棘波活動も非常に稀ですが、低カルシウム血症、急性間欠性ポルフィリン症、および一部の有毒物質(例:鉛、一酸化炭素)への曝露の場合には棘波活動が観察されています。
早期肝疾患は、一般的にシータ帯域の広範な徐波と関連しており、これは血中アンモニアレベルの上昇とともに重症度が増す可能性があります。障害が肝性脳症に進行すると、三相波(またはより非公式には肝臓波) と呼ばれる特徴的で診断的に関連性のあるEEGパターンが出現することがあります。これは、鈍いまたは丸みを帯びた棘波様一過性波によって開始される、前頭優位または広範な1.5〜3.0Hzの高電圧徐波によって特徴づけられます。様々な代謝性疾患がEEGに与える影響の詳細なレビューについては、Pangらによる参考文献の章を参照してください。
精神医学におけるEEG
精神医学の概要
およそ1938年頃から、継続的なEEG調査が活発に行われ始め、ほとんどすべての精神科集団において、健常者や非精神科患者と比較して軽微な異常の全体的な有病率が増加していることが明らかになりました。これは今日まで調査が続けられています。その一方で、2つの主要な要因が精神医学分野におけるEEGの急速な幻滅につながりました。第一は、EEG異常が既知の精神医学的症候群に特異性を示さなかったことです。第二の要因は、以前にも言及しましたが、てんかん、腫瘍、脳症、脳卒中症候群、昏睡と相関するEEG異常の発見が続いたことです。神経学的問題に伴う顕著なEEG変化の発見が増加し、精神医学的症状と関連するEEG異常が比較的曖昧で診断プロセスに貢献しないままであったため、臨床EEG(そして後に臨床神経生理学)の分野は、神経学のサブスペシャリティとしてより強固に確立され、精神科医の間ではEEGの重要性が低下しました。
最近、精神疾患の神経生物学への関心が急増し、神経精神医学という臨床分野が出現し、EEGやその他の神経生理学的信号のコンピュータ解析における前例のない進歩により、精神科医の間で電気生理学への関心が強く再燃しています。1995年、ジョン・ヒューズは、1950年以前から1994年までの181の重要な参考文献を選定し、EEGと精神医学の広範な領域に関する包括的な概要をまとめるという巨大な仕事に着手しました。このような編集物を調べると、EEG-精神医学関連の参考文献の半数以上が1980年以降に出版され、3分の1がヒューズの1995年の報告以前の5年以内に書かれていることが明らかになりました。文献の継続的な調査は、この傾向が衰えていないことを示しています。「EEG + Psychiatry」という用語を用いたPubMed検索では、1995年以降にこの分野でさらに12,054本の論文が出版されていることが確認されました(2015年以降、ほぼ2倍の増加)。これには臨床研究と基礎科学研究の両方が含まれます。さらに、電気生理学研究の成果を臨床的に利用可能な検査に迅速に変換することを主な目的として、2つの科学組織が設立されました。1991年にはアメリカ精神科電気生理学会(APEA) が設立されました。1999年にはAPEAがアメリカ医療EEG学会(AMEEGA)と合併し、EEGと臨床神経科学学会(ECNS) が結成されました(http://ecnsweb.org)。
精神医学において認識されている莫大な研究可能性にもかかわらず、電気生理学的手法は、その主要な応用が鑑別診断の目的(すなわち、「器質的」脳病理の除外)と睡眠障害の調査を支援することに限定されているため、臨床実践における影響は依然として限られています。DSM-5精神障害の診断や薬物治療の選択とモニタリングに対するEEG方法の承認された適応症は存在しません。これは、(1) 主要な精神障害、特に統合失調症において、Q-EEG異常の確固たる結果が報告され、独立して確認されていること、(2) 事象関連電位(ERP)および眼球運動の異常が、統合失調症およびうつ病の遺伝的危険因子、症状の次元、予後、および診断サブタイプに関連しているという証拠が提供されていること、(3) EEGおよび関連する手法がすでにトランスレーショナルパラダイムを提供しており、新しい治療法や化合物が前臨床開発および臨床試験において臨床的有効性を示す可能性を予測する有望性を示していることを考えると、驚くべきことかもしれません。
しかしながら、精神障害が「脳障害」として受け入れられているにもかかわらず、現在、脳画像診断や行動評価のどの分野においても、臨床診断の定式化に正式に統合された検査は存在しないことも認識されるべきです。おそらく、この乖離は、脳機能そのものというよりも、障害のある行動(例:正常な日常行動の減少、自己/他者に苦痛を与える異常行動の増加)こそが臨床的注意の必要性を示し、したがって診断と治療の決定の基礎となるという事実を反映しているのかもしれません。この点において、電気生理学的特徴が症状や障害に最も強く関連しているという証拠があったとしても、臨床症状が急性期に存在する場合、その特徴を診断指標として使用する必要があるとは限らないことは理解できます。
それでは、電気生理学は応用臨床精神医学においてどこにその場を見出すことができるでしょうか? 一つの有望な領域は、精神疾患につながる可能性のある前臨床期における病態生理学的プロセスの早期発見です。例えば、精神病の前駆期(すなわち、DSM-5の減弱精神病症候群) は現在、リスクのある個人(例:遺伝的素因、サブクリニカル症状を示す)が機能障害を発現し始める疾患進行の段階としてよく認識されており、これは脳成熟の重要な時期に影響を与える要因の組み合わせに対応している可能性があります。早期発見は、精神医学研究だけでなく、国立精神衛生研究所(NIMH)にとっても大きな関心事であり、トーマス・インゼル所長の指揮の下、8つの独立した研究室が統合され、北米前駆期縦断研究(NAPLS)コンソーシアムが形成されました。早期精神病の予測と予防(EP3)は、その後、2013年にNIMHの優先課題として特定され、その後の5年間はこの分野に資金提供の焦点を当てる計画が立てられました。これらの進展は、早期発見と介入によって重度の精神疾患の障害を軽減し、最初の臨床的接触に先行する長期にわたる未治療期間を短縮することを目的としています。EEG手法は、NAPLS研究の概念化とデータ収集において際立って重要な役割を果たしており、統合失調症の病態生理に敏感であることが示されているパラダイムが、前駆期における正式な精神病性障害への移行を予測する指標として使用されています。EEGは、低リスク、非侵襲性であり、この研究集団によって十分に許容されるという利点を持つ、この研究にとって非常に価値のある評価ツールを提供しました。重要なことに、EEGは、統合失調症の疾患プロセスにおいて変化すると仮説立てられている正常な神経発達プロセスに対する感度が確立されています。最後に、EEGシステムは比較的低コストで入手できるため、多施設研究に参加するセンター間で記録装置と方法論の標準化が可能になるという点も見過ごすべきではありません。NAPLS研究の革新には、被験者の移動や、施設間の機器の信頼性を評価するための追加のキャリブレーション手順が含まれており、精神医学における大規模なデータ収集の実現可能性をしっかりと確立しました。
結果の非特異性
精神科集団におけるEEG異常の研究分野を悩ませ、妨げている2つの特定の問題があります。第一に、他の点では健康な個人の最大20%にEEG異常が見られるという認識です。第二の主要な問題は、臨床的に診断可能な発作がない場合でも、発作間欠期てんかん波様活動は臨床的関連性のない偶発的(または非特異的)所見であるという、もう一つの蔓延した認識です。この分野でのさらなる研究をより有意義なものにするためには、これら2つの重要な問題に対処する適切に設計された研究が必要です。
さらに、脳の電気活動が正常または病理学的な影響に反応する方法は限られています。脳波は、単に周波数が速くなったり遅くなったり、電圧が低くなったり高くなったりするか、あるいはこれら2つの反応の組み合わせによって変化します。したがって、非常に類似したEEG異常パターンが異なる病因から生じる可能性があります。例えば、腫瘍、硬膜下血腫、脳膿瘍、脳血管障害、または閉鎖性頭部外傷は、常に同一とは限りませんが、類似した焦点性EEG徐波を引き起こす可能性があります。広範性徐波は一般的な異常所見であり、その病因には、皮質萎縮、薬物誘発性脳症、電気けいれん療法(ECT)、脳炎、特定の内分泌疾患(甲状腺機能低下症および下垂体機能低下症)、ポルフィリン症、頭部外傷、鉛曝露、低カルシウム血症、ウェルニッケ脳症などが挙げられます。結果の非特異性、または病因を特定できないことは真の限界ですが、考えられているほど悲観的なものではありません。
EEG異常の感度と特異性に関する懸念は、主に従来の臨床EEGに関連しており、これは視覚的検査によって確認できるデータの限られた次元しか現実的に検査できないためです。これらの懸念は、依然として適切ではありますが、Q-EEG分野の進歩を考慮すると、いずれ許容できるレベルに軽減される可能性があります。Q-EEGプロファイル、および誘発反応の逸脱は、精神疾患を持つ被験者と健常対照者および他の診断グループを比較する分類分析において、高い感度と特異性を示しています。Q-EEGは概して研究ツールではありますが、診断決定に貢献する可能性は小規模な概念実証研究で示されています。これまでの臨床開発は、部分的に、十分な規範的サンプルや、大規模で相互相関のあるデータセットでの分類を実行するタスクに適した統計ツールの利用可能性によって妨げられてきました。現代の機械学習(ML)アルゴリズムの応用は、既知の診断カテゴリーへの依存を軽減し、空間、時間、スペクトル領域で表現されるEEGの複雑な次元を利用するように最適化できる「教師なし」モデルを使用して疾患クラスの境界を明らかにするための解決策として有望視されています。
精神医学における応用EEG
前述の通り、応用臨床精神医学におけるEEGの役割は、器質的病因の鑑別診断にかなり限定されています。この点において、呈示症状、最初の症状の発現年齢、または治療への反応が非典型的であり、より構造的な脳病理が評価中の症候群に寄与している可能性を示唆する場合に、EEGは最も有用となり得ます。このような場合、発作性EEG活動または焦点性もしくは広範性徐波の存在は除外されるべきです。もし発作性活動が同定された場合、そのようなEEG所見は、症状が遡っててんかん性であると見なされない限り、てんかんを診断する十分な根拠ではないことを明確にすることが重要です。非典型的な呈示を示す患者において、特に検討されている診断の家族歴がない場合に、発作性EEG異常が存在する場合、臨床医は診断に対して用心深く、自信を持てなくなるべきです。現在の知識レベルでは、その他に特定されないカテゴリーを活用するのが良い慣行かもしれません。このような状況で抗けいれん剤が適応されるかどうかは、臨床的判断に委ねられる問題です。この分野の初期の研究では、抗けいれん剤がEEGてんかん波様放電をブロックし、また攻撃的行動を示す個人において劇的な臨床的改善をもたらすことがあると示唆されていました。さらに、カルバマゼピン(テグレトール)は、てんかん性疾患の既往歴がないにもかかわらず、側頭葉EEG所見と攻撃的傾向を示す統合失調症の個人において臨床的に有用であると考えられていました。現在の実践に基づくと、不安障害、認知症、統合失調症、うつ病、双極性障害、薬物・アルコール離脱症候群の場合にこのクラスの薬剤が一般的に処方されることからも示唆されるように、処方医はEEG所見に関わらず、多くの適応症に対して抗けいれん剤の補助療法を使用することに抵抗がないようです。これらの場合(おそらく薬物離脱を除いて)、処方は発作の有無ではなく、攻撃性、気分の変動、躁病、パニック症状を含む精神症状を治療する抗けいれん剤の有効性に基づいています。
EEGにおける焦点性徐波異常の存在についても同様のコメントができます。正常な神経学的検査を有する患者における軽微な焦点性徐波異常は、重篤な空間占拠性病変を反映する可能性は低いでしょう。しかし、軽微な焦点性徐波に論理的な説明(例:古い頭部外傷)がなく、その所見が以前のEEGには見られなかった場合、再度のEEGを行うことで、その所見が静的であるか進行性であるかを判断する価値があるかもしれません。臨床医は、いつ画像診断(およびどのような画像診断)を行うべきかについて、臨床的判断を使用すべきです。空間占拠性病変が疑われる場合、通常はCTスキャンで十分です。病変の状態が急性でない場合(例:古い頭部外傷)は、MRIの方が異常を検出する可能性が高いでしょう。発作性活動の存在と同様に、焦点性徐波異常の存在は、臨床医に診断に対する用心を促すべきです。EEGによって同定された焦点性脳異常に臨床的に相関する欠損があるかどうかを評価するために、神経心理学的評価を行うことも検討されるべきです。
不安定な患者や反応のない患者の管理中にEEGが取得される場合は状況が異なります。急性興奮状態の患者に対して行われるEEGから得られる最も重要なデータは、広範性徐波(せん妄性脳症状態を示す)または進行中の非けいれん性てんかん重積状態(NCSE)の存在です。どちらの状態でも、EEG異常はかなり明白であり、必要であれば一時的に患者を再訓練し、電極キャップを使用してセットアップ時間を最小限にすることで、短時間で検出できます。EEGは、薬剤毒性によるせん妄を除外するのに極めて有用であり、この点において、血清血漿レベルが治療範囲内であるにもかかわらず、広範なEEG徐波(広範性脳症プロセスを示唆する)が見られる可能性があることに留意すべきです。
高齢者集団を扱う場合、器質的病態に対する感度は特に高めるべきです。認知症およびせん妄の評価に加えて、発作が疑われる場合にはEEGは非常に貴重であり、この点において、新規発症てんかん症例の最大4分の1を高齢患者が占めることが指摘されています。また、認知症と診断された患者において、軽度段階を過ぎた後に正常なEEGが見られる場合、うつ病性障害やその他の可逆性原因が臨床像に寄与している可能性があるという疑念を抱くべきであることも忘れてはなりません。
精神疾患におけるEEG所見
EEGと精神医学のインターフェースに関する一般的な考察に加えて、いくつかの精神疾患について特に言及する必要があります。臨床応用が期待される所見を簡単にレビューします。
統合失調症
統合失調症患者におけるEEG異常は広範に調査されてきました。最近発表された133の研究を網羅する文献レビューでは、統合失調症で観察される一般的なEEG異常が、初回精神病エピソード時だけでなく、高リスクの臨床的個人においても検出されることが明らかになりました。これにはデルタ帯域およびガンマ帯域の増加が含まれます。さらに、これらの特徴の一部は、リスクのあるサンプルにおける精神病への移行を予測し、より悪い機能的状態と関連していることが示され、疾患の進行と予後のマーカーとしての有用性を示唆しています。慢性統合失調症におけるEEG文献は広範であり、ミスマッチ陰性電位(MMN)、P50感覚ゲート、P300、ガンマ帯域聴覚定常状態反応(ASSR)を含む、精神病関連バイオマーカーとして調査された特定のEEGおよびERP測定を対象とした少なくとも30のメタアナリシス研究が含まれています(以下のERPセクションを参照)。
2015年に双極性障害と統合失調症中間表現型ネットワーク(BSNIP)多施設コンソーシアムによって発表された研究では、DNAから得られた100万個の一塩基多型(SNPs)を用いて、統合失調症、精神病性双極性障害、および健常者のサンプルにおける安静時EEG周波数活動の多遺伝子構造が調べられました。多変量データクラスタリングと成分抽出法により、5つの周波数成分と9つのSNP成分が特定され、シータ活動とデルタ活動が、脳発達、神経新生、シナプス形成に関与する遺伝子成分と相関することが判明しました。前頭部のデルタ活動増加と後頭部のシータ活動異常は、統合失調症と双極性障害の両方のサンプルに存在しましたが、シータ活動は両疾患間で異なりました。シータ異常はまた、グルタミン酸経路とシナプス細胞接着プロセスに関与する独自の遺伝子クラスターによって媒介されていました。これらの結果は、統合失調症における過剰な安静時徐波活動に関する以前の知見を再現し、この異常の構成要素構造を精神病性双極性障害患者からさらに区別しました。これにより、従来の臨床評価では困難な診断的鑑別におけるこの特徴の特異性が向上しました。これらの所見はさらに、以前統合失調症に関与していた遺伝子と、安静時EEGで観察される異常な特徴の根底にある可能性のある新しいメカニズムからなる、もっともらしい遺伝子ネットワークを指し示しています。
カタトニア
既知の機能的病因を持つカタトニア患者のルーチンEEGは正常である傾向がありますが、カタトニアは、てんかんや様々な一般医学的状態に続発する脳症など、いくつかの重篤な医学的状態の症状である可能性があります。神経弛緩薬悪性症候群がカタトニアとして呈示されることがあり、そのような場合、EEGは脳症プロセスを示す広範な徐波の画像を示す可能性が高いです。通常の呈示にカタトニア症状が含まれる既知の患者はEEGを必要としないかもしれませんが、カタトニア症状を呈するすべての新規患者にはEEGを取得することが賢明です。
パニック障害
パニック発作の症状は、側頭辺縁てんかん活動、特にシルビウス裂に起源を持つものによって誘発される症状と有意な類似性を持っています。恐怖、離人感、頻脈、発汗、腹部不快感は、精神症状および自律神経症状を伴う単純部分発作の典型的症状です。パニック障害患者とCPS患者の症状を比較した研究では、多くの類似性が報告されており、両疾患を結びつける共通の神経生理学的基盤が存在する可能性を示唆しています。この文献の注目すべき結論は、パニック障害に苦しむ個人が、ベータパワーの特異な増加を含む非特異的EEG異常の発生率が高いことを示していることです。これは、これらの患者における過覚醒という一般的な臨床観察と一致すると考えられています。一部の証拠は、パニック障害においてIEDが規範的ベースライン率よりも高く発生することを示唆するかもしれませんが、パニック症状と発作活動との関係は依然として不明確であり、EEG所見は発作性てんかん波様放電から徐波活動の非対称性増加、焦点性徐波異常(パニック障害患者の最大25%で観察されたと報告されている)まで多岐にわたります。これらの線に沿って、従来の抗不安薬治療が無効である場合、バルプロ酸(デパケン)を含む抗けいれん剤の使用をパニック障害の症例で検討すべきであると示唆されています。
一方、てんかん患者ではパニック発作がより頻繁に発生することも示されています。場合によっては、その性質が正確に定義されないと、これらの発作が発作に対する過剰な投薬につながる可能性があります。ここでも、複数の発作中のEEGモニタリングは、そのような評価を行う上で不可欠です。他の報告では、側頭葉てんかんと鑑別しなければならない最も一般的な精神障害はパニック障害であると結論付けられています。てんかん性発作は、通常、パニック発作よりも短く、より定型化されています。加えて、失語症や記憶障害が発作活動にしばしば伴います。
強迫性障害
Zaboskiら(2021)が最近レビューしたように、強迫性障害(OCD)の神経学的基盤の研究におけるEEGの利用は比較的少なく、現在までに主にP300および安静時EEGのスペクトルパワーの障害が明らかになっています。例えば、OCD患者のEEG研究では、広範な徐波の増加が報告されており、加えて左側頭葉におけるてんかん波様活動の報告もあります。これらの異常の頻度は研究によって異なります。
Q-EEG研究は、より頻繁に頭皮の前方領域に関与しており、OCDの病因における前頭機能不全の仮説を支持しています。特に、帯状回はQ-EEG地形図脳マッピングによって機能不全の部位として関与しているとされています。特定の周波数帯の関与に関するデータは不均一であり、おそらく方法論の違い、研究サンプルの規模の小ささ、OCD症状の呈示における患者集団の広範な不均一性に起因していると考えられます。本章ではこのトピックに十分な言及はしていませんが、EEGバイオフィードバック、より正確にはニューロフィードバックは、OCDに苦しむ個人の非薬理学的治療選択肢として関心を集めています。基本的に、ニューロフィードバックは、進行中のEEGを患者にグラフィックで提示し、患者は病態生理学的ベースラインから正常化と見なされる方向へと活動を暗黙的に上下に調節することを学習します。繰り返しになりますが、OCD治療に関与する特定のEEG周波数と場所に関しては様々ですが、ニューロフィードバックはストレス管理の治療法としてFDAによって承認されており、ストレスと同様に、ニューロフィードバックの共通の治療メカニズムとして達成できる自己調整の改善から恩恵を受ける可能性があります。
気分障害
うつ病は、EEGが特定を助けることができる様々な脳疾患やその他の身体疾患(例:腫瘍、認知症、血管障害) から生じる可能性があります。この例外を除けば、気分障害の診断は通常、EEGによって知らされることはありません。それにもかかわらず、1936年のフレドリック・ルメールによる最初の出版以来、うつ病におけるEEG異常に関する研究結果は、うつ病の臨床的特徴と脳メカニズムを結びつける多くの直感的な解釈を提供してきました。注目すべきは、ルメールの最初の論文で彼が「…「良い」アルファ波を生成する能力は、個人の情動能力に何らかの形で関連する神経生理学的特性であると思われる…」と提案したことです。これはハンス・ベルガーのヒトEEGに関する最初の報告からわずか数年後のことであり、実際に彼は10Hzのアルファ波を「ベルガーリズム」と呼んでいました。アルファ周波数の異常に関する観察は、現在に至るまで、EEG研究とうつ病の概念化に関する主要な物語であり続けています。
1980年代初頭以来、リチャード・デビッドソンとその同僚に帰する研究は、前頭部アルファ非対称性とそれに関連する接近-回避モデル(接近・回避傾向モデルとも呼ばれる) を、うつ病の神経学的基盤の説明的統合として強調してきました。簡単に言えば、左半球に比べて右半球の過活動を伴う前頭部アルファの非対称性は、接近(肯定的感情に関連する食欲行動を促進する)と回避(否定的感情に関連する嫌悪刺激の回避を促進する)の相互作用として解釈されており、左側のアルファの減少は、うつ病における接近システムの活性化不足を反映していると考えられています。このモデルはさらに、相対的に高い右側の回避システムの活性化が不安や他の形の精神病理に寄与すると規定しています。EEG研究は、前頭部アルファ非対称性というこの画期的な発見を支持し続けており、ある程度は、うつ病のこの定式化を支持しています。他のグループの研究は、アルファ非対称性が大うつ病において特性というよりも状態の特性をより反映している可能性が高いことを示唆しています。それ以来、感情的課題の下で誘発される脳活動が、安静時に測定されるよりも精神病理のより強力な指標になると仮定し、したがって感情を刺激する刺激を用いた検査を伴う能力モデルを含む、アルファ非対称性に基づく新しいモデルが提案されています。
躁病エピソード中の急性期の薬物未服用被験者で大規模なEEG研究が行われたことはほとんどありません。これはおそらく、そのようなデータを得ることの困難さに一部起因しています。しかし、ジョイス・スモールとその同僚は、1990年代後半に、急性躁病状態のインディアナポリスにあるラルー・D・カーター記念病院に入院した約200人の患者のサンプルについていくつかの論文を発表しました。その多くは、投薬中、薬物ウォッシュアウト後、およびその後のエピソードで再入院した際にフォローアップEEGを受けました。約40人の協力的な患者のサブサンプルでもQ-EEGが実施されました。驚くべきことに、収集されたEEGデータの大部分は正常と解釈されました。異常な特徴のわずかな増加(サンプルの16%)は気分障害の家族歴と関連しており、棘徐波活動がサンプルの17%で観察されました。Q-EEGは、処方された薬物療法に基づいて患者を区別し、ベースラインのシータ活動が高いほど、向精神薬への反応が悪いことを予測しました。異常な半球性偏側性(9%の患者)が検出され、左半球の関与が示唆されました。
最近の証拠は、抗うつ剤治療の良好な結果だけでなく、不良な結果の予測におけるベースラインQ-EEG測定の有用性を示唆しています。アンドリュー・ルーヒターとそのチームは、コーデンス(相対パワーと絶対パワーを組み合わせたQ-EEG測定値) を導入し、二重盲検プラセボ対照パラダイムを用いて単極性うつ病におけるフルオキセチンへの反応の相関を調査しました。シータ帯域で高コーデンスを示す有意に多くのうつ病被験者が、低コーデンスの被験者と比較してフルオキセチンに反応しました。結果は、ベースラインの調節不全が低い(または小さい)うつ病被験者のみが治療に反応することを示唆していると解釈されました。ルーヒターのグループによる最近の研究では、前頭前野のコーデンス測定値の変化がプラセボ条件への良好な反応(例:ハミルトンうつ病評価尺度スコアの減少)を予測することも発見されました。しかし、改善を示すコーデンスの変化の方向は、研究間で完全に一貫しているわけではありません。
注意欠陥・多動性障害
注意欠陥・多動性障害(ADHD) は、子供や青年だけでなく、成人にも見られる一般的な障害です。ADHDにおける従来のEEGの異常の有病率は、年齢および性別が一致する健常対照被験者よりも高く、ADHDの子供の約3分の1が異常なルーチンEEGを有し、かなりの割合で棘波または棘徐波放電を示します。実際、一部の研究では、この障害における異常EEGの発生率が**最大60%**にも達すると報告されています。
Q-EEGは、特に前頭葉領域におけるシータ活動の増加を、ADHDにおける一貫した所見として特定しました。学習障害が交絡変数として除外された場合でも、シータ活動の増加は、世界の様々な地域の複数のグループによって再現されており、この障害における最も一般的なEEG所見の一つとして残っています。一貫した所見であることに加えて、ADHDで見られるシータ活動の増加は年齢の影響を受けにくい一方、ベータEEG周波数の異常は年齢とともに減少する傾向があります。また、初期の研究では、前頭部のシータ異常の増加がメチルフェニデートやその他の精神刺激薬への反応の強力な予測因子となる可能性があり、良好な臨床反応がEEG異常の正常化と関連する可能性があることが示唆されていることに留意すべきです。ベータ活動の減少がADHDで報告されることがあるため、一部の研究者は、より高い検出力を持つADHD関連EEG異常のより強力な測定値として、シータ対ベータ比を検討しようと試みてきました。しかし、類似の患者においてベータ活動の増加(減少ではなく) に関する追加のQ-EEG報告もあり、異なるADHDのサブタイプがベータ活動に異なる影響を与えるかどうかについて疑問を提起しています。最後に、Q-EEGデータの判別関数分析は、健常者、注意欠陥障害、ADHD、および学習障害のサブ集団を有意に区別できることが示されています。
認知症とせん妄
進行した認知症の患者は正常なEEGを示すことが稀であるため、正常な検査結果は仮性認知症(うつ病や精神病に続発する認知症症状)の診断において重要な役割を果たすことができます。認知症とうつ病が共存する場合、それぞれの疾患が全体的な臨床像にどの程度寄与しているかについてある程度の見当をつけることが重要になります。ルーチンEEGは、アルツハイマー病の進行を追跡するのにも有用であり、アルツハイマー病の病因と、進行性の行動悪化にもかかわらずルーチンEEGが正常であるか軽度な前頭部徐波を伴う前頭側頭型認知症(FTD)の鑑別にも有用である可能性があります。したがって、FTDにおける比較的正常なEEGは、これらの患者の行動的特徴が原発性の精神医学的原因によるものであるという兆候と見なすべきではありません。
多くの出版物が、早期アルツハイマー病の診断および予後検査としてのQ-EEGの有用性を強く支持しています。クリストフ・レーマンのリーダーシップの下、ストックホルムとニューヨークのセンター間の共同研究により、軽度アルツハイマー病を健常対照者からEEGベースで分類する診断効率が**感度85%、特異度78%**であることが示されました。利用可能な文献に基づくと、EEG測定は、アルツハイマー病が疑われる症例の診断ワークアップの要石として急速に浮上する可能性が高いです。
急性的に錯乱し、まとまりのない患者の鑑別診断には、しばしばせん妄が含まれます。急性興奮状態のせん妄患者において、EEGは、意識変容が(1) 広範な脳症プロセス、(2) 焦点性脳病変、または(3) 運動症状を伴わない持続性てんかん活動のいずれによるものかを示すのにしばしば役立ちます。ほとんどの場合、せん妄患者は中毒性代謝性脳症を患っています。一般に、脳症の進行に伴い、背景律動はアルファ波(8〜12Hz)からシータ波(4.0〜7.5Hz)活動へと広範な徐波化を示します。デルタ波活動(<3.5Hz)は、患者が反応不能に近づくまで通常は顕著になりません。この規則の主な例外は、アルコール離脱時および振戦せん妄時に見られます。前述の広範な徐波化の代わりに、アルコール離脱せん妄の患者では過剰な速波活動がEEGを支配します。せん妄状態ではないアルコール離脱患者は正常なEEGを示すことがあります。低電圧の速波活動はベンゾジアゼピンによっても誘発される可能性があり、EEGを解釈する際にはこれを念頭に置くべきです。したがって、EEGは、アルコール離脱性振戦せん妄と、医原性脳症を含む他の原因による脳症とを鑑別するのに役立つことがあります。せん妄で観察される典型的な変化は、後頭部の優位律動の徐波化または消失、徐波の増加、開眼に対する反応性の低下、および間欠的、特に前頭部に位置する律動性デルタ活動です。これらの変化は、コリン作動性刺激の欠如を伴うせん妄の最終共通経路としてのドーパミン作動性-コリン作動性の不均衡に関連すると考えられています。共通の病態生理学的特徴としてコリン作動性欠損を示すせん妄の症例とは対照的に、アルコールまたはベンゾジアゼピン離脱せん妄はEEG電圧の低下と速波活動の増加をもたらす一方、非けいれん性発作状態は律動性活動と典型的てんかん波様放電によって示されることがあります。連続的なEEG評価はせん妄診断のゴールドスタンダードとされています。
Q-EEGは、微妙な変化を検出する能力があり、認知症、蓄積された器質性脳疾患、および加齢に伴うEEG変化の有病率が高い虚弱な高齢者の評価に特に有用です。相対パワー測定値、アルファ波の減少とデルタ波の増加、ならびにピークまたは平均周波数の減少、および速波対徐波比の低下が、せん妄を示すことが判明しています。認知症が存在する場合、Q-EEGは特に単純な活性化手順と組み合わせることで、せん妄の検出とモニタリングを大幅に改善します。
自閉スペクトラム症
自閉スペクトラム症(ASD) においては、てんかん波様活動、背景徐波、および異常なEEG半球非対称性を含むいくつかの種類のEEG異常が見つかっています。ミューリズムの変異(運動野で発生する一過性の非後頭部アルファリズム) も報告されており、これは一部の研究者によって、ミラーニューロン機能の変化を示唆していると仮定されています。ミラーニューロンとは、個人が行動を実行する際と、他者が同じ行動を実行するのを観察する際の両方で発火するニューロンを指します。報告された様々なEEG異常のうち、てんかん波様活動がASDにおいて最も一貫した所見であり、自閉症を持つ個人の18.9%から最大60.7%で検出されています。興味深いことに、ASDの子供の約3分の1がその後てんかんを発症します。とはいえ、いくつかのレビューは、発作のない広汎性発達障害の子供に抗けいれん薬や手術を使用する正当性はないと結論付けています。つまり、EEG棘波を排除する治療が自閉症の行動異常に治療効果をもたらすという証拠はありません。
薬剤によるEEGの変化
非常に多くの薬剤、および治療目的または嗜好目的で摂取される物質が、EEGに何らかの程度の変化を引き起こす可能性があります。このセクションでは、臨床および研究精神医学に最も関連性の高い化合物に焦点を当てます。
薬理EEG
1970年代に、いくつかの研究室が、健常被験者における単回投与ルーチンによって誘発されるEEG変化に基づいて、向精神薬の分類を一貫して得ました。薬理EEG法は現在、薬物開発の初期段階で新規薬剤の治療適応を特定するため、中枢神経レベルでの薬物バイオアベイラビリティまたは「ターゲットエンゲージメント」を試験するため、薬物血漿濃度との相関に基づいて薬物動態プロファイルを評価するため、治療に有用な投与量を予測するため、および異なる製剤の薬物のバイオアベイラビリティを比較するために、前臨床研究で一般的に使用されています。薬理EEG研究により、前臨床研究ではそれぞれ抗アレルギー薬および抗不安薬として分類されていたミアンセリンとドキセピンの抗うつ作用、ならびに動物研究では精神刺激薬として分類されていたフェンフルラミンの鎮静作用が特定されました。ミアンセリンの抗うつ作用の発見は、新しい動物試験の開発に貢献し、それがひいてはフルボキサミン(ルボックス)やフルオキセチン(プロザック)のような新しい抗うつ薬の発見を促進しました。フルボキサミンとセルトラリン(ゾロフト)の場合、薬理EEG研究は、薬物開発の初期段階で治療用量を特定することを可能にしました。
薬理EEG法を精神科臨床現場に翻訳しようとする試みはほとんど行われていませんが、このアプローチは、特定の向精神薬または用量レベルに対する治療効果の期待を知らせることができます。反応予測のための薬理EEG法は研究に適用され、主に単回投与の薬物(いわゆるテストドーズ手順)または治療コースの早期におけるQ-EEG変化の検査を伴いました。このような方法が治療への信頼できる治療反応予測を提供できることが証明されれば、最初の治療への不応答がケアからの離脱、予後の重症度、ひいては精神疾患に関連する費用の増加につながることを考えると、臨床的に多大な影響を与える可能性があります。
治療反応の早期予測に関して、統合失調症における第一世代抗精神病薬(FGA)のいくつかのQ-EEG研究は一貫した所見を生み出しましたが、最終的な臨床的影響はありませんでした。例えば、高力価FGAの投与は、特に低アルファ帯域(7.5〜9.5Hz)において、アルファ活動の増加を生み出すことが判明し、いくつかの独立したグループがこれを良好な臨床反応の予測因子であると見出しました。
テストドーズ手順は、うつ病患者の反応予測に関する薬理EEG研究ではほとんど使用されていません。一例として、Q-EEGコーデンス(相対パワーと絶対パワーを組み合わせた指標) は、治療抵抗性の入院患者のサンプルにおいて、治療前および抗うつ薬治療の1週目と4週目に測定されました。奏功者では前頭前野シータコーデンスの減少が、非奏功者では治療開始後1週間で増加が見られました。これらの所見は、他の脳画像結果と一致しており、前頭前野活動の早期変化が抗うつ薬への臨床反応を媒介することを示唆しています。
結論として、Q-EEG指標は、患者の臨床評価の貴重な補完となり、適切な薬物治療の選択に関するさらなるガイダンスを提供できる可能性があります。この目的のために、国際薬理EEG学会(IPEG)によってガイドラインが発表されており、薬理EEG研究で得られたデータの取得と処理の標準化を目指しています。これらの方法を臨床ルーチンに導入するためには、大規模な患者集団での所見の再現と、最近臨床実践に導入された新薬の研究が必要になります。
向精神薬 – 一般的な考察
向精神薬がEEGに影響を与えることはよく知られています。ルーチンEEGでは、ベンゾジアゼピンと発作性EEG放電を誘発する傾向のある一部の化合物を除けば、薬剤が毒性を引き起こしていない限り、臨床的に関連する影響はほとんどありません。例えば、ベンゾジアゼピンは、少量でも広範囲に見られる有意な量のベータ活動を生成し、これらの薬物の迅速な反応とピーク占有(通常1〜4時間)を考慮すると、予想よりもかなり長く(最大2週間)持続することがあります。この反応は非常に普遍的であるため、特定の脳領域が予想されるベンゾジアゼピン誘発性ベータ活動を示さない場合、その領域は何らかの形で損傷している可能性があると示唆されています。
向精神薬 – 毒性作用
EEGが向精神薬の神経毒性作用に敏感であることは古くから受け入れられており、臨床的悪化と相応する薬剤の神経毒性反応の検出におけるEEGの価値を示す臨床的短編が報告されています。多くの要因が患者に影響を与え、症状が微妙である可能性があるため、このようなシナリオは治療期間中のいつでも発生しうることがしばしば強調されます。長期治療を受けている患者が臨床的悪化を呈する場合、特に患者がその薬剤を服用していることが知られており、血清血漿レベルが治療範囲内である場合でも、EEG調査が有用である可能性があります。このような臨床状況はまた、患者が臨床的悪化を呈した場合に比較のためにベースラインEEGを利用可能にしておく必要性を浮き彫りにするかもしれません。規範的なEEGデータベースは利用可能ですが、横断的評価に基づいており、精神疾患の動的な性質や投薬状態による変化を考慮に入れていません。したがって、毒性を検出する目的で、ルーチン臨床EEGは、向精神薬を処方された患者の日常的な管理に直接関連しています。向精神薬を服用しており、臨床状態が不安定な患者(特に高齢者)において有意な広範性EEG徐波の出現が見られた場合、臨床医は、脳症の他の原因(例:電解質不均衡や甲状腺の問題など)に加えて、薬剤毒性を考慮すべきです。
向精神薬誘発性EEG異常(非発作性および発作性)
向精神薬が導入されたほぼ当初から、これらの化合物の一部が、一部の個人において発作性EEG放電(棘波および棘徐波活動)を含むEEG異常を引き起こす可能性があることが知られていました。通常、薬剤誘発性の発作性EEG活動は行動的には無症状であり、医原性の明らかな発作症状を伴いません。
全身麻酔薬
全身麻酔薬は、主に神経イオンチャネルに結合して作用を発揮します。EEGシグネチャの観点から見ると、麻酔薬は最初に前頭部の速波活動を誘発し、続いてアルファリズムの崩壊を引き起こします。麻酔が深まるにつれて、EEG活動はより遅く、低電圧(深い睡眠と似ている) になり、バースト・サプレッションパターンが観察されることがあります。最も深いレベルでは、EEG活動は停止し、昏睡状態で見られるパターンに似ることもあります。
バルビツール酸塩
バルビツール酸塩は現在、医療目的または嗜好目的で最小限しか使用されていません。このクラスの薬物の作用機序は、GABA受容体上の特定の部位に結合し、抑制性神経伝達物質GABAの効果を増強することを含みます。バルビツール酸塩が医療目的または嗜好目的で摂取されると、EEG、特に前頭部にベータ活動が導入されます。高用量では、より低い周波数とアルファリズムの消失(眠気と睡眠が続くにつれて)と関連します。長期曝露後のバルビツール酸塩の突然の離脱は、広範性発作性活動と棘波放電を含むEEGを引き起こす可能性があり、これらはしばしば明らかな運動発作症状とは関連していません。これらの効果は、最後の薬物曝露後数日から最大3〜4週間見られることがあります。
伝統的神経弛緩薬(定型抗精神病薬)
伝統的な抗精神病薬/神経弛緩薬(例:クロルプロマジン、ハロペリドール)の主な作用機序は、D2ドーパミン受容体の拮抗作用です。神経弛緩薬によるEEGの変化には、アルファ活動の増加、低周波数へのシフト、およびベータ活動の減少が含まれます。高用量では、発作や棘波が発生する可能性があります。
非定型抗精神病薬
クロザピンやリスペリドンなどの非定型抗精神病薬は、伝統的な神経弛緩薬と比較して異なる作用機序を持ち、5HT2a、アルファアドレナリン、D4受容体などに対する親和性があります。クロザピン投与中のEEG周波数変化には、デルタ、シータ、ベータの増加が含まれ、これらは前頭部、中心部、頭頂部で顕著です。一部の発作性徐波と棘波が発生する可能性があり、まれに発作も発生します。他の非定型抗精神病薬のEEG相関についてはほとんど知られていません。
三環系抗うつ薬(TCAs)
旧世代の三環系抗うつ薬(TCAs)(例:イミプラミン、ドキセピン)は通常、セロトニンとノルエピネフリンの両方の再取り込み阻害剤として作用します。これらは徐波および速波の量を増加させ、アルファ波の周波数を減少させ、発作性の徐波や棘波を誘発する可能性があります。高用量では、発作を誘発する可能性があり、三環系抗うつ薬にはやや狭い治療域があることを考えると、これは特に懸念されます。
選択的セロトニン再取り込み阻害薬(SSRIs)
選択的セロトニン再取り込み阻害薬(SSRIs)は、その定義から、セロトニントランスポーターに結合することでシナプスにおけるセロトニンレベルを増加させます。これらの薬剤はアルファ活動を減少させる傾向があり、シータ周波数を増加させます。さらに、発作の発生率は三環系抗うつ薬と比較してSSRIsの方が低いです。
リチウム
リチウムは依然として双極性障害の治療に一般的に使用されており、EEGに著しい変化を誘発する可能性があります。リチウム塩は、特に中毒レベルで、広範なEEG徐波と発作性棘波、および三相波と関連しており、これらは血清レベルが正常化した後も残存する可能性があります。
ベンゾジアゼピン
バルビツール酸塩と同様に、ベンゾジアゼピンはGABAの作用を増強しますが、その作用機序はGABA受容体上の別のベンゾジアゼピン部位への結合を伴います。そのため、ベンゾジアゼピンは一般的に抗不安作用および抗けいれん作用のために使用されます。治療用量のベンゾジアゼピンはベータリズムの強力な増強剤であり、加えてシータパワーをわずかに増加させます。アルファ周波数の減少も認められます。ベンゾジアゼピンはてんかん波様活動を減少させることでよく知られており、実際、てんかん重積状態の第一選択薬です。
その他の治療薬
現在の章の範囲外ですが、他の多くの非精神科治療薬がEEGに強力な影響を誘発することが示されています。最も注目すべきは、抗てんかん薬治療におけるEEG変化がよく文書化されていることです。さらに、抗生物質、免疫抑制剤、抗腫瘍剤などもすべてEEGシグネチャに影響を与えることが示されています。これらの薬剤タイプに関する詳細な説明については、BauerとBauerによる参考文献の章を参照してください。
乱用薬物
依存性薬物の嗜好目的での使用は、依然として深刻な公衆衛生上の問題です。実際、疾患のコストという点では、薬物依存症は心血管疾患に次ぐ第2位と推定されています。したがって、薬物依存症は、精神疾患の評価と治療に関わる人々にとってますます大きな懸念となっています。ほとんどすべての乱用薬物がEEGの周波数スペクトルを変化させる能力があり、その変化の程度は、嗜好目的での使用か大量使用か、およびEEGが急性中毒時、禁断期の介在期間、または依存症患者の臨床離脱時に取得されたかによって異なります。
まれな例外を除いて、乱用薬物の使用は、視覚的に分析されたEEGトレースに明白な臨床的異常を導入することはありません。これは特に娯楽目的での薬物使用に当てはまり、依存性のある使用の場合も同様です。このため、薬物乱用のみを理由にEEGを依頼する十分な理由はありません。多くの乱用薬物によって生成される視覚的に分析されたEEGの周波数と電圧の変化は印象的でないことが多いですが、地形図Q-EEG分析は、人口規範からの有意な逸脱を構成するEEGスペクトルの著しい変化を明らかにすることができます(臨床的意味合いは不明確であるかもしれませんが)。それにもかかわらず、異なる薬物クラスがEEGに与える様々な影響を理解することが重要です。
アルコール
エチルアルコール、またはエタノールは、ベンゾジアゼピンと多くの同じ薬力学を示します(すなわち、GABAA受容体の陽性アロステリックモジュレーターとして作用します)。そのため、その行動およびEEG効果の多くは類似しています。アルコール摂取には、アルファ活動量の増加とアルファ周波数のわずかな徐波化が典型的であり、血中アルコール濃度が高いほどシータ活動量が増加するという点でかなりの合意があります。一部の報告では、慢性的なアルコール摂取がより低い電圧とわずかに速い安静時EEGと関連している可能性が示唆されていますが、これの臨床的関連性は依然として不明確です。
アルコール離脱は、GABAとグルタミン酸の神経伝達物質/受容体機能の障害の結果として、てんかん性発作につながる可能性があります。離脱中の依存症アルコール中毒者では、高周波数のベータ活動が大幅に増加することがあり、せん妄振戦が臨床像を複雑にする場合、過剰な速波活動がEEGを支配する可能性があります。急性アルコール離脱中のEEGシグネチャは、低電圧で非同期化され、広範な棘波が観察されることがあります。アルコール関連発作は、併存するアルコール依存症を伴う真のてんかん波様活動と鑑別する必要があります。ルーチンEEGはこの点で非常に役立ちます。禁酒期間中の正常なEEG、特に早期離脱中の異常なEEGと関連している場合、発作が離脱によって誘発されたものであることを強く示唆します。バルビツール酸塩からの離脱と比較して、アルコールからの離脱中は、EEGはより速く正常化する傾向がある(広範な振幅の減少を除く)ことに留意すべきです。
オピエート
モルヒネやヘロインなどのオピエートがEEGに与える影響はアルコールと類似しており、アルファ周波数のわずかな減少を伴います。また、EEGの電圧、特にシータ活動とデルタ活動のパワーを増加させることもあります。オピオイド麻酔は、良性てんかん波様睡眠一過性波に似た棘波放電を誘発することも示されています。しかし、オピエートの過剰摂取が昏睡性の臨床症状を引き起こす場合、EEGは通常、臨床的に異常な広範な徐波化から構成されます。
大麻
マリファナ、または大麻は、最も一般的な乱用薬物の一つであり続けています。さらに、非犯罪化の傾向と「医療用マリファナ」の使用の受容により、その消費率は上昇しています。大麻、またはその主要な精神活性成分であるデルタ-9-テトラヒドロカンナビノール(THC) は、中枢カンナビノイド受容体(CB1R) を介して脳に影響を与えます。CB1Rは、主に神経伝達物質GABAとグルタミン酸の放出に影響を与えることによって作用します。SkosnikとCortes(2016)がレビューしたように、大麻/THCがEEGに与える影響は、安静時EEG(固有のリズム)、ERP、および誘発/誘導された振動への影響に分類できます。
急性大麻喫煙は、従来のEEGには通常、最小限の視覚的影響しか与えません。Q-EEGを利用した現代の研究では、慢性的大麻使用者は、非中毒状態でアルファ、シータ、およびベータ周波数帯域のパワーの減少を典型的示します。急性THCは、安静時シータパワーを減少させることが示されており、これは記憶パフォーマンスの変更と関連しています。慢性的および急性の両方の大麻/THCは、P300 ERPを妨害することが示されており、これは大麻の注意と記憶への影響と一致しています。最後に、慢性的および急性の両方の大麻/THCは、感覚誘発性および誘導性のガンマリズムを妨害することが示されており、これはカンナビノイドの知覚変化作用のメカニズムを提供する可能性があります。
最後に、大麻に含まれるもう一つの非精神活性成分であるカンナビジオールが抗てんかん特性を持つことが示されていることにも留意すべきです。したがって、これはカンナビノイドの「薬用」使用における将来の潜在的な方向性を示す可能性があります。
精神刺激薬
コカイン、アンフェタミン、メチルフェニデートなどの精神刺激薬は、主に中枢ドーパミン機能を増加させるように作用します。これらは通常、ベータ活動とアルファ活動の量を増加させ、一般的にEEG電圧を減少させます。精神刺激薬の過剰摂取は、EEGに典型的な昏睡パターンを引き起こします。精神刺激薬がERPに与える影響はまちまちの結果を出していますが、統合失調症のようなドーパミン機能障害で観察されるものと類似したいくつかの効果を示す可能性があります。
吸入剤
揮発性物質(例:飛行機糊、洗浄液、塗料シンナー、ガソリン)の吸入乱用は、ほぼ瞬時の陶酔感を生み出すことができ、使用の初期には、急性反応が治まった後に明らかな残存物がない場合があります。しかし、吸入剤の乱用が続くと、深刻な神経学的および神経認知機能障害が出現し、禁煙によって完全に回復しない可能性があります。揮発性物質の吸入がヒトEEGに与える即時的な影響は十分に研究されていないようです。慢性的な吸入剤乱用後に持続的な神経学的または神経認知後遺症がある場合、低シータから高デルタ帯域の臨床的に異常な広範なEEG徐波が見られることがあります。
幻覚剤
リゼルグ酸ジエチルアミド(LSD)やメスカリンのような薬物は、視覚的に分析されたEEGにわずかな影響しか与えず、臨床的に関連する変化は引き起こしません。しかし、最近のエクスタシー(MDMA)に関する研究では、いくつかのERPの異常が示されており、これは長期MDMA使用による記憶障害効果と関連している可能性があります。
タバコ
タバコ(ニコチン)は、アナログEEGに劇的な変化を引き起こすようには見えません。しかし、地形図Q-EEG分析は、タバコの急性暴露および離脱において顕著なEEG変化を明らかにします。喫煙の即時効果には、遅い周波数(特にシータ)の減少、アルファ周波数帯域の上半分におけるパワーの増加、およびベータ活動が含まれます。24時間のタバコ禁断は、アルファ周波数の著しい減少を引き起こし、対応するシータ活動の相対パワー(量)の著しい増加を伴います。急性喫煙と禁断の効果は本質的に互いに反対です。さらに、ニコチンは、P50 ERP抑制の研究によって示されるように、「感覚ゲート」の変化と関連しています。ただし、これらの効果は、急性ニコチン暴露時に検査されるか、ニコチン離脱時に検査されるかによって異なる場合があります。
カフェイン
コーヒーやカフェイン含有製品の使用は非常に普及しています。カフェインの使用は、視覚的に分析されたEEGを解釈する臨床医にとってほとんど懸念になりません。しかし、カフェイン依存症の個人におけるカフェイン離脱は、シータ活動の振幅または電圧の著しい増加を引き起こします。この効果は、コーヒー1杯を摂取してから15分以内に可逆的です。
その他の乱用薬物
近年、いくつかの新規合成乱用薬物が出現しており、最も注目すべきは合成カンナビノイドである「K2/スパイス」と、通常カチノン系である合成精神刺激薬/幻覚剤である「バスソルト」です。しかし、これらの物質、特にEEGの文脈での研究はほとんど行われていません。
EEGと実験的研究パラダイム
精神医学分野で行われるEEGの大部分は、実際には研究目的であり、通常の安静条件下で確認される内在性リズムの研究だけでなく、様々な感覚-知覚および認知課題に関連する多くの実験パラダイムも含まれます。EEGの高い時間分解能は、本質的に実験条件下での脳活動の変化を「リアルタイム」で測定することを可能にします。EEGは、実験者が、頻繁に提示される刺激とまれに提示される刺激に対する聴覚反応の違いのような顕在的なプロセス、ならびに刺激提示の予期(例:事象関連陰性変動;CNV)から、ボタン押しに備えた補足運動野活性化(例:側方化「準備」電位;LRP)、あるいは刺激セットの提示後のワーキングメモリに関連する統合-想起プロセスに至るまでの潜在的なプロセスに関連する脳活動の変化を研究することを可能にします。これらの例が示すように、EEGは、時間の経過に伴う一連の精神的活動として生成される神経活動の違いや変化を評価するための理想的なツールです。このような機能が離散的な皮質または皮質下領域に局在化できるかどうか(これはEEG研究の第一の目的ではありません)にかかわらず、既知の事象(例:制御された試験条件下)に応答して神経活動の変化を正確に記録する能力は、研究者が人間の情報処理と精神疾患によって影響を受ける能力に関する無限の質問を問い、潜在的に答えることを可能にします。
誘発電位と事象関連電位
実験的EEG研究の起源は間違いなく誘発電位(EP)法に根ざしており、これは中枢神経機能の検査として神経内科診療においてルーチンで用いられ続けています。簡単に言えば、EPは外部刺激に対する電気生理学的応答であり、通常は刺激特性(例:周波数、強度)の変化を伴いながら、数回の繰り返しで投与されます。EPは任意の感覚モダリティで生成できますが、ほとんどの臨床応用では、EEGで測定される視覚誘発電位(VEP) と脳幹聴覚誘発電位(BAEP)、または筋電図で測定される体性感覚誘発電位(SSEP) を伴います。EPに関して覚えておくべき重要な点は、応答が刺激の送達に時間的にロックされているため、厳密に「誘発された」ものと見なせることです。この点が、概念的および意味的に類似しているが、刺激に対する電気生理学的応答でもある事象関連電位(ERP) とEPを区別します。しかし、これらの測定値を区別する微妙な違いは、前段で提供されたいわゆる顕在的プロセスと潜在的プロセスの例で理解できます。顕在的な聴覚誘発応答はEPと見なせるのに対し、CNVやLRPを含むERPの例は刺激送達の前に発生し、したがって、刺激に時間的にロックされたり、「誘発された」応答であるとは限らない、精神的活動の実行プロセスに関与する脳活動を反映しています。したがって、「誘発された」という用語は、研究分野では時間とともに「事象関連」に置き換えられ、EEG記録は「ボトムアップ」感覚誘発応答と、誘導された脳信号によって表現される高次認知プロセスに関連する神経活動の変化の両方を研究するために使用されています。
EPまたはERPに関するもう一つの基本的な原則は、これらの電位が、進行中のEEG活動(50uV以上に達する)と比較して、通常は振幅が小さい(数マイクロボルト程度) ということです。これは、EP/ERPが、何百もの試行からなる可能性のある、刺激送達の反復試行全体で一貫して存在するEEGの成分のみを表しているためです。EP/ERPは、平均化によってデジタル記録から抽出され、進行中の背景EEG活動(刺激に時間的にロックされていない)が平均化プロセスによって相殺された、刺激事象に応答する神経活動の変化を反映する信号となります。結果として得られた平均は、時間プロット上の電圧の変化としてグラフ化され、ピーク振幅と潜時の測定値によって定量化できます。
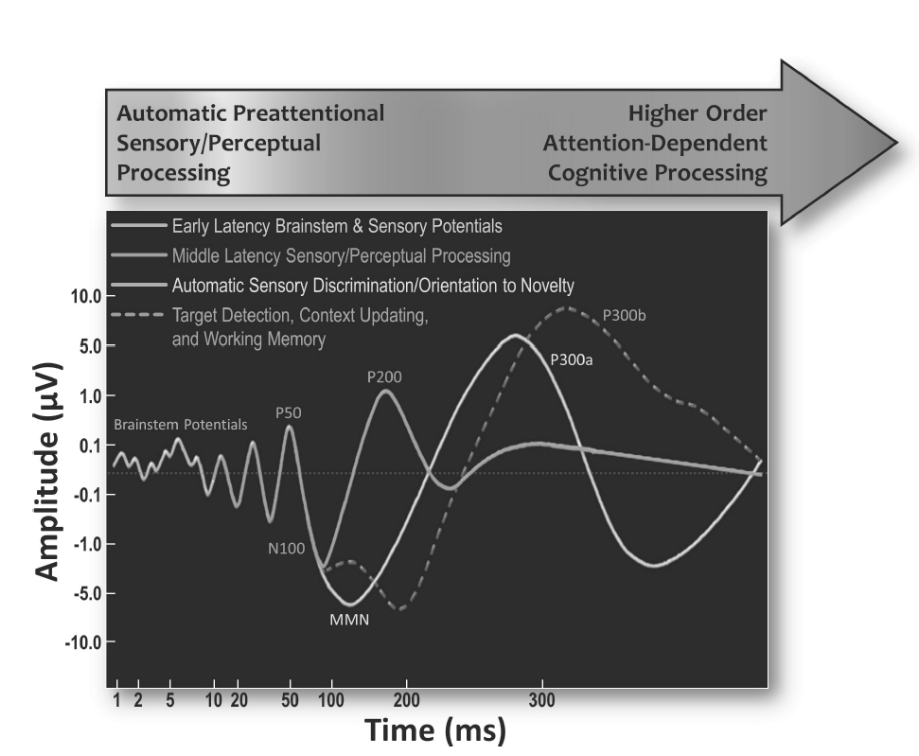
慣例により、BAEPはローマ数字I、II、III、IV、Vでラベル付けされ、成分の順序を反映しており、成分IからIIIは第VIII脳神経の聴覚枝によって生成され、成分IVとVは上部脳幹によって生成されます。ERP(およびSSEPとVEP)は、その極性と潜時の両方に応じてラベル付けされます。「P」または「N」の文字は、刺激前ベースラインに対する偏位の正または負の方向を示しますが、極性がグラフ上で上向きまたは下向きに描かれるかどうかは個人的な選択の問題であり、多くの場合、関連する電場双極子分布のため、電極位置によって極性が反転することもあります。ERPピーク潜時を表すラベル命名法は、例外を除いてより単純に行われます。ラベル「P300」と関連するERPは、刺激送達後約300msでピークに達する正の偏位ですが、約100msでP1またはP100、約200msでP2またはP200に続くERPの3番目の正の偏位を示す「P3」も使用できます。精神医学で最も一般的に研究されているERPの時間経過と従来のラベル付けは、図1.26-16に示されています。
脳に刺激が提示されると、それは受容感覚器官と脳幹(視覚および嗅覚刺激を除く)を通過し、特定の感覚入力に対応する一次皮質領域へと向かいます。一次感覚皮質で記録されるEPは、刺激が脳によってどのように受容され、登録されたかを示し、それによって根底にある神経構造の完全性の検査を提供します。例えば、BAEPは、聴覚刺激の送達後最初の10ms以内に発生するEEG波で測定され、聴覚経路の完全性を反映していると考えられており、ほとんどは難聴の診断に有用です。ERPがほとんどの現代神経精神医学研究の焦点となっているため、現時点では、基本的なEPが精神疾患によって広範にまたは特異的に影響を受けるかどうかは確実には述べられません。しかし、例えば、早期感覚処理における障害は、統合失調症の病態生理の根幹にあると考えられており、感覚処理の最も初期段階で検出される障害を含む可能性があります。
情報処理の段階に関して、早期潜時電位(刺激後10ms未満で発生するBAEPやその他の成分を含む)、中期潜時電位(200msまで発生する)、および後期潜時電位(200ms以降に発生する)という基本的な区別がなされています。一般的な経験則として、早期潜時電位は主に、刺激強度やレートなど、中枢神経系外で決定される外因性要因に依存する処理を反映していると考えられています。外因性電位は、被験者の意識レベルに関係なく測定でき、認知プロセスによって本質的に影響を受けず、基本的な感覚登録を表していると考えられています。脳によって受容されると、刺激は心理的処理と評価を受け、これらの操作は一次感覚皮質外に広く分布する後のERP波に影響を与えます。ERPにも外因性成分が含まれますが(通常は早期潜時電位を正確に測定するにはサンプリングレートが遅すぎる)、中期潜時電位と後期潜時電位は実験研究にとって最も関心のある傾向があります。情報処理の後期段階では、ERPは、予期、符号化、認識などの認知プロセスに関連する活動をますます反映するため、実験課題に費やされる覚醒度と注意資源のレベルによって影響を受ける可能性があります。したがって、中期潜時および後期ERPは主に内因性電位を反映し、振幅やその他の特性の測定値は、刺激特性と実験課題の要求と、情報処理における個々の差異との相互作用を反映します。ERPは実験的操作に敏感であるため、感覚処理と認知処理のインターフェースにおける脳機能を研究するために様々なパラダイムが開発されてきました。これらのパラダイムは、精神医学研究文献全体で中期潜時および後期のプロセス中に多くの異常を示しており、したがって臨床ツールとしての潜在力にかなりの関心があります。
中期潜時成分(P50とN100)
聴覚モダリティにおいて最も多く研究されているERP成分のうち3つは、P50(刺激提示後35〜80msで発生する陽性成分)、N100(刺激提示後80〜150msで発生する陰性成分)、およびP200(刺激提示後150〜250msで発生する陽性成分)とされています。図1.26-16は、これらの中期潜時ERPの典型的な例を示しています。
これらの成分は、反復によって振幅が減少する(慣れまたは感覚ゲート) という共通の特性を持っています。P50とN100成分は、精神科患者において広範に研究されてきました。
中期潜時成分(P50とN100)
聴覚モダリティで最も詳細に調べられている3つの事象関連電位(ERP)成分は、P50(刺激提示後35〜80ミリ秒でピークに達する陽性成分)、N100(刺激提示後80〜150ミリ秒で発生する陰性成分)、およびP200(刺激提示後150〜250ミリ秒で発生する陽性成分)とされています。図1.26-16は、これらの中期潜時ERPの典型的な例を示しています。
これらの成分は、反復によって振幅が減少する(慣れまたは感覚ゲーティング) という共通の特性を持っています。P50とN100成分は、精神科患者において広範に研究されてきました。
P50
P50は、刺激提示後約50ミリ秒でピークに達する陽性電圧の中期潜時ERP成分であり、離散的な聴覚刺激(例:短いホワイトノイズクリック音)によって最もよく誘発されます。標準的なP50ゲーティングまたは「デュアルクリック」パラダイムでは、2番目の対になったクリック(S2)に対するP50の振幅が、最初のクリック(S1)に対するP50の振幅と比較して減衰します。通常、500ミリ秒の刺激間隔が用いられ、ゲーティングを誘発するのに最適です。S1に対するP50は、脳が顕著な刺激を登録する能力に関連すると考えられているのに対し、S2に対するP50振幅の減少(S1と比較して)は、冗長で無関係な刺激の自動的抑制的ゲーティングを反映しています。これは、海馬、側頭頭頂領域、聴覚皮質、および前頭前野によって媒介されていると考えられています。
P50抑制の欠陥は、統合失調症と一般的に関連しており、精神病リスクの候補内表現型(疾患の根底にある遺伝的原因と関連する生理学的に検出可能な特徴)として提案されています。これは、いくつかの精神病リスク遺伝子への連鎖の証拠や、統合失調症のプロバンドの第一度近親者で観察されるP50抑制の同様の減少によって部分的に支持されています。統合失調症患者における抑制異常(すなわち、感覚ゲーティング欠損)の証拠は、過去30年間にわたって蓄積されてきました。統合失調症の提案されている内表現型の初期のメタアナリシスでは、P50応答の感覚ゲーティングが、神経画像研究および行動研究で報告されている最も堅牢な所見と同等またはそれ以上の欠損の大きさを示していることが判明しました。
N100
N100成分は、課題要求に関わらず存在する大きな外因性ERPです(ただし、注意によって変調されることがあります)。N100は一般的に、一次感覚皮質に起源を持つ早期の知覚処理と関連しており、実験的な文脈に関係なく、様々な形式の聴覚および視覚刺激に応答して誘発されます。注目すべきは、視覚N100が後頭部および後頭頂部の電極部位に局所的に集中するのに対し、N100(すべての聴覚ERPと同様に)は、両側聴覚皮質で生成される電位の合流を代表して、中心または前頭中心の部位で最大となる傾向があることです。
N100成分は、デュアルクリックパラダイムを使用して評価した場合、P50 ERPと同様の抑制を示すことも示されており、統合失調症患者でも同様に影響を受けます。ヨハネスセンとその同僚の研究は、統合失調症におけるN100振幅の減少が、対になったクリック音によって誘発されたか、より短い刺激間隔(約1,200ミリ秒間隔)で提示された純音によって誘発されたかにかかわらず、健常対照被験者と比較した場合に同様に大きな効果量を持つことを示し、したがって、聴覚反応を誘発するために使用される刺激特徴よりも、内部の神経処理に依存することを示しています。同じ研究では、P50およびP300測定値が統合失調症と双極性障害を区別できなかったのに対し、N100は、これらの精神医学的グループを合理的な(72%の)精度で分類する際に独自の分散を提供しました。注目すべきは、いくつかのERPおよびスペクトル周波数測定値からなる最適な多変量モデルを使用した、N100に基づく統合失調症と双極性参加者の分類は、一致した健常参加者に対する統合失調症の分類(79%の精度)よりもわずかに精度が低いだけでした。したがって、N100によって示される聴覚処理は、統合失調症患者の間で一貫した(例:異なる実験的文脈で得られる)、堅牢で、おそらく診断的に関連する神経生理学的欠損を表していると考えられます。
P300
P300は、後期陽性、後注意性ERP成分であり、指向性注意、ワーキングメモリの文脈更新、および逸脱的または新規な刺激への顕著性の帰属に関連すると考えられています。この応答は通常、標準的な「オッドボール」パラダイムを利用して誘発されます。このパラダイムでは、低確率の標的刺激(約10%〜20%)が、何らかの物理的次元(例:周波数、持続時間、振幅)で異なる高確率の標準刺激(約80%〜90%)の反復シーケンスの中に埋め込まれています。P300、特にP300b成分(指定された標的への応答として誘発される) は、視床、海馬、下頭頂葉、上側頭回、前頭皮質などの領域を含む分散した神経ネットワークからの活動を反映すると考えられています。認知神経科学者および感情神経科学者は、P300が40年以上前に発見されて以来、基本的な研究を行っており、臨床科学者によってまだ完全に活用されていない豊富な知識基盤を提供しています。
ミスマッチ陰性電位(MMN)
ミスマッチ陰性電位(MMN) は、主に上側頭葉と前頭前野で生成される、自動的で前注意性の陰性電圧ERP成分です。MMNは、標準刺激と周期的な逸脱刺激間の「ミスマッチ」の自動的で前注意性の処理を指標化すると考えられています。これは、逸脱刺激と標準刺激によって生成されたERPの減算によって作成された波形において、100〜200msの潜時で測定される陰性成分の振幅によって示されます。MMN実験はP300オッドボールパラダイムと類似しており、標準刺激(例:1,000Hzのトーンの10ms提示)の連続提示が、微妙に異なる逸脱刺激(例:1,500Hzのトーンの10ms提示、1,000Hzのトーンの50ms提示)によって時折中断されます。
しかし、P300とは異なり、刺激への注意は必要なく、通常は同時並行の非妨害的タスク(例:読書、視覚的ターゲット検出)によって主要な聴覚弁別タスクから注意が転用されます。また、聴覚刺激と視覚刺激の両方に敏感なP300とは異なり、MMNはほとんどが音響情報処理に関連して研究されてきました。周波数、持続時間、律動パターンや刺激提示のタイミングなどの学習された特徴を含む、音響刺激のほぼあらゆる特徴に敏感であるため、MMNは聴覚処理の特定の側面に関連する問題の評価に特に有用です。MMNの逸脱は、うつ病、アルコール依存症、認知症を含むいくつかの精神疾患で報告されていますが、統合失調症で最も注目されています。
初回入院した統合失調症患者を対象とした縦断的調査において、Salisburyとその同僚(2007)は、初回入院後1.5年間のMMNの減少が、統合失調症ではヘッシェル回の灰白質体積の進行性減少と関連していたことを示しました。一方、精神病性双極性障害患者または健常対照被験者では、MMNと灰白質測定値の間で有意な変化や相関は認められませんでした。この重要な発見は、実験的電気生理学的プロセスと脳構造を結びつけ、統合失調症の病因に特異的に関与している可能性のある神経変性プロセスに対するMMNの感度を浮き彫りにしています。
エラー関連陰性電位(ERN)
通常、選択反応時間課題で研究されるエラー関連陰性電位(ERN) は、誤った選択がなされてから約60〜150ms後に発生します。ERNは、エラー検出への感受性、エラーを補償するために取られる是正行動、およびプロセスによって生成される葛藤を反映すると提唱されています。時間周波数分析は、ERNが主に前帯状皮質(ACC) に由来すると考えられる前頭部のシータ活動から構成されており、ACCは行動制御と自己モニタリングに関与する神経系の一部です。ERNが感情的および認知的情報処理と評価の両方に関与しているように見えるため、OCDや他の不安障害、大うつ病、行動脱抑制に関連する外向性精神病理を含む様々な精神疾患の臨床的特徴に敏感であることは驚くべきことではありません。これらの研究結果は、不安な個人はより大きなERNを生成するため、エラーを犯すことに対してより敏感である一方、うつ病の個人や行動脱抑制に関連する障害を持つ個人はそうではないことを示唆しています。これらの結果は、これらの障害の臨床的特徴付けを考慮すると、一般的に期待と一致しています。
まとめと今後の方向性:精神病理の体系的研究におけるEEG
ERPを含むEEGの異常が、統合失調症、気分障害、不安症、ADHD、物質乱用障害など、様々な精神疾患と関連していることは、膨大な研究文献によって今や確固たるものとなっています。
ERPはEEGから派生しているため、時間周波数分析を使用して構成要素となるEEGスペクトルを特定することが可能です。これらは刺激提示に時間的にロックされているため、ERP波形を構成します。この種の分析は、事実上、刺激の開始から関連するERPの解決までの各時点において、各EEG周波数の量を決定することを可能にします。これらの過渡誘発振動(図1.26-13) は、自発的/安静時EEGで特定されたのと同じ周波数帯域に分割できますが、安静時EEGでの出現に関連する役割とは機能的に異なる役割を果たす可能性のある刺激誘発性リズムを表しています。例えば、より高い安静時低周波数(例:デルタ、シータ)は多くの臨床状態で病理と関連していますが、課題関連条件下(例:ワーキングメモリ)での低周波数活動のより高い活性化は、より良い脳機能を示すと解釈されることがよくあります。P300 ERPに関しては、より高い振幅(より良い機能)は、主にデルタおよびシータ周波数の活性化に依存し、アルファ周波数の減少を伴います。
一例を挙げると、過渡誘発振動は、脳のダイナミクスと精神病理、特にアルコール依存症の発症に関する洞察を提供し始めています。減少したデルタおよびシータ誘発振動は、減少したP300振幅に関連するリスクを超えて、アルコール依存症の発症リスクと関連しています。これは、P300 ERPを構成する振動成分に分解することが、ERPによって特徴付けられる帯域通過信号(通常0.5〜12Hzまたは24Hzまでフィルタリングされる)よりもこの測定値の感度を向上させる可能性があることを示唆しています。これらの誘発振動はまた、多くの精神疾患に関与する神経化学経路に関連しているコリン作動性およびGABA作動性神経伝達物質システムに関与する遺伝子変異体とも関連しています。アルコール依存症で行われたこの種のERPまたは誘発振動研究は、人間の情報処理の実験的電気生理学的アッセイを、精神疾患の発症リスクの根源的な生物学的、そしておそらく遺伝的に関連する指標として使用するための進化する科学的努力を例証しています。
研究成果の臨床応用への翻訳
臨床的意思決定に新しい測定アプローチを評価し統合するための指針となるシステムや受け入れられたアプローチがない場合、大きな可能性を秘めたEEG所見は、同様の研究に着手しようとする研究者のみが発見できる興味深い研究成果として残り続ける可能性が高いです。そのような所見を診断的に堅牢で、臨床的に意味があり、心理測定学的に検証された手順に翻訳しなければ、学術コミュニティによって評価されている精神医学におけるEEGの進化は、臨床応用には繋がらないでしょう。私たちは、2007年にナッシュ・ブートロスとシンシア・アルフケンによって提供されたガイダンスを、診断ツールを心理測定学的に開発するために取られたステップの例としてレビューし、コメントします。
以下に、ご要望いただいた日本語訳を逐語的に正確に示します。
臨床診断および/またはエンドポイント測定の開発に関するこの基準に従い、EEG研究方法を臨床ツールに変換するのに適切であると見なされる場合、以下の点が考慮されるべきである。医療政策を策定する幅広いステークホルダーから孤立してこれらの努力が行われた場合、現在の標準治療への受容と統合に必要な範囲または支持が不足する可能性がある。この意味で、効果的な変換は、保険支払者、患者擁護団体、民間企業(例:EEGメーカー、製薬会社)、および医薬品や医療機器の安全性と有効性を確保することで公衆衛生を保護することを職務とする食品医薬品局(FDA)などの連邦規制当局からの意見も有益となるだろう。関心のある読者は、FDAクリティカルパスイニシアチブが提供する出版物を参照されたい。2004年に開始されたCPIは、FDAが規制する医療製品の開発、評価、製造方法を変革するためのFDAの国家戦略である。現時点では、EEGに関するイニシアチブはほとんど検討されていない。しかし、FDAは最近、医師が自宅から個人のEEGを日常活動中に監視できる遠隔EEGウェアラブルデバイスに510(k)承認を与えた。FDA承認は、新しいデバイスメーカーが、すでに承認されている同様の市場デバイスと「実質的に同等」であることを製品が示すことができる場合に適用され、デバイスメーカーは、特定の期間内に医療機器を市場に出す意図をFDAに通知する必要がある。市場に同等のものがない(すなわち、先行品がない)新しいデバイスや測定値の承認への道は、比較してより複雑であり、臨床試験の結果を通じて、そのテストの利益が既知のリスクを上回ると当局が結論付ける必要がある。CNS薬物開発に投資している製薬業界のスポンサー、学術界のリーダー、およびEEGデバイスメーカーの協力を含む、EEG測定値を薬物開発ツールとして確立するための現在の取り組みが、慎重な科学を通じて、精神医学におけるEEGの将来の展望を示す別の例としてここに示されている。ERPバイオマーカー認定コンソーシアム(https://erpbiomarkers.org/)。
ステップ1
生物学的変数が特定の患者集団において健常対照者から逸脱していることが観察される。この初期段階の重要な要素は、盲検法を用いてその所見のテスト-再テスト信頼性を実証することである。目標は、測定法およびそれを取得するための手順を標準化し、その測定法が意図された使用シナリオ全体で再現可能かつ一般化可能であることを保証することである。このような努力は、単一の研究室、あるいは少数の研究施設では現実的に達成不可能であり、測定方法論の調和に尽力し、そのような努力を支援するために必要な財源を生み出すことができる大規模な研究者グループ間の協力的な努力を必要とする。実際には、意味のある人口パラメータを推定するために必要な、人口統計学的、地域的、そしておそらく国際的な多様性を代表するサンプルを取得することを意図するだろう。NAPLSコンソーシアムはそのような努力の一例であり、米国中の8つの研究サイトとカナダの1つのサイトが関与し、共通のメカニズムの下で共同で助成金資金を申請し、各サイトの専門家が主導して測定努力を調整し、サイト間のテストプロトコルの標準化を推進した。
ステップ2
特定の所見の潜在的な臨床的有用性の実証。この段階での最も重要な2つの目的は、ターゲット患者集団と適切な対照群(ターゲット疾患の鑑別診断リストに一般的に現れる診断を持つ患者群であるべきである)との間の差異の実証である。所見の効果量の推定は、ステップ3の研究の有力な候補と見なされるべき所見を判断するための合理的な指針となる可能性がある。注目すべきは、臨床的意義に関するガイダンスは、「意義」が実証される基準に応じていくつかの形をとる可能性があることである。診断エンティティの分離が、より広いクラスを代表する診断的特徴の典型性に関する基本的な基準を満たす一方で、バイオマーカー単独の「意義」は、特に中枢神経系疾患の場合において、医薬品開発者と連邦規制当局との間で非常に争われている問題である。したがって、現在の医療基準によって提供される前例を追加的に考慮すべきである。例えば、新しい技術(例:遠隔外来EEGモニタリング)が、診断的監視のための臨床標準(例:クリニックベースの睡眠研究)と同程度の性能を示すことが実証された場合、開発への道はより単純である。EEGが、疾患の早期発見や治療への早期反応の測定値など、予後指標として有用であると見なされる例では、臨床的意義の基準は、既知の疾患状態におけるマーカーの存在だけでなく、将来の転帰を予測するその予測力に基づいているだろう。
ステップ3
テストの性能特性を確立する必要がある。具体的には、生物学的マーカーの感度、特異度、陽性予測値、および陰性予測値を検討すべきである。これらの基準は、測定値が意図するインデックスケース(例:診断グループ、治療応答者、「高リスク」段階から移行する者)を高感度で正確に特定する能力(陽性マーカーが状態を示す)だけでなく、これらのケースを他のクラスに属する者から正確に区別する能力(陰性マーカーが状態の不在を示す)も考慮し、これは分類結果に対する測定値の特異度を反映する。意図する使用と、分類器が情報を提供するために使用される意思決定のリスク-ベネフィットに応じて、感度を特異度よりも最適化する測定値、またはその逆の測定値が優先される可能性がある。
ステップ4
テストの臨床応用を定義し、大規模な多施設臨床試験で使用される技術を標準化するのに役立つ。多施設試験は、テストを実施するために使用される検査手順の標準化のための方法論、ならびに費用対効果と短期および長期の臨床転帰への影響に関するデータの取得を指導すべきである。診断検査の開発に向けた取り組みを記述する研究は、診断精度報告基準(STARD)イニシアチブ(https://www.equator-network.org/reporting-guidelines/stard/ を参照)が提案するガイドラインを遵守することが強く推奨される。
参考文献
- Bauer G, Bauer R. EEG, drug effects, and central nervous system poisoning. In: Schomer DL, Lopes da Silva FH, eds. Niedermeyer’s Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. Lippincott Williams & Wilkins; 2011.
- Boutros NN, Mirolo HA, Struve F. Normative data for the unquantified EEG: examination of adequacy for neuropsychiatric research. J Neuropsychiatry Clin Neurosci. 2005;17:84-90.
- Boutros NN, Arfken CL. A four-step approach to developing diagnostic testing in psychiatry. Clin EEG Neurosci. 2007;38:62.
- Chang BS, Schomer DL, Niedermeyer E. Epilepsy in adults and the elderly. In: Schomer DL, Lopes da Silva FH, eds. Niedermeyer’s Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. Lippincott Williams & Wilkins; 2011.
- Cong F, Ristaniemi Y, Lyytinen H. Advanced Signal Processing on Brain Event-Related Potentials: Filtering ERPs in Time, Frequency and Space Domains Sequentially and Simultaneously. World Scientific; 2015.
- Grant AC, Abdel-Baki SG, Weedon J, et al. EEG interpretation reliability and interpreter confidence: a large single-center study. Epilepsy Behav. 2014;32:102-107.
- Greenfield LJ, Geyer JD, Carney PR. Reading EEGs: A Practical Approach. 2nd Edition. Lippincott Williams & Wilkins; 2020.
- Johannesen JK, O’Donnell BF, Shekhar A, McGrew JH, Hetrick WP. Diagnostic specificity of neurophysiological endophenotypes in schizophrenia and bipolar disorder. Schizophr Bull. 2013;39:1219-1229.
- Michel CM, Brunet D. EEG Source Imaging: A Practical Review of the Analysis Steps. Front Neurol. 2019;10:325.
- Narayanan B, Soh P, Calhoun VD, et al. Multivariate genetic determinants of EEG oscillations in schizophrenia and psychotic bipolar disorder from the BSNIP study. Transl Psychiatry. 2015;5(6):e588.
- Nunez PL, Srinivasan R. Electric Fields of the Brain: The Neurophysics of EEG. 2nd ed. Oxford University Press; 2006.
- Pang T, Selvitelli M, Schomer DI, Niedermeyer E. Metabolic disorders in EEG. In: Schomer DL, Lopes da Silva FH, eds. Niedermeyer’s Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. Lippincott Williams & Wilkins; 2011.
- Perrottelli A, Giordano GM, Brando F, Giuliani L, Mucci A. EEG-based measures in at-risk mental state and early stages of schizophrenia: a systematic review. Front Psychiatry. 2021;12:653642.
- Roach BJ, Carrión RE, Hamilton HK, et al. Reliability of mismatch negativity event-related potentials in a multisite, traveling subjects study. Clin Neurophysiol. 2020;131(12):2899-2909.
- Salisbury DF, Kuroki N, Kasai K, Shenton ME, McCarley RW. Progressive and interrelated functional and structural evidence of post-onset brain reduction in schizophrenia. Arch Gen Psychiatry. 2007;64:521-529.
- Schmidt LA, Segalowitz SJ. Developmental Psychophysiology: Theory, Systems, and Methods. Cambridge University Press; 2007.
- Skosnik PD, Cortes-Briones JA. Electroencephalography (EEG) and cannabis: from event-related potentials (ERPs) to oscillations. In: Preedy VR, ed. The Neuropathology of Drug Addictions and Substance Misuse. Elsevier Science; 2016.
- Thatcher RW. Validity and reliability of quantitative electroencephalography. J Neurother. 2010;14:122-152.
- Zaboski BA, Stern EF, Skosnik PD, Pittenger C. Electroencephalographic correlates and predictors of treatment outcome in OCD: a brief narrative review. Front Psychiatry. 2021;12:703398.

