要約
この記事は、うつ病の病態生理と治療におけるミクログリアの役割についての包括的なレビューです。ミクログリアは脳内の主要な免疫細胞であり、炎症や神経ネットワークの形成に関与し、うつ病において重要な役割を果たします。記事では、ミクログリアの活性化、抗うつ薬や天然物による調節、ストレスモデルにおけるミクログリアの影響などを詳述しています。また、ミクログリアが炎症、神経新生、シナプス可塑性にどのように関与するかについても焦点を当てています。
主なポイント
- ミクログリアはうつ病の病態生理において重要な役割を果たし、炎症や神経ネットワーク形成を調節する。
- 動物モデルや患者におけるミクログリア活性化のメカニズムが説明されている。
- 抗うつ薬や天然物がミクログリアの活性化に与える影響について議論されている。
- ミクログリアの炎症促進性(M1)または抗炎症性(M2)の分極が、うつ病の発症や治療に関連している。
- ミクログリアを標的とする治療が、新しい治療戦略となる可能性が示唆されている。
- うつ病患者の脳領域(前頭前皮質、海馬など)でミクログリアの活性化や密度の変化が観察されている。
- ストレスや炎症がミクログリアを介して神経新生を抑制し、うつ病の進行に寄与する。
- 天然物(ギンセノシド、クルクミンなど)は、ミクログリアを調節し、うつ病様の行動を改善する可能性がある。
- 腸内マイクロバイオータとミクログリアの関係が、腸-脳軸を介したうつ病発症に影響を与える可能性がある。
本文
大うつ病性障害は、脳内のさまざまな細胞種の機能不全を伴う、非常に衰弱性の高い精神疾患である。ミクログリアは、脳内の主要な常駐免疫細胞であり、うつ病において重要な役割を果たしている。 最近の研究では、うつ病はミクログリアの病気とみなすことができることが示唆されている。ミクログリアは、炎症、シナプス可塑性、および神経ネットワークの形成を調節するが、これらはすべてうつ病に影響を与える。 このレビューでは、うつ病の病態におけるミクログリアの役割を強調した。まず、動物モデルおよび臨床的にうつ病の患者におけるミクログリアの活性化について説明した。 次に、ミクログリアがうつ病関連ストレスを認識し、状態を調節する可能性のあるメカニズムを強調した。 第三に、抗うつ薬(臨床薬および天然物)がミクログリアの活性化にどのように影響するかを説明した。 したがって、このレビューは、うつ病におけるミクログリアの役割を客観的に分析し、潜在的な抗うつ薬に焦点を当てることを目的とした。 これらのデータは、ミクログリアの作用の調節が、深刻な精神疾患の悪影響を打ち消すための新しい治療戦略となる可能性があることを示唆している。
大うつ病性障害(MDD)は、世界中で約3億2200万人が罹患している公衆衛生上の問題である[1]。 2019年のコロナウイルス病(COVID-19)のパンデミックの間、メタアナリシスでは、COVID-19患者の45%がうつ病を経験したと報告された[2]。 70万人以上が、うつ病性障害による自殺で毎年命を落としており、個人と社会に大きな負担をかけている[3]。 MDDの臨床症状には、持続的な気分の落ち込み、食欲不振、好きな活動への関心の低下、絶望感、睡眠障害、および重度の場合は自殺行動が含まれる[4]。 残念ながら、遺伝的および環境的要因によって決定されるその複雑さと不均一性のために、うつ病の根底にある生物学的メカニズムは不明のままである。 現在、うつ病に関する理論は、主にモノアミン神経伝達物質の枯渇仮説、神経可塑性仮説、および視床下部-下垂体-副腎(HPA)軸仮説に焦点を当てている[5]。 しかし、これらの特定の病態メカニズムには、抗うつ薬の遅延効果を説明できないことや、中枢神経系(CNS)のニューロン以外の細胞に焦点を当てていないことなどの限界がある[6、7]。 ミクログリアは、CNSの自然免疫系の第一線であり、健康な脳と障害のある脳の微小環境の変化を積極的に調節する。 ミクログリアの活性化は、炎症、シナプスの洗練、シナプスの刈り込み、およびニューロンの接続性を調節する[8]。
うつ病は、ミクログリア関連障害(ミクログリア病)と考えられている[9]。 豊富な証拠は、ミクログリアを介した神経炎症が、上記のMDDと相関する3つの理論すべてと相互作用することを示唆している[10、11]。 神経炎症とHPA軸は、協調して機能すると考えられており、それらの調節不全がうつ病の発症を媒介する可能性がある[10、12-14]。 いくつかの臨床抗うつ薬は、ミクログリアの活性化と神経炎症に影響を与える[15-17]。 非ステロイド性抗炎症薬は、ミクログリアの活性化を抑制することにより、うつ病の症状を軽減するように見える[18]。 ミノサイクリンは、前頭前皮質(PFC)および海馬(HIP)におけるミクログリアの活性化を抑制することにより、うつ病様の行動を著しく改善する半合成テトラサイクリン系抗生物質である[19]。 ミクログリアの活性化は、最適な条件下でのM1の古典的活性化またはM2の代替活性化に分けられる[20]。 最近、ミクログリアの分極を調節する薬理学的原理は、精神障害の再発を軽減するための有益な治療法を提供する可能性がある[21-23]。 したがって、Pubmed電子データベースを使用して体系的なレビューを実施した。 検索テーマには、うつ病とミクログリア、神経新生、ストレス、および抗うつ薬が含まれていた。 1992年から2021年までの、ミクログリアとうつ病の関連性に焦点を当てた記事をレビューした。 このレビューでは、動物モデルおよび臨床的にうつ病の患者におけるミクログリアの活性化状態について説明した。 うつ病の根底にあるメカニズムと、ミクログリアを標的とする治療の可能性を解明した。 最後に、ストレス誘発性のうつ病動物モデルにおいて、ミクログリアを調節することによって作用する抗うつ薬の保護効果を強調した。
ミクログリアの起源と機能
ミクログリアの起源と発達
ミクログリアは、1919年にスペインの神経科学者ピオ・デル・リオ=オルテガによって明確な細胞型として初めて記述され、脳内の全細胞集団の約5〜10%を占めている[24]。 成体のマウスの脳内のミクログリアの数は、約350万個と推定されており、密度は領域によって異なる。 たとえば、より多くのミクログリアがHIP、黒質(SN)、嗅脳、および基底核に見られる。 より少ないミクログリアが、線維路、小脳、およびほとんどの脳幹で観察される[25]。 発生学的に、最近の系統追跡研究により、ミクログリアは発生中の卵黄嚢内の赤血球骨髄前駆細胞に由来し、発生中のCNSに移動して成熟したミクログリアに分化することが明らかになった。 CNSミクログリアは、個体の生涯を通じて、増殖とアポトーシスによって自己再生する細胞集団を形成する[26、27]。
ミクログリアの特性と機能
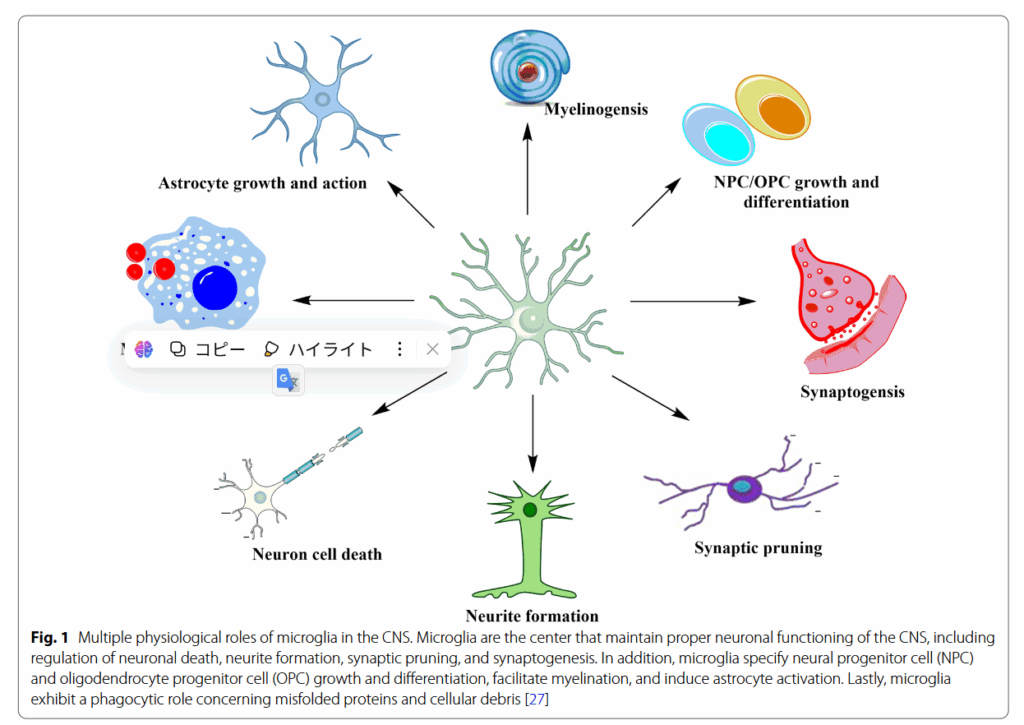
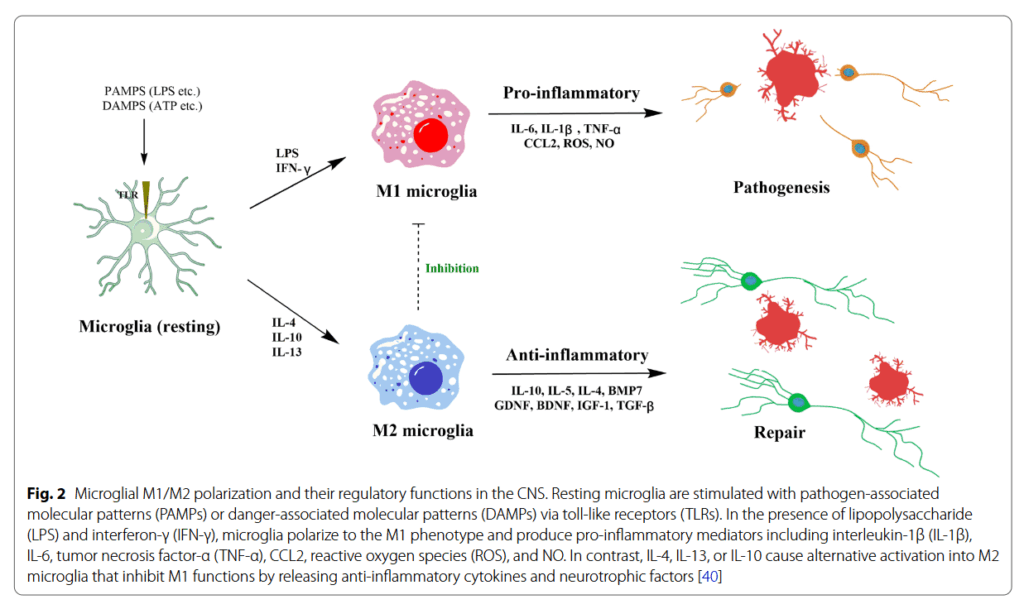
CNS免疫エフェクター細胞として、ミクログリアは、その形態と機能に関して、末梢マクロファージと類似している[28]。 通常の状態では、ニューロンはCNSにおいて調節の役割を果たす。 ミクログリアは、ニューロンに保護と栄養サポートを提供し、ニューロンの恒常性を制御し、シナプス形成を調節し、アストロサイトを活性化する(図1)[29、30]。 静止ミクログリアは、周囲の環境の変化を感知するために、延長または収縮した状態を維持するために、毎分$ 0.4-3.8 \ mu m / min の速度で突出する複数の対称的に分布した突起を持つ小さなソーマによって特徴付けられる。[cite:610,611,612,613,614,615,616,617]ミクログリアは、ニューロンとアストロサイトからのシグナルによって、部分的に比較的静止状態に維持される[31]。[cite:612,613,614,615,616,617,618]組織の損傷、病原体、または他の病理学的プロセスなどの課題に応じて、ミクログリアは恒常性の不均衡に迅速に対応し、防御メカニズムを提供するためにかなりの形態学的変化を受ける[32]。[cite:612,613,614,615,616,617,618]具体的には、プロセスが収縮し、ソーマが拡大し、遠位枝の分岐が減少する。[cite:613,614,615,616,617,618]活性化されたミクログリアは、追加の形態学的変化を受け、「アメーバ様」の形状を呈する。[cite:613,614,615,616,617,618]形質転換されたミクログリアの数が増加し、組織修復のために1〜2ドル/分で損傷部位に移動する[33、34]。[cite:616,617,618]活性化されたミクログリアは、栄養サポートの提供とニューロンの修復から、ニューロンの機能不全に徐々に移行する。[cite:616,617,618]これらの機能の変化は、特定の刺激に継続的にさらされた後、より持続する可能性がある。[cite:616,617,618]この反応はさらに、末梢自然免疫細胞(例えば、マクロファージ)および適応免疫細胞(例えば、B細胞)を補充して、血液脳関門を通過させ、最終的に認知および感情障害を引き起こす[35−37]。[cite:619,620,621,622,623,624,625,626,627]ミクログリアの分極ミクログリアは、通常の生理学的条件下では静止状態で存在し、「免疫監視」機能を実行する[38、39]。[cite:619,620,621,622,623,624,625,626,627]CNSの損傷または感染が発生すると、ミクログリアは、古典的活性化(M1)または代替活性化(M2)の表現型に広く分割できる。[cite:619,620,621,622,623,624,625,626,627]M1ミクログリアは、炎症誘発性サイトカインの放出と、いくつかの分化マーカー86および 16/32 $(CD86、CD16 / 32)および誘導性一酸化窒素シンターゼ(iNOS)の発現増加をもたらす。 M2ミクログリアは、抗炎症性サイトカイン、アルギナーゼ-1(Arg1)、トランスフォーミング増殖因子-β1(TGF-β1)、CD206、およびキチナーゼ-3-様-3を発現する傾向がある[22]。 M1ミクログリアは、アポトーシス細胞、病原体を除去し、正常なニューロンの成長を抑制し、シナプス伝達に悪影響を与える。
M2ミクログリアは、細胞片や誤って折り畳まれたタンパク質の貪食、組織修復を促進し、ニューロンの生存をサポートする。 興味深いことに、M2ミクログリアは、複数の抗炎症性メディエーターの協調的な調節によって駆動され、最終的に免疫抑制とニューロン保護を達成するM1誘導性炎症に対抗する(図2)[40]。 ただし、ミクログリアの状態には、局所環境の変化に応じて、さまざまな重複する機能的表現型の範囲が含まれる場合がある[1]。 たとえば、単一細胞RNAシーケンスおよび飛行時間型質量分析法によるサイトメトリーなどの新しい単一細胞技術は、免疫細胞の種類と状態、正常から疾患への移行、および治療への反応を特徴付ける優れた方法として登場した[2]。 たとえば、LPSを注入したマウスから単離されたミクログリアは、単一細胞RNAシーケンスおよび多色フローサイトメトリーによって、恒常性マーカー(例えば、Tmem119、Mef2c、P2ry13、P2ry12、およびSiglech)のダウンレギュレーションを受ける。
エトメトリーは、免疫細胞の種類と状態、正常から疾患への移行、および治療への反応を特徴付ける優れた方法として登場した 。 たとえば、LPSを注入したマウスから単離されたミクログリアは、単一細胞RNAシーケンスと多色フローサイトメトリーによって、恒常性マーカー(例えば、Tmem119、Mef2c、P2ry13、P2ry12、およびSiglech)のダウンレギュレーションと炎症性遺伝子(例えば、Ccl2、Gpr84、およびNfkbia)のアップレギュレーションを示した 。 アルツハイマー病(AD)のトランスジェニックマウスモデルの脳では、単一細胞分析を使用して、新しいタイプのミクログリア(疾患関連ミクログリア、DAM)が同定された 。 研究者らはさらに、Trem2がDAMステージ1からDAMステージ2への変換に必要であることを発見した 。 バイアスのかからないハイスループット分析手法の開発により、CNSの発達と疾患におけるミクログリアの空間的および時間的不均一性を包括的に特徴付けることが可能になる 。 現在のミクログリア表現型の研究に基づいて、M1およびM2サブタイプを使用した分類は単純化されすぎており、普遍的に受け入れられていない 。 うつ病におけるミクログリアの寄与を強調するために、以降の説明では「炎症促進性」または「抗炎症性」ミクログリアを使用する 。
うつ病におけるミクログリア
臨床的証拠
多くの研究により、発達期および成体の脳におけるミクログリアの典型的な構造および機能の損傷が、うつ病性障害の病因と関連していることが示されている 。 PFC、HIP、前帯状皮質(ACC)、および扁桃体を含むさまざまな脳領域におけるミクログリアの変化が、うつ病の発症に関与している 。 以前の研究では、重度のMDDエピソード中にPFCおよびACCでかなりのミクログリア活性化が起こることが示されている 。 ACCにおけるミクログリアの活性化は、うつ病エピソードの重症度とも正の相関がある 。 陽電子放出断層撮影法(PET)スキャンでは、MDDエピソード中にACCでミクログリアが増加していることが示されている 。 同時に、TSPOレベル(ミクログリア活性化のマーカー)がMDD患者で増加した 。 18F-FEPPA PETを使用した断面研究では、TSPOの総分布量と未治療のMDDの期間、総疾患期間、および抗うつ薬曝露との間に強い関係が示された 。 同様に、MDD患者の剖検研究では、ミクログリアによって産生されるキノリン酸(QUIN)の濃度が、自殺犠牲者の膝下ACCおよび前部中帯状皮質で増加していた 。 うつ病の自殺患者からの背側ACC白質では、イオン化カルシウム結合アダプター分子1(Iba-1)、CD45、および単球走化性タンパク質-1の遺伝子発現の上昇によって特定されるように、ミクログリア密度が有意に増加していた 。 別の研究では、前頭白質で同様の結果が得られたと報告されている 。 それにもかかわらず、うつ病の発生におけるミクログリアを介した炎症の役割は依然として議論の余地がある。 追加の証拠は、うつ病ではミクログリアが減少することを示した 。 家族性MDDの被験者では、神経膠細胞が明らかに減少し、ニューロン数は変化しなかった 。 脳画像では、ブロードマン野24の膝下部分の皮質萎縮が明らかになった 。 層分析に基づいて、神経膠細胞密度の同様の減少が、眼窩皮質、ACC、および背外側PFCでも観察された 。 さらに、ステレオロジー的手法を用いて評価した場合、MDD患者の扁桃体の左側で特に神経膠細胞数が減少した 。 しかし、うつ病患者の体性感覚皮質の3b野では神経膠細胞数の減少は見られず、気分障害における神経膠細胞の減少は特定の脳構造に限局していることが示唆された 。
うつ病性障害に加えて、ミクログリアの活性化は、不安 、統合失調症 、および自閉症スペクトラム障害 などの他の精神障害でも報告されている。 不安障害は多くの場合、人生の早期に出現し、他の疾患と関連している 。 ミクログリアおよび不安障害に関する臨床報告は、うつ病の動物モデルを除いて、非常に限られている 。 PET画像研究では、統合失調症患者および精神病のリスクが非常に高い人でミクログリア活動の増加が示された 。 自閉症では、脳の皮質領域(前頭島皮質および視覚皮質)でミクログリアの増加が観察された 。 逆に、いくつかの研究では、統合失調症および自閉症における有意なミクログリア症または神経膠細胞マーカーの発現の変化は報告されていない 。 したがって、これらの精神疾患の発症におけるミクログリアの活性化に関して異なる意見があり、これは疾患発症のさまざまな段階での評価または個々の不均一性に関連している可能性がある 。 うつ病の治療は、個々の患者におけるうつ病およびミクログリア機能の状態に基づいて個別化されるべきである 。 また、自殺は精神疾患の長期経過において有病率が高いことにも留意すべきである 。 剖検分析により、統合失調症およびうつ病患者におけるミクログリア密度の増加が自殺と関連していることが明らかになり 、ミクログリア活性の変化が精神障害において重要である可能性があることが示唆されている。
前臨床的証拠
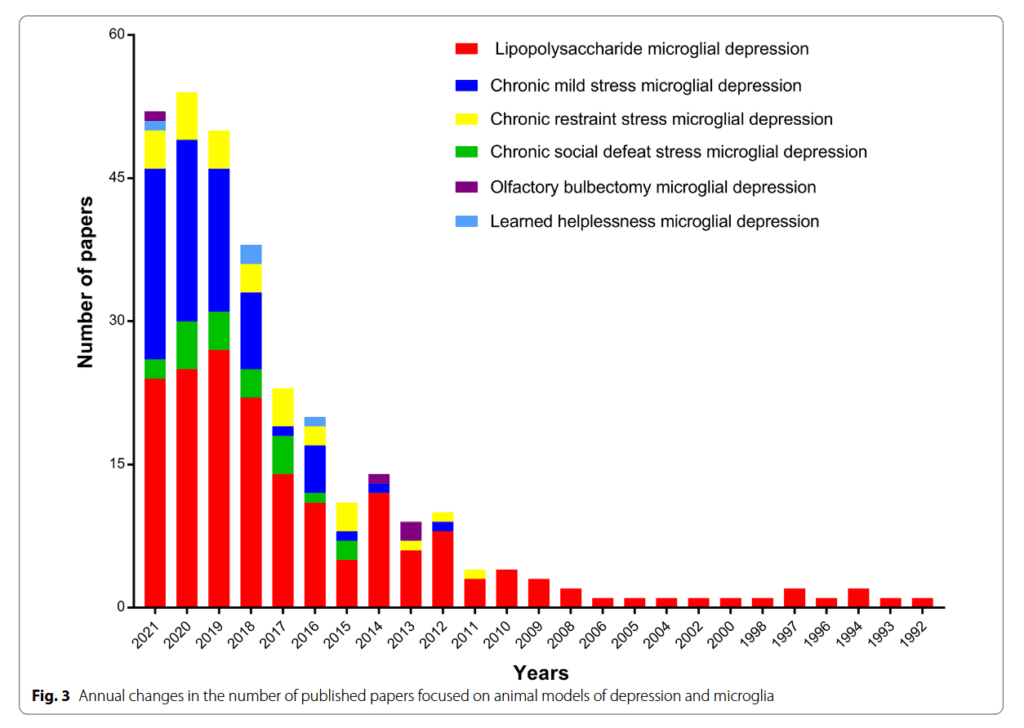
多くの研究が、さまざまな動物モデルにおけるMDDとミクログリアの関係に焦点を当ててきた 。 炎症誘発性サイトカインの高レベルを示す持続的なミクログリア活性化が、さまざまな脳領域で観察されており 、ミクログリアの阻害はうつ病様の行動を軽減した 。 このレビューでは、急性/慢性ストレスやげっ歯類薬理学的モデルを含む、うつ病の動物モデルにおけるミクログリア活性化の影響について説明した 。 使用された検索テーマには、「LPS、慢性軽度ストレス(CMS)、慢性社会的敗北ストレス(CSDS)、慢性拘束ストレス(CRS)、嗅球摘出(OBX)、または学習性無力症(LH)」と、それぞれ組み合わせたミクログリアとうつ病が含まれていた。 結果は、ミクログリアが上記のほぼすべてのモデルに関与していることを示した。 それらの中でも、ミクログリアは、図3に示すように、LPS、CMS、およびCRS、ならびにCSDS誘発性神経炎症に関連するモデルで最も顕著であった。
急性うつ病モデルマウスでは、腹腔内LPS投与により、HIPにおけるnod様受容体ピリン含有3(NLRP3)の発現およびIL-1β開裂が活性化された。 免疫蛍光染色では、NLRP3が対照マウスと比較してIba-1陽性ミクログリアに主に発現していることが示された 。 BV2ミクログリア細胞では、LPS曝露により、炎症促進性および抗炎症性ミクログリア表現型の間の不均衡が誘導され 、TLR4/核因子-κB(NF-kB)経路が活性化され、TREM2発現がダウンレギュレーションされた 。 CMS曝露マウスのHIPおよび皮質では、免疫蛍光染色により、活性化されたミクログリア(Iba-1陽性細胞)だけでなく、炎症促進性ミクログリアマーカー(IL-1B、TNF-α、IL-6、INF-γ、およびiNOS)の増加および抗炎症性マーカー(Ym1、IL-4、IL-10、およびArg-1)の減少が明らかになり、ミクログリア表現型の変換が示唆された 。 CSDSパラダイムは、気分変化およびミクログリア活性化、ならびにROS上昇も引き起こす 。 さらに、PLX5622を使用したミクログリアの枯渇は、明暗(LD)および社会的相互作用(SI)試験における行動異常から保護する 。 これらの研究は、うつ病様の行動および炎症が、慢性ストレスおよび薬理学的げっ歯類モデルに存在し、ミクログリア関連シグナル伝達の持続的な干渉と関連している可能性があるという証拠を提供する 。 うつ病とミクログリアの関連性を実証する他の動物モデルは、追加ファイル1:表S1に示されている 。 1992年以来、CNSミクログリアを介した炎症がうつ病の原因となる可能性があり、領域選択性および疾患重症度と密接に関連しているという概念が、数多くの研究によって検証されている 。 患者および動物モデルにおいてミクログリアとうつ病の間に強い相関関係が観察されているにもかかわらず、ミクログリア異常が実際うつ病において重要な役割を果たしているかどうかを判断することは依然として困難である 。
うつ病の病因におけるミクログリアの役割
うつ病におけるミクログリア-ニューロンコミュニケーション
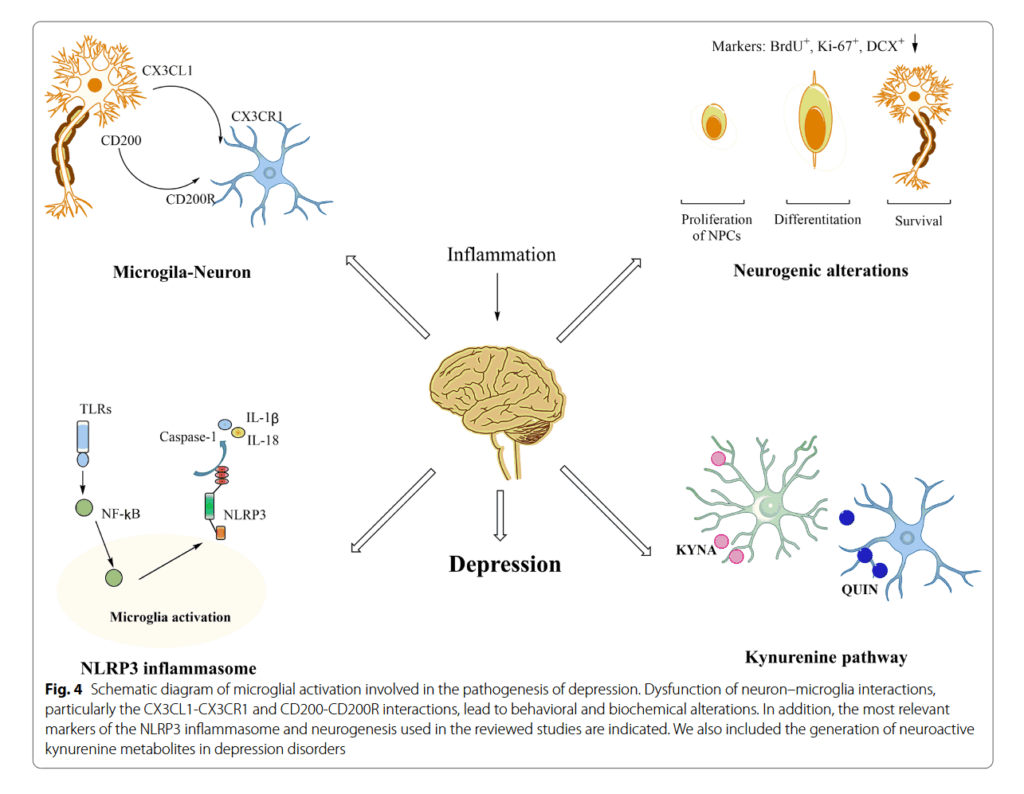
ミクログリア-ニューロンコミュニケーションは双方向に機能する 。 ミクログリアは、ニューロン機能の多くの側面にかなりの影響を与える。 同様に、ニューロンは、ケモカイン、サイトカイン、および神経伝達物質などの可溶性因子を介して、主にミクログリア機能を調節する 。 これらの因子の中で、CX3CL1およびCD200は主にニューロンによって発現され、それらの受容体であるCX3CR1およびCD200Rはミクログリアで発現される 。 ニューロンとミクログリア間の機能不全な相互作用は、うつ病、統合失調症、およびADを含む重度の神経疾患の重要な因子である 。
CX3CL1とCX3CR1間のコミュニケーションは、ミクログリアが機能的安定性を維持する能力に貢献する 。 脳損傷の程度に応じて、CX3CL1はミクログリアの炎症促進の増加または静止状態でのミクログリアの維持をもたらす 。 LPS誘導性うつ病モデルでは、CX3CL1の発現低下およびミクログリア活性化がHIPで観察された 。 中等度から重度のうつ病患者の血清レベルは、対照群よりも高かった 。 同様の観察が、併存するコカイン中毒のMDD患者からのCX3CL1の血漿レベルで行われた 。 Cx3cr1欠損マウスは、出生後の初期に一過性のミクログリア減少を示し、その後のシナプス刈り込みの欠陥を示した 。 シナプス刈り込みの欠陥は、シナプス伝達の有効性の低下および神経回路形成の減少、ならびにいくつかの神経精神障害で観察されている社会的相互作用の減少および反復行動の増加と関連している 。 これらの発見は、ミクログリアを介したシナプス刈り込みの破壊が、神経発達および神経精神障害と関連している可能性があることを示唆している 。 さらに重要なことに、以前の研究では、げっ歯類のうつ病様の行動に、過剰に枝分かれしたミクログリア(プロセスの枝分かれおよび/またはソーマの肥大化)が関連していることが示唆されている 。 CX3CR1欠損マウスは、野生型マウスと比較して、反復水泳ストレス誘導性うつ病様行動およびミクログリアの過剰枝分かれ変化に対して明確な耐性を示した 。 また、CX3CR1欠損マウスは、長期増強(LTP)の障害も示した 。 IL-1β受容体アンタゴニストによる治療は、CX3CR1欠損マウスで観察された認知機能およびシナプス可塑性の障害を有意に逆転させた 。 出生前ストレスは、ラットの成体子孫において、不安およびうつ病様行動の行動障害を引き起こした 。 根底にあるメカニズムは、HIPおよび前頭皮質におけるCXCL12およびその受容体のアップレギュレーション、ならびにCX3CL1-CX3CR1発現の減少に関連している可能性があり、外因性CX3CL1適用が観察された変化を軽減した 。 さらに、CX3CR1欠損は、慢性ストレスに対するニューロン-ミクログリア応答性を損なうことが示されている 。 フルオキセチン、ベンラファキシン、またはチアネプチンなどの抗うつ薬による治療は、これらの行動および生化学的変化を正常化した 。
最近、CD200-CD200Rは、さまざまなストレス誘導プロトコルを使用することに焦点を当てた動物モデル研究を通じて、うつ病の病因に関連していることが示されている 。 たとえば、逃避不能な尾ショックへの曝露は、HIP、基底外側(BLA)、および扁桃体中心核におけるCD200Rレベルの低下をもたらした 。 同様の観察が雄ラットおよび雌ラットで報告されている 。 しかし、逆説的な観察は、ラットにおける回避不能な足ショックが、HIPではなく視床下部におけるCD200Rの転写レベルを低下させたことを示した 。 HIPに関する発表された報告間のこれらの矛盾は、2つの研究グループによる異なるプロトコルの使用に起因する可能性がある 。 IFN-α誘導性うつ病モデルでは、脆弱なマウスはMHC-II、CD86、およびCD200Rレベルの増加を示した 。 これらのマウスは、強制水泳試験(FST)および尾懸垂試験(TST)における不動時間の増加、ならびに新規物体探索試験における探索行動の減少によって特徴付けられるうつ病様の行動を示した 。
うつ病におけるミクログリアと神経新生
脳の発達中、ミクログリアはシナプス伝達
脳の発達中、ミクログリアはシナプス伝達を調節し、ニューロンシナプスを刈り込み、神経回路の形成を促進する 。恒常性が乱れると、ミクログリアは活性状態に変換され、炎症誘発性サイトカイン、ケモカイン、および反応性酸化剤を放出する 。炎症誘発性ミクログリアは、通常は有害な事象と考えられている炎症誘発性メディエーターのアップレギュレーションに関与している 。一方、抗炎症性ミクログリアは、ニューロンの生存と成体神経新生において保護効果を示す 。ミクログリアの活性化は、炎症およびストレスの存在下での神経新生抑制における重要なメカニズムである 。海馬神経新生は、脳神経回路への新生細胞の生成と機能的統合を伴う複雑な神経生物学的プロセスである 。いくつかの研究では、ストレスが成体海馬神経新生を強く抑制することが実証されている 。急性および慢性ストレスはどちらも、神経前駆細胞の増殖および新生細胞の生存を減少させ、新生ニューロンの成熟を損なうことによって、成体神経新生を減少させることが報告されている 。 4週間のカニューレを介したLPS注入は、HIPの歯状回顆粒細胞層における新しいニューロンの生存を減少させたが、ラットへの6日間の皮質内LPS注入は、新しい細胞の増殖に影響を与えなかった 。 さらに、LPS誘導性神経炎症は、BrdU陽性細胞、DCX陽性細胞、およびNeuN陽性細胞の減少によって示されるように、HIPの歯状回における神経幹細胞の増殖と分化を抑制した 。 8週間のCMS誘導性うつ病パラダイムでは、C57BL/6マウスは、Iba-1陽性細胞の数およびIL-1B、IL-6、およびTNF-αのレベルの増加を示した 。 CMSに関する別の報告では、末梢炎症マーカーの不均衡およびCX3CL1/CX3CR1免疫反応性の低下が、HIPのDGにおけるBrdU/Ki-67/DCX+(新生、増殖、およびDCX関連)細胞の減少と関連していることが示された 。 さらに、5、6、または7週間のCMSの段階的研究では、皮質およびHIPにおける炎症促進性または抗炎症性ミクログリアの変化、ならびにBrdU/DCX+細胞がDGで減少することがわかった 。 うつ病様の行動とミクログリアおよび神経新生の変化との間の関係に関する同様の結果が、母親の分離 、母親の睡眠不足 、慢性水浸拘束ストレス(CWIRS)、およびCSDS を含む心理社会的ストレスモデルで報告されている。 一方、IL-4およびIL-10は、組織リモデリングおよび神経再生において重要な神経保護機能を発揮する抗炎症因子の代替活性化を誘導する。 IL-4による治療は、HIPにおけるグリア細胞活性化および神経伝達物質レベルを調節することにより、IL-1βによって引き起こされるうつ病様行動を著しく抑制した 。 IL-4刺激は、神経新生を促進することが報告されているインスリン様成長因子-1のミクログリアにおける発現を増加させた 。 最近の研究では、IL-4駆動Arg1+ミクログリアがCMSマウスの脳由来神経栄養因子(BDNF)依存性神経新生を介してストレス回復力を調節することが実証された 。 IL-10刺激ミクログリアは、NPCの増殖を促進したが、ニューロンの分化には影響を与えなかった。 IL-10分泌ミクログリアは、in vitroでニューロンの分化と新しく形成された細胞の生存をサポートした 。 CX3CR1CreERIL−10ノックアウトマウスは、mPFCにおけるNR2B(N-メチル-D-アスパラギン酸受容体(NMDAR)サブユニット)およびシナプトフィジン(SYP)レベルの低下、ならびに扁桃体におけるNR2Bおよび postsynaptic densitin-95(PSD95)レベルの増加とともに、うつ病および不安様の行動を示した 。 さらに、海馬神経新生はCX3CR1欠損マウスで減少し、IL-1βシグナル伝達の拮抗は、CX3CR1欠損マウスで観察された認知機能およびシナプス可塑性の障害を回復させた 。
シグナル伝達の拮抗は、CX3CR1欠損マウスで観察された認知機能およびシナプス可塑性の障害を回復させた [113]。 全体として、これらの研究は、炎症誘発性メディエーターが神経新生の調節不全を引き起こし、うつ病の発症に寄与することを示唆している。
うつ病におけるミクログリアと炎症
炎症は、感染または損傷に対する複雑な生物学的応答である。 ただし、慢性炎症は、うつ病を含む多くの疾患の病因に寄与する [114]。 炎症促進性サイトカインは、うつ病患者のCNSおよび末梢組織で上方制御される [115]。 興味深いことに、ミクログリアは、炎症促進性メディエーターの主要な供給源である [116]。 ミクログリアは、LPSなどの病原体関連分子パターン(PAMP)またはATPなどの危険関連分子パターン(DAMP)に応答して活性化され、炎症促進性メディエーターを放出し、炎症カスケードを刺激する [117]。 活性化されたミクログリアは、IL-1β、IL-6、TNF-α、および一酸化窒素(NO)を含むさまざまな炎症促進性メディエーターを生成する [118]。 これらのメディエーターは、神経内分泌機能、神経伝達物質代謝、および神経回路に影響を与えることにより、うつ病の病態生理に寄与する可能性がある [119]。
NLRP3インフラマソームは、自然免疫系の重要な構成要素である。 これは、LPSおよびATPなどのさまざまなシグナルによって活性化される細胞質多タンパク質複合体である [120]。 活性化されると、インフラマソームは、カスパーゼ-1の自己触媒的切断、およびIL-1βやIL-18などの炎症促進性サイトカインの成熟と放出を促進する [121]。 以前の研究では、NLRP3インフラマソームの活性化が、うつ病の発症を媒介する上で重要な役割を果たしている可能性があることが示唆されている [121]。 別の実験的研究では、持続的なCMS手順(12週間)により、ラットPFCでIL-1、NLRP3、ASC、TLR2、NF-κB、p-p65、およびIKKβのレベルが上昇したが、これらの変化はフルオキセチンによって逆転した [122]。 免疫蛍光分析により、NLRP3インフラマソームがPFCのミクログリア(Iba-1 / NeuN +細胞)でのみ主に活性化されることが確認された [122]。 NLRP3インフラマソーム阻害剤AC-YVAD-CMKおよびVX-765を使用すると、CMSマウスのスクロース嗜好性試験(SPT)でのスクロース摂取量の増加および強制水泳試験(FST)での不動時間の減少によって示されるように、うつ病様の行動が有意に改善された [94、123]。 さらに、P2X7受容体の活性化は、慢性ストレスに曝露されたラットの海馬グリア細胞におけるNLRP3インフラマソームの組み立てを刺激し、うつ病様の行動を誘発した [124]。 全体として、これらの研究は、NLRP3インフラマソームがうつ病の病態生理において重要な役割を果たしていることを示唆している。
活性化されたミクログリアは、キヌレニン経路(KP)の主要な供給源でもある。 KPは、必須アミノ酸であるトリプトファン(TRP)の代謝経路である [125]。 KPは、主に2つの酵素、すなわちインドールアミン2,3-ジオキシゲナーゼ(IDO)およびトリプトファン2,3-ジオキシゲナーゼ(TDO)によって触媒される [126]。 KPの活性化は、神経毒性代謝産物であるキノリン酸(QUIN)および3-ヒドロキシキヌレニン(3-HK)の産生を増加させ、神経保護代謝産物であるキヌレニン酸(KYNA)の産生を減少させる [127]。 したがって、KP代謝産物の不均衡は、グルタミン酸作動性神経伝達の増加、グルタミン酸受容体の活性化、および興奮毒性を引き起こす可能性がある [128、129]。 3-HKは、ROSの産生を増加させることにより、酸化ストレスおよび神経炎症を引き起こす可能性がある [130]。 逆に、KYNAは、グルタミン酸受容体をブロックすることにより、神経保護効果を発揮する [131]。 以前の研究では、うつ病患者の脳脊髄液および血液サンプルで、KP代謝産物のレベルの変化が報告されている [132、133]。 最近の研究では、ミクログリアQUINの発現が、重度のうつ病による自殺患者の死後脳のACCの膝下および脳梁上領域で増加していることがわかった [147]。 対照的に、追加の研究では、単極性および双極性うつ病患者のHIPの左CA1または右CA2 / 3領域でQUINが減少していることが明らかになった [138]。 さらに、メタアナリシスにより、うつ病患者ではKYNAおよびキヌレニン(KYN)レベルが減少し、抗うつ薬を使用していない患者ではQUINレベルが増加することが明らかになった [139]。 同様の結果が、周産期うつ病および青年期MDDにおけるQUINの増加に関して報告されている [140、141]。 臨床データに加えて、3-HKおよびQUINのレベルの増加が、いくつかのうつ病モデルで観察されている [142、143]。 したがって、ミクログリアを介したKPの活性化は、炎症性メディエーターの放出を促進し、それによってうつ病の発症に寄与する可能性がある。
抗うつ薬によるミクログリア調節
うつ病の治療には、主に薬物療法と心理療法が含まれる。 薬物療法には、選択的セロトニン再取り込み阻害薬(SSRI)、セロトニン-ノルエピネフリン再取り込み阻害薬(SNRI)、ノルアドレナリン作動性および特異的セロトニン作動性抗うつ薬(NaSSA)、三環系抗うつ薬(TCA)、モノアミン酸化酵素阻害薬(MAOI)などの従来の抗うつ薬が含まれる [144]。 これらの抗うつ薬は、細胞内モノアミン濃度の増加に影響を与えることによって機能する [145]。 しかし、これらの薬物は、治療効果の発現が遅く、反応しない患者の割合が高く、いくつかの副作用があるため、限られた有効性を示す [146]。 したがって、科学者たちは、ミクログリアを調節することにより、うつ病を治療するための新規でより効果的な戦略を模索している。
従来の抗うつ薬
以前の研究では、従来の抗うつ薬がミクログリアの活性化に影響を与える可能性があることが示唆されている。 しかし、抗うつ薬のミクログリアに対する効果は、細胞型、投与量、および投与期間によって異なる [147、148]。 たとえば、フルオキセチンは、LPSで処理されたラットの初代ミクログリア培養において、炎症促進性メディエーターの放出を減少させることが示されている [149]。 しかし、他の研究では、フルオキセチンがLPSで処理されたBV2ミクログリア細胞でTNF-αおよびIL-1βの放出を増加させることが示されている [150]。 イミプラミンおよびクロミプラミンは、LPSで処理されたラットの初代ミクログリア培養において、IL-1β、IL-6、およびTNF-αの放出を減少させた [151]。 しかし、これらの抗うつ薬は、LPSで処理されたBV2ミクログリア細胞において、TNF-αおよびIL-6の放出を増加させた [150]。 したがって、抗うつ薬のミクログリアに対する影響を完全に理解するためには、さらなる研究が必要である。
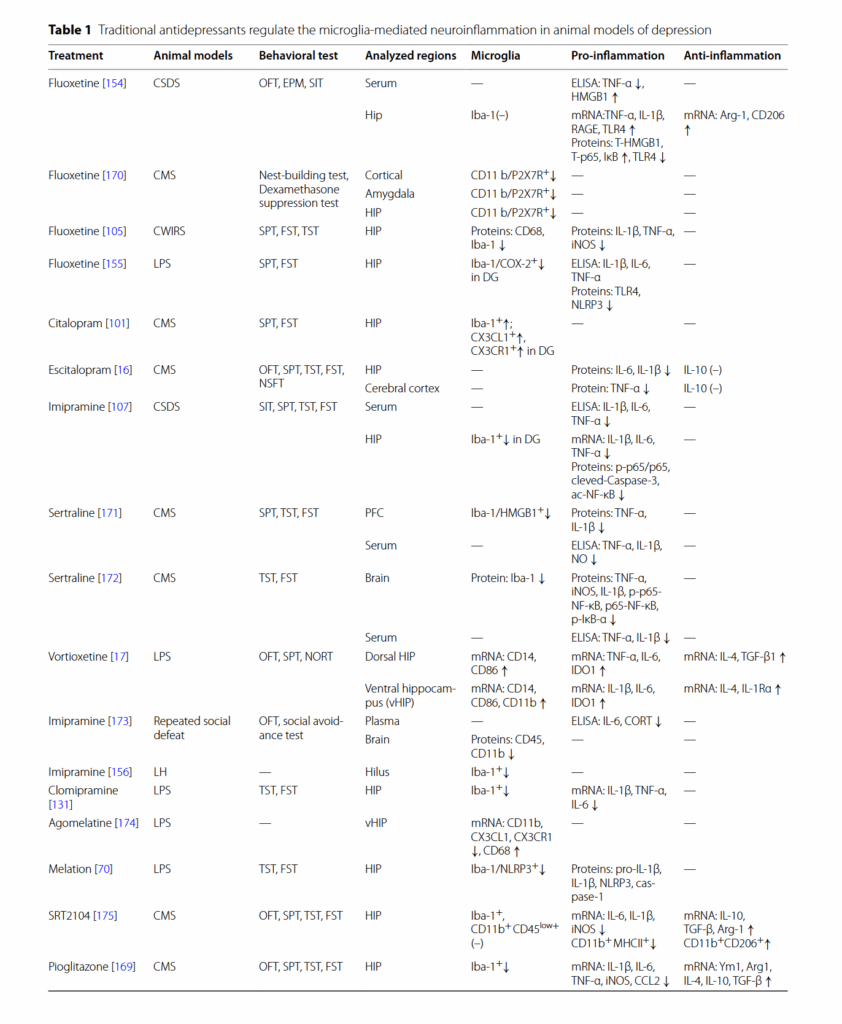
フルオキセチン、セルトラリン、エスシタロプラム、およびイミプラミンなどのいくつかの抗うつ薬は、動物モデルのうつ病様の行動を改善することが示されている [152、153、154]。 これらの抗うつ薬は、ミクログリアの活性化および炎症促進性メディエーターの放出を減少させることにより、これらの効果を発揮する [155、156、157]。 たとえば、フルオキセチンは、CSDS [154]、CMS [155]、およびLPS [158]誘発性うつ病モデルにおいて、TNF-α、IL-1β、およびIL-6のレベルを減少させることが示されている。 セルトラリンは、CMS誘発性うつ病モデルにおいて、TNF-α、IL-1β、およびIL-6のレベルを減少させることが示されている [159]。 エスシタロプラムは、CMS誘発性うつ病モデルにおいて、TNF-αおよびIL-1βのレベルを減少させることが示されている [16]。 イミプラミンは、LPS誘発性うつ病モデルにおいて、TNF-αおよびIL-1βのレベルを減少させることが示されている [157]。
ミクログリアの活性化を調節することに加えて、抗うつ薬は、神経栄養因子の発現を増加させ、神経新生を促進し、シナプス可塑性を改善することも示されている [160、161、162]。 これらの効果は、抗うつ薬の治療効果に寄与する可能性がある [163、164、165]。
全体として、これらの研究は、従来の抗うつ薬がミクログリアの活性化を調節し、うつ病様の行動を改善することを示唆している。 ただし、抗うつ薬のミクログリアに対する影響を完全に理解するためには、さらなる研究が必要である。
天然物
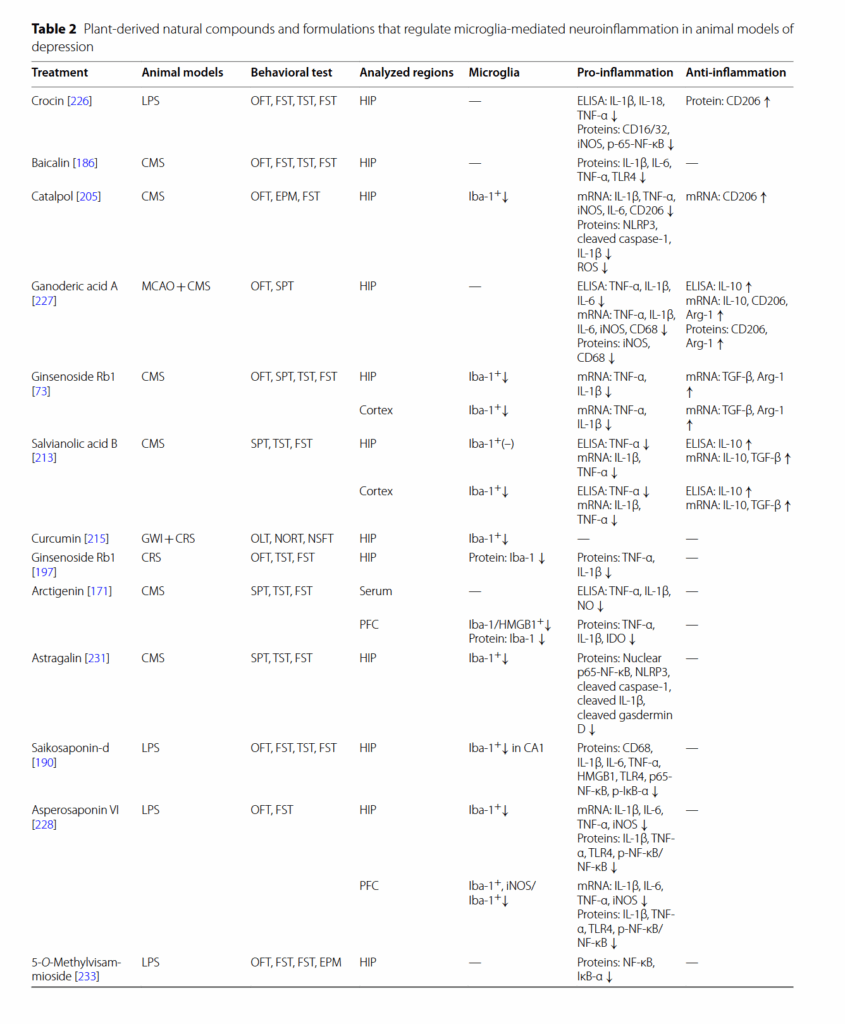
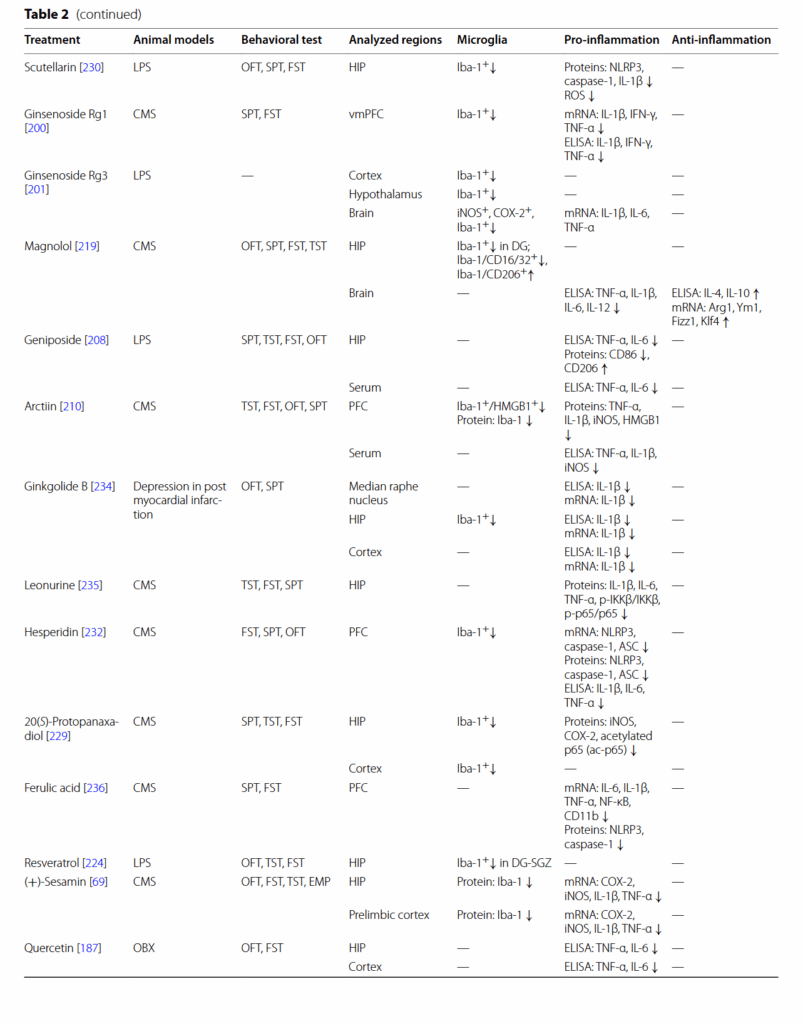
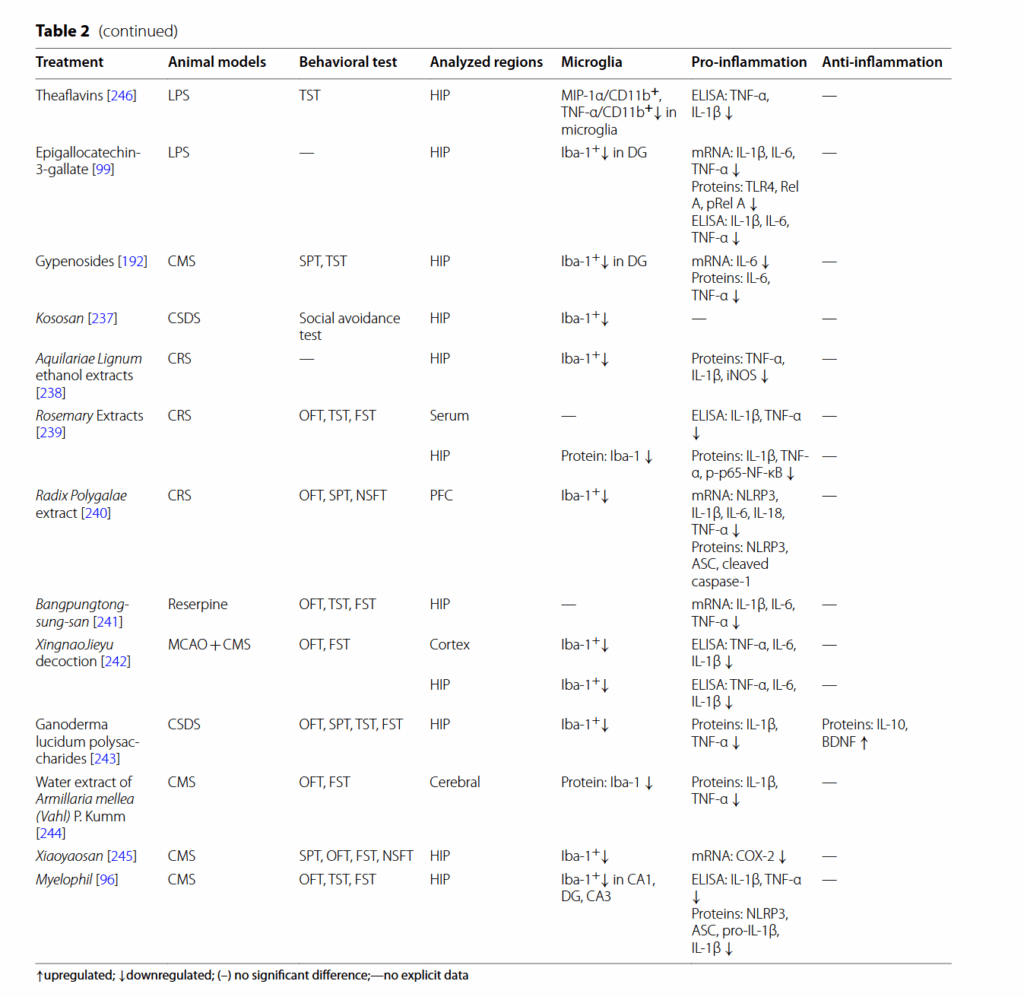
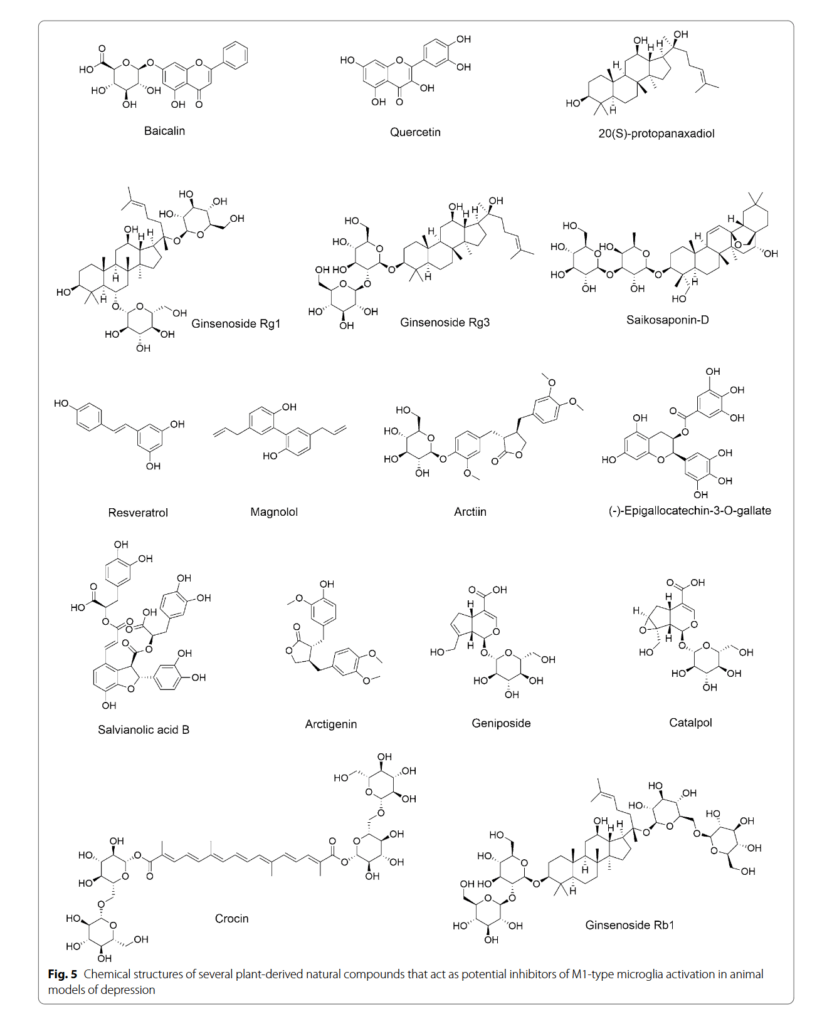
天然物は、うつ病を含むさまざまな疾患の治療薬として長い間使用されてきた。 最近、天然物がミクログリアの活性化を調節し、うつ病様の行動を改善できるという証拠が増えている [164]。 ギンセノシド(Rg1、Rg3、およびRb1)、レスベラトロール、サルビノール酸B、およびマグノロールなどの天然物のミクログリアを介した神経炎症に対する効果を、表2にまとめる。 MDDにおける炎症促進性ミクログリア活性化の潜在的な阻害剤として作用する可能性のあるいくつかの天然化合物の化学構造を、図5に示す。
フラボノイドは、2-フェニルクロメン-4-ケトンの骨格で構成されるフラボノイドのサブグループであり、それらの生物学的活性はin vitroおよびin vivoで報告されている [184]。 フラボノイドは、ミクログリアの活性化およびNLRP3インフラマソームを調節することにより、抗うつ効果を発揮する。 オウゴン(Scutellariaの根に含まれるフラボノイド)は、CMSマウスのHIPにおけるIL-1β、IL-6、およびTNF-αの発現を減少させることにより、うつ病様の行動を改善する可能性がある [185、186]。 別の研究では、バイカリンがLPSで処理されたBV2ミクログリア細胞におけるNLRP3インフラマソームの活性化を阻害することが示された [187]。 したがって、フラボノイドは、ミクログリアの活性化およびNLRP3インフラマソームを調節することにより、抗うつ効果を発揮する可能性がある。
サポニンは、さまざまな植物に含まれる天然配糖体である。 サポニンは、抗炎症作用、抗酸化作用、および神経保護作用を含む、さまざまな生物学的活性を持っていることが報告されている [188、189]。 最近の研究では、サポニンがミクログリアの活性化を調節し、うつ病様の行動を改善できることが示唆されている。 サイコサポニン-dは、LPSで処理されたマウスの初代ミクログリア培養において、IL-1β、IL-6、およびTNF-αの放出を減少させることが示されている [190]。 別の研究では、サイコサポニン-dがCMSラットのHIPにおけるミクログリアの活性化を阻害することが示された [171]。 したがって、サポニンは、ミクログリアの活性化を調節することにより、抗うつ効果を発揮する可能性がある。
ギンセノシドは、薬用植物であるオタネニンジンに含まれるサポニンの主要な活性成分である。 ギンセノシドは、抗炎症作用、抗酸化作用、および神経保護作用を含む、さまざまな生物学的活性を持っていることが報告されている [194、195、196]。 最近の研究では、ギンセノシドがミクログリアの活性化を調節し、うつ病様の行動を改善できることが示唆されている。 ギンセノシドRg1は、CMSラットのHIPにおけるIL-1β、IL-6、およびTNF-αの発現を減少させることにより、うつ病様の行動を改善する可能性がある [73]。 別の研究では、ギンセノシドRg3がLPSで処理されたBV2ミクログリア細胞におけるNLRP3インフラマソームの活性化を阻害することが示された [197]。 したがって、ギンセノシドは、ミクログリアの活性化を調節することにより、抗うつ効果を発揮する可能性がある。
クルクミンは、スパイスのターメリックに含まれる天然化合物である。 クルクミンは、抗炎症作用、抗酸化作用、および神経保護作用を含む、さまざまな生物学的活性を持っていることが報告されている [198、199、200]。 最近の研究では、クルクミンがミクログリアの活性化を調節し、うつ病様の行動を改善できることが示唆されている。 クルクミンは、CMSラットのHIPにおけるIL-1β、IL-6、およびTNF-αの発現を減少させることにより、うつ病様の行動を改善する可能性がある [201、202]。 別の研究では、クルクミンがLPSで処理されたBV2ミクログリア細胞におけるNLRP3インフラマソームの活性化を阻害することが示された [203]。 したがって、クルクミンは、ミクログリアの活性化を調節することにより、抗うつ効果を発揮する可能性がある。
レスベラトロールは、赤ワインに含まれる天然化合物である。 レスベラトロールは、抗炎症作用、抗酸化作用、および神経保護作用を含む、さまざまな生物学的活性を持っていることが報告されている [204、205、206]。 最近の研究では、レスベラトロールがミクログリアの活性化を調節し、うつ病様の行動を改善できることが示唆されている。 レスベラトロールは、CMSラットのHIPにおけるIL-1β、IL-6、およびTNF-αの発現を減少させることにより、うつ病様の行動を改善する可能性がある [207]。 別の研究では、レスベラトロールがLPSで処理されたBV2ミクログリア細胞におけるNLRP3インフラマソームの活性化を阻害することが示された [208]。 したがって、レスベラトロールは、ミクログリアの活性化を調節することにより、抗うつ効果を発揮する可能性がある。
マグノロールは、モクレンの樹皮に含まれる天然化合物である。 マグノロールは、抗炎症作用、抗酸化作用、および神経保護作用を含む、さまざまな生物学的活性を持っていることが報告されている [209、210、211]。 最近の研究では、マグノロールがミクログリアの活性化を調節し、うつ病様の行動を改善できることが示唆されている。 マグノロールは、CMSラットのHIPにおけるIL-1β、IL-6、およびTNF-αの発現を減少させることにより、うつ病様の行動を改善する可能性がある [212]。 別の研究では、マグノロールがLPSで処理されたBV2ミクログリア細胞におけるNLRP3インフラマソームの活性化を阻害することが示された [213]。 したがって、マグノロールは、ミクログリアの活性化を調節することにより、抗うつ効果を発揮する可能性がある。
天然物は、従来の抗うつ薬よりも副作用が少ない可能性がある。 さらに、天然物は、従来の抗うつ薬が有効でない患者に有効である可能性がある。 したがって、天然物は、うつ病の治療のための有望な新しい治療法を提供する可能性がある。
結論
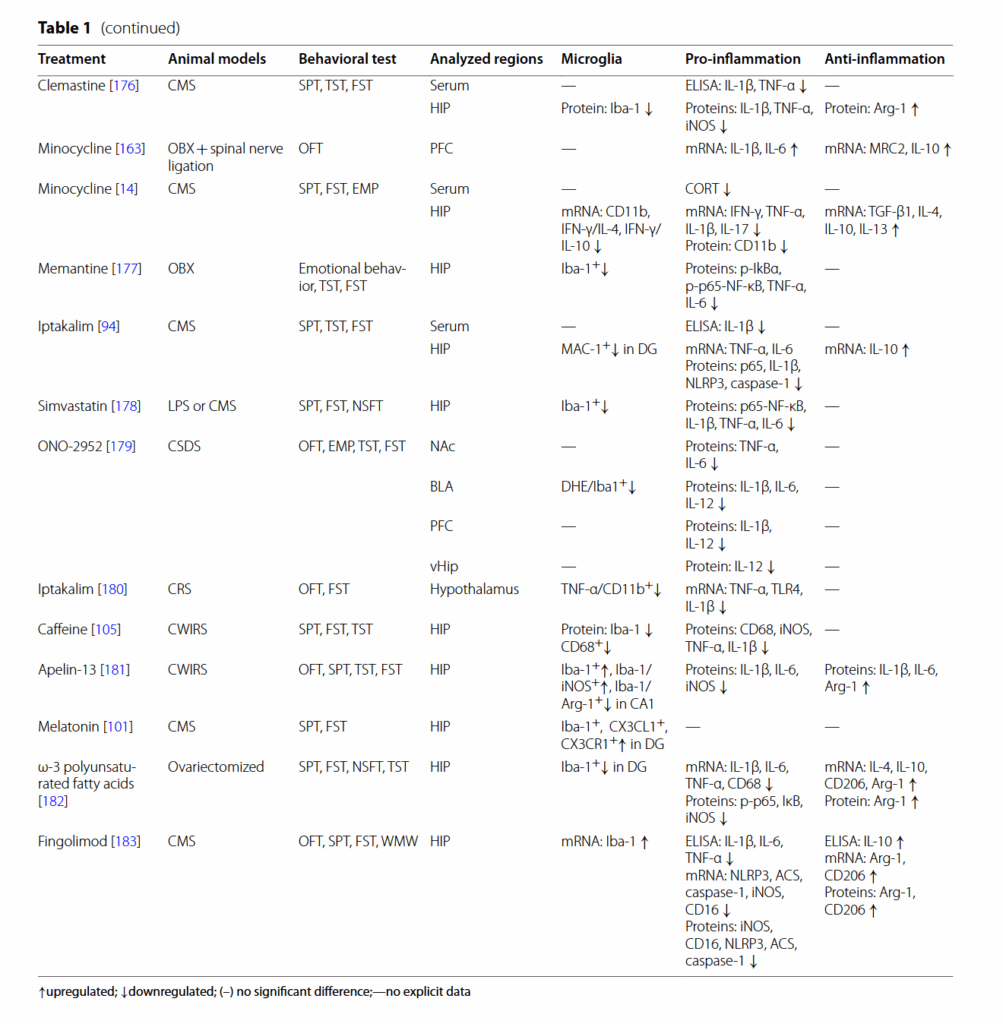
このレビューでは、うつ病の病態におけるミクログリアの役割を強調した(図4)。 さらに、ストレス誘発性うつ病モデルにおける従来の抗うつ薬および植物化学物質の治療的役割について説明した(表1および2)。
最近、天然化合物は、部分的にはそれらの抗酸化作用および抗炎症作用のために、神経精神疾患の予防または治療のための潜在的な薬剤と考えられている [249]。 多数の研究により、天然化合物および製剤が、表2に示すように、ミクログリア機能を調節する能力を介してうつ病の治療に有益であることが示されている。 これらの生物活性化合物の化学構造を図5に強調する。 ほとんどの化合物は、炎症反応、酸化ストレスを調節し、ミクログリアの活性化を阻害することにより、うつ病の症状を改善することが示されている。
ただし、これらの化合物が炎症促進性表現型を持つミクログリアから抗炎症性表現型への変換を促進するかどうか、またはミクログリアによって活性化される下流シグナル伝達経路の調節に依存するかどうかを判断するには、追加の研究が必要である。 病理学的状態では、ミクログリア表現型の変化は、疾患の段階と重症度に依存する。 したがって、適切な時間枠で炎症促進性/抗炎症性
ミクログリアを調節することは、うつ病の治療に役立つ可能性がある。 さらに、腸内マイクロバイオータとうつ病との関連性に関する最近の証拠は、ミクログリアの活性化が腸-脳軸を介して起こる可能性があることを示唆している [250]。 したがって、ミクログリアの活性化を調節する治療的介入は、うつ病の治療に有望な新しい方法を提供する可能性がある。
著者詳細
- 重慶医科大学第一附属病院精神医学科、重慶400016、中国。2. 重慶医科大学精神医学研究所、重慶400016、中国。
参考文献
- Olesen JB、Waltereit R、Andersen PK。 世界の疾病負担研究2010のデータを使用した、気分障害の発生率、有病率、および有病期間。 PLoS One。 2016;11:e0154865。
- Xiong J、Li Q、Liu T、Chelkowski G、Dubé JP。 COVID-19パンデミック中のうつ病の世界有病率:メタアナリシス。 J Affect Disord。 2020;277:369–81。
- WHO。 うつ病。 2021年9月13日に取得。https://www.who.int/news-room/fact-sheets/detail/depression
- Greden JF。 気分障害。 In:Loscalzo J、Fauci A、Kasper D、Hauser S、Longo D、Jameson J、編集者。 ハリソンの内科の原則。 21版。 ニューヨーク:マグロウヒル; 2022年。
- Nestler EJ、Barrot M、DiLeone RJ、Eisch AJ、Gold SJ、Monteggia LM。 うつ病の分子メカニズムにおけるストレスと遺伝的要因の役割。 Nature。 2002;417:391–7。
- Krishnan V、Nestler EJ。 うつ病の神経生物学。 Nature。 2008;455:894–902。
- Castrén E、Rantamäki T。 うつ病の神経栄養仮説:臨床的証拠。 Br J Pharmacol。 2010;161:1426–37。
- Wolf SA、Boddeke HW、Kettenmann H。 ミクログリアのダイナミクス。 EMBO Rep。 2017;18:1787–802。
- Yirmiya R、Raison CL。 うつ病はミクログリア病である。 Immunol Allergy Clin North Am。 2016;36:43–61。
- Beurel E、Toups M、Nemeth MJ。 炎症とうつ病:相互作用する網状神経回路の役割。 Neuropharmacology。 2020;172:108096。
- Miller AH、Shatzman AR、Woolwine BJ、You M、Garcia-Bueno B、Stemkowski P、et al。 うつ病における炎症と神経内分泌の相互作用:ミクログリアの役割。 Neurosci Biobehav Rev。 2009;33:713–28。
- Pace TW、Miller AH。 うつ病における炎症とグルココルチコイド抵抗性:交差感作モデル。 Brain Behav Immun。 2009;23:22–33。
- Schiepers OJ、Wichers M、Maes M。 うつ病における炎症とHPA軸の活動:メタアナリシス。 Biol Psychiatry。 2005;57:684–96。
- Hodes GE、Stavropoulos N、Sullivan JM、Dwivedi Y、Yehuda R、Malinow R、et al。 慢性社会的ストレスは、うつ病のげっ歯類モデルにおけるシナプス鬱と行動の脆弱性を促進する。 Nat Neurosci。 2012;15:1630–8。
- Taler M、Krasienkiewicz K、Ziemińska E、Łasoń W。 慢性ストレスに曝露されたラットの脳におけるミクログリアの活性化に対するフルオキセチンの効果。 Pharmacol Rep。 2016;68:854–61。
- Kohsaka S、Yamamoto G、Ikeda K、Tateda H、Matsumoto Y、Tsuji M、et al。 エスシタロプラムは、慢性社会的敗北ストレスによって引き起こされるうつ病モデルにおけるミクログリアの活性化を抑制する。 J Neuroinflammation。 2013;10:133。
- Benedetti F、Radaelli D、Gava M、Saresella M、Colombo C、Aiello C、et al。 躁うつ病におけるミクログリア活性化の抗うつ薬調節。 Biol Psychiatry。 2013;73:e13–5。
- Köhler CA、Freitas CP、Maes M、de Andrade NQ、Machado-Vieira R、Soares JC、et al。 うつ病における非ステロイド性抗炎症薬(NSAID)のメタアナリシス:臨床試験。 J Affect Disord。 2016;196:29–37。
- Green KM、 будущем M、Moiseyenko V、Sokoloff G、Mandiuk R、Hryshko L、et al。 ミノサイクリンは、うつ病様の行動を軽減し、慢性ストレスに曝露されたラットの脳におけるミクログリアの活性化を抑制する。 Brain Behav Immun。 2015;45:147–58。
- Ransohoff RM。 分極に関する疑問:M1およびM2ミクログリアは存在するのか? Nat Neurosci。 2016;19:987–91。
- Orihuela R、McPherson CA、Harry GJ。 ミクログリアM1 / M2分極または状態? 直線的二分法を超えて。 Front Immunol。 2016;7:109。
- Franco R、Fernandes A。 ミクログリアのダイナミクスとうつ病におけるそれらの役割。 Mol Neurobiol。 2016;53:801–21。
- Wang L、Zhang J、Zhang X、Deng B、Wu Q、Li J、et al。 慢性ストレス後のうつ病におけるミクログリア分極の役割。 Brain Res Bull。 2018;138:33–42。
- Sierra A、Enriquez-Romero J、Romero-Rodriguez T。 ミクログリアの発生、組織化、および恒常性。 Front Cell Neurosci。 2014;8:420。
- Lawson LJ、Perry VH、Duyckaerts C、Gordon S。 正常な高齢者の脳におけるミクログリア細胞密度。 Neuroscience。 1990;39:363–75。
- Ginhoux F、Lim S、Hoeffel G、Low D、Fanjić M。 ミクログリアの起源と発達。 Curr Opin Neurobiol。 2010;20:642–8。
- Hashimoto T、Takeuchi H、Wakayama Y、Sudo K、Makita Y、Liao YF、et al。 生涯にわたる自己再生を介した成体マウス脳におけるミクログリアの恒常性。 PLoS One。 2013;8:e83900。
- Davalos D、Grutzendler J、Yang G、Kim JV、Zuo Y、Jungerius BJ、et al。 脳の免疫監視におけるミクログリアのリアルタイムイメージング。 Nat Neurosci。 2005;8:752–8。
- Wake H、Moorhouse AJ、Jinno S、Kohsaka S。 生きた脳スライスにおけるミクログリアのダイナミクス。 Cortex。 2011;47:629–36。
- Schafer DP、Lehrman EK、Kiani PK、Friedman AR、Molofsky AV、Stephan AH、et al。 ミクログリアは、補体系を介して発達中の脳における過剰なシナプスを刈り込む。 Neuron。 2012;74:691–705。
- Nimmerjahn A、Bechmann I、Nitsch R、Typlt M。 生きた脳のミクログリアは、ニューロン活動に迅速かつ局所的に反応する。 Science。 2005;307:894–7。
- Hanisch UK、Kettenmann H。 ミクログリア:アクティブプレーヤーとしての中枢神経系の免疫細胞。 Nat Rev Neurosci。 2007;8:981–97。
- Kreutzberg GW。 神経系の反応性神経膠症。 Prog Brain Res。 1994;100:31–41。
- Raivich G。 神経炎症の分子メカニズム。 Brain Res Rev。 2005;47:24–8。
- Ransohoff RM、Perry VH。 血液脳関門、炎症、および神経変性。 FASEB J。 1993;7:577–86。
- Perry VH、Matyszak MK、Fearn S。 脳における炎症の発生と結果。 Brain Behav Immun。 2003;17:S8–17。
- Dantzer R、O’Connor JC、Freund GG、Johnson RW、Kelley KW。 炎症とうつ病:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- Kettenmann H、Hanisch UK、Noda M、Verkhratsky A。 ミクログリア:神経系の活性免疫細胞。 Physiol Rev。 2011;91:1163–213。
- Wolf Y、Yirmiya R。 脳の免疫監視。 Nat Rev Immunol。 2010;10:677–88。
- Tang Y、Le W。 ミクログリアの分極と機能。 Mol Neurobiol。 2016;53:381–92。
- Haney MS、荘園LJ、グレイソンJK、マクギャリーLM。 単一細胞RNAシーケンスは、LPS誘導性炎症におけるミクログリアの転写状態の不均一性を示す。 J Neuroinflammation。 2018;15:183。
- Keren-Shaul H、Spinrad A、Millership SJ、Weiner A、Garbuzov A、Lara-Sterenberg R、et al。 アルツハイマー病における疾患関連ミクログリアの単一細胞分解能。 Nature。 2017;549:389–93。
- Deczkowska A、Keren-Shaul H、Weiner A、Fayos-Alfonso M、Mano M、Amit I、et al。 TREM2は、疾患関連ミクログリアの段階的活性化を制御する。 Nature。 2018;556:365–9。
- Hickman SE、Allison PT、Power M、Weiner IF、Bennett DA、Shulman JM、et al。 ミクログリアの状態プロファイルとアルツハイマー病におけるAβプラークとの関係。 J Neurosci。 2008;28:8354–69。
- Lawson LJ、Duyckaerts C、Perry VH、Gordon S。 アルツハイマー病におけるミクログリアのヘテロジェニティと病変との関係。 Neuroscience。 1992;50:809–22。
- Lull ME、Block ML。 うつ病におけるミクログリア:病態生理学と治療の可能性。 Neurotherapeutics。 2016;13:653–61。
- Rajkowska G、Miguel-Hidalgo JJ、Wei J、 स्टॉकmeier CA、Raymont V、Sebring T、et al。 重度のうつ病における前頭前皮質の細胞数と細胞密度。 Biol Psychiatry。 1999;45:1085–98。
- Hercher C、Müller S、Lanzenberger R、Kasper S、Dresler M。 うつ病におけるミクログリア活性化のin vivo証拠:系統的レビュー。 J Affect Disord。 2014;167:15–21。
- Steiner J、Walter M、Gos T、Guillemin R、Bernstein HG、Sarnyai Z、et al。 重度のうつ病患者の剖検脳におけるミクログリアの活性化とキノリン酸の増加。 J Neuroinflammation。 2011;8:175。
- Pandey G、施瓦ルツM、ザールM、ジラーニN、ライスD、スミスM、et al。 うつ病患者の背側前帯状皮質白質におけるミクログリア活性化の増加。 J Psychiatr Res。 2010;44:1091–8。
- Thomas AJ、Dunn BD、Burnet PW、Middleton FA、Lightman SL、Anstey KJ、et al。 前頭白質におけるミクログリア活性化の増加は、高齢者のうつ病と関連している。 J Affect Disord。 2010;126:407–11。
- Bowley MP、Drevets WC、Ongür D、Price JL。 家族性うつ病における前帯状皮質の神経膠細胞数の減少。 Biol Psychiatry。 2002;52:373–83。
- Ongür D、Drevets WC、Price JL。 家族性気分障害における前帯状皮質の萎縮。 Proc Natl Acad Sci USA。 1998;95:13298–303。
- Rajkowska G、Miguel-Hidalgo JJ、Wei J、 स्टॉकmeier CA、Raymont V、Sebring T、et al。 重度のうつ病における前頭前皮質の細胞数と細胞密度。 Biol Psychiatry。 1999;45:1085–98。
- Hamidi M、Drevets WC、Price JL。 うつ病における扁桃体の神経膠細胞数の減少。 Biol Psychiatry。 2004;55:790–7。
- Cotter D、Macleod D、Snelling M、Haroutunian V、Kahn R、Stockmeier C。 うつ病患者の体性感覚皮質における神経膠細胞数の変化はない。 Biol Psychiatry。 2001;49:543–53。
- Troubat R、Labbani M、Fineberg NA、アンドレッチSA。 不安障害の病態生理学:細胞レベルから行動レベルまでの翻訳的視点。 Eur Neuropsychopharmacol。 2021;46:22–44。
- van Berckel BN、Kezek O、Hertel J、Holst KK、Gunn RN、Eriksen JL、et al。 統合失調症患者における脳のミクログリア活性化の増加。 Biol Psychiatry。 2008;63:203–10。
- Doorduin J、de Vries EF、Willemsen AT、de Groot JC、Korf J、Nikkessen AC、et al。 統合失調症患者の脳におけるミクログリア活性化の証拠:[11C](R)-PK11195PET研究。 Biol Psychiatry。 2008;64:643–50。
- Suzuki K、Sakai Y、Banno T、Ota M、Matsumoto K、Hashimoto R、et al。 精神病のリスクが非常に高い被験者における脳のミクログリア活性化の増加。 Schizophr Bull。 2013;39:666–72。
- Vargas DL、Saito Y、Bartels LA、ロメロR、ペルドモR、ムストファM、シャッツバーグAF。 自閉症の死後脳におけるミクログリアの活性化とサイトカインの増加。 Ann Neurol。 2005;57:67–78。
62. Morgan JT、Chow ML、Parekh MB、ホワイトマンI、ウィルキンソンMD、セルディンMF、et al。 自閉症におけるミクログリア活性化の増加。 Biol Psychiatry。 2010;68:368–76。
63. Tetreault NA、Allingham KL、Dursun SM、Seres P、Bakker WL、Szewczuk MR、et al。 自閉症スペクトラム障害の死後脳における炎症性サイトカインおよびミクログリアマーカーの発現の変化はない。 Brain Behav Immun。 2012;22:906–16。
64. Vargas DL、ロメロR、ムストファM、シモンズRB、リッツォA、ペルドモR、et al。 自閉症の死後脳におけるミクログリアの活性化とサイトカインの増加。 Ann Neurol。 2005;57:67–78。
65. Steiner J、Jacobs R、Marchesi E、Wienold M、シュッツA、シレンコM、et al。 統合失調症およびうつ病患者の自殺におけるミクログリア活性化の増加。 J Psychiatr Res。 2008;42:1143–50。
66. Wohleb ES、Hines LM、Osório NS、Duman RS。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリア活性化の持続的な増加を引き起こす。 Biol Psychiatry。 2011;70:175–83。
67. McKim DB、Weber MD、Niraula LR、Sawicki CM、Campbell EL、パワーズR、et al。 血液脳関門の破壊は、慢性社会的敗北ストレス後のミクログリア活性化を促進する。 J Neurosci。 2018;38:8191–208。
68. Calcia MA、Brodkin ES、ジュニアRS、ミレニッチJD、リーRS、オハラTM、et al。 慢性社会的ストレスは、ミクログリアの活性化とニューロンの損傷を介して、げっ歯類のうつ病モデルにおける社会的回避を促進する。 J Neurosci。 2009;29:10063–73。
69. Goshen I、Yirmiya R。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 Brain Behav Immun。 2009;23:1381–92。
70. Fonken Y、Frank MG、Watkins LR、Sloan EM、クライクPJ、マハーTJ、et al。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 Biol Psychiatry。 2011;70:914–22。
71. Tynan RJ、ロココA、アンジェロスキエビッチM、ニコロフスカJ、ハミルトンJA。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 J Neurosci Res。 2010;88:2075–83。
72. Chaudhury D、Martisheva E、ジュニアR、クエバRJ、コリンズSL、マクドナルドAJ、et al。 慢性社会的ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 Biol Psychiatry。 2013;73:1104–12。
73. Jeong HU、Jo MJ、パクJH、キムHK、パクKI、キムJS、et al。 ギンセノシドRg1は、慢性ストレスに曝露されたラットの海馬におけるミクログリアの活性化を抑制することにより、うつ病様の行動を改善する。 J Ginseng Res。 2017;41:206–13。
74. Castanon N、ルーカM、オーブリーM、トゥーレC、ピヴェーM、ミカエルC、et al。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 J Neurosci。 2011;31:13915–25。
75. Inoue K、Tsuda M、小林K、Koizumi S、ウルベM、井上K。 LPS誘導性炎症におけるミクログリア活性化の役割。 Glia。 2009;57:1349–58。
76. Qin L、Wu X、Block ML、Liu Y、 ब्रेデセンDE、Hong JS、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurochem。 2007;100:1189–201。
77. Tanti A、シュミットHD。 うつ病における炎症とミクログリアの役割。 Eur Neuropsychopharmacol。 2016;26:3–16。
78. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
79. Kohsaka S、山本G、池田K、武田H、松本Y、辻M、et al。 エスシタロプラムは、慢性社会的敗北ストレスによって引き起こされるうつ病モデルにおけるミクログリアの活性化を抑制する。 J Neuroinflammation。 2013;10:133。
80. McKim DB、ジュニアRD、ソウルソンAM、マクガフティLM、ヘイガーAM、バーグBM、et al。 慢性社会的敗北ストレス後のミクログリア活性化におけるTLR4シグナル伝達の役割。 Biol Psychiatry。 2016;79:244–53。
81. Ménard C、ジュニアRD、ルーソSJ、デュベックAJ、マウアーJ、モリスMJ、et al。 慢性社会的敗北ストレス後のミクログリア活性化におけるTLR4シグナル伝達の役割。 J Neurosci。 2017;37:2924–36。
82. Wu HM、フロイドCL、ラドゥロビッチAE、グッドコフY、ハリスRB、ホリンガーMA、et al。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 Biol Psychiatry。 2007;61:1159–69。
83. Godbout JP、グラスメイヤーK、シェリダンJF、ジョンソンRW、ケルリーKW。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 J Neurosci。 2005;25:4103–13。
84. O’Connor JC、Freund GG、ジョンソンRW、ダンツァーR、ワトキンズLR、ペリーVH、et al。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 J Neurosci。 2009;29:15075–89。
85. Cope EC、Rao VT、ヒルMN、グールドGG。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 J Neurochem。 2009;108:433–48。
86. McKim DB、ジュニアRD、ソウルソンAM、マクガフティLM、ヘイガーAM、バーグBM、et al。 慢性社会的敗北ストレス後のミクログリア活性化におけるTLR4シグナル伝達の役割。 Biol Psychiatry。 2016;79:244–53。
87. Ménard C、ジュニアRD、ルーソSJ、デュベックAJ、マウアーJ、モリスMJ、et al。 慢性社会的敗北ストレス後のミクログリア活性化におけるTLR4シグナル伝達の役割。 J Neurosci。 2017;37:2924–36。
88. Calcia MA、Brodkin ES、ジュニアRS、ミレニッチJD、リーRS、オハラTM、et al。 慢性社会的ストレスは、ミクログリアの活性化とニューロンの損傷を介して、げっ歯類のうつ病モデルにおける社会的回避を促進する。 J Neurosci。 2009;29:10063–73。
89. Wohleb ES、Hines LM、Osório NS、Duman RS。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリア活性化の持続的な増加を引き起こす。 Biol Psychiatry。 2011;70:175–83。
90. Tynan RJ、ロココA、アンジェロスキエビッチM、ニコロフスカJ、ハミルトンJA。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 J Neurosci Res。 2010;88:2075–83。
91. Chaudhury D、Martisheva E、ジュニアR、クエバRJ、コリンズSL、マクドナルドAJ、et al。 慢性社会的ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 Biol Psychiatry。 2013;73:1104–12。
92. McKim DB、Weber MD、Niraula LR、Sawicki CM、Campbell EL、パワーズR、et al。 血液脳関門の破壊は、慢性社会的敗北ストレス後のミクログリア活性化を促進する。 J Neurosci。 2018;38:8191–208。
93. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
94. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
95. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
96. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
97. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
98. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
99. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
100. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
101. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
102. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
103. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
104. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
105. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
106. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
107. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
108. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
109. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
110. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
111. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
112. ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
113. Kreisel T、シェンクU、ビーズワースBS、ハラシュコA、シュワルツM、ツィマーマンJ、et al。 LPS誘導性炎症におけるミクログリア活性化の役割。 J Neurosci。 2014;34:4132–42。
- Dowlati Y、ロースTM、マクブライドMM、アンダーソンG、フェルトンSJ、ミラーAH、et al。 うつ病における炎症:メタアナリシス。 Mol Psychiatry。 2010;15:1–16。
- スミスRS。 うつ病における炎症:メタアナリシス。 Biol Psychiatry。 1991;30:763–86。
- ラッシングSR、ノックBL。 ミクログリア:うつ病における炎症の主要な調節因子。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 ミクログリア:うつ病における炎症の主要な調節因子。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- ラソフスキーAM、リディンガーSK、マンSM。 NLRP3インフラマソーム:うつ病における炎症の主要な調節因子。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 NLRP3インフラマソーム:うつ病における炎症の主要な調節因子。 J Neuroinflammation。 2016;13:79。
- ディ・マッテオV、エスポージトE。 慢性ストレスは、げっ歯類のうつ病モデルにおけるミクログリアプライミングを誘導する。 Biol Psychiatry。 2013;73:1104–12。
- ハーディンJC、マクガフティLM、メッツG、リウCD、マクナマラRK、デラロサA、et al。 NLRP3インフラマソームの活性化は、慢性社会的敗北ストレス後のうつ病様の行動に必要である。 Biol Psychiatry。 2016;79:939–48。
- ゴーシュA、ホルトJK、マクレナンKM、ミッキーBJ、ミッチェルAJ、ムニールA、et al。 P2X7受容体の活性化は、慢性ストレスに曝露されたラットの海馬グリア細胞におけるNLRP3インフラマソームの組み立てを刺激し、うつ病様の行動を誘発する。 J Neuroinflammation。 2017;14:128。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
- シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
- ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
- ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
- ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
- シュワァルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
186. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
187. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
188. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
189. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
190. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
191. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
192. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
193. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
194. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
195. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
196. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
197. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
198. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
199. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
200. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
201. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
202. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
203. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
204. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
205. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
206. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
207. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
208. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
209. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
210. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
211. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
212. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
213. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
214. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
215. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
216. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
217. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
218. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
219. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
220. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
221. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
222. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
223. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
224. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
225. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
226. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
227. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
228. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
229. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
230. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
231. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
232. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
233. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
234. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
235. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
236. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
237. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
238. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
239. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
240. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
241. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
242. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
243. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
244. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
245. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
246. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
247. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
248. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
249. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
250. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
251. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
252. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
253. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
254. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
255. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
256. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
257. ツァイSY、マッキンタインタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
258. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
259. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
260. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
261. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
262. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
263. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
264. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
265. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
266. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
267. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
268. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
269. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
270. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
271. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
272. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
273. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
274. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
275. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
276. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
277. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
278. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
279. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
280. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
281. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
282. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
283. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
284. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
285. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
286. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
287. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
288. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
289. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
290. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
291. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
292. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
293. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
294. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
295. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
296. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
297. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
298. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
299. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
300. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
301. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
302. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
303. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
304. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
305. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
306. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
307. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
308. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
309. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
310. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
311. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
312. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
313. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
314. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
315. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
316. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
317. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
318. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
319. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
320. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
321. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
322. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
323. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
324. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
325. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
326. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
327. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
328. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
329. ダンツァーR、オコナーJC、フレウンドGG、
はい、論文の続きを記述します。
ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
330. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
331. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
332. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
333. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
334. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
335. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
336. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
337. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
338. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
339. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
340. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
341. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
342. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
343. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
344. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
345. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
346. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
347. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
348. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
349. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
350. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
351. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
352. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
353. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
354. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
355. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
356. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
357. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
358. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
359. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
360. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
361. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
362. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
363. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
364. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
365. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
366. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
367. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
368. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
369. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
370. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
371. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
372. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
373. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
374. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
375. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
376. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
377. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
378. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
379. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
380. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
381. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
382. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
383. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
384. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
385. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
386. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
387. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
388. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
389. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
390. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
391. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
392. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
393. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
394. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
395. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
396. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
397. ツァイSY、マッキンタイアTM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 J Neuroinflammation。 2016;13:79。
398. ミラーAH、イェーダR、ツァイSY、マッキンタイアTM。 うつ病における炎症:ミクログリアの役割。 Biol Psychiatry。 2013;73:1104–12。
399. ダンツァーR、オコナーJC、フレウンドGG、ジョンソンRW、ケリーKW。 うつ病における炎症:免疫から脳へのコミュニケーションの免疫学的理論。 Physiol Rev。 2008;88:731–58。
400. シュワルツLM、ラッシングSR。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Neurosci Biobehav Rev。 2016;68:654–69。
401. ラソフスキーAM、リディンガーSK、マンSM。 うつ病におけるキヌレニン経路:ミクログリアの役割。 Brain Behav Immun。 2018;73:654–69。
398. Yue N、Huang HJ、Zhu XC、Han QQ、Wang YL、Li B、他。 海馬グリア細胞におけるP2X7受容体およびNLRP3インフラマソーム集合体の活性化は、慢性ストレス誘発性のうつ病様行動を媒介する。 J Neuroinflammation。 2017;14:102。
399. Zhang Y、Liu L、Peng YL、Liu YZ、Qin SY、et al。 ミクログリア活性化は、うつ病ラットの前頭前皮質におけるIL-1β関連の炎症を媒介する。 Brain Behav Immun。 2014;41:90–100。
400. Zhang Y、Liu L、Liu YZ、Shen XL、Wu TY、Zhang T、他。 NLRP3インフラマソームは、ニューロ炎症を介して、マウスの慢性軽度ストレス誘発性うつ病を媒介する。 Int J Neuropsychopharmacol。 2015;18(8):pyv006。