1.27 ポジトロン断層撮影法および単一光子放射断層撮影法を用いた放射性トレーサーイメージング:基本原理、方法論、および神経精神医学研究における役割
マーク・スリフスタイン博士、ジョン・H・クリスタル医学博士、アニッサ・アビ-ダーガム医学博士
概要
放射性トレーサーイメージングは、ヒトおよび前臨床種の脳内における空間的に局在した神経化学的情報を生体内で定量化する独自の能力を持つ方法論である。放射性トレーサーは、神経受容体、再取り込みトランスポーター、または細胞内酵素などの標的分子に結合するか、あるいは内因性物質の代謝経路の基質としてそれらと並行して作用することにより、神経化学システムと相互作用するように設計された化学的プローブである。「トレーサー」とは、定量可能なレポータープローブを含む化学物質を生体系に導入し、そのシステムとの相互作用をプローブによって「追跡」する実験的アプローチを指す。トレーサーは、システムの正常な機能がトレーサー自体の存在によって著しく妨げられないように、十分に低い濃度で導入されることが暗黙の前提である。トレーサー法は、最新のイメージング法および技術が登場する数十年前から使用されていた。ジョージ・ド・ヘヴェシーは、20世紀半ばにトレーサーに組み込まれた放射性同位元素の使用を開拓し、生物系を含む広範囲の化学現象を研究した。他の研究者たちは、トレーサー法に基づいて薬物動態モデルを開発し、生物組織における血液灌流などのプロセスを定量化した。これらは、最新の放射性トレーサーイメージングで使用される薬物動態モデルの基礎を形成しているが、実験データの取得には、しばしば動物への侵襲的測定が伴った。生きたヒトに日常的に使用できるほど非侵襲的なアプローチは、イメージングシステムと計算能力における技術的進歩がそのような方法を可能にした1970年代後半から1980年代まで利用可能にならなかった。放射性トレーサーでは、レポータープローブは、(神経)生物学的システムと相互作用するように設計された分子に組み込まれた放射性原子同位体である。放射性同位元素は不安定な核構造を有しており、個々の放射性原子は予測不可能なランダムな時間に、より安定した状態へと崩壊するが、多数の放射性原子が存在する場合、任意の時点での崩壊速度は初期速度の非常によく特徴付けられた割合となる。放射性同位元素が崩壊する方式は多数存在するが、すべてエネルギーの放出を伴う。イメージングで使用される放射性同位元素は、崩壊する際に高エネルギー光子(γ線とも呼ばれる)を放出し、これは生体組織を容易に通過し、体外のイメージングシステムで検出される。光子エネルギーは通常、電子ボルト(eV、1eV = 1.6*10⁻¹⁹ジュール、電子が1ボルトの電位差を通過する際に経験するエネルギー変化。1keV = 10³ eV、1MeV = 10⁶ eV)の単位で記述され、イメージングで使用される同位体によって放出される光子は、一部の同位体では約150keVから、他の同位体では511keVの範囲に及ぶ。鉛やイメージングシステムの検出器として使用される無機シンチレーション結晶などの非常に高密度の物質を除き、ほとんどの物質はこのエネルギー範囲の光子に対して透明である。放射性原子は、トレーサー分子のごく一部に組み込まれており、これらは標識分子と呼ばれ、トレーサーサンプル内で十分に混合されていると仮定されるため、任意の時点で組織内の場所で測定される崩壊速度は、そこにある未標識トレーサー分子の数と既知の比例関係を持つことになる。脳内の局所的な体積から一定時間内に発生する光子の数を数えることにより、その体積内の放射性トレーサーの濃度を推測することができる。放射能の発生源を空間的に特定する能力には、トモグラフィー再構成として知られる計算手法の使用が必要となる。トモグラフィーの背後にある数学的理論は、20世紀初頭にはすでに十分に確立されていたが、高速で強力なコンピューターの出現と、必要な空間的、時間的、およびエネルギー分解能を提供できる電子機器および検出器材料の開発と組み合わさって、ようやく20世紀の最後の数十年間に実用的に実装された。同様の実験方法を利用するが、光子の計数方法および使用される放射性同位元素の崩壊モードが異なる2つのイメージングモダリティがある。これらは、ポジトロン断層撮影法(PET)および単一光子放射断層撮影法(SPECT)である。「放出」という用語は、放射性同位元素が静脈内投与(または、より頻度は低いが、吸入または経口摂取)される分子の一部であり、検出される光子が体内から放出されるという事実に言及する。これは、X線およびコンピューター断層撮影(CT)スキャンのような透過イメージングとは対照的であり、透過イメージングでは、光子ビームが外部線源から身体に向けられ、介在する組織と相互作用せずに通過した部分が反対側で計数される。精神医学研究者は、PETおよびSPECTイメージングを使用して、多くの異なる神経精神医学的状態を有する被験者のサンプルコホートにおける神経化学の多くの側面を特徴付けてきた。イメージングで使用される放射性同位元素の数は少ないが、これらを組み込むことができる放射性トレーサーの数、および研究できる生化学システムの数は事実上無限であり、多くの異なるトレーサーがヒト被験者を用いた研究で使用されてきた。現在、精神医学において、これらのイメージング法はほぼ専ら研究に使用されている。それらはまだ診断に使用できる感度や特異性を備えていない。精神医学的集団におけるほとんどの放射性トレーサー研究は、患者と比較対照被験者との間で測定量にかなりの重複がある、中程度の規模のサンプルコホートからの統計的推論に基づいて結論を下している。しかし、これらの研究は、基礎神経科学または創薬に取り組む他の研究者に対して、精神医学的状態において病理学的である可能性があり、インビトロ法または前臨床種を用いてより詳細に調べることができるプロセス、あるいは薬物療法の分子標的を示唆する可能性のあるプロセスに関する重要な手がかりを提供する。この意味で、放射性トレーサーイメージングは、精神医学的患者集団における脳の神経化学を理解するための重要なトランスレーショナルツールである。本章の残りの部分では、イメージングの物理学と技術、薬物動態モデル、および精神医学的イメージング研究で使用される実験計画について説明し、続いて研究されてきた放射性トレーサー、分子標的、および精神医学的集団、ならびにいくつかの十分に再現された結果を概観する。
基本的物理原理
放射能、放射性核種、および光子放出
**半減期。**前述の通り、個々の放射性原子が崩壊する時間はランダムであり予測不可能である。しかしながら、放射性トレーサーの投与量には非常に多数の標識分子が含まれている。例えば、典型的なPETの投与量には、10¹⁰個オーダーの標識分子が含まれており、それぞれが他のすべての分子とは独立に、単位時間あたり同じ崩壊確率を持つ。この状況では、崩壊率、すなわち単位時間あたりの崩壊数は、指数関数式 A(t) = A(0)e⁻<sup>λt</sup> に従う。ここで、A(t)は時刻tにおける放射能、すなわち単位時間あたりの崩壊数であり、A(0)は初期放射能、λは各放射性同位体ごとに異なる、非常によく特性評価された速度定数である。放射能の国際単位系(SI)単位はベクレル(Bq)であり、1秒あたり1崩壊に等しい。古いが、依然として頻繁に使用される単位はキュリー(Ci)であり、1秒あたり3.7×10¹⁰崩壊に等しい。イメージングで使用される放射能の範囲では、MBq(10⁶ Bq)およびmCi(10⁻³ Ci)の単位を使用する方が便利である。また、λをln(2)/T<sub>1/2</sub> に分解するのも便利である。ここで、T<sub>1/2</sub>(半減期)は、Aが初期値の半分に減少するのにかかる時間である。初期測定A(0)が行われた際の時間の選択および総放射能は半減期に影響しない。いかなる測定の後でも、追加のT<sub>1/2</sub>が経過した後には放射能は50%減少する。PETおよびSPECTで最も一般的に使用される同位体の半減期およびその他のパラメータは、表1.27-1に示されている。放射性トレーサーイメージングで使用される同位体は、放射性核種とも呼ばれる。
**陽電子放出による崩壊とPET放射性核種。**陽電子放出による崩壊では、原子核内の陽子が中性子と陽電子(およびニュートリノと呼ばれる極めて質量の小さい非荷電粒子)に変換される。陽電子は、電子と同じ静止質量を持つが、反対の電荷を持つ粒子である。陽電子が核から放出されると、初期運動エネルギーを持ち、粒子が周囲の物質と相互作用するにつれて減少する。近傍の物質との一連の衝突により、陽電子は多くの方向転換を伴う予測不可能な経路をたどり、最も一般的に使用されるPET放射性核種(表1.27-1)の場合、放出からナノ秒以内、かつその発生源原子から1~2ミリメートル以内に通常静止する。その時点で、陽電子と局所的な電子は反対の電荷によって互いに引き付け合い、対消滅反応を起こし、その質量がエネルギーに変換される。陽電子と電子の静止質量からのエネルギーが保存されるため、それぞれ電子の静止質量である511keVのエネルギーを持つ2つの光子が生成される。光子は互いにほぼ反対方向に進む(全運動量は保存される:陽電子と電子の運動量は対消滅時にはほぼゼロであり、光子の運動量は反対で合計ゼロとなるが、対消滅事象時の粒子にわずかな残留運動量があるため、角度は通常180度とはわずかに異なる)(図1.27-1)。PET技術は、同時計数検出の原理を利用することにより(下記参照)、対消滅事象の場所から2つのほぼ同一直線上の光子が同時に放出されるという事実を利用する。PET脳イメージングで最も一般的に使用される2つの放射性核種は、¹¹炭素(¹¹C、T<sub>1/2</sub> = 20分)と¹⁸フッ素(¹⁸F、T<sub>1/2</sub> = 110分)である。¹⁵O標識水に組み込まれた¹⁵酸素(¹⁵O、T<sub>1/2</sub> = 2分)は、脳血流を評価するために使用できるが、この目的での使用は主にMRI技術に取って代わられている。また、¹³N標識アンモニアに組み込まれた¹³窒素(¹³N、T<sub>1/2</sub> = 10分)は、心臓病学などの他の分野で頻繁に使用されている。⁶⁴銅(⁶⁴Cu、T<sub>1/2</sub> = 12.7時間)のような他の陽電子放出核種は、より長い半減期が望ましい状況で放射性核種として使用されてきたが、現在まで、⁶⁴Cuは神経画像診断には応用されていない。PETで使用される放射性核種は天然には存在せず、その短い半減期は、研究のどれくらい前に、したがって研究施設からどれくらい離れた場所でそれらを製造し、放射性トレーサーに組み込むことができるかについて厳しい制約を課す。PET放射性核種の製造は、サイクロトロンと呼ばれる粒子加速器で行われる。これはいくつかの医療機器メーカーによって製造されている装置であるが、大型で高価であり、操作と維持に高度なスキルを必要とし、放射能を生成するため規制当局の厳しい監視の対象となる。放射性核種を放射性トレーサーに迅速に組み込むには、精巧な化学および品質管理機器と、これらの作業を実行するための高度なスキルを持つ化学者が必要である。おおよその経験則として、放射性トレーサーは、¹¹C標識放射性トレーサーとして適するためには、1時間以内に合成され、無菌性および化学的純度の試験を受けられなければならない。したがって、¹¹Cの使用は、PETスキャン時に局所的に製造できる施設に限定され、¹¹C放射性トレーサーを使用したPET研究は、必要な人員と設備をサポートできる大規模な学術医療センターでほぼ専ら実施されている。¹¹C標識放射性トレーサーの製造要件は明らかに厳しいものであるが、¹¹Cにはその使用を非常に望ましいものにするいくつかの大きな利点がある。第一に、トレーサーとして関心のある事実上すべての分子における炭素の遍在性は、有機分子中の¹²Cを¹¹Cで置換することにより、その生化学的特性を変えることなく標識を潜在的に実行できることを意味する。第二に、20分の半減期により、同日に複数のスキャンが可能となり、1回の研究セッションで被験者に対して異なる実験条件下でスキャンを実行できる。学術医療センターはまた、¹⁸F標識放射性トレーサーを日常的に製造している。¹⁸F標識トレーサーの製造における時間的プレッシャーは、¹¹Cの場合よりも明らかに少ない。さらに、¹⁸Fの110分の半減期により、研究施設から数時間の移動時間内にある施設を持つ専門メーカーによって¹⁸Fトレーサーを製造するための十分な時間的余裕が生まれる。さらに、¹⁸F標識は、放射性トレーサーの薬物動態が数時間のスキャンを必要とする場合に好ましい。この場合、¹⁸Fはスキャン期間全体にわたって信頼性の高い信号を提供し続けるのに対し、¹¹Cの放射能は非常に低くなり、スキャン後半のデータは信頼性が低くなる。しかし、単一被験者における同日の複数回の¹⁸Fスキャンは、最初のスキャンからの放射能が2回目のスキャンからの放射能と重複するため、正確に分析することが困難である。
表1.27-1. 一般的に使用されるPETおよびSPECT放射性核種の特性
| 核種 | T<sub>1/2</sub>(分) | イメージング光子エネルギー (keV) | 通常のイメージングモダリティ | 平均陽電子飛程 (mm) |
| ¹¹C | 20.4 | 511 | PET | 1.1 |
| ¹⁸F | 109.8 | 511 | PET | 0.6 |
| ¹⁵O | 2.03 | 511 | PET | 2.4 |
| ¹²³ | 787.8 | 159 | SPECT | |
| 360.4 | 140 | SPECT |
注釈:
“平均陽電子飛程 (mm)” は、PET核種に特有の特性であり、SPECT核種には通常適用されません。そのため、SPECT核種である “¹²³” およびその下の核種の該当欄は空白になっています。
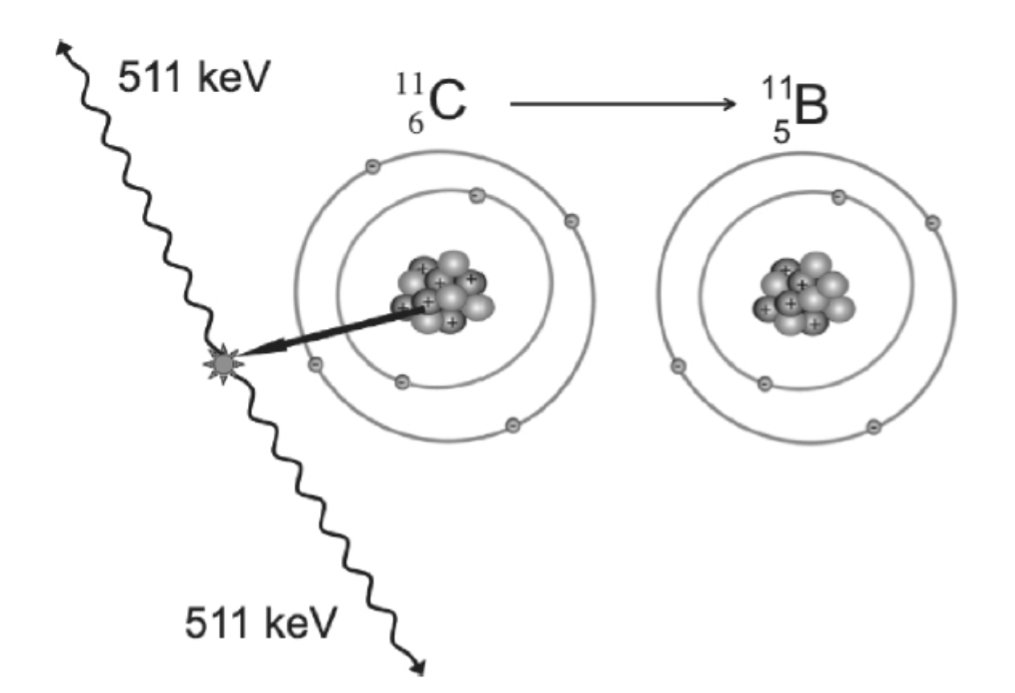
図1.27-1。不安定な炭素11の安定なホウ素への崩壊の模式図。陽電子が炭素原子核から放出され、最終的に電子と衝突する。対は消滅し、2つの511 keV光子が反対方向に放出される。距離は縮尺通りではない。
SPECT用放射性核種。その名前が示すように、SPECTスキャナは、同時計数を利用するPETスキャナとは異なり、単一の放出光子を測定する。理論上は、PET用放射性核種もSPECTシステムで使用できる可能性があるが、同様に使用可能なエネルギー範囲の光子を放出し、より長い半減期で崩壊する他の放射性核種の方が実用的である。脳イメージングに特に有用であることが証明されているSPECT用放射性核種は、123ヨウ素(123I、半減期 = 13.1時間)である。123Iは電子捕獲のプロセスによって崩壊する。このプロセスでは、軌道電子が陽子と結合して中性子(およびニュートリノ)を形成し、別の外側軌道電子が変換された電子によって空いた軌道殻を埋めるときに特性X線光子が放出される。123Iが経る可能性のある電子捕獲崩壊スキームは複数あり、さまざまなエネルギーの光子の放出につながるが、崩壊の約83%が159 keV光子の放出をもたらし、これらがSPECTスキャナによって検出されるものである。123Iはサイクロトロンで製造できるが、半減期が長いため、123Iまたは123I標識放射性トレーサーを製造施設から数千マイルの範囲内に配送することが可能である。すべてのSPECTアプリケーションにおいて、最も一般的に使用される放射性核種は99mテクネチウム(99mTc、半減期 = 6時間)である。99mTcは、99モリブデン(99Mo、半減期 = 66時間)の崩壊による「準安定」生成物であり、その原子核が適度に励起された状態にあり、別の元素に変換されることなく、より安定な99Tc形態に崩壊することを意味する。99mTcはいくつかのプロセスを経て安定な99Tcに崩壊する可能性があるが、崩壊の約88%が140 keV光子の放出をもたらし、これらの光子がSPECTスキャナによって検出される。99mTcは、大規模な原子炉で製造された99Moを含む携帯型装置である99Moジェネレータの形で、イメージング施設に最も一般的に供給される。ジェネレータ内で99Moが99mTcに崩壊し、99mTcはクロマトグラフィー法によって99Moから分離することができる。しかし、99mTcは血液脳関門(BBB)を容易に通過しないのに対し、123Iはヨウ素の親油性がより高いため、より容易に通過する。その結果、脳イメージング用のSPECT放射性トレーサーの大部分は123Iで標識されている。
エミッショントモグラフィーの物理的原理
V線検出。PETで放出される511 keV光子およびSPECTで放出される140~159 keV光子をイメージングに有用なものにしているのと同じ組織透過特性が、それらを計数する電子システムによる処理により適した形態にそれらのエネルギーを検出および変換するための特殊な材料の必要性につながる。PETおよびSPECTにおける検出器は、放射性崩壊から生じる高エネルギー光子と相互作用し、すなわちそれを阻止し、吸収されたエネルギーの一部を可視光から紫外域の低エネルギー光子の形で放出する、高密度の無機シンチレーション結晶である。SPECTで最も一般的に使用されるシンチレータは、タリウム添加ヨウ化ナトリウム(NaI(Tl))である。PETでは多くのシンチレーション検出器が使用されてきた。最も頻繁に使用されるものには、ゲルマニウム酸ビスマス(BGO)、オキシオルトケイ酸ルテチウム(LSO)、およびイットリウムオキシオルトケイ酸ルテチウム(LYSO)がある。それぞれ異なる特性を持ち、用途によっては他のものよりも最適な場合がある。 シンチレータが低エネルギー光子を放出した後、PETとSPECTの両方における信号変換の次の段階は、その信号を、残りの放射能計数プロセスを実行する電子回路内で検出された事象を表す電流に変換することである。この構成要素は光センサーと呼ばれる。2000年代の最初の10年間まで、およびそれを通じて、ほとんどの市販スキャナの光センサーは光電子増倍管(PMT)であった。PMTは、シンチレータと接する端部(陰極)に感光材料を備え、管の長手方向に沿って連続的により高い電圧に維持された一連の金属板(ダイノード)を有する、真空ガラス管である。陰極に当たった光は、電子が表面を離れて最も近いダイノードに衝突するように誘導し、さらに多くの電子がその板から離れて次のダイノードに衝突するように誘導する。このカスケードは続き、最終段(陽極)による電子流の十分な増幅により、電子回路の次の段階に適した範囲の電流が形成される(図1.27-2)。PETにおける検出器とPMTの一般的な構成は、少数のPMTに取り付けられた長方形の検出器材料ブロックである。これらのブロックは、撮像視野を囲む多角形のリング状に組み立てられ(図1.27-3)、多数のリングが同心円状に組み立てられて円筒形の撮像ガントリーを形成する。同様の設計はSPECTでも可能であるが、より一般的には、SPECTスキャナは、被写体の周りを回転して全角度からデータを取得する多数のPMTアレイに取り付けられたいくつかの大きな検出器材料のスラブを含んでいる(図1.27-3)。近年、PMTに代わる固体光センサーの開発が大きく進んでおり、これは主にハイブリッドPET-MRスキャナの開発によって推進されている(下記参照)。PMTはMRIスキャナによって生成される強力な磁場と相互作用し、その中では適切に動作しないのに対し、固体光センサーはその環境で動作することができる。広範囲に研究されてきた2つの設計は、アバランシェフォトダイオード(APM)と呼ばれるものと、ガイガーモードで動作するAPM(シリコン光電子増倍管、SiPMと呼ばれる)である。APMおよびSiPMは、PET-MRだけでなく、より最近製造された多くのスキャナにおいて標準的な光センサーとなっている。
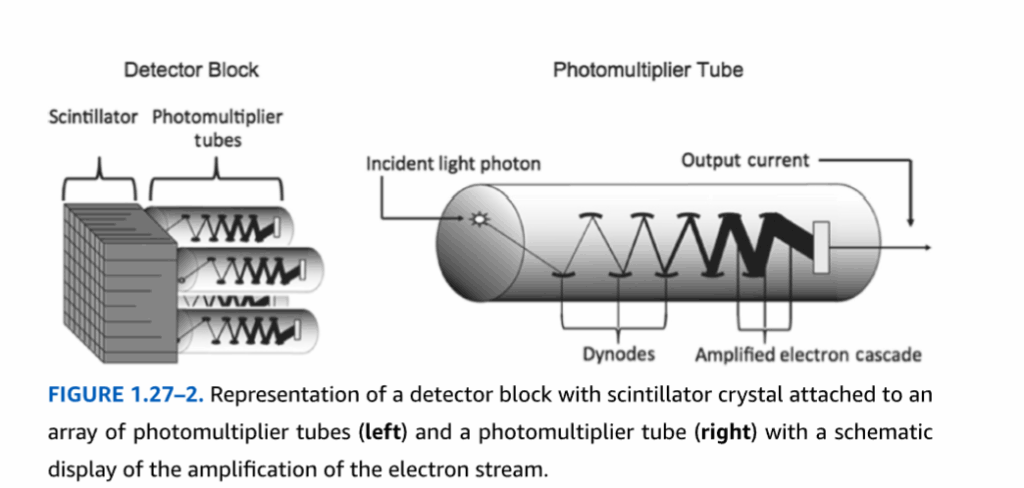
図1.27-2。シンチレータ結晶が光電子増倍管アレイに取り付けられた検出器ブロックの表現(左)と、電子流増幅の模式図を伴う光電子増倍管(右)。
PETにおける同時計数検出。PETでは、2つの511 keV光子が2つの検出器に同時に衝突したときに放射性崩壊事象が記録される。2つの検出器間の経路は応答線(LOR)と呼ばれる。電子回路は、同時計数時間窓と呼ばれる非常に狭い時間間隔内に2つの光子到達事象が発生したかどうかを検出する。最新のスキャナにおける同時計数時間窓は、3~6ナノ秒の範囲である。検出された各同時計数事象により、コンピュータはそのLORの総カウント数を1単位増加させる(図1.27-3)。
コリメーションによるSPECTにおける光子検出。SPECTでは、鉛コリメータの使用により、崩壊事象はLORに局在化される。これらは通常、検出器に取り付けられた鉛のブロックから形成され、検出器に対して狭い角度範囲からの光子のみを通過させる長く狭いチャネルを持つ。最も単純な設計では、すべてが検出器の平坦面に対して垂直な平行な円筒形チャネルを利用するが、異なるスキャナ設計や異なる画像再構成アルゴリズムと共に、多くの異なる構成が使用されている。SPECTにおけるコリメーションの必要性により、そのスキャナは、PETスキャナよりも放射性崩壊から放出される光子のより少ない部分を利用することになる。スキャナが視野内の放射能を検出カウントに変換する全体的な効率は感度と呼ばれる。コリメーションのため、SPECTシステムはPETシステムよりも感度が低い。
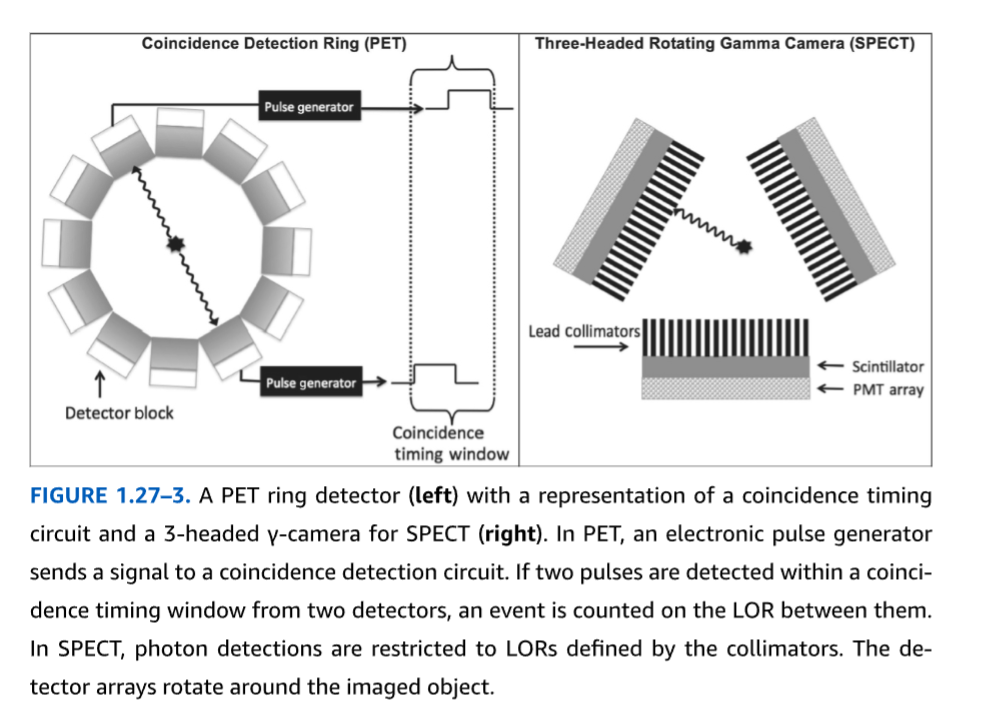
図1.27-3。同時計数回路の表現を伴うPETリング検出器(左)とSPECT用の3検出器ヘッドガンマカメラ(右)。PETでは、電子パルス発生器が同時計数検出回路に信号を送る。2つの検出器からの2つのパルスが同時計数時間窓内に検出されると、それらの間のLORでイベントがカウントされる。SPECTでは、光子検出はコリメータによって定義されたLORに限定される。検出器アレイは撮像対象物の周りを回転する。
画像再構成
PETとSPECTの両方で得られるデータは投影データと呼ばれる。各LORについて、LORに沿ったすべての位置からのカウントを含む単一の数値が記録される。逆に、崩壊事象後に光子が放出される方向はランダムであるため、放射能を含む撮像視野内の各位置は、複数の、場合によっては多くのLORにカウントを寄与する。LORデータは崩壊事象の元の分布の複製を再構成するのに十分な情報を含んでいるが、これには投影データの数理モデルの適用と、コンピュータ上でのモデルの数値的実装が必要となる。再構成には、フィルタ補正逆投影法(FBP)と逐次近似再構成法という2つの一般的なアプローチがある。どちらもある程度の数学的複雑さを伴い、それぞれに多くの変法が存在する。以下では、特定の実装ではなく、両手法の一般的な概念のみを説明する。投影データはサイノグラムと呼ばれる数値配列として保存され、これは原点(視野の中心)からの角度と半径方向距離によって構成される。各角度θと距離dについて、点(θ, d)のサイノグラムに記録される値は、角度θで原点を通る線に垂直であり、原点から距離dでその線を通過するLOR内の検出イベント数(カウント数)である(図1.27-4)。サイノグラムという名前は、空間的の一点のみに放射能を持つ物体が(θ, d)表現において正弦波として記録されるという事実に由来する。再構成された画像は通常、ピクセル(2次元)またはボクセル(3次元の「体積要素」)の長方形グリッド内の直交座標で表現される。
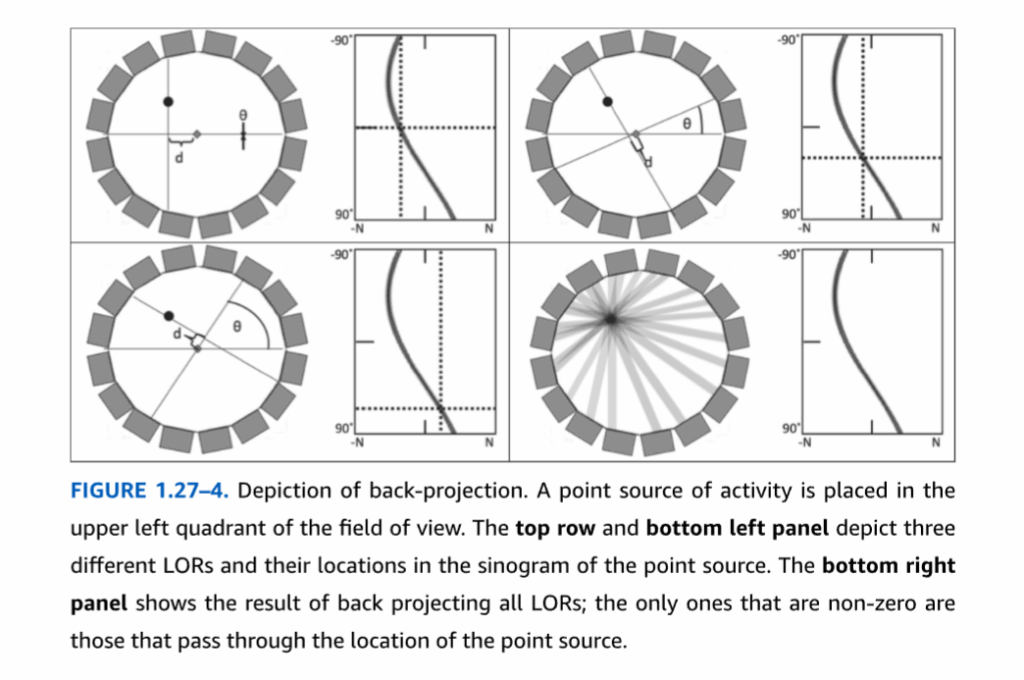
図1.27-4。逆投影の図解。点状の放射能線源が視野の左上象限に置かれている。上段と左下のパネルは、3つの異なるLORと、点線源のサイノグラムにおけるそれらの位置を示している。右下のパネルはすべてのLORを逆投影した結果を示しており、非ゼロとなるのは点線源の位置を通過するものだけである。
フィルタ補正逆投影法。FBPは、解析的再構成法と呼ばれることもあり、CTの初期から2000年代初頭まで画像再構成の最も一般的なアプローチであった。これは、1980年代にいくつかの発表論文に登場した逐次近似法が、当時のコンピュータにとっては計算量が多すぎ、したがって処理が遅すぎたことが一因である。視覚的により鮮明な再構成画像をもたらす逐次近似再構成プログラムは、現在では市販スキャナのソフトウェアパッケージの一部として日常的に提供されているが、後述する統計的な問題から、多くの研究者はいまだにFBP再構成を好む。FBPの基本方程式は、ラドン変換および逆ラドン変換と呼ばれる数式から導き出される。これらは20世紀初頭に初めて記述された理論的構成概念であり、2次元空間で定義された数学関数、すなわち直交座標の各(x,y)対に対して単一の数値を定義するf(x,y)と、その投影との関係を説明するものである。FBPは逆ラドン変換の離散化版であり、すなわち、原点からの角度と距離の完全な連続体ではなく、有限数のLORに基づいたバージョンである。最初のステップは、すべてのLORからの投影を重ね合わせ、合計することと考えることができる(図1.27-4)。このステップは逆投影と呼ばれる。放射能を含む位置はそれらを通過するすべてのLORに寄与するため、逆投影されたデータはこれらの位置で強度が高くなる。しかし、純粋な逆投影では、カウントを含む各LOR全体に沿っても放射能を割り当ててしまうため、逆投影の前に空間フィルタリングと呼ばれる調整が適用され、そうでなければ生じる星芒状アーチファクトを除去する(図1.27-5)。これはFBPの概念的な説明であり、実際の装実装では、より洗練されたコンピュータアルゴリズムや、フーリエ変換などの数学的手順が使用される。FBPの主な利点は、処理が速いことである。しかし、欠点もある。フィルタリング処理とLORの数が有限であるという事実が相まって、空間分解能が低下し、いわゆるストリークアーチファクトが発生する(図1.27-6)。
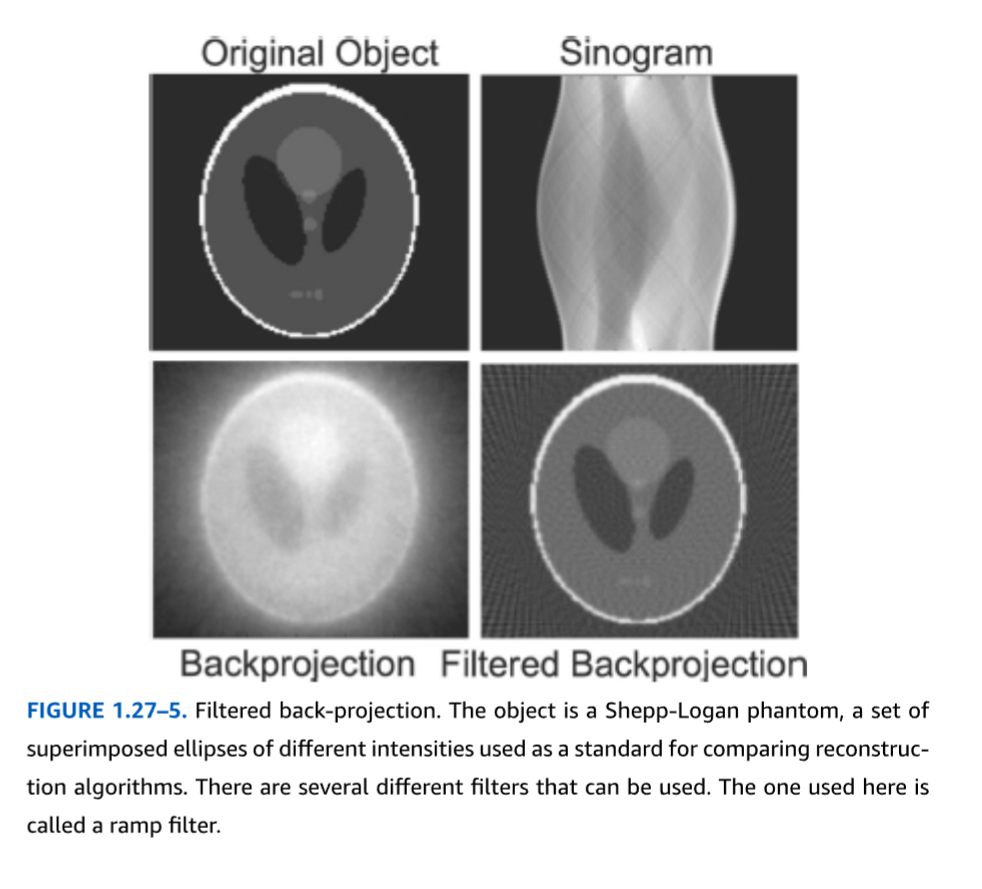
FIGURE 1.27-5. フィルター逆投影。オブジェクトはShepp-Loganファントムであり、これは異なる強度を持つ重ね合わせられた複数の楕円の集合で、再構成アルゴリズムを比較するための標準として使用されます。使用できるフィルターはいくつかあります。ここで使用されているものはランプフィルターと呼ばれます。
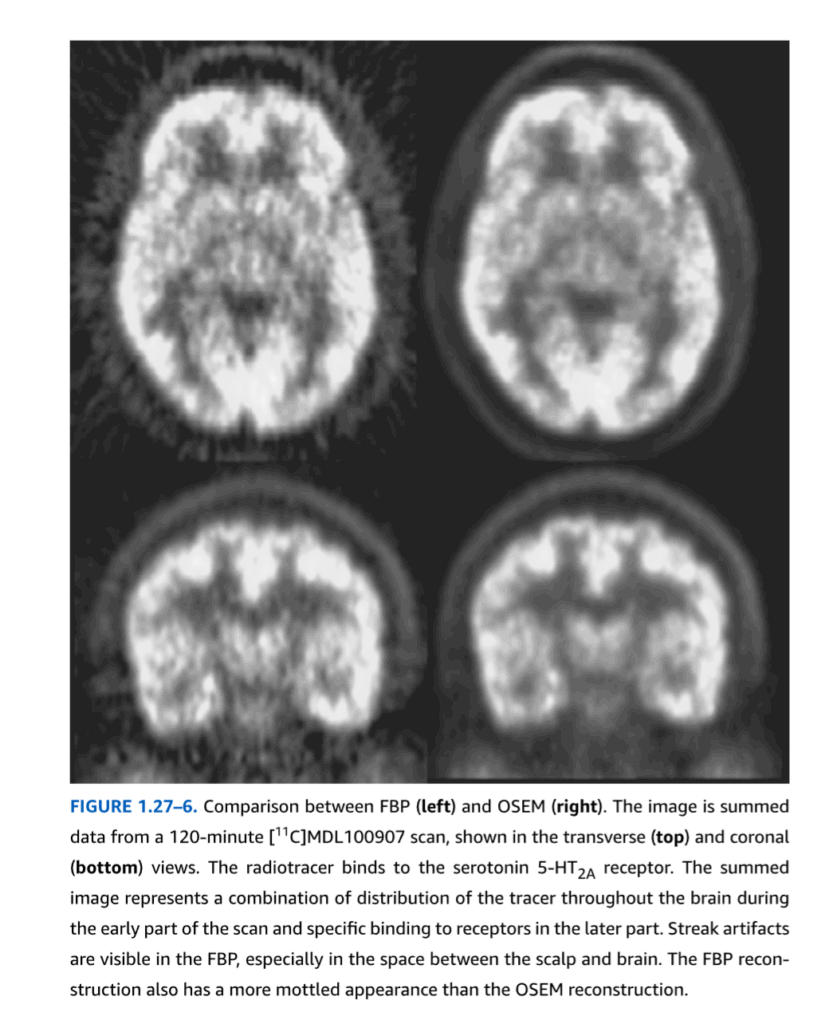
FIGURE 1.27-6. FBP(左)とOSEM(右)の比較。この画像は120分間の[11C]MDL100907スキャンから得られた合計データで、横断像(上)と冠状像(下)で示されています。この放射性トレーサーはセロトニン5-HT2A受容体に結合します。合計画像は、スキャンの初期における脳全体へのトレーサー分布と、後期における受容体への特異的結合の組み合わせを示しています。FBPには、特に頭皮と脳の間の空間に筋状のアーチファクトが見られます。FBP再構成はまた、OSEM再構成よりも斑状に見えます。
反復再構成。投影データとボクセル値の関係を、再構成を統計的推定問題として組み立てることによって確率的に扱うアルゴリズムが多数提案されている。これらはボクセル値を確率分布から抽出されたサンプルとして扱い、測定された投影データと、検出器の形状などのイメージングシステムの既知の物理的特性が与えられた場合に、ボクセル内のカウントの最も確率的な分布を推定しようとする。これらが反復と呼ばれるのは、ボクセル値の任意の推定値から開始し、現在の推定値を入力として受け取り、改善された推定値を出力として返す式を更新することによって、その推定値を連続的に改善するからである。この手順を1サイクル実行することを反復と呼ぶ。ほとんどの商用スキャナ製造業者が提供するソフトウェアパッケージで利用可能な反復アルゴリズムは、期待値最大化 (EM) アルゴリズムの修正版である、順序付きサブセット期待値最大化 (OSEM) と呼ばれる。EMとOSEMは最尤 (ML) 原理に基づいている。ML推定手順は、観測されたサンプルデータからパラメトリック確率分布のパラメータを推定する式を確立する統計的方法である。たとえば、ガウスランダム変数の平均uをサンプル平均として推定する従来の式は、ML原理から導出できる。尤度は、これらのデータと分布のパラメータの関数として表現された、観測されたサンプルデータの確率の式である。その名前が示すように、ML法は、観測されたデータの尤度を最大化するパラメータの値を求める。ボクセルデータは通常、ポアソンランダム変数としてモデル化される。ポアソン分布は非負の整数値のみを取り、分布の平均である単一のパラメータλを持つ。EMおよびOSEMアプローチでは、各ボクセルから放出されるカウントは、他のすべてのボクセルから統計的に独立しているとして扱われる。ボクセルjにおけるカウントの平均または期待値は、そのボクセルのポアソン分布のパラメータであるλjであると仮定される。しかし、これらは隠れた変数である。なぜなら、観測されたデータはLOR上の投影データのみだからである。EMアルゴリズムは、投影データなどの不完全なデータしか利用できない場合に、隠れた変数の分布に対するMLパラメータ推定値を取得するように設計されている(投影データと観測されないボクセル平均は完全なデータと呼ばれる)。投影データとボクセル値の仮定されたポアソン分布の特定のケースでは、この手順は、連続する反復の過程でボクセル平均のML推定値の集合{λj}に収束することが保証された、シンプルでエレガントな式につながる。しかし、完全なポアソンEMアルゴリズムは、PETおよびSPECT画像データのLORとボクセルの数が多いため、膨大な数の計算を必要とし、したがってEMアルゴリズムが提案された当時に利用可能なコンピュータでは実用的ではなかった。OSEMアルゴリズムは、1990年代に導入された修正版であり、反復再構成を実用化した。LORデータの全セットをより小さなサブセットのシーケンスに巧みに順序付けし、すべてのLORを完全な反復ごとに1回だけではなく、各連続するサブセットで実行された計算に基づいてボクセル推定値を更新することで、解決する必要がある方程式の数が減り、必要な反復回数、したがって計算負荷が大幅に削減される。完全なEMとは異なり、OSEMはボクセル値のML推定値に収束することが保証されていないが、実用的な経験では、固定された少ない反復回数で非常に満足のいく画像再構成が得られることが示されている(図1.27-6)。OSEM再構成の主な利点は、FBP再構成で見られるような筋状のアーチファクトやランダムノイズのレベルなしで、より鮮明な画像が得られることである(図1.27-6)。欠点は、特にPETで発生するいくつかのノイズ源に対する再構成前のシナグラムデータへの必要な予備補正の後、ポアソン分布の仮定が完全に満たされないため、活動量の高い脳領域と低い脳領域間の真の比例関係が維持されないバイアスにつながる可能性があることである。ただし、このバイアスは比較的小さい。このため、視覚的な提示よりも定量化に興味がある多くの神経画像研究者は、歴史的にOSEMよりもFBPを好んでいた。しかし、EMベースのアルゴリズムの継続的な改良と、ますます強力になるコンピュータハードウェアにより、より高速でバイアスの少ない反復法が開発され、最新バージョンは定量的イメージングにおいてより競争力を持つようになっている。
もう一つの最近の開発は、反復再構成アルゴリズムにおける飛行時間 (TOF) 情報の実用的な応用である。対向する検出器の間の正確な中間点に消滅イベントの場所がない場合、光子は検出器にわずかに異なる時間に到達する。理論的には、この時間差が正確に分かれば、LORに沿った同時発生イベントの位置も特定できるだろう。しかし実際には、ほとんどのスキャナは時間差をナノ秒(10−9秒)以上の精度でしか分解できず、この情報が脳画像診断に有用であるにはイベントの位置推定の不確実性が大きすぎる。しかし、より最近製造されたスキャナでは、タイミング分解能が大幅に改善されており、一部のシステムでは210ピコ秒(2.1×10−10秒)という低い値もテストされている。これにより、数センチメートルまでの局所化が可能になる。これ自体では消滅イベントの位置を適切に特定するほど正確ではないが、この情報を反復再構成アルゴリズムに組み込むことで、再構成画像の信号対雑音比が大幅に改善される。
画像の定量化と画質に影響を与える要因
光子の放出とそれに続く検出に関する上記の記述は、光子の100%が生体組織を何ら相互作用することなく通過し、検出器に衝突する光子や同時発生ペアの100%が完全に検出されたカウントに変換されると仮定している点で理想化されています。しかし実際には、光子と組織の間には相互作用があり、LOR(Line of Response)は実際には線ではなく、中心部の方が端に向かうよりも検出確率が高い3次元の柱であり、電子機器はその時間分解能とエネルギー分解能に有限の限界があります。これらの要因などが、全体的な画質と空間分解能を低下させ、中には再構成段階の前に補正処理を適用する必要があるほど深刻なものもあります。
光子の減衰
放射性崩壊からの光子の多くは組織を妨げられることなく通過しますが、その一部はそうではありません。PETやSPECTの同位体から放出されるエネルギー範囲のガンマ線や、生体組織のような物質の場合、相互作用の大部分はコンプトン散乱によるものです。これは、光子が原子と衝突して元の経路から偏向し、そのエネルギーの一部が原子の軌道電子に吸収される現象です。まれに、光子が衝突で完全に吸収され、原子が電子を放出することもあり、このプロセスは光電効果と呼ばれます。これらの相互作用による検出光子の減少は減衰と呼ばれます。
減衰の確率は、ガンマ線エネルギーの増加とともに減少し、光子源と検出器の間の介在物質の密度と厚さの増加とともに増加します。軟組織のような特定の物質の場合、光子が減衰せずに通過する確率は、光子が放出される組織の深さの指数関数として表されます。この確率はe−μdに比例し、ここでdはセンチメートル単位の深さ、μはcm−1単位の物質の線減衰係数です。空気中の減衰はほぼゼロであるため、減衰の要因は組織の厚さのみであり、検出器までの全距離は関係ありません。線係数μは、光子のエネルギーと、光子が通過している物質の性質の両方の関数です。μが大きいほど減衰は大きくなります。
PET光子はSPECT光子よりもエネルギーが高いため、減衰は少なくなります。例えば、511 keV光子の場合、水中のμは0.097 cm−1であるのに対し、150 keV光子の場合、約0.15 cm−1であり、軟組織中のμは水中のμと類似しています。減衰補正なしでは、組織の深部に位置するボクセルは、同じ放射性トレーサー濃度を持つ表面に近いボクセルよりも検出カウントが低くなります。したがって、減衰補正は定量的イメージングにおいて必要なステップです。
PETが同時検出を利用するという事実は、非常に正確な減衰補正を可能にします。これは、消滅からのいずれかの光子が減衰しない確率は、もう一方が減衰するかどうかに独立しており、したがって両方の光子が減衰しない確率はそれらの確率の積となるためです。これはe−μd1e−μd2=e−μ(d1+d2)に比例し、LORによって通過される組織の全長d1+d2のみに依存し、消滅イベントが発生するLOR内の位置には依存しません(図1.27-7)。PETにおける減衰補正は通常、再構成前にシナグラムに適用され、各LORの値を、透過スキャンと呼ばれる別のスキャンで測定された補正係数で乗算します。専用PETシステムでは、これは通常、既知の放射能を持つ陽電子放出物質の点線源または複数の点線源を含むロッドを測定対象物(被験者の頭部)の周りを回転させ、反対側で検出された放射能の割合を記録することによって行われます。ハイブリッドPET-CTおよびPET-MRスキャナでは異なるアプローチが必要となります(後述)。SPECTのような単一光子検出では、他の戦略を用いる必要があります。透過線源を使用して減衰を測定するためのいくつかの洗練されたアルゴリズムがSPECTへの応用のために考案されていますが、一様減衰補正が最も頻繁に適用されます。このアプローチでは、水の補正係数に等しいボクセル値を持つ楕円形オブジェクトの画像が再構成されたSPECT画像に位置合わせされ、2つの画像の値をボクセルごとに乗算します。
光子の散乱
コンプトン散乱光子は組織に完全に吸収されるのではなく、その軌道を変え、エネルギーを減少させて進みます。変化の方向はランダムであり、偏向角が増加するにつれてエネルギーの減少は増加します。
PETイメージングでは、散乱光子とそのパートナーは同時計数時間窓内で2つの検出器に到達し、したがって消滅イベントは真の位置を通過しないLORに誤って帰属されます。SPECTイメージングでは、光子は散乱方向で散乱イベントの位置からLORに沿って放出される光子として誤って読み取られます。
どちらのモダリティでも、検出器回路は光子エネルギーを識別し、低エネルギー光子をある程度拒否できます。しかし、受け入れられるエネルギー範囲と散乱光子のエネルギーの間には十分な重なりがあり、多くの散乱光子が真の崩壊イベントとしてカウントされます。散乱は真の放射性トレーサー分布とは無関係なランダムノイズを加え、補正されない場合、画質を著しく低下させます。
多くの散乱補正方法が提案され、実装されています。最新のスキャナには、透過画像から生成された減衰マップからの情報を利用して散乱分布の確率モデルを作成する洗練されたソフトウェアアルゴリズムが組み込まれており、これらは再構成前にシナグラムデータから差し引かれます。
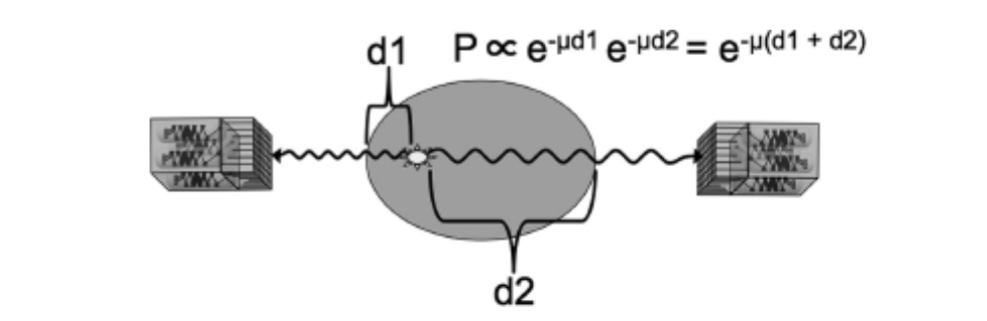
FIGURE 1.27-7. 減衰
中央の楕円は、視野内にある架空の対象物(例えば、頭部)を表しています。SPECT(Single Photon Emission Computed Tomography)では、左へ向かう光子は減衰しない確率がe−μd1に比例し、右へ向かう光子は減衰しない確率がe−μd2に比例します。一方、PET(Positron Emission Tomography)では、このLOR(Line of Response)に沿った同時計数イベントが減衰しない確率は、そのイベントがLOR上のどこで発生したかにかかわらず、e−μ(d1+d2)に比例します。
PETにおける偶発的同時計数
PETに特有の追加ノイズ源として、偶発的(またはランダム)同時計数が挙げられます。これは、異なる消滅イベントから放出された2つの光子が、たまたま同じ同時計数時間窓内に2つの検出器に到達し、その2つの検出器を結ぶLORに沿った消滅イベントとして誤ってカウントされることで生じます。
偶発的同時計数は視野全体に均一に分布し、背景活動レベルの上昇というアーチファクトを引き起こします。この上昇は、シングルス率(個々の光子が検出される率)の約2乗に比例します。散乱と同様に、偶発的同時計数は適切に処理されない場合、画質を著しく低下させます。
ほとんどのスキャナーは、遅延同時計数時間チャネルという電子回路を備えています。これは、同時計数時間窓よりも数ナノ秒以上離れて到達した光子ペアを意図的に同時計数イベントとしてカウントすることで、偶発的同時数を推定するものです。これらの光子は、同じ消滅イベントから発生したものではないことが既知です。推定された偶発的同時計数は、他の処理の前にシナグラムデータから差し引かれます。真の活動がまったくない、あるいは非常に低い視野の領域では、このステップにより見かけ上の負のカウントが生じることがあります。
空間分解能
すべての画像システムは、それぞれ固有の空間分解能と、区別できる最小のオブジェクト寸法の指標を持っています。PETおよびSPECTシステムにおける分解能は、スキャナーの物理的特性によって制限されます。例えば、LORの有限の幅(無限に細い線ではないこと)や、投影データがすべての角度と長さの連続値ではなく、限られた数の角度と、各角度における原点からの距離で測定されるという事実などです。
PETに特有の分解能制限要因としては、陽電子の飛程(陽電子が消滅するまでに移動する距離)と、消滅イベントが崩壊サイトから半径1〜2 mmの球状の範囲内にしか局所化されないこと、そして放出される光子間の角度が厳密に180度ではないことなどが挙げられます。SPECTの分解能は、コリメーターの設計と、撮像されるオブジェクトとコリメーターとの距離によって制限されます。
画像システムの分解能は、標準的な形状の放射性線源を撮像し、画像の精度を特性評価することによって経験的に測定されます。視野内に小さな点線源または細い線線源を配置すると、再構成された画像は、その点または線の周囲に鐘型の曲線(**点広がり関数(PSF)または線広がり関数(LSF)と呼ばれる)に広がります。分解能は通常、PSFの半値幅(FWHM)**として報告されます。これは、PSFの値がその最大中央値の半分になる2点間の長さ(ミリメートル単位)です(図1.27-8)。
PSFとFWHMは通常、視野全体で一定ではありません。位置によってわずかに変化しますが、通常は平均値として報告されます。これらは適用される画像再構成方法にも依存します。性能評価レポートは通常、スキャナー間やレポート間の比較を容易にするために、標準化された方法を使用して実施されます。
ほとんどの最新の市販PETスキャナーのFWHMは4〜5 mmの範囲です。一部の特殊なPETスキャナーでは2〜3 mmの範囲です。SPECTの分解能は使用するコリメーターシステムに依存します。臨床で使用される回転ヘッド式SPECTスキャナーのFWHMは10〜12 mmの範囲です。動物とコリメーターの近接性を利用し、特殊なコリメーター設計を使用できる特殊な小動物用SPECTスキャナーでは、ミリメートル以下のFWHMが得られることもあります。
画像は通常、チェッカーボード状やピクセル化した外観を避けるために、FWHMよりも小さいボクセル寸法で再構成されます。結果として、各ボクセルは隣接するボクセルからの重なり合った情報を含みます。
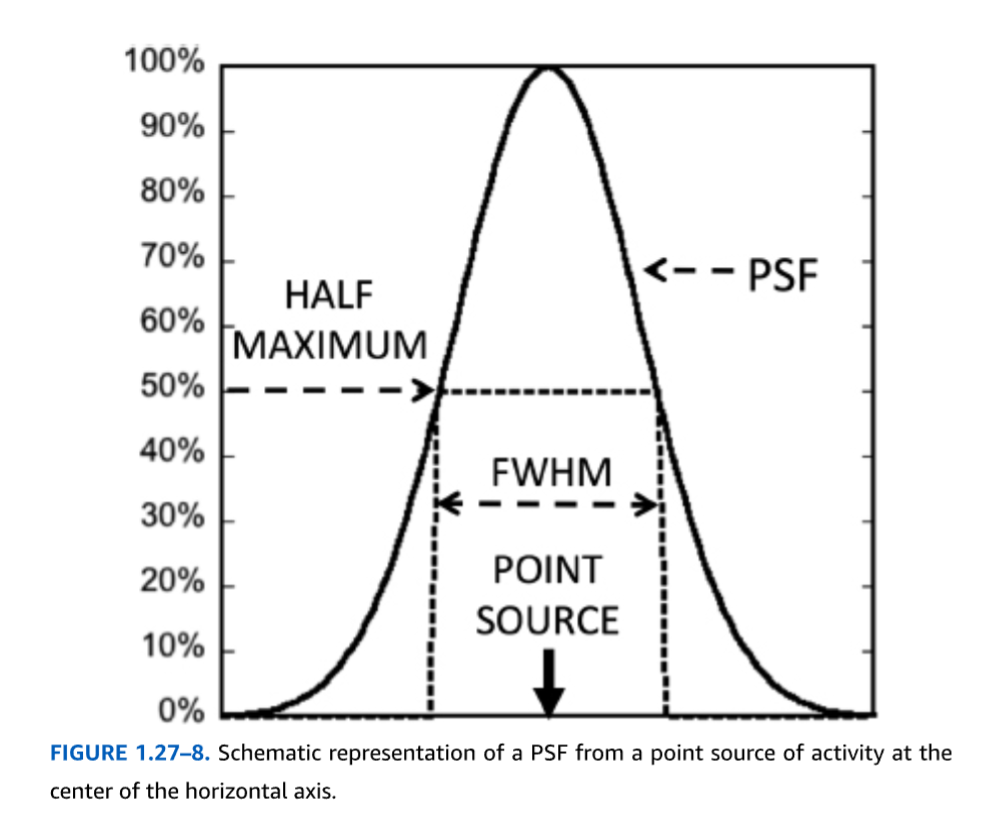
FIGURE 1.27-8. 水平軸の中心にある放射能点線源からのPSFの概略図。
ハイブリッドイメージングシステム
2000年以降、スキャナメーカーは、PETまたはSPECTコンポーネントと、CTや磁気共鳴(MR)などの追加のイメージングシステムを組み合わせたマルチモダリティスキャナの製造を開始した。実際、ヒトの画像診断専用PETシステムはますます稀になり、最近製造されたシステムの大部分はCTコンポーネントを含んでいる。ハイブリッドPET-MRスキャナも一般的になりつつあり、すべての主要メーカーが現在、臨床用途のシステムを製造している。これらのシステムを使用するために必要な適応と、神経画像診断の文脈で得られる情報を拡大するそれらの可能性について簡単に説明する。
PET-CTおよびSPECT-CT。CTシステムはPETまたはSPECTシステムと同じ軸上に搭載されている。CTと放射性核種イメージングは同時にではなく、連続して実行される。これは、2つのシステムのイメージング検出器の位置が異なるためである。患者の2つのモダリティの位置間の距離が正確にわかっており、放射性トレーサー画像からの神経化学情報を、より解剖学的に正確な高分解能CT画像に重ね合わせる画像融合に使用できるため、画像の非常に正確な位置合わせが可能である。臓器はCT画像では容易に識別できるが、PETやSPECT画像では識別できないため、これは胸部や腹部の画像診断において非常に価値があることが証明されている。CT画像は軟組織の種類を区別しないため、脳画像診断においてはその価値は低い。一方、MRI画像は灰白質、白質、CSFを区別するため、MRIは解剖学的コヒーレント登録と構造識別のための好ましいモダリティである。神経画像診断研究では、MRI画像は別セッションで取得され、コヒーレント登録はソフトウェアメソッドによって実行されることが多い。PET-CTおよびSPECT-CTシステムは、CTスキャンを減衰補正のための透過スキャンとして利用する。この利用の利点は、CT画像で得られる高い信号対雑音比である。CTスキャナからの光子は、約40〜140 keVの比較的広範囲のエネルギー スペクトルにわたるX線である。これらはPETまたはSPECTからの高エネルギー光子とは異なる(高い)減衰を持ち、それらのμ値を他のモダリティに適した値に変換するためにルックアップテーブル法を使用する必要がある。
PET-MR。PET-CTとは異なり、PETとMRIコンポーネントは同心円状であり、画像は同時に取得される。全身画像診断の場合、主な利点は、CTによる追加の放射線被ばくなしで解剖学的画像を取得できることと、全体の画像診断時間を短縮できることである。神経画像診断の場合、MRからの解剖学的情報に加えて、灌流イメージング、磁気共鳴スペクトロメトリー、またはBOLD fMRIなどの他のMR技術を同時に利用できる可能性があり、単一の画像診断セッションで得られる実験情報を大幅に拡大する。進行中の技術的課題は減衰補正である。同心円状のスキャナリング設計と両モダリティのコンポーネントの現在のサイズにより、従来の透過スキャンに使用される放射能のロッドまたは点線源を含めることができない。一方、MRI画像は脳組織に関する非常に正確な解剖学的情報を提供するが、高エネルギー光子の減衰に関する直接的な情報は提供しない。さらに、頭蓋骨や、患者のベッドやMRI RFコイル(MR視野外にある)など、PET視野内の光子を減衰させる他の材料はMRIでは検出されない(頭蓋骨は特殊な高速エコーRFパルスシーケンスを使用して検出でき、メーカーはこれらをソフトウェアに含み始めている)。脳画像診断の現在の方法は、取得したMRI画像を標準アトラスに位置合わせし、ルックアップテーブルから標準化されたμ値を使用することである。各ボクセルが標準化されたμ値を持つ組織タイプに割り当てられる脂肪/水組織セグメンテーションアルゴリズムのような、他のより単純な方法も全身スキャンに十分であることが証明されている。過去10年間で多くの進歩があったが、PET-MRにおける減衰補正は活発な研究分野のままであり、技術の成熟と関心の高まりとともに改善と洗練が期待される。
安全性
放射線被ばくと内部被ばく線量測定
放射性崩壊は、陽電子、電子、または光子が組織内の分子と相互作用するときに、組織内にエネルギーを沈着させます。PETおよびSPECT研究の被験者が曝露される放射線の種類と量は、急性効果を引き起こす可能性は非常に低いですが、長期的な影響や遺伝子損傷の可能性については十分に解明されていません。
リスク/ベネフィットの考慮に基づき、政府や国際的な諮問機関は、研究被験者への被ばく線量制限に関するガイドラインや規制を提案しています。これらは、線形非閾値モデルに基づいており、はるかに高い曝露レベルで質的に異なる放射線で観察された結果が、PETおよびSPECT研究で研究被験者が曝露されるレベルに外挿できると仮定しています。この仮定の妥当性については、放射線生物学者の間で現在のところコンセンサスはありませんが、明確なデータがないため、保守的なアプローチが採用されています。
米国では、研究被験者への最大放射線被ばく量を制限するFDA(食品医薬品局)の規制があります。他の国では、**国際放射線防護委員会(ICRP)**の勧告に従っています。
体内の任意の臓器または部分に沈着するエネルギーの量は、組織の種類、臓器の形状、同位体、および放射性トレーサーの体内分布によって複雑に変化します。放射性トレーサーに伴う推定放射線被ばく量は、数学モデル、コンピューターシミュレーション、およびテストスキャンを組み合わせて決定されることが多く、これらは総称して内部被ばく線量測定研究として知られています。
放射性標識の体内分布は、トレーサーの代謝およびクリアランスによって放射性トレーサーごとに異なり、これは少数のヒト被験者または動物において全身スキャンを取得し、種間のサイズの違いを考慮するためのスケーリング係数を適用することによって経験的に決定されます。臓器の放射線量は、臓器自体で発生する崩壊によるエネルギーと、体の他の部分で発生する崩壊イベントから臓器に沈着するエネルギーの重み付けされた合計として計算されます。
吸収線量の単位は**グレイ(Gy、ジュール/kg組織)**です。古い単位は放射線吸収線量(rad、1rad=0.01Gy)です。被ばく量は通常、注入された放射能量あたりの吸収線量として、mGy/MBq(1mGy=10−3Gy)またはrad/mCiなどで報告されます。
ICRPガイドラインでは、吸収線量は放射線の種類を考慮した追加の品質係数で乗算され、異なる単位になります(このガイドラインは、PETおよびSPECTで使用されるものよりも損傷性の高い種類の放射線に職業的に曝露される作業者にも適用されます)。品質係数を乗じた後、Gyは**シーベルト(Sv)と呼ばれる単位に、radはレントゲン当量(rem)**になります。ただし、PETおよびSPECT同位体からの放射線の種類の場合、品質係数はすべて1に等しいため、Svは数値的にGyと等価であり、remは数値的にradと等価です。
すべての臓器から発生する活動の寄与の合計として各臓器への放射線量を計算するために使用される重み付け係数は、さまざまなサイズ、年齢、性別のヒトの数学モデルにおける臓器の形状、サイズ、組成、および他の臓器からの距離を考慮した詳細なコンピューターシミュレーションによって生成された表から導き出されます。
FDA規制は重要臓器の概念に基づいており、1回の研究あたりの許容される総放射線量は、最も被ばく量の多い単一臓器への吸収線量によって制限されます。ICRPガイドラインは、所定の臓器セットへの線量の重み付け平均に基づいています。これらのガイドラインは複数回改訂されており、重み付けされた合計の名称と定義も変更されています。名称はやや紛らわしいほど類似していますが(線量当量、実効線量、等価線量、実効線量当量など)、ICRP Publication 103(2007年)の標準は、28の指定された臓器および組織からの吸収線量の重み付け合計に等しい**実効線量(ED、Sv)**です。
正確な線量制限はトレーサーごとに異なりますが、ほとんどの放射性トレーサーでは、許容される被ばく範囲内であれば、1回の研究で被験者あたり複数のスキャンを実行できます。
薬理学的毒性
ヒトの研究被験者に投与される化合物は、承認される前に広範な毒性スクリーニングを受けなければなりません。研究被験者に通常投与される低質量用量(数μg以下)は、生理学的効果が認められるレベルよりも数桁低い用量に保たれます。
これは、神経受容体拮抗薬である放射性トレーサーの場合に特に当てはまります。トレーサー用量では、これらの薬剤は受容体の数パーセントを最大限に占有するにすぎず、神経伝達に薬理学的効果をもたらすために必要な量よりもはるかに少ない量です。
一方、一部のアゴニスト放射性トレーサーは、非常に低い質量用量であっても薬理学的反応を引き起こすことが知られています。2つの例として、μ-オピオイドアゴニストの**[11C]カルフェンタニルがあり、これはμg用量で鎮静と換気低下を引き起こす可能性があります。また、ドーパミンD2/D3受容体アゴニストの[11C]-(+)-PHNO**は、急速静脈内注射後数分で一過性の悪心を引き起こすことがあります。
薬物動態モデルと手法、実験デザイン
全体的枠組みとコンパートメントモデル
ここまで、PETやSPECT画像を生成するために使用される物理理論、画像処理技術、およびアルゴリズムの一部を説明しました。実験者の視点から見ると、これらのすべての要素は、定量的な神経画像診断を可能にする画像データの重要な特性につながります。それは、画像内の各空間位置において、測定された活動量がその位置のトレーサー濃度に比例するという点です。
これらの測定量は、数千ボクセルもの大きさから単一ボクセルまで、明確に定義された脳の関心領域における平均活動量として抽出できます。その後、画像データは観測された生物学的プロセスの数学モデルに統計的に適合され、そのプロセスを定量的に特徴付けるためのパラメータ推定値を導き出すことができます。
画像データは、スキャン後10〜20分で得られるトレーサー分布の単一の静的スナップショットから、数時間にわたるトレーサーの動態プロファイルを記録する連続的な動態画像まで多岐にわたります。数学モデルも、異なる組織における放射性トレーサー濃度の比率を単純に測定するものから、脳内の放射性トレーサー濃度の薬物動態プロファイルと、同じ期間に脳画像と並行して採取された動脈血漿中の濃度との関係を詳細な微分方程式モデルで記述するものまで様々です。
放射性トレーサーは血流から脳に入り込みます。最も包括的なモデルは、**BBB(血液脳関門)**を横切る輸送の方程式と、脳組織における関心のある生物学的プロセスと放射性トレーサーの相互作用に関する方程式を組み合わせたものです。適切な条件が満たされれば、これらのモデルからより単純なモデルを導き出すことも可能です。輸送方程式は通常、フィックの原理に基づいており、BBBを横切る純流入または流出速度が脳組織と血液中の放射性トレーサー濃度の勾配に比例するとされます。
生物学的プロセスのモデルは、放射性トレーサーが標的分子に可逆的に結合するリガンドであるか、代謝経路の基質であり、ある段階で不可逆的に捕捉されるかによって大まかに分類できます。可逆的および不可逆的なケースを網羅する一般的で柔軟な枠組みがコンパートメントモデルです(図1.27-9)。
コンパートメントモデルは、放射性トレーサーの動態を単純な一連の規則で記述します。ここでは、放射性トレーサーの状態がボックスとして描かれたコンパートメントとして表され、状態の変化は、コンパートメント間の許容される流れの方向を示す矢印で示される、コンパートメント間の流れとして表されます。この流れの速度は、供給元コンパートメント内のトレーサー濃度に比例します。
コンパートメント図に対応して、速度を記述する微分方程式系があります。関連する生物学的または薬物動態学的情報を含む結果測定値は、速度定数の関数として形成されます。速度定数は未知のパラメータであり、モデルを測定されたPETまたはSPECTデータに最適に適合させるコンピューターベースのデータ適合手順を使用して推定されます。
最適適合の最も一般的な基準は最小二乗最小化です。この方法では、プログラムは速度定数のすべての妥当な範囲を探索し、スキャン中に連続する時間点における離散的な「フレーム」として記録された測定データと、これらの時間点におけるモデル予測との間の二乗差の合計を最小化するものを発見します。ただし、従来の最小二乗アプローチに加えて、多くのデータ適合およびパラメータ抽出手順が使用されています。

薬物動態モデルと手法、実験デザイン
FIGURE 1.27-9. コンパートメントモデルの数式の一部
可逆性および非可逆性2TCモデルの概念をボックス(左図)で示しています。中央の列は、関連する微分方程式を示しています。これらの式は、コンパートメントの全体的な変化率が、すべての供給元コンパートメント(矢印が流入するコンパートメント)の濃度の重み付けされた合計から、そのコンパートメントが可逆性の場合(矢印が流出するコンパートメント)は、そのコンパートメント自体の濃度の重み付けされた合計を差し引いたものであるという単純なルールに基づいて導かれます。重みは、K1、k2、k3、k4とラベル付けされた速度定数です。右の列は結果測定値を示しています。可逆性トレーサーの場合、すべての結果測定値は濃度の平衡比です。これらは平衡比であるため、各コンパートメントの変化率(中央列の式左辺)は0となり、濃度比は速度定数の関数として導き出すことができます。非可逆性モデルの場合、CPREの定常状態表現は同様の方法で導き出すことができ、CMの蓄積率に関する微分方程式に代入すると、Kinの速度定数表現が得られます。
可逆性モデル
可逆性結合トレーサーは、脳内の受容体、トランスポーター、酵素、またはその他のタンパク質の密度を定量化するためによく用いられます。これらのトレーサーは放射性リガンドとも呼ばれます。可逆性放射性リガンド結合のプロセスは、放射性リガンドと標的タンパク質との二分子会合、および標的-リガンド複合体の単分子解離としてモデル化されます。このプロセスの微分方程式は質量作用の法則に基づいています。可逆性放射性リガンドに適用される標準的なコンパートメントモデルは、**二組織コンパートメントモデル(2TC)**です(図1.27-9)。
2TCモデルは、モデルへの入力として、スキャン中に動脈血漿中の放射性トレーサー濃度を測定することを要求します。これは、動脈カテーテル留置が必要であり、末梢で形成されスキャン中に血液中に蓄積する放射性標識代謝物ではなく、未代謝放射性リガンドによる血液中の放射能の割合を推定するためにクロマトグラフィーの適用が必要となるため、侵襲的であり、技術的に要求が厳しいです。一部の放射性トレーサーでは、動脈血漿入力関数を必要としない関連パラメータの推定方法がありますが、これらでさえしばしば2TCから概念的に導き出されており、可逆性トレーサーのモデルにおけるその中心的役割を強調しています。
2TCには2つの主要な単純化仮定があります。放射性リガンドがBBB(血液脳関門)を通過すると、最初は遊離状態、つまり非結合状態にあります。遊離状態からは、結合するように設計された標的タンパク質と特異的に結合することも、膜に非特異的に緩く結合することもできます。特異的結合は、その結合が飽和性(リガンド濃度がどれほど高くても利用可能な標的タンパク質の濃度を超えることはできない)であり、同じ部位に結合する他のリガンドによって置換可能であるという特性によって特徴付けられます。反対に、非特異的結合は飽和性がなく、置換可能ではありません。また、特異的結合プロセスの速度と比較して、遊離および非特異的に結合した放射性トレーサーは迅速に平衡に達します。
最初の単純化仮定は、この平衡が瞬時に起こるため、遊離および非特異的に結合した放射性トレーサーが非置換性コンパートメントと呼ばれる単一のコンパートメントに結合されるというものです。この非置換性コンパートメント内のトレーサー濃度はCNDと表記されます。CNDの遊離画分のみがfNDと表記され、標的分子に特異的に結合することができます。結合状態は特異的結合コンパートメント(CS)です。
2番目の単純化はトレーサー用量近似と呼ばれます。質量作用の法則の二分子会合項には、非結合標的タンパク質濃度と遊離放射性トレーサー濃度の積が含まれます。トレーサー用量近似は、放射性リガンド濃度が非常に低く、標的のせいぜい数パーセントしか結合しないため、標的濃度は一定であるかのように扱えるというものです。トレーサー用量近似の条件を満たすためには、通常数マイクログラム以下の非常に低い質量の放射性リガンドが注入されます。これはまた、放射性トレーサーが研究対象のシステムを薬理学的に撹乱する可能性を制限します。理論上、これらの単純化を含まないモデルも形成できます。遊離および非特異的に結合したトレーサーを別々のコンパートメントとして扱い、トレーサー用量仮定なしの完全な質量作用の法則の式を実装することも可能ですが、経験上、2TCモデルが最も包括的であり、信頼性の高いパラメータ推定のために十分な堅牢性と安定性を持つことが証明されています。
2つのコンパートメント、すなわち非置換性コンパートメント(CND)と特異的結合コンパートメント(CS)は、同じボクセル内で同時に発生しており、画像内で分離することはできません。それらの合計、すなわち総濃度(CT=CND+CS)のみが観測可能であり、CNDとCSの関係はモデルを介して推測されなければなりません。動脈血漿中の放射性トレーサー濃度はCpと表記されます。
2TCモデルから導き出される関連する結果測定値には、主に2つのタイプがあります。これらは分布容積と結合能です。これらは、トレーサー用量条件下での放射性トレーサー濃度の平衡比を表しますが(図1.27-9)、平衡条件下で推定されることは稀です。むしろ、通常は放射性トレーサーのボーラス注射後に取得された動態スキャンデータから、推定された速度定数の関数として導き出されます。分布容積と速度定数の間の導出された関係につながる数式の一部は、図1.27-9の凡例でより詳細に提供されています。
分布容積は、コンパートメント内のトレーサー濃度と動脈血漿中のトレーサー濃度との間の平衡比を表します。2TCモデルの場合、関連する分布容積は3つあります。非置換性コンパートメントの分布容積VND=CND/Cp、特異的結合コンパートメントの分布容積VS=CS/Cp、そして総分布容積VT=VND+VSです。
結合能は、平衡状態での特異的結合放射性トレーサーと遊離放射性トレーサーの比率に比例するパラメータです。自由濃度を近似する方法の違いにより、比例定数の異なるいくつかの形式の結合能が存在しますが、PETおよびSPECT研究で頻繁に報告されるバージョンは、BP$_{ND}$と表記される非置換性結合能であり、これは平衡状態でのCS/CNDの比率を指します。分布容積の定義から、BP$_{ND}$はVS/VNDに等しいことがわかります。
生理学的に、BP$_{ND}$はfNDBMAX/KDに相当します。ここで、BMAX(nM)は標的タンパク質の濃度です。受容体研究では、内因性神経伝達物質によるベースライン受容体占有や、細胞表面と細胞質間の受容体輸送などの現象により、総濃度BMAXの一部が放射性トレーサーに結合できない可能性があるという事実を強調するために、これをBAVAILとして報告します。KD(nM)は平衡解離定数(親和性の逆数)です。平衡定義CS/CNDから、BP$_{ND}$は、最も関心のある量である特異的結合と、非特異的結合を含む実質的に妨害変数である非置換性濃度との比率であることが明らかです。このため、BP$_{ND}$は信号対バックグラウンド比と見なされることがあります。
Cpが測定される研究では、VTはすべての脳領域で推定できます。非置換性結合能(BP$_{ND}$)は、標的タンパク質濃度が無視できる脳領域である参照組織がある場合に、2TCモデルを使用して推定できます(図1.27-10)。参照組織では、VT=VNDです。すべてのコンパートメントモデルに適用される追加の仮定で、実験誤差の範囲内でデータによって十分に裏付けられているのは、VNDがすべての脳組織で同じであるため、参照組織におけるVTが脳全体のVNDの推定値を提供するというものです(図1.27-10)。
理論的には、BP$_{ND}$は2TCモデルにおける速度定数k3/k4の比率に等しいです。しかし実際には、実際のデータに統計的曲線適合を適用する際、これはBP$_{ND}$を決定する信頼できる方法ではありません。個々の速度定数とその比率は識別性の悪さに苦しみます。つまり、多くの異なる速度定数の組み合わせが同じデータにうまく適合してしまうのです。
一方、VTは識別可能であり、すべての脳領域でBP$_{ND}を推定するためのより堅牢な方法は、分布容積を介して[$V$_T$(領域) – V$_T$(参照組織)] / V$_T$(参照組織)$ とする方法です。また、参照組織がある場合、動脈血漿濃度Cpを方程式から排除し、標的が豊富な脳領域と参照組織の関係からBP$_{ND}$を直接推定する数学モデルもあります。これらにより、動脈血サンプルの必要なくBP$_{ND}$を推定できます。
(BP$_{ND}$ などは理解しにくいが、このまま)
薬物動態モデルと手法、実験デザイン
FIGURE 1.27-9. コンパートメントモデルの数式の一部
可逆性および非可逆性2TCモデルの概念をボックス(左図)で示しています。中央の列は、関連する微分方程式を示しています。これらの式は、コンパートメントの全体的な変化率が、すべての供給元コンパートメント(矢印が流入するコンパートメント)の濃度の重み付けされた合計から、そのコンパートメントが可逆性の場合(矢印が流出するコンパートメント)は、そのコンパートメント自体の濃度の重み付けされた合計を差し引いたものであるという単純なルールに基づいて導かれます。重みは、K1、k2、k3、k4とラベル付けされた速度定数です。右の列は結果測定値を示しています。可逆性トレーサーの場合、すべての結果測定値は濃度の平衡比です。これらは平衡比であるため、各コンパートメントの変化率(中央列の式左辺)は0となり、濃度比は速度定数の関数として導き出すことができます。非可逆性モデルの場合、CPREの定常状態表現は同様の方法で導き出すことができ、CMの蓄積率に関する微分方程式に代入すると、Kinの速度定数表現が得られます。
可逆性モデル
可逆性結合トレーサーは、脳内の受容体、トランスポーター、酵素、またはその他のタンパク質の密度を定量化するためによく用いられます。これらのトレーサーは放射性リガンドとも呼ばれます。可逆性放射性リガンド結合のプロセスは、放射性リガンドと標的タンパク質との二分子会合、および標的-リガンド複合体の単分子解離としてモデル化されます。このプロセスの微分方程式は質量作用の法則に基づいています。可逆性放射性リガンドに適用される標準的なコンパートメントモデルは、**二組織コンパートメントモデル(2TC)**です(図1.27-9)。
2TCモデルは、モデルへの入力として、スキャン中に動脈血漿中の放射性トレーサー濃度を測定することを要求します。これは、動脈カテーテル留置が必要であり、末梢で形成されスキャン中に血液中に蓄積する放射性標識代謝物ではなく、未代謝放射性リガンドによる血液中の放射能の割合を推定するためにクロマトグラフィーの適用が必要となるため、侵襲的であり、技術的に要求が厳しいです。一部の放射性トレーサーでは、動脈血漿入力関数を必要としない関連パラメータの推定方法がありますが、これらでさえしばしば2TCから概念的に導き出されており、可逆性トレーサーのモデルにおけるその中心的役割を強調しています。
2TCには2つの主要な単純化仮定があります。放射性リガンドがBBB(血液脳関門)を通過すると、最初は遊離状態、つまり非結合状態にあります。遊離状態からは、結合するように設計された標的タンパク質と特異的に結合することも、膜に非特異的に緩く結合することもできます。特異的結合は、その結合が飽和性(リガンド濃度がどれほど高くても利用可能な標的タンパク質の濃度を超えることはできない)であり、同じ部位に結合する他のリガンドによって置換可能であるという特性によって特徴付けられます。反対に、非特異的結合は飽和性がなく、置換可能ではありません。また、特異的結合プロセスの速度と比較して、遊離および非特異的に結合した放射性トレーサーは迅速に平衡に達します。
最初の単純化仮定は、この平衡が瞬時に起こるため、遊離および非特異的に結合した放射性トレーサーが非置換性コンパートメントと呼ばれる単一のコンパートメントに結合されるというものです。この非置換性コンパートメント内のトレーサー濃度はCNDと表記されます。CNDの遊離画分のみがfNDと表記され、標的分子に特異的に結合することができます。結合状態は特異的結合コンパートメント(CS)です。
2番目の単純化はトレーサー用量近似と呼ばれます。質量作用の法則の二分子会合項には、非結合標的タンパク質濃度と遊離放射性トレーサー濃度の積が含まれます。トレーサー用量近似は、放射性リガンド濃度が非常に低く、標的のせいぜい数パーセントしか結合しないため、標的濃度は一定であるかのように扱えるというものです。トレーサー用量近似の条件を満たすためには、通常数マイクログラム以下の非常に低い質量の放射性リガンドが注入されます。これはまた、放射性トレーサーが研究対象のシステムを薬理学的に撹乱する可能性を制限します。理論上、これらの単純化を含まないモデルも形成できます。遊離および非特異的に結合したトレーサーを別々のコンパートメントとして扱い、トレーサー用量仮定なしの完全な質量作用の法則の式を実装することも可能ですが、経験上、2TCモデルが最も包括的であり、信頼性の高いパラメータ推定のために十分な堅牢性と安定性を持つことが証明されています。
2つのコンパートメント、すなわち非置換性コンパートメント(CND)と特異的結合コンパートメント(CS)は、同じボクセル内で同時に発生しており、画像内で分離することはできません。それらの合計、すなわち総濃度(CT=CND+CS)のみが観測可能であり、CNDとCSの関係はモデルを介して推測されなければなりません。動脈血漿中の放射性トレーサー濃度はCpと表記されます。
2TCモデルから導き出される関連する結果測定値には、主に2つのタイプがあります。これらは分布容積と結合能です。これらは、トレーサー用量条件下での放射性トレーサー濃度の平衡比を表しますが(図1.27-9)、平衡条件下で推定されることは稀です。むしろ、通常は放射性トレーサーのボーラス注射後に取得された動態スキャンデータから、推定された速度定数の関数として導き出されます。分布容積と速度定数の間の導出された関係につながる数式の一部は、図1.27-9の凡例でより詳細に提供されています。
分布容積は、コンパートメント内のトレーサー濃度と動脈血漿中のトレーサー濃度との間の平衡比を表します。2TCモデルの場合、関連する分布容積は3つあります。非置換性コンパートメントの分布容積VND=CND/Cp、特異的結合コンパートメントの分布容積VS=CS/Cp、そして総分布容積VT=VND+VSです。
結合能は、平衡状態での特異的結合放射性トレーサーと遊離放射性トレーサーの比率に比例するパラメータです。自由濃度を近似する方法の違いにより、比例定数の異なるいくつかの形式の結合能が存在しますが、PETおよびSPECT研究で頻繁に報告されるバージョンは、**非置換性結合能(BP$_{ND}$)**であり、これは平衡状態での特異的結合コンパートメント濃度(CS)と非置換性コンパートメント濃度(CND)の比率(CS/CND)を表します。分布容積の定義から、非置換性結合能(BP$_{ND}$)はVS/VNDに等しいことがわかります。
生理学的に、非置換性結合能(BP$_{ND}$)はfNDBMAX/KDに相当します。ここで、BMAX(nM)は標的タンパク質の濃度です。受容体研究では、内因性神経伝達物質によるベースライン受容体占有や、細胞表面と細胞質間の受容体輸送などの現象により、総濃度BMAXの一部が放射性トレーサーに結合できない可能性があるという事実を強調するために、これをBAVAILとして報告します。KD(nM)は平衡解離定数(親和性の逆数)です。平衡定義CS/CNDから、非置換性結合能(BP$_{ND}$)は、最も関心のある量である特異的結合と、非特異的結合を含む実質的に妨害変数である非置換性濃度との比率であることが明らかです。このため、非置換性結合能(BP$_{ND}$)は信号対バックグラウンド比と見なされることがあります。
Cpが測定される研究では、VTはすべての脳領域で推定できます。非置換性結合能(BP$_{ND}$)は、標的タンパク質濃度が無視できる脳領域である参照組織がある場合に、2TCモデルを使用して推定できます(図1.27-10)。参照組織では、VT=VNDです。すべてのコンパートメントモデルに適用される追加の仮定で、実験誤差の範囲内でデータによって十分に裏付けられているのは、VNDがすべての脳組織で同じであるため、参照組織におけるVTが脳全体のVNDの推定値を提供するというものです(図1.27-10)。
理論的には、非置換性結合能(BP$_{ND}$)は2TCモデルにおける速度定数k3/k4の比率に等しいです。しかし実際には、実際のデータに統計的曲線適合を適用する際、これは非置換性結合能(BP$_{ND}$)を決定する信頼できる方法ではありません。個々の速度定数とその比率は識別性の悪さに苦しみます。つまり、多くの異なる速度定数の組み合わせが同じデータにうまく適合してしまうのです。
一方、VTは識別可能であり、すべての脳領域で非置換性結合能(BP$_{ND})を推定するためのより堅牢な方法は、分布容積を介して[$V$_T$(領域) – V$_T$(参照組織)] / V$_T$(参照組織)$ とする方法です。また、参照組織がある場合、動脈血漿濃度Cpを方程式から排除し、標的が豊富な脳領域と参照組織の関係から非置換性結合能(BP$_{ND}$)を直接推定する数学モデルもあります。これらにより、動脈血サンプルの必要なく非置換性結合能(BP$_{ND}$)を推定できます。
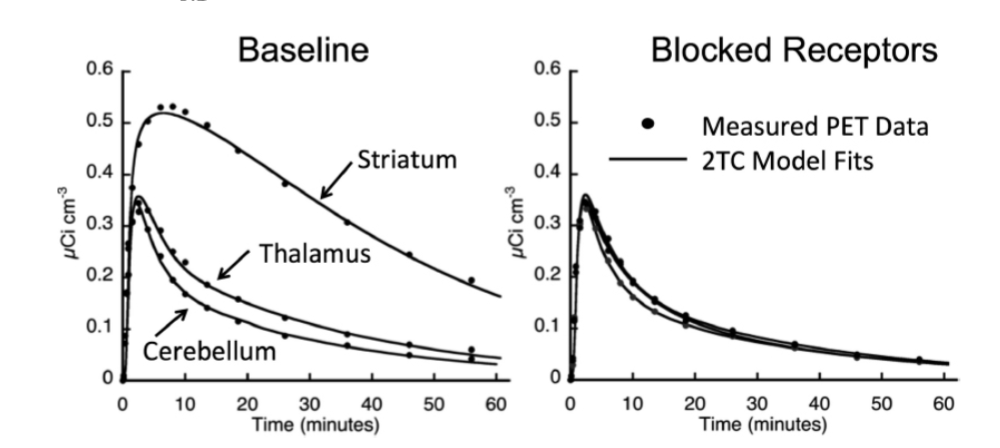
FIGURE 1.27-10. ベースラインおよび受容体遮断後の時間-放射能曲線と2TC適合
この図のデータは、ベースライン時(左)とハロペリドールによるD2受容体遮断後(右)の非ヒト霊長類における、ドーパミンD2様受容体トレーサーである[11C]ラクロプリドのスキャンから得られたものです。この図は、2TCモデルのいくつかの側面を示しています。ベースライン時の分布容積(V+)は、線条体で3.9、視床で1.4、小脳で1.0です。小脳のV-をVNDの推定値として使用すると、線条体でBPND = 2.9、視床で0.4となります。受容体遮断後、すべての領域が小脳と同様に見え、すべてのV-が1に近くなります。これは、参照組織である小脳におけるVTが、受容体を含む領域におけるVNDの良い推定値を提供するという概念を示しています。
可逆性モデルの実験デザイン
可逆性モデルの最も直接的な応用は、グループ間または条件間で標的タンパク質密度を比較することです。比較対象のスキャン間で、平均してKp(平衡解離定数)とfND(非置換性画分)が異ならないと仮定すると、BPND(非置換性結合能)はBMAX(標的タンパク質の最大濃度)またはBAVAIL(利用可能な標的タンパク質濃度)の差を表すと見なすことができます。
多くの異なる現象をモデル化できる別の柔軟なパラダイムは、被験者内での条件間でBPNDの相対的な変化を比較することです。これは、ABPND(BPNDの条件間変化率)として表されることがあります。
ABPND = [BPND(条件2) – BPND(条件1)] / BPND(条件1)
最も一般的な応用例は、条件1がベースライン測定であり、条件2がシステムを撹乱する薬理学的負荷後のスキャンである場合です。刺激薬負荷は、受容体結合の場合の神経伝達物質など、結合部位の内因性リガンドを放出させ、放射性リガンドと結合部位を競合させます。別の例は、枯渇パラダイムであり、負荷はベースライン条件下で通常部位に結合する内因性物質の合成を妨げるか、または減少させ、根底にあるBMAXのマスキングを解除します。
ABPNDはまた、外因的に投与された薬物によって達成される標的画分、つまり占有率の推定値を提供します。最も単純なケースでは、条件2で標的分子の一部を占有する競合リガンドが1つだけで、条件1に競合がない場合、BPNDは1 / (1 + [L] / KDL) の係数で減少します。ここで、[L]は競合の濃度、KDLは標的に対するLの平衡解離定数です。係数1 / (1 + [L] / KDL) は1 – 占有率に等しく、占有率は濃度[L]でLによって平衡状態で占有される標的濃度の画分です。したがって、ABPNDは競合Lによって達成される標的占有率の推定値を提供し、PETイメージングは薬物開発および既存の薬物の特性評価において重要なツールとなっています。
PETによるin vivo占有率研究は、候補薬物による標的エンゲージメントを実証するためのほぼ必須の手段となっており、このような研究の必要性が、薬物療法の標的部位として研究中の新しい標的分子に対するトレーサーの開発を促進しています。占有率研究デザインには、安定した用量で投与された患者における受容体占有率の単純な測定と、用量または薬物血漿レベルと標的占有率の関係のモデルを形成するための用量の実験範囲を利用したより包括的なデザインが含まれており、ED50またはEC50(標的の50%が占有される用量および血漿中濃度)などの関連パラメータの推定値が含まれています。ABPNDが外因的に投与された薬物による標的占有率以外の変化を測定するために使用される研究、特に正常な生理学的範囲外の神経化学系に変化を誘導するために薬理学的負荷を利用する研究は、単純な競合モデルが意味するよりも複雑な根底にある薬物動態または生物物理学的プロセスが関与している可能性がありますが、ABPNDは依然として負荷効果の大きさを定量化するための有益なパラメータです。
不可逆性モデル
最も一般的に使用される不可逆性コンパートメントモデルもまた、2つの組織を含みますが、可逆性モデルのように最終コンパートメントから中間コンパートメントへの戻り経路がありません。放射性トレーサーまたは放射性標識された代謝副産物は、事実上、最終状態に捕捉されます。このモデルは、放射性トレーサーが内因性物質の代謝経路のすべての段階ではなく、いくつかの段階の基質であり、各段階の代謝副産物に放射性標識が保持される場合に最も頻繁に適用されます。
最後の共有ステップからのクリアランスが、スキャン中に蓄積された放射性標識代謝物が実質的にすべてその状態に留まるほど十分に遅い場合、それは捕捉された状態または不可逆的な状態として扱われます。可逆性モデルとは異なり、不可逆性モデルには広く合意された用語はありませんが、ここではCPRE(前駆体、最後の捕捉された状態より前の脳内のすべての可逆性状態を包含)とCM(代謝物、捕捉された状態)という用語が採用されています。
不可逆性モデルには平衡状態はありませんが、CPREから動脈血漿への流入と流出がCPREからCMへの前方変換によってちょうど釣り合い、CPRE濃度が一定に保たれるという仮想的な定常状態を想定することができます。コンパートメントモデルの式から、この定常状態はCPRE=[K1/(k2+k3)]Cpという条件を満たします。全体の捕捉速度はk3CPREに等しく、これはK1k3/(k2+k3)]Cpに等しくなります。K1k3/(k2+k3)という式は、トレーサーの定常状態取り込み速度定数であるKinと呼ばれ、不可逆性モデルで推定される通常の結果測定値です。可逆性モデルと同様に、不可逆性プロセスに対する参照組織が存在する場合、動脈血漿を採取することなくKinの修正版を推定できます。
不可逆性モデルの例
不可逆性モデルにおける仮定は、可逆性モデルの場合よりも個々のアプリケーションに特有です。その動作の一般的な感覚は、脳PETで最も広く使用されている2つの代謝トレーサーである**[18F]DOPAと18FDG**の例を通して最もよく説明されます。
[18F]DOPAは、ドーパミン作動性神経終末内でL-ジヒドロキシフェニルアラニン(DOPA)をドーパミンに触媒する酵素であるアミノ酸脱炭酸酵素(AADC)の基質です。[18F]DOPAはBBBおよび細胞膜を容易に通過し、ドーパミン作動性神経終末でAADCによって6-フルオロドーパミン(6-FDA)、実質的には18F標識ドーパミンに代謝されます。6-FDAは内因性ドーパミンと同様にBBBを通過しないため、神経終末の近傍に「捕捉」され、線条体における小胞負荷、エキソサイトーシスによる放出、および終末への再取り込みのサイクルに入り、シナプスからのクリアランスの主要なモードであるドーパミントランスポーターを介した再取り込みと並行して内因性ドーパミンと共存します。不可逆性捕捉モデルで推定されるKinは、前シナプス性ドーパミン作動性状態のマーカーを表します。
捕捉は近似的なものです。なぜなら、6-FDAはモノアミン酸化酵素(MAO)およびカテコール-O-メチルトランスフェラーゼ(COMT)の基質であり、6-FDA代謝からの放射性標識代謝副産物はBBBを容易に拡散できるためです。脳からの遅い排出(しばしばklossと呼ばれる)を[18F]DOPA実験のモデリングとデザインに組み込むためのいくつかの方法が提案されていますが、多くの研究ではより基本的な不可逆性モデルを用いてKinを定量化しています。[18F]DOPAデータセットは、1時間から数時間の動態イメージングで構成される場合があります。小脳を含むいくつかの脳領域は、[18F]DOPAイメージングの参照組織として機能することができます。
**18F標識2-フルオロ-2-デオキシ-D-グルコース(18FDG)**は、断然最も広く使用されているPET放射性トレーサーです。元々は脳のグルコース代謝を定量化するために開発されましたが、初期の段階で、18FDGが周囲の組織よりも特定の種類の腫瘍細胞に迅速に取り込まれることが観察され、18FDGイメージングは腫瘍学や他の医学分野で広く使用される診断および病期分類ツールとなりました。現在でも、脳グルコース代謝の定量化のための研究で頻繁に使用されています。
18FDGは、グルコースを脳組織内に輸送するのと同じキャリアタンパク質の基質です。また、グルコースを代謝する酵素であるヘキソキナーゼの基質でもあり、18FDG-6-PO$_4$にリン酸化されます。18FDG-6-PO$_4$はグルコース代謝のさらなるステップには進みません。脱リン酸化はしますが、その速度は前方プロセスと比較して非常に遅く、18FDG-6-PO$_4$は捕捉された状態として扱われます。
ここで、Kinは18FDGの定常状態リン酸化速度を表します。これは、輸送およびリン酸化速度が2つの化合物で異なるという事実のため、脳グルコース代謝におけるこれらのステップの速度に比例しますが、同一ではありません。この違いを考慮する変換因子(2つの変換因子をまとめたものであるため、「複合定数(lumped constant, LC)」と呼ばれる1/LC)を乗じると、Kin/LCに血漿グルコース濃度を乗じたものが脳グルコース代謝の推定値として扱われます。グルコースは脳全体で利用されるため、参照組織は存在しません。
18FDGを用いたKin推定の最も包括的なアプローチは、動脈サンプルを取得し、PETデータを動脈入力を含む2TC不可逆性モデル、または緩徐な脱リン酸化を考慮した修正バージョンに適合させることですが、これは臨床研究では稀です。臨床研究では、血液入力とPETデータ取得の両方の単純化が頻繁に採用されます。
血液入力データの単純化は、静脈カテーテル留置部位を温めて血管拡張を引き起こし、動脈と静脈の18FDG濃度のより迅速な平衡化を促すことで「動脈化」された静脈血を利用すること、あるいはさらに単純に、少数のサンプルのみを採取し、これらを用いて標準化された集団入力スケールを調整することを含みます。PETデータ取得は、Kinを定常状態における脳内の18FDG濃度を動脈血漿入力の曲線下面積で割ったものとして近似することで削減できます。このアプローチでは、ボーラス注射後45〜60分に開始し、通常30分以下の比較的短い期間の平均18FDG濃度の画像が使用されます。
最後に、定常状態アプローチは、**標準取り込み値(Standard Uptake Value, SUV)**と呼ばれるパラメータを推定することでさらに単純化できます。これは、血液中の18FDGの曲線下面積を、注入された放射能を被験者の体重で割ったものに置き換えるものです。SUVは臨床スキャンで広く使用されている結果測定値ですが、研究ツールとしては批判を受けています。なぜなら、血液中の18FDG濃度を直接評価することなく、この方法では被験者間または条件間での18FDGの末梢クリアランス速度の差を考慮できず、したがって、スキャン内の脳内の相対代謝に関する情報しか提供できないためです。
放射性トレーサー
表1.27-2は、近年ヒト被験者において成功裏に使用されてきたPETおよびSPECTの放射性トレーサーをリストアップしています。新しい標的のためのトレーサーや、既存の標的のための改良されたトレーサーは常に開発中であり、この表は2021年時点で利用可能なリソースの感覚を伝えることを意図しています。さらに多くのトレーサーが提案されてきましたが、採用されなかったか、またはin vitro試験や前臨床種での試験を超えて進展していないものもあります。
有用な可逆性結合放射性トレーサーにつながる薬物動態学的特性は、デリケートであり、in vitro結合実験や治療薬に適した化合物となる特性とはいくぶん異なります。一般的に、定量が信頼できるものとなるためには、いくつかの異なる特性間のバランスが必要です。例えば、検出可能な信号を提供するために、トレーサーが脳組織に適切に供給されることが必須です。いくつかの要因がこれに影響を与える可能性があります。
トレーサーは血液中の血漿タンパク質に非特異的に結合します。タンパク質結合画分(非結合画分はfpと呼ばれ、1−fpが結合画分です)は非常に高い場合があります。一部の放射性トレーサーでは、1−fp>99%に達することもあります。場合によっては、これが信頼性の高い画像定量化のために十分な濃度の放射性トレーサーが脳に到達するのを妨げる可能性があります。BBB(血液脳関門)の透過性は、細胞培養や脳組織を用いたin vitroアッセイでは生じないin vivo環境で対処しなければならない問題です。
これに関連する特性として脂溶性が挙げられます。高い脂溶性は一般的に、化合物のBBB透過性を向上させる可能性を高めますが、同時に高い非特異的結合も引き起こします。もし非特異的結合が特異的結合に対して高すぎると、特異的結合信号をバックグラウンドから分離することが困難になり、結果的にBPND(非置換性結合能)が低くなり、信頼性の低い定量化につながります。したがって、脂溶性は脳への透過性の必要性と高い非特異的結合の望ましくない効果とのバランスをとるために、**中間的な値(log Pが1.5から4の範囲)**を持つ必要があります。
また、BBB透過性に関連して、一部の放射性トレーサー候補が**P-糖タンパク質(P-gp)**や、脳への侵入を積極的に妨げる他の排出機構の基質または弱い基質であるという事実があります。これはin vivo試験の前に予測することが困難な場合があります。
考慮すべき別の特性は、トレーサーの標的に対する親和性と標的密度の関係です。BPND(非置換性結合能)がfNDBMAX/KDであることから、特定の標的利用可能性とfNDに対して、BPNDが親和性に直接比例して変化することがわかります。BPNDが低すぎると、非特異的結合に対して特異的結合を信頼性高く測定できません(図1.27-11)。逆に、標的密度が非常に高い場合、高親和性トレーサーは合理的な時間枠内にウォッシュアウト相に到達しない可能性があり、パラメータ推定値は安定しません。スキャン後半のデータのわずかな摂動が結果測定値に大きな変化をもたらす可能性があります(図1.27-11)。
脳内で非常に不均一に分布している標的は、高BMAX領域には中程度の親和性トレーサー、低BMAX領域には高親和性トレーサーといった、複数の放射性トレーサーを必要とする場合があります。開発段階で有望に見える一部のトレーサーは、ヒトでの使用には不向きなスペクトルの極端な端にあることが判明するかもしれません。つまり、どこでもBPNDが低すぎるか、どこでもウォッシュアウトが遅すぎるといった具合です。
放射性トレーサーの有用性を制限する可能性のある別の現象は、in vivoで、一次標的分子に対する選択性がin vitroでの予測よりも低いことが判明する場合です。一般的に、トレーサーは多くの脳タンパク質に対する結合親和性についてin vitroでスクリーニングされますが、一次標的に対するin vitro親和性が別のタンパク質よりも数百倍高いにもかかわらず、in vivoでは親和性の差がはるかに小さいことが判明し、二次標的への結合が定量化を混乱させる要因となる場合があります。
最後に、上記のすべての基準に従って高い可能性を秘めているように見えたトレーサーが、最終的に血液中にBBBを通過し、定量化を困難または不可能にする放射性標識代謝物を持っていることが判明する場合があります。
放射性トレーサー開発に従事する化学者は、これらのパラメータの一部を制御できますが、プロセスの大部分は試行錯誤です。開発には、標的に特異性を持つことが知られている初期の薬理活性骨格または分子から始め、放射性標識手順を考案し、in vitroで結果をテストし、前臨床種でテストし、テスト結果に基づいて特性を改善するために分子を変更し、ヒトでのテストに十分な潜在力を持つ適切な候補が見つかるまで繰り返すという一連の作業が含まれる場合があります。このプロセスは長く困難なものであり、特定の標的に対する適切な放射性トレーサーにたどり着くまでに数年かかることもよくあります。最近の研究では、プロセスの合理化や、新しいトレーサーの開発初期段階での定量的可能性を予測するための合理的なアプローチの開発に焦点が当てられています。
精神医学研究における神経化学イメージング
表1.27-2が示すように、多くの異なる神経化学系を画像化するための放射性トレーサーは、ヒトイメージングの段階まで進展しています。これらのうちいくつかは最近開発されたものか、または1つか数個の研究でしか使用されていませんが、より確立されたトレーサーのいくつかは、神経精神疾患や脳機能に関連する他の状態に関する数十または数百の研究が発表されています。最も研究されている分野のいくつかには、統合失調症および関連する状態、大うつ病およびその他の気分障害と感情障害、物質およびアルコール乱用と依存症、そして最近ではアルツハイマー病およびその他の認知症が含まれますが、さらに多くの分野が調査されています。
これらの広範に研究された分野の一部と、いくつかのよく再現された結果をここで説明します。このセクションは、精神医学におけるすべての神経画像診断結果の包括的なレビューを意図するものではなく、むしろ研究の性質、より確立されたまたは有益な結果の一部、そして放射性トレーサーイメージングの能力と限界を示す事例を伝えるための選択的なサンプルです。

読めないが、重要でもないのでこのまま。
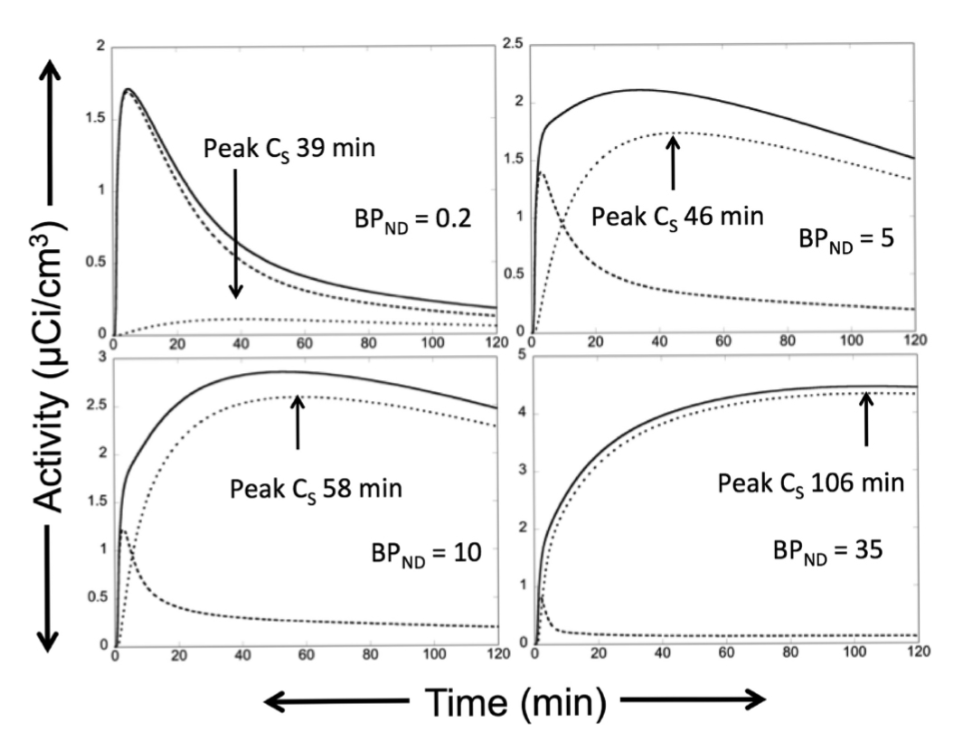
FIGURE 1.27-11. シミュレーションされた2TC時間-放射能曲線における特異的結合のピーク到達時間
これらのシミュレーション曲線はすべて、同じ入力関数と同じK1、k2、k4の値で作成されており、**BAVAILに比例するk3のみが異なります。**これらの曲線は、特異的結合のピーク到達時間がBAVAILの増加とともに増加するという事実を示しています。
左上のパネル(BP$_{ND}$ = 0.2)では、活動の大部分が非置換性コンパートメント(CND、点線)の曲線に起因するため、総濃度(CT、実線)とCNDを区別することが困難になり、BP$_{ND}$を正確に推定することが難しくなります。これは信号対バックグラウンド比が低すぎる状態です。
右下のパネル(BP$_{ND}$ = 35)では、特異的結合のピークがスキャンの非常に遅い段階で発生するため、最後の数点のデータポイントのわずかな変動が、推定される分布容積(VT)またはBP$_{ND}$に大きな差をもたらす可能性があります。
他の2つのパネル(BP$_{ND}$ = 5、10)は、パラメータ推定が堅牢であるケースを示しています。これは、CS(特異的結合コンパートメント、点線)がCTの大部分を占めていること、そして特異的結合のピークとウォッシュアウト相がスキャンの途中で達成されていることの両方によります。
各曲線は、非置換性コンパートメント(CND)が点線、特異的結合コンパートメント(CS)が点線、総濃度(CT)が実線で表されています。
ドーパミン
ドーパミン作動性システムは、PETとSPECTイメージングの両方で最も広範に研究されている神経伝達システムの1つです。研究では、広範な患者集団のコホートにおいて、受容体とトランスポーターの利用可能性、ならびに神経伝達物質の合成、貯蔵、および放出能力が調べられてきました。ホスホジエステラーゼ10A(PDE10A)など、ドーパミン受容体のシグナル伝達経路に関与する細胞内酵素についても、いくつかのトレーサーが開発されています。
すべての抗精神病薬がある程度ドーパミンD2受容体伝達を遮断すること、そしてドーパミン伝達が環境刺激への顕著性の帰属やワーキングメモリの微調整などの機能に関与していることから、ドーパミン作動性機能不全は統合失調症に大きく関与しているとされており、統合失調症患者におけるドーパミン作動性システムの様々な側面を特徴付けるイメージング研究が特に数多く行われてきました。
ドーパミン作動性システムのイメージング研究が多数行われているもう1つの分野は物質依存症です。多くの乱用薬物は、シナプスにおけるドーパミンの放出を誘導します。これは、ドーパミン終末に直接作用するコカインやアンフェタミンなどの薬物で特に顕著ですが、アルコールやニコチンなど間接的に作用する他の物質についても当てはまります。このこと、そしてドーパミンが動機付け、報酬刺激の識別、報酬行動の強化において果たす役割のために、ドーパミン作動性機能不全は薬物乱用と依存症に関与しているとされており、これはイメージング研究の焦点となってきました。
D1受容体利用能
ドーパミンD1様受容体は、脳のほとんどの領域に分布しており、線条体で高濃度に、前頭皮質で低〜中程度の濃度に存在します。小脳のD1濃度は現在利用可能なトレーサーでは検出可能なレベル以下であるため、小脳は参照組織として扱われます。皮質のドーパミン作動性機能が認知やワーキングメモリに関与していることから、これらの機能が影響を受ける状態、特に統合失調症において皮質のD1を評価することに大きな関心が寄せられてきました。
D1受容体利用能の評価に最も頻繁に使用されてきたPET放射性トレーサーは2つあります。これらは**[11C]NNC112と[11C]SCH23390**です。どちらのトレーサーもD1受容体とD5受容体を区別することはできません。BPND(非置換性結合能)の値で表される信号対雑音比は、[11C]NNC112の方が[11C]SCH23390よりも約3倍高くなっています。また、[11C]SCH23390の急速な末梢代謝は、動脈血漿濃度を信頼性高く測定することを困難にしており、そのため[11C]SCH23390は参照組織法のみで使用されます。一方、[11C]NNC112は動脈入力法と参照組織法の両方で使用できます。
統合失調症患者におけるD1利用能を調べるためにいくつかの研究が行われてきました。[11C]NNC112を用いた研究では、抗精神病薬非服用患者、特に抗精神病薬治療歴のない患者において、人口統計学的に一致した対照被験者と比較して皮質のD1増加が認められています。一方、[11C]SCH23390を用いた研究ではD1の減少が認められています。当初、これはトレーサー特性の違いを反映している可能性があると考えられましたが、両グループの研究者によるその後の研究では、元のコホートのサブサンプルに両方のトレーサーを投与して比較した結果、最初に報告されたものと同じ方向の結果が得られました。これは、トレーサーよりも集団の異質性に関連している可能性が高いことを示唆しています。
2000年代の最初の10年間で、いくつかの研究者が、[11C]NNC112と[11C]SCH23390の両方が、セロトニン5-HT2A受容体と比較してD1への選択性がin vitroで測定された100倍の差ではなく約10倍であることを示しました。そして、皮質のBPNDの25%から35%が両トレーサーの5-HT2A結合に起因することが判明しました。研究者たちは、統合失調症研究におけるグループ差に5-HT2A結合が寄与していない可能性を示すいくつかの証拠を提示しましたが、よりD1選択性の高い放射性トレーサーが開発されない限り、将来の研究では結果を解釈する際にこの要因を考慮する必要があるでしょう。
D2/D3受容体利用能
ドーパミンD2様受容体は不均一に分布しており、線条体に高濃度で、視床、中脳(黒質および腹側被蓋野、SN/VTA)、内側側頭皮質領域(扁桃体、海馬)に低濃度で、前頭皮質には非常に低濃度で存在します。これらの受容体はイメージングで最も研究されているものの一つであり、多くのトレーサーが開発されてきました。
広く使用されているトレーサーは、PET用の**[11C]ラクロプリドとSPECT用の[123I]IBZM**です。どちらも線条体のイメージングには適していますが、線条体以外のイメージングには十分なBPND(非置換性結合能)がありません。小脳は両者にとって頻繁に参照組織として使用され、どちらのトレーサーもD2受容体とD3受容体を区別しません。
線条体外のイメージングのために、PET用の**[18F]ファリプライドや[11C]FLB457**、SPECT用の**[123I]エピデプリド**など、いくつかの高親和性トレーサーが開発されています。[11C]FLB457は、11Cイメージングに適した時間枠内で線条体結合が平衡に達しないため、皮質および大脳辺縁系領域でのみ定量的に使用できます。また、D2様受容体用の他のほとんどのトレーサーとは異なり、[11C]FLB457の特異的結合は小脳でも検出可能です。
[18F]ファリプライドは、半減期が長い放射性同位体であるため、線条体と線条体外領域を同時にイメージングできますが、皮質のBPNDは依然として非常に低く、線条体のイメージングには最低3〜4時間という長時間のスキャンが必要です。[11C]FLB457と化学的に類似する[123I]エピデプリドでも小脳における特異的結合が検出されています。123Iの長い半減期は、線条体と線条体外の同時イメージングを可能にしますが、やはり4時間を超える非常に長いスキャン時間が必要です。さらに、一部の研究者は、[123I]エピデプリドの放射性標識代謝物が脳内で検出されたと報告しています。
これらの高親和性トレーサーのいずれも、D2受容体とD3受容体を区別することはできません。[11C]-(+)-PHNOは、D3受容体への親和性が非常に高いアゴニスト放射性トレーサーです。in vivoでのD3:D2選択性の推定値は20〜50倍の範囲です。D3受容体はD2受容体よりも分布がはるかに狭く、濃度も低いですが、[11C]-(+)-PHNOのD3優先的性質により、D3受容体の非侵襲的なin vivo特性評価が初めて可能になりました。結合は、線条体、淡蒼球、視床、SN/VTA、および視床下部で定量可能です。
背側線条体のBPNDは主にD2結合に起因し、SN/VTAおよび視床下部のBPNDは主にD3結合に起因し、淡蒼球、視床、および腹側線条体のBPNDは両方の受容体サブタイプが混在したものを表します。小脳は参照組織として使用されます。
統合失調症におけるD2受容体利用能
統合失調症における線条体のD2受容体利用能に関する研究結果はまちまちであり、メタアナリシスでは、線条体のD2様受容体利用能がわずかに、もし上昇しているとしても、わずかな上昇にとどまっている可能性が示唆されています。これらの研究のほとんどは、[11C]ラクロプリドまたは[123I]IBZMを用いて行われました。最近のある研究でも、統合失調症患者と一致する対照被験者との間で、線条体の[11C]-(+)-PHNOのBPND(非置換性結合能)に差は検出されませんでした。
[18F]ファリプライド、[11C]FLB457、および[123I]エピデプリドイメージングを用いて、統合失調症における線条体外D2受容体利用能を評価する研究も発表されています。個々の研究では、側頭皮質、前帯状回、視床など、いくつかの脳領域で患者と対照の間で差が報告されていますが、これらは研究間で一貫して見られるわけではなく、時には逆方向の結果を示すこともあります。これは、観察された変化が状態依存性であるか、または集団の異質性によるものである可能性を示唆しています。要約すると、これまでのイメージング文献は、統合失調症におけるドーパミン作動性機能不全が受容体発現レベルを介して媒介されている可能性は低く、むしろ前シナプス性または後シナプス性の現象によるものである可能性が高いことを示唆しています。
物質依存症におけるD2受容体利用能
物質依存症では、非常に異なる状況が明らかになっています。ここでは、コカイン、メタンフェタミン、アルコール、ヘロインなど、様々な物質に依存している被験者において、線条体D2受容体利用能の低下が一貫して示されています。
ただし、大麻使用は例外であり、中程度の使用者を対象とした[11C]ラクロプリドを用いた複数の研究、または重度の使用者を対象とした[11C]-(+)-PHNOを用いた1つの研究では、このような差は検出されていません。
ドーパミン放出、合成、貯蔵能力
多くの研究で、ドーパミン伝達の側面を間接的に評価するためにイメージング法が用いられてきました。これには、薬理学的負荷後のシナプスドーパミン濃度レベル、またはその変化を推測するために、受容体結合トレーサーのABPND(BPNDの条件間変化率)を測定する研究や、主に[18F]DOPAを用いて前シナプス性ドーパミンの状態を評価する代謝研究が含まれます。
理論上、受容体に結合するすべての放射性トレーサーは、内因性神経伝達物質のシナプス濃度変化に感受性を示すはずですが、まだ十分に理解されていない理由により、D2様受容体用の放射性トレーサーが最も感受性が高いことが判明しています。そのため、ドーパミン伝達を調べる研究では、主に[11C]ラクロプリドまたは[123I]IBZMが使用されてきました。より最近では、線条体外ドーパミン伝達を調べるために[18F]ファリプライドや[11C]FLB457を用いた研究、あるいはアゴニストおよびD3優先的特性により異なる視点を提供する[11C]-(+)-PHNOを用いた研究がいくつか発表されています。
シナプスドーパミンを増加させるために最も広く使用されている薬理化合物は、**デキストロアンフェタミン(d-AMPH)とメチルフェニデート(MPH)**の2つです。d-AMPHは、ドーパミン再取り込みトランスポーター(DAT)の作用方向を逆転させることにより、細胞内シナプス小胞からドーパミンを押し出し、シナプスに放出させます。ベースラインスキャンとd-AMPH投与後スキャン間の線条体におけるABPNDは、放射性トレーサーとドーパミン間の受容体における競合と一致して、結合の減少(ABPND < 0)を示します。
d-AMPHパラダイムは慎重に検証されています。前臨床試験では、測定されたABPNDがマイクロダイアリシスで測定されたドーパミン放出レベルと強く相関すること、測定されたレベルがd-AMPH用量依存性であること、そしてドーパミンがd-AMPH投与前に枯渇している場合、d-AMPH効果が打ち消されること(ABPND ≈ 0)が示されています。つまり、この効果にはドーパミンの存在が必要です。放射性トレーサーとドーパミン間の競合に加えて、d-AMPH効果が受容体の細胞表面と細胞質間のトラフィッキングなどの他のプロセスによって媒介されるかどうかについては、ドーパミンサージ後のBPNDの減少が少なくとも数時間長く持続するため、いくつかの疑問があります。しかし、それでもなお、d-AMPH後のABPNDはドーパミン合成、貯蔵、および放出の能力の信頼できる指標として受け入れられています。
非ヒト霊長類からのマイクロダイアリシス結果は、d-AMPH後の細胞外ドーパミン濃度が1,000%以上増加することを示しており、ヒト被験者に投与される用量範囲ではドーパミン放出が高いにもかかわらず、BPNDへの影響は依然として小さく、[11C]ラクロプリド、[123I]IBZM、および[18F]ファリプライドでは線条体ABPNDが10%から20%の範囲であることを示唆しています。
ドーパミンがアンタゴニストよりもアゴニストトレーサーとより効果的に競合する可能性があるという証拠があります。[11C]-(+)-PHNOまたはD3優先性ではない別のアゴニスト放射性トレーサーである[11C]NPAを用いたd-AMPH誘発ドーパミン放出を調べる研究では、同じ被験者が[11C]ラクロプリドでスキャンされた場合よりも大きなABPNDが認められました。この効果は、アゴニストとドーパミンがGタンパク質共役型であり、したがってアゴニスト結合に対して高親和性状態にある受容体の同じサブセットを競合しているのに対し、アンタゴニストトレーサーは共役型および非共役型受容体に等しい親和性で結合するためである可能性があります。ただし、この解釈はやや推測的であり、ドーパミン放出に対するトレーサー応答の違いの原因として厳密に実証されるには至っていません。
MPHはトランスポーターを介した再取り込みを遮断するため、放出されたドーパミンがシナプスおよび細胞外空間に蓄積します。MPH後の蓄積ドーパミン濃度の大きさはd-AMPH後の放出量よりも少ないですが、この効果はイメージングで依然として確実に検出され、MPH負荷も前シナプス性ドーパミンの状態の測定として広く使用されています。
D2様受容体用の放射性トレーサーが内因性ドーパミンからの結合競合に感受性を示すこと、およびドーパミンが受容体に結合する持続的な低いベースラインレベルがあるため、見かけのベースラインBPNDがベースラインドーパミンによってどの程度減少しているかについては疑問があります。ドーパミン合成または小胞貯蔵を薬理学的に妨げる化合物の事前投与を伴う枯渇研究は、ベースラインドーパミンが見かけのBPNDに寄与する度合いを明らかにするように設計されています。チロシンヒドロキシラーゼ阻害剤である**α-メチル-パラ-チロシン(AMPT)**は、48時間以上にわたって投与されるとドーパミン合成を阻害し、ドーパミン貯蔵を枯渇させます。AMPTは、ヒト被験者においてD2受容体のベースライン占有率をドーパミンによって明らかにするために使用されてきました。
統合失調症におけるドーパミン伝達
d-AMPH負荷を用いた研究では、統合失調症患者において、一致する対照被験者と比較して、ドーパミン放出の増加(より大きなABPNDの値)が一貫して示されています。これは、[123I]IBZMまたは[11C]ラクロプリドイメージングを用いて、線条体全体レベルで観察されています。
AMPT枯渇パラダイムを用いた研究では、[123I]IBZMを用いて線条体全体レベルで、そしてより最近では、[11C]ラクロプリドイメージングを用いて連合性線条体(尾状核および前交連被殻)で特異的に、ベースラインドーパミンの上昇が認められています。これらの研究は、ヒトにおいて、ドーパミンによるD2受容体のベースライン占有率が10%から20%の範囲にあることを示唆しています。
少数の患者コホートをd-AMPHとAMPTの両方の負荷でイメージングした1つの研究では、これら2つの間に高い相関が見られました。すなわち、AMPH誘発ドーパミン放出が大きいほど、AMPTによる脱マスキングから推測されるベースラインドーパミン結合も大きいことが示されました。したがって、ドーパミン伝達のイメージング測定は、統合失調症における線条体での前シナプス性ドーパミンの状態の上昇を一貫して示しています。これは、統合失調症患者および統合失調症発症リスクの高い前駆期被験者における[18F]DOPAイメージングの結果とも一致しています。これらの研究では、患者で一致する対照と比較してKinの上昇が、前駆期被験者では中程度の上昇が示されており、[18F]DOPA Kinの大きさと前駆期における精神病への進行の可能性との間に関連性が見られます。
逆に、ある研究ではd-AMPHパラダイムを[11C]FLB457イメージングと組み合わせて使用し、統合失調症患者の皮質および中脳におけるドーパミン放出の鈍化を認めました。これは、統合失調症における皮質のドーパミン機能低下という理論モデルと一致しています。線条体における放出の増加と皮質における放出の減少という2つの表現型が、同じ患者で同時に発生するかどうかはまだ実証されていません。
物質依存症におけるドーパミン伝達
統合失調症患者とは対照的に、物質依存症の被験者では、d-AMPHまたはMPH投与後に、一致する対照と比較してドーパミン放出の減少が最も頻繁に観察されています。これは、コカイン使用者、ヘロイン使用者、重度の大麻使用者、およびアルコール依存症の被験者で観察されています。
ある研究では、AMPT枯渇モデルを用いて、コカイン使用者におけるベースラインドーパミンレベルの低下も示されています。D2様受容体利用能の低下という観察結果と組み合わせると、イメージング文献は、物質依存症におけるドーパミン作動性システムの全体的な機能低下または鈍化を示唆しています。これらの研究は、ドーパミン機能の低下が薬物使用の素因であるのか、それとも結果であるのかという問いに答えることはできません。しかし、コカイン依存症の非ヒト霊長類モデルを用いた最近の研究では、VMAT2放射性トレーサーである[11C]DTBZで測定されたドーパミン終末における前シナプス小胞利用能が、慢性的なコカイン投与後に低下することが判明しており、これは使用者におけるドーパミン機能の観察された減少に、コカイン自体が直接的な役割を果たしていることを示唆しています。
ドーパミン作動性標的エンゲージメント
1980年代後半から1990年代初頭にまで遡ると、一般的に使用されている抗精神病薬による受容体占有率を推測するためにABPND(BPNDの条件間変化率)を用いたPET研究が発表されました。[11C]ラクロプリドを用いて、ハロペリドール(Haldol)とスルピリド(Dogmatil, Dolmatil, Eglonyl, Espiride, Modal, Sulpor)が治療用量で投与された場合、D2様受容体の75%から90%を占有することが示されました。また、[11C]SCH23390を用いて、両薬物のD1様受容体への結合は検出可能なレベル以下であることが示されました。
非定型抗精神病薬である**クロザピン(Clozaril)**は、D2様受容体の約50%を占有し、D1様受容体の約40%を占有することが示されました。これらの論文はまた、**錐体外路症状(EPS)**とD2受容体占有率のレベルとの間の直接的な関連性を初めて示し、約80%の占有率でEPSが出現する閾値があることを示しました。それ以来、多くの抗精神病薬や他の多くのクラスの薬物について、受容体占有率が特徴付けられてきました。
[11C]ラクロプリドを用いた研究は、リスペリドン(Risperdal)やオランザピン(Zyprexa)などの広く使用されている一部の非定型抗精神病薬が、安定した用量で投与されている患者において線条体のD2様受容体の70%から80%を占有することを繰り返し示しています。また、治療レベルのクロザピンによるD2占有率が他の抗精神病薬よりも低いという以前の結果も再現されています。さらに、リスペリドン、オランザピン、クロザピンはいずれも、5-HT2A用の放射性トレーサーを用いて、ドーパミンD2受容体よりも高い割合でセロトニン5-HT2A受容体を占有することが示されています。
部分アゴニスト抗精神病薬である**アリピプラゾール(Abilify)**によるD2様受容体の線条体および線条体外占有率を[18F]ファリプライドを用いて測定した研究では、安定した用量で約90%という非常に高い占有率がEPSなしで示されています。これは、部分アゴニストがアンタゴニストよりもEPSなしで高レベルのD2受容体遮断を支持するという期待と一致しています。
セロトニン
セロトニン作動性(5-HT)システムもまた、神経イメージングで広く研究されてきました。主要なうつ病や他の気分障害における5-HTの関与により、これらの状態における受容体と再取り込みトランスポーターの利用能を測定する広範なイメージング研究が行われてきましたが、セロトニン作動性指標は、神経精神医学的および関連する状態の広範なスペクトルにわたって特徴付けられています。
5-HT1A受容体利用能
5-HT1A受容体は脳全体に分布しており、島皮質および内側側頭皮質で最高濃度、帯状回で高濃度、前頭前野および後部皮質(頭頂葉および後頭葉)で中程度の濃度に存在します。これらの受容体は、**背側縫線核(DRN)**にも見られ、そこでは抑制性自己受容体として機能します。DRN濃度は低いですが、セロトニン伝達の調節における5-HT1A自己受容体の役割があるため、特に重要です。前臨床研究や他の情報源からの証拠は、選択的セロトニン再取り込み阻害薬(SSRIs)のメカニズムが、治療開始後数週間にわたるDRNにおける5-HT1A自己受容体の脱感作に関与し、最終的にセロトニン伝達の増加につながる可能性を示唆しています。
[カルボニル-11C]WAY100635、通常**[11C]WAY100635**と略されるこの選択的5-HT1A受容体拮抗薬は、この標的のために最も広く使用されている放射性トレーサーです。小脳は[11C]WAY100635で頻繁に参照組織として使用されますが、小脳虫部で検出可能な特異的結合が存在するため、参照組織はその小脳の部分を除外するように定義されなければなりません。
[11C]WAY100635は、長くて複雑な合成手順のため製造が困難であり、また急速な末梢代謝と小脳での非常に低い信号のため定量化も困難です。そのため、改変版や代替品を開発するための数多くの試みが行われてきました。これらの多くは放射性標識として18Fを使用していますが、脳内の放射性標識代謝物や頭蓋骨への[18F]フッ化物イオンの取り込みという問題に直面しています。ごく最近、新しい11C放射性トレーサーである[11C]CUMI101が導入されましたが、まだ広く採用されていません。したがって、その使用に関連する困難にもかかわらず、患者集団におけるこれまでのほとんどの発表された研究は[11C]WAY100635を用いて行われています。
うつ病における5-HT1A受容体利用能
大うつ病性障害(MDD)および関連する気分障害において、[11C]WAY100635を用いた5-HT1A受容体利用能を調べる多数の研究が行われてきました。これらのほとんどは、MDD患者において、一致する対照と比較して、DRNおよび他の多くの脳領域でBPND(非置換性結合能)の低下を報告しています。少数の研究は、グループ間に差がないと報告しています。
しかしながら、少数の研究者は、結果測定値としてVs/fpとして導出されるBPpを使用した場合に、DRNおよび他の領域での結合の増加を報告しています。BPpは、脳内の非置換性濃度を使用するBPNDとは異なり、動脈血漿中の非タンパク質結合トレーサーを参照値として使用する結合能の一種です。これらの例外的な知見が、方法論的な違い、患者サンプルの違い、またはこれらの組み合わせによるものかについては議論があります。小脳を参照組織としてBPNDを使用する研究は、トレーサーの小脳結合におけるグループ差や、fNDにおけるグループ差によって偏りが生じる可能性があります。逆に、動脈血漿およびfpの測定は困難であり、データに変動をもたらし、矛盾する結果につながる可能性があります。
いくつかの証拠は、[11C]WAY100635がP-gpの弱い基質であることを示唆しています。P-gp活性における潜在的なグループ差は、これまでのMDDでは調査されていませんが、もし存在すれば、血漿ベースの結果測定値にBPNDよりも大きな偏りをもたらす可能性があります。したがって、MDDにおける5-HT1A受容体利用能の役割を理解することの重要性にもかかわらず、この分野には現在論争があり、この標的のためのより定量的に信頼できる放射性トレーサーの開発と使用によってのみ最終的に解決される可能性があります。
セロトニン再取り込みトランスポーター利用能
**セロトニン再取り込みトランスポーター(SERT)**は脳内で不均一に分布しており、中脳で最高濃度、線条体、扁桃体、視床で高濃度、帯状回と海馬で中程度の濃度、前頭皮質で低濃度に存在します。小脳はSERTトレーサーの参照組織として扱われます。
SERTをイメージングするために最初に使用された放射性トレーサーは**[123I]β-CIT**でした。このトレーサーはSERTとドーパミン再取り込みトランスポーター(DAT)の両方に親和性があり、DAT濃度が高い線条体でのSERTイメージングには適していませんでした。事実上、[123I]β-CITは中脳におけるSERT測定にのみ使用できました。
その後、SERTイメージングのためにいくつかのPET放射性トレーサーが開発されました。このうち最初に開発されたのは1990年代初頭の**[11C]McN5652で、信号対雑音比は比較的低いものの、中脳と線条体でのイメージングに適しています。1990年代後半に開発された[11C]DASB**は、[11C]McN5652のほぼ2倍のBPND値を持っていますが、前頭前野では依然として非常に低いです。[11C]DASBは、SERTイメージングで最も広く使用される放射性トレーサーとなっています。
より最近では、[11C]AFMや[11C]HOMADAMなどの高親和性トレーサーが開発されており、皮質で信頼性の高い定量化を提供する可能性がありますが、これらを用いた研究はまだ広く報告されていません。イメージングで測定されたSERT利用能は、5-HT神経支配のマーカーおよびセロトニン作動性システムの完全性のマーカーとして解釈されてきました。
MDMA使用者におけるSERT利用能
**3,4-メチレンジオキシメタンフェタミン(MDMA、エクスタシー)**は、SERT(セロトニン再取り込みトランスポーター)に結合してその作用方向を逆転させることで、5-HT(セロトニン)を放出し、シナプス濃度を上昇させます。MDMAは、陶酔感と共感性を誘発する性質のため、娯楽用薬物として使用されてきました。
1980年代後半に行われた動物研究では、MDMAが娯楽使用者と同程度の用量で神経毒性を引き起こし、SERTを減少させることが示され、MDMAの使用が可逆的または永続的な神経損傷につながる可能性が浮上しました。1990年代後半に行われたSERT利用能の初期研究では、[11C]McN5652を用いて、MDMA使用者において、一致する対照被験者と比較して、BPND(非置換性結合能)が劇的に低下していることが判明しました。その後のいくつかの[11C]McN5652を用いた研究では、最初の研究で観察された劇的な結果は再現されませんでしたが、現在のMDMA使用者において**中程度のBPND低下(20%から30%の範囲)**が示され、これは、元使用者を含む横断研究や、別の研究での禁欲期間や使用量との相関関係において、可逆的であるように見えました。
それ以来、少なくとも8つの研究が、現在のMDMA使用者および元使用者において[11C]DASBを用いて行われてきました。これらの研究は、最近禁欲した現在のMDMA使用者において、皮質のSERT利用能の中程度の低下を一貫して示しています。元使用者を調べた1つの研究では、一致する対照と比較して差は認められず、MDMA関連神経毒性の可逆性について慎重な解釈を示唆しています。この一連の知見の興味深い点は、健常対照における[11C]DASBの報告されている前頭前野のBPND値が約0.05から0.15の範囲であることです。これらは通常、定量的な信頼性の限界をはるかに下回ると考えられていますが、それにもかかわらず、最近禁欲したMDMA使用者における皮質SERTの低下という結果は繰り返し再現されています。
セロトニン放出、合成、貯蔵能力
刺激薬負荷後の放射性トレーサーとの競合を介して5-HT放出を間接的に測定する試みは、ドーパミンの場合ほど成功していません。強力な5-HT放出剤であるフェンフルラミンやMDMAはヒトへの投与には適さないため、実験デザインの選択肢はより限られており、ヒト被験者を用いた研究は、5-HTレベルを増加させるためにSSRIsの投与に頼らざるを得ませんでした。これは、5-HTを直接放出する化合物よりも穏やかな効果しか得られない可能性があります。しかし、げっ歯類および非ヒト霊長類を用いたフェンフルラミンによる5-HT放出の研究では、マイクロダイアリシスによって細胞外5-HTレベルが薬理学的負荷に反応して劇的に上昇するという証拠があったにもかかわらず、2000年代の最初の10年間に利用可能だったほとんどの5-HT1Aおよび5-HT2トレーサーの5-HTに対する感受性が一貫して示されませんでした。
より最近開発されたいくつかのトレーサーは、非ヒト霊長類モデルにおける5-HTレベルの変化に対する感受性を示しました。これらには、5-HT1B受容体用の2つの放射性トレーサー、[11C]AZ10419369および**[11C]P943**、ならびに5-HT2A受容体用のアゴニストトレーサーである**[11C]CIMBI-36**が含まれます。これら3つすべてが、フェンフルラミン投与後のロバストなABPNDを伴うフェンフルラミンによる5-HT放出に感受性があることが証明されています。これまでにヒトで行われた少数の研究からの結果は、SSRIsに対する反応が最小限であるなど、よりまちまちです。ただし、ある研究では、dAMPHに反応して[11C]CIMBI-36結合がロバストに減少することが示されました。
受容体への潜在的なベースライン結合を脱マスキングするために5-HTレベルを低下させる現在利用可能な唯一のアプローチは、**急速トリプトファン枯渇(RTD)**です。トリプトファンは5-HTの前駆体です。トリプトファンの唯一の供給源は食事であり、被験者に他のアミノ酸が高濃度で含まれ、トリプトファンが含まれない調製物を摂取させることで、血漿レベルが急速に低下し、結果的に脳内の5-HTが減少します。行動研究では、RTDが寛解期うつ病患者にうつ病症状を誘発することが示されています。PETとFDGで測定されたグルコース代謝、PETと15O水で測定された脳血流、およびfMRIで測定された神経活動はすべて、RTDが脳機能に検出可能な影響を与えることを示唆しています。
PETを用いた神経化学イメージングは、よりあいまいな結果を示しています。[11C]WAY100635または[11C]DASBを用いた研究では、5-HT1A受容体またはSERTに対する影響は検出されませんでした。5-HT2Aトレーサーである[11C]MDL100907または[18F]Setoperoneを用いた2つの研究では、RTD後にいくつかの脳領域でトレーサー結合がわずかに増加するのではなく、わずかに減少するという逆説的な効果が検出されました。[11C]P943および[11C]CIMBI-36を用いたより最近の研究でも、RTDのトレーサー結合への影響を明確に検出するには至っていません。
セロトニン作動性標的エンゲージメント
PETイメージングは、SSRIの有効性に必要なSERT(セロトニン再取り込みトランスポーター)占有率を確立するために使用されてきました。これらの研究は、治療効果のあるSSRI用量がSERTの80%以上の占有率を達成することを示す上で、患者群、薬物、および放射性トレーサー間で驚くほど一貫しています。研究には、MDD患者、パニック障害、強迫性障害、およびその他の状態の患者が含まれ、放射性トレーサーとして[11C]McN5652と[11C]DASBの両方が使用されています。テストされた薬物には、シタロプラム(Celexa)、フルオキセチン(Prozac)、パロキセチン(Paxil)、セルトラリン(Zoloft)、ベンラファキシン(Effexor)などが含まれます。これらの知見は、SERT遮断が抗うつメカニズムとして機能することの理解に定量的な側面を与え、薬物開発と臨床試験デザインのベンチマークとなっています。
興味深い関連研究は、薬物開発におけるイメージング研究の応用に関する教訓的な例を提供しています。SSRIの治療効果発現までの長い潜伏期間は、5-HT1A自己受容体の刺激によって引き起こされるDRN(背側縫線核)におけるセロトニン作動性細胞の発火抑制による、初期の一時的な増加に続く5-HT放出の減少期間に関連していると考えられています。この抑制は、5-HT1A自己受容体の脱感作により数週間にわたって治まると考えられていました。したがって、潜伏期間を短縮する戦略は、DRNの5-HT1A受容体を遮断することでしょう。しかし、これはDRNにおける自己抑制を減少させるかもしれませんが、5-HT1A拮抗薬の全身投与は、終末領域のシナプス後5-HT1A受容体も遮断し、抗うつ作用を妨げる可能性があります。
ピンンドロール(Visken)は、β-アドレナリン受容体遮断薬であり、5-HT1A受容体に対する弱い部分アゴニストでもあります。1990年代には、いくつかの前臨床データおよび剖検データが、ピンンドロールがDRN自己受容体 preferentially に結合する可能性を示唆しており、ピンンドロールによるSSRI治療の増強が、SSRIの潜伏期間を短縮し、有効性を高める可能性があることを示唆していました。二重盲検プラセボ対照臨床試験では結果はまちまちで、有益な効果を報告するものもあれば、そうでないものもありました。
2000年代初頭には、[11C]WAY100635イメージングを用いて、ピンンドロールによる前シナプスおよび後シナプスの5-HT1A受容体占有率を測定するためにいくつかのPET研究が行われました。これらの研究では、臨床試験で増強療法として投与されたピンンドロールの用量では、DRNの5-HT1A受容体の30%未満しか占有されていなかった可能性が高いことが示され、試験された用量が有効であるために十分な自己受容体遮断を提供したかどうかについて疑問が投げかけられました。ピンンドロールの特定のケースでは、アドレナリン作用のために高用量をテストすることはできませんでしたが、これらの研究は、治療薬による標的エンゲージメントを定量化する上でイメージングが果たす重要な役割を実証しました。ピンンドロールの占有率を測定したいくつかのPET研究の中で、最も包括的な研究は、皮質よりもDRNで高い占有率を観察しました。理論モデルが提唱されていますが、この違いのメカニズムはこれまで注意深く特徴付けられていません。
精神医学における神経炎症イメージング
神経炎症マーカーのイメージングは、当初神経疾患や神経変性疾患で研究されていましたが、統合失調症やうつ病における炎症性サイトカインの発現増加など、様々な証拠に基づいて、より最近では精神医学にも広く応用されるようになりました。ミクログリアは脳の常在免疫細胞であり、**18 kDaトランズロケータータンパク質(TSPO)**は、活性化ミクログリアおよび反応性アストロサイトで高度に発現するミトコンドリアタンパク質です。TSPOイメージングのために多くのトレーサーが開発されており(表1.27-2)、これは最も広範に画像化されてきた神経炎症標的です。
このタンパク質は活性化ミクログリアに特異的ではありませんが、TSPOの上昇は活性化ミクログリアの増加を示すものとして依然として解釈されています。この解釈は、炎症性物質であるリポ多糖の投与がTSPO放射性トレーサー結合を増加させたヒトおよび非ヒト霊長類の研究によって裏付けられています。
TSPOの最初のPETトレーサーは**[11C]PK11195**であり、多くの初期の研究でこの放射性リガンドが使用されました。しかし、[11C]PK11195は信号対バックグラウンド比が低いため、この標的のためのより良いトレーサーの探索が促されました。多くの新しいトレーサーが開発され、それらのすべてが、程度の差こそあれ、単一塩基多型(rs6971)に感受性があることが発見されました。研究参加者は、この第2世代トレーサーのTSPOに対する結合親和性が、優性アレルを2コピー持つ者(高親和性結合者、HABs)、優性アレルと劣性アレルのヘテロ接合体である者(混合親和性結合者、MABs)、または劣性アレルのホモ接合体である者(低親和性結合者、LABs)に応じて異なることが判明しています。一部の第2世代トレーサー、例えば[11C]PBR28では、LABsにおける特異的結合が非常に低く、事実上検出不可能です。
ほとんどの研究者が採用している戦略は、遺伝子スクリーニングを事前に行い、LABsを研究から除外し、HABまたはMABグループのメンバーシップを統計モデルにおける因子として扱うことです。明確な参照組織が存在しないため、ほとんどの研究者は**VT(総分布容積)**を結果測定値として報告しています。一部の研究、特に初期の[11C]PK11195研究では、2TC適合から推定された速度定数の比率から直接導出されたBPp(非タンパク質結合トレーサーを基準とした結合能)またはBPND(非置換性結合能)も報告されています。運動モデルのセクションで述べたように、これらは慎重に解釈されるべきです。
統合失調症および精神病におけるTSPO
[11C]PK11195を用いた初期の研究の一部は、統合失調症患者の皮質全体で、一致する対照よりも高いBPpまたはBPNDを報告しました。より新しい第2世代トレーサーを用いた多くの研究では、それらの結果は再現されませんでした。統合失調症および他の精神病性障害における第2世代トレーサーを用いた研究のメタアナリシスでは、患者において全体的にVTの低下または患者と対照の間で差がないことが判明しています。第2世代トレーサーのより優れた画像特性と、より信頼性の高い結果測定値であるVTを考慮すると、利用可能なデータは、精神病性障害におけるTSPO上昇の仮説を支持していません。
大うつ病におけるTSPO。MDDにおける研究では、統合失調症よりもTSPO結合と疾患との間に強い関連性が確立されています。現在までに、MDD患者と適合対照者を比較する7つの研究が実施されています。これらのうち6つは、主に第二世代トレーサーを使用して、皮質全体で患者の結合が増加していることを発見しました。個々の研究における追加の所見には、TSPO結合と末梢炎症性マーカーまたは未治療期間の関連性、および抗炎症薬に対する治療反応のTSPO結合の予測値が含まれていました。
心的外傷後ストレス障害(PTSD)におけるTSPO。神経炎症の画像マーカーはPTSDではまだ広範囲に研究されていませんが、興味深い結果が報告されています。ストレス関連障害は脳の神経免疫活性化と関連しているという仮説に反して、PTSD患者は前頭前野辺縁系の脳領域で、適合対照者よりも低い[11C]PBR28 VTを有することが判明し、VTは症状の重症度と血漿C反応性タンパク質レベルの両方と負の相関がありました。これらの結果は、PTSDの女性が対照者よりも低いTSPO発現を示す剖検データとも一致していました。この研究は再現が必要ですが、PTSD、MDD、精神病性障害の間でTSPO画像結果に違いがあることは、異なる精神疾患における神経免疫系の関与が非常に異なることを示唆しています。
神経炎症イメージングの他の標的。TSPOイメージングの限界は、神経炎症に関連する他の標的のための放射性トレーサーを開発する探求を促しました。これらのうち、最も進歩しているのはシクロオキシゲナーゼ1および2(COX-1、COX-2)であり、どちらも炎症過程に関与しています。COX-2は基礎レベルが低いですが、急性炎症状態に反応して急速に増加し、ミクログリアとニューロンの両方で発現します。[11C]MC1トレーサーはCOX-2に特異的ですが、低い基礎レベルは検出および定量化が困難です。COX-1はすべての組織で構成的に発現しており、脳ではミクログリアで優勢な発現が見られます。ベースライン結合を定量化する能力は、COX-1を精神科集団における慢性炎症を検出するためのより望ましい標的とする可能性があります。[11C]PS13はCOX-1トレーサーであり、健康なヒトボランティアの脳内で不均一な結合分布を示し、海馬、後頭葉、感覚運動皮質で最高のV7を示します。これは剖検脳からの既知のmRNA発現と一致しています。まだ初期の探索段階ではありますが、[11C]PS13を用いたCOX-1イメージングは、近い将来、精神科集団における神経炎症を調査するためのパラダイムとして試験される可能性が高いです。
将来の展望
PETやSPECTを用いた放射性トレーサーイメージングの分野は成長と拡大を続けており、これらの手法を用いた査読付き論文の数は毎年増加しています。技術と生物科学の両面における特定の分野の進歩は、イメージングの有用性と適用範囲を拡大させる可能性があります。より安価またはより携帯性の高いスキャナーやサイクロトロンの製造は、さらに広範な利用を促進するでしょう。
一部のメーカーはすでに、例えばBGO検出器結晶を利用することで、低コストのPET装置のラインを開発しています。BGO検出器結晶は、一部最適ではない特性を持つものの、LSOやその他の最先端のシンチレーターよりも安価です。その一方で、メーカーはハイエンドスキャナーで主要な技術的進歩を続け、より精細な空間分解能、高感度、再構成画像におけるより優れた信号対雑音比を実現しています。これらの画質の改善は、これらの装置がより広く使用されるようになるにつれて、研究イメージングにおいてより正確な結果につながることが期待されます。
PETまたはSPECTで対処できる科学的疑問を拡大する最も直接的な方法は、現在アクセスできない標的分子やプロセスのためのトレーサーの開発です。多数の試みにもかかわらず、グルタミン酸作動性およびGABA作動性伝達物質系のトレーサー開発は遅々としていますが、主要な興奮性および抑制性神経化学系を直接観察することは、すべての脳研究に利益をもたらすことは明らかです。コリン作動性およびオピオイド系などの他の伝達物質系の人体イメージング用トレーサーのライブラリは近年かなり広がり、これらは精神疾患への新たな洞察を提供する研究につながることが期待されます。統合失調症やうつ病における代替治療標的の最近の進展は、作用機序を確認するために新しいイメージングパラダイムを必要とするでしょう。
最後に、最終的にはPETおよびSPECT放射性トレーサーイメージングによって現在得られている神経化学情報は、例えばMRIで検出できる神経化学プローブの開発によって、より非侵襲的な方法に置き換えられる可能性もあります。しかし、予見可能な将来において、PETおよびSPECT神経イメージング法は、健康と疾患における脳の理解、そして薬剤開発プロセスに情報を提供するための不可欠なトランスレーショナルツールであり続けるでしょう。
参考文献
- Abihttps://www.google.com/search?q=-Dargham A, Gil R, Krystal J, et al. Increased striatal dopamine transmission in schizophrenia: confirmation in a second cohort. Am J Psychiatry. 1998;155:761https://www.google.com/search?q=-767.
- Abihttps://www.google.com/search?q=-Dargham A, Mawlawi O, Lombardo I, et al. Prefrontal dopamine D1 receptors and working memory in schizophrenia. J Neurosci. 2002;22:3708https://www.google.com/search?q=-3719.
- Abihttps://www.google.com/search?q=-Dargham A, Xu X, Thompson JL, et al. Increased prefrontal cortical D1 receptors in drug naive patients with schizophrenia: a PET study with [11C]NNC112. J Psychopharmacol. 2012;26:794https://www.google.com/search?q=-805.
- Baldassarri SR, Park E, Finnema SJ, et al. Inverse changes in raphe and cortical 5https://www.google.com/search?q=-HT1B receptor availability after acute tryptophan depletion in healthy human subjects. Synapse. 2020;74(10):e22159.
- Bhatt S, Hillmer AT, Girgenti MJ, et al. PTSD is associated with neuroimmune suppression: evidence from PET imaging and postmortem transcriptomic studies. Nat Commun. 2020;11(1):2360.
- Buchert R, Thiele F, Thomasius R, et al. Ecstasyhttps://www.google.com/search?q=-induced reduction of the availability of the brain serotonin transporter as revealed by 11CMcN5652https://www.google.com/search?q=-PET and the multihttps://www.google.com/search?q=-linear reference tissue model: loss of transporters or artifact of tracer kinetic modelling? J Psychopharmacol. 2007;21:628https://www.google.com/search?q=-634.
- Cherry SR, Sorenson JA, Phelps ME. Physics in Nuclear Medicine, 4th ed. Saunders; 2012.
- Erritzoe D, Ashok AH, Searle GE, et al. Serotonin release measured in the human brain: a PET study with [(11)C]CIMBIhttps://www.google.com/search?q=-36 and dhttps://www.google.com/search?q=-amphetamine challenge. Neuropsychopharmacology. 2020;45(5):804https://www.google.com/search?q=-810.
- Farde L, Wiesel FA, Halldin C, Sedvall G. Central D2https://www.google.com/search?q=-dopamine receptor occupancy in schizophrenic patients treated with antipsychotic drugs. Arch Gen Psychiatry. 1988;45(1):71https://www.google.com/search?q=-76.
- Farde L, Nordstrom AL, Wiesel FA, Pauli S, Halldin C, Sedvall G. Positron Emission Tomographic Analysis of Central D1https://www.google.com/search?q=-Dopamine and D2https://www.google.com/search?q=-Dopamine Receptor Occupancy in Patients Treated with Classical Neuroleptics and Clozapinehttps://www.google.com/search?q=-Relation to Extrapyramidal Sidehttps://www.google.com/search?q=-Effects. Arch Gen Psychiatry. 1992;49:538https://www.google.com/search?q=-544.
- Gunn RN, Slifstein M, Searle GE, Price JC. Quantitative imaging of protein targets in the human brain with PET. Phys Med Biol. 2015;60(22):R363https://www.google.com/search?q=-R411.
- Howes OD, Kambeitz J, Kim E, et al. The nature of dopamine dysfunction in schizophrenia and what this means for treatment. Arch Gen Psychiatry. 2012;69:776https://www.google.com/search?q=-786.
- Innis RB, Cunningham VJ, Delforge J, et al. Consensus nomenclature for in vivo imaging of reversibly binding radioligands. J. Cereb. Blood Flow Metab. 2007;27:1533https://www.google.com/search?q=-1539.
- Kegeles L, Abihttps://www.google.com/search?q=-Dargham A, Frankle WG, et al. Increased synaptic dopamine in associative regions of the striatum in schizophrenia. Arch. Gen. Psychiatry. 2010;67:231https://www.google.com/search?q=-239.
- Laruelle M. Imaging dopamine transmission in schizophrenia. A review and metahttps://www.google.com/search?q=-analysis. QJ Nucl Med. 1998;42:211https://www.google.com/search?q=-221.
- Laruelle M. Imaging synaptic neurotransmission with in vivo binding competition techniques: a critical review. J Cereb Blood Flow Metab. 2000;20:423https://www.google.com/search?q=-451.
- Laruelle M, Slifstein M, Huang Y. Relationships between radiotracer properties and image quality in molecular imaging of the brain with positron emission tomography. Mol Imaging Biol. 2003;5:363https://www.google.com/search?q=-375.
- Martinez D, Narendran R, Foltin RW, et al. Amphetaminehttps://www.google.com/search?q=-induced dopamine release: markedly blunted in cocaine dependence and predictive of the choice to selfhttps://www.google.com/search?q=-administer cocaine. Am J Psychiatry. 2007;164:622https://www.google.com/search?q=-629.
- Martinez D, Slifstein M, Broft A, et al. Imaging human mesolimbic dopamine transmission with positron emission tomography. Part II: amphetaminehttps://www.google.com/search?q=-induced dopamine release in the functional subdivisions of the striatum. J. Cereb. Blood Flow Metab. 2003;23:285https://www.google.com/search?q=-300.
- Meyer JH, Cervenka S, Kim MJ, Kreisl WC, Henter ID, Innis RB. Neuroinflammation in psychiatric disorders: PET imaging and promising new targets. Lancet Psychiatry. 2020;7(12):1064https://www.google.com/search?q=-1074.
- Narendran R, Mason NS, Laymon CM, et al. A comparative evaluation of the dopamine D(2/3) agonist radiotracer 11Chttps://www.google.com/search?q=-Nhttps://www.google.com/search?q=-propylhttps://www.google.com/search?q=-norapomorphine and antagonist [11C]raclopride to measure amphetaminehttps://www.google.com/search?q=-induced dopamine release in the human striatum. J Pharmacol Exp Ther. 2010;333(2):533https://www.google.com/search?q=-539.
- Okubo Y, Suhara T, Suzuki K, et al. Decreased prefrontal dopamine D1 receptors in schizophrenia revealed by PET. Nature. 1997;385:634https://www.google.com/search?q=-636.
- Plavénhttps://www.google.com/search?q=-Sigray P, Matheson GJ, Collste K, et al. Positron emission tomography studies of the glial cell marker translocator protein in patients with psychosis: a metahttps://www.google.com/search?q=-analysis using individual participant data. Biol Psychiatry. 2018;84(6):433https://www.google.com/search?q=-442.
- Shotbolt P, Tziortzi AC, Searle GE, et al. Withinhttps://www.google.com/search?q=-subject comparison of [Chttps://www.google.com/search?q=-11]https://www.google.com/search?q=-(https://www.google.com/search?q=%2B)https://www.google.com/search?q=-PHNO and [Chttps://www.google.com/search?q=-11]raclopride sensitivity to acute amphetamine challenge in healthy humans. J Cereb Blood Flow Metab. 2012;32(1):127https://www.google.com/search?q=-36.
- Shrestha S, Hirvonen J, Hines CS, et al. Innis: Serotoninhttps://www.google.com/search?q=-1A receptors in major depression quantified using PET: controversies, confounds, and recommendations. Neuroimage. 2012;59:3243https://www.google.com/search?q=-3251.
- Slifstein M, Laruelle M. Models and methods for derivation of in vivo neuroreceptor parameters with PET and SPECT reversible radiotracers. Nucl Med Bio. 2001;28:595https://www.google.com/search?q=-608.
- Slifstein M, van de Giessen E, Van Snellenberg J, et al. Deficits in prefrontal cortical and extrastriatal dopamine release in schizophrenia: a positron emission tomographic functional magnetic resonance imaging study. JAMA Psychiatry. 2015;72(4):316https://www.google.com/search?q=-324.
- Urban NB, Girgis RR, Talbot PS, et al. Sustained recreational use of ecstasy is associated with altered pre and postsynaptic markers of serotonin transmission in neocortical areas: a PET study with [(1)(1)C]DASB and [(1)(1)C]MDL 100907. Neuropsychopharmacology. 2012;37:1465https://www.google.com/search?q=-1473.
- van de Giessen E, Weinstein JJ, Cassidy CM, et al. Deficits in striatal dopamine release in cannabis dependence. Mol Psychiatry. 2017;22(1):68https://www.google.com/search?q=-75.
- Volkow ND, Wang GJ, Fowler JS, et al. Decreased striatal dopaminergic responsiveness in detoxified cocainehttps://www.google.com/search?q=-dependent subjects. Nature. 1997;386:830https://www.google.com/search?q=-833.

