- 2.2 脳血管障害の神経精神医学的側面
- 比較病因論(Comparative Nosology)
- 疫学
- 精神病 (Psychosis)
- 無関心 (Apathy)
- 脳卒中後無関心の有病率に関する最近の研究(表2.2-1)
- 脳卒中後の無関心
- 図2.2-1. 脳卒中後の無関心の発症
- 破局反応 (Catastrophic Reaction)
- 仮性球麻痺性感情 (Pseudobulbar Affect)
- 失認症 (Anosognosia)
- 病因論 (Etiology)
- 躁病 (Mania)
- 精神病 (Psychosis)
- 無関心 (Apathy)
- 表2.2-2. 脳卒中後無関心における最近の画像所見
- 神経学的診察における認知症の鑑別診断の手がかり
- 破局反応 (Catastrophic Reaction)
- 仮性球麻痺性感情 (Pseudobulbar Affect)
- 診断と臨床特徴
- 抑うつ (Depression)
- 躁病 (Mania)
- 不安 (Anxiety)
- 無関心 (Apathy)
- 表2.2-3. 無関心にみられる感情の欠如、活動の緩慢化、および認知活動の障害の存在を判断するために使用される無関心尺度からの質問
- 無関心 (Apathy)
- 破局反応 (Catastrophic Reactions)
- 仮性球麻痺性感情 (Pseudobulbar Affect: PBA)
- 病理と検査 (Pathology and Laboratory Examination)
- 病的笑いと泣き尺度 (Pathological Laughing and Crying Scale: PLACS)
- 脳卒中後うつ病(PSD)の診断における検査
- その他の障害の検査
- 経過と予後 (Course and Prognosis)
- 脳卒中後うつ病(PSD)と認知機能障害
- 身体機能回復(ADL)とPSD
- 死亡率とPSD
- 抗うつ薬治療と死亡率
- 図2.2-4. 脳卒中後3ヶ月間の治療後の死亡率
- 脳卒中後うつ病(PSD)の臨床経過を示す症例報告
- 躁病 (Mania)
- 不安 (Anxiety)
- 図2.2-5. 双極性障害または躁病のみの患者における脳卒中病変の脳画像
- 脳卒中後不安 (Anxiety)
- 無関心 (Apathy)
- 図2.2-6. 脳卒中後の大うつ病と不安障害の縦断的関連
- その他の障害の経過と予後
- 治療 (Treatment)
- 図2.2-7. 不安症状と脳卒中発生の関係に基づいた推定生存関数(年齢と性別で調整後)
- 高血圧と血管性認知症
- 脳卒中関連認知機能障害のリスクが高い患者の治療
- 血管性認知症患者の治療
- 脳卒中後うつ病(PSD)の治療
- 図2.2-8. 脳卒中後うつ病予防のための4つの無作為化試験のまとめ
- 脳卒中後うつ病(PSD)の治療:その他の有望な進歩
- 躁病 (Mania)
- 不安障害 (Anxiety Disorders)
- 精神病 (Psychosis)
- 無関心 (Apathy)
- 仮性球麻痺性感情(Pseudobulbar Affect: PBA)
- その他の障害 (Other Disorders)
- 謝辞 (ACKNOWLEDGMENTS)
- 参考文献 (FURTHER READINGS)
2.2 脳血管障害の神経精神医学的側面
スタンレー・リンドン医学博士、フアン・カルロス・ウリザール医学博士
定義
脳血管障害とは、脳への血液供給を途絶させる多数の疾患を指します。これらの障害は、その病因に基づいて2つのグループに分けられます。**虚血性(血流の欠如)と出血性(脳内または脳を覆う膜の周囲での出血)**です。また、影響を受ける血管の大きさによって分類することもできます。大血管病変は脳に大きな病変を引き起こすのに対し、小血管(細動脈)病変は小さなラクナ病変を引き起こします。血管病変は脳のあらゆる領域で発生する可能性があります。
臨床医は1世紀以上にわたり、神経精神障害と脳血管疾患との関連性を認識してきました。しかし、この主題が体系的な科学的調査の焦点となったのは、過去40年間のことです。本章では、脳卒中の神経精神医学的相関に焦点を当てます。
脳卒中は、脳への血流が突然途絶し、永久的な組織損傷を引き起こすものと定義されます。脳卒中のほぼ90%が虚血性であり、残りの10%は出血性の事象によって引き起こされます。出血性脳卒中は、稀ではあるものの、虚血性脳卒中よりも重症である傾向があり、死亡率も高くなっています。
世界で最も一般的な重篤な神経疾患である脳卒中は、世界の公衆衛生上の負担となっています。世界保健機関は、毎年世界中で1500万人が脳卒中と診断されていると推定しています。脳卒中の年齢別発生率は、生涯にわたって劇的に変化します。米国心臓協会が発表した「心臓病と脳卒中統計の2021年更新」によると、米国における周産期脳卒中の全体的な発生率は、出生10万人あたり29人です。
脳卒中の発生率は年齢とともに著しく増加し、85歳以上で初めての脳卒中の発生率が最も高くなります。しかし、全脳卒中の約10%は18歳から50歳の個人で発生します。55歳から64歳の成人では、初めての脳卒中の年間発生率は1,000人あたり2.2〜5.3人であるのに対し、75歳から84歳の高齢者では1,000人あたり8.9〜13.8人です。85歳以上の脳卒中患者は、全脳卒中患者の17%を占めます。米国だけでも、毎年795,000件の脳卒中が発生し、約130,000人が脳卒中関連で死亡しています。脳卒中は、米国における死因の第4位であり、世界では死因の第2位です。2010年から2050年の期間で、脳卒中の発生件数は2倍以上になると予想されており、その増加の大部分は高齢者(75歳以上)およびマイノリティグループに集中すると見られています。超高齢の患者は、リスク調整後の死亡率が高く、障害がより重く、入院期間が長く、エビデンスに基づいたケアを受ける機会が少なく、元の住居に退院できる可能性が低くなっています。
歴史
脳損傷(通常は脳血管疾患によって引き起こされる)後の抑うつに関する初期の報告は、症例記述において神経学者と精神科医によって行われました。アドルフ・マイヤーは、1900年代初頭の言語機能のような大脳局在に関する新しい発見が、脳の中心と機能の過度に性急な特定につながったと警告しました。彼は、せん妄、認知症、失語症などのいくつかの臨床症候群が脳損傷の直接的な結果であると特定しました。しかし、ほとんどの精神的な「反応」の生物心理社会的な原因に関する彼の見解に沿って、彼は躁うつ病やパラノイア状態は、脳損傷(具体的には左前頭葉と皮質凸面を挙げている)、精神疾患の家族歴、および病前からの個人的な精神疾患の組み合わせから生じると考えました。オイゲン・ブロイラーは、脳卒中後の患者に「数ヶ月、時にはそれ以上続く憂鬱な気分が頻繁に現れる」と記述しました。エミール・クレペリンは、躁うつ病と脳血管疾患との関連性を認識しました。彼は、「抑うつ状態の診断は、特に動脈硬化が関与している場合に困難を伴うことがある」と述べました。クレペリンは、脳血管障害が躁うつ病の随伴現象である可能性、またはそれ自体が抑うつ障害を引き起こす可能性があると結論付けました。
仮性球麻痺性感情(PBA)は、脳梗塞を含む脳損傷と関連付けられてきたもう一つの感情障害であり、脳卒中患者における抑うつの鑑別診断の一つです。1956年、レッドヴァース・アイアンサイドは、この状態の臨床症状を記述し、患者の感情表現が報告された内的な感情状態とは特徴的に無関係であると指摘しました。笑いまたは泣きは、自発的に、あるいは一見些細な誘発の後にも起こることがあります。表現される感情は、刺激と経験された感情状態の両方に対して誇張されており、時には経験された感情状態と完全に不一致です。ここでの感情の表現は不随意で制御不能です。この現象には、病的笑いと泣き(PLAC)、感情失禁、感情不安定、病的感情過多、不随意感情表現障害など、様々な名称が与えられてきました。均一性の目的で、本章では臨床現場でより広く使用されている用語であるPBAを使用します。
もう一つの感情異常、これも脳損傷に特徴的であると考えられているのは、デレク・デニー・ブラウンが1952年に記述した無関心反応です。右半球病変と関連しており、この反応は失敗に対する無関心、家族や友人への関心の欠如、愚かな冗談の楽しみ、身体的困難の最小化として記述されました。19世紀後半、レオノーレ・ヴェルトは初めて、眼窩前頭葉損傷と関連する多幸感と多弁症を記述しました。ヘルマン・オッペンハイムは、これらの患者における不適切なユーモアを指すために「ウィッツェルズフト」という用語を使用し、カール・クレイストは、眼窩前頭皮質が感情生活の中心であり、背外側前頭皮質が精神運動および知的活動の源であると述べました。
クルト・ゴールトシュタインは、脳卒中などの脳損傷に歴史的に関連付けられてきたもう一つの神経精神障害を記述し、それを破局反応と呼びました。彼はこの反応を、様々な程度の怒り、欲求不満、抑うつ、涙ぐむ、拒否、叫び、罵倒、時には攻撃的な行動を含む感情的な爆発として特徴づけました。ゴールトシュタインは、この反応を、身体的または認知機能に深刻な欠陥がある状況に直面した際に、有機体が対処できないことに起因するとしました。
ジョセフ・ジュール・フランソワ・フェリックス・バビンスキーは、患者が自身の片麻痺に気づいていないことを示すために**失認症(anosognosia)**という用語を導入しました。バビンスキーはこの状態を「脳性片麻痺で私が観察する機会を得た精神障害であり、患者が自分を襲う麻痺を知らない、あるいは知らないように見えるという事実にある」と記述しました。この用語は、皮質盲、半盲、健忘など、脳卒後における他の欠陥に対する認識不足にも拡張されています。
比較病因論(Comparative Nosology)
**精神疾患の診断・統計マニュアル第5版(DSM-5)**は、脳卒中後の精神病性、気分障害、不安障害を「他の医学的状態(脳卒中)による障害」と定義しています。患者の臨床症状に関する詳細情報を提供するために、関連する特定因子が診断に適用されます。例えば、DSM-5によれば、大うつ病エピソードの完全な基準を満たす脳卒中後の抑うつ症候群は、「脳卒中によるうつ病、大うつ病様エピソードを伴う」と称されます。
脳卒中後の亜症候性うつ病(軽症うつ病とも呼ばれる)は、もう一つの有益な症例例を提供します。脳卒中後に一般的に見られる亜症候性うつ病の症状は、大うつ病エピソードに必要な症状のうち、2つ以上5つ未満の特徴を持ち、少なくとも2週間持続することが特徴です。DSM-5の名称によれば、このような臨床シナリオは「脳卒中によるうつ病、抑うつ症状を伴う」として分類されます。
DSM-5基準に基づく脳卒中後の不安の診断は、不安障害の現象学的特徴に関わらず「脳卒中による不安障害」と称されます。例えば、ある患者はパニック障害を示唆する不安症状を持つかもしれませんが、別の患者は全般性不安障害(GAD)とより一致する症状を持つかもしれません。これらの両方の患者は、DSM-5に従って「脳卒中による不安障害」と診断されます。
DSM-5の疾患で、脳血管疾患に特異的なものは、主要または軽度血管性神経認知障害のみです。DSM-5は、血管性疾患による2つの形態の認知機能障害を特定しています。それは、主要血管性神経認知障害と軽度血管性神経認知障害です。「血管性認知症」という用語(DSM第4版で使用されていたもの)は、「主要血管性神経認知障害」という用語に置き換えられました。また、「軽度認知機能障害」の代わりに「軽度血管性神経認知障害」が使用されるようになりました。PBAや破局反応など、脳損傷に特異的な前述の他の神経精神障害には、DSM-5に定義された診断基準がありません。
身体疾患と共存する抑うつを研究する研究者たちは、一部の症状(例:睡眠や食欲の障害)が身体疾患から直接生じる可能性がある場合、これらの障害の診断に最も適切な方法について議論してきました。この複雑なシナリオにおける抑うつを評価するために、以下の4つのアプローチが使用されてきました。
- 包括的アプローチ:抑うつの診断症状は、身体疾患に関連しているかどうかに関わらず数えられます。
- 病因的アプローチ:抑うつ症状は、診断医が身体疾患によって引き起こされたものではないと感じた場合にのみ数えられます。注目すべきは、これがDSM-5の診断を行う際に使用される方法であるということです。
- 代替アプローチ:抑うつの他の心理的症状が神経栄養症状を置き換えます。
- 排他的アプローチ:症状が、抑うつ患者で非抑うつ患者よりも頻繁に見られない場合、診断基準から除外されます。
1997年、セルジオ・パラディソと共同研究者は、脳卒中後の最初の2年間の抑うつ診断におけるこれらの方法の有用性を検討しました。急性脳卒中患者205人のうち、142人の患者が脳卒中後3、6、12、または24ヶ月で診察のために追跡調査されました。追跡調査を受けた142人の患者のうち、60人(42%)は入院中に抑うつ気分を報告し(抑うつ群)、残りの82人は抑うつではありませんでした。抑うつ症状は、**植物性(例:自律神経性不安または主観的アネルギー)と心理的(例:心配または絶望感)**のサブタイプに分けられました。
抑うつ群と非抑うつ群で、異なる追跡調査期間において、抑うつ群で有意に頻繁ではなかった植物性症状は以下の通りでした。
- 初回評価時:体重減少、早朝覚醒
- 6ヶ月時:体重減少、早朝覚醒
- 1年時:体重減少、早朝覚醒、不安な予感、性欲減退
- 2年時:体重減少、性欲減退
心理的症状のうち、抑うつ患者は2年間の追跡調査期間を通して、ほとんどの心理的症状の頻度が高かった。抑うつ群で非抑うつ群よりも有意に頻繁ではなかった心理的症状は以下の通りでした。
- 3ヶ月時:自殺企図、単純な関係妄想、病的罪悪感
- 6ヶ月時:病的罪悪感
- 1年時:病的罪悪感、自殺企図、罪悪感のある関係妄想、易怒性
- 2年時:病的罪悪感、自己卑下
これらの知見は、2010年のカミングらによる最近の研究によって裏付けられています。この研究には、脳卒中後18ヶ月の患者149人と、一般集団から年齢と性別をマッチさせたコントロール745人が含まれていました。大うつ病エピソードは、脳卒中患者149人中25人(17%)とコントロール745人中61人(8%)で診断されました。これら2つの抑うつ群間で症状プロファイルを比較すると、コントロール群は脳卒中群と比較して「感情を感じられない」ことをより多く報告しました。それ以外に、グループ間の症状プロファイルに統計的に有意な差はありませんでした。さらに、抑うつの10の心理的および身体的症状の因子分析では、抑うつ診断に関わらず、脳卒中群とコントロール群の間で差は認められませんでした。
要するに、これら2つの研究は、脳卒中後うつ病(PSD)の現象論が一般集団におけるうつ病と類似していることを示唆しています。言い換えれば、これら2つの集団でうつ病の同じ診断基準を使用することは有効であるようです。したがって、DSM-5は、脳卒中を伴わない患者で発生する大うつ病と同じ症状に基づいて脳卒中による抑うつ障害を定義しています。
疫学
血管性主要神経認知障害
病因論のセクションで議論されたように、DSM-5は現在、血管性認知症を主要または軽度神経認知障害の病因的サブタイプとして分類しています。しかし、「認知症」や「血管性認知症」は公表された研究で引き続き一般的に使用されている用語であるため、以下の公表された研究のレビューでは、「認知症」と「主要神経認知障害」(および「血管性認知症」と「血管性主要神経認知障害」)を同義語として使用します。
2000年、アントニオ・ロボと共同研究者は、人口ベースの研究に基づいてヨーロッパにおける認知症の有病率のレビューを行いました。軽度から重度の認知症の合計2,346症例に基づくと、年齢標準化された全原因認知症の有病率は6.4%、アルツハイマー病による認知症(dAD)は4.4%、血管性認知症は1.6%でした。著者らは、血管性認知症の生涯有病率が加齢とともに一貫して増加することを発見しました。65歳から69歳のプーリングされた有病率は男性で0.5%、女性で0.1%でしたが、90歳以上の男性では3.6%、女性では5.8%でした。
2007年、エイジング、人口統計、記憶研究(Aging, Demographics, and Memory Study)は、米国における認知症の有病率を推定しました。71歳以上の約850人の高齢者で構成され、認知症全体の有病率は13.9%であり、これは340万人に相当します。血管性認知症の有病率は2.43%でした。アジアでは、過去20年間まで血管性認知症はdADよりも一般的でした。発展途上国における認知症の疫学に関するレビューで、ラージ・カラリアと共同著者は、一部のラテンアメリカ諸国とアジア諸国を除いて、血管性認知症の有病率は低いようだと結論付けました。全体として、彼らは発展途上国における血管性認知症の有病率を0.6%から2.1%と推定しています。最後に、81の研究を含むウナ・クランシーらによる2021年のメタアナリシスでは、白質病変(WMH)の重症度が高いほど無関心と関連があることが見出されました。WMHの重症度が高いほど、せん妄と疲労とも関連していました。
高血圧は、世界中で最も一般的な修正可能な脳卒中リスク因子であることが示されており、血管関連認知機能障害とアルツハイマー病との強い関連性に媒介効果を持つ可能性があります。血管性認知症患者173人を対象とした縦断研究では、脳卒中および脳アテローム性動脈硬化症の危険因子の頻度を調べました。高血圧は脳アテローム性動脈硬化症と脳卒中の最も一般的な危険因子でしたが、このサンプルでは低血圧が血管性認知症の最も一般的な危険因子でした。心臓不整脈の有無にかかわらず、アテローム性動脈硬化症型の心臓病も、血管性認知症の症例の大多数で存在していました。心臓病は脳塞栓源となり、血管性認知症を引き起こす可能性があります。1日1パック以上の喫煙は21%で危険因子でした。高トリグリセリド血症である4型高脂血症は29%の症例で存在していました。医学的治療を必要とする臨床的に十分な重症度の糖尿病は20%の症例で見つかり、下肢に関連する虚血性症状を伴う症候性末梢血管疾患は6%で存在していました。血管性認知症は学歴の低さとも関連しており、教育に関連する予防努力が疾患の進行を遅らせる、または予防するのに効果的である可能性を示唆しています。あるいは、学歴の低さとの関連性は、この疾患の発症を抑制する可能性のある学習の社会的または神経生物学的な利点を示唆しているのかもしれません。
抑うつ
脳卒中後の抑うつの有病率を検討したいくつかのレビューがあります。最も新しいものでは、ルイス・アヤーベと共同研究者が、20,293人の患者を含む43の研究のデータを評価しました。彼らは、任意の時点で観察された抑うつのプーリングされた有病率が**29%であることを発見しました。有病率は時間経過や異なる設定の研究で有意な差はありませんでした。PSDの累積発生率は、脳卒中後5年以内に39%から52%**でした。
別の大規模なレビュー(51のコホートと25,207人の患者)では、マリー・L・ハケットの研究グループは、脳卒中患者の**33%が抑うつを経験すると推定しました。両方のレビューは、PSDの有病率の推定が、抑うつの種類(例:症候性対亜症候性抑うつ)や集団の種類(例:病院ベース対外来サンプル)など、重要な臨床変数の異質性によって混乱していることを強調しています。これらの限界に対処するため、ボブ・ロビンソンと共同研究者は2006年にこれらの要因の系統的レビューを実施しました。地域ベースの環境における2,108人の患者のうち、大うつ病の有病率は14.1%であり、軽症うつ病の有病率は9.1%**でした。合計2,769人の患者が急性期またはリハビリテーション病院で治療を受けました。これらの患者のうち、**21.6%が大うつ病の基準を満たし、さらに20.0%が軽症うつ病でした。外来患者の研究では、大うつ病と軽症うつ病の有病率はそれぞれ24.0%と23.9%**でした。
自殺念慮は、急性脳卒中発症直後に発症することがあります。特に、学歴が低い患者、以前に気分障害の既往がある患者、および脳卒中の急性期に抑うつ症状を発症した患者に多く見られます。2015年のレビューで、マウリツィオ・ポンピリと共同研究者は、PSD、既存の気分障害、脳卒中の既往歴、および認知機能障害が脳卒中後の自殺の最も重要なリスク因子であることが判明したと結論付けました。
躁病
PSDと比較して、脳卒中後の躁病は稀な神経精神医学的発生であり、文献は主に症例報告または少数の症例シリーズで構成されています。カタリナ・サントーザと共同研究者は、その人口統計学的および臨床的特徴をよりよく理解するために、2011年に脳卒中後躁病の系統的レビューを実施しました。彼らの文献検索は約50年をカバーし、成人脳卒中患者の躁病症例が合計74件得られました。著者らは、典型的な患者は、精神疾患の個人的または家族歴がなく、少なくとも1つの血管危険因子を持ち、皮質下萎縮がなく、右脳梗塞がある男性であったことを観察しました。全体として、この研究は脳卒中後の躁病の稀さを示しています。
不安
2018年のレビューとメタアナリシスで、レナ・ラフステンと共同研究者は、脳卒中後1年間の不安障害のプールされた有病率を**29.3%**と推定しました。リスクは脳卒直後が最も高く、1年間で減少し、脳卒中後0~2週で36.7%、脳卒中後2週~3ヶ月で24.1%、脳卒中後3~12ヶ月で23.8%の頻度推定でした。
2013年の44の報告と5,760人の脳卒中患者のメタアナリシスでは、臨床面接によって決定された脳卒中後の不安障害のプールされた推定値は**18%でした。不安症状が評価尺度によって評価された場合、不安の有病率は25%**でした。含まれた研究のうち3つは、異なる不安障害の相対頻度を検討し、恐怖症性障害と全般性不安障害(GAD)が最も一般的であることを発見しました。さらに、不安の有病率は時間とともに増加する傾向がありました。脳卒中後1ヶ月では20%、1ヶ月から5ヶ月では23%、6ヶ月以上では24%が不安症状を持っていました。これらの結果は、脳卒中後に不安症状が一般的に見られ、持続する傾向があることを示唆しています。このレビューでは、研究設定(人口ベース対病院対リハビリテーション対地域ベース)に関わらず、同様の有病率推定値が報告されました。
脳卒中後の不安障害を持つ患者のかなりの数が、抑うつも併発しています。脳卒中後3ヶ月以内の1,445人の患者を対象としたレビューでは、49%が併存する抑うつを伴わないGADの基準を満たし、14%が併存するGADと大うつ病を有していました。地域サンプルでは、GAD単独の割合は2%で、抑うつを伴うGADは8%でした。病院および外来サンプルでは、GAD単独は5.5%の症例で発生し、抑うつを伴うGADは15.2%で発生しました。したがって、脳卒中後の不安障害は抑うつ障害と頻繁に併存しますが、かなりの数の患者が不安単独で発症します。
多数の症例報告が存在しますが、脳卒後における異なる種類の不安障害(例:恐怖症やパニック障害)の頻度に関する体系的な研究からのデータは不足しています。しかし、現在、脳卒後におけるPTSDの発生に関する文献が増加しています。例えば、ゴールドフィンガーと共同研究者は、脳卒中または一過性脳虚血発作(TIA)を経験した535人の患者を評価し、18%がPTSDである可能性が高いことを発見しました。一般的に、PTSDである可能性が高い患者は、身体的および精神的健康状態が悪化していました。脳卒中後PTSDの予測因子には、低収入、繰り返しの脳卒中またはTIAの既往、より重い障害、およびより多くの医学的併存疾患が含まれていました。高齢、恋愛関係のパートナーの存在、および感情的支援があることは、PTSDの発症に対する防御因子でした。この文献はまだ初期段階ですが、このような研究は様々な急性医学的イベント後のPTSDの研究に貴重な貢献をしています。
精神病 (Psychosis)
稀ではありますが、脳卒後精神病は症例報告や経験的調査によって記録されており、主に妄想や幻覚の存在によって特定されます。2つの病院登録研究が最初に脳卒後精神病の疫学的特徴を評価しました。報告された精神病性障害の頻度は、脳卒中患者の0.4%と3.1%であり、発生率は1,000人年あたり1.1件、発症までの中央値は脳卒中後6.1ヶ月でした。
脳卒中後の精神病は、最近のヘレ・スタンゲランドらによる系統的レビューでも評価されています。彼らは76の研究を対象としました。脳卒後精神病の平均年齢は66.6歳であり、遅発性が一般的でした。神経学的症状は脳卒中に典型的でしたが、かなりの少数で、他に「無症候性脳卒中」がありました。最も一般的な精神病は妄想性障害であり、次いで統合失調症様精神病、そして精神病性特徴を伴う気分障害でした。推定される妄想の有病率は4.67%、幻覚は5.05%でした。12年間の発生率は6.7%でした。病変は典型的には右半球、特に前頭葉、側頭葉、頭頂葉、および右尾状核に位置していました。一般的に、脳卒後精神病は不良な機能的転帰と高い死亡率と関連していました。精神病は、脳卒中の病気負担を著しく増加させます。
無関心 (Apathy)
DSM-5にはこの状態の診断基準は含まれていませんが、無関心は、感情、情緒、興味、関心、または意欲の欠如または不在によって特徴付けられ、脳卒中を含む脳損傷患者で頻繁に報告されています。過去5年間で、無関心は脳卒中関連障害の中で最も精力的に研究されているものの一つとなっています。表2.2-1は、脳卒後無関心の有病率に関する最近のいくつかの研究の概要を示しています。
表2.2-1. 脳卒中後無関心の有病率に関する最近の研究
| 著者 (年) | 研究デザイン | 患者数 (n) | 平均年齢 (歳) | 脳卒中後の期間 | 無関心の有病率 (%) |
| Marin et al. (1991) | 前向き、コホート | 50 | 65.4 | 1ヶ月後 | 24.0 |
| Starkstein et al. (1992) | 前向き、コホート | 70 | 68.3 | 3ヶ月後 | 31.4 |
| Jorge et al. (2003) | 前向き、コホート | 136 | 66.8 | 3ヶ月後 | 22.1 |
| Brodaty et al. (2003) | 後ろ向き、横断 | 226 | 74.0 | 6ヶ月後 | 27.0 |
| Okada et al. (2007) | 前向き、コホート | 100 | 70.2 | 1年後 | 20.0 |
| Kandiah et al. (2008) | 後ろ向き、横断 | 120 | 67.5 | 1ヶ月後 | 18.3 |
| van Dijk et al. (2010) | 前向き、コホート | 160 | 69.5 | 1ヶ月後 | 26.0 |
| Cottrell et al. (2010) | 前向き、コホート | 80 | 68.1 | 3ヶ月後 | 25.0 |
| Cumming et al. (2010) | 後ろ向き、横断 | 149 | 73.2 | 18ヶ月後 | 28.2 |
| Chemerinskaia et al. (2011) | 前向き、コホート | 90 | 67.8 | 3ヶ月後 | 23.3 |
| Vataja et al. (2012) | 前向き、コホート | 94 | 70.5 | 1年後 | 26.6 |
| Paradiso et al. (2012) | 前向き、コホート | 142 | 67.2 | 2年後 | 29.6 |
| Kauhanen et al. (2014) | 前向き、コホート | 109 | 63.9 | 3ヶ月後 | 22.0 |
| Zuo et al. (2015) | 後ろ向き、横断 | 230 | 68.5 | 1ヶ月後 | 28.7 |
| Qu et al. (2016) | 前向き、コホート | 150 | 67.1 | 3ヶ月後 | 25.3 |
| Lim et al. (2017) | 後ろ向き、横断 | 210 | 69.8 | 6ヶ月後 | 24.3 |
| Tang et al. (2018) | 前向き、コホート | 120 | 65.5 | 3ヶ月後 | 23.5 |
| Zhang et al. (2019) | 前向き、コホート | 180 | 68.0 | 6ヶ月後 | 26.7 |
| Lan et al. (2020) | 前向き、コホート | 200 | 66.7 | 1年後 | 27.5 |
| Meta-analysis by van der Stelt et al. (2021) | メタアナリシス (複数の研究の統合) | N/A | N/A | N/A | 26.4 |
| Meta-analysis by Una Clancy et al. (2021) | メタアナリシス (複数の研究の統合) | N/A | N/A | N/A | 27.2 |
注記: この表は、異なる研究デザイン、患者数、脳卒中後の期間、および無関心の有病率に関する多様な結果を示しています。これは、脳卒後無関心の研究が進行中であり、その有病率の推定が異なる要因によって変動する可能性があることを示唆しています。
脳卒中後無関心の有病率に関する最近の研究(表2.2-1)
| 研究 (年) | N (患者数) | 無関心の頻度 | 多変量モデルに基づく関連変数 |
| Brodaty et al. (2013) | Index: 135 | Index: 32% | 認知症 |
| Year 5: 70 | Year 1: 33% | 新規脳卒中 | |
| Year 3: 37% | ADL(日常生活動作)障害 | ||
| Year 5: 37% | |||
| Caeiro et al. (2012) | 94 | 38% | 脳出血 |
| 低学歴 | |||
| Caeiro et al. (2013) | メタアナリシス: 2,221 | 36% | 抑うつ |
| 認知機能障害 | |||
| Mayo et al. (2009) | 408 | 50% 低スコア | 低い回復力と関連する高スコア |
| 3% 高スコア | |||
| 7% 改善 | |||
| Tang et al. (2013) | 75 | 33% | 抑うつ |
| Tang et al. (2014) | 391 | 9% | 精神的QOL(生活の質)の低下 |
| van Dalen et al. (2013) | メタアナリシス: 2,706 | 35% | 女性 |
| 高齢 | |||
| 認知機能障害 | |||
| 重度障害 | |||
| 抑うつ |
脳卒中後の無関心
2,221人の脳卒中患者を対象とした2013年のメタアナリシスでは、無関心が高齢、抑うつ、および認知機能障害と関連していることが判明しました。無関心の頻度は、性別、脳卒中の種類(虚血性か出血性か)、病変部位(左半球病変か右半球病変か)を考慮しても差はありませんでした。興味深いことに、日常生活活動(ADL)の指標が調べられた際、無関心の存在は臨床転帰に影響を与えないようでした。
しかし、別の研究では異なる結果が示されています。80人の急性期脳卒中患者の研究では、18人(22.5%)が無関心を呈しており、無関心のない62人の脳卒中患者と比較されました。9人(11.3%)は無関心と抑うつを併発していました。抑うつの有無にかかわらず、無関心のある患者は無関心のない患者よりも有意に高齢でした。また、無関心のある患者はADLにおいて有意に重度の障害を示しました。無関心と抑うつの両方の基準を満たした9症例は、無関心単独または抑うつ単独の患者よりもADLが著しく障害されていました。
清二浜(Seiji Hama)らは、抑うつと無関心が機能回復に与える異なる影響についてさらに調査しました。出血性または虚血性脳卒中患者237人のサンプルに基づき、著者らは無関心が抑うつよりも機能回復不良のより強力な予測因子であることを発見しました。Douven et al.の画像マーカーに関する研究のメタアナリシスも、急性期および亜急性期にPSA(脳卒中後無関心)を発症するリスクがある人を決定する上で、病変の種類が病変の側方性や位置よりも重要な要因である可能性があると結論付けました。
24のコホートからの2,706人の患者を対象とした最近のメタアナリシスでは、脳卒中後中央値120日での無関心の平均有病率は34.6%でした。無関心のある患者の40.1%に抑うつが見られたことから、無関心が抑うつとは別に発生することが多いことが示唆されます。無関心患者における抑うつの相対リスク推定値は1.8でした。
ごく最近の縦断的1年間の研究では、脳卒中後1年以内に患者の41.1%が無関心の診断基準を満たしたことが判明しました。さらに、発症までの平均月数は3.8±3.3ヶ月であり、無関心の診断基準を満たしていた平均期間は5.6±2.3ヶ月でした(図2.2-1参照)。線形混合モデルにおいて、著者らは年齢、初期の障害の重症度、および大うつ病を調整した結果、無関心群の患者は非無関心患者と比較して、脳卒中後1年間の認知機能とADLの回復が有意に少ないことが判明しました。
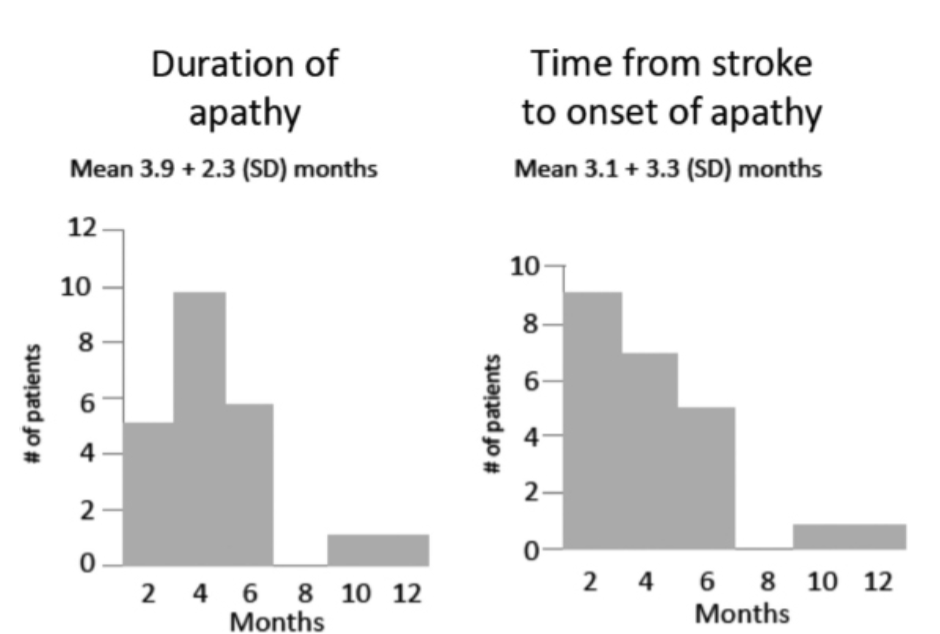
図2.2-1. 脳卒中後の無関心の発症
- 左側: ロバートらによって提唱された無関心の診断基準を満たした患者の数を示します。各列の右端は、その無関心が持続した期間を表します。例えば、5人の患者は3ヶ月間、次の列では10人の患者が4.5ヶ月間、診断基準を満たしていました。
- 右側: 初回評価から無関心発症までの約期間を示します。左端の列は、9人の患者が初回評価時に発症したことを示し、次の列は7人の患者が1.5ヶ月後に発症したことを示しています(つまり、初回評価時には無関心はなかったが、3ヶ月後に存在した)。したがって、いくつかの例外を除いて、無関心は脳卒中後最初の5ヶ月以内に発生し、約6ヶ月間持続しました。
破局反応 (Catastrophic Reaction)
ゴールドシュタインによって最初に記述された破局反応は、不安、涙、攻撃的行動、罵倒、転位、拒否、放棄、および/または、時には代償的な自慢によって特徴付けられます。
初期の研究では、破局反応の存在と重症度を評価するために開発された**破局反応尺度(CRS)**が導入されました。連続した62人の患者の調査に基づくと、急性脳卒中病変を持つ12人(19%)に破局反応が見られました。 これらの12人のうち、9人(75%)が大うつ病の基準を満たし、さらに2人が軽症うつ病でした。さらに、破局反応のある12人の患者は、不安の尺度であるハミルトン不安尺度で高いスコアを示しました。
より大規模な前向き研究では、脳卒中後4日以内に202人の連続した患者がCRSを受けました。その結果、71人(35%)の患者に怒りが見られ、このうち26人は重度の怒りでした。 3番目の研究では、10項目のスピルバーガー特性怒り尺度を使用し、外来患者145人中47人(32%)が、脳卒中後3〜12ヶ月で怒りや攻撃性を制御できないという証拠を示しました。
仮性球麻痺性感情 (Pseudobulbar Affect)
虚血性脳卒中患者508人を対象としたコホート研究では、9.4%の患者が急性脳卒中の治療のための入院中に病的感情の証拠を示しました。3ヶ月後には、その頻度は11.7%に増加しました。 しかし、脳卒中後3ヶ月の516人の患者を対象とした別の研究では、PBAの推定値は7.6%でした。 3番目の研究では、大学関連の地域病院で最初にケアを受けた脳卒中患者127人が、脳卒中後3ヶ月でPBAについて評価されました。介護者が評価に関与した場合、PBAの有病率は17.9%でした。 対照的に、患者のみが評価された場合、推定値は6.3%に減少しました。 このような研究は、関連する臨床因子(例:研究のタイミング;情報提供者の関与)が有病率に大きく影響しうることを示しています。
失認症 (Anosognosia)
失認症の有病率の推定値は、文献によって大きく異なります。 この異質性にはいくつかの要因が寄与しています。例えば、失語症や認知症の患者を含めると、それぞれ言語および認知の著しい制限のために推定値が混同される傾向があります。 さらに、失認症は脳卒中後3ヶ月を超えると稀になります。したがって、研究評価のタイミングも、この文献における重要な要因です。
これまでの唯一のメタアナリシスでは、ロレンツォ・ピアと共同研究者らが1938年から2001年までの52の研究を対象に特定しました。彼らは、片麻痺に対する失認症の頻度が、研究が脳卒中発生に対していつ実施されたかに応じて、20%から44%の範囲であることを発見しました。 さらに、完全な対側運動障害を持つ患者では、失認症の有病率は32.3%でした。
病因論 (Etiology)
抑うつ (Depression)
PSDの病因については、いくつかの仮説が提唱されています。 多数の研究が、セロトニントランスポーター遺伝子や特定の炎症性サイトカイン、特にインターロイキン6と18など、気分調節不全に関連するバイオマーカーの異常を発見しています。 グルタミン酸伝達に影響を与えるグルココルチコイドのレベルの上昇、および生体アミン伝達の遮断を引き起こす脳卒中の部位も追加の知見です。 これらの要因のうち、病変部位は大きな関心の対象となってきました。
Douven et al.によるPSDの画像マーカーに関する研究の系統的レビューおよびメタアナリシスは、病変の側方性や種類よりも病変部位が、亜急性期脳卒中後のPSDの重要なリスク因子となる可能性があることを示唆しました。 脳卒中後3〜12ヶ月で実施された研究では、PSDの有病率は左半球病変のある患者と右半球病変のある患者で類似しています。 しかし、脳卒中後最初の数ヶ月では、病変部位がPSDのリスクを増加させるように見えます。 この関係は、ロビンソンと共同研究者らが行ったメタアナリシスの対象となっており、彼らは脳卒中後2ヶ月以内の抑うつの頻度を評価しました。 左前部脳卒中と左後部脳卒中の患者128人のうち、左前部脳卒病変の存在は、後部病変と比較してPSDのオッズを2.3倍増加させました。 右前部脳卒中と左前部脳卒中の比較では、左前部病変を持つことはPSDのオッズを2.18倍増加させました。
脳卒中後6ヶ月以内に実施された8つの研究の別のメタアナリシスでは、脳卒中病変の前縁と左右の前頭極との近接性およびPSDの重症度が評価されました。著者らは、抑うつの重症度と左前頭極からの脳卒中の距離との間に有意な逆相関関係を見出しましたが、右前頭極とはそうではありませんでした。
3番目のメタアナリシスは異なる見方を示しています。Na Weiと共同研究者らが行ったこのメタアナリシスは、43の研究と約5,500人の患者で構成されていました。全体的な分析では、病変部位とPSDの関係は示されませんでした。 しかし、脳卒中からの時間の影響がその後のサブグループ分析で評価され、**亜急性期(すなわち脳卒中後1〜6ヶ月)のグループにおいて、右半球脳卒中とPSDリスクの間にわずかながら統計的に有意な関係(オッズ比0.79)**が発見されました。 しかし、Douven et al.によって行われた4番目の最新のメタアナリシスでは、PSDを含む74の研究が含まれており、前頭葉および大脳基底核病変を持つPSDの明確なリスクを示しました。
要するに、脳卒中後最初の数ヶ月はPSDのリスクが高まるように見えますが、メタアナリシスはPSDと病変部位との関連性に関してやや矛盾した結果を報告しています。 このような矛盾した結果は、神経精神医学全体に見られる基本的な概念を示しています。つまり、特定の臨床症状は孤立した病変の産物である可能性は低く、むしろ主要な神経回路の機能不全によるものです。 さらに、これらのメタアナリシスにおける大きな問題は、先に述べたように、研究間の結果を統合することで、潜在的な修飾変数をしばしば見落とすことです。例えば、特定の種類(すなわち、大うつ病対軽症うつ病)、抑うつの特定の症状(すなわち、神経栄養性対心理的)、および脳損傷の種類(例:虚血性対出血性)は、メタアナリシス手法によって見落とされがちな他の重要な変数である可能性があります。
いくつかの研究がPSDの臨床的相関を評価しています。最も一貫した発見は、PSD患者におけるADLの障害の重症度の増加でした。 2005年、ハケットと共同研究者らは観察研究の系統的レビューを実施しました。この要因を評価した11の研究のうち9つで、脳卒中後の障害がPSDと正の有意な関連を示しました。 ロビンソン研究グループによる別のレビューでは、18の研究のうち15の研究(83%)が、PSDの重症度または存在とADLの障害の重症度との間に統計的に有意な関係を見出しました。 しかし、これらの研究のほとんどで、これらの因子間の時間的関係(つまり、抑うつが重度の機能障害に先行したか続発したか)は検討されていませんでした。
さらに、多数の研究が、精神疾患の個人的な病歴または家族歴がPSDの重要なリスク因子であることを実証しています。 生物学的、臨床的、心理的相関のこの組み合わせにより、多くの研究者がPSDの生物心理社会的病因を仮説化するに至っています。これはPSD全体を説明するための有用な臨床的構成概念かもしれませんが、体系的に検証される必要があります。
躁病 (Mania)
他の神経精神障害と同様に、躁病の病因は不明です。脳卒中後に躁病が比較的稀に発生するということは、この症候群を引き起こすには複数の変数の組み合わせが必要である可能性を示唆しています。
例えば、脳卒中と躁病(すなわち、DSM-IVの「脳卒中による気分障害、躁病性特徴を伴う」診断)を持つ17人の患者の研究では、12人が片側性の右半球病変を有していました。右半球病変の頻度は、左前頭葉または大脳基底核病変を有する大うつ病患者28人、あるいは脳卒中後に気分障害のない患者と比較して有意に高かったと報告されています。躁病と関連する病変は、皮質性(脳底側頭皮質または眼窩前頭皮質)または皮質下(前頭白質、大脳基底核、または視床)のいずれかでした。
(18F)フルオロデオキシグルコース(FDG)を用いたPET研究では、右皮質下病変を持つ3人の躁病患者において、右脳底側頭皮質に局所的な低代謝性欠損が示されましたが、この低代謝は同年齢の正常対照7人では見られませんでした。Santosらによる躁病の単一または小規模な症例シリーズの別の系統的レビューでは、49人の患者のうち、男性、血管リスク因子、および右半球梗塞との関連が見出されました。
したがって、躁病は辺縁系とつながる特定の右半球構造への損傷によって誘発されるように見えます。右脳底側頭皮質は特に重要である可能性があります。なぜなら、直接的な病変だけでなく、離断症を示唆するこの皮質領域の遠隔性の低代謝効果が二次性躁病と関連していたからです。脳底側頭皮質は眼窩前頭皮質と強力な遠心性結合を有しており、右半球の外側眼窩前頭回路が躁病の病因に関与している可能性を示唆しています。生体アミン系機能不全と眼窩前頭視床回路への持続的な抑制性入力の解放の組み合わせが躁病の発生につながる可能性があります。
Starksteinらによる別の研究では、二次性躁病患者と気分障害のない患者を比較しました。参加者は脳病変の大きさ、部位、病因についてマッチングされていました。二次性躁病患者は、両前頭葉および第三脳室容積の脳容積に対する比率によって測定された皮質下萎縮の程度が有意に大きかったです。さらに、二次性躁病を発症した患者のうち、精神疾患の家族歴が陽性であった患者は、家族歴のない患者よりも有意に萎縮が少なかったです。これは、感情障害に対する遺伝的素因と脳萎縮が、脳卒中後の躁病の独立した危険因子である可能性を示唆しています。一方、Santosらによる49例の系統的レビューでは、皮質下萎縮や精神疾患の家族歴との関連は報告されておらず、このレビューに含まれる研究の多くはこれらの2つの因子を検討していませんでした。したがって、これらの関連性を探索するのに十分な検出力がなかった可能性があります。
精神病 (Psychosis)
脳卒中後精神病のメカニズムに関する情報は、逸話的な報告または小規模な症例シリーズから得られています。脳卒中後の精神病患者5人の研究では、すべての患者が右半球病変を有しており、主に前頭頭頂領域に関与していました。年齢、教育、病変の大きさ、部位をマッチさせたが精神病のない5人の患者と比較した場合、二次性精神病患者は有意に大きな皮質下萎縮を有していました。この萎縮は、脳病変と対側の側脳室前角および側脳室体部の両方の領域の拡大によって顕著でした。しかし、右半球脳卒中患者の大多数は妄想を発症しません。神経画像解析は、右外側前頭前野の病変およびこの領域への連結性に影響を与える病変が、妄想的信念の発症と相関することを明らかにしています。
いくつかの研究者も、二次性精神病患者における発作の高頻度を報告しています。これらの発作は通常、脳病変の後で精神病の発症前に始まりました。前述の脳卒中後精神病患者と病変がマッチングされた対照患者の研究では、脳卒中後精神病患者5人中3人で発作性障害が見られましたが、精神病のない脳卒中患者5人中では0人でした。全体として、右半球病変、特に右外側前頭前野またはこの領域への連結性に影響を与える病変、発作、および皮質下脳萎縮が、脳卒中後精神病の病因において重要な要因であるように見えます。
無関心 (Apathy)
脳卒中後無関心のメカニズムは、多くの研究の焦点となってきました。例えば、慢性期脳卒中患者55人のサンプルでは、実験室での正の強化に対してほとんど行動反応を示さなかった患者は、より高いレベルの無関心を報告しました。これらの患者はまた、腹側被殻と淡蒼球、背側視床と前頭前野の病変を有していることも判明しました。急性期脳卒中患者106人の別の研究では、急性脳卒時における無関心が1年後の追跡調査時の無関心を予測しました。メタアナリシスでは、2,221人の患者における無関心がPSD(脳卒中後うつ病)とより大きな認知機能障害と関連していることが報告されています。
画像研究では、無関心が橋、前頭皮質、大脳基底核、背側視床、内包後脚、および側頭皮質の病変と有意に関連していることが見出されています(表2.2-2)。
全体として、前帯状皮質下回路(帯状回、前頭皮質、腹側線条体、腹側淡蒼球、および大細胞背内側視床を含む)に沿った病変は、無関心の発生と頻繁に関連しており、脳卒中後無関心の解剖学的基盤を構成する可能性があります。
表2.2-2. 脳卒中後無関心における最近の画像所見
表2.2-2. 脳卒中後無関心における最近の画像所見
| Author (年) | N (患者数) | 無関心の頻度 | 画像所見 |
| Hama et al. (2007) | 243 | 12% 無関心あり、抑うつなし | 無関心は両側前頭葉損傷と関連。PSDは左前頭葉損傷と関連。 |
| Murata et al. (2010) | 149 総症例 | (無関心頻度の記載なし) | 無関心は脳幹と両側線条体の病変と関連。 |
| Okada et al. (2011) | 57 無関心あり | (無関心頻度の記載なし) | CBF(脳血流量)の低下と基底核の低代謝は無関心の存在と関連。 |
| 55 対照 | |||
| Tang et al. (2013) | 75 無関心あり | (無関心頻度の記載なし) | 梗塞前体積の四分位数が脳卒中後無関心の発生を有意に予測。 |
| 167 対照 |
- ADLs: Activities of Daily Living (日常生活活動)
- Brodaty H, Liu Z, Withall A, Sachdev PS. The longitudinal course of post-stroke apathy over five years. J Neuropsychiatry Clin Neurosci. 2013;125(4):283.
- Caeiro L, Ferro JM, Costa J. Apathy secondary to stroke: a systematic review and meta-analysis. Cerebrovasc Dis. 2013;35(1):23-39.
- Caeiro L, Ferro JM, Figueira ML. Apathy in acute stroke patients. Eur J Neurol. 2012;19(2):291-297.
- Mayo NE, Fellows LK, Scott SC, Cameron J, Wood-Dauphinee S. A longitudinal view of apathy and its impact after stroke. S2troke. 2009;40(10):3299-3307.
- Tang WK, Chen YK, Liang HJ, et al. Location of infarcts and apathy in ischemic stroke. Cerebrovasc Dis. 2013;35(6):566-571.
- Tang WK, Lau CG, Mok V, Ungvari GS, Wong KS. Apathy and health-related quality of life in stroke. Arch Phys Med Rehabil. 2014;95(5):857-861.
- van Dalen JW, Moll van Charante EP, Nederkoorn PJ van Gool WA, Richard E. Poststroke apathy. Stroke. 2013;44:851-860.
神経学的診察における認知症の鑑別診断の手がかり
| 異常な眼所見 | 運動失調症 | 構音障害 | 錐体外路徴候 |
| セリアック病 | セリアック病 | 小脳変性症 | アルツハイマー病 |
| ゴーシェ病 3型 | 小脳変性症 | 慢性外傷性脳症 | 小脳変性症 |
| ミトコンドリア病変 | 慢性外傷性脳症 | 透析認知症 | 慢性外傷性脳症 |
| 多発性硬化症 | GM2ガングリオシドーシス | 運動ニューロン病 | レビー小体型認知症 |
| ニーマン・ピック病 C型 | 甲状腺機能低下症 | 多発性硬化症 | ファー症候群 |
| 進行性核上性麻痺 | 多発性硬化症 | ニーマン・ピック病 C型 | GM1ガングリオシドーシス 3型 |
| 梅毒 | ニーマン・ピック病 C型 | 神経アカントーシス | ハンチントン病 |
| 血管性認知症 | プリオン病 | パントテン酸キナーゼ関連神経変性症 | 多系統萎縮症 |
| ウェルニッケ・コルサコフ症候群 | 進行性多巣性白質脳症 | 進行性多巣性白質脳症 | 神経アカントーシス |
| ホイップル病 | 中毒性代謝性脳症 | 中毒性代謝性脳症 | ニーマン・ピック病 C型 |
| ウィルソン病 | ウェルニッケ・コルサコフ症候群 | 進行性核上性麻痺 | 特発性正常圧水頭症 |
| ウィルソン病 | ウィルソン病 | パントテン酸キナーゼ関連神経変性症 | |
| 進行性核上性麻痺 | |||
| 脳炎後パーキンソン症候群 | |||
| 亜急性硬化性全脳炎 | |||
| 中毒性代謝性脳症 | |||
| 血管性認知症 | |||
| ウィルソン病 |
| 歩行障害 | ミオクローヌス | 末梢神経障害 | 錐体路徴候 |
| 副腎白質ジストロフィー | アルツハイマー病 | 副腎白質ジストロフィー | 副腎白質ジストロフィー |
| 小脳変性症 | セリアック病 | B12欠乏症 | B12欠乏症 |
| 慢性外傷性脳症 | 透析認知症 | HIV脳症 | 小脳変性症 |
| HIV脳症 | クフス病 | 異染性白質ジストロフィー | GM2ガングリオシドーシス |
| 多発性硬化症 | ラフォラ小体病 | ポルフィリン症 | HIV脳症 |
| 特発性正常圧水頭症 | ミトコンドリア病変 | 中毒性代謝性脳症 | クフス病 |
| パーキンソン病 | プリオン病 | 異染性白質ジストロフィー | |
| 進行性核上性麻痺 | 亜急性硬化性全脳炎 | 運動ニューロン病 | |
| 梅毒 | 多発性硬化症 | ||
| 血管性認知症 | パントテン酸キナーゼ関連神経変性症 | ||
| ウェルニッケ・コルサコフ症候群 | 進行性多巣性白質脳症 | ||
| ウィルソン病 | ポリグルコサン小体病 | ||
| 進行性核上性麻痺 | |||
| 白質脳症 | |||
| 血管性認知症 |
破局反応 (Catastrophic Reaction)
急性脳卒中患者62人を対象とした研究では、破局反応を示す患者は、急性脳卒中対照群と比較して、大脳基底核に関わる病変の頻度が有意に高いことが判明しました。破局反応のある抑うつ患者10人と、破局反応のない抑うつ患者10人を比較すると、破局反応群はより前方の病変を、主に皮質下領域に有していました(例えば、破局反応のある抑うつ患者9人中8人が皮質下病変を有していたのに対し、破局反応のない抑うつ患者9人中3人が皮質下病変を有していました)。
別の研究では、急性脳卒中で入院した患者62人中12人(19%)に破局反応が発生しました。破局反応のある患者は、破局反応のない患者と比較して、精神疾患(ほとんどが抑うつ)の家族歴および個人歴が有意に高い頻度で見られました。しかし、破局反応は、失語症患者と非失語症患者の間で有意に頻繁ではありませんでした。この発見は、破局反応が「欲求不満を抱いた」失語症患者の理解できる心理的反応であるという主張を支持しませんでした。さらに、破局反応のある患者12人中9人(75%)は**脳卒中後うつ病(PSD)**も有しており、2人(17%)は軽症うつ病であり、抑うつではなかったのはわずか1人でした。したがって、破局反応はPSDと密接に関連していました。
これらの発見に基づくと、破局反応は知的な障害を認識することよりも、神経生理学的機能不全に起因する可能性があります。破局反応は、前部皮質下病変に関連する大うつ病患者に主に発生しました。皮質下の損傷は、皮質の辺縁系領域への抑制性入力を除去することによって、感情表現の「解放」の根底にあるとも仮説化されています。
仮性球麻痺性感情 (Pseudobulbar Affect)
病的感情は伝統的に、下行する新皮質上位運動ニューロンの球部運動核への両側性遮断に続発するものとして説明されてきました。病的感情を持つ患者の中にはそのような両側性病変を持つ者もいますが、これは一様な所見ではありません。例えば、ある研究では、いずれかの半球に前頭葉または側頭葉病変を持つ患者が、病的感情の頻度を有意に増加させていることが判明しました。病的哭泣を持つ12人の患者における病変の大きさおよび部位の検討では、最も頻繁に哭泣エピソードを持つ患者は比較的大きな両側性の橋病変を有していました。中間群は大きな両側性病変を有していました。最も影響の少ない患者は比較的大きな片側性の皮質下病変を有していました。
このような証拠は、病的感情が縫線核セロトニン作動性ニューロンまたはその投射の部分的な破壊から生じる可能性があるという仮説につながっています。また、小脳関与の証拠も増加しており、アイオワ大学の研究者らは、PBAを引き起こす重要な病変が前頭-橋-小脳経路に沿って位置していることを示唆しています。
診断と臨床特徴
軽度および主要血管性神経認知障害 (Mild and Major Vascular Neurocognitive Disorders)
DSM-5における**血管性認知機能障害(VCI)**の分類には、認知症患者(すなわち、主要血管性神経認知障害)とその前駆症状(すなわち、軽度神経認知障害)の両方が含まれます。主要血管性神経認知障害の診断基準を満たすには、以下の3つの条件が満たされる必要があります。
- 主要神経認知障害の基準が満たされること(すなわち、1つ以上の認知領域における後天性の障害の存在、および他の医学的状態ではよりよく説明できないADLにおける有意な障害);
- 臨床的特徴が血管性病因と一致すること。これは、(a)1つ以上の脳血管イベントと時間的に関連する認知機能の欠損、または(b)顕著な実行機能障害(例:不注意または処理速度の遅延)の存在によって示唆される;
- 患者の病歴、身体診察、および/または神経画像所見が、患者の認知機能障害を説明するのに十分な重症度の脳血管疾患と一致すること。
軽度血管性神経認知障害の患者は、1つ以上の認知領域に障害がありますが、日常生活機能は比較的保たれています。しかし、影響を受ける個人は、通常の時間よりも長くかかったり、認知障害を克服するために代償的な技術を使用したりするかもしれません。
血管性疾患による認知機能障害は、身体診察で多巣性運動障害および/または感覚障害の存在下で発生することが予想されます。単一の血管病変でも、主要血管性神経認知障害と一致する臨床像を呈する可能性があります。
抑うつ (Depression)
脳卒中患者や他の身体疾患のある患者における抑うつの評価は、かなり議論の対象となってきました。DSM-5によると、脳卒中後のうつ病は2種類が認識されています。それは、「脳卒中によるうつ病、大うつ病様エピソードを伴う」と「脳卒中によるうつ病、抑うつ症状を伴う(すなわち、亜症候性うつ病)」です。しかし、診断基準では、臨床医が気分障害が脳卒中の直接的な生理学的結果であると信じるかどうかを判断する必要があります。この判断が下された場合、患者は「脳卒中による抑うつ」と診断されます。
この診断スキームの問題点は、最も経験豊富な臨床医でさえ、抑うつが脳卒中の直接的な生理学的結果であるかどうかを確実に判断できないことです。患者が脳卒中以前に抑うつの既往があったとしても、脳損傷に対する生理学的反応が新しい抑うつエピソードを誘発するかどうかは分かりません。さらに、抑うつの臨床症状は、脳卒中後に発生したかどうかに関わらず同じように見えます。つまり、経験的証拠は、脳卒中後に発症した大うつ病のすべての症状が、抑うつではない脳卒中患者と比較して、抑うつを呈する脳卒中患者で有意に頻繁であることを示しています。したがって、抑うつ気分、無快感症、体重減少、不眠症、精神運動性興奮または制止、気力の喪失、無価値感、集中力低下、自殺念慮といった症状は、構造的脳損傷のない抑うつ患者と同様に、PSD患者を特徴づけます。したがって、より良い診断システムは、脳卒中を産後発症と同様の特定因子とすることかもしれません。つまり、「大うつ病」または「軽症うつ病」の診断が、脳卒中後発症という修飾語を伴う形です。経験的データは、現在の診断分類よりも、そのような命名法を支持しているようです。
急性脳卒中のために入院している患者のPSDの早期発見を促進するため、ヤンネケ・デ・マン=ファン・キンケルと共同研究者は、脳卒中後うつ病予測尺度を開発しました。著者らは、410人の脳卒中患者を対象とした研究でこの尺度を検証しました。脳卒中後最初の1週間以内に、参加者は様々なPSD予測因子について評価され、その後、脳卒中後6〜8週間で再評価されました。多変量モデルに基づくと、うつ病または他の精神障害の病歴がPSDの最も重要な予測因子でした(オッズ比7.2)。その他の予測因子には、高血圧、狭心症の病歴、およびADLのバーセル指数における着替え項目に基づいた着替え能力の障害が含まれていました。さらに、脳卒中後1週間の最低リスクカテゴリー(合計スコア10未満)は、6〜8週間後の追跡調査で**2%**の抑うつリスクと関連していましたが、最高リスクカテゴリー(合計スコア21超)の82%は6〜8週間後に抑うつを発症しました。
躁病 (Mania)
脳損傷による気分障害で躁病性特徴を持つDSM-IV基準を満たした連続25人の患者のシリーズで、躁病の症状が検討されました。脳卒中、外傷性脳損傷、または腫瘍の後に躁病を発症したこれらの患者は、原発性躁病(すなわち、既知の神経病理がない)患者25人と比較されました。両群の患者は、多幸感、切迫した発話、観念奔逸、誇大的思考、不眠症、幻覚、および妄想について類似した頻度を示しました。したがって、脳卒中後に発生した躁病の症状(現在DSM-5では、躁病の完全な基準を満たしていれば「脳卒中による双極性障害、躁病様エピソードを伴う」と診断され、躁病の完全な基準を満たしていない場合は「脳卒中による双極性障害、躁病性特徴を伴う」と診断される)は、特発性躁病(すなわち、双極性障害)で見られるものと同じであるように見えます。抑うつと同様に、より良い診断分類は脳卒中後発症の躁病かもしれません。
不安 (Anxiety)
2013年の374人の患者を含む研究では、**病院不安抑うつ尺度(HADS)の不安セクションで8点以上のスコアによって定義される不安を持つ患者が23%**いることが判明しました。脳卒中後の不安を持つ患者は、一般的に、そしてエネルギー、気分、性格、思考、仕事を含むいくつかの領域で、脳卒中関連の生活の質が不良でした。
2013年の別の研究では、縦断的に追跡された220人の患者の脳卒中後不安の長期転帰が調べられました。脳卒中後5年時点で、患者の64人(29%)が不安と見なされ、73人(33%)が抑うつと見なされ、43人(20%)に不安と抑うつの併存が見られました。脳卒中後6ヶ月時点での不安スコアが高いことは、脳卒中後5年時点での不安と関連していましたが、6ヶ月時点でのADLスコアとは関連していませんでした。
最後に、急性脳卒中患者693人の画像研究では、HADSで8点以上のスコアによって定義された不安のある患者は、他の関連変数を調整した後でも、右前頭部梗塞の頻度が有意に増加していることが報告されました。要するに、不安は脳卒中後によく見られ、その有病率は脳卒中から数年経っても高いままです。不安(および抑うつ)は回復不良と関連しているため、不安(およびPSD)の定期的な評価が保証されます。
以下の症例は、脳卒中後の不安とその抑うつとの頻繁な併存の典型的な臨床経過を示しています。
71歳の農夫が脳底動脈血栓症を患いました。彼は視界のぼやけ、歩行障害、顔面感覚異常を発症しました。脳卒中から2ヶ月以内に、患者はパニック発作と全般性不安障害(GAD)を発症しました。彼のGADは、些細な問題に対するほぼ絶え間ない不安、不眠症、落ち着きのなさ、集中力低下によって特徴付けられました。パニック発作は、頻脈、息切れ、発汗、そして再び脳卒中や心臓発作で気を失うか死ぬのではないかという恐怖を伴う不安の急速な発症によって特徴付けられました。パニック発作はまず自宅を離れているときに起こり、その後自宅でも起こるようになりました。パニック発作はアルプラゾラムで制御されましたが、この薬を1日4回服用しているにもかかわらず、彼は心配、落ち着きのなさ、筋肉の緊張、集中力低下、不眠症といった著しい不安を抱え続けました。約2ヶ月後、患者はまた、気分低下、興味喪失、集中力低下、自責の念、絶望感、精神運動性緩慢といった症状を伴う抑うつを発症しました。彼は電気けいれん療法に反応しましたが、すぐに再発しました。その後、ノルトリプチンで治療され、抑うつ障害と不安障害の両方が寛解しました。
無関心 (Apathy)
無関心の臨床症状は、1990年代にMarinとStarksteinによって無関心評価尺度を開発し、診断基準を提案するために利用されました。無関心の必須症状は、意欲または動機付けの喪失であり、これは無関心の診断に必須の症状です。動機付けの欠如は、感情的、認知的、または行動的に現れる可能性があり、最近Robertsと共同研究者らによって提案された無関心の診断基準に反映されています(表2.2-3を参照)。
以下の症例は、脳卒中後の無関心の症例と、他の状態とのいくつかの違いを示しています。
55歳のオフィス管理者で、不十分にコントロールされた高血圧と肥満の結果と考えられていた右前頭前野虚血性脳卒中から回復中でした。入院1週間後、抑うつの評価のために精神科へのコンサルテーションが依頼されました。彼の妻と理学療法士は、彼が期待通りにリハビリに参加せず、「 disconnected 」に見えると報告しました。彼は協力的で丁寧な態度を維持しているにもかかわらず、「今はエネルギーがない」と言って治療を避けました。彼は悲しいと感じていることを否定しましたが、「興味がなく、平坦な感じ」と報告しました。それ以外は、彼は回復について希望的でした。以前のように家族の訪問が彼を元気づけるようには見えず、彼の娘は彼が「輝きを失ったようだ」とコメントしました。患者は泣きたい気持ちを否定し、家族も彼が泣き叫んだり異常な笑いをしたりしないことに同意しました。彼は精神疾患や神経疾患の既往歴はありませんでしたが、スタッフは脳卒中後の抑うつを懸念していました。彼の定期的な血液検査は異常なく、画像検査でも新しい所見はありませんでした。彼の最新の神経学的診察では、軽度の左片麻痺が改善し、筋力が強くなり、歩行が安定していることが明らかになりました。入院時に記録された混乱状態は解消されているようで、彼は自分自身、日付、周囲、そして入院状況について完全に認識していました。彼は家族全員と臨床医を認識しており、疑い深い様子はありませんでした。会話中は注意深かったですが、疲れやすいようでした。彼の精神状態は一日中変動することはなく、夜間の睡眠はぐっすり眠れていると報告されました。食欲は減退していましたが、徐々に改善していました。せん妄からの回復が患者の症状の最も可能性の高い原因であると考えられ、そのため外来での観察とモニタリングが推奨されました。残念ながら、3週間後の最初の外来受診では、彼の家族は、彼のエネルギーと意欲の欠如が悪化し、怒り出し、回復に意味のある形で関わることを拒否したと報告しました。妻は医療保険によるリハビリテーションサービスの中止を懸念していました。再び、抑うつのスクリーニングは陰性でした。脳卒中後無関心と診断され、低用量のメチルフェニデートが開始されました。この介入から数週間以内に、患者は定期的な理学療法セッションに参加し始め、その合間に自宅で処方された運動を行うようになりました。
表2.2-3. 無関心にみられる感情の欠如、活動の緩慢化、および認知活動の障害の存在を判断するために使用される無関心尺度からの質問
| 感情の欠如 (Lack of Emotion) | 活動の緩慢化 (Slowed Motor Activity) | 認知活動の障害 (Impaired Cognitive Activity) |
| ご自分の病状について心配していますか? | 誰かに毎日何をすべきか言われる必要がありますか? | 新しいことを学ぶことに興味がありますか? |
| 物事に無関心ですか? | 物事に多くの努力を払いますか? | あなたが興味を持つことは何かありますか? |
無関心 (Apathy)
無関心の診断に提案されている基準は、意欲の欠如(例:「意欲がありますか?」)に加え、上記3つの症状(すなわち、感情の欠如、運動活動の緩慢化、および/または認知活動の障害)のうち2つ以上が、少なくとも4週間、ほとんどの時間にわたって存在することです。
データはMikami K, Jorge RE, Moser DJ, et al. Prevention of poststroke apathy using escitalopram or problem-solving therapy. Am J Geriatr Psychiatry. 2013;21(9):855-862より。
破局反応 (Catastrophic Reactions)
現在、破局反応に対する確立された診断基準はありません。本章の冒頭で述べたように、患者は通常、拒否、罵倒、涙、そして時には攻撃的な行動の突然の爆発を呈します。この激しい感情的反応は、認知検査のようなストレスの多い状況によって誘発されることが多く、通常は数分以内に治まります。
仮性球麻痺性感情 (Pseudobulbar Affect: PBA)
PBAに対する確立された診断基準はありません。この状態は、会話や感情的な反応が発生した状況とは不釣り合いな、突然の泣き、あるいは稀に笑いの発作によって特徴付けられます。感情は数秒から数分間持続し、悲しみや幸福感の残存はありません。
少なくとも5つの研究が病的感情の臨床的特徴を調べています。PBAの主要な特徴は以下の通りです。
- 泣きや笑いを制御できないこと
- そのような感情表現の頻度が増加すること
- 感情表現が自身の根底にある感情と矛盾している、または過剰であると患者が認識すること
PBAにはいくつかの評価尺度がありますが、PLACS尺度だけが特に脳卒中後の病的感情のために開発されました。図2.2-2に示すように、この尺度は脳卒中患者の病的感情の存在と重症度を評価します。
病理と検査 (Pathology and Laboratory Examination)
軽度および主要血管性神経認知障害 (Mild and Major Vascular Neurocognitive Disorders)
血管性神経認知障害の臨床的特定には、病歴、神経学的診察、精神医学的面接、および神経心理学的評価が必要です。診断検査も重要な役割を果たし、血液生化学検査(主にB12、葉酸、甲状腺機能)、頭部CTおよび/または脳MRI、そして特定の場合には脳血管造影によって情報が得られます。これらの検査データと画像データは、腫瘍、血管奇形、脳血腫、正常圧水頭症、感染症、内分泌異常、またはビタミン欠乏症によって引き起こされる治療可能な形態の認知症を評価するために使用されます。
構造画像検査(すなわち、頭部CTまたは脳MRI)は、1つまたは、より可能性が高いですが、いくつかの脳血管病変の存在と、存在する場合はそれらの病変に関連する脳容積減少の分布を記録する必要があります。脳血管造影は、インターベンショナルラジオロジーまたは神経外科的処置によって**可逆的な血管病変(例:動脈瘤や脳動脈狭窄)**を特定する可能性があります。
役立つ可能性のある追加の検査には、感染性の原因やアルツハイマー病などの認知症の他の原因、腫瘍随伴症候群を除外するためのCSF(脳脊髄液)分析、急性虚血性脳卒中後の予後診断に役立つ脳波(EEG)、せん妄と認知症を鑑別する、そして血管性認知症とアルツハイマー病を鑑別する、そして脳卒中後の機能的制限を評価するための誘発電位を伴うEEG(視覚誘発電位は視覚経路を評価し、脳幹誘発電位は椎骨脳底系によって供給される脳構造で発生する脳卒中を評価し、体性感覚誘発電位と運動誘発電位は虚血性脳卒中における機能回復の有用な早期予後マーカーとなる)が含まれます。
病的笑いと泣き尺度 (Pathological Laughing and Crying Scale: PLACS)
パート1:患者インタビュー
- 最近、突然笑いがこみ上げるエピソードを経験しましたか?
- 最近、突然泣き出すエピソードを経験しましたか?
もし突然笑い出すエピソードを経験した場合は、以下の質問3~10にお答えください。そうでない場合は、質問11に進んでください。
- これらのエピソードは、周囲に原因なく発生しましたか?
- これらのエピソードは、長期間続きましたか?
- これらのエピソードは、ご自身で制御できませんでしたか?
- これらのエピソードは、幸福感の結果として発生しましたか?
- これらのエピソードは、幸福感を超えて発生しましたか?
- これらの笑いのエピソードは、悲しみを感じながら発生しましたか?
- これらのエピソードは、幸福感や悲しみ以外の感情(緊張、怒り、恐怖など)を伴って発生しましたか?
- これらのエピソードは、あなたに苦痛や社会的な恥ずかしさを引き起こしましたか?
もし突然泣き出すエピソードを経験した場合は、以下の質問11~18にお答えください。
- これらのエピソードは、周囲に原因なく発生しましたか?
- これらのエピソードは、長期間続きましたか?
- これらのエピソードは、ご自身で制御できませんでしたか?
- これらのエピソードは、悲しみを感じた結果として発生しましたか?
- これらのエピソードは、悲しみを感じる程度を超えて発生しましたか?
- これらの泣きのエピソードは、幸福感を感じながら発生しましたか?
- これらのエピソードは、幸福感や悲しみ以外の感情(緊張、怒り、恐怖など)を伴って発生しましたか?
- これらのエピソードは、あなたに苦痛や社会的な恥ずかしさを引き起こしましたか?
図2.2-2. 病的笑いと泣き尺度。 (Robinson RG. The Clinical Neuropsychiatry of Stroke: Cognitive, Behavioral and Emotional Disorders following Vascular Brain Injury. 2nd ed. Cambridge University Press; 2006:430より許可を得て転載。)
脳卒中後うつ病(PSD)の診断における検査
現在、B12、葉酸、ヘモグロビン、甲状腺機能(うつ病症状の他の原因を除外するために日常的に行われるもの)を除いて、PSDの臨床診断を裏付けるために日常的に使用される検査や神経画像検査はありません。しかし、このテーマは科学コミュニティにとって大きな関心分野です。
これまでの研究は、主に大うつ病に関連する内分泌マーカーに焦点を当ててきました。例えば、**デキサメタゾン抑制試験(DST)**が、可能な生物学的マーカーとして調査されています。327人の患者を対象とした合計9つの研究では、PSDとデキサメタゾン投与に対する血清コルチゾールの抑制不全との間に統計的関連が示されました。この検査の平均プールデータ特異度は87%でしたが、感度は47%でした。これらの値は、診断に有用であるには不十分です。DSTの診断ツールとしての不十分さは、急性脳卒中が過去1年以内に発生した65人の患者を対象とした研究でも見られました。これらの症例のうち、大うつ病の67%が血清コルチゾールの抑制に失敗したのに対し、軽症うつ病の25%、抑うつではない患者の32%でした。大うつ病に対するDSTの感度は67%で、陽性適中率は50%でした。特異度はわずか70%で、陰性適中率は80%でした。患者の33%に見られた偽陽性検査は、病変体積が大きいことと関連していました。
別の研究では、デシプラミンに対する成長ホルモン反応の研究で、PSD患者において成長ホルモン反応が有意に鈍化していることが判明しました。これらの結果は、α2-アドレナリン受容体機能の低下がPSDの重要なマーカーである可能性があることを示唆しています。この検査の感度は100%、特異度は75%でした。PSDのマーカーとしての内分泌反応に関する将来の研究は、診断的妥当性を持つことが証明されるかもしれません。あるいは、そのようなマーカーは、研究目的でより均質なPSDのサブタイプを定義するのに役立つかもしれません。
もう一つの主要な研究分野は、PSDのリスクを予測する様々なバイオマーカーの特定に関係しています。この研究の大部分は、うつ病を発症しない脳卒中患者と比較して、PSD患者で異常がある多数の炎症性バイオマーカーに焦点を当てています。これには、血清BDNF濃度の低下、C反応性タンパク質やフェリチンなどの早期炎症マーカーの増加、血清プロ炎症性サイトカイン(TNF-α、IFN-γ)、プロ炎症性/抗炎症性比の増加、補体発現の低下、血清ビタミンDレベルの低下、高コルチゾール血症、および鈍化したコルチゾール覚醒反応が含まれます。
神経画像マーカーも特定されています。主に左半球の気分調節の脳前頭葉-皮質下回路(前頭前野、基底核、視床)に影響を与える病変は、脳卒中後1年後のPSDを予測するようです。急性脳卒中患者における追加の橋および葉状の脳微小出血、ならびに脳の重度の微小血管病変もPSDの可能性を高めます。
その他の障害の検査
脳卒中後の躁病、不安障害、精神病、無関心、破局反応、および失認症の診断または予後における臨床検査の有用性は、病因の項で議論された場合を除いて、確立されていません。
経過と予後 (Course and Prognosis)
軽度および主要血管性神経認知障害 (Mild and Major Vascular Neurocognitive Disorders)
主要血管性神経認知障害の経過は、脳卒中の発生と認知機能の悪化との間の密接な時間的関係によって特徴付けられます。脳卒中の再発確率は年間約7%です。しかし、脳卒中後認知機能障害の経過と予後は、予防策によって影響を受ける可能性があります。
フラミンガム心臓研究は、2014年に報告されたように、新しい脳卒中の認知への影響を前向きに検討した最初の研究でした。この研究では、新たに脳卒中を発症し、認知症のない132人の患者が前向きに追跡され、連続的な認知検査を受けました。脳卒中後6ヶ月時点で、以下の認知領域で有意に大きな障害が見られました。論理的および視覚的記憶の即時想起、言語学習、命名、実行機能、視空間能力、および運動能力。これらの欠損は、脳卒中前の認知機能および血管リスク因子とは独立していました。
皮質下血管性神経認知障害に関する2014年の更新では、皮質下血管性認知症が白質の小血管の重度の狭窄と小血管病によって引き起こされることが指摘されています。これらのプロセスは、白質虚血、症状の緩徐な進行、およびコリン作動性ニューロンの損傷につながり、皮質下血管疾患による認知機能障害とdAD(アルツハイマー病性認知症)との鑑別を困難にしています。
レヴィンと共同研究者らは、脳卒中発症後の生存者を対象とした前向き研究で、認知機能の急性期の低下と、6年間にわたる加速的かつ持続的な認知機能低下との関連を発見しました。
抑うつ (Depression)
PSDの縦断的経過は、多くの研究で検討されています。初期の急性期またはリハビリテーション病院での評価時(例:脳卒中後1週間)には、患者の21.6%が大うつ病と一致する症状クラスターを有し、20%が軽症うつ病(すなわち、亜症候性うつ病)の症状クラスターを有していました。大うつ病と軽症うつ病の両方とも数ヶ月間続くように見えますが、観察された経過は研究によって異なっています。
フィリップ・モリスと共同研究者らは、大うつ病の平均持続期間が39.0±31.8週間、軽症うつ病の平均持続期間が12.2±18.2週間と算出しました。ロビンソンと共同研究者らによる急性脳卒中後2年間の142人の患者に関する別の報告では、大うつ病の平均持続期間は31.2週間でしたが、軽症うつ病は11.9ヶ月でした。患者の平均26%が初期診断から1年後も大うつ病を継続していました。1,233人の脳卒中患者を15年間追跡した研究では、3ヶ月時点でPSDを呈していた患者の50%が1年までに回復していました。2013年の50の研究からなる4,022人の患者のメタアナリシスでは、脳卒中後数ヶ月で抑うつ状態にあった患者のうち、1年後の回復率は15%から57%の範囲でした。要するに、これらの所見は、脳卒中後に大うつ病または軽症うつ病を発症する患者のかなりの数が、脳卒中後2年以上持続的な抑うつを経験する可能性があることを示しています。
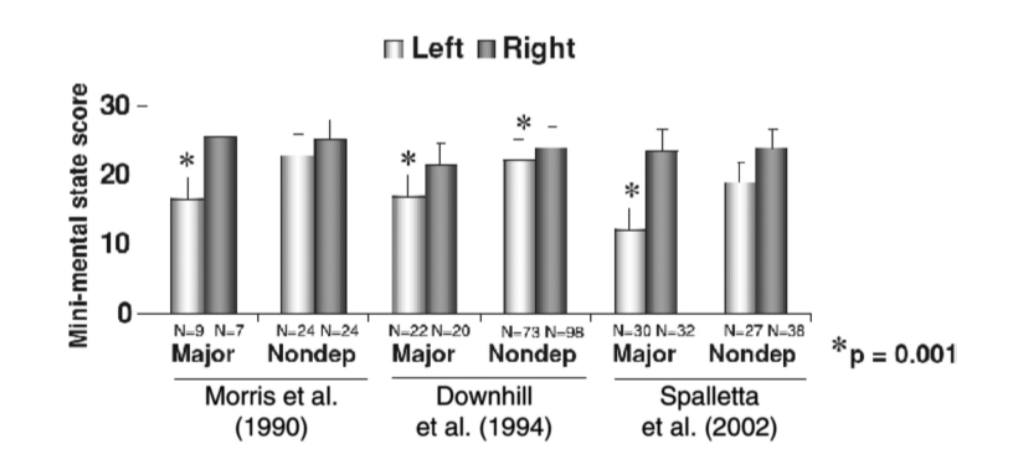
脳卒中後うつ病(PSD)と認知機能障害
図2.2-3. は、うつ病と病変部位に関連する認知機能障害を示しています。これは、虚血の半球別にグループ化された、大うつ病または気分障害のない患者の3つの研究における急性脳卒中後のミニメンタルステート検査のスコアです。3つの研究すべてにおいて、左半球脳卒中後の大うつ病患者と、同様の病変を持つうつ病ではない患者との間に有意な差(P = .001)がありました。右半球病変後の大うつ病は、同じ現象を引き起こしませんでした。(Robinson RG. The Clinical Neuropsychiatry of Stroke: Cognitive, Behavioral and Emotional Disorders following Vascular Brain Injury. 2nd ed. Cambridge University Press; 2006:155より許可を得て転載。)
PSDと認知機能回復の予後も、部分的にPSDの存在に依存します。3つの別々の研究により、急性脳卒中後の大うつ病は、脳卒中が左半球で発生した場合に、より重度の認知機能障害と関連することが示されています(図2.2-3)。この右半球対左半球脳卒中の効果は、同様の病変を持つ抑うつではない患者には見られません。縦断的研究も、左半球脳卒中後の大うつ病患者は、同等の脳卒中だが大うつ病ではない患者と比較して、脳卒中後12ヶ月間により重度の認知機能障害を呈することを示しています。しかし、脳卒中後12ヶ月から24ヶ月の間で、これらの患者の認知機能は改善する傾向があります。追跡調査24ヶ月時点では、病変部位(すなわち、右半球対左半球脳卒中)や抑うつ状態(すなわち、抑うつ患者または非抑うつ患者)に関わらず、患者間の認知機能障害の重症度に差はなくなります。
身体機能回復(ADL)とPSD
抑うつと脳卒中からの身体/機能回復(ADLによって測定)との関係を調べた研究のほぼすべてで、抑うつが重度であるほど、ADLにおける患者の障害がより深刻であることが判明しています。さらに、これらの研究の一部は、急性脳卒後における抑うつ重症度が、脳卒中後1年以上経過したADL障害の重症度の独立した予測因子であることを示しています。したがって、急性脳卒中後に患者が抑うつを患っている場合、ADL回復の予後は有意に悪くなります。興味深いことに、Cevdet Bilgeと共同研究者らは、シタロプラムによる治療に反応したPSD患者が、一度も抑うつになったことのない患者よりも、ADLにおいて有意に良好な改善を示したことを発見しました。
死亡率とPSD
重要なこととして、PSDは死亡率の増加と劇的に関連しています。標準化されたインタビューと診断を用いてこの現象を報告した最初の研究は、1993年に急性脳卒中患者103人のサンプルで実施されました。脳卒中後10年時点で、大うつ病または軽症うつ病の患者は、うつ病ではない患者と比較して、死亡のオッズが3.4倍増加していました。脳卒中患者976人の別の研究では、脳卒中後3週間でウェイクフィールド自己評価うつ病インベントリを用いて評価された抑うつ患者は、うつ病ではない患者と比較して、1年後の死亡率が50%高かったことが判明しました。2013年の50の研究のメタアナリシスでは、脳卒中後3ヶ月以内に抑うつを患った患者は、うつ病ではない脳卒中患者と比較して、生活の質の低下、障害の増加、追跡調査時の死亡率の増加によって定義される臨床転帰が不良でした。
抗うつ薬治療と死亡率
しかし、おそらく最も示唆に富む発見は、PSD後の死亡率と抗うつ薬治療との関係です。PSDの治療を受けた患者の9年間の追跡調査では、12週間にわたるノルトリプチンまたはフルオキセチンによる積極的な治療(n = 53)が、プラセボ(n = 28)と比較して、6年後の生存確率を増加させたことが判明しました(すなわち、治療群で59.2%、プラセボ群で36.4%)(図2.2-4)。年齢、糖尿病、再発性うつ病、抗うつ薬の使用の影響を調べたロジスティック回帰では、抗うつ薬の使用と糖尿病の存在が独立して有意に生存を予測することが判明しました。
最近の一連の発見では、フルオキセチン(20 mg/日)またはノルトリプチン(100 mg/日)の使用が、3ヶ月間の治療後、それぞれ3ヶ月または12ヶ月での脳卒中からの回復改善と関連していることが示されました。興味深いことに、この効果はPSDとは独立していました。
脳卒中後の気分障害の経過は、以下の症例報告によって例示されています。
図2.2-4. 脳卒中後3ヶ月間の治療後の死亡率
この図は、脳卒中後最初の6ヶ月間に12週間の抗うつ薬治療またはプラセボを投与された脳卒中患者の、9年間の追跡調査における生存率を示しています。抗うつ薬を投与された患者の生存確率は有意に高かったです(カイ二乗値 = 8.2、自由度 = 1、P = .004、カプランマイヤー生存分析、ログランク検定)。
(Jorge RE, Robinson RG, Arndt S, Starkstein S. Mortality and poststroke depression: a placebo-controlled trial of antidepressants. Am J Psychiat. 2003;160(10):1827より許可を得て転載。)
脳卒中後うつ病(PSD)の臨床経過を示す症例報告
Aさんは35歳の女性で、全国規模の企業の地域マーケティングディレクターでした。納期、頻繁な出張、販売ノルマはすべて、彼女のプレッシャーの多い仕事の一部でした。最初の妊娠中に高血圧を発症しましたが、それにもかかわらず、彼女は多忙な仕事のスケジュールを維持しました。しかし、次の妊娠中に仕事で出張中に脳卒中を患い、右側に軽度の脱力と、発話は困難だが理解はできるタイプの失語症(すなわち、非流暢性失語症、表現性失語症)が生じました。これらの運動障害と言語障害は比較的軽度で、脳卒中後数ヶ月以内に解消されました。
脳卒中後約6ヶ月の時、彼女は脳卒病の結果としてまだ何かがおかしいと確信していました。数人の医師は、身体的には何も問題がなく、仕事に戻る必要があるだけだと彼女に告げました。彼女は脳卒中以前に長期にわたる抑うつ症状を経験したことはなく、評価時には彼女の感情は抑うつ的ではありませんでした。彼女はおしゃべりで、思考や発話は遅延していませんでした。これはうつ病によく見られるものです。彼女は涙もろくなく、自殺念慮もありませんでした。しかし、彼女は抑うつ感を感じ、興味、集中力、意欲の喪失がありました。彼女は1日2時間だけ仕事に戻っていましたが、簡単な作業さえもこなせるほど集中できませんでした。彼女は事実上すべての仕事や社会活動に対する興味と喜びを失っていました。もはや会社のヒエラルキーを上り詰めるという野心もありませんでした。また、早朝覚醒を伴う睡眠障害、食欲と体重の減少、性的興味の低下、エネルギーの低下もありました。PSDと診断され、ノルトリプチンによる抗うつ薬治療が開始されました。
抗うつ薬治療に対する彼女の反応は劇的でした。ノルトリプチンを開始してから4〜6週間で、気分が大幅に改善し、仕事に戻ることができました。彼女は仕事に集中でき、興味と喜びを感じられるようになりました。2〜3ヶ月の間に、彼女は職業的にも社会的にも抑うつによって事実上動けなかった状態から、効果的で精力的な女性へと戻りました。彼女はまた、以前の野心の一部を取り戻しましたが、企業のトップに到達するという以前の意欲はまだ欠けていました。
ノルトリプチンを服用してから9ヶ月後、彼女はこの薬を中止したいと希望しました。彼女の理由は、完全に回復したと感じており、口渇や便秘を引き起こす薬を服用し続けたくないというものでした。薬は約6週間かけて漸減され、その後中止されました。彼女は約1年間は良好な状態を保ちましたが、その後、最初に観察されたのと同じ症状が再発しました。つまり、仕事に興味がなくなり、通常の活動のいずれにも喜びを感じず、仕事や家庭の要求に応えることができなくなりました。また、睡眠困難、食欲不振、抑うつ感も感じました。これらの症状は、抗うつ薬を再開した後に治まり、彼女はさらに1年間服用を続けました。その1年後、彼女は再び抗うつ薬の中止を主張しました。その後2年間の追跡調査では、彼女は抑うつ症状から解放されたままでしたが、以前の病歴により、抑うつの再発リスクが高いことを助言されました。彼女は、抑うつの兆候や症状に常に注意を払い、直ちに報告するよう助言され、それにより迅速に治療再開を検討できることになりました。
躁病 (Mania)
脳卒中後の躁病の経過は、系統的に調べられていません。躁病または抑うつの再発エピソードがこれらの患者に起こる可能性があることを示す症例報告がされています(図2.2-5)。
不安 (Anxiety)
標準化されたインタビューと診断基準に基づいた全般性不安障害(GAD)と大うつ病の有病率は、2つの別々の研究で記録されています(図2.2-6)。併存するうつ病の有無にかかわらず、GADの発生率は脳卒中後3年間で約20%で安定していることに注意してください。220人の患者を対象とした5年間の縦断研究では、脳卒中後5年時点で不安の有病率は29%であり、6ヶ月時点で不安があった患者は、不安がなかった患者よりも5年時点で不安を抱えている可能性が有意に高いことが判明しました。別の10年間の研究では、不安は17%から24%の範囲であり、5年間の累積発生率は57%でした。さらに、毎年、併存する不安とうつ病は57%から73%の範囲でした。
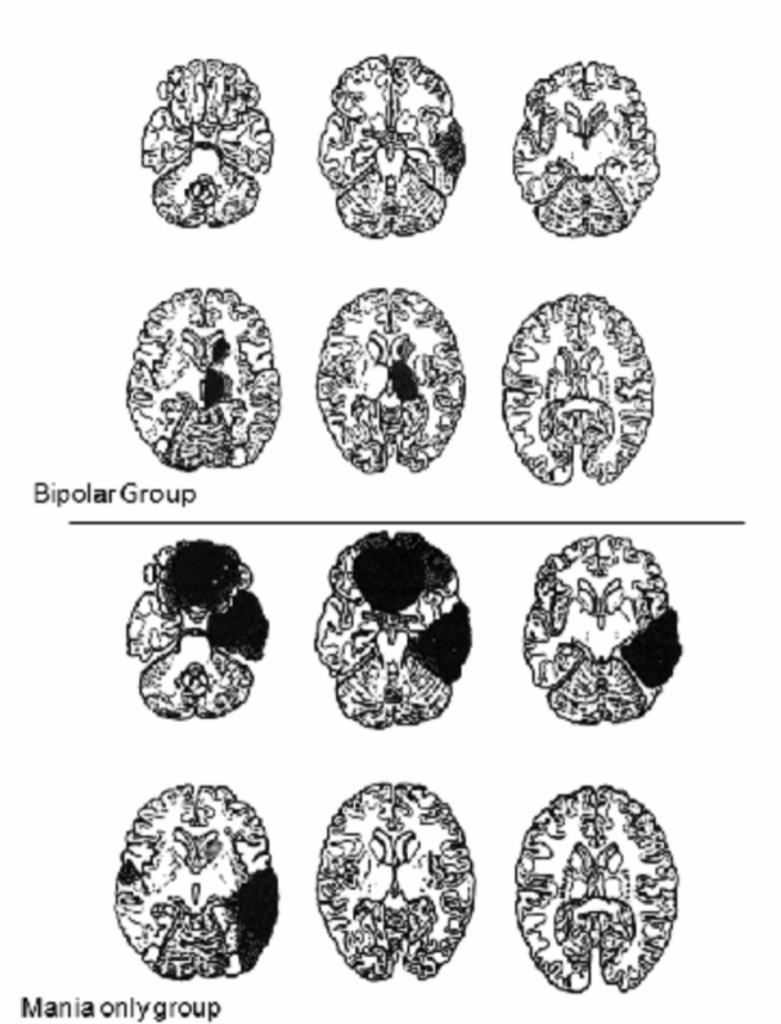
図2.2-5. 双極性障害または躁病のみの患者における脳卒中病変の脳画像
この図は、双極性障害または躁病のみの患者における脳卒中病変の脳画像を示しています。
- 双極性群(Bipolar Group): 躁うつ病患者の病変の最大断面を示すCTスキャン画像テンプレート。病変は主に右尾状核頭部と右視床に認められました。
- 躁病のみの群(Mania only group): 躁病のみの患者の病変の最大断面を示すCTスキャン画像テンプレート。病変は主に眼窩前頭皮質と右側頭底皮質に認められました。
(Robinson RG. The Clinical Neuropsychiatry of Stroke: Cognitive, Behavioral and Emotional Disorders following Vascular Brain Injury. 2nd ed. Cambridge University Press; 2006:302より許可を得て転載。)
脳卒中後不安 (Anxiety)
2年間で142人の患者を対象とした別の研究では、発症早期(脳卒中後3ヶ月以内)の抑うつを伴わない不安障害の平均持続期間は1.5ヶ月であったのに対し、発症遅延(脳卒中後6ヶ月以降)の抑うつを伴わないGADの平均持続期間は3ヶ月でした。さらに、不安の存在は抑うつの持続期間にも影響を与えました。GADと大うつ病を併発している患者は、併発する不安障害がない抑うつ患者よりも、抑うつの平均持続期間が有意に長かったことが示されています。
ルイス・アヤーブと共同研究者らによる2014年の脳卒中後不安の縦断研究では、脳卒中後3ヶ月時点での不安が、10年後の追跡調査における生活の質の低下と関連していることが報告されました。2014年には、マヤ・ランビアセと共同著者らは、6,019人の脳卒中患者を対象に、ベースライン時の不安スコアが高いことが、16年間の追跡調査期間内の脳卒中発生リスク増加と関連していることを発見しました(図2.2-7)。
無関心 (Apathy)
前向きコホート研究では、ベースライン時のVCI(血管性認知機能障害)と、ベースラインから慢性期の脳卒中段階にかけての無関心レベルの増加との関連が発見されました。興味深いことに、ベースライン時のVCIと抑うつ症状の経過との間には関連は見られませんでした。
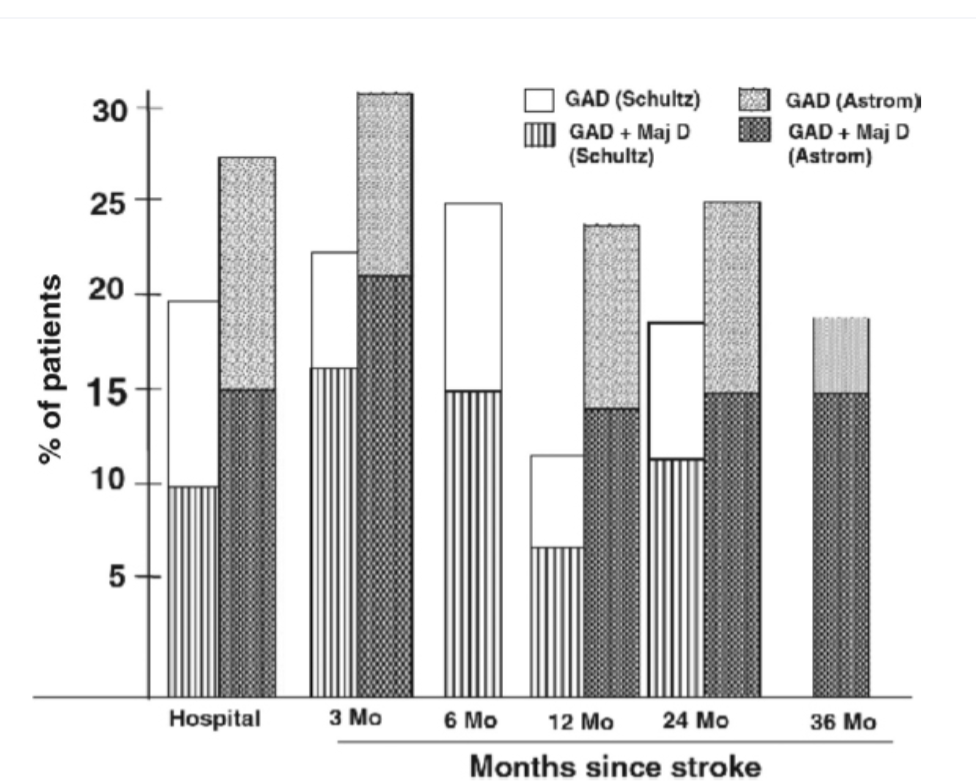
図2.2-6. 脳卒中後の大うつ病と不安障害の縦断的関連
この図は、急性脳卒中後3年間にわたる全般性不安障害(GAD)の、大うつ病を伴う場合と伴わない場合の頻度を示しています。診断と統計マニュアル第4版(DSM-IV)基準を用いたSchultzら(1997)の結果と、診断と統計マニュアル第3版改訂版(DSM-III-R)基準を用いたAstrom(1996)の結果が比較されています。結果は、DSM-IV基準を用いたGADの頻度がわずかに低いことを示しており、脳卒中後の不安障害を持つ患者集団における大うつ病の顕著性を強調しています。
(Robinson RG. The Clinical Neuropsychiatry of Stroke: Cognitive, Behavioral and Emotional Disorders following Vascular Brain Injury. 2nd ed. Cambridge University Press; 2006:336より許可を得て転載。)
その他の障害の経過と予後
精神病、無関心、破局反応、PBA(仮性球麻痺性感情)、および失認症の患者の経過と予後は、系統的に研究されていません。
治療 (Treatment)
軽度および主要血管性神経認知障害 (Mild and Major Vascular Neurocognitive Disorders)
脳卒中のリスク因子の中には効果的に治療できるものがあり、そのため血管性疾患による認知機能障害が将来的に予防可能な状態になるという希望が持たれています。過去10年間で、抗血小板薬による治療は、TIA(一過性脳虚血発作)患者における反復性虚血性血管エピソードの数を減少させてきました。アセチルサリチル酸(ASA)やその他の抗血小板薬は、脳卒中の二次予防に効果があることが示されています。2,435人の患者が異なる2つの用量のASA(300mg/日と1200mg/日)を使用した英国TIAアスピリン試験では、プラセボ治療と比較して、非致死性脳卒中、心筋梗塞、または死亡のリスクが用量に応じて21.7%と25.1%減少したことが判明しました。
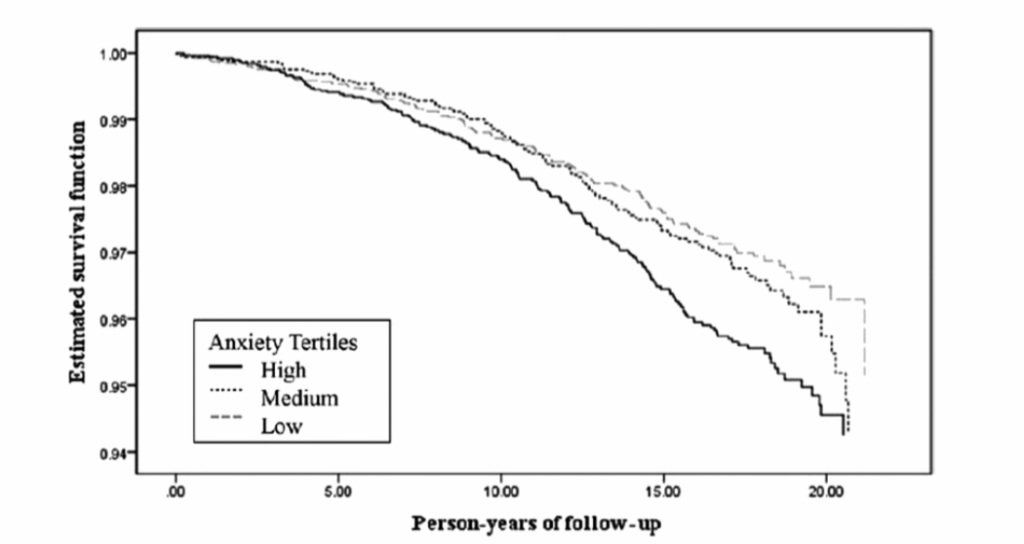
図2.2-7. 不安症状と脳卒中発生の関係に基づいた推定生存関数(年齢と性別で調整後)
この図は、年齢と性別で調整した後の、不安症状と脳卒中発生の関係に基づいた推定生存関数を示しています。不安症状のレベルが高いほど、脳卒中のリスクが高かったことが示されています。
(Lambiase MJ, Kubzansky LD, Thurston RC. Prospective study of anxiety and incident stroke. Stroke. 2014;45(2):438. doi: 10.1161/ STROKEAHA. 113.003741より許可を得て転載。)
高血圧と血管性認知症
高血圧は脳卒中の最大の危険因子であるため、血管性認知症の発生率への影響は大きな関心領域となってきました。サリー・シャープと共同研究者らによる2011年のメタアナリシスでは、血管性認知症768例と約10,000例の対照症例を対象に、高血圧と血管性認知症のリスクとの間に有意な関連があることが判明しました。これは、縦断研究と横断研究に基づき、それぞれオッズ比1.6と4.8でした。2011年の別のメタアナリシス(14の研究に基づく)では、降圧薬を処方された個人が血管性認知症のリスクを低下させることが示されました(プールされた相対リスク0.67)。2018年のコクラン系統的レビュー(38,742人の参加者を評価)では、血圧降下剤を服用している人々の認知症のプールされたリスク比は、プラセボを服用している人々と比較して0.88であることが判明しました。現在まで、この効果が特定の種類の降圧薬によるものなのか、または高血圧の治療単独によるものなのかは不明です。1
脳卒中関連認知機能障害のリスクが高い患者の治療
脳卒中関連認知機能障害のリスクが特に高いが、まだ認知症の兆候を示していない患者(すなわち、TIA、脳卒中、または無症候性脳梗塞の既往がある患者)の場合、頸動脈狭窄が70%から99%の範囲にある場合、将来の脳卒中のリスクを最小限に抑えるために頸動脈内膜剥離術が適応となることがあります。心原性脳塞栓症の後には、抗凝固療法が脳卒中再発のリスクを減らす効果的な治療法です。心原性脳塞栓症は、全虚血性脳卒中の約15%を占め、若年患者ではこの割合がさらに高くなります。
血管性認知症患者の治療
血管性認知症患者では、血管リスク因子の継続的な治療が一般的に推奨されます。ただし、リスクが明らかに利益を上回る場合は除きます。例えば、通常、さらなる脳卒中およびそれに関連する認知機能低下のリスクを最小限に抑えるために降圧治療が推奨されます。しかし、降圧治療が起立性低血圧を引き起こす場合、転倒のリスクがその治療の利益を上回る可能性があります。
血管リスク因子を減少させるための治療法には、降圧薬(例:β遮断薬またはカルシウムチャネル遮断薬)、スタチンなどの脂質降下薬、禁煙、および糖尿病の予防または慎重な管理が含まれます。最後に、治療には、認知機能のためのコリン作動薬(例:ドネペジルやガランタミン)、抗うつ薬、抗血小板凝集薬、およびその他の併存疾患のためのスタチンも含まれる場合があります。
脳卒中後うつ病(PSD)の治療
1984年に報告された最初のPSDにおける無作為化盲検プラセボ対照研究では、ノルトリプチン(50~100mg/日)で治療された14人の患者が、プラセボを投与された20人の患者よりも、6週間でハミルトンうつ病スコアが有意に大きく減少したことが判明しました。選択的セロトニン再取り込み阻害薬(SSRIs)の有効性を検討した最初の二重盲検プラセボ対照試験は、Grethe Andersonと共同研究者らによって1993年に報告されました。脳卒中後患者33人(65歳未満は20mg/日、65歳以上は10mg/日)にシタロプラムを投与した結果、同様の患者33人にプラセボを投与した場合と比較して、6週間でハミルトンうつ病スコアが有意に大きく減少することが観察されました。
16の試験と1,655人の被験者からなる2008年のハケットと共同研究者らによるコクランレビューでは、PSDの治療において、薬物治療を支持するオッズ比0.47が判明しました。最も最近では、5,370人の患者を含む2020年のメタアナリシスでは、SSRIを服用している患者のリスク比が0.78であることが示されました。したがって、PSD、特に重症うつ病に対する抗うつ薬治療の有効性は確立されています。しかし、2019年のコクランレビューでは、SSRIが脳卒中後の神経学的障害の機能的回復を助けるようには見えないことが示されました。
**認知行動療法(CBT)**はうつ病にいくつかの肯定的な効果があるように見えますが、PSDの単剤療法として使用するには十分な証拠がありません。
おそらく、PSD治療における最も有望な最近の進歩は、予防的治療の研究です(図2.2-8)。現在までに、少なくとも4つの無作為化研究がSSRI抗うつ薬を用いたPSDの予防を評価するために設計されています。これらの研究結果は図2.2-8に示されています。4つの研究のうち3つは予防に有意な効果を示しませんでしたが、予防率の類似性は、検出力不足が効果の欠如の原因であった可能性を示唆しています。ロビンソンと共同研究者らによって実施された4番目の研究は、抑うつではない急性脳卒中患者58人を対象とし、エシタロプラム(65歳以上は5mg/日、65歳未満は10mg/日)を1年間投与しました。PSDの発生率は8.5%でした。これは、問題解決療法(PST)を受けた57人の患者では11.9%、プラセボを受けた58人の患者では22.4%と比較して低いものでした(エシタロプラム対プラセボ、P ≤ .001;PST対プラセボ、P ≤ .001)。
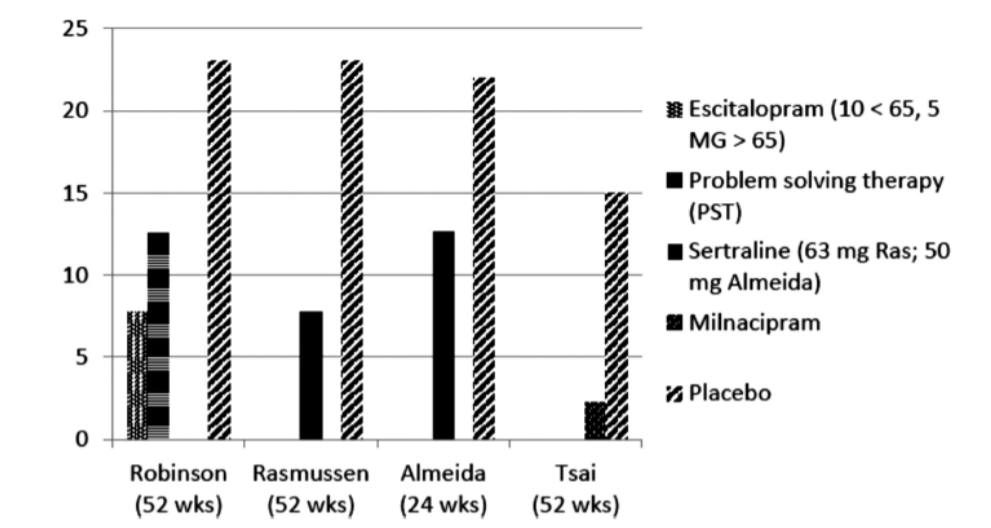
図2.2-8. 脳卒中後うつ病予防のための4つの無作為化試験のまとめ
この図は、脳卒中後うつ病予防のための4つの無作為化試験の結果をまとめたものです。各研究について、予防試験期間中に抑うつを発症した患者の割合が示されています。ロビンソンとラスムッセンの研究は驚くほど類似した結果を示しました。ロビンソンとツァイの研究では、抗うつ薬とプラセボの間に統計的に有意な差がありました。
(データはRobinson RG, Jorge RE, Moser DJ, et al. Escitalopram and problem-solving therapy for prevention of poststroke depression: a randomized controlled trial. JAMA. 2008;299(20):2391-2400; Rasmussen A, Lunde M, Poulsen DL, Sorensen K, Qvitzau S, Bech P. A double-blind, placebo-controlled study of sertraline in the prevention of depression in stroke patients. Psychosomatics. 2003;44(3):216-221; Almeida OP, Waterreus A, Hankey GJ. Preventing depression after stroke: results from a randomized placebo-controlled trial. J Clin Psychiatry. 2006;67(7):1104-1109; およびTsai CS, Wu CL, Chou SY, et al. Prevention of poststroke depression with milnacipran in patients with acute ischemic stroke: a double-blind randomized placebo-controlled trial. Int Clin Psychopharmacol. 2011;26 (5):263-267から抽出。)
脳卒中後うつ病(PSD)の治療:その他の有望な進歩
もう一つの有望な最近の進歩には、PSDの治療のための反復経頭蓋磁気刺激(rTMS)や経頭蓋直流電流刺激(tDCS)のような非侵襲的脳刺激の使用が含まれます。rTMS試験からのデータは特に有望です。しかし、実行可能な治療選択肢と見なされるためには、プロトコルが標準化された後、より大規模な無作為化比較試験を実施する必要があります。
躁病 (Mania)
単一または再発性の躁病エピソードを持つ個々の患者に関するデータは、リチウムに反応することを示唆していますが、リチウムまたはカルバマゼピンのいずれにも反応しない患者もいます。脳卒中後躁病の治療に関する無作為化比較試験は実施されていませんが、23人の患者を対象としたある縦断研究では、ほとんどの患者の躁病エピソードが数ヶ月以内に寛解することが示されました。
不安障害 (Anxiety Disorders)
脳卒中後のGADと抑うつを併発している患者の治療において、ノルトリプチン(n=13)とプラセボ(n=14)を評価するために、3つの無作為化二重盲検治療研究のデータが統合されました。不安の重症度はハミルトン不安評価尺度で測定され、抑うつの重症度はハミルトンうつ病評価尺度で測定されました。人口統計学的特性、脳卒中タイプ、神経学的所見においてノルトリプチン群とプラセボ群の間に有意差はありませんでしたが、ノルトリプチン治療を受けた患者は、ハミルトンうつ病スコアと比較してハミルトン不安スコアで有意に迅速な改善を示し、不安が抑うつよりも治療に迅速に反応する可能性があることを示唆しています。さらに、不安症状はプラセボと比較してノルトリプチン治療に対してより大きな改善を示しました。
葛飾美上と共同研究者らは、ロビンソンらのグループによって以前に実施されたPSDの予防試験の患者の二次分析を行いました。脳卒中後GADのない52人の患者がエシタロプラムで1年間治療されたうち、GADを発症したのはわずか3例でした。これに対し、PSTで治療された53人中3例、プラセボを投与された49人中9例がGADを発症しました(P = .0005)。2017年のコクランレビューでは、プラセボ対照なしの脳卒中後不安の治療に関する全体的なエビデンスは不十分であると結論付けられました。
精神病 (Psychosis)
脳卒中後の妄想や幻覚を持つ患者に対する対照治療試験は実施されていません。症例報告は、2つの基本的な治療アプローチを示唆しています。それは、抗てんかん薬または抗精神病薬の使用です。抗てんかん薬の使用は、脳卒中後の精神病性障害とてんかんの頻繁な併存に根拠があります。抗精神病薬は、発作閾値を下げる傾向があるため、脳卒中患者では発作リスクが高いため、慎重に使用する必要があります。
無関心 (Apathy)
脳卒子後の無関心は、ノルトリプチン、ブロモクリプチン、メチルフェニデート、アマンタジン、セレギリン、タクリンで、ある程度の成功を収めて治療されてきました。ネフィラセタムは新規のGABA-Aアゴニストであり、ロビンソンと共同研究者らによる併発する無関心とうつ病の治療に関する二重盲検試験では、ネフィラセタム(900mg/日)が、無関心評価尺度のスコアを減らす上でプラセボよりも有意に優れていることが示されました。なお、ネフィラセタムは、米国食品医薬品局(FDA)によっていかなる適応症も承認されていません。無関心は脳卒中の比較的一般的な結果であり、脳卒中後の回復に壊滅的な影響を与える可能性があるため、治療試験が緊急に必要とされています。
美上と共同研究者らは、脳卒中後の無関心の予防を評価するために、前述のうつ病試験の二次分析を行いました。エシタロプラム(65歳未満は10mg/日、65歳以上は5mg/日)で1年間治療された無関心ではない51人の患者のうち、無関心を発症したのは2人でした。これに対し、PSTで治療された56人中3人、プラセボを投与された47人中7人が無関心を発症しました(P = .0031)。したがって、エシタロプラムなどの抗うつ薬の投与が脳卒中後無関心の予防に役立つかどうかを判断するために、無関心の予防を主要評価項目とする治療試験が必要です。
仮性球麻痺性感情(Pseudobulbar Affect: PBA)
2019年の病的感情の治療試験に関するコクランレビューには、脳卒中患者239人を対象とした7つの試験が含まれていました。三環系抗うつ薬、SSRI(選択的セロトニン再取り込み阻害薬)、SNRI(選択的セロトニン・ノルエピネフリン再取り込み阻害薬)を含む抗うつ薬治療は、PBAの頻度と重症度を有意に減少させます。例えば、16人の患者を対象とした二重盲検プラセボ対照クロスオーバー研究では、シタロプラム投与中に泣きのエピソード数が50%以上減少したと報告されています。8人の患者はシタロプラム(20mg/日)服用後24時間以内に治療に反応し、3人の患者は3日以内に反応し、4人の患者は反応するまでに1週間以上かかりました。さらに、デキストロメトルファンとキニジンを組み合わせたFDA承認薬(Nuedexta)が現在、PBAの治療に特化した適応症で利用可能です。このように、PBAの治療に効果的であることが示されている治療法は、臨床使用が可能です。
PBAの臨床症状は、以下の症例報告で理解できます。
64歳の右利きの退職した既婚女性で、脳卒中の既往歴はありませんでした。血栓性右半球脳卒中を発症し、片麻痺を伴いましたが感覚障害はありませんでした。脳卒中後数日以内に、患者は1日5〜10回発生し、それぞれ約1〜2分間続く、制御不能な泣きのエピソードを経験し始めました。泣きのエピソードに加えて、患者はハミルトン抑うつ尺度で19点の重症うつ病を患っていました。彼女は悲しいと感じていると述べましたが、エピソード時の泣きは彼女の悲しみをはるかに超えており、泣きを制御できる感覚はありませんでした。病的な感情表現は、抑うつ気分よりも彼女にとってより厄介なものでした。彼女と夫は以前は活発な社交生活を送っていましたが、これらの泣きのエピソードによって社会的に恥をかくことを恐れて、友人に会うのをやめ、家から出なくなりました。彼女のPLACSスコアは24で、重症の範囲でした。ノルトリプチンによる治療後、彼女は大幅に改善しました。
その他の障害 (Other Disorders)
破局反応や失認症については、有効な治療法は確立されていません。
謝辞 (ACKNOWLEDGMENTS)
本書の前版でこの章に多大な貢献をされたサラ・T・マカッチョン医師とロバート・G・ロビンソン医師に感謝いたします。
参考文献 (FURTHER READINGS)
- Ayerbe L, Ayis S, Wolfe CD, Rudd AG. Natural history, predictors and outcomes of depression after stroke: systematic review and meta-analysis. Br J Psychiatry. 2013;202(1):14-21.
- Bucur M, Papagno C. A systematic review of noninvasive brain stimulation for post-stroke depression.1 J Affect Disord. 2018;238:69-78.
- Clancy U, Gilmartin D, Jochems ACC, Knox L, Doubal FN, Wardlaw JM. Neuropsychiatric symptoms associated with cerebral small vessel disease: a systematic review and meta-analysis. Lancet Psychiatry. 2021;8(3):225-236.
- Denny-Brown D, Meyer JS, Horenstein S. The significance of perceptual rivalry resulting from parietal lesions.2 Brain. 1952;75:433-471.
- Douven E, Köhler S, Rodriguez MMF, Staals J, Verhey FRJ, Aalten P. Imaging markers of post-stroke depression and apathy: a systematic review and meta-analysis.3 Neuropsychol Rev. 2017;27(3):202-219.
- Frey J, Najib U, Lilly C, Adcock A. Novel TMS for stroke and depression (NoTSAD): accelerated repetitive transcranial magnetic stimulation as a safe and effective treatment for post-stroke depression.4 Front Neurol. 2020;11:788.
- Goldstein K. The Organism: A Holistic Approach to Biology Derived from Pathological Data in Man. American Books; 1939.
- Hackett ML, Kohler S, O’Brien JT, Mead GE.5 Neuropsychiatric outcomes of stroke. The Lancet Neurology. 2014;13(5):525-534.
- Knapp P, Campbell Burton CA, Holmes J, et al. Interventions for treating anxiety after stroke. Cochrane Database Syst Rev. 2017;5(5):CD008860.
- Kohler S, Hackett ML, O’Brien JT, Mead GE.6 Neuropsychiatric outcomes after stroke-authors’ reply. Lancet Neurol. 2014;13(12):1168-1169.
- Kraepelin E. Manic Depressive Insanity and Paranoia.7 E & S Livingstone; 1921.
- Legg LA, Tilney R, Hsieh C-F, et al. Selective serotonin reuptake inhibitors (SSRIs) for stroke recovery. Cochrane Database Syst Rev. 2019;2019(11):CD009286.
- Levada OA, Troyan AS. Poststroke depression biomarkers: a narrative review.8 Front Neurol. 2018;9:577.
- Levine DA, Galecki AT, Langa KM, et al. Trajectory of cognitive decline after incident stroke. JAMA. 2015;314(1):41-51.
- Li W, Ling S, Yang Y, Hu Z, Davies H, Fang M. Systematic hypothesis for post-stroke depression caused inflammation and neurotransmission and resultant on possible treatments.9 Neuro Endocrinol Lett. 2014;35(2):104-109.
- Lincoln NB, Brinkmann N, Cunningham S, et al. Anxiety and depression after stroke: a 5 year follow-up. Disabil Rehabil. 2013;35(2):140-145.
- Meyer A. The anatomical facts and clinical varieties of traumatic insanity. Am J Insanity. 1904;60:373.
- Pompili M, Venturini P, Lamis DA, et al. Suicide in stroke survivors: epidemiology and prevention. Drugs Aging. 2015;32(1):21-29.
- Rafsten L, Danielsson A, Sunnerhagen KS. Anxiety after stroke: a systematic review and meta-analysis. J Rehabil Med. 2018;50(9):769-778.
- Robinson RG, Jorge RE. Post-stroke depression: a review. Am J Psychiatry. 2016;173(3):221-231.
- Robinson RG, Jorge RE, Long J. Prevention of post-stroke mortality using problem solving therapy or escitalopram. Am J Geriat Psychiatry. 2017;25:512-519.
- Rochat L, Van der Linden M, Renaud O, et al. Poor reward sensitivity and apathy after stroke: implication of basal ganglia. Neurology. 2013;81(19):1674-1680.
- Stangeland H, Orgeta V, Bell V. Poststroke psychosis: a systematic review. J Neurol Neurosurg Psychiatry. 2018;89(8):879-885.
- Starkstein SE, Hayhow BD. Treatment of post-stroke depression. Curr Treat Options Neurol. 2019;21(7):31.
- Tang WK, Lau CG, Mok V, Ungvari GS, Wong K-S. Impact of anxiety on health-related quality of life after stroke: a cross-sectional study. Arch Phys Med Rehabil. 2013;94(12):2535-2541.
- Virani SS, Alonso A, Aparicio HJ, et al. Heart Disease and Stroke Statistics-2021 Update: a report from the American Heart Association. Circulation. 2021;143(8):e254-e743.
- Wang S-B, Wang Y-Y, Zhang Q-E, et al. Cognitive behavioral therapy for post-stroke depression: a meta-analysis. J Affect Disord. 2018;235:589-596.
- Wiesmann M, Kiliaan AJ, Claassen JA. Vascular aspects of cognitive impairment and dementia. J Cereb Blood Flow Metab. 2013;33(11):1696-1706.
- Zonneveld TP, Richard E, Vergouwen MD, et al. Blood pressure-lowering treatment for preventing recurrent stroke, major vascular events, and dementia in patients with a history of stroke or transient ischaemic attack. Cochrane Database Syst Rev. 2018;7(7):CD007858.

