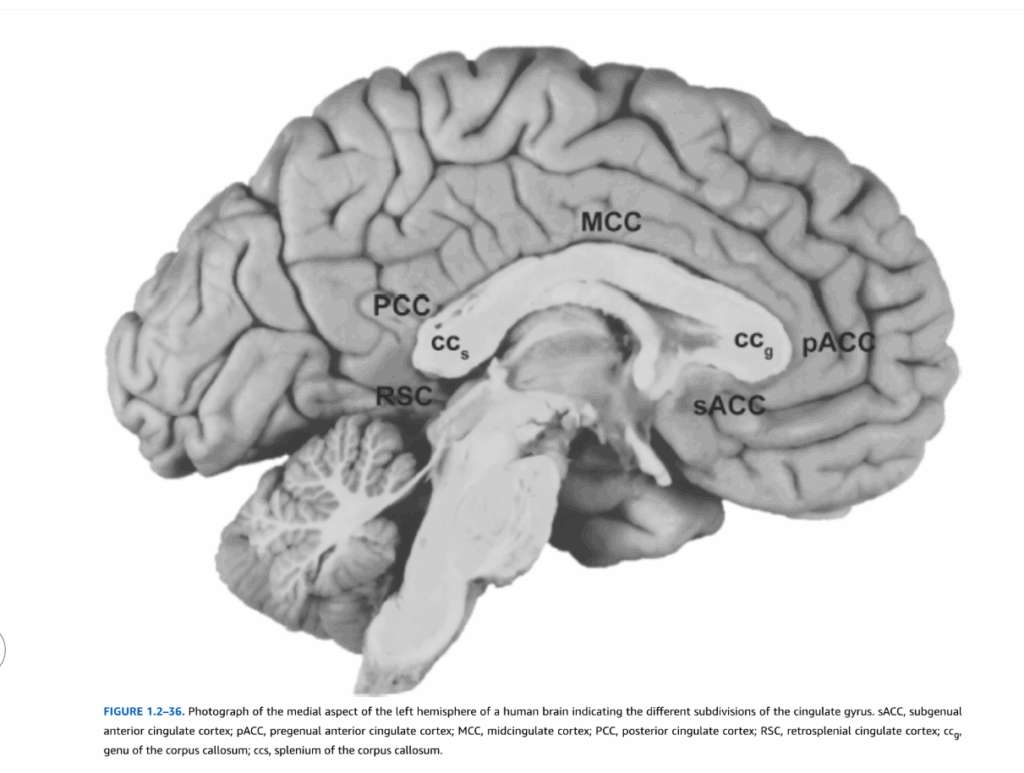
- 図1.2-36. ヒト脳左半球の内側面の写真で、帯状回の異なる区分を示している
- 海馬体
- 図1.2-37. ヒト海馬体におけるニューロン特異的核蛋白質に対する免疫反応性ニューロンの顕微鏡写真
- 扁桃体
- 中隔野
- 視床下部
- 図1.2-38. 海馬体の横断面図と、その構造と乳頭体の間を走る脳弓の経路の模式図
- 視床下部の前後区分
- 視床下部の機能的区分
- 視床下部核の詳細構造
- 中部結節領域(Medial Tuberal Region)
- 視床下部後部内側区域(Medial Posterior Section)
- 中部結節領域(Medial Tuberal Region)
- 視床下部後部内側区域(Medial Posterior Section)
図1.2-36. ヒト脳左半球の内側面の写真で、帯状回の異なる区分を示している
sACC:膝下前帯状皮質、pACC:膝前前帯状皮質、MCC:中帯状皮質、PCC:後帯状皮質、RSC:脾後帯状皮質、ccg:脳梁膝部、ccs:脳梁膨大部
手綱は、技術的には上視床の一部であるが、辺縁系内で重要な結合を持ち、内側と外側の区分に分けられる。外側手綱は、辺縁系、大脳基底核、脳幹回路を結ぶハブとして機能する。これらの結合、特に外側手綱から縫線核のセロトニン作動性ニューロンおよび腹側被蓋野のドパミン作動性細胞への投射を含むものは、外側手綱が気分調節およびうつ病などの障害に関与している可能性を示唆している。外側手綱を対象としたDBSの予備研究が成功しており、うつ病の病態生理学と治療におけるこの脳領域のさらなる研究への道を開いた。
図1.2-36に示されているように、帯状回は広範囲にわたり、後方に向かうにつれて、内側側頭葉に位置する海馬傍回と(白質の帯状束線維を介して)連続となる。海馬傍回は、いくつかの異なる細胞構築学的領域を含んでいる。これらの領域の中で最も重要なもののひとつは嗅内皮質で、高度に処理された皮質情報を海馬体に伝えるだけでなく、海馬体からの主要な出力経路でもある。
海馬体
海馬体は3つの異なる区域から構成される:歯状回、海馬、海馬台複合体であり、側脳室側角の底部に位置している(図1.2-10参照)。これらの区域は、吻尾方向に走る隣接する皮質組織の帯から構成されているが、内外側方向に螺旋状に互いに折り重なり、C字型の外観を呈する。
歯状回は3つの層から構成される:海馬裂のクモ膜下腔に面する外側の無細胞分子層、顆粒細胞から構成される中間層、および内側の多形層(図1.2-37)。顆粒細胞は樹状突起を分子層に伸ばし、海馬への苔状線維投射を形成する軸索を出す。
海馬もまた、分子層と多形層、および錐体ニューロンを含む中間層から構成される三層構造である。細胞構築学と結合性の違いに基づいて、海馬は3つの異なる野に分けることができ、CA3、CA2、CA1と標識されている(図1.2-37参照)(CAは、雄羊の角を持って描かれたエジプトの神アンモンにちなんだcornu ammonisという用語に由来し、初期の研究者の一部は海馬の形を表していると考えた)。いわゆるCA4領域については議論がある。この用語は、CA3に隣接し、歯状回の顆粒細胞層によって作られる「C」の内側にある海馬の部分に適用されてきた。しかし、結合研究により、この領域は歯状回により密接に関連しており、歯状回の門領域または門部と呼ぶのがより適切であることが明らかになった(図1.2-37参照)。
海馬の多形層に隣接する白質は海馬采として知られている。この構造の軸索は脳弓に寄与し、海馬の尾側端で脚脳弓となる。これらの両側性構造は収束して脳弓体を形成し、前方に向かって移動し、その後下方に曲がって脳弓柱を形成し、視床下部を通って乳頭体に入る(図1.2-38)。
海馬台複合体は一般的に5つの構成要素を持つと考えられている:前海馬台、傍海馬台、前海馬台、後海馬台、海馬台であり、これらは一緒に海馬と海馬傍回の間の移行領域として機能する。
海馬体の構成要素は、主に一方向性で情報の特定の流れを提供する、内在結合の独特のパターンを持っている。海馬体への主要な入力は、嗅内皮質の第2層と第3層のニューロンから生じ、貫通路を通って(すなわち、海馬台と海馬を通って)歯状回の分子層の外側3分の2に投射し、そこで顆粒細胞の樹状突起にシナプスを形成する。顆粒細胞の苔状線維軸索は、海馬のCA3野の錐体ニューロンに投射を提供する。CA3錐体ニューロンからの軸索側枝はCA3内に投射し、これらのCA3ニューロンの一次軸索、いわゆるSchaffer側枝は、海馬のCA1野に投射する。この領域は海馬台複合体に投射し、これが嗅内皮質に出力を提供し、回路を完成させる。
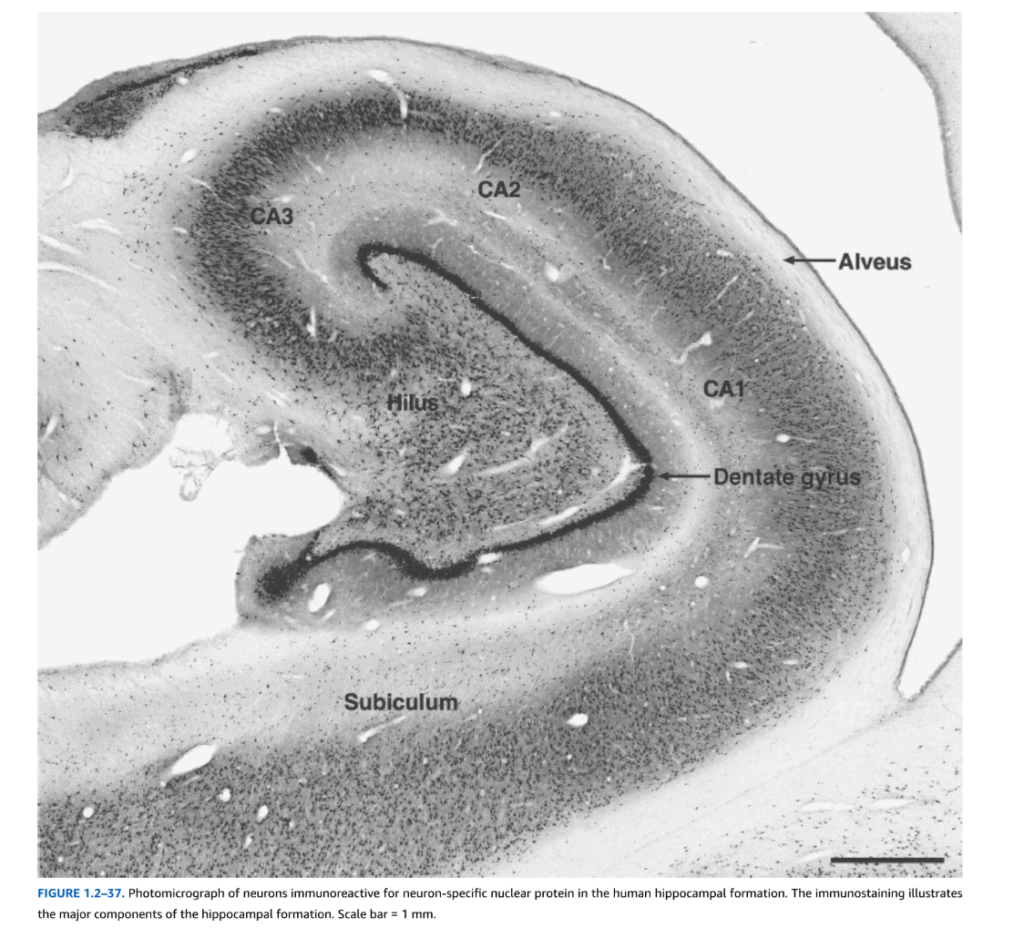
図1.2-37. ヒト海馬体におけるニューロン特異的核蛋白質に対する免疫反応性ニューロンの顕微鏡写真
免疫染色は海馬体の主要構成要素を示している。スケールバー = 1 mm
扁桃体
海馬体の直前の内側側頭葉に位置するのは、扁桃体と呼ばれる核群である(図1.2-9参照)。これらの核は、いくつかの異なるクラスターを形成する:基底外側複合体、中心内側扁桃体群、および皮質扁桃体核を含む嗅覚群。これらの核は通常、ニッスル染色によって明らかにされる細胞構築学的特徴を用いて区分される。しかし、カンナビノイドCB1受容体含有軸索の化学構築学もまた、これらの核を明確に区分する(図1.2-39)。CB1受容体免疫反応性は、3つの群の中で最大の基底外側核内に見出される一方、中心核と内側核はCB1受容体標識を欠いている。
基底外側複合体は、多くの点で残りの扁桃体核と異なっている。基底外側複合体は層状構造ではないが、その結合性といくつかの他の解剖学的特徴は、残りの扁桃体核よりも皮質領域により類似している。例えば、基底外側核は側頭葉、島皮質、前頭前野皮質と直接的かつ相互的に結合している。さらに、いくつかの皮質領域と同様に、基底外側複合体は内側背側視床核と双方向結合を共有し、正中および髄板内視床核からの投射を受ける。最後に、興奮性アミノ酸を神経伝達物質として使用する錐体様形態を持つ基底外側複合体のニューロンは、線条体への投射を提供する。これらの解剖学的特徴に基づいて、基底外側複合体は実際に多様式皮質領域と類似して機能するという仮説を立てることができる。
対照的に、中心内側扁桃体は、レンズ核下無名質を通って分界条床核と連続するより大きな構造の一部であるように見える。拡大扁桃体と呼ばれているこのより大きな構造は、2つの主要な区分から構成される。拡大扁桃体の中心区分は、中心扁桃体核と分界条床核の外側部分を含む。この区分は、脳幹の内臓感覚および内臓運動領域ならびに外側視床下部と相互結合している。さらに、皮質辺縁領域と基底外側扁桃体複合体からの求心性線維を受ける。対照的に、内側扁桃体核とその分界条床核内側部への延長から構成される拡大扁桃体の内側区分は、視床下部の内側または内分泌部分との相互結合によって特徴づけられる。
中隔野
中隔野は、前交連の直上に位置する灰白質構造である(図1.2-40)。中隔核は海馬、扁桃体、視床下部と相互結合し、脳幹の多数の構造に投射する。中隔と海馬は広範囲な相互結合を持ち、不安の調節のための神経生物学的回路である中隔海馬経路を形成している。
視床下部
視床下部は、間脳内の小さな構造で、情動だけでなく自律神経系、内分泌系、および一部の体性機能を調節する神経回路の重要な構成要素である。辺縁系の他の構成要素との関係に加えて、脳幹と脊髄の様々な内臓および体性核と相互接続し、下垂体の機能を調節する出力を提供する。
その下面において、視床下部は前方を視神経交叉、後方を乳頭体の後縁によって境界づけられる。これら2つの構造の間の視床下部の領域は灰白隆起と呼ばれ、正中隆起を生じ、これは漏斗柄、次に下垂体後葉と連続している(図1.2-41)。これらの特徴に基づいて、視床下部は前方から後方に3つの区域に細分される:視索上部、漏斗部、乳頭体部。(さらに、視索上部の直前に位置する終脳構造である視索前野は、通常、視床下部の一部と考えられている。)これら3つの区域もまた、視床下部体を通って乳頭体に向かう脳弓によって、各側で内側と外側の領域に分けられる。表1.2-4に示されているように、視床下部の6つの部分は異なる核を含んでいる。
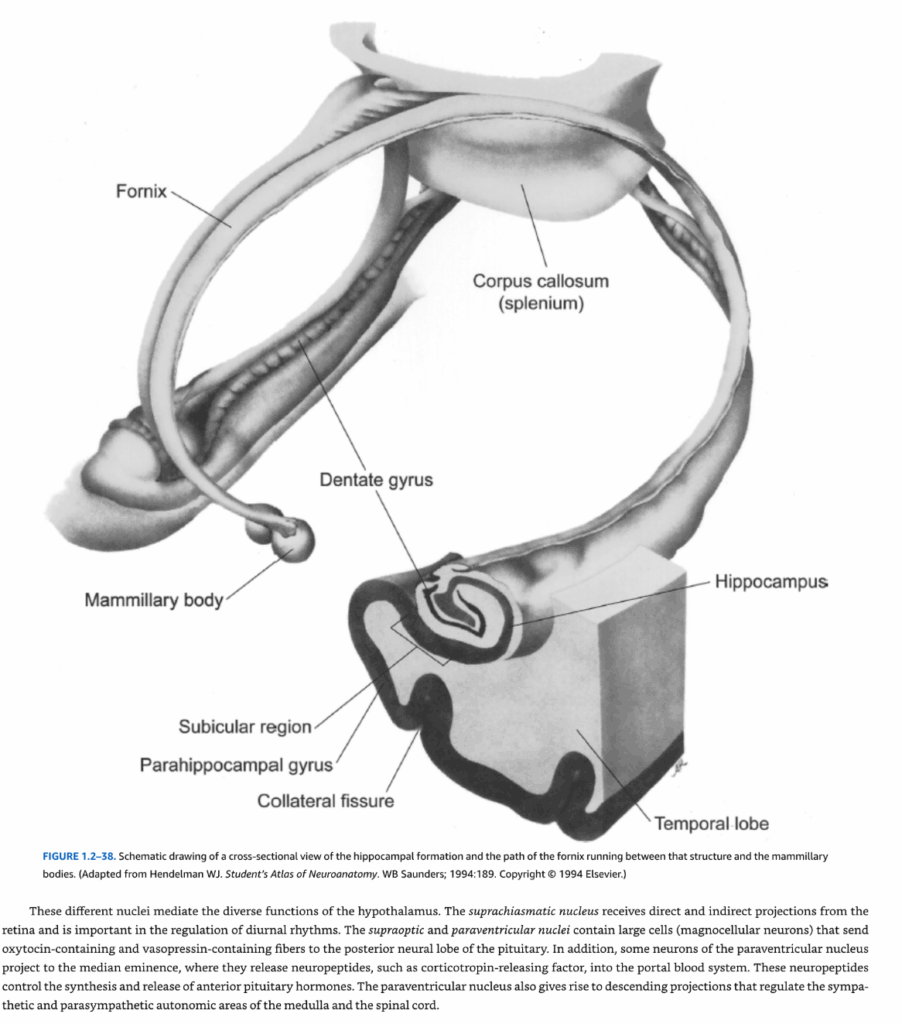
図1.2-38. 海馬体の横断面図と、その構造と乳頭体の間を走る脳弓の経路の模式図
(Hendelman WJ. Student’s Atlas of Neuroanatomy. WB Saunders; 1994:189より改変。Copyright @ 1994 Elsevier.)
これらの異なる核は、視床下部の多様な機能を媒介している。視交叉上核は網膜からの直接的および間接的投射を受け、日周リズムの調節において重要である。視索上核と室傍核は、オキシトシン含有線維とバソプレシン含有線維を下垂体後葉神経部に送る大型細胞(大細胞ニューロン)を含んでいる。さらに、室傍核の一部のニューロンは正中隆起に投射し、そこで副腎皮質刺激ホルモン放出因子などの神経ペプチドを門脈血系に放出する。これらの神経ペプチドは、前葉下垂体ホルモンの合成と放出を制御する。室傍核はまた、延髄と脊髄の交感神経および副交感神経自律神経領域を調節する下行投射も生じる。
視床下部の領域と核の構造
視床下部の前後区分
| 区分 | 英語 | 日本語 |
|---|---|---|
| Anterior | 前部 | 前部視床下部 |
| Middle | 中部 | 中部視床下部 |
| Posterior | 後部 | 後部視床下部 |
視床下部の機能的区分
| 区分 | 英語 | 日本語 |
|---|---|---|
| Preoptic | 視索前部 | 視索前部 |
| Supraoptic | 視索上部 | 視索上部 |
| Infundibular | 漏斗部 | 漏斗部 |
| Mammillary | 乳頭部 | 乳頭部 |
視床下部核の詳細構造
脳室周囲帯(Periventricular Zone)
| 部位 | 核名(英語) | 核名(日本語) |
|---|---|---|
| 前部 | Preoptic nucleus | 視索前核 |
| 前部 | Periventricular nuclei | 脳室周囲核 |
| 中部 | Suprachiasmatic nucleus | 視交叉上核 |
| 中部 | Periventricular nuclei | 脳室周囲核 |
| 後部 | Arcuate nucleus | 弓状核 |
内側帯(Medial Zone)
| 部位 | 核名(英語) | 核名(日本語) |
|---|---|---|
| 前部 | Medial preoptic nucleus | 内側視索前核 |
| 前部 | Anterior hypothalamic nucleus | 前視床下部核 |
| 中部 | Paraventricular nucleus | 室傍核 |
| 中部 | Supraoptic nucleus | 視索上核 |
| 中部 | Dorsomedial nucleus | 背内側核 |
| 中部 | Ventromedial nucleus | 腹内側核 |
| 後部 | Mammillary nuclei | 乳頭核 |
| 後部 | Posterior hypothalamic nuclei | 後視床下部核 |
外側帯(Lateral Zone)
| 部位 | 核名(英語) | 核名(日本語) |
|---|---|---|
| 前部 | Lateral preoptic nucleus | 外側視索前核 |
| 前部 | Lateral hypothalamic nucleus | 外側視床下部核 |
| 中部 | Lateral tuberal nuclei | 外側結節核 |
| 中部 | Lateral hypothalamic nucleus | 外側視床下部核 |
| 後部 | Lateral hypothalamic nucleus | 外側視床下部核 |
出典: Patestas MA, Gartner LP. A Textbook of Neuroanatomy. 2nd ed. John Wiley & Sons; 2016:441より改変
中部結節領域(Medial Tuberal Region)
腹内側核(Ventromedial nucleus)と弓状核(Arcuate nucleus)
- 下垂体前葉機能の調節に参加
- 腹内側核は生殖行動と摂食行動において重要な役割を果たす
視床下部後部内側区域(Medial Posterior Section)
後核(Posterior nucleus)
- 扁桃体拡張部と相互結合を持つ
- 齧歯類よりも霊長類でより発達している
- ヒト脳において重要だが、まだ明確化されていない役割を持つと考えられる
乳頭体(Mammillary bodies)
- 外側乳頭核と内側乳頭核を含む
- 脳弓(fornix)を通じて海馬からの入力を受ける
- 視床前核群に投射する
視床下部が単に自律神経や内分泌機能だけでなく、記憶・学習(海馬-乳頭体-視床前核回路)、情動(扁桃体との結合)、そして複雑な行動制御(生殖・摂食行動)にも深く関与していることを示しています。特に後核の霊長類での発達は、ヒトの高次脳機能における視床下部の進化的な重要性を示唆している。
重要なポイントを整理すると:
中部結節領域(Medial Tuberal Region)
腹内側核(Ventromedial nucleus)と弓状核(Arcuate nucleus)
- 下垂体前葉機能の調節に参加
- 腹内側核は生殖行動と摂食行動において重要な役割を果たす
視床下部後部内側区域(Medial Posterior Section)
後核(Posterior nucleus)
- 扁桃体拡張部と相互結合を持つ
- 齧歯類よりも霊長類でより発達している
- ヒト脳において重要だが、まだ明確化されていない役割を持つと考えられる
乳頭体(Mammillary bodies)
- 外側乳頭核と内側乳頭核を含む
- 脳弓(fornix)を通じて海馬からの入力を受ける
- 視床前核群に投射する
この記述は、視床下部が単に自律神経や内分泌機能だけでなく、記憶・学習(海馬-乳頭体-視床前核回路)、情動(扁桃体との結合)、そして複雑な行動制御(生殖・摂食行動)にも深く関与していることを示しています。特に後核の霊長類での発達は、ヒトの高次脳機能における視床下部の進化的な重要性を示唆している興味深い点ですね。
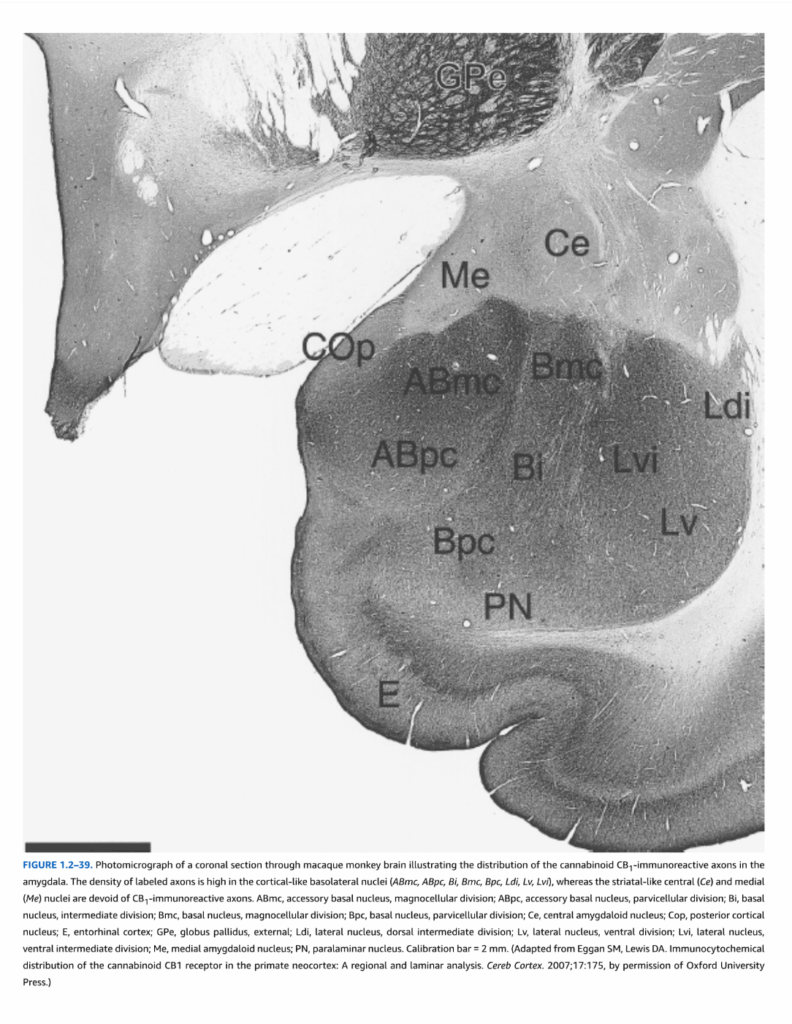
図1.2-39. 扁桃体におけるカンナビノイドCB1免疫反応性軸索の分布を示すマカクザル脳冠状断面の顕微鏡写真。標識軸索の密度は皮質様基底外側核(ABmc, ABpc, Bi, Bmc, Bpc, Ldi, Lv, Lvi)において高いが、線条体様中心核(Ce)および内側核(Me)ではCB1免疫反応性軸索を欠いている。ABmc, 副基底核大細胞部; ABpc, 副基底核小細胞部; Bi, 基底核中間部; Bmc, 基底核大細胞部; Bpc, 基底核小細胞部; Ce, 中心扁桃体核; Cop, 後皮質核; E, 嗅内皮質; GPe, 外側淡蒼球; Ldi, 外側核背側中間部; Lv, 外側核腹側部; Lvi, 外側核腹側中間部; Me, 内側扁桃体核; PN, 傍層核。較正バー = 2 mm。(Eggan SM, Lewis DA. Immunocytochemical distribution of the cannabinoid CB1 receptor in the primate neocortex: A regional and laminar analysis. Cereb Cortex. 2007;17:175より改変、Oxford University Press許可)
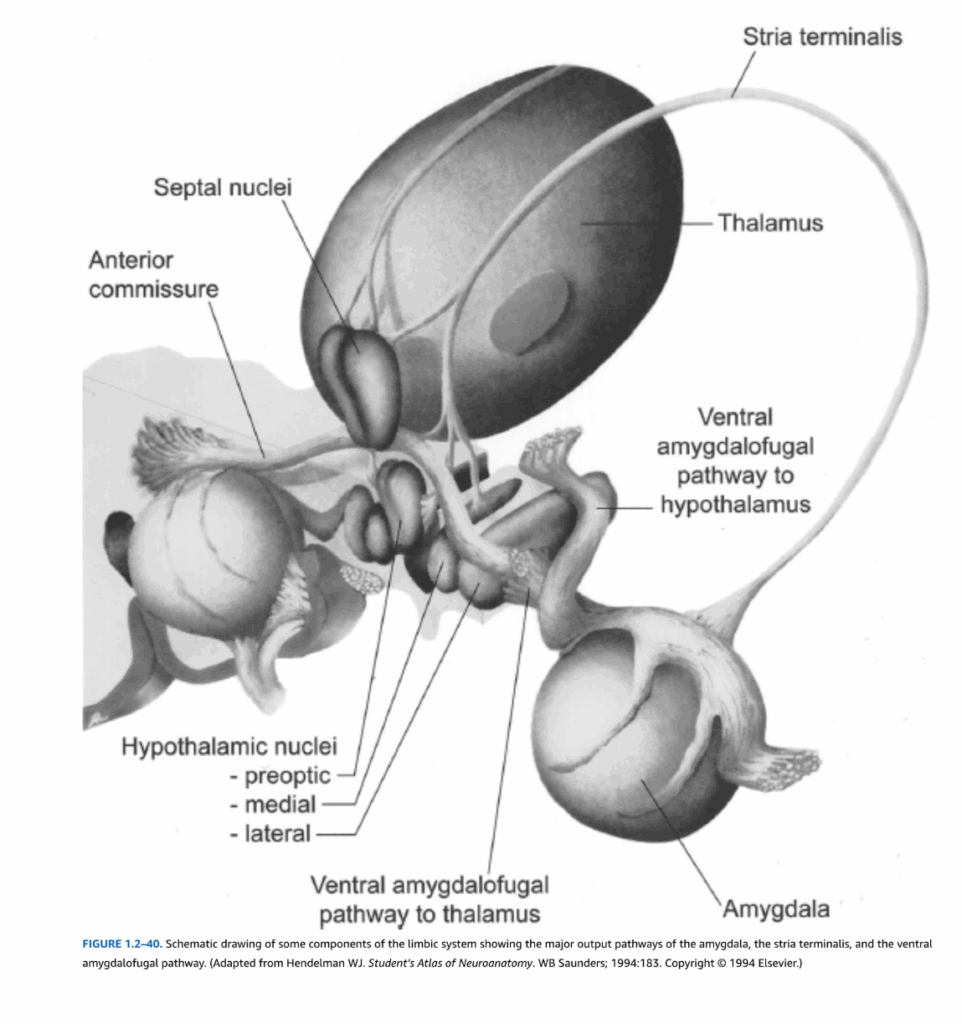
図1.2-40. 扁桃体の主要な出力経路である分界条と腹側扁桃体遠心路を示す辺縁系の一部構成要素の模式図。(Hendelman WJ. Student’s Atlas of Neuroanatomy. WB Saunders; 1994:183より改変。Copyright @ 1994 Elsevier.)
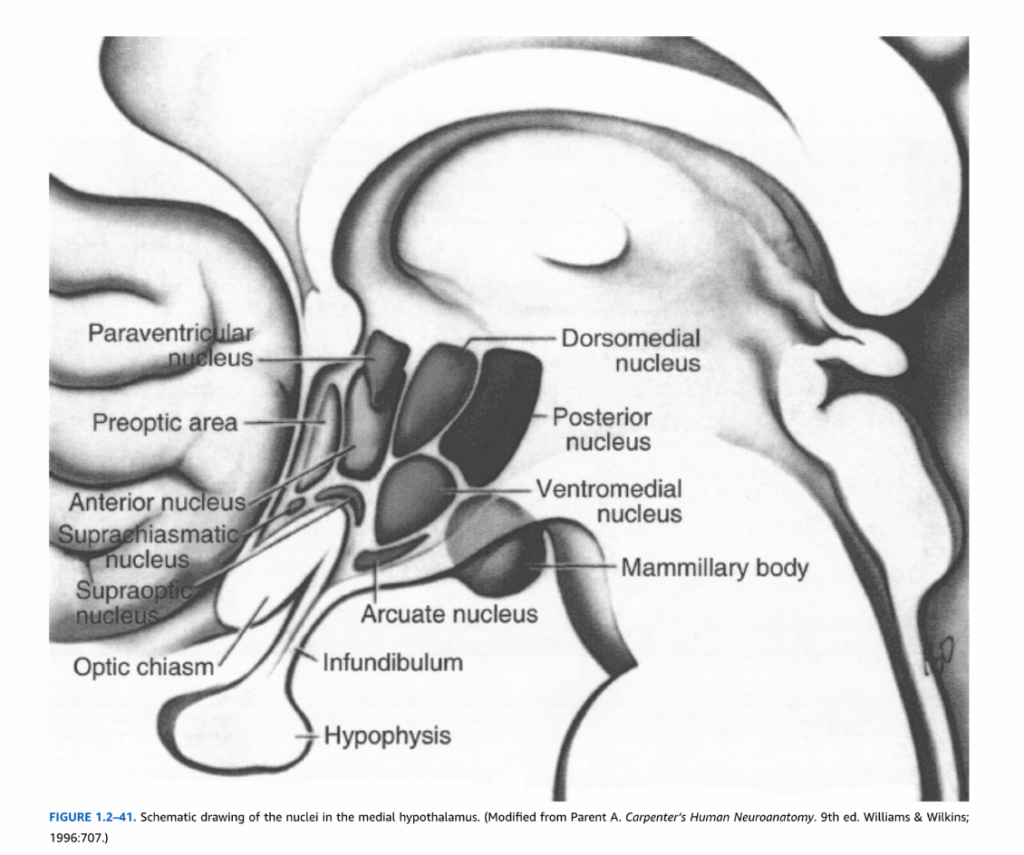
図1.2-41. 内側視床下部の核の模式図。(Parent A. Carpenter’s Human Neuroanatomy. 9th ed. Williams & Wilkins; 1996:707より改変。)
視床下部の外側部分は、内側前脳束の縦走線維の間に散在する低密度のニューロンを含んでいる。この領域は前脳、脳幹、脊髄の複数の領域と相互結合している。外側視床下部領域はまた、オレキシン神経ペプチドであるオレキシンAおよびオレキシンB(ヒポクレチンAおよびヒポクレチンBとしても知られる)を発現するニューロン集団を含み、これらは睡眠と覚醒に関与していると思われる。ヒト脳におけるおよそ70,000個のオレキシン産生ニューロンは、小脳を除く脳全体に投射している(図1.2-42)。オレキシンニューロンは大部分のモノアミン作動性核(すなわち、黒質、青斑核、背側縫線核)およびコリン作動性核(すなわち、内側中隔、脚橋被蓋核、外側背側被蓋核)に投射している。オレキシンニューロンはまた大脳皮質全体に広範な投射を持っている。オレキシン軸索の高密度を含む領域には、視床室傍核、視床下部弓状核、青斑核、背側縫線核が含まれる。睡眠と覚醒に関与する神経系(すなわち、青斑核、縫線核、外側背側/脚橋被蓋核)へのオレキシンニューロンの投射は、オレキシンニューロンがこれらの機能に参加していることを示唆している。動物およびヒトにおける多数の研究は、オレキシン欠乏がナルコレプシーの主要な原因であることを示している。例えば、オレキシン遺伝子を欠くマウスはヒトナルコレプシーに類似した生理学的症状を示し、ナルコレプシー患者の脳の死後検査では、オレキシン免疫反応性ニューロン数の85から95パーセントの減少が明らかになっている。
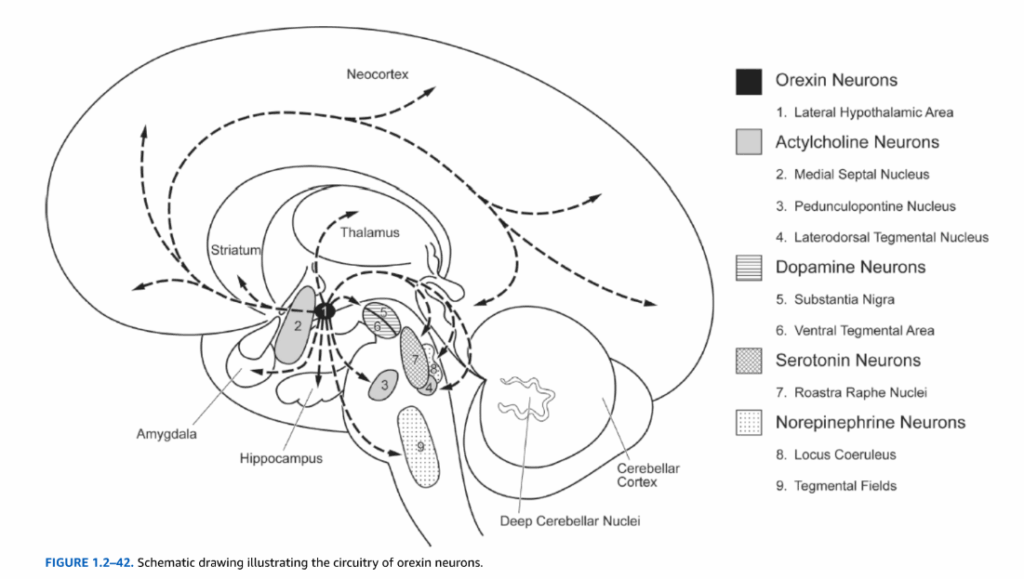
図1.2-42. オレキシンニューロンの回路を示す模式図。
機能回路。辺縁系の主要な構造は、互いにそして神経系の他の構成要素と様々な方法で相互結合している。辺縁系のいくつかの主要な出力経路は明確に定義されている。一つの経路(図1.2-43)では、帯状皮質、眼窩皮質および側頭皮質、そして扁桃体からの高度に処理された感覚情報が海馬傍回の嗅内皮質に伝達され、次に海馬体に伝達される。海馬体の内在回路を通過した後、情報は脳弓を通して辺縁皮質に投射する前視床、または中隔野と視床下部のいずれかに投射される。これら後者の二つの領域は脳弓を通して海馬体にフィードバックを提供する。さらに、視床下部の乳頭体は前視床に投射する。最後に、視床下部と中隔野は脳幹と脊髄に投射する。
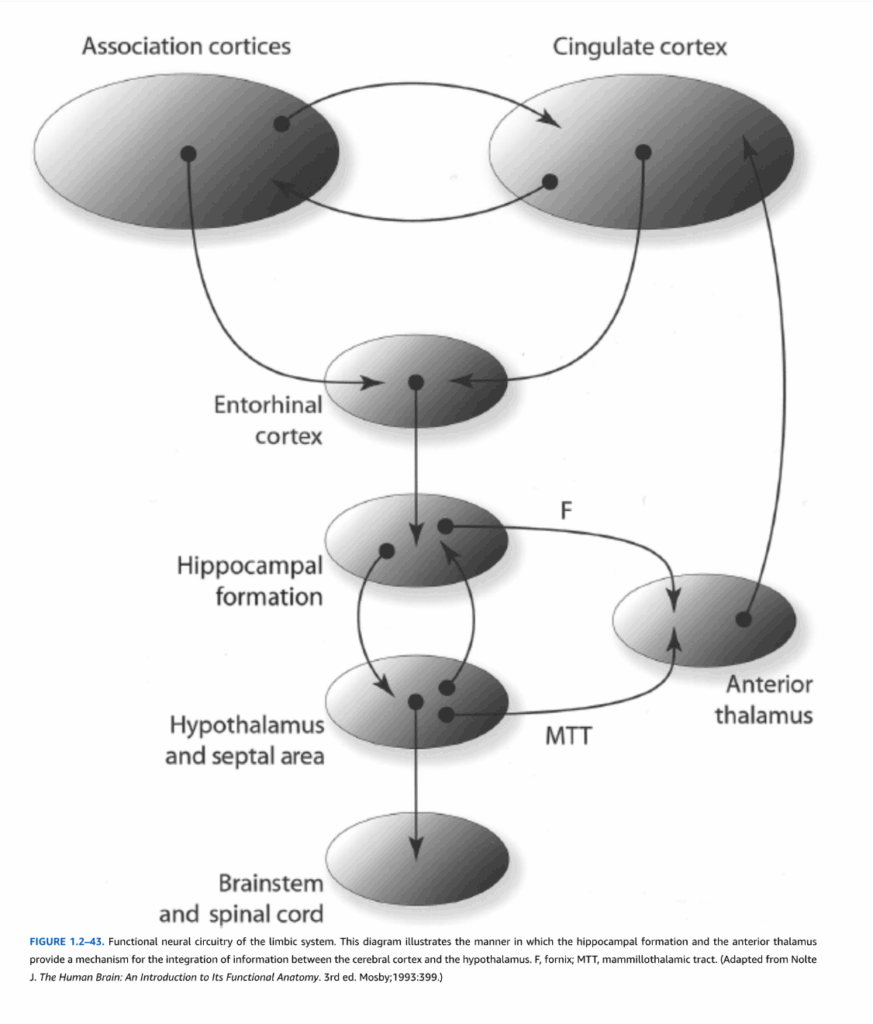
図1.2-43. 辺縁系の機能的神経回路。この図は海馬体と前視床が大脳皮質と視床下部の間の情報統合のメカニズムを提供する方法を示している。F, 脳弓; MTT, 乳頭視床路。(Nolte J. The Human Brain: An Introduction to Its Functional Anatomy. 3rd ed. Mosby; 1993:399より改変。)
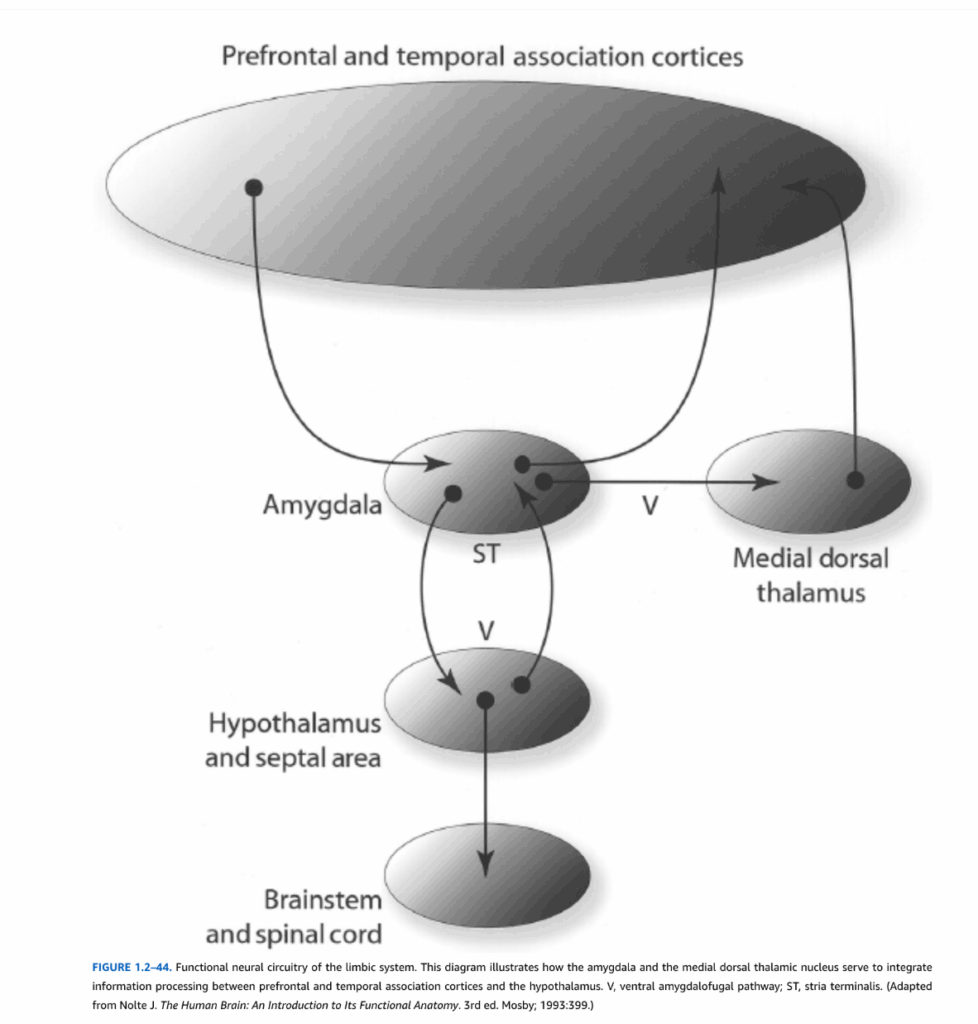
図1.2-44. 辺縁系の機能的神経回路。この図は扁桃体と内側背側視床核が前頭前野および側頭連合皮質と視床下部の間の情報処理を統合する役割を示している。V, 腹側扁桃体遠心路; ST, 分界条。(Nolte J. The Human Brain: An Introduction to Its Functional Anatomy. 3rd ed. Mosby; 1993:399より改変。)
辺縁系内のもう一つの主要経路は扁桃体からの出力を中心としている(図1.2-44)。主に前頭前野および側頭皮質の連合領域からの高度に処理された感覚情報が扁桃体に投射する。扁桃体からの出力は二つの主要経路を通って伝導される(図1.2-40参照)。背側経路である分界条は、側頭葉の周りを弧状に尾状核に沿って走り、主に中隔野と視床下部に投射する軸索を含んでいる。第二の主要出力経路である腹側扁桃体遠心路は、豆状核の下を通過し、中隔野、視床下部、内側背側視床核を含む多くの領域で終止する線維を含んでいる。前述のように、内側背側視床核は前頭前野といくつかの側頭皮質領域に強く投射しており、この経路が情動的および恒常性維持情報を認知回路に統合するために重要である可能性を示唆している。
これらの経路はいずれも、辺縁系が大脳皮質回路の高度に処理された感覚的および認知的情報内容を、自律神経系および内分泌系を制御する視床下部経路と統合することができる方法を明らかにしている。さらに、辺縁系は大脳基底核系の構成要素と相互作用する(図1.2-45)。例えば、腹側扁桃体遠心路はまた側坐核(腹側線条体)、すなわち尾状核頭部が被殻と融合する領域(図1.2-27および1.2-28参照)に投射する。この領域は腹側淡蒼球(淡蒼球の延長部)に遠心性線維を送り、これは次に内側背側視床核に投射する。この経路は大脳基底核の機能が運動活動の調節を超えて拡張していることを示し、特定の脳領域の機能または機能不全をその回路のすべての側面の文脈において考慮する必要性を示している。
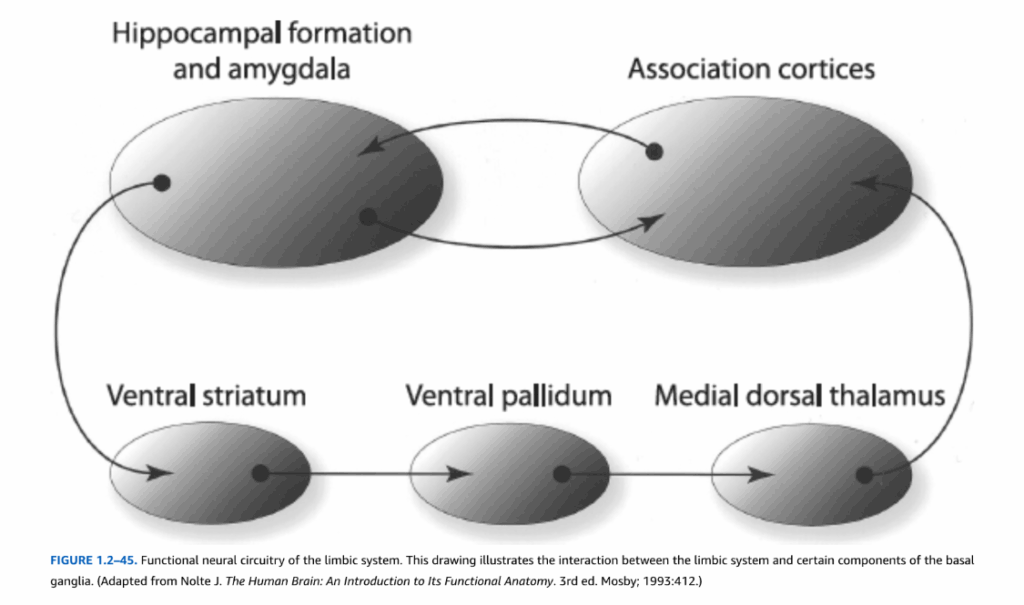
図1.2-45. 大脳辺縁系の機能的神経回路 この図は大脳辺縁系と大脳基底核の特定の構成要素との相互作用を示している。(Nolte J. The Human Brain: An Introduction to Its Functional Anatomy. 3rd ed. Mosby; 1993:412より改変)
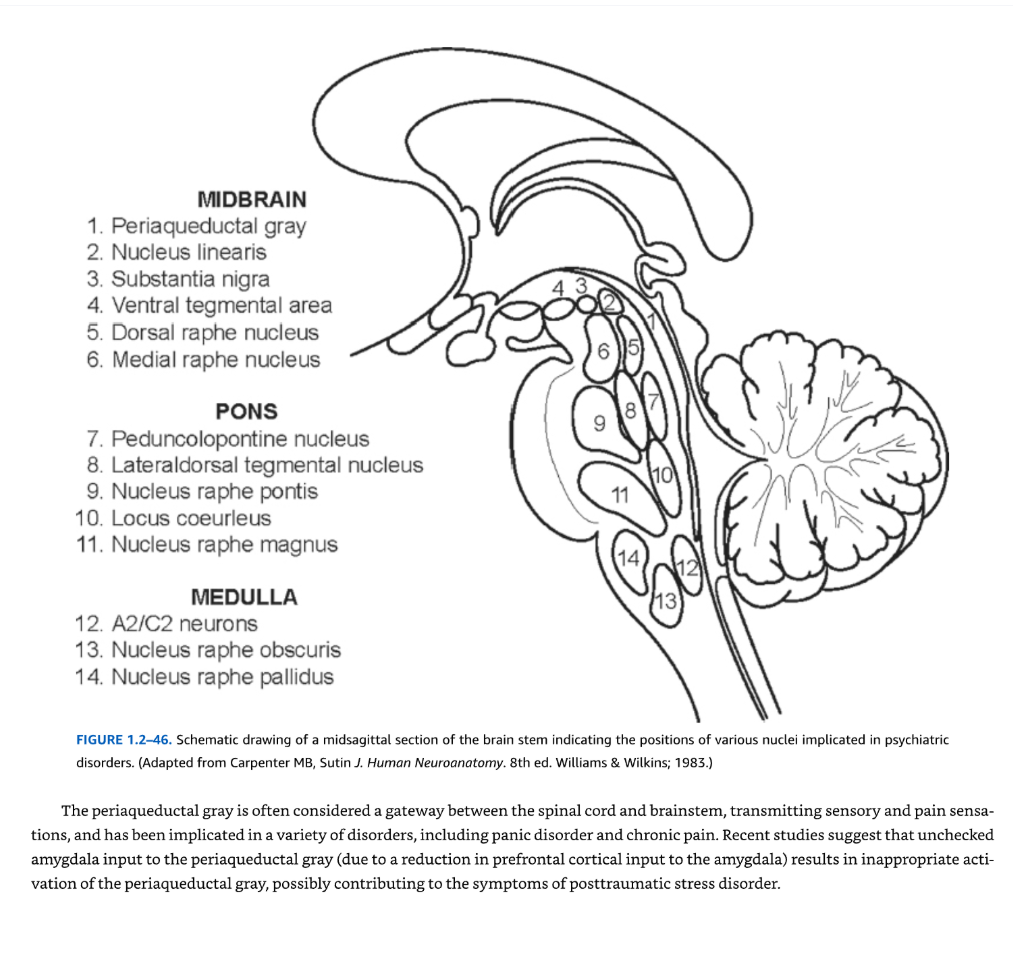
脳幹 前述のように、脳幹は吻側から尾側に向かって中脳、橋、延髄の3つの区分に分けられる(図1.2-46)。脳幹は多面的な構造であり、一般的に自律神経機能と感覚処理を司ると考えられている。脳幹の網様体核群は総じて網様体を構成し、これには脳幹のより緊密で名前の付いた核の間に散在するすべてのニューロンが含まれる。多数の研究により、脳幹内に埋め込まれた核のいくつかが、精神疾患でしばしば障害される情緒的・認知的機能において重要な役割を果たすことが明らかになっている。
感覚核は脳幹の3つのレベルすべてに位置し、それらに関連する経路は脊髄から脳幹を通って上位レベル、特に視床と大脳皮質へと向かう。脳幹の基本的な感覚表象は島皮質と隣接する前頭弁蓋領域への共通経路を共有し、これにより内受容経路を形成している。内受容とは、個体が身体からの信号を検出、統合、解釈する能力であり、自己の概念と密接に関連している。最近の研究では、統合失調症患者において内受容精度の低下が、強迫性障害患者において内受容感受性の増加が報告されている。
中脳 中脳内では、黒質と腹側被蓋野(図1.2-26、1.2-46、1.2-47参照)が精神障害に対して特に重要である。これらの領域のニューロンはドーパミンの主要な産生源だからである。これらの結合とそれらが精神障害に与える影響については、前の章(大脳基底核/主要構造/黒質)で概説されている。
中脳内のその他の注目すべき核には、歴史的に情動の調節と痛みの体験に関連してきた中脳水道周囲灰白質がある(図1.2-46参照)。中脳水道周囲灰白質は大脳水道を取り囲み(図1.2-47参照)、吻側から尾側に配向した4つの柱から構成される:背内側中脳水道周囲灰白質、背外側中脳水道周囲灰白質、外側中脳水道周囲灰白質、腹外側中脳水道周囲灰白質(図1.2-47参照)。2つの背側柱と2つの腹側柱はしばしば組み合わされて、それぞれ背側中脳水道周囲灰白質と腹側中脳水道周囲灰白質を形成する。背側中脳水道周囲灰白質は扁桃体、腹内側視床下部、内側前頭前皮質、およびすべての感覚系から神経支配を受ける。背側中脳水道周囲灰白質は交感神経系を神経支配し、自律神経活動の増加を伴う闘争/逃走反応およびその他の能動的対処反応を促進すると考えられている。腹側中脳水道周囲灰白質は前島皮質と背内側前頭前皮質から標的とされ、副交感神経系を神経支配する。腹側中脳水道周囲灰白質は受動的対処機制を仲介すると考えられている。
中脳
- 中脳水道周囲灰白質
- 線状核
- 黒質
- 腹側被蓋野
- 背側縫線核 6.内側縫線核
橋 7. 脚橋被蓋核 8. 外側背側被蓋核 9. 橋縫線核 10. 青斑核 11. 大縫線核
延髄 12. A2/C2ニューロン 13. 暗縫線核 14. 淡縫線核
図1.2-46. 精神障害に関与する様々な核の位置を示す脳幹の正中矢状断面の模式図(Carpenter MB, Sutin J. Human Neuroanatomy. 8th ed. Williams & Wilkins; 1983より改変)
中脳水道周囲灰白質はしばしば脊髄と脳幹の間の関門と考えられ、感覚と疼痛感覚を伝達し、パニック障害や慢性疼痛を含む様々な障害に関与している。最近の研究では、扁桃体から中脳水道周囲灰白質への抑制されない入力(扁桃体への前頭前皮質からの入力の減少による)が中脳水道周囲灰白質の不適切な活性化をもたらし、心的外傷後ストレス障害の症状に寄与している可能性があることが示唆されている。
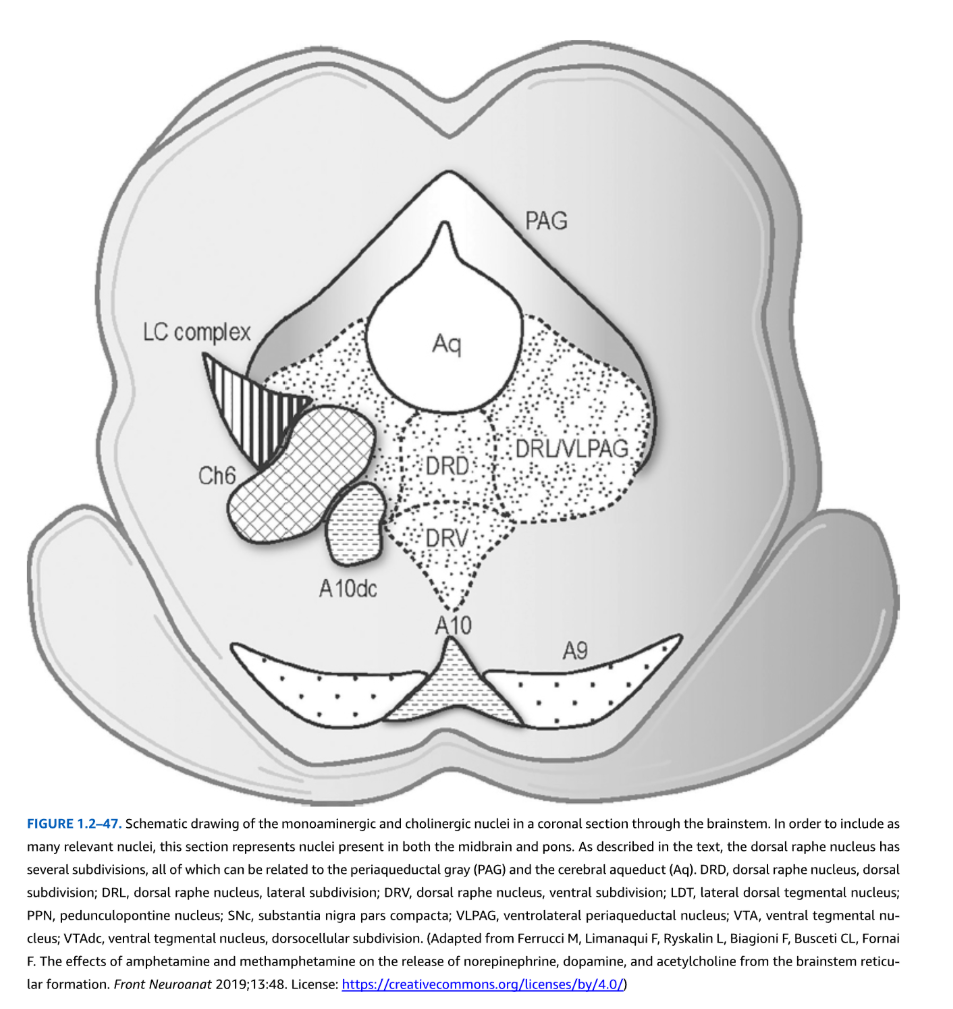
図1.2-47. 脳幹の冠状断面におけるモノアミン作動性およびコリン作動性核の模式図
関連する核をできるだけ多く含めるため、この断面は中脳と橋の両方に存在する核を表している。本文で述べられているように、背側縫線核はいくつかの下位区分を有し、そのすべてが中脳水道周囲灰白質(PAG)と大脳水道(Aq)に関連している。
略語説明:
- DRD:背側縫線核、背側下位区分
- DRL:背側縫線核、外側下位区分
- DRV:背側縫線核、腹側下位区分
- LDT:外側背側被蓋核
- PPN:脚橋被蓋核
- SNc:黒質緻密部
- VLPAG:腹外側中脳水道周囲核
- VTA:腹側被蓋核
- VTAdc:腹側被蓋核、背側細胞下位区分
(Ferrucci M, Limanaqui F, Ryskalin L, Biagioni F, Busceti CL, Fornai F. The effects of amphetamine and methamphetamine on the release of norepinephrine, dopamine, and acetylcholine from the brainstem reticular formation. Front Neuroanat 2019;13:48より改変。ライセンス:https://creativecommons.org/licenses/by/4.0/)
縫線核群
縫線核群は中脳から延髄まで脳幹の全長にわたって分布し(図1.2-46参照)、脳内におけるセロトニン作動性投射の主要な起源である。人間の脳内では脳幹内の位置に基づいて7つの異なる縫線核を区別することができる。これらの核はまた、主にその遠心性投射に基づいて背側群と尾側群に分けることもできる。背側群には線状核、背側縫線核、内側縫線核が含まれる。
線状核は両側の赤核の間の正中線上に位置し、脚間核の背側にあり、上小脳脚交叉のレベルで終わる。この核はセロトニンを合成する最も吻側の縫線核であるが、ドパミン作動性ニューロンを含む様々な化学特異性細胞も含んでいる。
吻側レベルでは、背側縫線は正中線上に位置し、中脳水道周囲灰白質の腹側にあり、外側は動眼神経核と内側縦束によって境界され、尾側では中脳水道周囲灰白質の腹側に留まり、滑車神経核と内側縦束が外側境界となる。背側縫線は人間の脳で最大のセロトニン作動性ニューロン集団を含む背側縫線、外側背側縫線、腹側背側縫線を含む亜核にさらに細分される(図1.2-47参照)。
内側縫線は正中線上に位置し、背側縫線の腹側にある。いくつかのレベルでは、これら2つの核は互いに隣接している。内側縫線は上小脳脚交叉から三叉神経運動核のレベルまで延び、内側縦束の下の橋で終わる。
多数の研究により、背側縫線と内側縫線内のセロトニン作動性ニューロンが大脳皮質や視床、大脳基底核、扁桃体、海馬などの他の前脳構造に投射を送ることが明らかになっている。これら2つの核から大脳皮質への投射は平行で密な投射であり、線維の形態とその層状樹状化パターンによって区別することができる。簡潔に述べると、背側縫線ニューロンからの軸索は小さな膨大部を持ち、大脳皮質と海馬に広く分布するのに対し、内側縫線からの軸索は大きな膨大部を持ち、主に海馬に分布し、大脳皮質にはより控えめな神経支配を提供する。
背側縫線核と内側縫線核およびそれらの軸索投射は、選択的セロトニン再取り込み阻害薬の有効性によって示されるように、気分が影響を受ける多くの精神的状態の治療において重要な標的である。
橋
ノルアドレナリン作動性投射の主要な起源は、脳幹の被蓋内に埋め込まれた青斑核から生じる。青斑核は第四脳室底と上背外側橋に位置している。この核内のニューロンの青い色素沈着にちなんで名付けられた(ラテン語で青を意味するcaeruleus)この小さなニューロンクラスターは、大脳皮質全体に広範囲な投射を持つ。脳内には他にもノルアドレナリン作動性核があるが、青斑核は大脳皮質と視床への投射の主要な起源である。
ノルエピネフリンは脳機能に広範囲で多機能な影響を与え、(中枢神経系内および身体内の)ホルモンとしても神経伝達物質としても考えることができる。大脳皮質におけるノルアドレナリン作動性神経伝達は、パニック障害や全般性不安障害を含む不安障害と強く関連している。しかし、大脳皮質のすべての領域にわたるノルエピネフリン軸索の広範囲な分布を考えると、青斑核のノルアドレナリン作動性ニューロンは多くの精神障害において役割を果たしている可能性が高い。
脚橋被蓋核と外側背側被蓋核は、腹側被蓋野を含む他の脳幹領域と同様に、視床へのコリン作動性投射の主要な起源である。大脳皮質へのほとんどのコリン作動性投射は基底前脳から生じ、この回路が精神障害において最も研究されている。
延髄
解剖学的に、延髄は錐体によって特徴づけられる。錐体は中心前回、中心後回、運動前皮質から脊髄への情報を運ぶ白質路であり、皮質脊髄路を形成する。精神障害において役割を果たす可能性のある延髄核には、A2/C2核と2つの縫線核(暗縫線核と淡縫線核)が含まれる。A2/C2核はアドレナリン作動性とコリン作動性ニューロンから構成され、それぞれの投射を他の脳幹領域や視床に送る。
生物学に基づく診断システムへの含意
この章で述べられた神経解剖学的特徴の完全性は、精神障害の個体において異なる解像度レベルで評価することができる。ニューロン数、ニューロンサイズ、またはニューロン間の結合における疾患関連変化は、生体内イメージング技術によって検出される粗大な構造変化に反映される可能性がある。しかし、これらのイメージング技術によって提供される解像度が、臨床診断に情報を提供できる方法で異なる疾患過程を識別できるかどうかは不明のままである。
例えば、特定の脳領域の体積における疾患関連の差異は、ニューロンの減少、ニューロンの縮小、または神経結合の減少によるものである可能性があり、構造イメージングによって明らかになる同じ異常が、非常に異なる基礎的疾患過程を表している可能性がある。
死後研究はそのような可能性を区別するのに必要な解像度を提供するが、これらの調査からの所見の診断的価値は(イメージング研究の場合と同様に)、以下の5つの「C」を区別する能力を必要とする:(1)原因(cause)、疾患病因に関連する上流因子;(2)結果(consequence)、原因の有害な影響;(3)代償(compensation)、恒常性の回復を助ける原因または結果に対する脳の反応;(4)併存疾患(comorbidity)、疾患過程の一部ではないが、頻繁に関連する因子の産物;または(5)交絡(confound)、関心のある測定値を得るために使用されたアプローチのアーティファクト。精神障害の診断スキーマへの解剖学的データの将来の組み込みは、適切な解像度レベルで測定を行い、特定の観察がどの「C」カテゴリーを表すかを決定する能力に依存するであろう。
FURTHER READINGS
Beneyto M, Sibille E, Lewis DA. Human postmortem brain research in mental illness syndromes. In: Charney DS, Nestler EJ, eds. Neurobiology of Mental
Illness. 3rd ed. Oxford University Press; 2009.
Chen AC, Oathes DS, Chang C, et al. Causal interactions between fronto-parietal central executive and default-mode networks in humans. Proc Natl Acad
Sci USA. 2013;110:19944-19949.
Chudasama Y, Robbins TW. Functions of frontostriatal systems in cognition: comparative neuropsychopharmacological studies in rats, monkeys and
humans. Biol Psychol. 2006;73:19-38.
*Datta D, Arion D, Roman KM, Volk DW, Lewis DA. Altered expression of ARP2/3 complex signaling pathway genes in prefrontal layer 3 pyramidal cells in
schizophrenia. Am J Psych. 2017;174:163-171.
DeFelipe J. The evolution of the brain, the human nature of cortical circuits, and intellectual creativity. Front Neuroanat. 2011;5:29.
DeLong MR, Wichmann T. Circuits and circuit disorders of the basal ganglia. Arch Neurol. 2007;64:20-24.
Eggan SM, Lewis DA. Immunocytochemical distribution of the cannabinoid CB1 receptor in the primate neocortex: a regional and laminar analysis. Cereb
Cortex. 2007;17:175-191.
*Fuster JM. The Prefrontal Cortex. 4th ed. Academic Press; 2008.
Glausier JR, Lewis DA. Dendritic spine pathology in schizophrenia. Neurosci. 2013;251:90-107.
Gonzalez-Burgos G, Cho RY, Lewis DA. Alterations in cortical network oscillations and parvalbumin neurons in schizophrenia. Biol Psychiatry.
2015;77:1031-1040.
Haines DE. Fundamental Neuroscience for Basic and Clinical Applications. 4th ed. Churchill Livingstone; 2006.
Hamami C, Mayberg H, Stone S, Laxton A, Haber S, Lozano AM. The subcallosal cingulate gyrus in the context of major depression. Biol Psychiatry.
2011;69:301-308.
Heimer L, Van Hoesen GW. The limbic lobe and its output channels: implications for emotional functions and adaptive behavior. Neurosci Biobehav Rev.
2006;30:126-147.
*Lewis DA, Curley AA, Glausier JR, Volk DW. Cortical parvalbumin interneurons and cognitive dysfunction in schizophrenia. Trends Neurosci. 2012;35:57-
67.
Lewis DA, Melchitzky DS, Gonzalez-Burgos G. Specificity in the functional architecture of primate prefrontal cortex. J Neurocytol. 2002;31:265276.
Mäki-Marttunen V, Andreassen OA, Espeseth T. The role of norepinephrine in the pathophysiology of schizophrenia. Neurosci Biobehav Rev.
2020;118:298-314.
*Nolte J, Sundsten JW. The Human Brain: An Introduction to Its Functional Anatomy. 6th ed. Mosby; 2008.
Patestas MA, Gartner LP. A Textbook of Neuroanatomy. Blackwell; 2006.
*Peters SK, Dunlop K, Downar J. Cortico-striatal-thalamic loop circuits of the salience network: a central pathway in psychiatric disease and treatment.
Front Syst Neurosci. 2016;10:104.
Petrides M. Lateral prefrontal cortex: architectonic and functional organization. Philos Trans R Soc Lond B Biol Sci. 2005;360:781-95.
Ramnani N. The primate cortico-cerebellar system: anatomy and function. Nat Rev Neurosci. 2006;7:511-522.
Sillito AM, Cudeiro J, Jones HE. Always returning: feedback and sensory processing in visual cortex and thalamus. Trends Neurosci. 2006;29:307-316.
*Sherman SM, Guillery RW. Functional Connections of Cortical Areas: A New View from the Thalamus. MIT Press; 2013.
Squire LR, Bloom FE, McConnell SK, et al. Fundamental Neuroscience. 4th ed. Academic Press; 2012.
Steriade M. Grouping of brain rhythms in corticothalamic systems. Neuroscience. 2007;137:1087-1106.
The Petilla Interneuron Nomenclature Group (PING). New insights into the class and nomenclature of cortical GABAergic interneurons. Nat Rev Neurosci.
2013;14:202.568.
Tsujino N, Sakuri T. Orexin/Hypocretin: a neuropeptide at the interface of sleep, energy homeostasis, and reward system. Pharmacol Rev. 2009;61:162-
176.
*Venkatraman A, Edlow BL, Immordino-Yan MH. The brainstem in emotion: a review. Front Neuroanat. 2017;11:15.
Zhang F-F, Peng W, Sweeney JA, Jia Z-Y, Gong Q-Y. Brain structure alterations in depression: psychoradiological evidence. CNS Neurosci Ther. 2018;24:994-
1003.

