1.6 アミノ酸神経伝達物質
ジョセフ・T・コイル医学博士
70年以上にわたり、精神疾患の病態生理学における神経伝達物質の役割に関する思考は、生体アミンによって支配されてきました。しかし、過去20年間で、死後脳、脳画像、遺伝子研究から、アミノ酸神経伝達物質、特にグルタミン酸とγ-アミノ酪酸(GABA)が、統合失調症、双極性障害、大うつ病、自閉症スペクトラム障害(ASD)、アルツハイマー病、不安障害など、広範な精神疾患の病態生理において、中心的な役割ではないにしても、重要な役割を果たしているという証拠が蓄積されてきました。最近の十分なパワーを持ったゲノムワイド関連解析(GWAS)の進展は、ヒトゲノム上のリスク部位とアミノ酸神経伝達物質、特にグルタミン酸に関連する遺伝子を結びつける上で絶大な影響を与えました。CNSのほぼすべてのニューロンがGABA作動性ニューロンとグルタミン酸作動性ニューロンによって神経支配されているという事実を考えると、これは全く驚くべきことではありません。これと一致して、脳内のシナプスGABAとグルタミン酸の濃度はミリモル範囲であるのに対し、生体アミンとペプチド神経伝達物質はマイクロモル範囲以下です。神経伝達物質アミノ酸のmM濃度は、コンピューター支援断層撮影(CAT)や陽電子放出断層撮影(PET)スキャンなどの放射線被曝を伴わない磁気共鳴分光法(MRS)によって、ヒト脳内の生体内で測定できるという点でユニークです。本章の目的は、アミノ酸神経伝達物質に関する現在の理解を概観し、精神疾患におけるその潜在的な関与について考察することです。
グルタミン酸
グルタミン酸は脳内で速い興奮性神経伝達を媒介し、脳内シナプスの約80パーセント、特に樹状突起スパインに神経支配しているシナプスの神経伝達物質です。グルタミン酸作動性神経伝達によって脱分極したニューロン膜の再分極は、脳のエネルギー消費の80パーセントにも達します。脳内のグルタミン酸濃度は全アミノ酸の中で最も高い10mMであり、その約20パーセントが神経伝達物質プールとしてのグルタミン酸を構成しています。
グルタミン酸のシナプス後効果は2つの受容体ファミリーによって媒介されます。1つは速い神経伝達を担うグルタミン酸ゲート型陽イオンチャネルです。2番目のタイプのグルタミン酸受容体は、α-アドレナリン受容体やドーパミン受容体と同様にGタンパク質共役型受容体(GPCR)である**代謝型グルタミン酸受容体(mGluR)**です。mGluRは主にグルタミン酸作動性神経伝達を調節します。
グルタミン酸の合成
グルタミン酸の興奮性(そして潜在的に神経毒性)効果を考えると、血液脳関門(BBB)によって脳から排除されるのは当然のことです。したがって、脳内のグルタミン酸は、トリカルボン酸回路を介してグルコースからde novoで合成され、α-ケトグルタル酸を生成する必要があります。α-ケトグルタル酸はトランスアミナーゼ反応を介してアミノ基を受け取り、グルタミン酸に変換されます。グルタミン酸はα-ケトグルタル酸と平衡状態にあり、脳に入るほぼすべてのグルコースがグルタミン酸を介して循環します。神経伝達に特化したグルタミン酸の部分(約20パーセント)は、**小胞グルタミン酸トランスポーター(vGluT)**によって貯蔵小胞に能動的に隔離されます。
2番目の代謝経路は、シナプスグルタミン酸を補充するために特に重要です。この経路は、グルタミン酸作動性シナプス(すなわち、シナプスボタンとシナプス後スパイン)と、シナプスを包むアストロサイトの末端脚との密接な関係を利用しています。グルタミン酸をシナプスから除去し、その作用を終結させる興奮性アミノ酸トランスポーター(EAAT1および2)を発現しているのは、グルタミン酸神経終末ではなくアストロサイトです。アストロサイト内で、細胞質性アデノシン三リン酸(ATP)依存性酵素であるグルタミン合成酵素が、グルタミン酸からグルタミンへの変換を触媒します。グルタミン合成酵素はグリア細胞で発現しますが、ニューロンでは発現しません。その後、グルタミンはアストロサイトから放出され、グルタミン酸作動性終末に取り込まれ、そこでミトコンドリア酵素であるリン酸活性化グルタミナーゼによってグルタミン酸に変換されます。このプロセスは「グルタミンサイクル」として知られており、脳内のグルタミン酸回転の約40パーセントを占めます。
脳における主要なグルタミン酸作動性経路
すべての主要な感覚求心性システムは、網膜神経節細胞、蝸牛細胞、三叉神経、脊髄求心性神経など、グルタミン酸を主要な神経伝達物質として使用します。求心性情報を皮質に広範囲に分布させる視床皮質投射はグルタミン酸作動性です。皮質からの内在性、連合性、および遠心性の興奮性投射の主要な源である皮質辺縁系領域の錐体ニューロンはグルタミン酸作動性です。新しい記憶の発達に重要な役割を果たす側頭葉回路は、一連の4つのグルタミン酸作動性シナプスです。穿通路は海馬顆粒細胞に神経支配し、それがCA3錐体細胞に神経支配し、それがCA1錐体細胞に神経支配します。小脳皮質に神経支配する登上線維は、皮質脊髄路と同様にグルタミン酸作動性です。
イオンチャネル型グルタミン酸受容体
立体構造が制限されたグルタミン酸の選択的活性化または合成アナログに基づいて、3つのイオンチャネル型グルタミン酸受容体ファミリーが同定されています。これらには、α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸(AMPA)受容体、**カイニン酸(KA)受容体、およびN-メチル-D-アスパラギン酸(NMDA)**受容体が含まれます(図1.6-1)。その後のクローニングにより、機能的な受容体に集合するサブユニットをコードする16個の哺乳類遺伝子が明らかになりました。グルタミン酸ゲート型イオンチャネル受容体は四量体であり、サブユニット組成は受容体の薬理学的および生物物理学的特性の両方に影響を与えます。
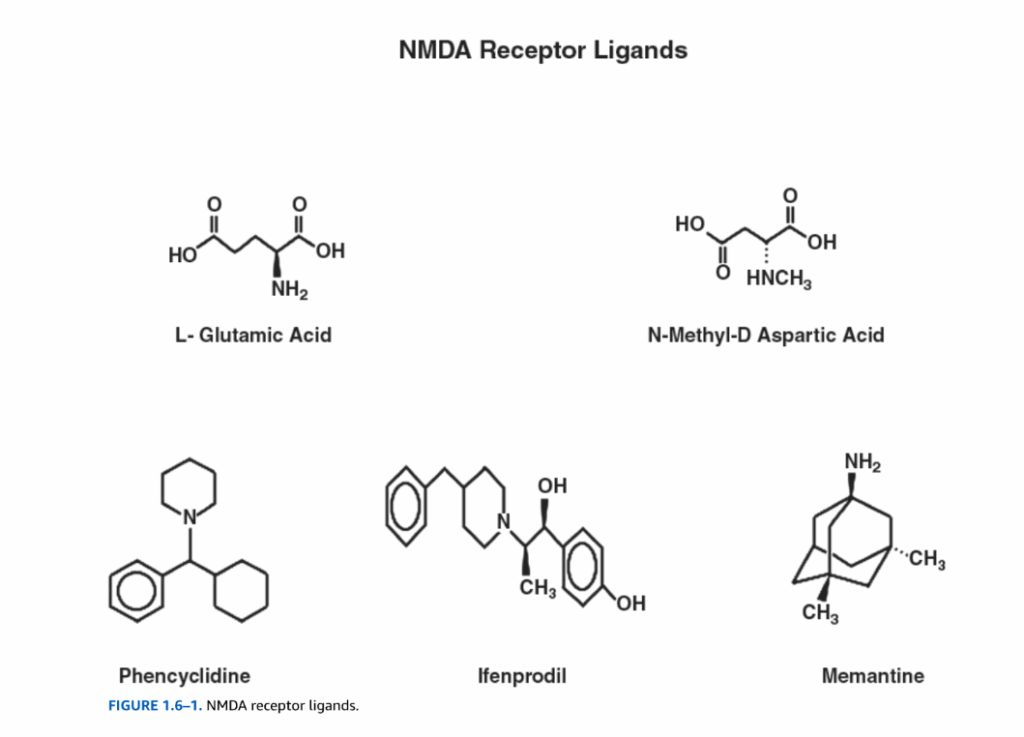
AMPA受容体(AMPAR)は、主に興奮性神経伝達を担う興奮性(脱分極性)シナプス後電流(EPSC)を媒介し、CNSに広く分布しています(図1.6-2)。AMPARファミリーは、GluR1からGluR4の4つのサブユニットから構成されます。しかし、追加の複雑さがAMPARの機能に影響を与えます。GluR1からGluR4のメッセンジャーリボ核酸(mRNA)の115 bpカセットの選択的スプライシングにより、脱感作速度と脳内の局所分布が異なる2つの形態(フリップとフロップ)が生じます。第2の膜貫通ドメインにおいて、GluR1、3、および4は高いCa²⁺コンダクタンスをもたらすグルタミン(Q)残基を有しますが、GluR2はこの位置にアルギニン(R)を有し、Ca²⁺の通過を厳しく制限し、Na⁺のみを伝導します。アデノシンデアミナーゼによるmRNA編集は、Q/R編集として知られるプロセスによって、GluR2のコドンをアルギニンからグルタミンに変換します。これにより、編集されたGluR2サブユニットを含むAMPARのCa²⁺に対するチャネル透過性が劇的に増加します。カイニン酸受容体サブユニットGluR5および6についても、同様のmRNA編集メカニズムが記述されています。
カイニン酸受容体ファミリーは5つのサブユニットから構成されます。GluR5からGluR7は、グルタミン酸ゲート型陽イオンチャネルを形成するサブユニットを表します。KA1およびKA2は無視できるチャネル活性しか示しませんが、GluR5からGluR7と結合して高親和性カイニン酸受容体を形成します。カイニン酸受容体の役割はAMPARほど明確に定義されていませんが、グルタミン酸作動性終末におけるシナプス前局在により、カイニン酸受容体は活性化されるとグルタミン酸作動性神経伝達を減少させます。特筆すべきは、カイニン酸受容体もGCPRとして機能しうる点です。
7つの遺伝子がNMDA受容体ファミリーを構成するサブユニットをコードしています。NMDA受容体にはいくつかのユニークな特徴があります(図1.6-3)。まず、チャネルは静止膜電位でマグネシウム(Mg²⁺)によってブロックされます。したがって、NMDA受容体は、AMPARの活性化がMg²⁺遮断を解除するのに十分なほどニューロン膜を脱分極させるまで「サイレント」です。NMDA受容体は、チャネルが開くために、異なる2つのサブユニット上の別々の認識部位に同時に2つのリガンドが結合することを必要とします。チャネルを形成するNR1サブユニットには、グリシンおよびD-セリンが内因性リガンドであるグリシン調節部位(GMS)と呼ばれる結合部位があります。神経伝達物質グルタミン酸の結合部位は、2番目の非チャネルサブユニット(NR2A-D)に位置しています。前脳では、D-セリンが優勢な共アゴニストであり、シナプス後ニューロンのシナプススパインで合成され、シナプスで放出され、そこでオートクリン因子として、シナプスNMDA受容体がシナプスグルタミン酸に直ちに反応するように準備させます。NMDA受容体は、チャネルが開くために3つの事象が同時に起こらなければならないため、「偶然の一致検出器」として記述されています。したがって、NMDA受容体は、受容体を飽和させるのに十分な量のシナプス前グルタミン酸が放出され、D-セリン(またはグリシン)がGMSを占有し、シナプス膜がMg²⁺遮断を解除するのに十分なほどAMPAR活性化によって脱分極された場合にのみ機能します。通常、これが発生するには、複数の収束するグルタミン酸作電性求心性神経が同時に発火する必要があります。
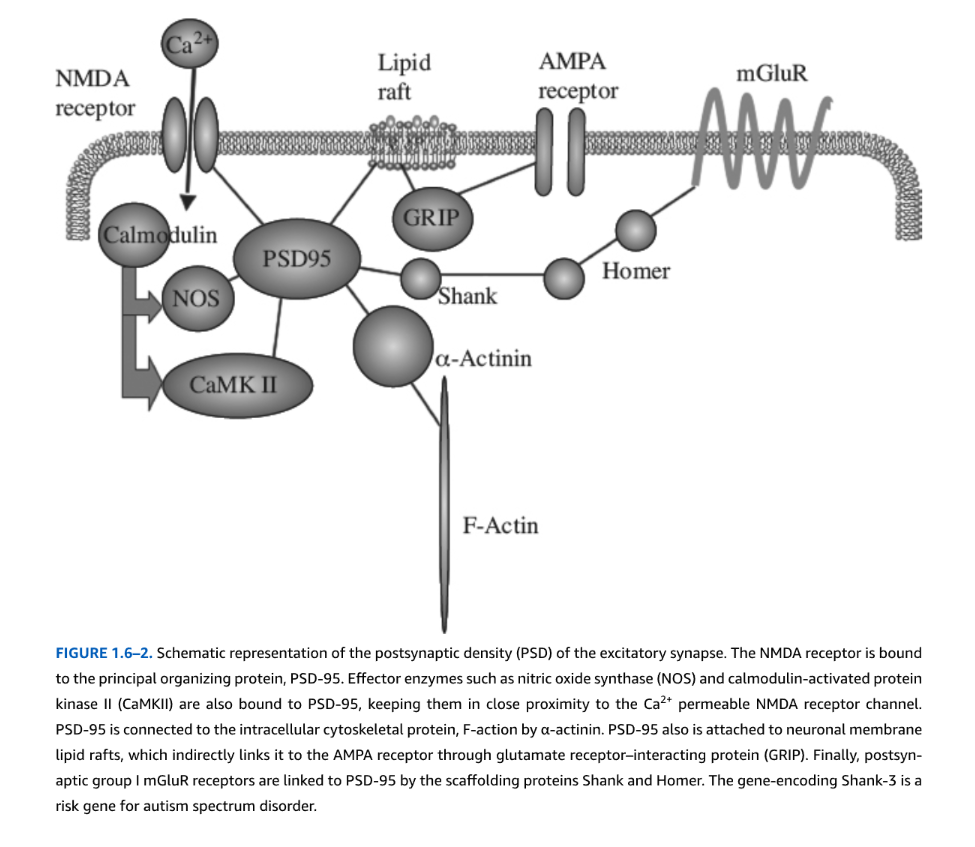
図1.6-2. 興奮性シナプスのシナプス後密度(PSD)の模式図。
NMDA受容体は、主要な組織化タンパク質であるPSD-95に結合しています。一酸化窒素合成酵素(NOS)やカルモジュリン活性化プロテインキナーゼII(CaMKII)などのエフェクター酵素もPSD-95に結合しており、Ca²⁺透過性NMDA受容体チャネルに近接して維持されています。PSD-95は、α-アクチニンによって細胞内細胞骨格タンパク質F-アクチンに接続されています。PSD-95はまた、ニューロン膜脂質ラフトにも結合しており、グルタミン酸受容体相互作用タンパク質(GRIP)を介してAMPARに間接的にリンクしています。最後に、シナプス後グループI mGluR受容体は、足場タンパク質ShankおよびHomerによってPSD-95にリンクしています。Shank-3をコードする遺伝子は、自閉症スペクトラム障害のリスク遺伝子です。
NMDA受容体チャネルはCa²⁺が容易に通過できるほど十分に大きいです。細胞内で、Ca²⁺は最終的にニューロンの遺伝子発現に影響を与えるいくつかのキナーゼを活性化します。例えば、即時初期遺伝子c-Fosは、NMDA受容体活性化の感受性代替指標です。NR2サブユニットのタイプは、NMDA受容体の薬理学的および生物物理学的特性に影響を与えます。例えば、NR2B含有受容体は、NR2A含有受容体よりもはるかにCa²⁺透過性です。NR2A含有受容体は、成熟脳の皮質辺縁系領域で主に発現します。NR2Bは未成熟皮質で高レベルで発現し、成熟とともに減少します。NR2Cは主に小脳で発現し、NR2Dは主に小脳、中脳、脳幹に局在しています。
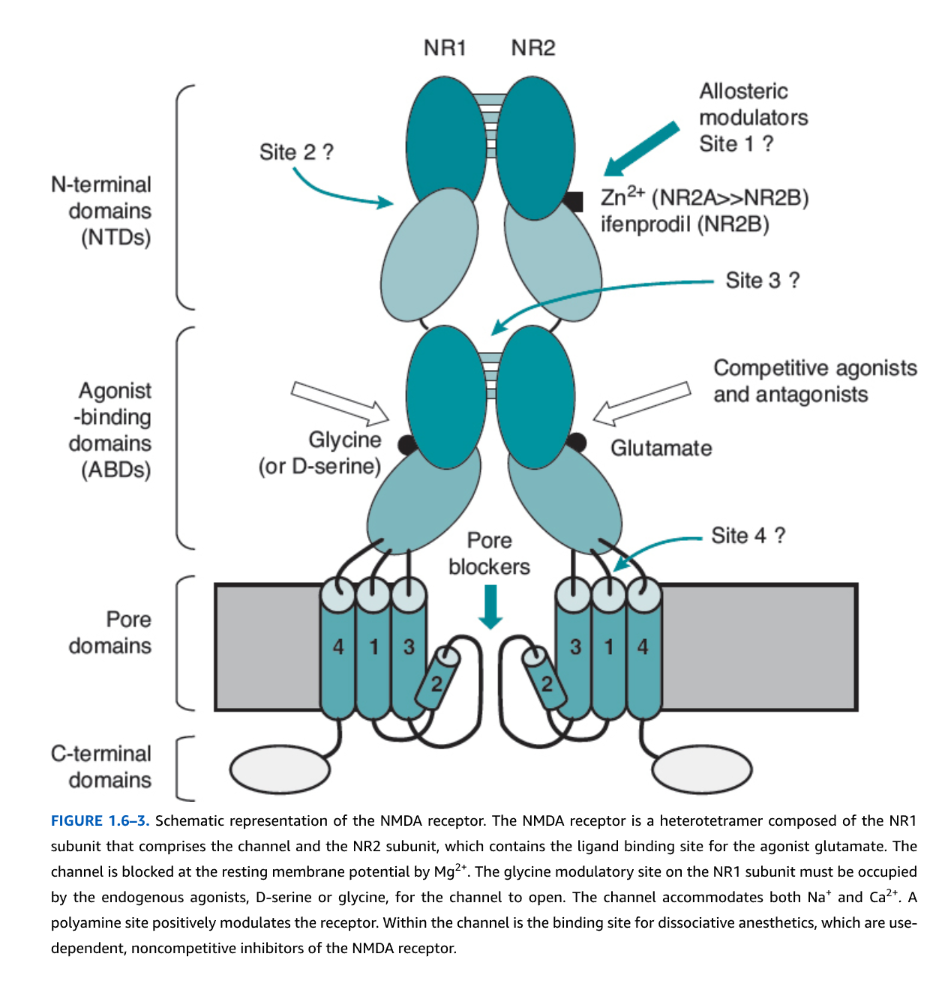
図1.6-3. NMDA受容体の概略図
NMDA受容体は、チャネルを構成するNR1サブユニットと、アゴニストであるグルタミン酸の結合部位を含むNR2サブユニットからなるヘテロ四量体です。このチャネルは、静止膜電位でMg2+によってブロックされます。チャネルが開くためには、NR1サブユニット上のグリシン調節部位に、内因性アゴニストであるD-セリンまたはグリシンが結合している必要があります。このチャネルは、Na+とCa2+の両方を通します。ポリアミン結合部位は受容体を正に調節します。チャネル内部には、NMDA受容体の使用依存性非競合的阻害剤である解離性麻酔薬の結合部位があります。
学習や興奮毒性(後述)においてNMDA受容体が重要な役割を果たすことを考えると、NMDA受容体が最も厳密に制御されている神経伝達物質受容体の一つであることは驚くことではありません。前述のように、NMDA受容体が機能するには、2つの異なるリガンドがNMDA受容体の2つの異なるサブユニットに結合する必要があります。さらに、イオン流を阻害するZn2+とH+の結合部位もあります。ポリアミン結合部位はチャネルの開口を促進します。さらに、チャネルは酸化還元状態に敏感であり、これもイオン電流に影響を与えます。サブユニットの組成は、モジュレーターに対する応答に影響を与えます。例えば、NR2AサブユニットはZn2+による阻害に非常に敏感であるのに対し、NR2Bサブユニットはポリアミン部位拮抗薬であるイフェンプロジルに対して選択的に高い感受性を示します。NMDA受容体を介したCa2+の流入はカルモジュリンを活性化し、カルモジュリンはNR1のC末端に結合してチャネル開口頻度と持続時間を減少させます。
代謝型グルタミン酸受容体
mGluRは、その作用がGタンパク質によって媒介され、カチオンの流入によってではないため、そのように名付けられています。全てのmGluRはグルタミン酸によって活性化されますが、その感受性は著しく異なります。現在までに8種類のmGluRがクローン化されています。これらの遺伝子は、GPCRスーパーファミリーに属する7つの膜貫通タンパク質をコードしています。これらは、アミノ酸配列の相同性、アゴニスト薬理学、および利用されるシグナル伝達経路に基づいて、3つのクラスに分類されます。グループI mGluR(mGluR1とmGluR5を含む)は、おそらくGoを介してPLCを活性化します。グループIIはmGluR2とmGluR3を含みます。グループIIIはmGluR4、mGluR6、mGluR7、mGluR8を含みます。グループIIとIIIのmGluRは、Gタンパク質を介してアデニル酸シクラーゼを阻害します。豊富な神経ペプチドであるN-アセチルアスパラチルグルタミン酸は、mGluR3の特異的アゴニストです。
シナプス後に位置するmGluRは、いくつかのチャネルと受容体を調節します。3つのグループ全てがL型電位依存性カルシウムチャネルを阻害し、グループIとIIはN型カルシウムチャネルを阻害します。さらに、mGluRは電位依存性K+チャネルを閉鎖し、それによって脱分極を遅らせ、興奮性を減少させることが報告されています。GABA作動性およびグルタミン酸作動性の両方の神経終末にあるシナプス前のmGluRは、おそらくP/Q型カルシウムチャネルを阻害することによって、神経伝達物質の放出を抑制します。
シナプス後肥厚
シナプス後肥厚(PSD)におけるグルタミン酸受容体の組織と動態の特性評価において、かなりの進展がありました。PSDは、足場タンパク質、細胞接着分子、および細胞間シグナル伝達経路のタンパク質を含む好浸透性多タンパク質複合体です。主要な足場タンパク質はPSD-95(分子量95 kDaのシナプス後肥厚タンパク質の頭字語)です。PSD-95は他のタンパク質と結合するいくつかの領域を含みます。3つのPDZドメイン(PSD-95/disc large/zona occludens-1の頭字語)があります。PDZドメインは、相補的なアミノ酸配列を持つタンパク質のC末端に結合する約90個のアミノ酸を含んでいます。ニューロリギンはPDZに結合し、シナプス間隙に伸びて、シナプスのシナプス前成分に固定されているβ-ニューレキシンに結合します。この配置は、シナプス前とシナプス後の成分を連結することによってシナプスを安定化させます。PSD-95の2つのN末端システインはパルミチン酸に結合し、タンパク質を細胞膜の脂質ラフトに結合させます。NMDA受容体のNR2サブユニットはPDZドメインに結合します。PSD-95はまた、樹状突起スパインの細胞骨格複合体の重要な成分であるフィラメント状アクチンに結合しているα-アクチンにも結合します。
NMDA受容体とは対照的に、AMPA受容体はPSD-95に直接結合しませんが、PSD-95に結合する中間タンパク質を介して間接的に結合します。これらには、グルタミン酸受容体相互作用タンパク質(GRIP)、Cキナーゼ1相互作用タンパク質(PICK1)、および97 kDaのシナプス関連タンパク質(SAP-97)が含まれます。さらに、AMPA受容体をPSDへ輸送し、その中に組み込むことに関与する膜貫通型AMPA受容体調節タンパク質(TARPs)があります。成熟したシナプスにおけるNMDA受容体の数は比較的一定である傾向がありますが、PSDにおけるAMPA受容体の数は大きく変動します。実際、AMPA受容体を含まずNMDA受容体のみを含むPSDもあります。これらは「サイレントシナプス」と呼ばれます。なぜなら、NMDA受容体はいくつかの例外を除いて静止膜電位で不活性化されているため、グルタミン酸は興奮作用を持たないからです。mGluR7を除いて、シナプス後のmGluRは、ホーマーとシャンクという2つの足場タンパク質に結合することによってPSDの周辺に繋がれています。シャンクはPSD-95に結合します。注目すべきは、ニューレキシン、ニューロリギン、シャンクを含むPSDを構成する遺伝子コードタンパク質の対立遺伝子バリアントが自閉症に関与していることです。
アストロサイトの役割
アストロサイトの特殊な末端足はグルタミン酸作動性シナプスを取り囲んでいます。アストロサイトは、シナプスからグルタミン酸を除去し、その作用を終結させる主要な役割を果たす2つのNa+依存性グルタミン酸トランスポーターを発現しています。それはEAAT1とEAAT2(興奮性アミノ酸トランスポーター1および2)です。神経細胞のグルタミン酸トランスポーターであるEAAT3は上位運動ニューロンで発現し、EAAT4は主に小脳のプルキンエ細胞で発現し、EAAT5は網膜に限定されています。EAAT1またはEAAT2のどちらかのヌル変異についてホモ接合性のマウスは、細胞外グルタミン酸の上昇と興奮毒性神経変性を示します。特に、いくつかの研究では、筋萎縮性側索硬化症(ALS)の腹側角におけるEAAT2タンパク質と輸送活性の喪失が報告されています。
アストロサイトはAMPA受容体を発現しているため、シナプスにおけるグルタミン酸放出を監視できます。細胞外空間におけるグリシン濃度を準飽和状態に保つGlyT1は、アストロサイトの形質膜上に発現しています。GlyT1は、アストロサイトに輸送されるグリシン1分子あたり3つのNa+を細胞外に輸送します。この化学量論は、シナプスで放出されたグルタミン酸がアストロサイト上のAMPA受容体を活性化し、アストロサイトを脱分極させる際に、輸送方向が強力に逆転する結果をもたらします。GlyT1によるシナプスでのグリシン放出は、グルタミン酸作動性神経伝達と協調しています。
主に前脳で見られるD-セリンは、主に錐体細胞、そしてより少ない程度でGABA作動性ニューロンで発現する**セリンラセマーゼ(SR)**によって合成されます。D-セリンのレベルは、**D-アミノ酸酸化酵素(DAAO)**によっても決定され、DAAOの発現が高い小脳や脳幹ではD-セリンレベルが低く、DAAOの発現が非常に低い皮質辺縁系脳領域ではD-セリンレベルが高いことが分かっています。対照的に、GlyT1の発現は小脳と脳幹で最も高いです。この分布は、D-セリンが前脳におけるNMDA受容体の主要な共アゴニストであり、グリシンは脳幹と小脳でより顕著であることを示唆しています。それにもかかわらず、GlyT1阻害剤は実験動物において認知促進効果を示しており、統合失調症における認知機能障害および陰性症状の治療のために臨床試験が行われています。
可塑性とグルタミン酸作動性神経伝達
ヘブは、学習と記憶がシナプス有効性の使用依存的変化に関与していると提唱しました。神経生理学的研究では、もともと海馬CA1錐体細胞上の同定可能なグルタミン酸作動性シャッファー側枝シナプスを利用して、シャッファー側枝への短期間の強い刺激(100 Hz)が、これらのシナプスにおけるシナプス神経伝達の有効性のその後の持続的な増加をもたらすことを示しました。この現象は長期増強(LTP)として知られており、グルタミン酸作動性シナプスにおいて非常に広範囲にわたります。対照的に、グルタミン酸作動性軸索への安定した低頻度刺激は、シナプス神経伝達の有効性の持続的な減少をもたらし、これは長期抑圧(LTD)として知られている現象です。これらの海馬の研究におけるLTPは、解離性麻酔薬であるケタミンや**フェンシクリジン(PCP)などのNMDA受容体拮抗薬によってブロックされるという事実によって示されるように、NMDA受容体の活性化を必要とします。海馬におけるLTPのブロックをもたらす条件は、新しい記憶の獲得の障害と関連しています。これらの可塑性変化の性質は、活発な研究の焦点となっています。LTPとLTDにおけるシナプス有効性の持続的な変化は、影響を受けるシナプスのPSDからのAMPA受容体の挿入(LTP)または除去(LTD)**に起因します。したがって、NMDA受容体とは対照的に、AMPA受容体は非常に動的であり、そのシナプス機能はシナプス内外へのトラフィックによって制御されています。
条件付け恐怖の消去もまた、扁桃体におけるNMDA受容体の活性化によって媒介される活動的なプロセスであることが示されています。NMDA受容体拮抗薬によるラットの治療は条件付け恐怖の消去を妨げますが、部分アゴニストであるD-シクロセリンによる治療は条件付け恐怖の消去を促進します。(D-シクロセリンは、結核の治療に使用される抗生物質であり、NMDA受容体の部分アゴニストでグリシンの50%の有効性を持つ。)この現象がヒトにも当てはまるかを判断するために、高所恐怖症患者にプラセボまたは単回用量のD-シクロセリンを認知行動療法(CBT)と併用して投与しました。D-シクロセリンとCBTの併用は、プラセボとCBTの併用と比較して、高所恐怖症症状の非常に有意な減少をもたらし、それが少なくとも3ヶ月間持続しました。他のプラセボ対照臨床試験も、D-シクロセリンがCBTを強力に強化するという考えを支持しており、薬理学的に神経可塑性を増強することが心理的介入を補強するために使用できることを示唆しています。D-シクロセリンは統合失調症患者の認知機能改善を促進する可能性がありますが、この証拠は予備的なデータに限定されています。
グルタミン酸が媒介するシナプス可塑性は機能的であるだけでなく、構造的でもあります。樹状突起スパインは動的な付属器官です。このような動態は、緑色蛍光タンパク質をコードするクラゲの遺伝子をマウスゲノムに挿入し、グルタミン酸作動性ニューロンのみが蛍光を発するようにしたマウスの脳において、in vitroおよびin vivoでリアルタイムで巧みに示されています。共焦点顕微鏡を用いて、研究者たちは、NMDA受容体の持続的な活性化が、スパインを長く細いものから太くずんぐりしたものへと成熟させ、さらには新しいスパインの生成をもたらすことをリアルタイムで示すことができました。この変換は、活性化されたNMDA受容体を介したカルシウムの流入によって部分的に媒介されます。シナプススパインにおけるこのような急速な構造変化は、タンパク質合成(すなわち翻訳)が個々の樹状突起スパイン内で起こることが最近実証されたという事実を反映しています。
脆弱X症候群の患者で欠損している**脆弱X精神遅滞タンパク質(FMRP)**は、NMDA受容体活性化時にスパイン内で局所的に合成され、特定のmRNAを翻訳のために樹状突起スパインへ輸送する役割も果たします。特に、FMRP遺伝子をヌル変異によって不活性化したマウスや、脆弱X症候群の患者は、樹状突起スパインの数が少なく、そのほとんどが未熟な形態をしています。FMRPの欠損は、樹状突起のタンパク質合成を刺激するmGluR5の応答を誇張します。mGluR5拮抗薬による治療は、FMRP遺伝子が不活性化されたマウスにおいて脆弱X症候群様表現型を逆転させましたが、この戦略は臨床試験では失敗しました。すが、この戦略は臨床試験では失敗しました。
興奮毒性
1970年代初頭、未成熟な動物に大量のグルタミン酸ナトリウムを経口投与すると、視床下部の弓状核など、血液脳関門(BBB)が未発達な脳領域の神経細胞が変性することが示されました。その後の研究では、カイニン酸(KA)、イボテン酸、NMDAなどのイオンチャネル型グルタミン酸受容体アゴニストを直接注射すると、注射部位に近い細胞体を持つ神経細胞に影響を与え、遠隔の神経細胞から伸びる軸索やグリア細胞には影響しない神経変性パターンが引き起こされることが示されました。AMPA/カイニン酸受容体およびNMDA受容体の持続的かつ圧倒的な活性化は、Na+とCa2+の膨大な流入、そしてそれに続くH2Oの流入を引き起こします。結果として生じる急性細胞浮腫は壊死性細胞死を引き起こします。注射部位からより離れた場所では、細胞内Ca2+の持続的な上昇がミトコンドリアを破壊し、シトクロムCを放出してカスパーゼを活性化させ、**プログラム細胞死(アポトーシス)**をもたらします。
虚血性脳卒中後に発生する神経細胞変性は、興奮毒性の結果です。虚血による局所的な低酸素はATP産生の中止を引き起こし、神経細胞およびアストログリア細胞膜におけるATP駆動型ナトリウム勾配の崩壊をもたらします。その結果、ナトリウム依存性グルタミン酸トランスポーターの方向が逆転し、大量のグルタミン酸放出を引き起こします。イオンチャネル型グルタミン酸受容体またはその過剰刺激によって引き起こされる下流の事象をブロックするいくつかの薬剤は、脳卒中の動物モデルにおける神経損傷の量を減少させるのに効果的であることが証明されていますが、臨床試験ではまだそのような薬剤は効果的であるとは証明されていません。
興奮毒性は、アルツハイマー病における神経細胞変性の直接的な原因としても関与しています。ほとんどの証拠は、β-アミロイド、特にβ-アミロイド1-42の凝集体の毒性作用を指摘しています。β-アミロイド線維は神経細胞を脱分極させ、Mg2+ブロックの消失とグルタミン酸に対するNMDA受容体感受性の増強をもたらします。これらの線維はまた、アストロサイトへのグルタミン酸輸送を障害し、それによって細胞外グルタミン酸濃度を増加させます。β-アミロイドは、炎症を介して酸化的ストレスを直接促進し、それがグルタミン酸に対する神経細胞の脆弱性をさらに高めます。最後に、炎症性(「反応性」)アストロサイトの増殖は、必須のNMDAR共アゴニストであるD-セリンを放出することによって興奮毒性をさらに促進し、神経細胞を上昇した細胞外グルタミン酸に対して脆弱にします。したがって、アルツハイマー病においては、いくつかのメカニズムがNMDA受容体媒介性興奮毒性に対する神経細胞の脆弱性に寄与しています。軽度から中等度のアルツハイマー病に対するFDA承認治療薬である**メマンチン(ナメンダ)**は、NMDA受容体の弱い非競合的阻害剤です。これは、NMDA受容体の興奮毒性に対する緊張性感受性を低下させますが、「相性」神経伝達を妨げないため、アルツハイマー病における神経細胞変性を軽減します。
抑制性アミノ酸:GABA
GABAは脳の主要な抑制性神経伝達物質であり、脳全体に広く分布し、ミリモル濃度で存在します。その生理学的効果と分布を考えると、GABA作動性神経伝達の機能不全が、不安障害、統合失調症、アルコール依存症、てんかんなどの広範な神経精神疾患に関与していることは驚くべきことではありません。化学的には、GABAは主要な興奮性神経伝達物質であるグルタミン酸からカルボキシル基が1つ除去されただけのもので、単純に異なります。
GABAは、GADによってグルタミン酸から合成され、GADはα-カルボキシル基の除去を触媒します。中枢神経系では、GADの発現はGABA作動性ニューロンに限定されているようですが、末梢では膵臓の島細胞で発現しています。GADをコードする遺伝子には、2つの異なるが関連する遺伝子があります。GAD65は神経終末に局在し、そこでシナプス小胞に濃縮されるGABAの合成を担っています。速い抑制性神経伝達におけるその役割と一致して、GAD65のヌル変異についてホモ接合性のマウスは発作のリスクが上昇します。GAD67は神経細胞のGABAの主要な供給源であると考えられており、GAD67のヌル変異についてホモ接合性のマウスは出生時に死亡し、口蓋裂を有し、脳のGABAに大きな減少を示します。
GABAはGABAトランスアミナーゼ(GABA-T)によって異化され、コハク酸セミアルデヒドを生成します。トランスアミノ化は、通常、親化合物であるα-ケトグルタル酸がアミノ基を受け取るために存在し、それによってグルタミン酸を再生するときに起こります。コハク酸セミアルデヒドは、コハク酸セミアルデヒド脱水素酵素(SSADH)によってコハク酸に酸化され、クエン酸回路に再入します。GABA-Tは、細胞表面の膜結合酵素であり、細胞外区画に面しており、神経細胞とグリア細胞の両方で発現しています。予想されるように、GABAの異化を阻害する薬剤は抗けいれん作用を持ちます。**バルプロ酸(VPA)**の作用機序の一つは、GABA-Tの競合的阻害です。γ-ビニルGABAはGABA-Tの自殺基質阻害剤であり、ヨーロッパでは抗けいれん薬として使用されていますが、網膜のGABA作動性神経伝達を増強することによって視覚を障害する可能性があります(ビガバトリン; サブリル)。
GABAのシナプス作用は、シナプス前終末およびアストロサイトへの高親和性輸送によっても終結します。異なる動態的および薬理学的特性を持つ4つの遺伝学的に異なるGABA高親和性トランスポーターが同定されています。これらは全て、12の膜貫通ドメインという特徴を持つ他の神経伝達物質トランスポーターと相同性を共有しています。能動輸送はナトリウム勾配によって駆動されるため、脱分極時には神経細胞からのGABAの輸送が促進されます。アストロサイトに輸送されたGABAはGABA-Tによって異化され、最終的にグルタミン酸、次にグルタミンに変換され、GABA合成のためにシナプス前終末に輸送し戻されます。**チアガビン(ガビトリル)**は、てんかんの治療に使用される強力なGABA輸送阻害剤です。
GABA作動性システムの解剖学
脳の皮質辺縁系領域では、GABAは内在性(すなわち、局所回路)ニューロンに局在しています。大脳皮質の柱状構造では、GABA作動性ニューロンは、柱の外縁に内向きの軸索を提供します。GABA作動性介在ニューロンは皮質ニューロンの少数(15〜25パーセント)を構成しますが、グルタミン酸作動性錐体細胞の活動を深く抑制します。抑制の著しい有効性は、GABA作動性シナプスの2つの神経解剖学的特徴を反映しています。それらはグルタミン酸作動性脱分極を打ち消すためにシナプススパインの軸に集中し、活動電位の生成を制限するために神経細胞体および近位軸索に集中しています。大脳皮質では、GABA作動性介在ニューロンは神経ペプチドの共局在の主要な部位です。これらには、コレシストキニン(CCK)、ダイノルフィン、ニューロペプチドY(NPY)、ソマトスタチン、サブスタンスP、および**血管作動性腸管ペプチド(VIP)**が含まれます。
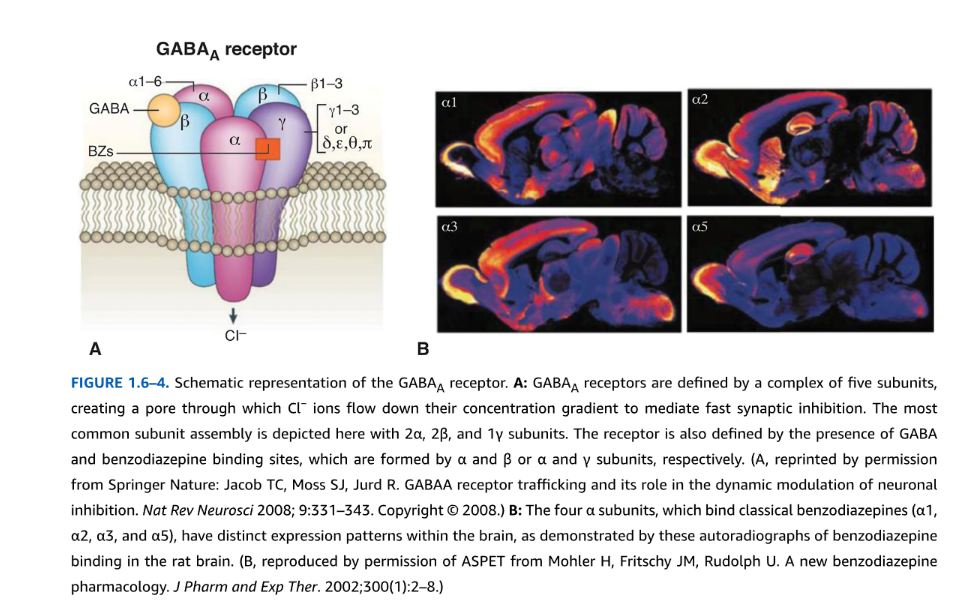
図1.6-4. GABAA受容体の概略図
A: GABAA受容体は、5つのサブユニットからなる複合体によって定義され、Cl-イオンがその濃度勾配に従って流れ込み、高速なシナプス抑制を媒介する孔を形成します。最も一般的なサブユニット構成は、2つのα、2つのβ、および1つのγサブユニットで示されています。この受容体は、それぞれαとβまたはαとγサブユニットによって形成されるGABA結合部位とベンゾジアゼピン結合部位の存在によっても定義されます。(AはSpringer Natureの許可を得て転載:Jacob TC, Moss SJ, Jurd R. GABAA receptor trafficking and its role in the dynamic modulation of neuronal inhibition. Nat Rev Neurosci 2008; 9:331-343. Copyright @ 2008.)
B: 古典的なベンゾジアゼピンが結合する4つのαサブユニット(α1、α2、α3、α5)は、ラット脳におけるベンゾジアゼピン結合のこれらのオートラジオグラフで示されるように、脳内で異なる発現パターンを持ちます。(BはASPETの許可を得て複製:Mohler H, Fritschy JM, Rudolph U. A new benzodiazepine pharmacology. J Pharm and Exp Ther. 2002;300(1):2-8.)
線条体では、GABA作動性ニューロンが黒質網様部に直接投射し、ドーパミン作動性ニューロンの活動を調節します。加えて、淡蒼球に投射する線条体GABA作動性ニューロンがあり、淡蒼球-視床下核GABA作動性ニューロンとシナプスを形成し、視床下核からの興奮性出力を調節するほか、黒質/腹側被蓋野から線条体への相互のGABA作動性投射もあります。小脳では、GABA作動性プルキンエ細胞がその主要な遠心性システムです。
GABAA受容体
GABAA受容体は脳全体に分布しています。GABAA受容体複合体は、活性化されると、静止膜電位である-70mVに近い平衡電位を持つ膜コンダクタンスの増加を媒介します(図1.6-4)。成熟したニューロンでは、これは通常Cl-の流入をもたらし、膜の過分極を引き起こします。過分極は、活動電位を生成する閾値を増加させるため、抑制的です。細胞内Cl-濃度が異常に高い未成熟ニューロンでは、GABAA受容体を活性化すると、逆説的に脱分極を引き起こすことがあります。このため、GABAA受容体活性を増強することによって作用する抗けいれん薬は、新生児期には発作を悪化させる可能性があります。
GABAA受容体サブユニットは、ニコチン性アセチルコリン受容体やグリシン受容体を含む、より大きなリガンド依存性チャネルファミリーと配列相同性を示します。少なくとも19種類の異なるが密接に関連する遺伝子が、GABAA受容体サブユニットをコードしていることが特定されています。各サブユニットには4つのαヘリックス膜貫通ドメインが含まれており、その配列はサブユニット間で高度に保存されています。受容体複合体はヘテロ五量体です。リガンド結合部位は、α-サブユニットとβ-サブユニットの間の界面で形成されます。サブユニット組成は、受容体の生物物理学的および薬理学的特性に影響を与えます。異なるサブユニットを含むGABAA受容体複合体は、発生の異なる段階や脳の異なる領域で発現します。
GABAA受容体の薬理学は特に豊富です。幻覚性キノコであるベニテングタケの抽出物成分であるムッシモールは、GABAA受容体の直接アゴニストです。典型的なGABAA拮抗薬はビククリンであり、チャネル開口の頻度と持続時間を減少させることによって作用し、促けいれん効果を持ちます。もう一つの促けいれん薬であるピクロトキシンは、塩化物チャネルをブロックすることによって作用します。
NMDA受容体を想起させるように、GABAA受容体複合体は複数のアロステリックモジュレーターとの相互作用が注目されます。これらには、ベンゾジアゼピン、バルビツール酸塩、全身麻酔薬、エタノール、および神経ステロイドが含まれます。ベンゾジアゼピンはGABAA受容体複合体内の異なる部位に結合し、GABAに応答してチャネル開口頻度をアロステリックに増加させます。したがって、ベンゾジアゼピンは受容体を直接活性化するのではなく、シナプス放出されたGABAに対する相性応答を増強します。この間接的な作用機序とベンゾジアゼピン感受性受容体の局在が、バルビツール酸塩と比較してベンゾジアゼピンの呼吸抑制リスクが低い理由です。ベンゾジアゼピン結合部位は、他の調節性リガンドの結合部位とアロステリックに結合しており、エタノールなどとの毒性相互作用に寄与する可能性があります。注目すべきは、ベンゾジアゼピン受容体の拮抗薬および逆アゴニストが開発されており、不安誘発性および認知促進効果を示すことです。
フェノバルビタールやペントバルビタールなどのバルビツール酸塩は、その鎮静作用と抗けいれん作用で知られています。バルビツール酸塩は、薬理学的に関連する濃度で、GABAおよびベンゾジアゼピンの結合部位の親和性をアロステリックに増加させます。バルビツール酸塩はまた、長い開状態を著しく増加させ、短い開状態を減少させることによってチャネルダイナミクスに影響を与え、それによってCl-コンダクタンスと抑制を増加させます。GABAA受容体におけるこの直接的な作用機序が、過剰摂取時の致死的な呼吸抑制の原因です。
プロゲステロンとコルチコステロンの化学修飾されたアナログは、行動研究において、GABAA受容体複合体との相互作用を通じて鎮静作用と抗不安作用を持つことが示されています。これらはバルビツール酸塩と特徴を共有しますが、疎水性の神経ステロイドはGABAA受容体上の認識部位で細胞膜内に高濃度で蓄積します。これらはアゴニストの受容体への結合をアロステリックに増強し、Cl-チャネル開口の持続時間を増加させます。ステロイド投与または内因性ステロイドの変動に関連する様々な行動効果と、GABA作動性薬剤の性差特異的な効果は、内因性神経ステロイドの作用と関連付けられています。最近、FDAはブレキサノロン(アロプレグナノロン; Zulresso)を産後うつ病の女性の治療薬として承認しました。
GABAA受容体拮抗薬に関しては、ピクロトキシンはバルビツール酸塩と同様にチャネルダイナミクスを変化させますが、長い開状態を減少させ、最短の開状態を優先することによって逆方向に作用します。促けいれん薬であるペンテトラゾールもまた、Cl-チャネル透過性を減少させることによって作用します。高濃度で促けいれん薬となるペニシリンは、チャネル内の正電荷を持つ残基に結合し、それによってチャネルを閉塞させます。一般的なクラスとして、バルビツール酸塩、ステロイド、揮発性麻酔薬を含む麻酔薬は塩化物コンダクタンスを増加させ、それによって神経伝達を抑制します。GABAA受容体サブユニットの膜貫通ドメインにおけるアミノ酸は、麻酔薬に対する感受性を付与します。エタノールがGABAA受容体機能を増強する正確なメカニズムは、結果の不一致のために依然として不明であり、サブユニット組成が重要である可能性を示唆しています。しかし、最近の研究では、エタノールがδサブユニットを含み、GABAに対して非常に高い親和性を示す緊張性GABA活性化電流の応答を増加させることを示唆しています。
部位特異的突然変異誘発を利用した組換えDNA戦略は、ベンゾジアゼピンなどの薬物の薬理作用を媒介する特定のサブユニット上の部位の特定を可能にしました。ベンゾジアゼピンに対する結合能力を突然変異によって除去した結果、α1-サブユニットがベンゾジアゼピンの鎮静作用と健忘作用に主要な役割を果たし、α2-サブユニットが抗不安作用を与え、α3-サブユニットが恐怖の軽減に寄与し、α5-サブユニットが筋弛緩に寄与することが確立されました。鎮静剤であるゾルピデム(アンビエン)のように、ベンゾジアゼピンに対してサブユニット選択的な薬剤を開発することは、非特異的なベンゾジアゼピンに関連する非標的副作用を軽減します。
GABAB受容体
GABAB受容体は、GABAA受容体拮抗薬であるビククリンに非感受性であること、およびGABAA受容体では不活性であるバクロフェン(β-(4-クロロフェニル)-γ-アミノ酪酸; リオレサール)によって強力に活性化されるという点で、GABAA受容体とは薬理学的に区別されます。これらはGタンパク質共役型受容体スーパーファミリーのメンバーですが、2つの7回膜貫通型サブユニットの二量体で構成されている点で非常に珍しいです。GABAB受容体は神経系全体に広く分布しており、シナプス前とシナプス後の両方に局在しています。シナプス後のGABAB受容体は、カリウムチャネルを活性化することによって長期的な過分極を引き起こします。シナプス前のGABAB受容体は、自己受容体およびヘテロ受容体として作用し、神経伝達物質の放出を抑制します。
脊椎動物の脳における全てのGABAB受容体は、GABAB(1)とGABAB(2)遺伝子の単一の産物です(図1.6-5)。GABAB受容体間の薬理学的異質性は、スプライスバリアントに起因する異なるアイソフォームを反映しています。種間で保存されている最も一般的なバリアントはGABAB(1A)とGABAB(1B)です。これらは脳内で異なる領域分布を示し、例えば、GABAB(1A)転写産物は顆粒細胞層に限定されるのに対し、GABAB(1B)転写産物は主にプルキンエ細胞で発現します。全てのGABABアゴニストおよび競合拮抗薬は、GABAB(1)サブユニットの細胞外ドメインに結合します。GABAB(2)サブユニットも大きな細胞外ドメインを持ち、GABAB受容体のアロステリック調節部位である可能性があります。興味深いことに、GABAB(1)サブユニットのリガンド結合ポケットにはCa2+結合部位があり、GABAへの親和性を高めます。このCa2+結合部位は、生理学的濃度のCa2+で通常飽和しています。

