社会的逆境、環境からの脅威、そして免疫システム
かつてストレスは免疫抑制と結びつけられると考えられていましたが、過去数十年間の証拠は、この結論が哺乳類の免疫系の環境摂動に対する複雑さを過度に単純化していることを示唆しています。ストレスが免疫系の特定の側面、特に自然炎症反応を活性化させることは広く受け入れられています(図1.13-4参照)。今日の環境において、うつ病のリスクを高めるほとんどの要因は、末梢の炎症性バイオマーカーのレベルも上昇させ、感情的な幸福感を改善する多くの要因は、炎症を減少させることが分かっています。ストレス刺激が感染症、がん、自己免疫疾患などの免疫関連疾患の発症に影響を与えうることを示す一連の動物およびヒトの研究は、より広範な環境が免疫系に与える影響への関心を刺激しました。これらの発見は、末梢T細胞および単球系細胞の機能、特に心理社会的ストレスに応じたこれらの細胞の脳髄膜へのホーミングが、IL-4依存性メカニズムを介して海馬BDNF産生を促進するプロセスにおいて、げっ歯類の学習に必要であることを示しています。
ストレス(急性/軽度)
実験動物からのデータは、短期間または軽度のストレスが動物が新しい状況に適応するのに役立つ可能性があることを示唆しています。マウスモデルでは、抗原刺激に先行する短期間/軽度のストレスが免疫応答を増加させました。急性ストレスは、骨髄から血流への白血球の動員、病理部位への浸潤、および感染部位での増殖を促進することにより、白血球の活動を活性化させます。同様のNK細胞およびCD8細胞傷害性T細胞活性の変化がストレス中に観察されています。新しい研究によると、急性ストレスは制御性T細胞やその他のサプレッサーT細胞を減少させるようです。パラシュートジャンプ、算数問題解決、対立的な人間関係などの急性ストレスの後には、血中の活性化免疫細胞の増加が観察されています。しかし、急性ストレスによって引き起こされる免疫学的活性化は、ストレスの解消後速やかに減少します。注目すべきは、ストレスの免疫系への急性影響は交感神経活動の増加によって引き起こされますが、ストレス解消後の抑制は副交感神経活動の増加によって引き起こされることです。
重度/慢性ストレス
慢性ストレスは、炎症誘発性反応を増加させる能力があるにもかかわらず、免疫抑制効果と関連付けられてきました。慢性または重度のストレスは、健康リスクの増加と関連しており、しばしば炎症誘発性の変化を伴います。マウスモデルでは、慢性的な予期せぬストレス(捕食者ストレス、拘束ストレス)が炎症性細胞の動員とマクロファージの機能的活動を促進します。これらのストレス因子は、ATPなどのDAMPsの放出を増加させることによって作用し、それがインフラマソームを活性化してIL-1の放出につながります。
慢性ストレスの健康への影響
アレルギー: 慢性ストレスは、急性ストレスとは異なり、炎症誘発性のTh1と抗炎症性のTh2表現型の間のバランスをTh1が犠牲になる形で後者に傾かせます。したがって、動物およびヒトにおける急性/軽度ストレスは、Th2サイトカインIL-4を増加させることなく、Th1サイトカインIFN-ガンマのin vitro産生を増加させる可能性があります。対照的に、慢性/重度ストレス因子は、Th1細胞によるIFN-ガンマとIL-2を抑制する傾向がある一方で、Th2サイトカインIL-4とIL-10には影響を与えないか、または増加させます。このTh1からTh2へのシフトは、Th2反応が重要な役割を果たすアレルギー反応または過敏症反応への感受性を高める可能性もあります。ヒトにおける慢性ストレスは、NK細胞活性とマイトジェンに対するリンパ球増殖の減少、および内因性コルチゾールに対する単球感受性の減少につながります。さらに、介護者からのストレスや試験によるストレスは、体が病原体や免疫化に対する効果的な免疫を機能させたり発揮したりする能力を妨げます。
Th17細胞は、炎症誘発性サイトカイン(IL-6、IL-1、TNF)およびTh1細胞を標的組織に動員するケモカイン(単球走化性タンパク質[MCP]-1)を誘導することにより、自己免疫疾患(多発性硬化症)における組織炎症を調整します。機能性T制御性細胞が標的組織に蓄積しても、IL-6などの圧倒的な量の炎症誘発性サイトカインのために炎症期には効果がありません。これらのサイトカインは、エフェクターT細胞および細胞傷害性T細胞をTreg細胞の抑制効果から保護します。したがって、Treg細胞を増加させ、組織炎症を制御することが、組織炎症を制御し、自己免疫疾患を治療するための最も効果的な戦略を提供するかもしれません。
精神医学における免疫-CNS相互作用の病理および治療への関連性
大うつ病
長年にわたり、大うつ病はストレス関連疾患が免疫機能をどのように低下させるかの典型的な例と考えられてきました。しかし、より最近では、ストレスが獲得免疫の指標を抑制する一方で、炎症経路も活性化することが明らかになっています。したがって、慢性ストレス誘発性炎症活動はうつ病につながり、リンパ球増殖やNK細胞活性などのin vitro機能アッセイを抑制する可能性があります。それにもかかわらず、現代社会における健康への潜在的な悪影響にもかかわらず、抑うつ行動(それに伴う探索行動の減少を伴う)は、進化の過程でヒト科が直面した環境的課題を乗り越えるために、適応免疫を犠牲にして限られた代謝エネルギー貯蔵を自然免疫に再配備した適応的なものとして表れている可能性があります。図1.13-5は、抑うつ障害の病因において炎症性分子が標的とする主要な神経経路を示しています。
| Traditional (伝統的) | Modern (現代的) |
| Pathogens (病原体) | |
| – Alarm (警戒) | |
| – Avoidance (回避) | |
| ↓ Infectious mortality (感染性死亡率) | ↑ Infectious mortality (感染性死亡率) |
| ↓ Inflammatory conditions (炎症性疾患) | ↑ Inflammatory conditions (炎症性疾患) |
| ↑ Autoimmunity (自己免疫) | ↑ Autoimmunity (自己免疫) |
図 1.13-5.
脳内に入ると、炎症反応は代謝経路や分子経路に影響を及ぼし、神経伝達物質システムに作用することで、最終的に行動を調節する神経回路に影響を与える可能性があります。これは特に、うつ病を含むいくつかの神経精神疾患を特徴づける、モチベーションの低下(アンヘドニア)、回避、警戒(不安)といった行動に関連します。
分子レベルでは、I型およびII型インターフェロン(IFNs)、インターロイキン-1ベータ(IL-1β)、腫瘍壊死因子(TNF)などの炎症誘発性サイトカインは、以下のようなメカニズムでモノアミン(セロトニン(5-HT)、ドーパミン(DA)、ノルアドレナリン(NE))の利用能を低下させます。
- **有糸分裂促進因子活性化タンパク質キナーゼ(MAPK)**経路の活性化を介して、5-HT、DA、NEのシナプス前再取り込みポンプ(トランスポーター)の発現と機能を増加させる。
- サイトカイン誘発性の酸化ストレスに非常に敏感で、NO合成酵素(NOS)による一酸化窒素(NO)産生に関与するテトラヒドロビオプテリン(BH4)などの酵素補因子を減少させることで、モノアミン合成を低下させる。
IFN-ガンマ、IL-1ベータ、TNFを含む多くのサイトカインは、セロトニンの主要な前駆体であるトリプトファンをキヌレニンに分解する酵素インドールアミン2,3-ジオキシゲナーゼ(IDO)を活性化することで、関連するモノアミン前駆体を減少させることもあります。活性化したミクログリアはキヌレニンをキノリン酸(QUIN)に変換し、これがグルタミン酸(Glu)受容体であるN-メチル-D-アスパラギン酸受容体(NMDAR)に結合します。また、サイトカイン誘発によるアストロサイトのGlu再取り込みの減少や、反応性酸素種(ROS)および反応性窒素種(RNS)の誘導などにより、アストロサイトからのGlu放出が刺激されることも相まって、興奮性アミノ酸神経伝達物質である過剰なGluが生じる可能性があります。過剰なGlu、特にシナプス外NMDARに結合する場合、脳由来神経栄養因子(BDNF)の減少や興奮毒性を引き起こす可能性があります。
海馬歯状回におけるBDNFなどの成長因子に対する炎症の影響は、神経新生、長期増強、樹状突起の伸長といった神経整合性の基本的側面にも影響を与え、最終的に学習と記憶に影響を及ぼします。サイトカインが神経伝達物質システム、特にDAに与える影響は、大脳基底核、腹内側前頭前野(vmPFC)、膝下および背側前帯状皮質(それぞれsgACCおよびdACC)を含む皮質線条体回路における報酬モチベーションやアヘドニアのいくつかの側面を阻害する一方で、扁桃体、海馬、dACC、島皮質を含む不安、覚醒、警戒、恐怖を調節する回路を活性化させることもあります。
- BH2: ジヒドロビオプテリン
- DAT: ドーパミントランスポーター
- EAAT2: 興奮性アミノ酸トランスポーター2
- NET: ノルアドレナリントランスポーター
- NF-KB: 核因子カッパB
- SERT: セロトニントランスポーター
- TH: チロシンヒドロキシラーゼ
- TPH: トリプトファンヒドロキシラーゼ
(Miller A, Raison C. The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nat Rev Immunol 2016;16:22-34. doi: 10.1038/nri.2015.5 より転載)
炎症とうつ病-横断的関連
複数のメタアナリシスによって証明されているように、うつ病性障害を持つ個人は、IL-2、IL-5、IL-6、IL-7、IL-8、IL-10、IL-12、IL-13、IFN-ガンマ、CRP、TNFなど、いくつかの炎症促進性および抗炎症性サイトカインのレベルの上昇を示します。この多様な炎症性サイトカインのセットの中で、うつ病と炎症性バイオマーカーとの間で最も堅牢かつ一貫した関連性が観察されているのは、CRP、IL-6、IL-1、およびTNFです。特筆すべきは、抗炎症性サイトカインの上昇は、炎症促進性の偏りを打ち消すために起こる可能性があるということです。
炎症とうつ病-縦断的関連
慢性的な炎症活性化がうつ病のリスクを高めるという結論を支持する証拠があります。自己免疫疾患(関節リウマチ、多発性硬化症、ループス)、感染症(HIV、肝炎、サイトメガロウイルス)、血管疾患(脳卒中、虚血性疾患)、代謝性疾患(糖尿病、肥満)など、慢性炎症と関連する医学的疾患はすべて、うつ病の頻度の著しい増加と関連しています。これらの発見は、デンマークでの大規模な集団ベースのコホート研究において、年齢、出生年、性別で調整された生存分析を用いて検証され、支持されました。自己免疫疾患の診断後には気分障害のリスクが45%増加し、感染症による入院後には62%増加しました。
IFN-アルファなどの免疫刺激治療は、うつ病のよく知られた誘発因子です。最近のメタアナリシスを含む複数の研究が、抗うつ薬の前治療がIFN-アルファ治療を受けた被験者のうつ病発症リスクを低下させる可能性があることを示しています。最後に、CRPとIL-6の増加は、研究によって多少のばらつきはあるものの、将来的なうつ病の発症を予測することも示されています。
炎症とうつ病の関連性を解釈する上での注意点
これらの関連性にもかかわらず、炎症が普遍的にうつ病と関連しているのか、あるいはうつ病が多発性硬化症のような神経炎症性疾患なのかを結論付けることは困難です。うつ病のすべての被験者が炎症性サイトカインのレベル上昇を示すわけではなく、血漿サイトカインレベルが上昇しているすべての被験者がうつ病を発症するわけではないようです。炎症は、炎症誘発性うつ病に対する個々の脆弱性や生物学的素因が増加しているうつ病患者のサブセットにおいて、病態生理学と関連している可能性が高いです。
この関連性に影響を与えるもう一つの要因は、肥満、高血圧、糖尿病などの交絡因子であり、これらはうつ病患者に多く見られます。これらの交絡因子を調整した後も、炎症とうつ病の間にそのような関連性が存在するのかどうかは不明です。例えば、ウエスト周囲径と血圧を調整したある研究では、以前報告されたうつ病と血漿中の炎症マーカー増加との関連性を再現できませんでした。興味深いことに、いくつかの研究では、BMI(体格指数)で示される肥満を含む交絡因子を調整した後、未治療のうつ病患者にのみ、CRP、TNF、IL-6などの炎症マーカーの血漿レベルとCSF(脳脊髄液)レベルの間に高い相関が報告されています。さらに、69の研究のメタアナリシスでも、うつ病患者のCSFにおけるIL-6とTNF濃度の上昇が報告されています。
炎症とうつ病症状の領域間の関連性
うつ病の診断における極端な異質性は、その発症、進行、および治療反応に関連するバイオマーカーの探索を著しく妨げてきました。最近のアプローチの一つは、診断実体をサブシンドロームの症状領域に分解することで狭めることです。脳と行動に対する炎症の影響に関連するいくつかの主要な関心領域には、アンヘドニア、不安、自殺傾向、認知症状、睡眠が含まれますが、これらの症状領域は「横断的診断的に」うつ病以外の診断カテゴリーにも及ぶ可能性があります。
実際に、前述の通り、炎症の増加は、モチベーションと運動活動、さらには不安、覚醒、警戒を調節する神経伝達物質システム、脳領域、および回路への影響と確実に結びついています。これらの効果の特異性は、気分障害や不安障害の患者が示す広範な症状全体に対する炎症の影響が、より限定的であることを示唆しています。実際、15の集団ベースコホート研究から56,351人の被験者を対象に、炎症とうつ病の特定の症状との関係を調べた最近の論文では、アンヘドニア、疲労、睡眠の問題が炎症と確実に結びついていることが示されました。これらのデータは、炎症が脳にどのように影響するかについての私たちの知識と非常に一致しています。それにもかかわらず、このアプローチの詳細なレビューは本章の範囲を超えていますが、読者はこれらのトピックに関する詳細なレビューを参照してください。
従来の抗うつ薬治療への反応の予測因子としての炎症性バイオマーカー
関連する検査費用が安価で、時間もかからないのであれば、治療反応を予測できるバイオマーカーの特定は、臨床現場において極めて重要です。理想的には、これらのバイオマーカーは、患者をサブグループ(さまざまなバイオマーカープロファイルを持つうつ病患者)に分類し、従来の抗うつ薬に反応しない患者に最適な治療選択肢を提案するのに役立つでしょう。まとめると、現在の証拠は、炎症の増加と古典的な抗うつ薬治療への臨床反応との間に負の関係があることを示唆しています(ケタミンおよびECTを用いた有望なデータについては後で議論します)。以下に、一般的に研究されているいくつかのマーカーを検討します。
腫瘍壊死因子(TNF)
TNF遺伝子ノックアウトマウスにおける抗うつ薬治療への反応の欠如は、抗うつ薬が効果を発揮するためにはある程度のTNFが必要であることを示唆しました。この前臨床的な発見は、ヒトの研究では完全には支持されていません。エスシタロプラムによる抗うつ薬治療に反応した患者は、非反応者や健常対照群よりもベースラインのTNFレベルが低かったのです。SSRI抵抗性うつ病患者は、血漿中のIL-6およびTNFレベルが有意に高いことを示しました。複数の抗うつ薬治療が失敗した98人のうつ病患者を用いた最近の研究では、3回以上の治療が失敗した患者は、それよりも少ない治療失敗の患者よりも有意に高いTNF、sTNFR2、およびIL-6を示したと報告しました。さらに、これら3つのマーカーの血漿レベルは、有意な精度(AUC >0.7)で治療失敗を予測しました。TNF活性の増加は、一般的にインフリキシマブなどのTNF遮断モノクローナル抗体を用いてうつ病における免疫系を標的とする基礎となっています。
インターロイキン-6(IL-6)
IL-6は、2000年代初頭からうつ病における治療抵抗性と一貫して関連付けられてきました。健常対照群と比較して、SSRI治療に反応しなかったうつ病患者は、ベースラインのIL-6およびTNFレベルが高かったのです。驚くべきことに、IL-6のような炎症マーカーは、ケタミンに対する良好な反応を予測します。以前の報告では、ケタミン反応者は非反応者よりも血漿IL-6レベルが高いことを示していました。興味深いことに、前臨床の治療抵抗性うつ病モデルも同様の発見を示す傾向がありました。同様に、より最近の大規模な分析では、交絡因子のより構造化された制御が行われ、以前の研究からのこの結論を支持するようでした。この研究では、ベースラインのIL-6が、研究終了時のうつ病症状のより大きな軽減を予測しました。
さらに最近では、別の研究が、KYN代謝産物の上昇もケタミンへの陽性反応を予測することを示しており、ケタミン効果が炎症性活性化のある患者でより顕著である可能性を示唆しています。同様に、ベースラインのIL-6レベルが高いほど、ECT(電気けいれん療法)コースへの反応性が高いと予測され、この効果は女性の性別によって調整されました。興味深いことに、治療中のIL-6とCRPの早期の増加は、研究終了時には正常レベルに低下しました。まとめると、血中のIL-6レベルは治療の種類に応じて治療反応を予測し、IL-6の上昇はSSRIまたはSNRIへの非反応と、ケタミンおよびECTへの陽性反応と関連しています。
インターロイキン-8(IL-8)
IL-8は、ケモカインであり炎症促進性サイトカインであり、特に女性において不安やうつ病スコアの重症度との関連が示されています。最近のデータは、IL-8のベースラインレベルが、ECT(電気けいれん療法)のインデックスコースへの治療反応を予測することを示しており、特に女性において顕著です。例えば、ECT治療コースに反応した女性は、ベースラインでIL-8レベルが低いことを示しました。しかし、IL-6とは異なり、ベースラインから治療終了までのIL-8の減少は、女性のみにおいて症状改善の割合と負の相関がありました。したがって、IL-8は大うつ病におけるECT治療反応の性別特異的なマーカーである可能性があります。別の研究では、IL-8が女性のうつ病患者におけるケタミンへの反応を予測すると報告されています。
C反応性タンパク質(CRP)
GENDEP研究(多施設共同、部分的にランダム化された非盲検薬理遺伝学研究)の二次分析では、12週間にわたってエスシタロプラムまたはノルトリプチリンにランダム化されたうつ病患者におけるベースラインのCRPが治療反応を予測する影響を調べました。ベースラインのCRPレベルは、抗うつ薬の治療結果を異なる形で予測しました。CRP > 1 mg/Lの患者は、エスシタロプラムよりもノルトリプチリン治療により良好に反応しました。同様の所見はCOMED試験でも報告されており、CRP > 1の患者はエスシタロプラムへの反応が悪く、エスシタロプラムとブプロピオンの併用療法には良好に反応しました。別のより新しい研究では、治療抵抗性のうつ病患者は、反応した患者よりもベースラインの末梢CRPレベルが高かったことが示されています。
インターロイキン-1(IL-1)
IL-1遺伝子の1塩基多型(SNP)の2つの遺伝子型(GG遺伝子型)は、抗うつ薬治療6週間後の非寛解と関連していました。さらに、両方のSNPにおけるGアレル数の増加(G-、GG)は、情動刺激に対する扁桃体とACC(前帯状皮質)の反応性の低下と関連していました。
キヌレニン経路
死後研究では、急性うつ病で自殺傾向のある患者の前帯状皮質におけるミクログリアが、より高いQA(キノリン酸)レベルを発現していたと報告されています。QAのこれらの増加とそのNMDA受容体調節に対する下流効果は、炎症が亢進したうつ病患者における抗うつ薬治療としてケタミン(非競合的NMDA受容体拮抗薬)を検討するための分子基盤を提供しました。興味深いことに、初期のデータはKYNs(キヌレニン類)とうつ病に対するケタミン療法の結果も関連付けています。最近の分析では、KYN経路の毒性がCovid-19感染後のいくつかの神経認知障害の根底にある可能性が示されています。
結論として、末梢の炎症マーカーの増加は、治療に対する異なる反応を示す患者のサブグループを特定するための有用なバイオマーカーとなる可能性があります。しかし、CRP以外のすべての免疫バイオマーカーには標準化されたアッセイ技術が利用できないため、免疫学的バイオマーカーの選択は限定されるでしょう。さらに、これらのマーカーの経時的な濃度変動が大きいことや、機能的活性の冗長性が、免疫測定の解釈に影響を与える可能性があります。それにもかかわらず、心臓病学などの他の分野で日常的に行われているように、CRPをベースラインスクリーニングツールとして使用し、うつ病患者の炎症リスクを層別化することは可能です。
うつ病性障害に対する抗炎症療法
非ステロイド性抗炎症薬(NSAIDs)
シクロオキシゲナーゼ-1および2(それぞれCOX-1およびCOX-2)などの酵素を非ステロイド性抗炎症薬(NSAIDs)で阻害することは、うつ病の潜在的な治療法として評価されてきました。両方のCOX酵素は、胃腸および血管平滑筋を保護しながら炎症を促進するプロスタグランジンの合成につながります。NSAIDsは、COX-1およびCOX-2に作用するアスピリンを含む非選択的薬剤と、選択的COX-2阻害剤であるセレコキシブに分類されます。
NSAID単独療法
当初の熱意にもかかわらず、NSAIDsによる単独療法はこれまでのところ混合した結果しか得られていません。この分野の最も初期の研究では、過去5年間にアスピリンを使用していたが研究時には使用していなかったオーストラリア人男性は、抑うつ症状を経験するオッズが40%高いと報告されました。したがって、著者らはアスピリンがうつ病の発症を防ぐのに失敗したと結論付けました。しかし、アスピリンは、炎症とうつ病の増加に関連する慢性疾患を標的として処方された可能性が高いです。その後の研究では、スタチンとアスピリンの併用摂取がうつ病のリスクを低下させることが示されました。しかし、スタチンは、その抗炎症作用を介して、アスピリンの免疫保護効果を交絡させた可能性があります。別の研究では、血漿中のホモシステインレベルが高い高齢男性(血管炎症の増加を示す)におけるアスピリン摂取とうつ病の頻度の減少との関連が示されました。
アルツハイマー病(AD)予防試験から得られたうつ病の高齢者を対象とした研究で、セレコキシブ200mgを1日2回またはナプロキセンナトリウム220mgを1日2回をプラセボと比較したところ、セレコキシブ群もナプロキセン群も抑うつ症状の有意な寛解を経験しませんでした。変形性関節症の治療のためにイブプロフェン、ナプロキセン、セレコキシブを投与された患者からのデータでは、抑うつ症状の強度が有意に減少しました。しかし、変形性関節症による身体障害と痛みの制限が、うつ病スコアの改善に寄与した可能性が高いです。さらに重要なことに、NSAIDsの利点は、しばしば腎臓、胃腸、心血管系の副作用のリスクによって上回られます。特に、ロフェコキシブ(Vioxx)による治療後の心血管毒性は、治療開始後2ヶ月という早い段階で指摘されました。この文脈において、最近発表された非常に大規模な研究では、うつ病におけるアスピリンの保護効果は見られませんでした。
インターロイキン-8(IL-8)
IL-8は、ケモカインであり炎症促進性サイトカインであり、特に女性において不安やうつ病スコアの重症度との関連が示されています。最近のデータは、IL-8のベースラインレベルが、ECT(電気けいれん療法)のインデックスコースへの治療反応を予測することを示しており、特に女性において顕著です。例えば、ECT治療コースに反応した女性は、ベースラインでIL-8レベルが低いことを示しました。しかし、IL-6とは異なり、ベースラインから治療終了までのIL-8の減少は、女性のみにおいて症状改善の割合と負の相関がありました。したがって、IL-8は大うつ病におけるECT治療反応の性別特異的なマーカーである可能性があります。別の研究では、IL-8が女性のうつ病患者におけるケタミンへの反応を予測すると報告されています。
C反応性タンパク質(CRP)
GENDEP研究(多施設共同、部分的にランダム化された非盲検薬理遺伝学研究)の二次分析では、12週間にわたってエスシタロプラムまたはノルトリプチリンにランダム化されたうつ病患者におけるベースラインのCRPが治療反応を予測する影響を調べました。ベースラインのCRPレベルは、抗うつ薬の治療結果を異なる形で予測しました。CRP > 1 mg/Lの患者は、エスシタロプラムよりもノルトリプチリン治療により良好に反応しました。同様の所見はCOMED試験でも報告されており、CRP > 1の患者はエスシタロプラムへの反応が悪く、エスシタロプラムとブプロピオンの併用療法には良好に反応しました。別のより新しい研究では、治療抵抗性のうつ病患者は、反応した患者よりもベースラインの末梢CRPレベルが高かったことが示されています。
インターロイキン-1(IL-1)
IL-1遺伝子の1塩基多型(SNP)の2つの遺伝子型(GG遺伝子型)は、抗うつ薬治療6週間後の非寛解と関連していました。加えて、両方のSNPにおけるGアレル数の増加(G-、GG)は、情動刺激に対する扁桃体とACC(前帯状皮質)の反応性の低下と関連していました。
キヌレニン経路
死後研究では、急性うつ病で自殺傾向のある患者の前帯状皮質におけるミクログリアが、より高いQA(キノリン酸)レベルを発現していたと報告されています。QAのこれらの増加とそのNMDA受容体調節に対する下流効果は、炎症が亢進したうつ病患者における抗うつ薬治療としてケタミン(非競合的NMDA受容体拮抗薬)を検討するための分子基盤を提供しました。興味深いことに、初期のデータはKYNs(キヌレニン類)とうつ病に対するケタミン療法の結果も関連付けています。最近の分析では、KYN経路の毒性がCovid-19感染後のいくつかの神経認知障害の根底にある可能性が示されています。
結論として、末梢の炎症マーカーの増加は、治療に対する異なる反応を示す患者のサブグループを特定するための有用なバイオマーカーとなる可能性があります。しかし、CRP以外のすべての免疫バイオマーカーには標準化されたアッセイ技術が利用できないため、免疫学的バイオマーカーの選択は限定されるでしょう。さらに、これらのマーカーの経時的な濃度変動が大きいことや、機能的活性の冗長性が、免疫測定の解釈に影響を与える可能性があります。それにもかかわらず、心臓病学などの他の分野で日常的に行われているように、CRPをベースラインスクリーニングツールとして使用し、うつ病患者の炎症リスクを層別化することは可能です。
うつ病性障害に対する抗炎症療法
非ステロイド性抗炎症薬(NSAIDs)
シクロオキシゲナーゼ-1および2(それぞれCOX-1およびCOX-2)などの酵素を非ステロイド性抗炎症薬(NSAIDs)で阻害することは、うつ病の潜在的な治療法として評価されてきました。両方のCOX酵素は、胃腸および血管平滑筋を保護しながら炎症を促進するプロスタグランジンを合成します。NSAIDsは、COX-1およびCOX-2に作用するアスピリンを含む非選択的薬剤と、選択的COX-2阻害剤であるセレコキシブに分類されます。
NSAID単独療法
当初の熱意にもかかわらず、NSAIDsによる単独療法はこれまでのところ混合した結果しか得られていません。この分野の最も初期の研究では、過去5年間にアスピリンを使用していたが研究時には使用していなかったオーストラリア人男性は、アンヘドニア症状を経験するオッズが40%高いと報告されました。したがって、著者らはアスピリンがうつ病の発症を防ぐのに失敗したと結論付けました。しかし、アスピリンは、炎症とうつ病の増加に関連する慢性疾患を標的として処方された可能性が高いです。その後の研究では、スタチンとアスピリンの併用摂取がうつ病のリスクを低下させることが示されました。しかし、スタチンは、その抗炎症作用を介して、アスピリンの免疫保護効果を交絡させた可能性があります。別の研究では、血漿中のホモシステインレベルが高い高齢男性(血管炎症の増加を示す)におけるアスピリン摂取とうつ病の頻度の減少との関連が示されました。
アルツハイマー病(AD)予防試験から得られたうつ病の高齢者を対象とした研究で、セレコキシブ200mgを1日2回またはナプロキセンナトリウム220mgを1日2回をプラセボと比較したところ、セレコキシブ群もナプロキセン群も抑うつ症状の有意な寛解を経験しませんでした。変形性関節症の治療のためにイブプロフェン、ナプロキセン、セレコキシブを投与された患者からのデータでは、アンヘドニア症状の強度が有意に減少しました。しかし、変形性関節症による身体障害と痛みの制限が、アンヘドニアスコアの改善に寄与した可能性が高いです。さらに重要なことに、NSAIDsの利点は、しばしば腎臓、胃腸、心血管系の副作用のリスクによって上回られます。特に、ロフェコキシブ(Vioxx)による治療後の心血管毒性は、治療開始後2ヶ月という早い段階で指摘されました。この文脈において、最近発表された非常に大規模な研究では、うつ病におけるアスピリンの保護効果は見られませんでした。
NSAID増強療法
抗うつ薬療法に対するNSAIDsの増強剤としての有効性も、混合した結果に悩まされています。初期の研究では、セレコキシブとレボキセチン(抗うつ薬)の併用、レボキセチン単独、プラセボを比較するために、二重盲検、プラセボ対照ランダム化デザインが用いられました。レボキセチン単独群とレボキセチンとセレコキシブの併用群の両方で症状の重症度が軽減されましたが、セレコキシブ群からの脱落者の数が多かったことは、この薬剤の副作用に対する不耐性を示唆していました。その後、2つの研究が、フルオキセチンに対するセレコキシブの6週間増強療法に肯定的な効果があることを示しました。しかし、同じ対象集団を用いた別の研究では、セレコキシブの増強効果は4週間でピークに達し、8週間で減少することが示されました。著者らは、セレコキシブがSSRIへの反応を加速する可能性があると結論付けました。グリア細胞におけるトランスロケータータンパク質密度のPET標識のようなベースラインの炎症マーカーを使用すると、うつ病患者におけるセレコキシブへのより良い反応が予測されます。しかし、最近の適切に実施された研究では、ボルチオキセチンの抗うつ効果を増強する上で、セレコキシブの増強はプラセボよりも優れていないことが示されました。したがって、NSAID単独療法または増強療法の全体的な有効性は、現在のデータでは十分に支持されていません。
炎症が増加していない患者の選択、うつ病評価尺度のスコアの変化といった全体的なアウトカム変数、および標的外効果を持つ薬剤の使用など、いくつかの要因が試験の失敗に関与していました。韓国の大規模な集団ベースの研究では、NSAIDsと抗うつ薬の併用が頭蓋内出血のリスクを1.6倍(95%信頼区間 = 1.3から1.85)に増加させると報告されており、NSAID増強療法に関する深刻な懸念を提起しています。
サイトカイン阻害
一部のうつ病と炎症性サイトカインとの関連性を考慮すると、最近の研究ではサイトカイン遮断薬の抗うつ効果の検討に焦点が当てられています。インフリキシマブなどのTNF拮抗薬が最初に登場しました。2013年、治療抵抗性大うつ病の医学的に安定した患者60人(各群30人)が、12週間の試験のベースライン、2週目、6週目にTNF拮抗薬インフリキシマブ(5 mg/kg)またはプラセボの3回の点滴治療を受けました。ハミルトンうつ病評価尺度を用いたうつ病重症度スコアの全体的な変化は治療群間で差がありませんでしたが、治療、時間、群の相互作用があり、ベースラインのCRPレベルが5 mg/Lを超える高値を示した被験者は、インフリキシマブに有利な臨床的に意味のある反応を示しました。加えて、インフリキシマブ反応者では非反応者と比較して、ベースラインのTNFとその受容体が有意に高値でした。興味深いことに、NSAIDsを用いた研究とは対照的に、有害事象と脱落は非常に少なかったです。この記事は、いくつかの関連する要因を指摘しました。TNF拮抗作用と抗うつ作用を結びつける概念実証的な証拠を提供する一方で、著者らは結果の解釈において重大な注意を促しました。いくつかの限界には、探索的分析に利用できる少数のサンプル、臨床現場のほとんどのうつ病患者に対するCRP > 5 mg/Lの限定的な一般化可能性、および使用されたうつ病アウトカムの全体的尺度が含まれていました。
注目すべきは、乾癬などの医学的疾患を治療するためのTNF拮抗薬(インフリキシマブ、アダリムマブ、エタネルセプト)の使用が、併存するアンヘドニア症状の大幅な改善をもたらしたことです。これらの発見は、アンヘドニアの改善が疾患活動性による身体障害と苦痛の改善に起因する可能性があるため、慎重な解釈が必要です。TNF拮抗薬による治療は、結核、ヒストプラズマ症、細菌性敗血症などの日和見感染症のリスクを増加させます。最近、多中心性キャッスルマン病に対するシルツキシマブ(IL-6に対するキメラモノクローナル抗体)と関節リウマチ治療に対するシルクマブ(IL-6に対するヒトモノクローナル抗体)が、これらの医学的疾患を持つコホートにおける抗うつ効果について評価されました。上記の2つのIL-6拮抗薬による治療は、この分析においてうつ病とアンヘドニアの有病率を減少させましたが、主要な医学的疾患とその治療による交絡効果によって限定されます。最後に、双極性うつ病患者を対象とした最近のインフリキシマブ試験(下記参照)では、アンヘドニアに同様の効果が認められましたが、ベースラインの炎症との明確な関係はありませんでした。それにもかかわらず、炎症と確実に結びついている小児期の虐待の既往歴が、反応の予測因子であることが判明しました。
ケタミン
ケタミンに関する詳細な議論は、この教科書の他の章で利用できます。その炎症性活性化との関連は、本章にとって関心の対象です。以前のセクションでは、ケタミン療法による免疫マーカーの変化の概要が示されました。ケタミンがNMDA受容体部位の拮抗薬であるという長年の知識にもかかわらず、そのメカニズムがNMDA遮断に限定されるかどうかは不明です。特に、ケタミンはIDO活性を低下させ、中枢神経系におけるKYN/トリプトファン比を減少させます。ケタミンはまた、シナプス形成の維持に主要な役割を果たすラパマイシン標的タンパク質(mTOR)の哺乳類標的を刺激します。興味深いことに、ケタミンは前臨床のうつ病モデルでIL-6、TNF、およびIL-1レベルを低下させることも示されています。さらに、ケタミンは、うつ病において炎症を促進する転写因子であるNF-κBのレベルを低下させることが示されています。
ミノサイクリン
ミノサイクリンはミクログリア阻害剤であり、脳内のミクログリアから放出される炎症促進性サイトカインと反応性酸素種の産生を阻害することにより、脳内で抗炎症作用を発揮します。加えて、ミノサイクリンはIDO活性を低下させ、ミクログリア細胞による神経毒性KYN代謝産物の合成を減少させることがよく知られています。初期の研究では、HIV感染患者のグループにおいて、ミノサイクリン100mgを1日2回経口摂取すると、アンヘドニアの重症度が有意に減少すると報告されました。その後、ミノサイクリン150mg/日と抗うつ薬の併用が、単極性精神病性うつ病の治療に有効で忍容性が高いと報告されました。しかし、CRP > 3 mg/Lのアンヘドニア患者におけるミノサイクリンの有効性の証拠があるにもかかわらず、同様の用量の経口ミノサイクリンは、大うつ病性障害におけるTSPO標識を減少させないことが判明しました。最近のいくつかの研究では、うつ病および他の精神障害の治療におけるミノサイクリンの有効性を評価しましたが、残念な結果に終わっています(双極性障害の項で議論されます)。同様に、最近の大規模な双極性うつ病治療におけるミノサイクリンの効果を検討する取り組みも、意味のある結果を生み出していません。
抗うつ薬のサイトカインへの影響
前臨床研究
ヒト血液サンプルのin vitro分析では、使用された抗うつ薬によって解釈が困難な可変的な結果が得られています。ベンラファキシンはIL-6を減少させ、セルトラリンはIFN-アルファとIL-6を増加させ、いずれもNF-κB活性の減少と関連していました。イミプラミンとフルオキセチンは、NF-κB活性の減少を介して、in vitroでLPSを適用して免疫刺激を受けたラットグリア細胞によるTNFとIL-1の放出を減少させました。アミトリプチリンは、前臨床腹膜炎モデルで一酸化窒素産生を減少させることにより、血清IL-1とTNFレベルを減少させました。逆説的に、シタロプラムはIL-1、IL-6、TNF、IL-22の産生を増加させました。ミルタザピンはIL-1、TNF、IL-22を増加させました。エスシタロプラムは、アンヘドニア患者の免疫刺激T細胞およびBリンパ球によるIL-17産生を減少させました。この分野のレビューでは、高い変動性は使用された薬剤の種類と使用された免疫刺激の方法に起因すると考えられています。しかし、抗うつ薬は全体として、NF-κBが媒介する細胞内免疫シグナル伝達経路に収束する可能性があるようです。
臨床研究
治療されたアンヘドニア患者の臨床サンプルからの血漿炎症マーカーの測定も、私たちの理解を深めています。初期のメタアナリシスでは、抗うつ薬と免疫マーカーとの普遍的な関係を支持できませんでした。代わりに、SSRIがIL-6に影響を与え、SSRIとTCAの両方がIL-1に影響を与えるという、クラス特異的な効果がありました。サイトカインの血漿測定値を用いた35の縦断的臨床研究の最近のメタアナリシスでは、抗うつ薬治療の結果としてIL-6レベルの正味の減少が報告されました。
統合失調症
統合失調症における自然免疫の変化
炎症の増加は、一般に統合失調症でみられるような陽性精神病症状の発症とは関連付けられていません。血中免疫マーカーアッセイを用いた研究では、統合失調症と気分障害を区別するのに役立っていません。85,000人以上を対象としたメタアナリシスでは、統合失調症患者においてCRPが控えめながらも確実に増加していることが判明しました。さらに、SZ(統合失調症)患者におけるCRPレベルは、抗精神病薬や病状の経過(初回エピソード対進行性疾患)とは独立して中程度に増加し、末梢CRPレベルの増加は陽性症状の重症度の増加と並行していましたが、陰性症状とは並行していませんでした。しかし、より包括的なメタアナリシスでは、急性統合失調症、双極性躁病、および大うつ病において、2つのサイトカイン(IL-6、TNF)、1つの可溶性サイトカイン受容体(sIL-2R)、および1つのサイトカイン受容体拮抗薬(IL-1RA)の血漿レベルが上昇していると報告されました。最後に、最近のメタアナリシスは、統合失調症および感情障害患者のCSFにおける炎症マーカー(IL-6、IL-8、およびIgG/アルブミン比)の増加との関係を確認しました。これらの著者らは、バイアスと交絡因子の不適切な制御のため、確固たる結論に達することの困難さを指摘しました。しかし、変動性と交絡因子を制御した別のメタアナリシスでは、IL-6、IFN-ガンマ、およびIL-17に中程度の効果が示されました(平均差に対するヘッジのgは0.3〜0.6)。最後に、統合失調症におけるトランスロケータータンパク質(TSPO)-PET結合を調べた研究のメタアナリシスでは、結合能をアウトカム指標として使用した場合、統合失調症の灰白質におけるTSPOトレーサー結合の中程度の増加が報告されましたが、分布容積をアウトカム指標とした場合には差はありませんでした。したがって、マーカー推定値の変動性、サンプル選択におけるバイアス、および交絡因子の不適切な選択が状況を不明瞭にしています。しかし、初回エピソード精神病の研究では、より一貫した所見が得られています。薬剤未治療の初回エピソード患者3,453人と対照群4,152人を対象とした最近のメタアナリシスでは、初回エピソード精神病患者においてIL-6、IL-8、およびTNFの増加が認められました。初回エピソード患者に関する報告の希少性を考えると、複数の研究を統合するこのアプローチが最も実用的なアプローチである可能性があります。
統合失調症における獲得免疫の変化
統合失調症における獲得免疫細胞の変化に関する詳細な議論は本章の範囲を超えています。所見はしばしば可変的で矛盾しています。しかし、これらの研究はすべて、Tリンパ球およびBリンパ球と他の獲得免疫細胞の変更が、一部の統合失調症患者の病態に不可欠である可能性を強調しています。感受性のある個人の末梢血では、細胞傷害性、炎症促進性の偏り(制御性T細胞の活動とは対照的に)が認められます。興味深いことに、Bリンパ球の病態は、精神病症状と関連する自己免疫性脳炎の発現と関連している可能性があります。さらに、統合失調症患者の死後脳標本の転写プロファイリングは、自然免疫(サイトカイン、ケモカイン)、シナプス後シグナル伝達、およびグルタミン酸経路に関連する遺伝子が豊富であることを示しました。他の研究では、ミクログリア活性化、細胞傷害性リンパ球浸潤、およびIgG沈着のアップレギュレートされた発現が報告されています。
母体免疫活性化
ヒトの研究では、統合失調症における母体炎症への曝露と統計的関連が示されていますが、動物研究では、慢性的な母体炎症への曝露が子孫の脳の形態学的および機能的変化の持続と関連していることが明らかにされています。例えば、妊娠中の実験動物に様々な免疫刺激(抗ウイルス免疫と抗菌免疫の両方を活性化する)を投与すると、子孫に統合失調症に匹敵する異常な発達軌跡が生じます。これらの行動欠損には、社会交流の欠損、反復的で常同的な行動、作業記憶の低下、実行機能の障害、およびプレパルス阻害を介して評価される感覚運動ゲーティングの障害が含まれます。さらに、一部の病原性ウイルスは、ドーパミン作動性ニューロンの細胞死カスケードを誘発することによって作用し、DAレベルの変動と統合失調症の行動症状をもたらす可能性があります。複数の疫学研究は、子宮内での感染病理への曝露と、後の人生での統合失調症の発症との関連を示しています。統合失調症と関連付けられている出生前感染症には、風疹、インフルエンザ、トキソプラズマ症が含まれます。同様に、産科合併症、妊娠糖尿病、および重度の身体的または心理社会的ストレス因子(例:飢饉、戦争、精神的外傷、母体うつ病)は、母体炎症を増加させ、それが統合失調症の発症を予測します。IL-8を含む母体サイトカインも、統合失調症の発症につながる妊娠において有意に増加します。例えば、IL-8の増加への胎児曝露は、後の人生で統合失調症を発症した被験者において、脳室CSFの有意な増加、左内嗅皮質の容積の有意な減少、および右後帯状回の容積の有意な減少と関連していました。加えて、母体TNFの上昇も、後の統合失調症の発症と関連付けられています。興味深いことに、IL-1、IL-6、TNFなどの炎症性サイトカインをブロックする戦略は、実験動物モデルにおける統合失調症様行動に関連する行動的および皮質的欠損のリスクを減少させました。ポリICを用いて動物モデルで抗炎症性サイトカインIL-10の合成と放出を増加させる戦略によっても同様の結果が得られています。したがって、一部の統合失調症性障害は、発達中の脳における免疫活性化と炎症性病態の結果を表している可能性があります。
自己免疫性精神病
デンマーク国家登録を用いた研究では、自己免疫疾患の既往歴がその後の統合失調症のリスクを29%増加させ、感染症による入院歴がそのリスクを60%増加させると報告されました。さらに、自己免疫と感染症が組み合わさると、交絡因子を制御した後でも、その後の統合失調症のリスクは125%増加しました。この文脈において、精神病のリスクを促進する上で自己免疫が果たす役割が強調されてきました。より具体的には、獲得免疫応答による神経伝達物質受容体の病理学的活性化は、精神病における免疫調節不全を研究するための可能な道筋を提供しています。最も劇的な病態は、自己免疫性NMDA受容体脳炎を示唆する臨床的および検査所見です。自己免疫性脳炎は、てんかん発作、認知機能障害、運動障害などの明確な神経学的特徴が存在する場合に最もよく診断されます。加えて、これらの患者は、シナプスおよび関連タンパク質(主にNMDA受容体システム、電位依存性カリウムチャネル(VGKC)システム、ロイシンリッチグリオーマ不活性化(LGI)-1、およびコンタクチン関連タンパク質様(CASPR)-2システム)の表面エピトープを標的とする病原性抗体を持っています。これらの症候群と病態の詳細な記述は別の場所で提供されています。活性化リンパ球上の受容体特異的抗体およびCSFにおける特徴的なタンパク質バンドの同定は、診断的価値がある可能性があります。T2-FLAIR画像における内側側頭部高信号強度や、側頭部および頭頂部領域におけるFDG-PETの取り込みの増加または減少を含むMRI所見も報告されています。最後に、びまん性徐波、間欠的律動性デルタ波またはシータ波活動、または明らかなてんかん原性活動を含むEEG変化が、これらの疾患の診断的ワークアップに用いられてきました。
神経画像およびEEGマーカーの研究は、疾患プロセスにおける内側側頭部領域の特定の脆弱性を示唆しているにもかかわらず、これらの疾患の診断における基礎は臨床評価に変わりありません。抗体活性が潜在性腫瘍(胸腺腫など)と関連している場合、その切除が症状の軽減に役立つ可能性があります。加えて、血漿交換、免疫吸着、または静脈内免疫グロブリンなどの免疫療法がすべて様々なレベルで成功を収めてきました。高用量ステロイド、メトトレキサート、またはアザチオプリンなどの免疫抑制療法も急性期治療に用いられてきました。Bリンパ球活性を低下させるリツキシマブなどの抗CD20薬剤も一定の成功を収めています。最後に、Th27細胞の機能を変更することによるIL-27システムの調節が役割を果たす可能性があります。
統合失調症に対する免疫療法
この分野の広範なメタアナリシスとレビューは、読者に参照されるべきです。本セクションでは、この急成長する研究分野の概要を提供します。一般的に、ほとんどの研究では、精神病性障害の治療における抗炎症剤の追加療法に控えめな利点が見出されています。しかし、洗練されたメタ回帰分析では、限られたサンプル数の小規模な研究が、実質的により大きな効果量を示し、統合された推定値の信頼性を低下させていることが示されました。
非ステロイド性抗炎症薬(NSAIDs)
3〜4ヶ月間、高用量のアスピリン(1,000mg/日)を使用した初期の2つの研究では、約0.30の効果量で控えめな有効性が示されました。しかし、これは著しいリスク対ベネフィットの懸念を提起する領域です。さらに、アスピリンはBBBを容易に通過しない可能性があり、視床下部-下垂体-副腎(HPA)軸の活動を低下させる標的外効果があることでよく知られています。セレコキシブ400mg/日を5〜11週間使用した研究では、統合失調症の治療において低い効果量(0.15)が得られました。したがって、NSAIDsの使用は文献では十分に支持されていません。
必須脂肪酸
神経保護効果に加えて、エイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)などのオメガ-3脂肪酸は、IL-1、TNF、IFN-ガンマに中程度の抗炎症作用を持ちます。EPA量が0.5〜4g、DHA量が0.4〜2.2gの日用量の脂肪酸が、8週間から最大2年間研究されてきました。ほとんどの研究では、0.23の効果量で軽度の利点があることを示しています。それにもかかわらず、一部の被験者は必須脂肪酸の追加から恩恵を受ける可能性があります。
エストロゲン
エストロゲンが様々なメカニズムを介して免疫活性化を調節することはよく知られています。提案されているメカニズムには、抗酸化能力の増加、血糖恒常性の改善、そしておそらくDA調節不全の減少が含まれます。1日あたり0.05mgから2mgの範囲のエストロゲン量が試みられており、いくつかの利点があります。プールされた効果量は、女性のみのグループと両性のグループの両方で0.5の範囲でした。しかし、慢性的なエストロゲン療法によるがんリスクの増加などの他のリスクは、その利点とバランスを取る必要があるかもしれません。
ミノサイクリン
ミノサイクリンは一部の研究で効果が報告されていますが、大規模な研究では実質的に否定的な結果が示されており、その処方に対する信頼性は限られています。さらに、抗菌特性があるため、マイクロバイオームへの悪影響が懸念されており、広範な使用にはさらなるエビデンスが必要です。
双極性うつ病の治療におけるミノサイクリンの使用に関しては、以前のメタアナリシスでは有意な効果量が報告されました。しかし、大規模な研究では、アスピリンとの併用で改善が見られたものの、その効果は主にアスピリンによる可能性が指摘されています。また、別の大規模研究では、セレコキシブやミノサイクリン、またはそれらの併用による効果は認められませんでした。したがって、臨床医がリスクとベネフィットを判断するためには、さらなる調査が必要です。
N-アセチルシステイン(NAC)
**N-アセチルシステイン(NAC)**は、炎症、酸化ストレス、グルタミン酸代謝に調節効果を持ち、BBB(血液脳関門)を通過する可能性のある、よく研究された抗酸化分子です。600〜3,600 mg/日という用量が、数週間から1年間の期間で使用されてきました。慢性統合失調症におけるその有効性は、約0.4の効果量で他の免疫調節介入と同様です。初回エピソード統合失調症ではより大きな有用性が見られるかもしれませんが、この分野の研究は少なく、より多くのデータが必要です。
双極性障害においても、NACは酸化ストレスの活性化に関与する神経進行経路に対し、補助薬としてすべての病期で肯定的な結果を示しています。初期の研究では、NAC治療がうつ病評価尺度で改善をもたらし、最近の研究ではアスピリンとの併用でより良い反応率が報告されています。これは双極性障害の治療における有望な新しい治療標的となりえます。
メタボリックシンドローム治療薬
メタボリックシンドロームと糖尿病は、一般的に炎症促進性活動の増加と関連しています。グルコース代謝の調節因子を用いて代謝調節不全を標的とすることは、一部の精神病患者における免疫活性化を減少させるための実行可能な戦略として提案されてきました。
ピオグリタゾンは、抗炎症作用と血糖調節効果を持つPPAR(ペルオキシソーム増殖因子活性化受容体)-ガンマ阻害剤で、ある研究では統合失調症の経過に有益な効果を示しています。同様に、メトホルミンなどのインスリン感受性調節因子やスタチンなどの脂質代謝調節因子も、炎症活性化を標的とする効果が報告されています。メタボリックシンドローム、糖尿病、脂質調節不全は統合失調症患者によく見られ、主要な治療法である非定型抗精神病薬がこれらの病態に寄与することが知られているため、患者はこれらの薬剤に曝される可能性が高いです。
双極性うつ病の急性期治療において、ピオグリタゾンは抗うつ効果を示す可能性が概念実証研究で示されています。しかし、その副作用負担が大きいため、リスクとベネフィットを確立するには、より大規模な臨床試験が必要です。
双極性障害と免疫システム
免疫活性化と双極性障害との関連性は、炎症と大うつ病との関連に関する研究と類似しています。血中炎症マーカーの増加、KYN経路の活性化、およびグルタミン酸とDAシステムにおける炎症関連の調節不全はすべて、双極性障害で報告されています。
双極性うつ病と単極性うつ病の比較
単極性および双極性の両方の被験者は、炎症促進性Th1の増加と、抗炎症性Th2およびTh17細胞の減少を経験する可能性があります。しかし、MDD(大うつ病性障害)ではT細胞の不均衡が持続する一方で、BD(双極性障害)では次の再発まで一時的に回復する可能性があります。遺伝子発現研究は、炎症性遺伝子の発現増加が臨床症状の発症に先行するものの、BDでは症状の寛解後に治まることを示しています。これらの違いのメカニズムは不明ですが、炎症促進性遺伝子活性化のリスクは、小児期の逆境、発症年齢、病気の持続期間、エピソードの頻度などの環境要因に関連している可能性があります。
病期分類または神経進行モデル
双極性障害の再発は、その後のエピソードのリスクを増加させ、重症化、寛解可能性の低下、認知/神経機能障害の増加につながります。このプロセスは「カインドリング」と呼ばれ、「病期分類モデル」または「神経進行モデル」と呼ばれます。免疫機能不全は、カインドリングを促進する病因因子として提唱されており、特に自然免疫因子に焦点が当てられています。
血漿CRPと双極性障害との関連性に関するメタアナリシスでは、急性躁病エピソード中にCRP濃度が著しく上昇することが報告されています。他の研究では、TNF、IL-6、IL-1の可溶性受容体抗体(IL-1RA)、およびsIL-2Rなどの炎症マーカーの血中レベル増加が急性双極性症状と関連付けられています。
アロスタシスと神経進行
BDの反復エピソード後の慢性的な免疫活性化は、「アロスタシス負荷」の増加に起因する可能性があります。これは、慢性的な反復ストレスの適応コストの蓄積を表します。反復エピソードがアロスタシス負荷をどのように増加させ、脳病変に寄与し、認知機能障害を促進するかを理解するには、さらなる研究が必要です。
免疫システムと双極性精神薬理学
いくつかの免疫療法が臨床試験で検討されてきましたが、研究数が少なく、サンプルサイズが小さいこと、薬剤の多様性のため、データは慎重に解釈する必要があります。サイトカイン拮抗薬に関する最近のメタアナリシスでは、標的グループ選択によって中程度に有益であることが示されました。しかし、インフリキシマブを用いた大規模研究では否定的な結果が報告されており、免疫マーカーに基づく炎症の厳密な定義の重要性が示唆されています。
**オメガ-3脂肪酸(DHA/EPA)**の使用を調査した対照研究では、当初の期待に反して否定的な傾向が見られます。メタアナリシスでは控えめな効果量が示されていますが、小規模なサンプル数の研究がプールされた効果量に強く影響していることが示されています。
双極性障害治療薬の抗炎症効果
リチウムなどの抗躁薬は、様々な抗炎症効果を発揮することが知られています。例えば、COX-2の減弱、IL-1の合成阻害、NF-κBの阻害などです。後者の効果は、リチウムがグリコーゲンシンターゼキナーゼ(GSK)-3ベータに及ぼす影響を介して媒介されると考えられます。また、リチウムはミクログリアの活性化とTLR-4の発現を減少させる可能性があり、バルプロ酸も同じ部位であるTLR-4を阻害する可能性があります。
結論(双極性障害における抗炎症薬)
これまでのところ、双極性障害を治療するための抗炎症剤の精神薬理学的試験は、病期分類モデルの理解の進歩と並行して進んできました。一般的に、約0.4の中程度の効果量が報告されており、広範な抗炎症薬にわたって中程度の抗うつ効果があることを示唆しています。しかし、ほとんどの研究では、炎症に基づいて患者を層別化していませんでした。したがって、免疫調節剤が双極性躁病および疾患の経過に与える有用性を、特に炎症が増加している文脈で検討するために、さらなる研究が必要です。
自閉症
自閉症における免疫調節不全は、出生前および出生後のリスク要因の複合的な影響に起因すると考えられています。母体感染症に起因する**母体免疫活性化(MIA)**や、母親の約20%に見られる母由来の抗脳自己抗体は、出生前のリスクの一部を構成します。出生後の環境は、免疫調節不全、炎症、および内因性自己抗体のやや異なるプロファイルによって特徴付けられます。
自閉症は、Th1/Th2サイトカイン産生の不均衡、NK細胞およびT細胞活性化の低下、TNFおよびIL-12の増加など、いくつかの免疫異常と関連しており、特に併存する胃腸症状を伴う患者で顕著です。自閉症患者は、HLA-DR-Bβ1*04および補体C4Bヌルアレルを含む自己免疫関連遺伝子の増加を示します。最近のメタ分析研究では、IL-1、IL-6、IL-8、IFN-ガンマ、およびMCP-1の血中濃度増加と、抗炎症性サイトカインTGF-ベータの減少が報告されています。
自閉症に対する免疫学的要素の証拠がある一方で、免疫異常と神経行動学的症状との関係は依然として議論の的です。小児期のワクチンが自閉症を引き起こすという主張は裏付けられておらず、免疫ベースの治療法も確実な有効性を示していません。しかし、デンマークの大規模な疫学研究では、子宮内での母体インフルエンザ感染への曝露が自閉症のリスクを2倍に増加させ、長期間の母体発熱エピソードはリスクを3倍に増加させることが判明しました。同様に、母体自己免疫疾患は、子どもの自閉症のリスクを34%増加させることが示されています。
動物研究も、子宮内または早期の炎症性活性化が自閉症のリスクを増加させる可能性を支持しています。例えば、妊娠中のアカゲザルに低用量のLPSを曝露すると、影響を受けた子孫の脳容積が有意に増加しました。これは、ヒトの自閉症児で繰り返し観察される所見です。免疫プロセスが脳の発達において中心的な役割を果たすことが認識されており、MIAのマウスモデルでは、出生前の免疫刺激が抗炎症性Th2型T制御性細胞を減少させ、同時にTh1型細胞によるIL-6およびIL-17の産生を増加させることが示されています。免疫学的に正常な骨髄細胞をMIA子孫に移植すると、自閉症様の行動変化が回復しました。
その他の疾患
大うつ病、双極性障害、統合失調症、自閉症以外の神経精神疾患の病因における免疫、特に炎症の役割には、注目が十分ではありませんでしたが、炎症の増加がほぼすべての種類の精神疾患の顕著な特徴であるという証拠が増えています。現在定義されている精神疾患で、炎症性バイオマーカーのレベル低下と確実に結びついているものはありません。
心的外傷後ストレス障害(PTSD)
ストレスと免疫システムとの関係を考えると、PTSDと炎症性活性化との間にも同様の関係が存在すると推測できます。健常対照と比較して、PTSD患者はIL-1、IL-2、IL-6、IFN-ガンマ、およびTNF-アルファが有意に高く、中程度から強いプール効果量を示しました。小児期のトラウマに曝露された個人は、ベースラインの末梢CRP、IL-6、およびTNF-アルファレベルが有意に上昇していました。大規模な研究では、血漿CRPがPTSD症状の出現と将来的に関連する可能性が報告されており、炎症がPTSDになりやすい素因となる可能性を示唆しています。また、最近の研究では、PTSDとCRPの間の双方向の遺伝的関連性が強調されており、社会経済的地位がPTSDのリスクに関する小児期のサポートと炎症プロセスの相互作用において潜在的な役割を果たす可能性も示唆しています。
これらの研究は、PTSDと末梢炎症との間の横断的および縦断的な関連性を報告しています。加えて、エンドトキシンを用いた免疫刺激は、NF-κBの発現増加を介して、PTSD患者においてより強力な炎症反応と関連しています。炎症関連の恐怖消去回路におけるシナプス可塑性の障害が、PTSDにおける行動機能不全の根底にある可能性があることが示されています。
うつ病やPTSDのようなストレス関連疾患を比較すると、ストレス誘発性の免疫病態生理が複雑で異質であることが示唆されます。PTSDにおける末梢炎症の増加は十分に文書化されているにもかかわらず、中枢の神経免疫活性化プロファイルとは異なる関連性を示すデータもあります。ミクログリアの反応は、根底にある精神病理学的症候群によって異なる可能性が高いです。
強迫性障害(OCD)
シデナム舞踏病のような連鎖球菌感染症に関連する小児自己免疫性神経精神症候群(PANDAS)は、A群β溶血性連鎖球菌感染によって誘発される抗神経抗体によって引き起こされます。シデナム舞踏病の小児は頻繁に強迫性障害症状を示し、OCDの突然の発症、チック、情動不安定、多動性、ADHDがA群β溶血性連鎖球菌感染後の小児で記述されています。最近のデータは、一般的なOCDも、TNF、IL-6、およびIL-1を含むいくつかのサイトカインのレベル増加と関連している可能性を示唆しています。
ニューロCOVID
SARS-CoV-2感染と精神疾患患者
SARS-CoV-2によって誘発される重度の病態は、感染の程度よりも誇張された宿主免疫応答の結果です。特定の神経学的症候群には、嗅覚消失、脳症、脳卒中が含まれます。また、細胞内インフラマソーム経路の活性化とKYN(キヌレニン)システム活性化が、短期的および長期的なSARS-CoV-2脳病態を永続させる上で関与していることも示唆されています。
精神疾患患者におけるSARS-CoV-2の陽性率は、統合失調症スペクトラム群で22.3%、気分障害群で25.4%、不安障害群で24.1%でした。医療記録に基づいた研究では、統合失調症、気分障害、不安障害と診断された患者の22%から25%がSARS-CoV-2陽性でした。加えて、精神疾患発症前の統合失調症スペクトラム障害の診断がある場合、SARS-CoV-2感染後の死亡率は2.67倍有意に増加することが関連付けられました。
神経学的症状
- 嗅覚消失/味覚消失(味覚喪失):SARS-CoV-2は嗅覚ニューロンに直接感染するのではなく、嗅覚神経の支持細胞である支持細胞に感染します。嗅球の急性炎症が神経画像研究で示されており、症状は軽度感染後によく見られますが、長期間持続する場合があります。
- せん妄と意識変容:入院中のSARS-CoV-2感染におけるせん妄の発症の根底には脳症性変化があります。血漿およびCSF(脳脊髄液)中のサイトカインと神経フィラメント軽鎖タンパク質レベルの上昇は、急性錯乱患者における病理学的および行動学的変化と相関します。過活動性アストログリアやミクログリア、細胞傷害性T細胞活性の増加も関連しています。
- 脳卒中:感染の急性期には、脳血管内皮を巻き込む深刻な炎症反応による脳卒中、脳出血、播種性脳症が頻繁に見られます。これは、SARS-CoV-2の主要な侵入経路である脳内皮細胞上のACE受容体の豊富さに起因すると考えられます。脳卒中は、最も損傷が大きく生命を脅かす神経学的COVID-19病態です。
行動症候群
SARS-CoV-2感染の精神症状に関するデータは現在進行中です。重症入院患者のコホートに基づいた情報が主ですが、軽度から中等度の感染患者の情報も考慮する必要があります。
- 認知障害:SARS-CoV-2感染後、特に非入院患者において、「メンタルフォグ」と表現される主観的な認知障害は、最も一般的な自己申告症状の1つです。注意力の低下、集中力の低下、そしておそらく記憶症状の障害が特徴です。症状は急性期に頻繁に見られますが、長期的な持続性はまだ不明です。
- 疲労:疲労は、エプスタイン・バーウイルス感染症のようないくつかのウイルス感染後によく見られ、SARS-CoV-2感染症の多くと類似しています。筋痛性脳脊髄炎/**慢性疲労症候群(ME/CFS)**との病理学的重複が研究されています。
神経精神医学的症状
最近のメタアナリシスレビューで神経精神医学的症状が検討されています。急性期には、抑うつ気分(33%)、不安(36%)、記憶障害(34%)、注意集中力障害(38%)、不眠症(42%)、錯乱(28%)が見られました。これらの認知症状は年齢とは独立しているようでした。追跡調査では、不安障害の診断の時点有病率は14.8%、抑うつは14.9%、PTSDは32.2%でした。症状重症度スコアは、追跡調査中に軽度から中等度の不安とうつ病のスコアを示しました。また、PTSD症状、特に侵入、回避、過覚醒症状の重症度が高いことが指摘されています。
向精神薬とCOVID-19治療薬
精神疾患患者におけるSARS-CoV-2曝露のリスクが高いことを考慮すると、向精神薬と外来COVID-19治療薬の併用リスクを再確認することは有益です。抗ウイルス併用薬であるパキロビッド(ニルマトレルビルとリトナビルの合剤)は、強力なCYP3A4阻害剤であるリトナビルを含みます。カルバマゼピンのような薬剤やセントジョンズワートのようなハーブは、パキロビッドの効果を低下させる可能性があります。
クロナゼパム、ジアゼパム、クロバザム、エスタゾラム、フルラゼパム、クロザピン、ルマテペロン、ルラシドン、クエチアピン、ピモジドでは重篤な毒性のリスクがあるため、パキロビッド開始前に中止し、治療終了後3日間は再開しないことが推奨されます。トラゾドン、アリピプラゾール、ハロペリドール、イロペリドン、リスペリドン、アルプラゾラム、ブスピロン、フルニトラゼパムは相互作用の可能性がある薬剤であり、必要に応じて安全に中止できない限り、パキロビッドを開始すべきではないと推奨されています。ジプラシドンとゾルピデムも潜在的なリスクがあり、気分が悪いと感じた場合に中止するよう患者に十分に説明することが推奨されています。
精神疾患における免疫活性化関連因子
様々な個人変数が、多様な精神病理学的状態における免疫と脳のコミュニケーションに影響を与えます。社会的逆境、ストレス、健康状態などの要因は既に述べられていますが、ここでは疾患カテゴリーを超えて影響を与える要因について概説します。
加齢
加齢は逆説的に、免疫防御の劣化(免疫老化)と組織炎症の基礎レベルの増加(炎症老化)と関連しています。炎症老化は、自然免疫細胞の過剰な炎症反応と関連しており、ベースラインおよび免疫刺激に対する反応において、炎症活動の増加または誇張につながります。この過剰な免疫応答は、病原体と戦ったり、免疫化に対する免疫応答を起こしたりする効率が低下します。
この炎症の過剰化は、しばしばマクロファージや単球などの免疫細胞における表現型の変化に起因し、TNF、IL-6、IL-1などのサイトカインやMCP-1などのケモカインの分泌増加、ひいてはCRPの合成増加を引き起こします。脳内のミクログリア細胞も同様に免疫応答プロファイルの誇張を発達させ、アストログリア細胞も脳免疫を増幅し誇張する可能性があります。
免疫細胞が、自然発生的に変異する腫瘍細胞や、ベータアミロイドやアルファシヌクレインなどのミスフォールドタンパク質の加齢に伴う蓄積によって「プライミング」されることが、一つの説明として考えられます。慢性脳血管疾患、糖尿病、肥満、外傷性脳損傷の間欠的なエピソードなどの他の脳損傷も寄与する可能性があります。プライミングされた細胞の誇張された免疫応答は、脅威を部分的に中和するのに役立つかもしれませんが、「副次的」な組織損傷を介して他の意図しない結果につながる可能性があります。
加齢関連脳疾患における自然免疫活性化を理解する上で、2つの異なる見解があります。一つは、グリア細胞のプライミングと炎症性バイアスが、細胞残骸やミスフォールドタンパク質のより効率的な除去に役立つというもの、もう一つは、脳における免疫細胞活動の誇張が、より大きな神経細胞死と神経変性につながる可能性があるというものです。両方の見解に真実があるかもしれませんが、これらの変化の生物学的意味を理解するには、さらなる研究が必要です。
獲得免疫応答は加齢とともに減少します。獲得免疫応答の低下は、増加した「チェックポイント」調節に起因する可能性があり、それによってアミロイドや他の残骸のクリアランスに有益な獲得免疫活動を抑制することが示されています。したがって、最近のチェックポイント阻害剤の開発と発見は、いつの日か脳の健康を改善し、ADなどの疾患を予防するかもしれません。
栄養、肥満、および活動
BMIが30 kg/m2を超える肥満は、神経免疫恒常性に対する一般的な脅威です。免疫系と血糖/脂質管理システムとの間には双方向の関連性が一貫して報告されています。肥満/高BMIは、CRPやIL-6などの炎症促進性マーカーを用いて測定される炎症活動の慢性的な低度増加と確実に結びついています。この普遍的な関連性は、特に精神疾患患者を含むすべての人口カテゴリーに共通しています。腹部脂肪組織の脂肪細胞は炎症性タンパク質と細胞を補充し、慢性炎症を引き起こすことが知られています。
一方で、炎症性分子も体重増加を引き起こす可能性があります。最近のデータは、炎症性分子が細胞のグルコース代謝を再プログラムし、インスリン抵抗性、高血糖、高脂血症を促進し、それによってメタボリックシンドロームを促進することを示しています。ストレスに起因する慢性的な交感神経活性化は、褐色脂肪組織のマクロファージにおける遺伝子発現の変化につながり、異常な体温調節と体重減少を引き起こします。
体重減少を目的としたライフスタイル修正は、一般的に慢性炎症活動の減少につながります。例えば、CRPおよび関連するサイトカインの減少は、「健康的」な地中海式ダイエットと関連しており、CRPおよびsTNFR2の増加は、高トランス脂肪/高カロリー食の摂取後に認められています。同様に、フィットネスを促進する活動と身体運動は、炎症促進性分子とその活動を低下させることがよく文書化されています。逆に、座りがちなライフスタイルは、精神疾患患者を含むいくつかの人口グループにおいて、炎症促進性活動の有意な増加と関連しています。さらに、肥満は、加齢、ストレス、喫煙/飲酒、慢性疾患などの他の炎症促進性因子と結合して、慢性炎症活動を強調する傾向があります。
炎症の増加は、うつ病患者の異なるサブグループを特徴付ける可能性があります。最近のほとんどの定式化は、肥満と早期のライフストレスの存在が、高炎症を伴ううつ病患者のサブグループを表現型的に特定する可能性があると結論付けています。高BMIと高炎症の患者では、抗うつ薬治療へのL-メチル葉酸増強療法の反応が改善することが見られました。早期のライフストレスとBMIの間の関連性も強いと考えられます。
肥満は精神疾患患者の慢性炎症の病因において実質的な役割を果たしており、炎症状態を直接的に高める可能性があります。加えて、統合失調症やPTSDなどの疾患における他の疾患メカニズムの炎症ポテンシャルを悪化させ、活動不足、喫煙/飲酒、ストレスなどのライフスタイル因子の炎症促進ポテンシャルを増強する可能性があります。
マイクロバイオーム
マイクロバイオータ(微生物叢)の詳細な記述は本章の範囲を超えるため、読者はこの分野の総説を参照されたい。特定の場所に存在する微生物の集合はマイクロバイオータと呼ばれ、その集合的な遺伝物質はマイクロバイオームと呼ばれる。人体には大量のマイクロバイオータが存在し、そのほとんどは消化器系に位置している。人体内で見つかる遺伝物質の大部分は微生物の遺伝子で構成されていると述べられている。一部の微生物侵入者は深刻な免疫刺激を引き起こすが、ヒトのマイクロバイオータは主に共生的であり、宿主の炎症反応を刺激しないことが多い。ヒトの腸内には60以上の属からの微生物が生息している可能性が高い。微生物DNAの解析における最近の進歩は、宿主の脳の健康の様々な側面に対するマイクロバイオータの影響のより良い理解につながっている。代謝産物や神経伝達物質の合成、迷走神経の活性化、免疫系の抗炎症経路の活性化など、脳との間の複数の相互作用様式がすべて報告されている。
ヒトの腸内マイクロバイオームの定着は、出生時に、自然分娩では主に母体の産道への曝露によって、帝王切開では母体の皮膚への曝露によって始まる。早産、母乳育児、ペットの存在、カロリー摂取量、肥満といった他の要因も、発達中のマイクロバイオームに影響を与える可能性がある。食事摂取は、腸内マイクロバイオームの調節における重要な要因であると考えられている。例えば、繊維豊富な地中海食はプレボテラ属に関連し、高カロリーの西洋食はバクテロイデス属に関連する。腸と脳の間には複雑な双方向の関係がある。腸内マイクロバイオータが脳の発達と機能に影響を与えるという見解を支持する重要な前臨床データが存在するようである。興味深いことに、脳機能もマイクロバイオームを混乱させる可能性があるという新たな証拠がある。ストレスは様々な種でマイクロバイオータの組成を変化させ、プロバイオティクスは動物モデルにおいてストレスの影響を逆転させることが示されている。
初回エピソード精神病の被験者の間で、ラクトバチルス属およびビフィドバクテリウム属の有病率の低下が認められた。重要なことに、マイクロバイオータの違いは、追跡調査期間中の陰性症状の重症度と寛解の質を予測した。統合失調症患者からは、中咽頭マイクロバイオームの違いも報告された。プロバイオティクス治療は知覚できる臨床的利益をもたらさなかったが、統合失調症患者群における重度の腸の問題を改善した。双極性障害では、フィルミクテス門の2つの別個の属における違いと、プロバイオティクス補充に対する陽性反応が認められた。
精神疾患におけるマイクロバイオームの関与を示唆する最も説得力のある証拠は、うつ病の研究から得られている。前臨床データもまた、プロバイオティクスおよびプレバイオティクス療法がげっ歯類モデルにおいて抑うつ行動を軽減する可能性があることを示している。複数の系統的レビューは、プロバイオティクスがうつ病患者の気分を改善する可能性があることを示している。特筆すべきことに、うつ病患者からの腸内マイクロバイオームの移植は、げっ歯類においてより大きな抑うつ的および不安様行動を誘発した。いくつかの研究では、うつ病患者において微生物組成の変化が認められ、フェアカルバクテリウム属の相対的存在量の減少が、うつ病の重症度と負の相関を示していた。
要約すると、精神疾患の発症は、少なくとも部分的にはマイクロバイオータの免疫調節効果の喪失に関連している可能性がある。マイクロバイオータが炎症性病態を引き起こしたり変化させたりする正確なメカニズムはまだ不明である。しかし、炎症促進的および抗炎症的な傾向を持つマイクロバイオータ間のバランスが、ストレス時に崩れ、炎症促進性微生物の増殖を誇張させることにつながる可能性が提唱されている。この変化は、消化管粘膜の活性化の可能性をもたらし、炎症細胞や微生物産物が直接全身循環に放出されることにつながる可能性がある。この「リーキーガット(腸管壁浸漏)」仮説は、ストレス関連障害における慢性炎症の病因においてかなりの注目を集めている。
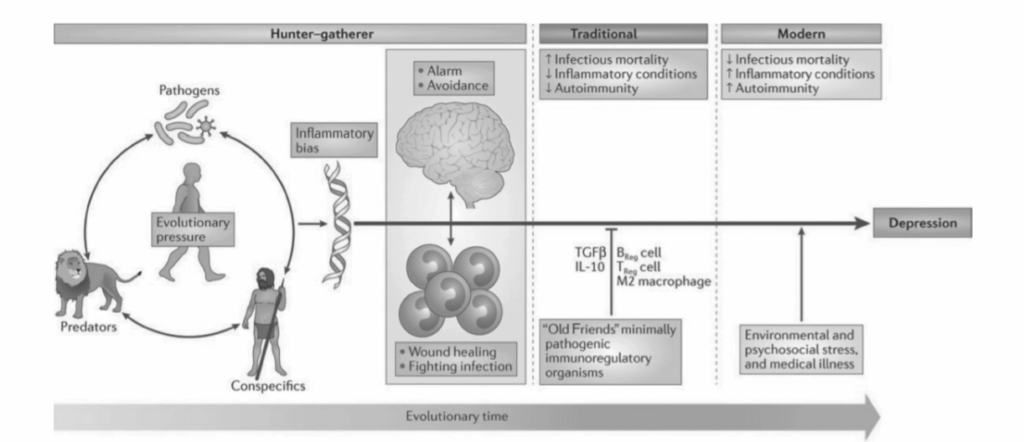
ヒトと微生物の共生―「古くからの友人」仮説。図1.13-6は、進化の圧力と現在の生活条件への適応が、どのようにして炎症傾向の高まりをもたらした可能性があるかを示している。研究では、うつ病を促進する遺伝子が、少なくとも部分的には、祖先の環境におけるうつ病の多くの生理学的および行動的側面が病原体に対する宿主防御を強化した可能性があるために、ヒトゲノム内で進化し存続してきたと主張している。マイクロバイオータに加えて、さらに2つのクラスの共生生物(偽共生生物および寄生虫)は、集合的に「古くからの友人」、すなわち、炎症誘発性活動を抑制しつつ健康な免疫機能を促進するヒト内部に生息する生物と呼ばれている。最近の一部の著者は、現代の環境慣行が「古くからの友人」との人間の関係を破壊し、より原始的な環境よりも工業化社会で一般的な免疫基盤の病状の有病率の増加につながったと仮説を立てている。
重要なin vitroおよびin vivoの前臨床データは、「古くからの友人」生物の3つのクラスすべて(マイクロバイオータ、偽共生生物、および寄生虫)が、自己免疫疾患、アレルギー性疾患、炎症性腸疾患、ならびに新生物および特定の感染症の動物モデルにおいて、病状を予防または改善する可能性があり、炎症活動の低減を介してそうすることを示している。疾患の病因におけるヒトと微生物およびヒトと寄生虫の相互作用は、生物ベースの介入が、統合失調症、自閉症、および気分障害の発症を防ぐために早期に実施されれば、有望である可能性を示唆している。
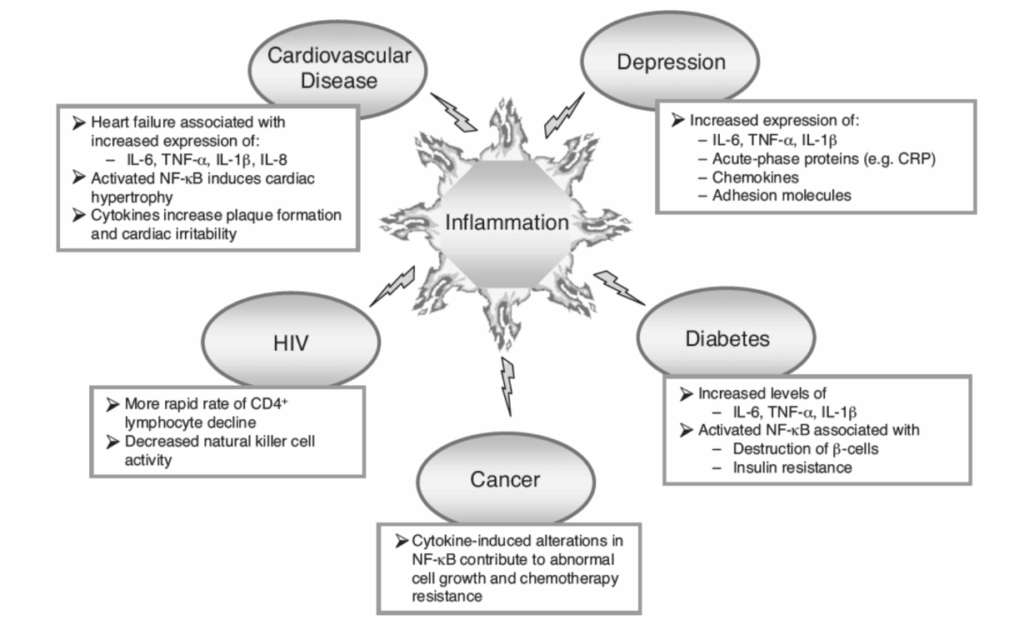
図1.13-6。病原体、捕食者、および(競争相手などの)ヒト同種個体との相互作用から生じた初期の進化的圧力は、感染との戦いおよび創傷治癒のためのエネルギーを温存しつつ、攻撃に対する警戒を維持する免疫学的および行動的反応の統合された一連を含む炎症バイアスをもたらした。この炎症バイアスは、ヒトの進化の大部分において、伝統的な(すなわち、地方の)環境における最小限の病原性で免疫寛容誘導性の微生物への曝露によって抑制されてきたと考えられており、これらの微生物は制御性T(TReg)細胞、制御性B(BReg)細胞、および免疫調節性M2マクロファージの誘導、ならびに抗炎症性サイトカインであるインターロイキン-10(IL-10)およびトランスフォーミング増殖因子ベータ(TGF-β)の産生を特徴とする免疫応答を生じさせた。現代では、より発展した社会の衛生化された都市環境は心理的課題に満ちているが、ヒトの進化の大部分にわたって罹患率および死亡率の主要な原因であった種類の感染性課題は概して欠如している。伝統的な免疫学的チェックアンドバランスがない場合、現代世界の心理的課題は、うつ病を含む様々な炎症関連疾患の高い発生率など、決定的な負債となる祖先の免疫学的および行動的レパートリーを誘発する。(Miller A, Raison C. The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nat Rev Immunol 2016;16:22-34. doi: 10.1038/nri.2015.5 より転載)
睡眠
睡眠リズムとサイクルの障害は、精神医学の分野では遍在している。最近のほとんどの著者は、睡眠を従来の精神医学的診断の境界を超えるトランス診断的マーカーとみなしている。睡眠と炎症を結びつける大量のデータを考慮し、読者はこの分野の原著論文を参照されたい。自然に生じる睡眠は、炎症性サイトカインの産生と炎症細胞の分布を制御することにより、免疫系を調節する。睡眠が、HPA軸やSNSを含むストレス応答系の機能を調節することはよく知られている。自然睡眠中および睡眠不足の状態で免疫マーカーを繰り返しサンプリングした方法論的に厳密な研究は、興味深い結果を生み出している。IL-6の全身レベルは午後7時から午前5時の間にピークに達する傾向があり、夜間の睡眠は、夜間のIL-6の増加と夜間のTNFの減少における唯一の決定要因である可能性がある。実験的な睡眠不足は、夜間のIL-6レベルを低下させ、IL-6分泌の夜間のピークを遅らせ、夜間の単球によるTNF産生を減弱させる可能性がある。徐波睡眠時間の短縮と急速眼球運動(REM)睡眠時間の増加を含む睡眠障害のある被験者は、日中のIL-6の増加と夜間の産生の減少を示す。最後に、夜間の睡眠は、夜間に可溶性IL-6受容体(sIL-6R)の濃度を増加させ、通常はIL-6の効果に応答しない神経細胞への影響力を高めるようである。大規模なメタアナリシスでは、睡眠中断は血漿中のCRPおよびIL-6の上昇と関連していた。 より決定的なことに、心理社会的ストレッサーや逆境は、睡眠効率と質を妨げることによって炎症に影響を与える可能性がある。うつ病における睡眠構築の特徴的な変化は、そのような変化の典型的な例である。この睡眠サイクルの変化が、単球などの免疫細胞において炎症性転写状態を誘発し、IL-6やTNFなどのサイトカインの放出パターンの変化につながるという仮説が立てられている。 対照的に、末梢の炎症の増加も睡眠を妨げる可能性がある。例えば、ウイルス感染や細菌感染は、ノンレム睡眠とレム睡眠のバランスを変化させることがよく知られており、この効果は炎症性サイトカインによって媒介される。迷走神経に位置する炎症の神経センサーが、免疫シグナルを脳の睡眠中枢に伝達すると考えられている。したがって、迷走神経の切除は、睡眠リズムに対する免疫分子の効果をなくすようである。研究の重要な領域は、睡眠障害と炎症老化(インフラメイジング)との関係を含んでいる。特筆すべきことに、一晩の部分的な睡眠不足は、免疫細胞における老化の加速と細胞老化の増加を示唆するゲノムおよび転写の変化を誘発した。ADの初期または前駆症状期は、神経炎症の増加と睡眠障害に関連している。これらの両方のプロセスが組み合わさってADの疾患進行を引き起こすと提唱されている。神経炎症は、アミロイドおよびタウタンパク質に曝露されたプライム化ミクログリア(持続的な活性化状態に陥ったミクログリア)に起因すると考えられている。したがって、神経炎症と睡眠不足は互いに悪化させ、疾患の進行に寄与する可能性がある。 特筆すべきことに、睡眠障害はまた、医学的疾患(高血圧や糖尿病など)のリスク、ライフスタイル要因(座りがちな生活様式や社会的孤立)、および睡眠障害(睡眠時無呼吸症候群、レム睡眠行動障害)にも役割を果たしており、これらはすべて認知症のリスクを高める可能性がある。最後に、うつ病における睡眠障害の関係は、文献でよく研究されている。持続的な不眠症は、うつ病再発の強力な予測因子であり続ける。特筆すべきことに、最近の研究は、エンドトキシン負荷などの炎症性刺激に対する抑うつ反応が、睡眠不足によって増幅される可能性があることを示している。あるいは、既存の炎症性疾患を有する被験者における睡眠障害の発症は、しばしばうつ病の発症を誘発する可能性がある。したがって、(睡眠薬によって誘発される睡眠とは対照的に)自然な睡眠を改善するように見える行動睡眠療法の使用は、うつ病の発症に対する睡眠障害の影響を軽減するための有望な道を提供する可能性がある。
本章の結論
精神疾患における破綻した免疫-脳コミュニケーションは、複雑な因果連鎖の累積的影響を表している可能性がある。しかし、その複雑さにもかかわらず、免疫-脳コミュニケーションの病態を十分に把握することは、我々の患者の生活を改善しうる、潜在的に修正可能な多くのリスク要因をより良く対象とするのに役立つ。
参考文献一覧
本参考文献リストは、精神疾患と免疫系の関連性に焦点を当てた研究を網羅しています。各文献は、特定の精神疾患、免疫学的メカニズム、治療的介入、および関連する生物学的経路について深く掘り下げています。
1. 精神疾患全般と炎症・免疫系:
- Dantzer R, O’Connor JC, Freund GG, Johnson RW, Kelley KW. 炎症から病気、そしてうつ病へ:免疫系が脳を支配するとき。Nat Rev Neurosci. 2008;9(1):46-56.
- Haroon E, Raison CL, Miller AH. 精神神経免疫学と神経精神薬理学の出会い:行動に対する炎症の影響のトランスレーショナルな意義。Neuropsychopharmacology. 2012;37(1):137-162.
- Miller AH, Raison CL. うつ病における炎症の役割:進化的必須事項から現代の治療標的まで。Nat Rev Immunol. 2016;16(1):22-34.
- Meyer JH, Cervenka S, Kim MJ, Kreisl WC, Henter ID, Innis RB. 精神疾患における神経炎症:PETイメージングと有望な新ターゲット。Lancet Psychiatry. 2020;7(12):1064-1074.
- Salvador AF, de Lima KA, Kipnis J. 免疫系による神経調節:サイトカインに焦点を当てて。Nat Rev Immunol. 2021;21(8):526-541.
2. 大うつ病性障害 (MDD) と炎症・免疫系:
- Lanquillon S, Krieg JC, Bening-Abu-Shach U, Vedder H. 大うつ病性障害におけるサイトカイン産生と治療反応。Neuropsychopharmacology. 2000;22(4):370-379.
- Shelton RC, Miller AH. 食べて死(そして絶望)に至る私たち:肥満と炎症のうつ病への寄与。Prog Neurobiol. 2010;91(4):275-299.
- Haroon E, Daguanno AW, Woolwine BJ, Goldsmith DR, Baer WM, Wommack EC, 他. 抗うつ薬治療抵抗性は、大うつ病性障害患者における炎症マーカーの増加と関連している。Psychoneuroendocrinology. 2018;95:43-49.
- Roman M, Irwin MR. うつ病における新規神経免疫療法の臨床的展望:これまでに分かっていること。Brain Behav Immun. 2020;83:7-21.
- Frank P, Jokela M, Batty GD, Cadar D, Steptoe A, Kivimaki M. 全身性炎症とうつ病の個別症状との関連:15の人口ベースコホート研究のプール解析。Am J Psychiatry. 2021;178(12):1107-1118.
- Strawbridge R, Arnone D, Danese A, Papadopoulos A, Herane Vives A, Cleare AJ. うつ病における炎症と治療への臨床反応:メタアナリシス。Eur Neuropsychopharmacol. 2015;25(10):1532-1543.
- Rosenblat JD, McIntyre RS. うつ病に対するミノサイクリンの有効性と忍容性:臨床試験の系統的レビューとメタアナリシス。J Affect Disord. 2018;227:219-25.
- Lucido MJ, Bekhbat M, Goldsmith DR, Treadway MT, Haroon E, Felger JC, 他. アヘドニアの幇助と教唆:脳への炎症の影響と薬理学的意義。Pharmacol Rev. 2021;73(3):1084-1117.
- Kiraly DD, Horn SR, Van Dam NT, Costi S, Schwartz J, Kim-Schulze S, 他. 治療抵抗性うつ病における末梢免疫プロファイルの改変:ケタミンへの反応と治療結果の予測。Transl Psychiatry. 2017;7(3):e1065.
3. 双極性障害と炎症・免疫系:
- Dargél AA, Godin O, Kapczinski F, Kupfer DJ, Leboyer M. 双極性障害におけるC反応性タンパク質の変化:メタアナリシス。J Clin Psychiatry. 2015;76(2):142-150.
- Fernandes BS, Steiner J, Molendijk ML, Dodd S, Nardin P, Goncalves CA, 他. 双極性障害の気分スペクトラム全体におけるC反応性タンパク質濃度:系統的レビューとメタアナリシス。Lancet Psychiatry. 2016;3(12):1147-1156.
- Rosenblat JD. 双極性障害の治療における免疫系の標的化。Psychopharmacology (Berl). 2019;236(10):2909-2921.
4. 統合失調症と炎症・免疫系:
- Brown AS. 統合失調症のリスク因子としての出生前感染。Schizophr Bull. 2006;32(2):200-202.
- Cho M, Lee TY, Kwak YB, Yoon YB, Kim M, Kwon JS. 統合失調症に対する抗炎症薬の補助的使用:ランダム化比較試験のメタアナリシス的調査。Aust N Z J Psychiatry. 2019;53(8):742-759.
- Miller BJ, Goldsmith DR. 統合失調症の免疫表現型に向けて:進捗、潜在的メカニズム、および将来の方向性。Neuropsychopharmacology. 2017;42(1):299-317.
5. 心的外傷後ストレス障害 (PTSD) と炎症・免疫系:
- Eraly SA, Nievergelt CM, Maihofer AX, 他; Marine Resiliency Study Team. 心的外傷後ストレス障害リスクのバイオマーカーとしての血漿C反応性タンパク質の評価。JAMA Psychiatry. 2014;71(4):423-431.
- Bhatt S, Hillmer AT, Girgenti MJ, 他. PTSDは神経免疫抑制と関連している:PETイメージングおよび死後転写産物研究からの証拠。Nat Commun. 2020;11(1):2360.
6. 強迫性障害 (OCD) と免疫系:
- Marazziti D, Mucci F, Fontenelle LF. 免疫系と強迫性障害。Psychoneuroendocrinology. 2018;93:39-44.
7. 自閉症スペクトラム障害 (ASD) と免疫系:
- Meltzer A, Van de Water J. 自閉症スペクトラム障害における免疫系の役割。Neuropsychopharmacology. 2017;42(1):284-298.
8. その他の関連トピック:
- Haroon E, Miller AH, Sanacora G. 炎症、グルタミン酸、グリア:気分障害における三重苦。Neuropsychopharmacology. 2017;42(1):193-215. (神経伝達物質と免疫系の関連)
- Schwarcz R, Stone TW. キヌレニン経路と脳:課題、論争、そして展望。Neuropharmacology. 2017;112(Pt B):237-247. (キヌレニン経路と精神疾患)
- Irwin MR. 睡眠と炎症:病気と健康におけるパートナー。Nat Rev Immunol. 2019;19(11):702-715. (睡眠と免疫系)
- Franceschi C, Santoro A, Capri M. 免疫老化と炎症老化の複雑な関係:新しい生物医学的展望に関する特集号。Semin Immunopathol. 2020;42(5):517-520. (老化と炎症)
- Pollak TA, Lennox BR, Müller S, 他. 自己免疫性精神病:自己免疫起源が疑われる精神病の診断と管理へのアプローチに関する国際的コンセンサス。Lancet Psychiatry. 2020;7(1):93-108. (自己免疫性精神病)
- Rogers JP, Chesney E, Oliver D, 他. 重症コロナウイルス感染に関連する精神医学的および神経精神医学的症状:COVID-19パンデミックとの比較を含む系統的レビューとメタアナリシス。Lancet Psychiatry. 2020;7(7):611-627. (COVID-19と精神症状)
- Solomon T. SARS-CoV-2による神経感染-これまでの経緯。Nat Rev Neurol. 2021;17(2):65-66. (SARS-CoV-2の神経感染)
- Schou TM, Joca S, Wegener G, Bay-Richter C. COVID-19の精神医学的および神経精神医学的後遺症-系統的レビュー。Brain Behav Immun. 2021;97:328-348. (COVID-19の後遺症)
- Marzolini C, Kuritzkes DR, Marra F, Boyle A, Gibbons S, Flexner C, 他. COVID-19抗ウイルス薬ニルマトレルビル/リトナビル(パクスロビド)と併用薬との間の薬物相互作用管理に関する推奨。Clin Pharmacol Ther. 2022;112(6):1191-1200. (COVID-19治療薬の薬物相互作用)
- Bastiaanssen TFS, Cryan JF. 精神衛生と薬物反応におけるマイクロバイオータ-腸-脳枢軸:方向性と因果関係の解析。Int J Neuropsychopharmacol. 2021;24(3):216-220. (腸脳軸)
- Vasupanrajit A, Jirakran K, Tunvirachaisakul C, Maes M. 自殺企図は活性化された免疫炎症、ニトロ酸化、および神経毒性経路と関連している:系統的レビューとメタアナリシス。J Affect Disord. 2021;295:80-92. (自殺と免疫炎症)

