- 🧬 3 精神医学遺伝学
- 🔬 精神医学遺伝学における手法
- 👥 臨床疫学:双生児、家族、および養子縁組研究
- 🧬 分子遺伝学的手法
- 🔎 ゲノムワイド関連解析 (GWAS)
- 📈 図3-1 双生児研究に基づく総遺伝率とSNP遺伝率の比較
- 🧬 GWASによる研究の展望
- 🌍 GWAS研究における祖先の偏りと公平性
- 🧬 ポリジェニック・リスク・スコア(PRS)
- 📊 図3-3 共通障害の遺伝率と共遺伝率
- 🧬 シーケンス研究 (Sequencing Studies)
- 🛡️ 高リスク研究
- 🧬 精神障害のエピジェネティクス
- 🍻 アルコール使用障害 (AUD)
- 🧠 アルツハイマー病 (AD)
- 🧠 図3-4 アルツハイマー病 (AD) のゲノムワイド関連解析のマンハッタンプロット
- 😠 反社会性パーソナリティ障害 (AP)
- 🔬 細胞遺伝学的研究
- 🧪 生物学的マーカー
- 😟 不安障害 (Anxiety Disorders)
- 🧠 注意欠陥多動性障害 (ADHD)
- 🧩 自閉スペクトラム症 (ASD) (広汎性発達障害)
- 🧩 表3-1 自閉スペクトラム症(ASD)の個人に見られるより一般的なコピー数多型のリスト
- 🧩 自閉症の遺伝学:最近の報告
- 🧬 図3-5 自閉スペクトラム症(ASD)と関連する稀な変異を含む遺伝子
- 🧩 自閉スペクトラム症のゲノムワイド関連解析 (GWAS)
- 💊 薬物使用障害 (DUDs)
- 🍽️ 摂食障害
- 🧠 知的障害 (ID)
- 😔 気分障害
- 2. 感情スペクトラム
- 3. 連鎖研究
- 4. エンドフェノタイプ
- 5. 遺伝子発現研究
- 6. 高リスク研究
- 7. 双極性障害のGWAS研究
- 🧼 強迫性障害 (OCD)
- 👻 統合失調症
- 🤕 身体化障害(身体症状症)
- 😫 トゥレット症候群
- 👨👩👧👦 遺伝カウンセリング
- 👨👩👧👦 表3-4 遺伝カウンセリングのための家族研究データ
🧬 3 精神医学遺伝学
John I. Nurnberger, Jr, MD, PhD
Wade Berrettini, MD, PhD
🔬 精神医学遺伝学における手法
ゲノムワイド研究(シーケンス、対立遺伝子連関、コピー数多型 (CNV)、転写に関する)の出現により、遺伝学の分野で科学革命が起こりました。新しい解析ツールとバイオインフォマティクスのツールにより、これまでになく大規模で複雑なマルチオミクスデータセットの解析が可能になりました。同時に、ゲノムにおける制御遺伝子座の知識基盤が広がり、ゲノムのイントロン領域と遺伝子間領域の機能に関する理解が深まりました。
これらの進歩を活用して、ほとんどの神経精神医学的疾患のリスクに影響を与える遺伝子変異が特定されてきました。現在、ほとんどの神経精神医学的疾患について、特定の一般的なおよびまれなリスク増加変異を裏付ける確固たるエビデンスが存在します。
👥 臨床疫学:双生児、家族、および養子縁組研究
特定のヒトの現象が実質的に遺伝的影響を受けているかどうかを確認するために、3種類の集団遺伝学研究(双生児研究、家族研究、養子縁組研究)が実施されています。
- 双生児研究一卵性双生児(MZ)は、2人の個人が各遺伝子についてまったく同じDNA配列を持つという自然実験を表すという事実にこの研究は基づいています。これに対し、**二卵性双生児(DZ)はDNA配列の50%を共有しており、他の兄弟姉妹のペアと遺伝的に類似している程度は変わりません。遺伝的要因によって影響を受ける現象は、DZ双生児と比較してMZ双生児でより「一致」(類似)**するはずです。
- 家族研究家族研究は、障害の遺伝に関して3つの重要な疑問に答えることができます。
- 罹患している被験者の親族は、対照被験者の親族と比較して、その障害のリスクが増加していますか?
- ある疾患を持つ個人の親族の中で、対照被験者の親族と比較して、増加した割合で見られる他の障害は何ですか?スペクトラムはありますか?
- 特定の遺伝様式を識別できますか?すべての主要な精神障害は、現在、多遺伝子性かつ多因子性であると考えられています。
- 養子縁組研究養子縁組研究では、4つの親族グループで障害のリスクが評価されることがあります。
- 罹患している養子の養育親族
- 罹患している養子の生物学的親族
- 対照養子の養育親族
- 対照養子の生物学的親族
分離分析
分離分析(Segregation analysis)は、家族における疾患のパターンが特定の伝達様式と一貫しているかどうかを決定するために使用されることがあります(単一の遺伝子が分散の実質的な部分を占める病態に最も有用です)。
主要な精神障害の複雑性のいくつかを以下に示します。
🧬 主要な精神障害の複雑性 主要な精神障害に見られる複雑性のいくつかは以下の通りです。
浸透率の変動(Variable penetrance):強い遺伝的素因を持つ一部の個人が疾患を発症しないこと。
フェノコピー(Phenocopies):遺伝的素因が非常に限定的であるにもかかわらず、疾患の症状を発症する個人。
遺伝的異質性(Genetic heterogeneity):リスクを増加させる複数の対立遺伝子の組み合わせが、同じ症候群を生み出す可能性があること。
症候群の診断境界が不確かである場合がある。
多面発現性(Pleiotropy):同じ対立遺伝子が、集団において様々な表現型のリスクを増加させる可能性があること。
🔗 連鎖解析 (Linkage Analysis) 任意の遺伝子座において、各個人は、その遺伝子座を定義するDNA配列(対立遺伝子)の2つのコピーを持っています。これらの対立遺伝子のうち、一方は母親から、もう一方は父親から受け継がれます。これらの対立遺伝子は、等しい確率(すなわち1/2)で、2つの対立遺伝子のうちの1つが各子孫に伝達されます。
2つの遺伝子座が染色体上で互いに「近い」場合、それらの対立遺伝子は一緒に(独立してではなく)遺伝する傾向があり、それらは「連鎖した」遺伝子座として知られています。減数分裂の間、相同染色体間で乗換え(組み換えとしても知られる)が起こる可能性があり、それによって連鎖した遺伝子座の対立遺伝子が常に一緒に遺伝するわけではないという観察が説明されます。
2つの連鎖した遺伝子座間で乗換えが起こる頻度は、染色体上のそれらの間の距離に直接比例します。実際、2つの連鎖した遺伝子座間の遺伝的距離は、その2つの遺伝子座間の組み換えのパーセンテージという観点から定義されます(この値はシータ (θ)として知られています)。染色体上で「遠く」離れている遺伝子座は、一緒に遺伝する可能性が1/2であり、連鎖していません。したがって、シータの最大値は0.5ですが、最小値は0です。連鎖解析は、2つ以上の遺伝子座のシータを推定するための手法です。
連鎖解析は、医学におけるメンデル遺伝病の研究で非常に価値がありましたが、主要な精神障害の研究では一般的に有用ではありませんでした。なぜなら、これらの障害の遺伝パターンは複雑であるように見えるためです。
分子遺伝学技術の進歩に伴い、ほとんどの場合、ゲノムワイド関連解析やシーケンス研究が連鎖研究に取って代わりました。しかし、連鎖研究は影響力の大きい稀な遺伝子座を特定しています。例としては、アミロイド前駆体タンパク質、またはプレセニリン1、あるいはプレセニリン2によって引き起こされる早期発症型アルツハイマー病(AD)の3つのサブタイプが含まれます。
【引用文献】
Libiger O, Schork NJ: A basic overview of contemporary human genetic analysis strategies. In: Nurnberger JI Jr, Berrettini W (eds). Principles of Psychiatric Genetics. Cambridge: Cambridge University Press, 2012.
連関研究 (Association Studies) と候補遺伝子研究 (Candidate Gene Studies) 連関研究では、2つの集団における特定の遺伝子座の対立遺伝子の頻度を比較します。一方の集団は疾患を持つ無関係の個人で構成され、「対照」集団は通常、民族的に類似した疾患を持たない無関係の個人で構成されます。特定の対立遺伝子が、当該疾患に一般的に素因を与える場合、その対立遺伝子は、対照集団と比較して疾患を持つ集団でより頻繁に生じるはずです。
潜在的な落とし穴 ケース・コントロール連関アプローチには潜在的な落とし穴があります。2つの集団が民族的背景について注意深くマッチングされていない場合、偽陽性の結果が生じる可能性があります。
これに代わる対照群の一つに、罹患した個人の両親がいます(罹患した子供に伝達されなかった対立遺伝子が「対照群」を構成します。これは**伝達不均衡テスト(TDT: Transmission Disequilibrium Test)**として知られています)。
ゲノムワイド関連解析 (GWAS) への移行 あらかじめ選択された「候補遺伝子」を用いた連関研究は、数十年前には頻繁に行われていましたが、2006年頃に**ゲノムワイド関連解析(GWAS: Genome-Wide Association Studies)**が出現して以来、一般的ではなくなりました。
レビューにより、ほとんどの精神障害の候補遺伝子仮説は、GWAS研究によって支持されていないことが示されており、一般的に、一般的な対立遺伝子が精神障害と関連しているとする初期の陽性報告のほぼ全てが、現在では偽陽性と見なされています。
注目すべき例外には、遅発型アルツハイマー病におけるAPOE4対立遺伝子(rs7412およびrs429358)の関連と、オピオイド使用障害におけるOPRM1対立遺伝子(rs1799971)の関連が含まれます。
【引用文献】
Seifuddin F, Mahon PB, Judy J, et al: Meta-analysis of genetic association studies on bipolar disorder. Am J Med Genet B Neuropsychiatr Genet 2012 Jul; 159B(5):508-518. doi: 10.1002/ajmg.b.32057. Epub 2012 May 9. PMID: 22573399.
🧬 分子遺伝学的手法
一塩基多型(SNP: single nucleotide polymorphisms)として知られる一般的なDNAマーカーのクラスが、現在、連関を検出するために通常使用されています。SNPとは、DNA配列の一つの塩基における変異のことです(例:GATACAとGATGCAを比較すると、4番目のヌクレオチドは「A」対立遺伝子または「G」対立遺伝子のいずれかになり得ます)。ヒトゲノムの30億塩基全体にわたって均等に分布しており、少なくとも数百万個の一般的な(少なくとも一つの民族で対立遺伝子頻度が1%を超える)SNPが存在すると推定されています。
🔎 ゲノムワイド関連解析 (GWAS)
GWASは2006年に導入されました。これらは、チップ技術によって可能になりました。このチップでは、約500万個もの一般的なSNPが、個人の断片化されたゲノムDNAをチップとインキュベートすることによってジェノタイプ決定されます。
この手法により、ゲノム内の実質的にすべての遺伝子を複数のSNPで調べることが可能になります。また、連鎖不平衡(近傍の変異が家族内だけでなく集団全体で一緒に伝達されるという事実)のため、実際にテストされたSNPからある程度離れた対立遺伝子との連関も検出可能です。
データの解釈と統計的要件
GWAS研究の主な限界はデータ解釈です。同時テストの数が膨大であるため、複雑な統計的補正が必要です。これは、すべてのイベントが独立しているわけではないためです。
現在受け入れられている標準は、GWAS研究における表現型とのSNP連関に対する**$p$値が5 $\times$ $10^{-8}$ 以下**であることです。これは、経験的な第一種過誤の確率に基づいています。
精神障害に関連する変異の効果量は一般的に非常に小さい(オッズ比が1.01〜1.2が標準)ため、この閾値を満たす$p$値を達成するには、非常に大きなサンプルサイズが必要です。身長、体重、血圧、認知能力、疾患リスクなど、数千もの複雑な形質が、現在、1,000,000人に近づくかそれを超えるサンプルサイズでGWAS手法によって広範に分析されています。
このようなサンプルは、現在、複数の大陸にまたがる複数の施設が関与する広範な共同研究によってのみ達成可能です。対照群と比較して、民族的背景が類似している集団からケースとコントロールのセットを選出する必要があります。これは、祖先に基づく対立遺伝子頻度に広範な変動があるためです。この民族的変動性は、通常、多次元尺度構成法(MDS: multidimensional scaling)または類似の方法を使用して正式に評価されます。
精神医学への応用
GWAS手法は、現在、精神障害において有用であることが証明されており、統合失調症、双極性障害、および単極性抑うつについて数百もの一般的なリスク対立遺伝子が特定され、他の多くの障害についても研究が進行中です。
最近の統計分析によると、GWASによって指標付けられた一般的な変異は、**主要な精神障害の遺伝率の25〜30%**を占めている可能性が高いことが示されています (図3-1)。
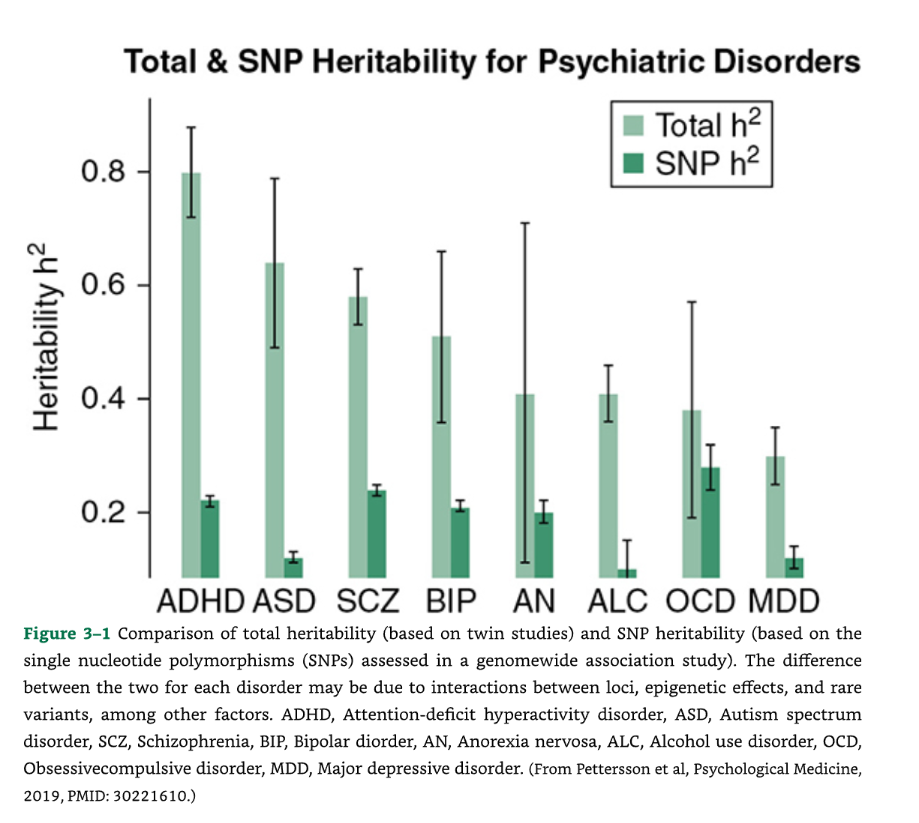
📈 図3-1 双生児研究に基づく総遺伝率とSNP遺伝率の比較
図3-1:総遺伝率(双生児研究に基づく)とSNP遺伝率(ゲノムワイド関連解析(GWAS)で評価された一塩基多型(SNP)に基づく)の比較。各障害における両者の差は、遺伝子座間の相互作用、エピジェネティックな効果、稀な変異などの要因による可能性があります。
- ADHD: 注意欠陥多動性障害 (Attention-deficit hyperactivity disorder)1
- ASD: 自閉スペクトラム症 (Autism spectrum disorder)
- SCZ: 統合失調症 (Schizophrenia)
- BIP: 双極性障害 (Bipolar disorder)
- AN: 神経性食欲不振症 (Anorexia nervosa)
- ALC: アルコール使用障害 (Alcohol use disorder)
- OCD: 強迫性障害 (Obsessive-compulsive disorder)
- MDD: 大うつ病性障害 (Major depressive disorder)
(出典:Pettersson et al, Psychological Medicine, 2019, PMID: 30221610.)
🧬 GWASによる研究の展望
これらの変異を特定し、それらが乱す生物学的経路を理解するためには、必要な大規模な症例サンプルを集めることが非常に価値あるものとなるでしょう。追加の分散は、遺伝子間の相互作用(エピスタシスとして知られる)と稀な変異によって説明されるでしょう。
GWAS研究からのアウトプットは、通常、個々のSNPの連関$p$値をゲノム上の位置(各染色体を指標とする)に対してプロットしたものとして表示されます。これは、都市のスカイラインに似ていることから、しばしば「マンハッタンプロット」と呼ばれます (図3-2)。
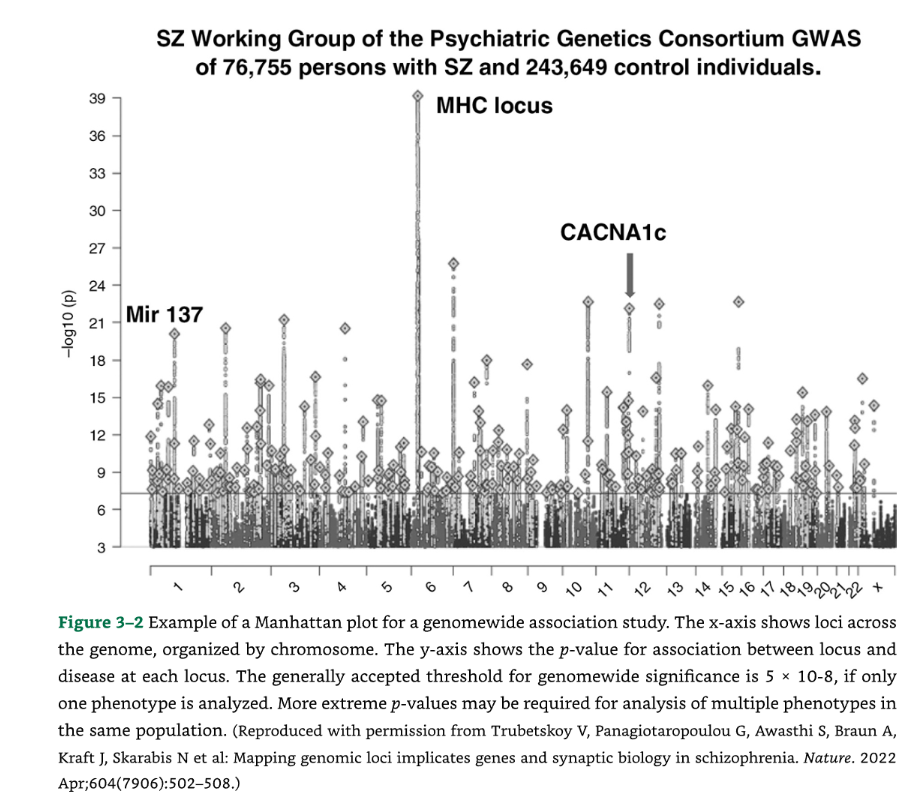
🏙️ 図3-2 ゲノムワイド関連解析(GWAS)におけるマンハッタンプロットの例 図3-2は、ゲノムワイド関連解析の結果を示すマンハッタンプロットの例です。
X軸は、染色体ごとに整理された、ゲノム全体の遺伝子座を示しています。
Y軸は、各遺伝子座における遺伝子座と疾患との間の関連性のp値を示しています。
有意性の閾値 一般的に受け入れられているゲノムワイド有意性の閾値は、単一の表現型のみを解析する場合、5×10 −8 です。同じ集団で複数の表現型を解析する場合には、より極端なp値が要求されることがあります。
(出典:Trubetskoy V, Panagiotaropoulou G, Awasthi S, Braun A, Kraft J, Skarabis N et al: Mapping genomic loci implicates genes and synaptic biology in schizophrenia. Nature. 2022 Apr;604(7906):502-508.より許可を得て複製。)
🌍 GWAS研究における祖先の偏りと公平性
近年、精神障害に関するGWAS研究が、ヨーロッパ系祖先の被験者の包含に実質的に偏っていることがますます認識されるようになりました。ある祖先の被験者からの発見が、他の祖先の被験者には常に適用されるわけではないため、これは科学的および臨床的な公平性の観点から問題となっています。
また、他の祖先の被験者を適切に代表するトランスアンセストラル(祖先間)研究の方が、機能的なリスク遺伝子座の特定により成功する可能性があることも指摘されています。
これらの理由から、現在、アフリカ系、アジア系、ラテン系の祖先を持つ被験者を含めるようにGWAS研究の範囲を広げるための大規模な取り組みが進行中であり、独特な祖先遺伝的歴史を持つ可能性のある先住民族にも注意が払われつつあります。
🧬 ポリジェニック・リスク・スコア(PRS)
PRSの概要
約10年前に、ポリジェニック・リスク・スコア(PRS: Polygenic Risk Score)という手法が、GWASの結果が形質に対する総遺伝率(双生児研究や家族研究から推定される)をどの程度説明するかを評価するために開発されました。
PRSとは、個人の一般的な対立遺伝子の遺伝的負債(ライアビリティ)を単一の値で推定したものであり、ゲノムワイドのジェノタイプの合計として計算されます。この際、各リスク対立遺伝子は、GWASデータから導き出された対応する効果量推定値(またはZスコア)によって重み付けされます。
実際には、PRSは、統計的有意性の仮定されたレベル(例:$p < 0.05$、$0.01$、または$0.001$)を超えるすべてのGWASリスク対立遺伝子を、リスクに対するその対立遺伝子の効果量で重み付けして合計することによって計算されます。1つのGWASには、このような「リスク」対立遺伝子が10万個にもなり得ますが、それぞれがPRSに非常にわずかな量しか寄与しません。より最近の手法では、すべてのSNPがPRSの計算に含まれています。
PRSの用途
PRS(PGS: Polygenic Scoreとも呼ばれる)は、ある障害(または形質)の一般的な対立遺伝子が、別の障害や形質のそれとどの程度重複しているかを評価するのに有用であることが示されています。これは、**Leeら(2013年)**による以下の分析で示されています。
遺伝的重複(共遺伝率)
遺伝的重複、または共遺伝率は、ゲノムワイド関連解析で調べられたすべての一般的なSNPを使用して遺伝的効果の相関をとることによっても観察できます。
これらの手法を用いた一つの観察結果は、統合失調症と双極性障害を説明する遺伝的変動のほとんどが、実際には両方の病態間で共有されているというものでした(図3-3)。
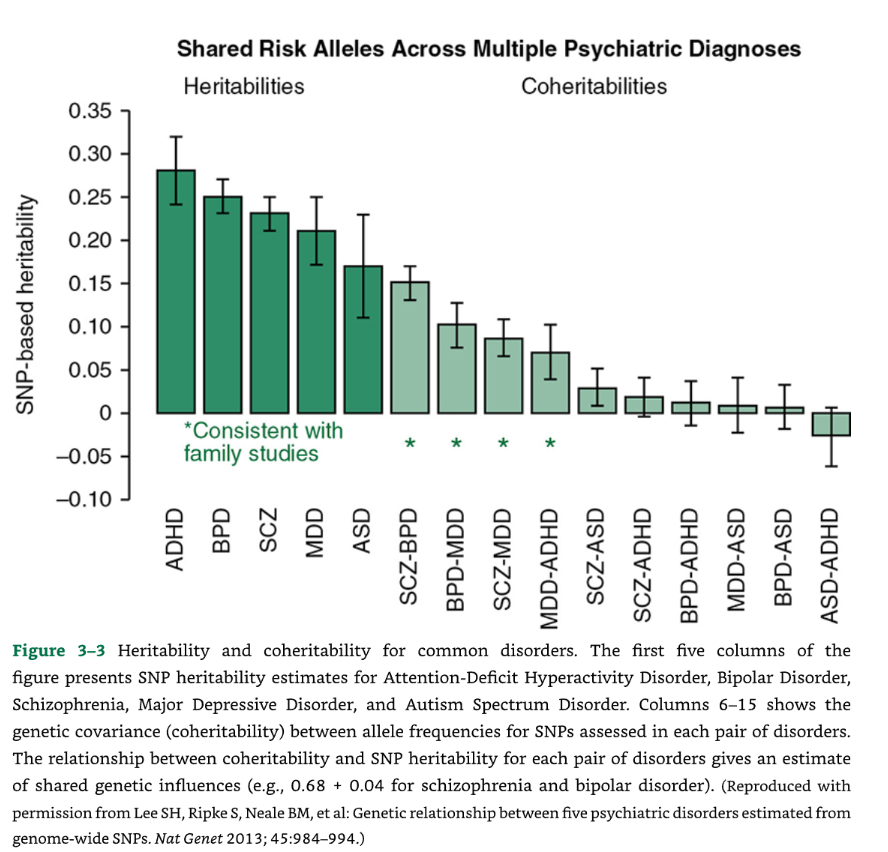
📊 図3-3 共通障害の遺伝率と共遺伝率
図3-3:共通障害の遺伝率と共遺伝率。図の最初の5列は、注意欠陥多動性障害(ADHD)、双極性障害、統合失調症、大うつ病性障害、および自閉スペクトラム症(ASD)のSNP遺伝率の推定値を示しています。6列目から15列目は、SNPの対立遺伝子頻度について、各障害のペア間で評価された**遺伝的共分散(共遺伝率)**を示しています。
各障害ペアにおける共遺伝率とSNP遺伝率の関係は、共有された遺伝的影響の推定値を与えます(例:統合失調症と双極性障害では $0.68 \pm 0.04$)。
(出典:Lee SH, Ripke S, Neale BM, et al: Genetic relationship between five psychiatric disorders estimated from genome-wide SNPs. Nat Genet 2013; 45:984-994.より許可を得て複製。)
🧬 シーケンス研究 (Sequencing Studies)
大規模なシーケンス研究は、自閉症、統合失調症、単極性および双極性障害を含む多くの主要な精神障害で完了しています。一般的に採用されている2つの戦略は、全ゲノムシーケンスとエクソームシーケンスです。
- 全ゲノムシーケンスは、被験者のゲノムにおけるすべての塩基対の決定を伴います。
- エクソームシーケンスは、直接転写されるゲノムの約2%または隣接する制御領域のみを対象とします。
データの精度と利点
シーケンス解析における重要な変数の一つは「リード頻度」、または配列情報のためにある領域が解析される回数です。稀な変異を正確に特定するためには、最大で30倍のカバー率が必要となる場合がありますが、ほとんどの変異を特定するには8倍で十分な場合もあります。
GWASに対するシーケンス解析の主な利点は、シーケンス解析が稀な変異(例:症例における頻度が1%未満)の特定を可能にすることであり、その中には疾患の脆弱性に大きな影響を与えるものがあります。
データ解析の課題
全ゲノムシーケンスデータの解析は、困難な計算上の問題を提起します。なぜなら、一人あたり $3 \times 10^9$ のデータポイントがあり、これには数十万の稀な変異と、各個人のゲノムにおけるアノテーションされた遺伝子内の250〜300個の機能喪失型変異が含まれるためです。
これらの膨大なデータセットの中で病原性のある変異をどのように特定するのでしょうか?現在の研究は、以前に当該障害と関連があると報告された遺伝子のリストに依存しているほか、単一の遺伝子内または単一の領域内で異なる変異を統合する(コラプシングする)戦略に依存しています。
この分野では、この疑問に答え、精神障害の遺伝学を定義するためのシーケンス手法の価値を強化するために、統計的手法が急速に進化すると予想されます。すでに、自閉症に関する研究では、病原性があると見なされる数十の機能喪失型変異が特定されています。
過去20年間にわたり、神経精神医学的障害におけるCNVの研究が報告されてきました。CNVは、数百から数百万の塩基対の挿入、欠失、重複、または逆位である可能性があります。CNVは稀ではなく、健康な個人のゲノム全体に見られますが、疾患集団においては、特定のCNVが自閉症、知的障害 (ID)、統合失調症、およびその他の障害で有意に高い頻度で見られます。
CNVは遺伝する場合とde novo(新規)で発生する場合がありますが、de novoの事象は、少なくとも小児期発症の障害にとって、より重要であるように見えます。de novoの状態は、両親のゲノムを調べることによって、両親にCNVが存在しないことを確認することで証明されます。
【引用文献】
- Cross-Disorder Group of the Psychiatric Genomics Consortium: identification of risk loci with shared effects on five major psychiatric disorders: a genome-wide analysis. Lancet 2013;381: 1371-1379; erratum Lancet 2013;381:1360.
- Malhotra D, Sebat J: CNVs: harbingers of a rare variant revolution in psychiatric genetics. Cell 2012;148(6):1223-1241. (Review)
- Peterson RE, Kuchenbaecker K, Walters RK, et al: Genome-wide association studies in ancestrally diverse populations: opportunities, methods, pitfalls, and recommendations. Cell 2019 Oct 17;179(3):589-603. doi: 10.1016/j.cell.2019.08.051. Epub 2019 Oct 10. PMID: 31607513.
🛡️ 高リスク研究
精神疾患を持つ個人の研究は、常に疾患の影響という問題によって交絡されます。つまり、罹患した個人と対照群との間の違いは、障害の原因に関連しているのか、それとも障害(またはその治療)の影響に関連しているのか、という問題です。
遺伝性疾患の考えられる違いを調査する場合、この困難な問題は、研究対象の障害を発症するリスクが高い個人のグループ(通常は青年または若年成人)を研究することによって対処できます(通常、彼らがその障害を持つ両親や親族を持っているため)。その後、高リスクグループを経時的に追跡し、観察された異常が真に疾患を予測するものかどうかを評価することができます。
【引用文献】
- Nurnberger JI Jr, McInnis M, Reich W, et al: A high-risk study of bipolar disorder: childhood clinical phenotypes as precursors of major mood disorders. Arch Gen Psychiatry 2011;68(10): 1003-1011.
- Schuckit MA, Smith TL, Chacko Y: Evaluation of a depression-related model of alcohol problems in 430 probands from the San Diego prospective study. Drug Alcohol Depend 2006;82(3): 194-203.
🧬 精神障害のエピジェネティクス
エピジェネティクスは、DNA転写の遺伝可能な生物学的修飾因子の研究です。議論される最も一般的なメカニズムは以下の通りです。
- 遺伝子のプロモーター領域におけるシトシン残基のDNAメチル化
- クロマチンのリモデリング
DNAのメチル化は、特定の遺伝子の転写を効果的に阻止します。クロマチン(核内のDNAを支持するタンパク質の枠組み)は、活性状態(転写を許容する)または不活性状態(転写を阻止する)で存在する可能性があります。環境的な出来事を含む様々な刺激が、遺伝子のオン/オフを切り替えるエピジェネティックな変化の原因となる可能性があります。調節性のマイクロRNA(miRNA)などによって、RNA転写のレベルで実質的な追加の遺伝子制御が行われます。
異なるメチル化は、プラダー・ウィリー症候群において重要であるように見えます。これは、知的障害、摂食障害、そして時に気分障害を臨床像の一部として含みます。この病態は、15qのインプリンティングに関連しています。この染色体領域の転写されるDNAセグメントは、一般的に父親由来のセグメントです。母親のその領域からのDNAはメチル化され、転写されない傾向があります。プラダー・ウィリー症候群では、その領域の父親のDNAも欠失しているため、どちらのセグメントも機能しません。アンジェルマン症候群では、通常、父親の染色体の重複、または片親性ダイソミーが見られます。
🍻 アルコール使用障害 (AUD)
1. 疫学遺伝学的研究
A. 双生児研究
双生児研究は、飲酒行動の遺伝率が約40%、アルコール依存症の遺伝率が**約40〜60%**であることを示す傾向があります。より最近のGWAS研究では、**アルコール使用障害(AUD)の有病率における分散の約10〜20%**が、検出可能な一般的な遺伝的変異に関連しているようです。
B. 養子縁組研究
AUDの養子縁組研究は、一般的に遺伝的仮説と一貫しています。養子縁組データから、Cloninger、Bohman、およびSigvardssonは、AUDの家族性の区別として、環境限定型(タイプI)と男性限定型(タイプII)を提唱しました。
- タイプIの人は通常、25歳以降に発症し、コントロールの喪失に問題を抱え、アルコール使用について大きな罪悪感と恐怖を持ちます。
- タイプIIの人は25歳より前に発症し、アルコールを断つことができず、飲酒時に喧嘩や逮捕がありますが、コントロールの喪失やアルコール使用に対する罪悪感と恐怖を示すことは少ないです。
C. 家族研究
アルコール依存症の遺伝学に関する共同研究(Nurnbergerら、2004年、手法のセクションで引用)からの報告は、AUDを持つ人々の親族において、薬物依存、気分障害、不安障害、およびアルコール依存症の有意な共凝集を示しています。
2. AUDと遺伝的に関連する障害
Winokurは、AUD患者の女性親族における抑うつの有病率の増加が、男性親族におけるAUDの有病率の増加とほぼ匹敵することを報告しました。疾患の一部は、共通の脆弱性要因から生じる可能性があります。最近の研究では、併存疾患(AUDおよび感情疾患を含む)自体が家族内で遺伝することが示唆されています。
BohmanとCloningerは、タイプII(男性限定型)アルコール依存症の養子に出された娘は、アルコール依存症の増加は示さないものの、身体化障害の増加を示すことを観察しました。
AUDと反社会性パーソナリティ障害を持つ個人は、同じ症候群の一部としてAUDと社会病質の両方を伝える可能性があります。
AUDを持つ個人の子孫は、行為障害および関連する病態のリスクが高いようです。
4. 連関研究
ADH
アルコールデヒドロゲナーゼ(ADH)は、アルコールの主要な代謝酵素であり、アルコールをアセトアルデヒドに分解するのを触媒し、アセトアルデヒドはその後、**アルデヒドデヒドロゲナーゼ(ALDH)**によってさらに代謝されます。
ADHとALDHの両方の遺伝子には、アルコールに対する「フラッシング反応」(皮膚の赤らみと、時に吐き気や頻脈を伴う温かさの感覚)と関連する変異があります。これらの変異は東アジアの集団で最も一般的であり、AUDの発症を防ぐ傾向があります。
最近の研究では、ADH酵素(ADHのいくつかのアイソザイムの遺伝子は染色体4qに位置する)のSNPが、ヨーロッパ系集団およびネイティブアメリカン集団におけるAUDと関連付けられています。最も強力な単一の発見はADH1B遺伝子にあり、この遺伝子座の変異は規則的な飲酒の早期発症と関連しているようです。
DRD2
約10年前に最初に報告され、21の研究のメタ分析によると、この遺伝子の変異を持つ人は50〜100%のリスク増加を示しています。最近のGWAS研究もこの関連性を確認しています。
ゲノムワイド関連解析 (GWAS)
AUDおよびアルコール消費に関連する表現型を用いたGWAS研究が報告されています。多くの研究者を驚かせたことに、消費とAUDの間の遺伝的相関は控えめです(約50%)。
最近のGWASは、複数の民族の100万人以上の被験者を特徴としています(下記参照)。ADH1Bの変異はAUDと強く関連しており、他のADH遺伝子の変異も関連しています。DRD2の変異も顕著に関連しており、体脂肪量と肥満に関連する遺伝子であるFTOも同様です。
【引用文献】
- Zhou H et al: Multi-ancestry study of the genetics of problematic alcohol use in over 1 million individuals. Nat Med 2023 Dec; 29(12), 3184-3192. doi: 10.1038/s41591-023-02653-5. PMID: 38062264.
エンドフェノタイプ
同期性の低い安静時EEG(低アルファ波)は、AUD素因に関連していると考えられてきました。ベータ波とシータ波のリズムの変化も実証されています。事象関連電位の測定では、AUDを持つ人の7〜13歳の息子が対照群と比較して、視覚刺激後のP300波が小さいことが示されています。低いP300は、AUD素因の家族性マーカーであるようです。
Schuckitは、一連の高リスク集団におけるアルコール投与に対する行動的および神経内分泌的反応を研究しました。AUDを持つ父親の子孫は、対照群よりも主観的な酩酊感を少なく示しました。追跡調査では、主観的な酩酊感の低下が、後のAUD発症のリスク因子として特定されました。アルコールの静脈内注入研究は、主観的効果のより複雑な分析を示唆していますが、家族歴に基づく反応の違いを引き続き示しています。
【引用文献】
- King AC, Cao D, deWit H, et al: The role of alcohol response phenotypes in the risk for alcohol use disorder. BJPsych Open. 2019 Apr 22;5(3):e38. doi: 10.1192/bjo.2019.18. PMID: 31685074.
- Kranzler HR, Zhou H, Kember RL, et al: Genome-wide association study of alcohol consumption and use disorder in 274,424 individuals from multiple populations. Nat Commun 2019 Apr 2;10(1):1499. doi: 10.1038/s41467-019-09480-8. PMID: 30940813.
- Salvatore JE, Han S, Farris SP, et al: Beyond genome-wide significance: integrative approaches to the interpretation and extension of GWAS findings for alcohol use disorder. Addict Biol 2019 Mar;24(2):275-289. doi: 10.1111/adb.12591. Epub 2018 Jan 9. PMID: 29316088.
- Saunders GRB, Wang X, Chen F, et al: Genetic diversity fuels gene discovery for tobacco and alcohol use. Nature 2022 Dec;612(7941):720-724. doi: 10.1038/s41586-022-05477-4. Epub 2022 Dec 7. PMID: 36477530.
🧠 アルツハイマー病 (AD)
ADの一部の病型では遺伝的病因が明確です。早期発症の症例は遺伝性である可能性が高く、単一の遺伝子によって決定される場合があります。遅発性の症例は多因子性である可能性が高いです。
家族研究
遅発型ADのプロバンドの親族のほとんどは、リスク年齢に達する前に他の原因で死亡します。しかし、発症年齢が70歳未満のプロバンドの同胞が罹患した親を持っている場合、そのリスクは50%近くになります。ADを持つプロバンドの第一度近親者が90歳に達した際の罹患リスクは40%になる可能性があります。Heunは、アルツハイマー病プロバンドの第一度近親者における認知症の発生率が**30%であるのに対し、対照群では22%**であると報告しました。
早期発症ADのサブセットは高度に家族性です。少なくとも一部のAD症例(主に遅発性のもの)は散発的(近親者が罹患していない)です。
分子遺伝学的研究
1987年、St. George-Hyslopらは、家族性ADと染色体21上の制限酵素断片長多型(RFLP)マーカーとの連鎖を報告しました。その後、特定の孤立した稀なAD家族では、アミロイド前駆体タンパク質の遺伝子に点突然変異があることが判明しました。これらの研究は、この遺伝子(AD患者の脳の細胞外空間に「プラーク」の形で蓄積するアミロイドタンパク質をコードする)の異常が、単独で疾患を引き起こす可能性があることを示唆しています。
早期発症家族性アルツハイマー病の別の原因は、染色体14上の遺伝子(プレセニリン1)であり、他の家族は染色体1上の遺伝子(プレセニリン2)に連鎖しています。これら2つの遺伝子は高い相同性を持っています。
多くの遅発性家族は、染色体19上のリポタンパク質E(通常ApoEと略される)をコードする領域に連鎖を示しており、これは心血管疾患にも関与しています。
- E4対立遺伝子のコピーが1つあると、ADリスクはE2を持つ場合と比較して4倍に増加します。
- E4のコピーが2つあると、リスクは約12倍に増加します。
APoE4の影響は、ほとんどの民族グループで検出可能です。アルツハイマー病の脆弱性遺伝子の分子メカニズムは、現在集中的な研究の対象となっています。それらがすべて、アミロイドと神経原線維変化に見られるリン酸化タンパク質タウの蓄積に影響を与えていると疑う理由があります。
ApoE対立遺伝子の大きな効果量を除くと、ADの残りの一般的なリスク対立遺伝子は、リスクへの影響が比較的小さいです。
111,000人以上のAD症例と677,000人の対照群を含む最近のGWAS論文では、75のリスク遺伝子座が明らかになり、そのうち42がこの論文で新規でした。ApoE4を除くすべての対立遺伝子は効果が小さかったです。分析では、タウ、アミロイド、ミクログリア、および腫瘍壊死因子アルファ経路が関与していることが示唆されました。これらの遺伝子のADの病態における役割はほとんど理解されていません (図3-4)。
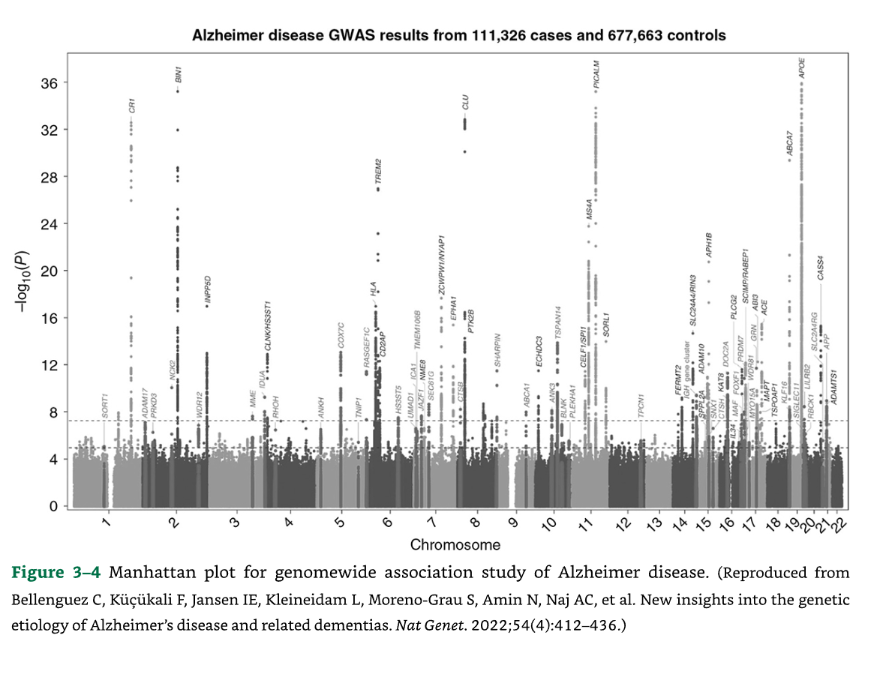
🧠 図3-4 アルツハイマー病 (AD) のゲノムワイド関連解析のマンハッタンプロット
図3-4:アルツハイマー病のゲノムワイド関連解析のマンハッタンプロットの例。
(出典:Bellenguez C, Küçükali F, Jansen IE, Kleineidam L, Moreno-Grau S, Amin N, Naj AC, et al. New insights into the genetic etiology of Alzheimer’s disease and related dementias. Nat Genet. 2022;54(4):412-436.より転載。)
😠 反社会性パーソナリティ障害 (AP)
双生児研究
最近の双生児研究は、反社会性パーソナリティ特性の経時的な安定性と、反社会性特性と境界性パーソナリティ障害特性との間にある程度の重複があることを示しています。
養子縁組研究
養子縁組研究(主に養子縁組と犯罪の両方について中央記録を持つスカンジナビア諸国で実施)は、反社会性パーソナリティ障害(AP)に対する遺伝的影響と環境的影響の両方を示す傾向があります。
Cloningerによる養子縁組研究では、環境要因が犯罪に素因を与える場合、男性養子の6.7%が犯罪者であったのに対し、素因を与えない出生後および遺伝的背景を持つ男性養子では**2.9%**でした。
遺伝的背景は素因を与えるが、出生後の環境はそうではない場合、男性養子の**12.1%が犯罪者であったのに対し、対照男性養子では2.9%**でした。
遺伝的背景と出生後の背景の両方が犯罪行動に素因を与えると判断された場合、男性養子の40%が犯罪者でした。これらの結果は、遺伝子と出生後の影響の相加的な効果と一貫しています。関与が示唆された環境的影響は、複数の里親家庭(男性の場合)と広範な施設ケア(女性の場合)でした。
疫学研究:家族研究
Guzeによる研究では、223人の男性犯罪者のうち80%がAPの診断を受けていることが判明しました。また、面接を受けた男性の第一度近親者の16%もこの診断を受けていたのに対し、女性の親族でAPの診断を受けたのはわずか2%でした(対照群の親族では男性3%、女性1%)。これらの犯罪者の第一度近親者の間では、アルコール依存症と薬物乱用の増加した割合も見られました。
66人の女性重罪犯と彼女らの228人の第一度近親者の家族研究では、親族の間でAP(18%)、アルコール依存症(29%)、薬物乱用(3%)、およびヒステリー(DSM-5の身体症状症に類似)(31%)の増加した割合が明らかになり、ヒステリーのすべては女性親族に発生していました。
予想通り、男性親族は女性親族(11%)と比較して、APが3倍に増加していました(31%)。女性重罪犯の第一度近親者におけるAPのリスク増加(31%)は、男性重罪犯の親族のリスク(16%)と比較して高いため、女性重罪犯には男性重罪犯と比較してより大きな遺伝的(または環境的)リスク要因があることが示唆されるかもしれません。
🔬 細胞遺伝学的研究
いくつかの報告は、刑務所や懲罰/精神施設におけるXYY男性の有病率が、一般集団の有病率よりも高いことを示唆しています。XYY核型は、平均よりわずかに低い知能、高身長、および嚢胞性ざ瘡と関連しています。この核型は、男性新生児約1000人に1人に見られます。
Hookは、20の懲罰/精神施設の3,813人の男性のうち53人に1人の割合でXYYを発見しました。Witkinは、ある出生コホートからすべての高身長のデンマーク人男性を調査し、4,139人中12人(0.29%)がXYY異常を持っていることを発見しました。この12人のXYY男性のうち5人は犯罪歴があり、主に軽犯罪でした。Witkinは、平均より低い知能が、XYY男性の間で過剰な犯罪活動を説明する可能性があることを示唆しています。この核型は、かつて考えられていたように、衝動的な暴力への素因とは関連していないようです。
🧪 生物学的マーカー
Nielsenは、トリプトファン水酸化酵素遺伝子(セロトニンの合成酵素をコードする)の変異を特定しました。これは、暴力的な犯罪者における脳脊髄液中の低い5-ヒドロキシインドール酢酸(5-HIAA)と自殺企図に関連していました。低い5-HIAAは、アカゲザルの実験コロニーにおいて衝動性と暴力に関連付けられています。
オランダのある家族では、MAOA遺伝子の第8エクソンの点突然変異によって引き起こされる低下したモノアミン酸化酵素A(MAOA)活性が報告されました。この変異を持つ男性(MAO遺伝子は両方ともX染色体上にあります)は、衝動的な攻撃性、放火、強姦未遂、および露出症を示します。他の家族性のモノアミン欠陥も攻撃的な行動に関連していることが今後発見される可能性が高いです。
囚人を対象とした研究に対する倫理的制限の現代的な解釈など、様々な理由により、遺伝的素因に関連して反社会的な行動を持つ人々の大規模なサンプルを研究することは困難であり、これらの病態についてはゲノムワイド研究はまだ本格的に着手されていません。
GWAS研究
関連する形質の複数のGWAS研究の最近のメタ分析では、FOXP2とその標的遺伝子CNTNAP2の変異が、動物モデルおよびヒトにおいて反社会的な表現型と関連していることが判明しました。著者らはまた、反社会的な行動と行為障害および抑うつとの間に実質的な遺伝的共分散を確立し、反社会的な行動と知能および教育達成度との間に負の関係を見出しました。
外在化行動特性の大規模なGWASは、反社会的な表現型およびいくつかの関連する表現型のPRS(手法を参照)を導出することができました。
【引用文献】
- Barr PB, Dick DM. The genetics of externalizing problems. Curr Top Behav Neurosci 2020;47:93-112. doi: 10.1007/7854_2019_120. PMID: 31845132.
- Karlsson Linnér R, Mallard TT, Barr PB, et al: Multivariate analysis of 1.5 million people identifies genetic associations with traits related to self-regulation and addiction. Nat Neurosci 2021 Oct;24(10):1367-1376. doi: 10.1038/s41593-021-00908-3. Epub 2021 Aug 26. PMID: 34446935.
- Tielbeek JJ, Uffelmann E, Williams BS, et al: Uncovering the genetic architecture of broad antisocial behavior through a genome-wide association study meta-analysis. Mol Psychiatry 2022 Nov;27(11):4453-4463. doi: 10.1038/s41380-022-01793-3. Epub 2022 Oct 25. PMID: 36284158.
😟 不安障害 (Anxiety Disorders)
不安障害の家族リスクの増加は100年以上前から知られています。障害のタイプは家族内で混合していることが多く、パニック障害、恐怖症性障害、および全般性不安障害を持つ被験者が含まれる場合があります。
純粋なパニック障害のプロバンドを対象としたある家族研究では、対照群の親族と比較して、第一度近親者の間でパニック発作の有意に高いリスクが見られました。任意の不安障害のリスクは5倍に増加していました。
同様に、広場恐怖症のプロバンドの親族では、広場恐怖症の**増加したリスク(11.6%)**が報告されています(パニックプロバンドの親族では1.9%、対照プロバンドの親族では1.5%)。
単純恐怖症の研究では、その診断を持つプロバンド(他の不安障害はない)の親族の間で、単純恐怖症の**増加したリスク(31%)**が見られました(健常なプロバンドの親族では11%)。
社交恐怖の家族歴研究は、恐怖症プロバンドの親族が、パニック障害プロバンドの親族(0.4%)や対照群の親族(2.2%)と比較して、この障害のリスクが増加していること(6.6%)を実証しました。
全般性不安障害の個別の遺伝的伝達は確立されていません。したがって、全般性不安の家族性伝達を示すいくつかのエビデンスはあるものの、その伝達は特異的ではない可能性があります。
双生児研究
ノルウェーのサンプルでは、すべての不安障害のMZ双生児における一致率(34.4%)が、DZ双生児における一致率(17.0%)よりも有意に高かったです。
連関研究
全般性不安障害スクリーニング質問票であるGAD-2のスコア(0から6の範囲)に関するGWASレポートは、多様な一般的な対立遺伝子が非常に少ない量のリスクを伝えていることを示唆しています(Leveyら、2020年)。これらの対立遺伝子は、遺伝子発現の調節因子であるSATB1遺伝子、MAD1L1遺伝子(双極性障害および統合失調症の遺伝学に関与)、および**エストロゲン受容体アルファ遺伝子(ESR1)**に見られました。
【引用文献】
- Levey DF, Gelernter J, Polimanti R, et al: Reproducible genetic risk loci for anxiety: results from ~200,000 participants in the million veteran program. Am J Psychiatry 2020;177:223-232.
🧠 注意欠陥多動性障害 (ADHD)
双生児研究は、注意欠陥多動性障害(ADHD)が実質的な遺伝率を持つことを示唆しており、推定値は約80%です(Faraone and Larsson, 2019)。ほとんどの複雑な精神障害と同様に、SNPベースの遺伝率ははるかに小さく、推定値は28%です(Lee et al, 2013)。残りの遺伝率は、ADHDの同族で検出されているCNVによって部分的に説明される可能性があります(Martin et al, 2020)。
ゲノムワイド関連解析 (GWAS)
ADHDに関するメタ分析(ADHDを持つ38,691人と対照群186,843人を含む)は、27のゲノムワイドで有意な遺伝子座を特定しました(Demontis et al, 2023)。これらの遺伝子座は、初期の脳発達で活動的な遺伝子の中に見られました。ADHDの遺伝的リスクは、中脳ドーパミン作動性ニューロンに関連する遺伝子で濃縮されており、これは脳のシナプス前ドーパミン放出を活性化する遺伝子の有効性と一貫した事実です。
【引用文献】
- Demontis D, Walters GB, Athanasiadis G, et al: Nature Genetics 2023 Feb;55(2):198-208.
- Faraone SV, Larsson H: Genetics of attention deficit hyperactivity disorder. Mol Psychiatry 2019;24:562-575.
- Martin J, Hosking G, Wadon M, et al: A brief report: de novo copy number variants in children with attention deficit hyperactivity disorder. Transl Psychiatry 2020;10:1-6.
🧩 自閉スペクトラム症 (ASD) (広汎性発達障害)
ASDのプロバンドの同胞におけるASDの頻度は、近年の診断の増加にもかかわらず、集団率の数倍で一貫して高いままです。自閉症の全体的な遺伝率は**60〜70%**と推定されています。
自閉症の遺伝学で際立っているのは、複数の単一遺伝子疾患との関連です。最も明確に文書化されている疾患は脆弱X症候群です。自閉症の被験者のおそらく8%が細胞遺伝学的脆弱Xを持っています。脆弱Xの男性の40〜50%が自閉スペクトラム症を持つ可能性があります。また、自閉症と結節性硬化症、神経線維腫症、およびフェニルケトン尿症との間に確からしい関連があります(表3-1)。
表3-1 自閉スペクトラム症の個人に見られるより一般的なコピー数多型のリスト
表3-1:自閉スペクトラム症を持つ個人に見られるより一般的なコピー数多型のリスト .
🧩 表3-1 自閉スペクトラム症(ASD)の個人に見られるより一般的なコピー数多型のリスト
| CNV(コピー数多型) | ASD浸透率 (保因者におけるASD発症率) | 神経精神医学的多面発現性 (関連する神経精神医学的表現型) | 身体的多面発現性 (関連する身体的表現型) |
| Del1q21.1 | 8% | ID (知的障害), ADHD, 統合失調症 | 小頭症, 心臓欠陥, 眼の異常, 低身長, てんかん |
| Dup1q21.1 | 36% | ID, ADHD, 統合失調症, 言語遅延 | てんかん, 大頭症, 心臓欠陥 |
| Del2q23.1 | 100% | ID, ADHD, 言語障害, 運動遅延 | 肥満, 小頭症, 低身長 |
| Del2q37 | 25% | ID, ADHD | てんかん, 低身長, 肥満, 心臓欠陥 |
| Del3q29 | 42% | ID, 言語遅延, 言語障害, 不安障害, 統合失調症, 双極性障害 | 胃腸の問題, 心臓欠陥, 摂食障害, 再発性耳感染症, 歯の異常 |
| Del5q14.3 | 27% | ID, 無言 | てんかん, 毛細血管奇形 |
| Dup7q11.23 | 43% | ID, ADHD, 不安障害, 反抗挑戦性障害, 言語遅延 | てんかん, 大頭症, 短頭症 |
| Del8p23 | 41% | ID, ADHD | 上行大動脈の拡張, 動脈管開存症, 慢性便秘, 腎臓の異常 |
| Dup15q11-q13 | 69% | ID, ADHD | 心臓欠陥, 先天性横隔膜ヘルニア |
| Del15q11.2 | 32% | ID, ADHD, 統合失調症, OCD (強迫性障害), 言語遅延 | てんかん, 欠陥, 筋緊張低下, 低身長 |
| Dup15q11.2 | 43% | ID, ADHD, 言語遅延 | てんかん, 運動失調, 欠陥 |
| Dup15q13.2-q13.3 | 80% | ID, 言語遅延 | てんかん, 運動失調, 筋緊張低下 |
| Del15q13.2-q13.3 | 60% | ID, ADHD | てんかん, 泌尿生殖器の異常, 再発性感染症 |
| Del16p11.2 | 15% | ID | てんかん |
| Dup16p11.2 | 25% | 統合失調症, 双極性障害 | てんかん |
| Dup16p13.11 | 不明 | ADHD, 言語遅延 | 大頭症, 腎臓の異常 |
| Del17p11.2 | 30% | 統合失調症, ADHD, 言語遅延, 不安障害 | (とりわけ)心臓欠陥, 口蓋異常, 低カルシウム血症, 摂食困難, 再発性感染症 |
| Del17q12 | 18% | ID, ADHD | 心臓欠陥, 難聴, 泌尿生殖器の異常, 口蓋異常 |
| Del22q11.2 | 25% | 統合失調症 | てんかん, 筋緊張低下, 仙骨のくぼみ, 言語構音障害 |
| Dup22q11.2 | Unknown | ID, 言語障害 | てんかん, 筋緊張低下, 振戦, 運動失調, 仙骨のくぼみ, 言語構音障害 |
| Del22q13.3 | >50% | ID, 言語障害 | てんかん, 心臓欠陥, 腎臓の異常, 斜視 |
用語解説:
- CNV: コピー数多型
- ID: 知的障害 (Intellectual Disability)
- ADHD: 注意欠陥多動性障害 (Attention-Deficit Hyperactivity Disorder)
- OCD: 強迫性障害 (Obsessive-Compulsive Disorder)
- ASD Penetrance: そのCNVを持つ人が実際にASDの診断を受ける割合。
- 多面発現性 (Pleiotropy): 1つの遺伝子が複数の表現型(症状や疾患)に影響を与える現象。
(出典:Vorstman JAS, Parr JR, Moreno-De-Luca D, et al. Autism genetics: Opportunities and challenges for clinical translation. Nat. Rev. Genet. 2017 Jun; 18(6): 362-376.より許可を得て複製。)
🧩 自閉症の遺伝学:最近の報告
最近の自閉症遺伝学に関する文献は、主に3つのタイプの報告によって占められています。
- CNV(コピー数多型)
- シーケンス変異
- GWASに基づく一般的な変異の影響
1. 自閉症のコピー数多型(CNV)研究
Sebatらは、自閉症の被験者の7%にde novo(新規)CNVが報告されたのに対し、対照群では1%でした。彼が被験者を単発例(家族内で罹患者が1人)または多発例(家族内で複数の罹患者)に分けたところ、単発例の被験者では**CNVの発生率が10%**でした。
Pintoらは、細胞遺伝学的報告に基づいて自閉症および知的障害に関与する遺伝子を破壊するCNVを考慮した場合に、症例と対照群との間の差が特に顕著であったことを発見しました。現在の研究では、20を超える染色体領域が自閉スペクトラム症と関連していることが示唆されています。CNVは、一般的に染色体マイクロアレイまたは全エクソームシーケンスによって検出されます。
2. 自閉症のシーケンス研究
ASDを持つ被験者における広範なシーケンス解析により、この病態と関連する100を超えるシーケンス変異が特定されています。これらは主にde novo(新規)であり、一般的に遺伝子産物の機能喪失と関連しています。主要な遺伝子機能には、遺伝子発現制御と神経伝達が含まれます。
これらの研究には、全エクソームシーケンスと全ゲノムシーケンスの両方の取り組みが含まれています。現在、ASD患者の臨床スクリーニングのためにエクソームシーケンスが一般的に推奨されています。遺伝子スクリーニングの臨床的有用性は、一般的に**10〜15%**と推定されています(図3-5)。
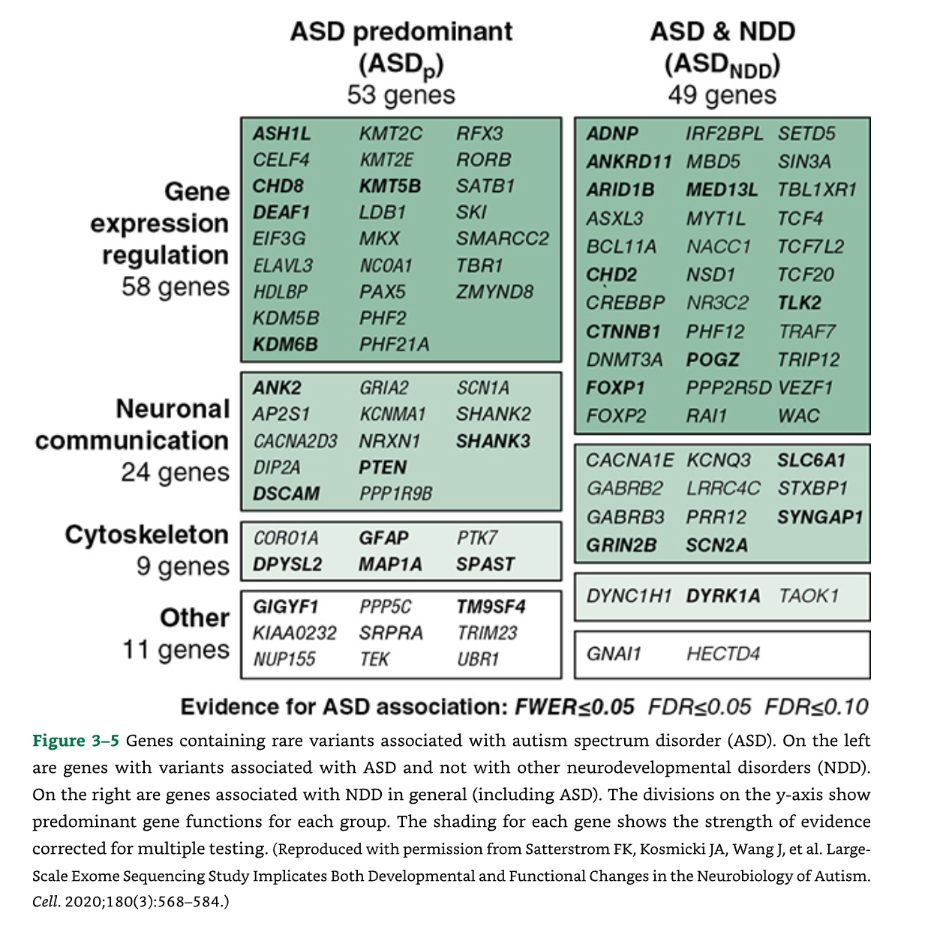
🧬 図3-5 自閉スペクトラム症(ASD)と関連する稀な変異を含む遺伝子
図3-5:自閉スペクトラム症(ASD)と関連する稀な変異を含む遺伝子。
この図は、ASDと関連する稀な変異を含む遺伝子を示しています。
- 左側には、ASDと関連しているが、他の神経発達障害(NDD)とは関連していない遺伝子が示されています。
- 右側には、NDD全般(ASDを含む)と関連している遺伝子が示されています。
- Y軸の区分は、各グループの主要な遺伝子機能を示しています。
- 各遺伝子の陰影は、多重検定を補正したエビデンスの強さを示しています。
| エビデンスの強さ | 統計的閾値 |
| FWER $\le 0.05$ | **家族全体誤差率(FWER)**が0.05以下 |
| FDR $\le 0.05$ | **偽発見率(FDR)**が0.05以下 |
| FDR $\le 0.10$ | **偽発見率(FDR)**が0.10以下 |
(出典:Satterstrom FK, Kosmicki JA, Wang J, et al. Large-Scale Exome Sequencing Study Implicates Both Developmental and Functional Changes in the Neurobiology of Autism. Cell. 2020;180(3):568-584.より許可を得て複製。)
🧩 自閉スペクトラム症のゲノムワイド関連解析 (GWAS)
最近の研究(18,000人以上の症例と27,000人の対照群を含む)では、ASDと関連する5つの有意な遺伝子変異に加えて、関連する表現型(統合失調症、抑うつ、教育達成度)と共有される7つの追加の変異が特定されました。
個々の一般的な変異が持つ影響は非常に小さいものの、それらの複合的な影響がASDの遺伝率の大部分を占めています。対照的に、CNVやSNV(一塩基変異)を含む稀な変異は、個人の内部で実質的な負債を占めますが、集団内のASDの遺伝率に占める割合ははるかに小さいです。
【引用文献】
- Gaugler T, Klei L, Sanders SJ, et al: Most genetic risk for autism resides with common variation.1 Nat Genet 2014 Aug;46(8):881-885. doi: 10.1038/ng.3039. Epub 2014 Jul 20. PMID: 25038753.
- Grove J, Ripke S, Als TD, et al: Identification of common genetic risk variants for autism spectrum disorder.2 Nat Genet 2019 Mar;51(3):431-444. doi: 10.1038/s41588-019-0344-8. Epub 2019 Feb 25. PMID: 30804558.
- Satterstrom FK, Kosmicki JA, Wang J, et al: Large-scale exome sequencing study implicates both developmental and functional changes in the neurobiology of autism.3 Cell 2020 Feb 6;180(3):568-584.e23. doi: 10.1016/j.cell.2019.12.036. Epub 2020 Jan 23. PMID: 31981491.
- Vorstman JAS, Parr JR, Moreno-De-Luca D, et al: Autism genetics: opportunities and challenges for clinical translation. Nat Rev Genet 2017 Jun;18(6):362-376. doi: 10.1038/nrg.2017.4. Epub 2017 Mar 6. PMID: 28260791.
💊 薬物使用障害 (DUDs)
遺伝子疫学:双生児、養子縁組、および家族研究
ベトナム戦争時代双生児登録の研究は、薬理学的クラスを横断して作用する共通の遺伝的要因の証拠を明らかにしました。これらの著者らはまた、家族研究の結果と同様に、特にオピオイド使用障害におけるクラス特異的な遺伝的要因の証拠も見つけました。
双生児、家族、および養子縁組研究から得られる比較的明確な結論は、薬物使用障害(DUDs)のリスクを増加させる****一般的な遺伝的要因が存在し、また、単一の薬理学的クラスの薬物に限定された使用障害のリスクを主として増加させると思われる薬理学的クラス特異的な遺伝的要因(例:オピオイド)が存在するということです。
連関研究
ニコチン使用障害(NUD)
15q25上のニコチン受容体サブユニット遺伝子のクラスターにおける変異とニコチン使用障害(NUD)との関連に関する複数の大規模なGWASレポートが発表されています。
898,680人(ヨーロッパ系739,895人、アフリカ系アメリカ人114,420人、ラテンアメリカ系44,365人)におけるNUDのマルチアンセストリー・メタ分析(電子カルテデータから導出)では、72の独立したリスク遺伝子座が特定されました(Toikumo et al, 2023)。
関与が示唆されたSNPの一つ(rs16969968)は、アルファ-5サブユニット遺伝子(CHRNA5)におけるミスセンス変異(N398D)です。高リスク(N)対立遺伝子は、細胞モデルでカルシウムの流入が不十分です。また、この高リスク対立遺伝子は、アゴニスト曝露後もより広範に脱感作された状態を保ちます。これらの結果は、このリスク対立遺伝子が機能低下型変異であることを示唆しています。ニコチン受容体サブユニット遺伝子には他のいくつかの変異も特定されており、複数のニコチン受容体複合体がNUDsに関与していることが明確に示されています。
オピオイド使用障害(OUD)
オピオイド使用障害のマルチアンセストリーGWASレポート(Kember et al, 2022)では、14の遺伝子座が特定され、これにはミューオピオイド受容体遺伝子の対立遺伝子が含まれます。SNP遺伝率がわずか11%であるためか、追加の対立遺伝子を特定するにはより大規模なサンプルサイズが必要です。
覚せい剤使用障害と大麻使用障害
小規模な覚せい剤使用障害(Cox et al, 2021)および大麻使用障害(Johnson et al, 2020)のGWASレポートでは、少数の遺伝子座が特定されていますが、より大規模なサンプルサイズが必要です。
【引用文献】
- Cox J, Sherva R, Wetherill L, et al: Genome-wide association study of stimulant dependence.4 Transl Psychiatry 2021 Jun 29;11(1):363.
- Johnson EC, Demontis D, Thorgeirsson TE, et al: A large-scale genome-wide association study meta-analysis of cannabis use disorder.5 Lancet Psychiatry 2020 Dec; 7(12):1032-1045.
- Kember RL, Vickers-Smith R, Xu H, et al: Cross-ancestry meta-analysis of opioid use disorder uncovers novel loci with predominant effects in brain regions associated with addiction.6 Nature Neuroscience 2022 25:1279-1287.
- Toikumo S, Jennings MV, Pham B, et al: Multi-ancestry meta-analysis of tobacco use disorders based on electronic health record data prioritizes novel candidate risk genes and reveals associations with numerous health outcomes.7 medRxiv 2023 29:2023.03.27.23287713. doi: 10.1101/2023.03.27.23287713.
🍽️ 摂食障害
家族研究
過去20年間にわたり、対照家族研究が実施されてきました。これらの研究は、かなりの家族内集積があることを示唆しています。全体的なパターンは、家族成員における実質的なリスクを示しており、オッズ比はほぼ確実に10より大きく、さらに大きい可能性もあります。
過食症(BN)のプロバンドの第一度近親者には神経性やせ症(AN)の増加した割合が見られ、ANのプロバンドの第一度近親者にはBNの増加した割合が見られます。ANおよびBNの個人の家族におけるこの摂食障害の集積は、両障害の家族性伝達を強力に支持し、リスク対立遺伝子の重複と一貫しています。ANの経過中に、通常、BNへの診断移行が見られます。
双生児研究
最大数の被験者と最も適切な方法論を用いたANの双生児研究を調べると、MZ双生児の平均一致率は64%、DZ双生児は14%です。これらの割合の差は、適度な相加的遺伝率と、非相加的遺伝的要因および/または共有環境要因の大きな影響を示唆しています。より最近の研究では、構造モデルを使用して相加的遺伝的要因に起因するリスクの割合を推定しています。遺伝率の推定値は0.48から0.76の範囲です。
摂食障害に関する最初の双生児研究の一つは、MZペアで56%、DZペアで5%のペアワイズ一致率を説明しました(プロバンドワイズの数値では71%と10%)。
家族歴の評価(両親からの追加の情報提供データを含む)では、女性の第一度近親者の4.9%、女性の第二度近親者の1.16%が人生のある時点でやせ症を患っていたことが示されました。これは、報告されている集団有病率よりもかなり高いリスクです。
MZコ・ツインは、「身体不満」、「やせへの強いこだわり」、体重減少、無月経期間の長さ、および最小BMI(体格指数)においてはるかに類似していました。
推定によると、ANの負債における分散の約58〜76%、およびBNの負債における分散の54〜83%が遺伝的要因によって説明できます。ANとBNの両方について、負債の残りの分散は、共有環境要因(つまり、同じ家族の同胞が共有する要因)ではなく、固有の環境要因(つまり、同じ家族の同胞にとって固有の要因)によるものと思われます。
過食、自己誘発性嘔吐、および食事制限といった特定の症状に関する双生児研究は、これらの行動が約46〜72%遺伝性であることを示唆しています。同様に、身体不満、摂食と体重への懸念、および体重へのとらわれといった病理的な態度は、約32〜72%の遺伝率を示します。
総合すると、これらの知見は、ANとBN、および臨床的な摂食病理に寄与し、それと相関する態度や行動に有意な遺伝的要素があることを示唆しています。
分子研究
最初のANのGWASには約1000症例が含まれていましたが、ゲノムワイドで有意な所見はありませんでした(Wang et al, 2011)。しかし、16,992のAN症例と55,525の対照群を対象としたより大規模な研究では、8つのゲノムワイドで有意な遺伝子座が明らかになり、これにはCADM1、MGMT、FOXP1、およびPTBP2に関与する対立遺伝子が含まれます。
他の行動特性との遺伝的相関の分析により、OCD、不安、および大うつ病性障害(MDD)との実質的な重複が明らかになりましたが、体脂肪率やBMIなどの肥満関連形質との重複は予想よりも少なかったです。これは、ANの対立遺伝子と肥満の対立遺伝子が、体重分布の二つの極端である可能性があることを示唆しています。ANに大きな影響を与える稀な変異の探索にもかかわらず、特定されたものはありません。
【引用文献】
- Abdulkadir M, Hübel C, Herle M, Loos RJF, Breen G, Bulik CM, Micali N. The impact of anorexia nervosa and BMI polygenic risk on childhood growth: a 20-year longitudinal population-based study.8 Am J Hum Genet 2022;109:1242-1254.
- Wang K, Zhang H, Bloss CT, et al; The Price Foundation Collaborative Group: a genome-wide association study on common SNPs and rare CNVs in anorexia nervosa.9 Mol Psychiatry 2011;16:949-959.
- Watson, H Yilmaz Z, Thornton LM, et al: Genome-wide association study identifies eight risk loci and implicates metabo-psychiatric origins for anorexia nervosa.10 Nat Genet 2019;51:1207-1214.
🧠 知的障害 (ID)
疫学研究
古典的な双生児研究は、IDに対する中程度の遺伝率を支持する傾向があります。IDを持つ子供の同胞のリスクは、障害の重症度と母親の生殖歴に応じて9.5%から23%の範囲であると推定されています。IDを持つ子供をすでに二人以上出産している母親の場合、同胞のリスクは**25〜50%**です。
特定の病因的要因
多くの医学的症候群がIDとして現れます。例えば、特定の代謝異常や染色体異常などです。Polaniは、染色体異常を持つヒトの受胎の4%のうち、85〜90%が自然流産として選択的に排除されると推定しました。出生児の6%は何らかのタイプの遺伝的または発達上の異常を持っている可能性があり、0.5%は染色体異常、4%は他の発達異常、1.5%は単一遺伝子疾患を持って生存します。
IDの単一遺伝子原因として、Koranyiは、5つの優性疾患(結節性硬化症、神経線維腫症、スタージ・ウェーバー症候群、フォン・ヒッペル・リンドウ病、頭蓋縫合早期閉鎖症)と、4つの劣性疾患(ハーラー・ハンター病、ガラクトース血症、G-6リン酸デヒドロゲナーゼ欠損症、家族性低血糖症)、および3つの劣性アミノ酸尿症と3つの脂質関連障害を挙げました。さらに多くの疾患が**McKusickの総覧『Mendelian Inheritance in Man』**にリストされています。
ダウン症候群は、1000人あたり1.5人のIDの原因となっており、この病態の最も一般的な単一原因です。ダウン症の有病率は大きく変動し、主に母親の年齢によって決定されます。
家族性小頭症は、出生40,000人に約1人に見られますが、ヘテロ接合体における影響のため、IDの有意な割合を占める可能性があります(後の議論を参照)。脆弱X症候群は1000人あたり約0.5人、他のX染色体症候群はさらに1000人あたり1人の原因となっています。すべての代謝原因を合わせると1000人あたり1人、染色体異常は1000人あたり3人の原因となっています。
ダウン症候群
このよく研究されている病態は、染色体21上の遺伝物質のトリソミー(3倍化)によって説明されます。この領域は、分子技術と細胞遺伝学を組み合わせて、ますます正確に局在化されています。21q22.2と21q22.3のセクションが関与している可能性が高いですが、21q21も関与している可能性があります。関与する領域には、アミロイドとスーパーオキシドジスムターゼの遺伝子が含まれます。ETS-2プロトがん遺伝子もこの領域の近くにあり、その存在は、ダウン症候群の個人とその親族における白血病の増加した発生率と関連している可能性があります。ヒトの21q21-22.3は、マウスの染色体16の一部と相同です。この領域を含む研究室で生成された相互転座に基づくダウン症のマウスモデルが記述されています。
ダウン症におけるトリソミーまたは不分離の理由は完全には明らかではありません。病因的要因は遺伝的というより環境的である可能性が高いです。この病態に対する脆弱性は遺伝しないようです。ダウン症患者のごく一部は、トリソミーではなく転座を持っています。
前述のように、最も明確な相関関係は母親の年齢です。しかし、不分離の起源が母親だけでなく父親にもある可能性は、長年知られています。血清マーカーは出生前の決定に寄与し(アルファ-フェトプロテインとエストリオールの減少、およびヒト絨毛性ゴナドトロピンの増加)、羊水穿刺への紹介が必要な女性の選択に役立ちます。
アルツハイマー病とダウン症候群の間に家族性関連が存在することが報告されていますが、これがすべてのダウン症候群の症例に共通の病理を示唆する可能性は低いです。最近の研究は、染色体21上の重要な領域のトリソミーがダウン症候群の臨床的変動の唯一の原因である可能性は低く、他のゲノム領域もおそらく重要であることを示唆しています。ダウン症候群の患者は、加齢とともにアルツハイマー病理のリスクが増加するようです。
脆弱X症候群
脆弱X症候群は、細胞遺伝学的観察にちなんで名付けられました。一部の患者からの培養細胞は、適切な条件下で染色体切断を示します。ヒトの染色体上には実際には複数の「脆弱部位」がありますが、脆弱X(Xq27.3での切断)が最もよく知られています。この症候群自体は、MartinとBellによって最初に記述されました。彼らは、X連鎖劣性パターンで分離するIDを持つ大きな家系図を記述しました。
脆弱Xは、X連鎖IDの最も一般的な形態であり、一般的に最も一般的な遺伝性のIDです(ダウン症は遺伝的ですが遺伝性ではありません)。850人に1人が欠陥を保因していると推定されています。そのうち、男性の5人中4人が臨床的表現型を発現するのに対し、女性は3人中1人です(一部のホモ接合体は非浸透であり、一部のヘテロ接合体は浸透しています)。非浸透の個人における保因者状態を決定するための遺伝子検査が現在利用可能です。
Xq27.3領域における正確な遺伝的エラーは、現在、可変長のトリプレットリピートであることが知られています。リピートの数が増加すると(疾患の重症度の増加と関連)、遺伝子が次世代に受け継がれるにつれて発生します。リピートの数が閾値を超えると、臨床症状が見られます。関与する遺伝子はFMR1であり、FMRPというタンパク質をコードしています。これはRNA結合タンパク質です。最近の機能研究は、その代謝型グルタミン酸受容体活性における役割に焦点を当てています。
ほとんどの女性の脆弱Xヘテロ接合体はIDを持っていません。しかし、保因者のサンプルの約3分の1で統合失調型特徴が見られ、感情障害との関連もあります。脆弱Xを持つ一部の被験者は自閉症候群を発症します。
知的障害の分子遺伝学的研究
CNVは、自閉症と同様に、IDと関連していることが判明しています。これらの研究は、多数の有望な候補遺伝子と神経生物学的経路を生み出しています。
明確に定義された遺伝的影響を持つ他の発達障害には、レット症候群、プラダー・ウィリー症候群、アンジェルマン症候群、およびスミス・マゲニス症候群が含まれます。議論については、Erickson et al (2012)を参照してください。
IDを含む神経発達障害を持つ子供には、一般的に遺伝子スクリーニングが推奨されています。様々な臨床コホートにおける診断の収率は平均約25%です。最適な検査戦略には、脆弱X検査に加えて染色体マイクロアレイまたはエクソームシーケンスが含まれます(そして、エクソームシーケンスが最も費用対効果が高いことがますます示されています)。
【引用文献】
- Jansen S, Vissers LELM, de Vries BBA.11 The genetics of intellectual disability. Brain Sci 2023 Jan 30;13(2):231. Doi: 10.3390/brainsci13020231. PMID: 36831774.
- Mollon J, Almasy L, Jacquemont S, et al: The contribution of copy number variants to psychiatric symptoms and cognitive ability.12 Mol Psychiatry 2023 Feb 3. Doi: 10.1038/s41380-023-01978-4. Online ahead of print. PMID: 36737482.
😔 気分障害
1. 遺伝子疫学研究
A. 家族研究
感情障害に関する家族研究は、親族における疾患の集積を継続的に実証してきました(表3-2および表3-3)。NIMH(国立精神衛生研究所)での研究では、双極性(BP)プロバンドの親族の25%が双極性または単極性(UP)疾患を持っていることが判明しました。これは、UPプロバンドの親族の20%および対照群の親族の7%と比較して高い割合です。同じ研究で、統合失調感情障害プロバンドの親族の40%が、人生のある時点で感情疾患を示しました。
これらのデータは、患者の親族におけるリスクの増加を示しています。また、様々な形態の感情疾患が階層的な方法で関連していることも示しています。統合失調感情障害プロバンドの親族は、統合失調感情疾患自体を持つ可能性がありますが、BPまたはUP疾患を持つ可能性がより高いです。BPプロバンドの親族は、BP疾患または(より可能性が高い)UP疾患のいずれかを持っています。
表3-2 主要気分障害の生涯リスク
表3-2は、異なるグループにおける主要気分障害(双極性または単極性)の生涯リスクを示しています。
| グループ | 主要気分障害の生涯リスク |
| 一般集団 | 2% |
| UP(単極性)プロバンドの親族 | 20% |
| BP(双極性)プロバンドの親族 | 25% |
| SA(統合失調感情障害、BP型)プロバンドの親族 | 40% |
| 罹患した両親を持つ子供(二人とも罹患) | 50%以上 |
| 罹患した一卵性双生児 | 60% |
📊 表3-3 双極性障害の生涯リスク
表3-3は、異なるグループにおける双極性障害の生涯リスクを示しています。
| グループ | 双極性障害の生涯リスク |
| 対照群 | 0.5〜1% |
| UP(単極性)プロバンドの親族 | 3% |
| BP(双極性)プロバンドの親族 | 8% |
| SA(統合失調感情障害)プロバンドの親族 | 17% |
| MZ(一卵性)双生児 | 80% |
発症年齢は、感情疾患をより遺伝的に均質なサブグループに分けるのに役立つ可能性があります。早期発症のプロバンドは、一部のデータセットで親族の罹患リスクが増加しています。いくつかの家族研究で出生コホート効果が観察されており、より最近生まれた人々の間で感情疾患の発生率が増加しています。このコホート効果は、一般集団よりもリスクのある親族の間でより大きな程度で観察されました。この発生率増加の理由はまだ不明です。
B. 双生児研究
双生児研究は、遺伝率の一貫した証拠を示しています。平均して、一卵性(MZ)双生児のペアは**65%の確率で一致を示し、二卵性(DZ)双生児のペアは14%**の確率で一致を示します。
C. 養子縁組研究
感情疾患の分野でいくつかの養子縁組研究が実施されています。その結果は、一般的に遺伝的仮説と一貫しています。
2. 感情スペクトラム
以下は、遺伝的に関連している感情障害およびその他の障害のタイプです。
- BPI(双極性I型):重度の躁病を伴う**古典的な「そううつ病」**で、通常、大うつ病エピソードも含まれます。
- BPII(双極性II型):軽躁病と大うつ病のエピソード。この障害はBPIおよびUP(単極性)と遺伝的に関連しています。最近の家族研究では、BPIIプロバンドの親族におけるBPII疾患の過剰を示すいくつかの証拠があります。BPIIは安定した生涯診断となる傾向があり、つまり、患者がBPIに移行することは頻繁ではないことが実証されています。
- 急速交替型(Rapid cycling):急速交替型BP疾患は、大きな理論的および臨床的関心の対象となってきました。甲状腺の病理との関連が提案されています。急速交替は家族性である可能性があります。
- UP躁病(単極性躁病):この病態は、大うつ病の既往がないBPI患者を含みます。このグループは、疾患の家族パターンに基づいて他のBPI患者と区別することはできません。
- 気分循環性障害/その他の特定された双極性および関連障害:この病態は、通常、臨床的注意を必要としない、反復性の高い気分変動と低い気分変動を持つ人々を含みます。これはBP障害と遺伝的に関連している可能性が高いです。
- 統合失調感情障害:気分安定期に間欠的な精神病を持つ患者のグループは、親族に感情疾患および統合失調症の増加が見られます。このグループは、気分障害および精神病性障害の中で最も高い遺伝的負荷(親族における感情疾患または統合失調症の総リスク)を持つ可能性があります。彼らは、BP疾患と統合失調症の両方に関連する遺伝子変異を保有している可能性があります。慢性的な精神病とそれに重なる気分障害のエピソードを持つ患者は、親族に慢性精神病と気分障害の両方のリスクをもたらしますが、全体的な遺伝的負荷は低いです。
- 統合失調症:近年、GWAS研究を含め、連鎖領域と脆弱性遺伝子に重複が特定されています。これは、特にBPI障害に当てはまり、BPII(大うつ病とより密接に関連している)にはそれほど当てはまりません。
- 摂食障害:神経性やせ症と過食症の家族研究では、一般的に親族に感情疾患の過剰が見出されています。やせ症を持つ人の親族は、BPプロバンドの親族と同様の感情障害のリスクを持つ可能性があります。
- 注意欠陥多動性障害(ADHD):この障害を持つ子供は、親族に抑うつの増加が見られるようです。その逆は実証されていません(BP/UPプロバンドの子孫に注意欠陥障害のリスクが増加しているという報告はありません)。
- アルコール使用障害:脆弱性形質の重複がある可能性があります。アルコール使用障害は、UP障害およびBP障害と併存するようです(それぞれの障害が個人内で互いのリスクを増加させるようです)。感情障害を伴うアルコール使用障害が家族内で集積する可能性があるといういくつかの証拠があります。
3. 連鎖研究
気分障害における連鎖研究は、GWASの時代においてはあまり重要ではありません。それらは、シーケンス研究からのデータを使用して、拡大した同族における大きな影響を持つリスク対立遺伝子を特定するのに依然として有用である可能性があります。
4. エンドフェノタイプ
いくつかのエンドフェノタイプマーカーが示唆されています。
- 機能的MRI(fMRI)による扁桃体の活性化
- 海馬のサイズ
- 睡眠遮断への反応
- 双極性障害における認知機能の欠損
- 感情関連の処理課題
- ポリジェニック・リスク・スコア
5. 遺伝子発現研究
気分障害患者の剖検脳サンプルや、血液などの末梢組織での研究が始まっています。これらの研究は、気分障害や自殺行動などの関連する表現型の候補遺伝子を特定するのに役立つはずです。
6. 高リスク研究
BP患者の子孫は、対照群よりも診断されたAxis I障害を持つ割合が多いです。BPの親を持つ子孫は、不快な感情状態に「脱抑制的」行動で反応する傾向があるかもしれません。小児期発症の不安障害または外在化障害を持つ子孫は、後の主要気分障害の発症リスクが高いようです。軽躁病または気分不安定性の初期症状は、後のBPの発症を予測する可能性があります。
7. 双極性障害のGWAS研究
Mullinsらによる最新の双極性GWAS研究(下記参照)では、遺伝的関連の所見を検証するために遺伝子発現データを使用して、15の信頼度の高い遺伝子が特定されました。これらには、セロトニン作動性受容体遺伝子のHTR6、メラニン凝集ホルモン受容体遺伝子のMCHR1、および神経発達遺伝子のFURINが含まれます(図3-6)。
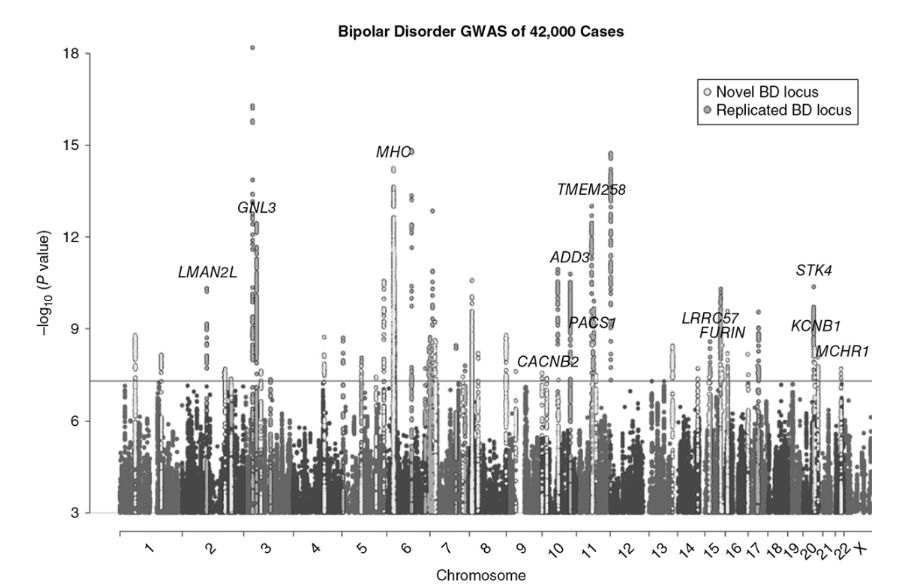
図3-6:双極性障害(BP)のゲノムワイド関連解析のマンハッタンプロット。
5×10 −8 の灰色の水平線は、ゲノムワイド有意性の閾値を示しています。
白丸で示された遺伝子座は、新規(以前のBPのGWASで特定されていない)です。
塗りつぶされた黒丸で示された遺伝子座は、以前の研究で特定され、本研究で再現されたものです。
ラベル付けされた遺伝子は、死後脳研究における遺伝子発現解析から裏付けとなるエビデンスがあるもの、または新規な遺伝子座における注目すべき遺伝子(MHC、CACNB2、KCNB1)です。
(出典:Mullins N, Forstner AJ, O’Connell KS, et al. Genome-wide association study of more than 40,000 bipolar disorder cases provides new insights into the underlying biology. Nat Genet. 2021 Jun;53(6):817-829.より許可を得て複製。)
- 双極性障害に関連する特定の遺伝子 いくつかの遺伝子は、複合サンプルを含む複数のGWAS研究で特定されています。
アンキリン3(ANK3):主要な精神障害でGWAS手法を用いて特定された最初の遺伝子でした。この遺伝子は、ナトリウムチャネルに関連する構造膜タンパク質をコードしています。ナトリウム輸送は、双極性障害および大うつ病の研究で1960年代から異常が報告されています。
カルシウムチャネル遺伝子 CACNA1C:Ferreiraらの報告でゲノムワイド有意性に達し、何度か再現されています。最近のデータでは、カルシウムチャネル遺伝子は全体として、主要な精神障害全般、特に双極性障害と関連しているようです。
ニューロカン(NCAN):双極性疾患を研究し、GWAS手法を用いた大規模な国際コンソーシアムによって特定されました。これは、細胞外マトリックス糖タンパク質をコードしています。マウスでは、これは皮質および海馬の脳領域に局在しています。
主要組織適合性複合体遺伝子座(Major Histocompatibility Locus):双極性障害の最新のGWAS研究で、ヒト白血球抗原(HLA)領域におけるシグナルが特定されました。これは、統合失調症についてすでに特定されているHLAシグナルとは異なる可能性があります。
シーケンス研究は、NCKAP5、SYNE1/CPG2、AKAP11、およびGABA作動性遺伝子のクラスを含む他の信頼度の高い候補のエビデンスを生み出しています。
双極性障害のこれまでで最大のシーケンス研究では、超稀なタンパク質切断型変異の一般的な増加が観察され、双極性障害における遺伝的異質性の証拠が引き続き示されています。
- 大うつ病のGWAS研究 気分障害におけるこれまでで最大のサンプルは、Howardらによって研究されました(200,000人以上の症例と500,000人以上の対照群を含み、100万人以上の参加者の再現サンプルを使用)。
102の変異、269の遺伝子、および15の遺伝子セットが抑うつと関連しており、これにはシナプス構造と神経伝達に関連する遺伝子セットが顕著に含まれています(下記参照)。濃縮研究は、前頭前野の脳領域の重要性を強調しました。
抑うつと神経症傾向の形質との間に強い遺伝的関係が特定されました。ドーパミン作動性遺伝子DRD2といくつかのカルシウムチャネル遺伝子との遺伝子-薬物関係が特徴として挙げられました(図3-7)。
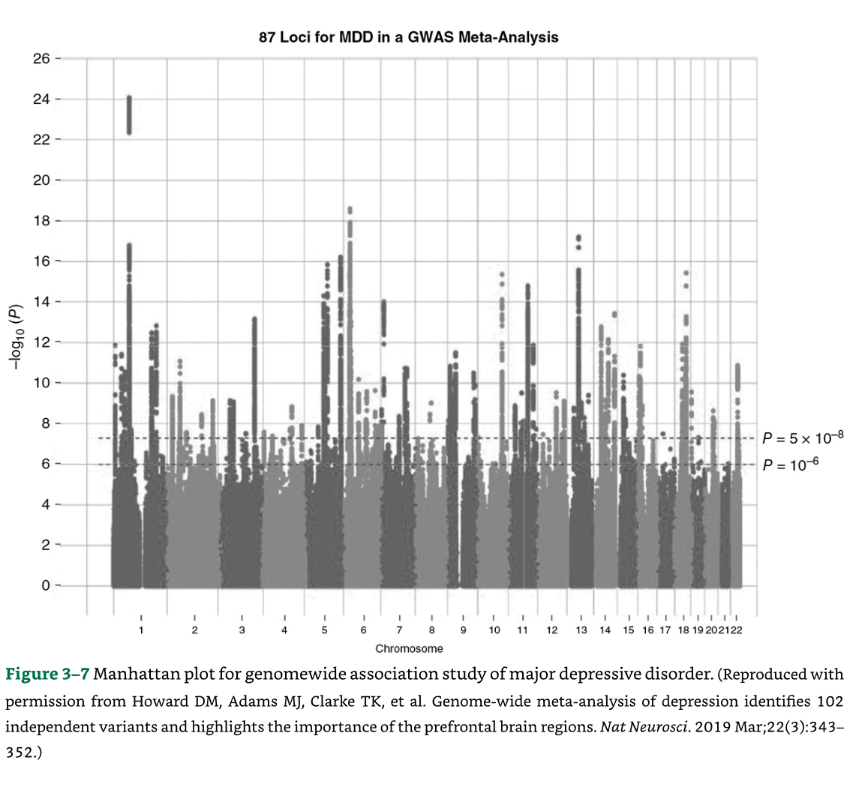
図3-7:大うつ病性障害のゲノムワイド関連解析のマンハッタンプロット。
(出典:Howard DM, Adams MJ, Clarke TK, et al. Genome-wide meta-analysis of depression identifies 102 independent variants and highlights the importance of the prefrontal brain regions. Nat Neurosci. 2019 Mar;22(3):343-352.より許可を得て複製。)
双極性障害と大うつ病の共同解析では、BP2型が大うつ病と実質的な遺伝的差異を共有し(約70%)、統合失調症との共有ははるかに少ないこと(約40%)が示されています。一方、BPI型は統合失調症と実質的な差異を共有し(約70%)、大うつ病との共有ははるかに少ないこと(約40%)が示されています。
教育達成度と気分障害の遺伝的相関は、双極性障害では正でしたが、大うつ病では負でした。二つの障害(BPとUP)は関連していますが、遺伝的には明らかに異なっています。
10. 双極性障害のCNV研究
Zhangらによる研究では、NIMH遺伝学イニシアチブデータベースの双極性障害の被験者において、稀なCNVが増加していることが報告されました。その後の研究では、早期発症(21歳未満)の双極性障害患者ではCNVの増加が見られましたが、遅延発症の患者では見られませんでした。
【引用文献】
- Coleman JRI, Gaspar HA, Bryois J, et al: The genetics of the mood disorder spectrum: genome-wide association analyses of more than 185,000 cases and 439,000 controls. Biol Psychiatry 2020 Jul 15;88(2):169-184. Doi: 10.1016/j.biopsych.2019.10.015. Epub 2019 Nov 1. PMID: 31926635.
- Howard DM, Adams MJ, Clarke TK, et al: Genome-wide meta-analysis of depression identifies 102 independent variants and highlights the importance of the prefrontal brain regions. Nat Neurosci 2019 Mar;22(3):343-352. Doi: 10.1038/s41593-018-0326-7. Epub 2019 Feb 4. PMID: 30718901.
- Mullins N, Forstner AJ, O’Connell KS, et al: Genome-wide association study of more than 40,000 bipolar disorder cases provides new insights into the underlying biology. Nat Genet 2021 Jun;53(6):817-829. Doi: 10.1038/s41588-021-00857-4. Epub 2021 May 17. PMID: 34002096.
- Palmer DS, Howrigan DP, Chapman SB, et al: Exome sequencing in bipolar disorder identifies AKAP11 as a risk gene shared with schizophrenia. Nat Genet 2022 May;54(5):541-547. doi: 10.1038/s41588-022-01034-x. Epub 2022 Apr 11. PMID: 35410376.
🧼 強迫性障害 (OCD)
1. 疫学研究
A. 双生児研究
強迫性障害(OCD)に関する大規模な双生児研究はありません。RasmussenとTsuangは報告された一連の症例をレビューし、51組のMZペアのうち32組(63%)が一致していたことに注目しました。
Lenaneは、46人のOCDの子供の145人の第一度近親者を研究しました。個人的に評価された90人の親のうち、15人(17%)がOCDと診断されました。これは、対照群として機能した34人の行為障害の子供の親の1.5%と比較して高いです。この17%の有病率は、集団有病率の約2%よりも有意に高くなっています。父親は母親よりも3倍OCDと診断される可能性が高かった。個人的に評価された56人の同胞のうち、3人(5%)がOCDの基準を満たしました。年齢補正を適用すると、その割合は35%に上昇しました。同胞に対する年齢補正の大きさのため、この数値は慎重に検討されるべきです。
すべてのプロバンドが重度の小児期発症OCDであり、治療のために著者らに紹介されたことに留意すべきです。小児期発症OCDは、OCDスペクトラムのより重症な形態を表している可能性があります。それにもかかわらず、この慎重に実施された家族研究は、OCDプロバンドの第一度近親者におけるOCDのリスク増加を明らかにしています。
OCDがトゥレット症候群の家族的背景で発生する場合、それはトゥレット症候群のスペクトラムの一部である可能性があります。しかし、ほとんどのOCDは、トゥレット症候群に罹患した第一度近親者を持たない個人に発生します。トゥレット症候群を発症する運命にある個人が、OCDの症状を呈し、その後運動チックが現れることが時折あります。これらの患者は、運動チックが発現するまでOCDと診断されることが多いです。
OCDのGWASレポートは、約2090の症例と4567の年齢・性別一致対照群について記述しましたが、ゲノムワイド有意性に達した対立遺伝子はなく、より大規模なサンプルサイズが必要であり、一般的な対立遺伝子がわずかなリスクしか伝えていないことが示唆されます(Mahjani et al, 2022)。
トゥレット症候群のGWASレポートは、6133人のTSの個人と13,565人の祖先一致対照参加者というサンプルサイズで、5q15染色体遺伝子座を特定し、これにはNR2F1遺伝子が含まれています(Tsetsos et al, 2023)。
【引用文献】
- Mahjani B, Klei L, Mattheisen M, et al: The genetic architecture of obsessive-compulsive disorder: contribution of liability to OCD from alleles across the frequency spectrum. Am J Psychiatry 2022 Mar;179(3):216-225.
- Tsetsos F, Topaloudi A, Jain P, et al: Genome-wide association study points to novel locus for Gilles de la Tourette syndrome. Biol Psychiatry 2023 Feb 2:S0006-3223(23)00051-3. doi: 10.1016/j.biopsych.2023.01.023.
👻 統合失調症
A. 双生児研究
統合失調症の各研究において、MZ双生児の一致率はDZ双生児の一致率よりも高いことから、遺伝的仮説と一貫しています。第二に、広義に定義された統合失調症の遺伝率は、厳密に定義された統合失調症の遺伝率よりも高いです。これはスペクトラムの概念と一貫しています。統合失調症の遺伝的負荷を持つ一部の個人は、異なる病態を発現します。第三に、非一致率はかなりのものです。MZ双生児でさえ、疾患の広い定義を使用した場合、非一致率は**51%**です。
統合失調症における環境効果に関するデータを作成するための双生児研究パラダイム
モーズレー病院の双生児シリーズにおける発症年齢を調べたところ、一方の双生児の発症から2年以内にペアのもう一方に高い罹患率が見られました。このグループを双生児が一緒に住んでいるか離れて住んでいるかに基づいてさらに分類すると、2年間の発生率は一緒に住んでいる双生児でのみ上昇していました。つまり、一緒に住んでいる双生児は発症年齢が一致するのに対し、離れて住んでいる双生児は一致しません。この興味深い発見は、環境要因を示唆しています。
B. 家族研究
統合されたヨーロッパの家族研究データは、年齢補正後の罹患リスクが、親で5.6%、同胞で10.1%、子供で12.8%であることを示しています。親の罹患率が低いのは、統合失調症を持つ人々の相対的な受胎能力の低下に関連していると考えられています。
一般集団における統合失調症のリスク推定値は約1%です。したがって、統合失調症を持つ人々のすべての第一度近親者の有病率は明らかに増加しています。両親が統合失調症である子孫のリスクは、症例数が少ないため推定が困難です。おそらく**35%から45%の間です(統合データでは46.3%**です)。
第二度近親者(叔父、叔母、甥、姪、孫)、異父母の同胞、およびいとこでは、リスクは2〜4%です。したがって、統合失調症を持つ人々の近親者は、この疾患のリスクが約5〜10倍超過しています。リスクは遠い親族ほど減少します。
第一度近親者のさらに別のグループは、「統合失調症スペクトラム」障害を発症するようです(後述)。それにもかかわらず、統合失調症を持つ人々の近親者の大多数は精神医学的診断を受けていません。
統合失調症の従来のサブタイプ(破瓜型、緊張型、妄想型)の遺伝的決定に関する強力な証拠はありません。MZ双生児ではサブタイプの有意な一致がありますが、これは家族研究では当てはまりません。
統合失調症と感情障害の区別の問題は解決されていません。生涯診断を使用し、統合失調症、慢性統合失調感情障害、急性統合失調感情障害、BP感情障害、UP感情障害、および対照群のプロバンドの親族を個別に調査した大規模な家族研究では、遺伝的負債に重複があるという証拠があることが結論付けられました(Lichtenstein et al, 2009)。具体的には、患者のすべての親族グループでUP障害の増加が見られました。統合失調感情障害(慢性および急性の両方)のプロバンドの親族は、感情障害と慢性精神病の両方の過剰を示しました。しかし、BPプロバンドは統合失調症の親族の過剰を示し、統合失調症プロバンドはBPの親族の過剰を示しました。家族研究データからの重複は、BP、MD、統合失調症のGWASデータの比較によって確認されており、感受性対立遺伝子の間で予想以上の重複が示されています(Lee et al, 2013)。
伝達様式に関して、利用可能なデータは広範に分析されています。結果は、一般的に単一遺伝子モデルよりも多因子モデルを支持するものと解釈されています。
C. 養子縁組研究
養子縁組研究の方法論が統合失調症に初めて適用されたのは約40年前です。統合失調症の女性の養子に出された子孫に、対照群の養子と比較して統合失調症の過剰があることが報告されました。
KetyとRosenthalは、デンマークの養子縁組と精神科入院登録を分析し、一連の大規模な系統的研究を実施しました。後の研究では、被験者は直接面接されました。すべての研究において、養子は幼い年齢で生物学的親から引き離され、非親族に養子に出されました。
統合失調症の養子の生物学的親族には、精神医学的に正常な養子の生物学的親族よりも多くの統合失調症および統合失調症スペクトラム障害が診断されていることが判明しました。両グループの養親の親族における精神疾患の有病率は同程度でしたが、少なかったです。
統合失調症の親から養子に出された子孫の統合失調症スペクトラム障害の頻度は、対照群の親から養子に出された子孫よりも高いです。これらの研究はすべて、選択バイアス、診断の妥当性、および比較の根拠から批判されてきました。しかし、データのさらなる独立した分析は結果を確認しています。つまり、同じ環境を共有していない統合失調症患者の生物学的親族は、同等の対照群の生物学的親族よりも統合失調症および統合失調症スペクトラム障害の有病率が有意に高いということです。
D. スペクトラム研究
統合失調症を持つ人々の第一度近親者の30%が関連障害を持っています。特に関与していると思われる特定の診断カテゴリーは、妄想性パーソナリティ障害と統合失調型パーソナリティ障害です。統合失調型パーソナリティ障害は統合失調症スペクトラムの一部である可能性が最も高く、妄想性および統合失調質パーソナリティ障害についても示唆的な証拠があります。妄想のみを特徴とする別の病態(単純妄想性障害)も存在する可能性があり、その遺伝は統合失調症や感情障害の遺伝とは独立しています。
E. 分子研究
最新の統合失調症のGWAS研究には、76,000症例以上が含まれ、200以上の遺伝子座が特定されています(Trubetskoy et al, 2022; 手法セクションの図3-2を参照)。リスク対立遺伝子は、中枢神経系の発達、脳細胞の分化、およびシナプス伝達に関連する遺伝子を含む神経機能に関与する遺伝子に集中していました。また、リスク対立遺伝子は、イオンチャネル、シナプス、軸索構造、および樹状突起コンパートメントをコードする遺伝子にクラスター化していました。
最後に、統合失調症の数千のエクソームをシーケンスした結果、一般的なリスク対立遺伝子を保有する遺伝子も、潜在的に大きな影響を持つ稀な統合失調症リスク対立遺伝子を含んでいることが実証されました(Singh et al, 2022)。
統合失調症における最も大きな影響を持つ遺伝子座(手法の図3-2を参照)は、第6染色体の主要組織適合性複合体(MHC)領域にあります。この領域内では、補体C4はC4AとC4Bの二つのアイソフォームで存在します。Sekarら(2016)は、C4Aへのヒト内在性レトロウイルス(HERV)の挿入がこの遺伝子座の主な原因であり、HERV挿入にホモ接合の人のオッズ比は1.3であることを示しました。さらに、Sekarら(2016)は、この対立遺伝子の効果が中枢神経系におけるC4Aの発現を増加させることを実証しました。これは、C4が中枢神経系でシナプスの刈り込みを指示するため重要であり、統合失調症では過剰なシナプスの刈り込みが発生している可能性を示唆しており、統合失調症患者が対照群と比較して薄い前頭皮質を持っているという事実の説明を提供します(Cannon et al, 2015)。
CNVは、統合失調症の遺伝的リスクの集合的には一般的ではない源であり、症例のおそらく4〜5%以下で発生します。Marshallら(2017)は、統合失調症の個人のゲノム間で8つのCNVが有意に濃縮されていることを発見しました。これら8つには、1q21.1、2p16.3(NRXN1)、3q29、7q11.2、15q13.3、遠位16p11.2、近位16p11.2、および22q11.2のCNVが含まれます。
統合失調症のエンドフェノタイプ
精神障害におけるエンドフェノタイプの概念は、過去数十年にわたって発展してきました。この用語は、生化学的検査または顕微鏡検査を通じて観察可能な、疾患に関連する特徴を定義します。有効なエンドフェノタイプは、その障害の症状よりも病態生理学的な遺伝子変異により密接に関連しているべきです。
現在の精神医学的疾病分類における操作的に定義された障害の遺伝的複雑性についてより正確な理解が得られたため、精神医学研究におけるエンドフェノタイプの有用性は現在より評価されています。エンドフェノタイプは、現在の疾病分類の境界を横断する可能性のあるより均質なサブタイプを作成するはずです。有効なエンドフェノタイプは、分子レベルでこれらの障害を理解するためのより迅速な進歩を可能にするでしょう。
エンドフェノタイプの基準
エンドフェノタイプの基準が導出されています。
- 一般集団における疾患と関連している必要があります。
- 安定しており、状態に依存しない必要があります。言い換えれば、患者が部分的または完全に寛解しているという事実にもかかわらず、観察可能でなければなりません。
- 遺伝性でなければなりません。
- 家族内で疾患と分離する必要があります。
- プロバンドがエンドフェノタイプを持つ同族の間で、一般集団と比較して罹患していない家族メンバーの間でもより高い割合で観察可能でなければなりません。
GlahnやGershonによるものを含め、エンドフェノタイプの定量的評価のためのいくつかの有用なスキームが現在開発されています。
統合失調症における可能なエンドフェノタイプには、作業記憶の欠損や、反復的な聴覚刺激に続くP50誘発反応の低下が含まれます。進行中のBSNIPコンソーシアムによって多くのエンドフェノタイプが調査されています。
要約すると、統合失調症の遺伝学的研究は、GWASとシーケンスを通じて多数の有望な候補遺伝子を特定しています。GWAS研究は、カルシウムチャネル関連遺伝子が統合失調症と双極性障害の両方に関与していることを特定しています。研究により、いくつかの有望なエンドフェノタイプ、特に聴覚誘発反応の異常と神経認知機能の欠損が明らかにされています。
【引用文献】
- Cannon TD, Chung Y, He G, et al: Progressive reduction in cortical thickness as psychosis develops: a multisite longitudinal neuroimaging study of youth at elevated clinical risk. Biol Psychiatry 2015;77:147-157.
- Lee SH, Ripke S, Neale BM, et al: Genetic relationship between five psychiatric disorders estimated from genome-wide SNPs. Nat Genet 2013;45:984-994.
- Lichtenstein P, Yip BH, Björk C, et al: Common genetic determinants of schizophrenia and bipolar disorder in Swedish families: a population-based study. Lancet 2009;373(9659):234-239.
- Marshall CR, Howrigan DP, Merico D, et al: Contribution of copy number variants to schizophrenia from a genome-wide study of 41,321 subjects. Nat Genet 2017 Jan;49(1):27-35.
- Sekar A, Bialas AR, de Rivera H, et al: Schizophrenia risk from complex variation of complement component 4. Nature 2016;530:177-183.
- Singh T, Poterba T, Curtis D, et al: Rare coding variants in ten genes confer substantial risk for schizophrenia. Nature 2022 Apr;604(7906):509-516.
- Trubetskoy V, Panagiotaropoulou G, Awasthi S, et al: Mapping genomic loci implicates genes and synaptic biology in schizophrenia. Nature 2022 Apr; 604(7906):502-508.
🤕 身体化障害(身体症状症)
Coryellによる家族歴研究では、Briquet症候群(現在はDSM-5で身体症状症(SSD)と呼ばれている)の49人のプロバンドの第一度近親者が評価されました。同様の訴えを持つ非症候性被験者と気分障害プロバンドの第一度近親者が対照群を形成しました。SSDプロバンドの第一度近親者における複雑な病歴のリスクは8%でした。これは、対照群の値の2.3%および2.5%と比較して高いです。
Guzeらは、重度のSSDの家族研究で、プロバンドの女性の第一度近親者の間で同様の障害の有意なリスク増加を報告しました(7/105)。これは、対照群プロバンドの女性の親族と比較して高いです(13/532)。さらに、彼らは、SSDプロバンドの男性(18/96)および女性(9/105)の親族の間で、反社会性パーソナリティ障害のリスク増加を報告しました。これは、対照群の**男性(44/420)および女性(14/532)**の親族のリスクと比較して高いです。
Torgersenは、体細胞形式障害(身体化障害、転換性障害、心因性疼痛障害、または心気症)を一方が持っているMZ双生児14ペアとDZ双生児21ペアを研究しました。MZ双生児の29%が体細胞形式障害に一致していたのに対し、DZ双生児は10%でした。この差は有意ではありませんでした。
養子縁組研究
大規模なスウェーデンの養子縁組コホートの分析で、Sigvardssonは、反復性の短い身体的愁訴と精神医学的障害を持つ女性の養子(「身体化者」)を他の女性の養子と区別する判別関数変数のセットを特定しました。その後の分析で、Bohmanは身体化者を二つのグループに分けました。「高頻度身体化者」(精神医学的、腹部、または背中の愁訴の有病率が高い者)と**「多様型身体化者」**(愁訴の頻度は低いが、複数の非常に多様な症状を持つ者)です。
高頻度身体化者の30%がアルコール乱用および/または犯罪歴を持っていました(これらの行動に関する国家登録に基づく)。彼らの男性の生物学的親族は、暴力的犯罪行動とアルコール乱用のリスクが増加していました。両タイプの身体化者について、交差養育分析は、体細胞形式障害の発達に対する先天性と出生後の影響の両方の証拠を提供しました。これらの研究は、一部のタイプの体細胞形式障害、アルコール依存症、および犯罪の間に家族的な関連があることを示唆しています。この分野では追加の研究が必要です。
分子遺伝学的研究
我々の知る限り、これらの障害を持つ人々を対象としたGWASまたはシーケンス研究は行われていません。
【引用文献】
- Torgersen S: Genetics and somatoform disorders. Tidsskr Nor Laegeforen 2002;122(14):1385-1388.
😫 トゥレット症候群
疫学研究
A. 双生児研究
Priceは、一方がトゥレット症候群であると定義された30組のMZおよび13組のDZの同性ペアを研究しました。MZ双生児の一致率は任意のチックで77%であったのに対し、DZ双生児は23%でした。トゥレット障害そのものでは、MZの一致率は53%であったのに対し、DZの割合は8%でした。これらはすべて有意な差です。
Paulsは、38人のトゥレット障害プロバンドの338人の生物学的親族、21人の養親、および正常対照群の22人の親族を研究しました。生物学的親族の中で、8.3%がトゥレット障害を、16.3%が慢性チックを、9.5%がOCDを持っていました。これらのリスクはすべて、対照群の43人の親族のリスクよりも有意に高いです。
B. 連鎖研究
トゥレットに関与する遺伝子変異を見つけるための系統的なゲノムスクリーニングを使用する共同研究が数年前から進行中です。最近の結果は、第2染色体上の変異が関与している可能性を示唆しています。樹状突起成長タンパク質SLITRK1(第13染色体)をコードする遺伝子の稀な変異が、この病態と関連しています。
C. ゲノムワイド関連解析
Tsetsosら(2023)は、第5染色体q15遺伝子座でゲノムワイド有意な遺伝子座を特定し、NR2F1遺伝子の関与を示唆しています。追加のリスク対立遺伝子を特定するにはより大規模なサンプルサイズが必要です。
【引用文献】
- Karagiannidis I, Dehning S, Sandor P, et al: Support of the histaminergic hypothesis in Tourette syndrome: association of the histamine decarboxylase gene in a large sample of families. J Med Genet 2013;50(11):760-764.
- Paschou P. The genetic basis of Gilles de la Tourette syndrome. Neurosci Biobehav Rev 2013;37(6):1026-1039.
- Tsetsos F, Topaloudi A, Jain P, et al: Genome-wide association study points to novel Locus for Gilles de la Tourette syndrome. Biol Psychiatry 2023 Feb 2:S0006-3223(23)00051-3. doi: 10.1016/j.biopsych.2023.01.023.
👨👩👧👦 遺伝カウンセリング
遺伝カウンセリングの経験的データは表3-4に要約されています。これらのデータは、もう一方の親が罹患していないことを前提としています。家族歴の後の括弧内のパーセンテージは、非選択の一般集団のリスクを提供します。
例えば、UP疾患(狭く定義された)の一般集団の生涯リスクは8%です。対象者がUPうつ病の親を持っている場合、生涯リスクは一般集団の2倍(16%)になります。このような個人は、BP疾患のリスクも4倍に増加しています。
👨👩👧👦 表3-4 遺伝カウンセリングのための家族研究データ
この表は、片親が罹患している場合に、子孫が特定の精神疾患を発症するリスクが、一般集団のリスクと比較してどの程度増加するかを示しています。
| 家族歴 (罹患親) | 非選択の一般集団リスク (生涯リスク) | 子孫の増加リスク (UP/BP/その他) |
| 単極性障害 (UP) | 8% | UPに対して2倍 (16%) |
| BPに対して4倍 (4%) | ||
| 双極性障害 (BP) | 1% | BPに対して9倍 (9%) |
| UPに対して2倍 (16%) | ||
| 統合失調症 (SZ) | 1% | SZに対して10倍 (10%) |
| アルコール依存症 | 18% (男性), 10% (女性) | UPに対して2倍 (15%) |
| パニック障害 | 0.5% | 約2倍 |
| トゥレット症候群 | 0.25% | 12倍 (6%) |
| アルツハイマー病 | 3% | 75歳時で5倍 (15%) |
| 注意欠陥・多動性障害 (ADHD) | 3% | 5倍 (15%) |
| 神経性やせ症 (AN) | 0.5% | 10倍 (5%) |
発症年齢とリスク評価
気分障害のような一部の疾患には、一般集団において発症年齢の狭い分布が見られます。例えば、双極性障害(BP)の最初のエピソードはほとんどの場合60歳未満で発生します。BP個人の実に50%が、20歳未満で最初のエピソード(抑うつまたは躁病)を発症します。リスクを評価する際には、このことを一般的な方法で考慮する必要があります。
例えば、BP疾患の親を持つ、未発症の40歳の息子は、すでにリスクのある年齢のほとんどを通過しており、したがって、BPのリスクは9%よりも大幅に低くなります。この場合、2%という推定値の方がより正確であると考えられます。
遺伝子型に基づく方法と臨床への応用
遺伝子型に基づく方法は、今後数年間で遺伝カウンセリングへの応用が期待されています。そのような方法は、稀なCNVやその他の大きな影響を持つ稀な対立遺伝子を持つ特定の珍しい家族での使用を除いて、まだ広く適用可能ではありません。
精神障害に対するポリジェニック・リスク・スコア(PRS)は、最終的な臨床応用に向けて研究されていますが、使用に先立って多様な集団における大規模な対照試験が必要です。
HLAタイピングや代謝酵素であるCYP2D6またはCYP2C19を用いた遺伝子検査は、気分安定化薬や抗うつ薬の治療計画を立てる上で有用である可能性があります。
【引用文献】
- Gershon ES, Alliey-Rodriguez N: New ethical issues for genetic counseling in common mental disorders. Am J Psychiatry 2013 Sep;170(9):968-976. doi: 10.1176/appi.ajp.2 013.12121558. PMID: 23897273.
- Nurnberger JI Jr, Austin J, Berrettini WH, et al: What should a psychiatrist know about genetics? Review and recommendations from the Residency Education Committee of the International Society of Psychiatric Genetics. J Clin Psychiatry 2018 Nov 27;80(1):17nr12046. doi: 10.4088/JCP.17nr12046. PMID: 30549495.
- https://ispg.net/genetic-testing-statement. Accessed 5/8/23.

