4. 遺伝学
生物の成長に必要な情報は、それぞれのゲノム(遺伝情報の全体)に保存されています。
すべての遺伝情報は「デオキシリボ核酸(DNA)」と呼ばれる高分子にコード化されています。
DNAは、デオキシヌクレオチドという単位からできており、そこには次の4種類の塩基が含まれます。
- アデニン(A)
- グアニン(G)
- シトシン(C)
- チミン(T)
この塩基同士は、AがTと、GがCと必ず対になって結合します。
この「塩基のアルファベット」、つまり遺伝暗号は、すべての生物で基本的に共通しており、非常に保存的(ほとんど変わらない)です。
たとえば動物の基本的な設計図(ドイツ語のBauplan=建築地図に由来)が、非常に長い年月をかけて保存されてきたのも、進化的な保存性の例です。
この設計図の維持には調節遺伝子が関与しており、構造遺伝子とは独立して働きます(構造遺伝子については後述)。
人間のDNAはおよそ35億塩基対からなっています。
DNAは、**コード領域(遺伝子を作る領域)**と、**非コード領域(いわゆる遺伝子を作らない領域)**に分かれています。
ヒトゲノムには、おそらく3万個ほどの機能的な遺伝子が存在すると考えられています。
この数は意外と少なく感じられますが、動物界の中で特に異例というわけではありません。
注目すべき点は、ヒトの脳ではコード領域の約55%が発現しているということです。
これは、脳が進化の過程で突然変異の主なターゲットとなってきた可能性を示唆しています(これが脳機能に良い影響をもたらす場合もあれば、悪い影響を及ぼす場合もあります)。
ヒトDNAの約97%は、未だに機能が完全にはわかっていない非コード領域です。
かつては「ジャンクDNA」(役に立たないDNA)と呼ばれていましたが、現在ではこの考えは否定されています。
というのも、DNAを維持するコストは非常に高いため、本当に不要なら進化の過程で淘汰されていたはずだからです。
実際、非コードDNAにはイントロンと呼ばれる領域が含まれ、遺伝子の発現(エクソン)の間隔を調整するなどの役割があるとされています。
遺伝子とは
DNAのうち、メッセンジャーRNA(mRNA)に転写されるテンプレートとなる部分を遺伝子と呼びます。
遺伝子は通常、
- スタート領域(プロモーター)
- ストップ領域
を持っています。これらはDNAからRNAへの転写を開始・終了させる重要なスイッチです。
遺伝子はイントロン(非コード領域)とエクソン(コード領域)から構成されており、一次転写産物(プレmRNA)からイントロンを除去するRNAスプライシングを経て、成熟したmRNAが作られます。
なお、RNAはDNAと非常によく似た構造をしていますが、T(チミン)の代わりに**U(ウラシル)**が使われます。
mRNAでは、3つの塩基がひとまとまりになって**トリプレット(コドン)**を形成し、各コドンがアミノ酸1個をコードします。
コドンの組み合わせは全部で64種類ありますが、コードするアミノ酸は20種類しかないため、
1つのアミノ酸を複数のコドンが担当している(=遺伝コードは縮重している)ことになります。
図1.2について
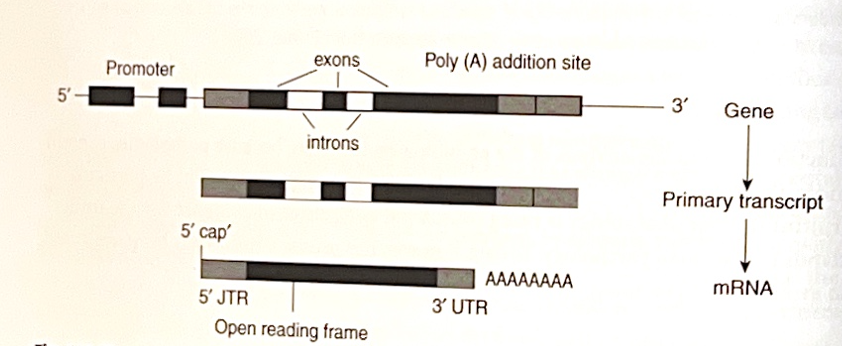
図1.2では、mRNAをコードする遺伝子の構造が示されています。
- 遺伝子の5’末端にはプロモーターがあり、ここにRNAポリメラーゼが結合して転写が始まります。
- 遺伝子全体が一次転写産物に転写されますが、成熟mRNAに反映されるのは一部のみです。
- mRNAに残る部分(灰色と黒)はエクソン、間に挟まれた領域(白)はイントロンです。
- 成熟mRNAを作る過程でイントロンは除去され、3’末端にはポリアデニル化(ポリAテール付加)、5’末端にはキャッピングが行われます。
- コドンによって連続してタンパク質がコードされる領域を**オープンリーディングフレーム(ORF)**と呼びます。
- 5’末端と3’末端に残る非翻訳領域(UTR)はタンパク質に翻訳されません。
図1.3について
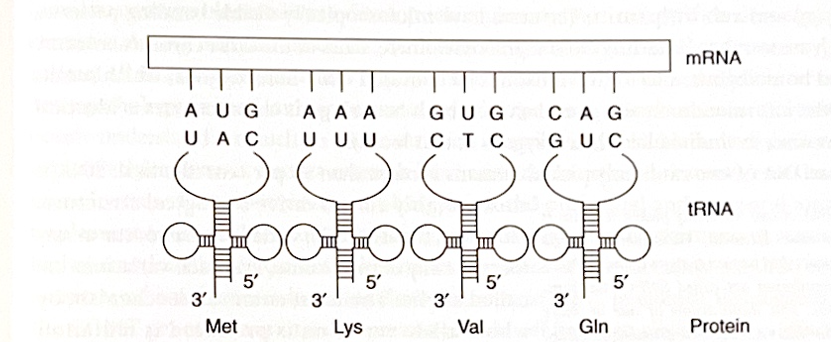
図1.3は**翻訳(タンパク質合成)**の仕組みを示しています。
- tRNAはmRNAのコドンに対応するアンチコドンを持ち、正確に結合します。
- 各tRNAは特定のアミノ酸を運び、mRNAとリボソームが形成する翻訳機構に供給します。
- こうして、mRNAの塩基配列はアミノ酸配列へと「翻訳」され、タンパク質が合成されます。
染色体と遺伝情報の構造
通常、DNAは二重らせん構造を取り、人間の場合は23対の染色体を構成します。
このうち2本は性染色体(XとY)です。
染色体はサイズ順に番号が付けられ、1番染色体が最も大きいです。
人間は46本の染色体を持ちますが、これはチンパンジーやゴリラの48本に比べて少ないです。
実は、人間の2番染色体は、共通祖先に存在した12番と13番染色体が融合したものです。
哺乳類では、
- 女性はX染色体を2本
- 男性はXとY染色体を1本ずつ持っています。
Y染色体は非常に小さいですが、性別決定において決定的な役割を持ちます。
Yを持てば男性に、持たなければ女性になります(ちなみに鳥類ではこの仕組みが逆です)。
また、「核型」とは常染色体(44本)+性染色体(XXまたはXY)の組み合わせを指します。
染色体異常とその影響
通常と異なる染色体数を持つ場合、これを異数性(アニュプロイディ)と呼びます。
代表例:
- ダウン症(21番染色体のトリソミー)
- クラインフェルター症候群(47,XXY)
- ターナー症候群(45,X0)
異数性は、精神遅滞、精神病のリスク、行動異常などに関連することが多いです。
また、染色体の一部が
- 欠失(消失)
- 逆位(向きが逆になる)
- 重複
- 転座(他の染色体に移動)
することもあります。
これらの再編成も、発達や精神的健康に重大な影響を与える可能性があります。
DNAの保存性と多様性
2人の人間のDNAは、実に99%以上が共通しています。
それでも、どの遺伝子座にも変異は起こりうるのが基本です。
変異の主なメカニズムは**突然変異(ミューテーション)**であり、これは単一塩基の置換などによって起こります。
特定の座位で複数の対立遺伝子が1%以上の頻度で存在する場合、これを**多型(ポリモルフィズム)**と呼びます。
中でも、単一塩基多型(SNP:スニップ)は非常に一般的で、およそ1,500塩基ごとに1つ存在すると考えられています。
SNPの多くは非コード領域にあり、表面的な特徴には影響しません。
しかし、コード領域や調節領域(プロモーター、エンハンサー、サイレンサーなど)にある場合は、遺伝子発現に重大な影響を与えることもあります。
また、
- 挿入(インサーション)
- 欠失(デリーション)
- 重複
- 複雑な多部位変異
といった大規模な変異は、近年**コピー数変異(CNV)またはコピー数多型(CNP)**と呼ばれています。
ヒトゲノム全体の約12%に相当する1,400箇所以上のCNVが発見されています。
ただし、CNVの機能的意義や進化的起源はまだ十分には解明されていません。
今後、CNV研究が精神医学の分野にも重要な影響をもたらすと期待されています。
最後に、進化の視点から見ると、
たった1%の適応上の有利さをもたらす変異でも、およそ4,000世代(ヒトで約10万〜12万年)あれば、
0.1%の出現率から99.9%にまで拡がる可能性があります。
ある遺伝子変異が本当に適応上の利益をもたらしたかどうかを判断するのは、実は非常に難しいということを、この事実は物語っています。
カテコール-O-メチル基転移酵素(COMT)という、ドーパミンの酵素的分解を担うタンパク質のアミノ酸配列158番目の位置におけるホモ接合性のバリン/バリン(val/val)多型は、メチオニン/メチオニン(met/met)変異体よりも速く働きます。
言い換えれば、met/met変異体ではドーパミンがシナプス間隙に長く留まるため、作業記憶に測定可能な影響を及ぼします。
val/val保有者は、作業記憶課題においてmet/met保有者よりも成績が悪く、またval/val変異体は、特に思春期初期に大麻を使用した場合に統合失調症を発症する脆弱性にも関与することが知られています。
ホモ接合性の両変異体と、ヘテロ接合性のval/met対立遺伝子は、集団内で平衡状態にあります。
しかしながら、val/val対立遺伝子はそれ自体が病理というわけではなく、おそらく多くの未解明の要因と組み合わさることで、統合失調症を説明するわずかな分散量に寄与する可能性があるに過ぎません。
実際、最近の研究では、met/met保有者は不快な情動刺激に対して、辺縁系や前頭葉、側頭葉領域において反応性が高まることが示されており、これはネガティブな気分状態に対するレジリエンス(回復力)が低く、情動の調整能力が低いことを示唆しています。
同様に、met対立遺伝子を1つ保有していることも(男性において)強迫性障害のリスク増加に関与する可能性が示唆されています。
本質的に、これらはCOMT遺伝子型のバリエーションが、作業記憶に対する有利な効果と情動反応性との間のトレードオフ(交換関係)を表していることを示唆しています。
他の遺伝的感受性座位におけるこのようなトレードオフについてはほとんど知られていませんが、将来の研究により、「ある疾患の遺伝子」と早計に考えられていた他の対立遺伝子についても、このような効果が明らかにされるのは間違いないでしょう。
新しい遺伝子は新たな機能を獲得する一方で、元の遺伝子はその場に留まります。
時には、染色体全体やゲノム全体が重複することもあります。
多くの対立遺伝子変異は選択的に中立的、すなわち個体の生殖適応度に影響を及ぼしません。
遺伝子流動とは、ある集団の遺伝子プールに遺伝子が出入りするプロセスを指します。
これは進化において非常に保守的な要因とみなされており、集団が新しい種へと進化するのを防ぎます。
これに対して、遺伝的浮動(ドリフト)は、特に小さな集団において、サンプリングエラーによって対立遺伝子が失われる場合に新種形成に寄与する可能性があります。
また、遺伝子はエピジェネティックな機構によって発現が変化したり、サイレンシング(不活性化)されることもあります。
遺伝子が不活性化される一般的なメカニズムの一つがメチル化であり、これは特にシトシンとグアニンのヌクレオチドが豊富な領域、いわゆるCpGアイランドにおいて起こります。
CpGアイランドは、全遺伝子の約50%の一端に存在し、そのうち60~70%がメチル化されています。
ヒトでは、DNA塩基の約1%がメチル化を受けています。
DNAメチル化は正常な細胞分化において重要な役割を果たしますが、腫瘍抑制遺伝子を沈黙させることにより、発癌過程にも関与することが示されています。
分子生物学の中心的ドグマの一つは、体内のタンパク質からDNAへの情報伝達は起こらないというものでした。
したがって、獲得形質の遺伝は起こらないとされてきました。
しかし、RNAが自身をコードした元のDNA以外の相同DNA配列と相互作用することで遺伝子サイレンシングを誘導する可能性があることが発見され、このルールが破られる可能性が示唆されています。
このようなメカニズムがヒトに存在するかどうかは、まだ明らかではありません。
メチル化と遺伝子サイレンシングは、X染色体の不活性化やゲノムインプリンティング(遺伝子の印刻)にも関与しています。
ゲノムインプリンティングは、雄性または雌性DNAの差別的メチル化によって生じます。
これは部分的に、胚内での父親と母親の遺伝子の「異なる利益」によるものと説明できます。
進化的観点から見ると、母親と父親から伝達される遺伝子間で、母親の資源の投資量に関する競争があると考えられます。
例えば、父親から受け継いだ遺伝子は、母親の最適な資源量を超えて、より多くの資源を引き出すよう選択されるかもしれません。
逆に、母親から受け継いだ遺伝子は、母親の最適な資源量に近いか、それ以下の資源を要求するよう選択されるかもしれません。
インプリンティング遺伝子はゲノム全体の1%しか占めていませんが、成長調節や多面的な影響を持つため、その効果は非常に大きい場合があります。
インプリンティング遺伝子の標的組織は、胎盤とおそらく脳です。
胎盤と脳は、遺伝的に関連する個体間で資源を移転する過程において重要な器官であり、部分的に異なる適応度を持つため、インプリンティング遺伝子の発現の不均衡が脳内で機能的な変化を引き起こす可能性が高いと予測されます。
この仮説を支持する例として、プラダーウィリー症候群とアンジェルマン症候群は、インプリンティングによる反対の影響が原因である可能性があります。
これは、染色体15の長腕の特定のDNA領域の欠失や、片方の親からのみ遺伝子が伝わる場合に現れる症候群です。
母親から受け継いだ遺伝子だけが発現する場合はプラダーウィリー症候群が、父親から受け継いだ遺伝子だけが発現する場合はアンジェルマン症候群が現れます。
プラダーウィリー症候群は、乳児が弱い泣き声や授乳の問題を示す一方、アンジェルマン症候群は、強い授乳反応を示しますが、協調性が欠けています。
最近では、ゲノムインプリンティングのプロセスが自閉症や統合失調症においても議論されており、社会的情報処理に関連する機能不全としての二極的な発現が関与している可能性があるとされています。
この観点から、精神病は母親由来のインプリンティング遺伝子が、社会的認知に関連する脳の特定の領域の発達を遅らせることによって引き起こされ、父親由来のインプリンティング遺伝子が自閉症に関連し、脳の過成長パターンを示す可能性があると考えられます。
両極端な変異は、脳の左右非対称性の減少や増加、またそれに伴う結合性と機能的な相関のパターンに現れます(詳細は第6章および第10章を参照)。
エピジェネティックなメカニズムは、依存症、うつ病、統合失調症などのいくつかの精神疾患でも最近議論されています。
興味深いことに、慢性的なストレスや早期のストレス経験は、これらの多くの精神疾患において遺伝子サイレンシングに寄与する可能性があることが示唆されています。
動物モデルによる研究では、これらの長期間続く影響が薬理学的に逆転できることが示されており、この事実は今後さらに注目されることになるでしょう。
非常に稀な障害、特にハンチントン舞踏病のような常染色体優性遺伝病では、疾患の重症度が世代を追うごとに増し、発症年齢が若年化する現象が観察されています。この過程は「期待現象(anticipation)」として知られており、親から子への遺伝伝達の際に反復三塩基配列の数が増加することと関連しています。
他の精神疾患において、この現象がどの程度関与するかは依然として議論の的であり、統合失調症、双極性障害、不安障害において期待現象が議論されています。
最後に、多くの場合、異なる遺伝子同士がさまざまな方法で、時にはかなり離れた距離を超えて相互作用することがあり、これはエピスタシス(epistasis)と呼ばれます。
また、多くの形質は複数の遺伝子に支配されており、この状態は多遺伝子遺伝(polygenic inheritance)と呼ばれます。
逆に、1つの遺伝子が複数の表現型側面に影響を与える場合は、多面発現性(pleiotropy)と呼ばれます。
これらの事実は、病的変異に関連する対立遺伝子の探索を複雑にしているものの、過去数年で洗練されたさまざまな手法が開発され、精神病理における遺伝的寄与の理解は大いに進展しています。
ポイント
すべての遺伝情報は個体のDNAに保存されており、これはアデニン、グアニン、シトシン、またはチミンを運ぶ脱酸核酸(デオキシヌクレオチド)から構成されています。生命の遺伝コードは、進化の歴史を通じて非常に保守的に保存されています。
ポイント
ヒトゲノムは約30,000の機能的遺伝子を含むと考えられています。遺伝子は、メッセンジャーRNAが転写されるユニットまたはテンプレートを表します。ヒトの脳では、コード領域DNAの約55パーセントが発現しており、これは脳が突然変異と選択の過程における主要なターゲットであることを示しています。
ポイント
ヒトは23対の染色体を持ち、それらがDNAを運んでいます。このうち、X染色体とY染色体は性染色体と呼ばれます。染色体数の異常(アニュープロイディー)は、しばしば行動異常を引き起こします。
ポイント
異種遺伝子型(ヘテロ接合体)ポリモーフィズムは、それがホモ接合体型よりも選択的に有利である場合、「均衡ポリモーフィズム」と呼ばれます。
ポイント
遺伝子はエピジェネティックなプロセスによってサイレンスされることがあり、その中でもメチル化が最も一般的なメカニズムです。メチル化は、雌の個体におけるX染色体のサイレンスに寄与します。
ポイント
期待現象(anticipation)は、反復的な遺伝要素の数が増加することで、疾患の発症がより早い年齢に移行する現象を指します。期待現象はハンチントン舞踏病で発生することが知られており、統合失調症、双極性障害、不安障害でも議論されています。
ポイント
遺伝子はエピスタシス(エピスタシス)として知られる複雑な相互作用を行うことがあります。さらに、複数の遺伝子が支配する形質は多遺伝子遺伝(polygenic)と呼ばれます。逆に、1つの遺伝子が複数の形質に影響を与える場合、それは多面発現性(pleiotropy)と呼ばれます。

